Method Article
Применение гибридизации вирусной РНК/ДНК in situ нового поколения в исследованиях вируса иммунодефицита человека/вируса иммунодефицита обезьян
В этой статье
Резюме
В данной работе мы представляем гибридизационный анализ in situ нового поколения для идентификации специфических последовательностей вирусной РНК или ДНК в тканях, залитых формалином и залитым парафином (FFPE). Этот подход позволяет визуализировать низкие копии РНК и ДНК менее чем за 24 ч с очень высокой чувствительностью и специфичностью.
Аннотация
Гибридизация in situ является мощным методом идентификации специфических последовательностей РНК или ДНК в отдельных клетках в срезах тканей, обеспечивая важную информацию о физиологических процессах и патогенезе заболевания. Гибридизация in situ (ISH) использовалась в течение многих лет для оценки местоположения клеток, инфицированных вирусами, но недавно был разработан подход ISH нового поколения с уникальной стратегией проектирования зонда, которая позволяет одновременно усиливать сигнал и подавлять фон для достижения визуализации одной молекулы при сохранении морфологии ткани. Этот метод ISH нового поколения основан на подходе, подобном разветвленной ПЦР, но выполняется in situ и является более простым, чувствительным и воспроизводимым, чем классические методы ISH или подходы ПЦР in situ при рутинном обнаружении РНК или ДНК в тканях, залитых формалином и парафином (FFPE). В течение последних нескольких лет наша лаборатория применяет эту платформу ISH для обнаружения вирусной РНК (vRNA) иммунодефицита человека (ВИЧ) и иммунодефицита обезьян (SIV) и/или вирусной ДНК (vDNA) положительных клеток во множестве тканей FFPE. С помощью этой подробной технической рукописи мы хотели бы поделиться нашими знаниями и советами со всеми людьми, заинтересованными в использовании ISH нового поколения в своих исследованиях.
Введение
ISH — это экспериментальный подход, используемый для нацеливания и визуализации комплементарных нитей ДНК, РНК или модифицированных нитей нуклеиновых кислот (т.е. зондов) к конкретным последовательностям ДНК или РНК в клетке или участке ткани. ISH позволяет точно локализовать и визуализировать конкретные нуклеиновые последовательности в тканях, что важно для понимания уровня экспрессии, организации, распределения и взаимодействия между мишенью и ее клеточной средой, что является ценной информацией, которую невозможно получить с помощью других популярных методов, таких как количественная ПЦР. До недавнего времени ISH обычно выполняли либо с меченой комплементарной ДНК, либо с комплементарной РНК (рибозондом). Эти зонды либо непосредственно конъюгировали с радио-, флуоресцентными или антиген-мечеными основаниями (например, 35S, FITC и дигоксигенином), либо локализовали и количественно оценивали в ткани с помощью методов ауторадиографии, флуоресцентной микроскопии или иммуногистохимического детектирования, соответственно. Несмотря на то, что эти технологии in situ по-прежнему являются ценными подходами, существуют широкие возможности для совершенствования для разработки менее трудоемких, более простых, быстрых, чувствительных и специфичных подходов.
Альтернативный коммерческий подход к ISH нового поколения (например, анализ РНК), впервые описанный в 2012 году, для обнаружения матричной РНК хозяина (мРНК) основан на разветвленной ПЦР. Детектирование мРНК выполняется в клетках и тканях FFPE, при этом чувствительность приближается к визуализации одной молекулы РНК в отдельных клетках1. Специфичность этого подхода достигается при единственном условии, что два зонда-мишени с двойным Z связываются непрерывно со своими соответствующими комплементарными последовательностями РНК (или ДНК) для последовательногосвязывания сигнального предусилителя 1. Это позволяет инициировать каскад амплификации сигнала с помощью последующих этапов гибридизации, аналогичных разветвленной ДНК (бДНК)1,2. Кроме того, этот подход удивительно быстр и прост, с результатами, полученными всего за 1 день (<8 ч), что является значительным преимуществом по сравнению с 4 неделями при использовании альтернативных методов, включая Radio-ISH 1,2. Этот ISH нового поколения открыл новые перспективы и возможности для исследований ВИЧ/ВИО. Основными препятствиями на пути к излечению ВИЧ являются клеточные и тканевые резервуары, которые формируются на ранних стадиях заболевания 3,4. Общая цель этого метода состоит в том, чтобы идентифицировать, локализовать и, в конечном итоге, понять основные тканевые компартменты, которые действуют как вирусный резервуар и являются стойкими внутри инфицированного хозяина. Это, в свою очередь, поможет в разработке эффективных стратегий лечения ВИЧ.
В этой рукописи мы подробно описываем наш дуплексный протокол ISH для мультиплексирования РНК/ДНК нового поколения (например, RNAscope/DNAscope) и объясняем, как мы модифицировали существующий протокол ISH РНК для оптимизации ISH следующего поколения для наших образцов и конкретных мишеней. Этот протокол позволяет визуализировать, локализовать и количественно оценить вирусную РНК и вирусную ДНК ВИЧ/ВИО в пределах срезов ткани размером 5 мкм. Одновременная визуализация как вРНК, так и вДНК осуществляется путем объединения двух пользовательских наборов зондов: одного, нацеленного на кодирующую цепь вДНК (C1 SIVmac239 Gag-Pol-Sense зонд [416141-C1]), и одного антисмыслового, нацеленного на транскрипты вРНК (C2 SIVmac239 Vif-Env-Nef-Tar-Anti-Sense зонд [416131-C2]), охватывающего различные области вирусного генома (Таблица 1), используя два разных канала визуализации, C1 и C2. В этом протоколе каналы C1 и C2 позволяют визуализировать сигналы разными цветами (т.е. AP красным цветом и HRP коричневым) и обнаруживать зонды с разными подходами. Без учета обработки фиксации тканей и разреза, этот анализ занимает 2 дня. Здесь представлен протокол гибридизации дуплексной вРНК и вДНК in situ, который может быть выполнен на клеточных гранулах или срезах тканей.
протокол
1. Подготовка секций и слайдов
- Обрежьте парафиновые блоки и с помощью микротома вырежьте секции размером 5 +/-1 мкм. Установите срезы или клеточные гранулы на заряженные предметные стекла микроскопа в водяной бане без РНКазы при температуре 40-45 °C. Сухие предметные стекла на воздухе в течение ночи при температуре 37 °C или RT.
ПРИМЕЧАНИЕ: Предметные стекла можно хранить до 3 месяцев при комнатной температуре (RT) и до 6 месяцев при 4 °C. - Депарафинизируйте FFPE слайды.
- Выпекать в сухой духовке в течение 1 часа при температуре 60 °C.
- В вытяжном шкафу заполните две чашки для окрашивания предметными стеклами ~200 мл свежего ксилола, а две дополнительные формы для окрашивания — ~200 мл свежего 100% этанола. Накройте емкости крышками.
- Поместите горки на решетку и погрузите в первую посуду, содержащую ксилол. Инкубировать в течение 5-10 мин при RT с перемешиванием.
- Поместите предметные стекла во вторую чашку, содержащую ксилол, и выдерживайте в течение 5-10 минут при RT с перемешиванием.
- Сразу же поместите горки в посуду, содержащую 100% этанол. Инкубируйте предметные стекла в течение 5-10 мин в режиме RT с перемешиванием.
- Немедленно поместите предметные стекла во вторую чашку, содержащую 100% этанол, и инкубируйте в течение 5-10 минут при RT с перемешиванием.
- Снимите решетку с этанолом, осторожно постучите по боковой стороне решетки, чтобы удалить излишки этанола, и промойте в воде, не содержащей РНКазы, в течение 5-15 минут.
2. Подготовка духовки
- Включите печь для гибридизации и установите температуру 40 °C.
- Положите ткань или прочное впитывающее бумажное полотенце в лоток и полностью смочите его водой двойной дистилляции, чтобы обеспечить контроль влажности.
- Вставьте закрытый противень в духовку и закройте дверцу духовки. Перед использованием поддон прогрейте не менее 30 минут при температуре 40 °C. Держите противень в духовке, когда он не используется.
3. Извлечение эпитопов, вызванное теплом
- Приготовьте 0,5-кратный буфер для извлечения мишени для гибридизации на основе цитрата (10 нмоль/л, pH = 6, см. Таблицу материалов). Доведите его до кипения в стакане на нагревательной плите.
- Выполните извлечение эпитопов, вызванное нагреванием, поместив предметные стекла в буфер для поиска кипящей мишени на 30 минут.
- Извлеките предметные стекла из целевого поискового буфера и немедленно промойте в воде двойной дистилляции. Обезвоживайте в 100% этаноле в течение 5 минут до сушки на воздухе.
- После того, как предметные стекла высохнут на воздухе, примените гидрофобную барьерную ручку, чтобы обвести участок ткани на предметном стекле. Обязательно дайте гидрофобному барьеру полностью высохнуть на воздухе.
4. Предварительная обработка протеазы
- Поместите высушенные предметные стекла на стопорную решетку для предметных стекол, затем приготовьте реагенты для предварительной обработки протеазы (раствор для разложения протеазы, 2,5 мкг/мл), разбавив стерильным холодным PBS в соотношении 1:5. Хорошо перемешайте.
ПРИМЕЧАНИЕ: Три различных протеазных реагента с различными концентрациями поставляются в коммерчески доступном наборе. Протеаза III (стандартная), Протеаза IV (сильная) и Протеаза Плюс (мягкая). Эмпирически проверьте время переваривания и разведения протеазы перед внедрением в исследование, поскольку оптимальные условия будут варьироваться в зависимости от типа ткани, фиксации и толщины (см. Обсуждение). - Разбавленный раствор протеазы распределите на предметных стеклах, чтобы полностью покрыть участки ткани. Немедленно инкубируйте предметные стекла в течение 20 минут при температуре 40 °C в духовке (подготовленной на шаге 1.4), убедившись, что предметные стекла запечатаны во влажном поддоне для гибридизации. Не допускайте пересыхания участков ткани до конца протокола.
- Немедленно промойте 3 раза, погрузив стопорную решетку в поддон для стирки, наполненный водой двойной дистилляции.
- Выполните эндогенную блокаду пероксидазы, капнув раствор пероксидазы на каждый участок ткани, чтобы полностью покрыть его. Инкубируйте предметные стекла в течение 10 минут при RT. После этого промойте секции 3 раза в воде двойной дистилляции.
5. Гибридизация зондов и усиление сигнала
ПРИМЕЧАНИЕ: Чтобы предотвратить испарение, убедитесь, что лотки с контролируемой влажностью надежно закрыты, чтобы ткани не высыхали на этапах инкубации. Поместите камеру влажности обратно в духовку на этапе стирки, чтобы убедиться, что она остается на уровне 40 °C.
- Смешайте зонд C2 и зонд C1 в соотношении 1:50, пипетируя 1 объем зонда C2 на 50 объемов зонда C1 в пробирку в соответствии с рекомендациями производителя. Переверните трубку несколько раз. Перед использованием разогрейте целевую смесь зонда в духовке при температуре 40 °C в течение ~10 минут, чтобы растворить все осадки.
ПРИМЕЧАНИЕ: Смешанные целевые зонды могут храниться при температуре 4 °C до 6 месяцев. - Уберите горки из воды. Промойте и постучите по предметным стеклам, чтобы удалить лишнюю воду с участков ткани. Немедленно распределите зонд по предметным стеклам, убедившись, что каждый участок ткани полностью покрыт без пузырьков воздуха. Инкубируйте зондовую смесь в камере влажности в течение ночи при температуре 40 °C.
- На следующий день выньте предметные стекла из духовки и поместите их в поддон для стирки, содержащий 0,5-кратный буфер для стирки, на 5 минут при RT. Повторите шаг стирки еще раз.
- Снимите предметные стекла с буфера для стирки. Прополощите и постучите или проведите по предметным стеклам, чтобы удалить излишки буфера для смывания с секций салфетки.
- Коммерчески диспенсируйте готовый к применению реагент АМФ 1 (2 нмоль/л) в буфере для гибридизации B (20% формамид, 5x SSC, 0,3% сульфат литиядодецил, 10% сульфат декстрана, блокирующие реагенты) на предметных стеклах, обеспечивая полное покрытие участка ткани без пузырьков воздуха. Инкубировать в течение 30 минут при температуре 40 °C в камере влажности. Повторите шаги 1.6.3-1.6.4, выполняя стирку по 2 мин каждый.
- Выдайте коммерчески доступный AMP 2. Убедитесь, что участок ткани полностью покрыт без пузырьков воздуха. Инкубируйте предметные стекла в камере влажности в течение 15 минут при температуре 40 °C. Повторите шаги 5.3-5.4, выполняя стирку по 2 мин каждый.
- Выдача коммерчески доступного AMP 3. Убедитесь, что участок ткани полностью покрыт без пузырьков воздуха. Выдержать предметные стекла в камере влажности в течение 30 минут при температуре 40 °C. Повторите шаги 5.3-5.4, выполняя стирку по 2 мин каждый.
- Выдача коммерчески доступного AMP 4. Убедитесь, что участок ткани полностью покрыт без пузырьков воздуха. Инкубируйте предметные стекла в камере влажности в течение 15 минут при температуре 40 °C. Повторите шаги 5.3-5.4, выполняя стирку по 2 мин каждый.
- Выдача коммерчески доступного AMP 5. Убедитесь, что участок ткани полностью покрыт без пузырьков воздуха. Выдержать предметные стекла в камере влажности в течение 30 минут при температуре 40 °C. Повторите шаг 5.3-5.4, выполняя стирку по 2 мин каждая.
- Выдача коммерчески доступного AMP 6. Убедитесь, что участок ткани полностью покрыт без пузырьков воздуха. Инкубируйте предметные стекла в камере влажности в течение 15 минут при температуре 40 °C. Повторите шаг 5.3-5.4, выполняя стирку по 2 мин каждая.
- Перед обнаружением промойте предметные стекла один раз в 1x TBS-Tween 20 (0,05% v/v). Снимите предметные стекла с буфера для стирки, прополощите и постучайте или проведите по слайдам, чтобы удалить излишки буфера для стирки с секций салфетки. Немедленно поместите в поддон для стирки, наполненный 1x TBS-Tween буфером.
6. Обнаружение сигнала цели по каналу 1 (C1)
ПРИМЕЧАНИЕ: Это выполняется с использованием красной щелочной фосфатазы и быстрой амплификации красного хромогена 6 из наборов для 2-плексного детектирования (см. Таблицу материалов), содержащих метки щелочной фосфатазы, и хромогенного детектирования. Он использует быстрый красный цвет в качестве подложки для генерации красного сигнала.
- Приготовьте быстрый красный (FR) рабочий раствор, используя разведение Fast RED-B до Fast RED-A в соотношении 1:60. Хорошо перемешайте. Чтобы уменьшить количество осадков и получить более чистый сигнал, отфильтруйте раствор хромогена через мембрану MCE толщиной 0,45 мкм с помощью шприца.
ПРИМЕЧАНИЕ: Используйте раствор Fast RED-B в течение 5 минут. Не подвергайте воздействию прямых солнечных лучей или ультрафиолетового света. - Снимите предметные стекла с TBS-Tween, промойте и постучайте или проведите по предметным стеклам, чтобы удалить излишки буфера с участков ткани.
- Нанесите смешанный, отфильтрованный огнестойкий раствор на каждый участок ткани, убедившись, что каждый участок полностью покрыт. Инкубировать при RT в течение 6-8 мин. Наблюдайте под микроскопом.
- Промойте предметные стекла в 0,5x буфере стирки 2x. Снимите предметные стекла с буфера для стирки, прополощите и постучайте или проведите по слайдам, чтобы удалить излишки буфера для стирки с секций салфетки.
- Выдача коммерчески доступного AMP 7. Убедитесь, что участок ткани полностью покрыт без пузырьков воздуха. Инкубируйте предметные стекла в камере влажности в течение 10 минут при температуре 40 °C. Повторите шаг 5.3-5.4, выполняя стирку по 2 мин каждая.
- Выдача коммерчески доступного AMP 8. Убедитесь, что участок ткани полностью покрыт без пузырьков воздуха. Инкубируйте предметные стекла в камере влажности в течение 15 минут при температуре 40 °C. Повторите шаг 5.3-5.4, выполняя стирку по 2 мин каждая.
- Выдача коммерчески доступного AMP 9. Убедитесь, что участок ткани полностью покрыт без пузырьков воздуха. Выдержать предметные стекла в камере влажности в течение 30 минут при температуре 40 °C. Повторите шаг 5.3-5.4, выполняя стирку по 2 мин каждая.
- Выдайте коммерчески доступный AMP 10. Убедитесь, что участок ткани полностью покрыт без пузырьков воздуха. Выдержать предметные стекла в камере влажности в течение 30 минут при температуре 40 °C. Повторите шаг 5.3-5.4, выполняя стирку по 2 мин каждая.
7. Обнаружение сигнала цели по каналу 2 (C2)
ПРИМЕЧАНИЕ: Это выполняется с использованием коммерчески доступных наборов хромогенов Brown HRP и DAB (см. Таблицу материалов). Амплификация 10 от 2-плексного детектирования содержит метки пероксидазы хрена, а хромогенное детектирование выполняется с использованием DAB для генерации коричневого сигнала.
- Для оптимального обнаружения сигнала DAB используйте имеющиеся в продаже комплекты и следуйте инструкциям производителя (см. Таблицу материалов). Наблюдайте под микроскопом.
ВНИМАНИЕ: DAB токсичен. Соблюдайте соответствующие меры предосторожности и правила техники безопасности при обращении с этим химическим веществом и его утилизации.
8. Противодействие и монтаж
- Противозаправьте предметные стекла гематоксилином.
- В течение 30 с подвергайте предметные стекла 50% свежему фильтрованному гематоксилину, перемешивая предметные стекла. Слайды будут казаться фиолетовыми. Немедленно промойте в проточной воде, помешивая горки вверх и вниз, пока вода не станет прозрачной. Участки ткани останутся фиолетовыми.
- Для получения лучшего контраста поместите предметные стекла в дистиллированную воду, насыщенную карбонатом лития, на 1 минуту. Тщательно промойте в проточной воде не менее 3 раз, помешивая горки. Используйте воду двойной дистилляции для окончательного ополаскивания.
- Поскольку FR чувствителен к органическим растворителям, предметные стекла, окрашенные FR, необходимо покрыть монтажным материалом на водной основе и высушить в течение ночи при RT.
- Установите слайды.
- Убедитесь, что участки ткани, покрытые монтажным материалом на водной основе, сухие.
- Перед снятием крышки слайды окуните в ксилол с помощью монтажного реагента. Обязательно предотвратите или удалите пузырьки воздуха между покровным стеклом и секцией салфетки и дайте высохнуть в течение 16 часов при RT.
9. Протокол количественного анализа изображений для РНК-скопа с использованием CellProfiler5
- Вкратце, убедитесь, что программное обеспечение разделит пятна гематоксилина и FR на отдельные изображения. Идентификация и измерение интересующих объектов: ядер, вирионов, положительных клеток и агрегированного FR-положительного окрашивания. Сохраните измерения в CSV-файле и сохраните проанализированное изображение.
- Выберите опцию «Размешать цвета», которая разделяет пятна, разделяя исходную область интереса (ROI) на отдельные изображения с гематоксилином и FR.
- Если гемосидерин, татуировка или подобные признаки мешают анализу, добавьте второй этап «Unmix» с гематоксилином, FR и DAB. Используйте второе изображение FR, чтобы найти наиболее интенсивные пиксели FR. Это второе изображение будет использоваться в качестве маски для истинного огнестойкого окрашивания.
- При необходимости сгладьте окрашенные изображения перед тем, как установить пороговые значения. Это эмпирическое решение и не всегда нужно. Установите пороговое значение для отдельных окрашенных изображений с помощью "IdentifyPrimaryObjects" для выбора положительных пикселей.
- Определите три различных типа объектов (вирион, агрегаты вирионов, продуктивная клетка).
- Убедитесь, что ядра представляют собой объекты диаметром от 4 до 100 пикселей (пикселей), окрашенные гематоксилином. Склеить и заполнить отверстия после порогового значения. Объекты "IntenseFastRed" имеют диаметр от 4 до 100 пикселей и включают в себя вирионы, положительные клетки и агрегированное положительное окрашивание, такое как наблюдаемое на фолликулярных дендритных клетках (FDC) в В-клеточных фолликулах (BCF). Это изображение используется для фильтрации ложных срабатываний (например, гемосидерина).
- Убедитесь, что малые позитивы FR являются объектами диаметром 2-12 пикселей. Это измерение включает вирионы и клетки vDNA+. Отбросьте все объекты, находящиеся за пределами этого диапазона. Склеить и заполнить отверстия после порогового значения.
- Убедитесь, что FR большие положительные объекты: 9-100 пикселей в диаметре. Это измерение включает в себя vRNA+ положительные клетки и агрегированное положительное окрашивание. Сбросить после порогового значения. Размер малых и больших FR-положительных объектов может перекрываться. Они будут разделены на более позднем этапе.
ПРИМЕЧАНИЕ: Программное обеспечение (например, Cellprofiler) использует пиксели для определения размеров объектов, а используемые здесь пиксели получены из слайдов, отсканированных с разрешением 0,2510 мкм/пиксель (40x).
- Определение и извлечение результатов.
- После того, как какие-либо объекты идентифицированы, определите и извлеките результаты по количеству вирионов, продуктивных инфицированных клеток и ядер.
- Идентификация вирионов путем маскировки FastRedSmallPositives с помощью объекта IntenseFastRed, настроенного на удаление ложных срабатываний (например, гемосидерина).
- Затем определите положительные клетки и агрегируйте FR-положительное окрашивание. Удалите ложные срабатывания и вирионы из FastRedLargePositives , замаскировав его с помощью IntenseFastRed и набора объектов virion.
- Извлекайте положительные клетки из очищенных FastRedLargePositives путем повторной маскировки с помощью ядер. Разделите объекты, которые больше не соприкасаются, и отфильтруйте результаты по площади объекта, удалив мелкие объекты (≤6 пикселей). При этом удаляются пятнышки, созданные путем маскировки перекрытия ядер. В результате получаются положительные клетки.
- Наконец, определите совокупные положительные результаты FR. На этом шаге используются IdentifyTertiaryObjects, которые находят объекты, содержащиеся в более крупном родительском объекте. В этом случае уточненный набор объектов FastRedLargePositives является родителем, а положительные ячейки вычитаются.
- Подсчитайте количество вирионов и положительных клеток.
- Измерьте совокупную положительную площадь и конвертируйте ее из пикселей в мм2. При необходимости запишите площадь, занимаемую вирионами и положительными клетками, вмм2 , если анализ требует использования стандартных размеров ячеек и вирионов вместо прямого подсчета.
- Наложите положительные объекты на исходное изображение и сохраните результат.
ПРИМЕЧАНИЕ: Данные ISH представлены по количеству вирионов на 106 ядер (клеток) и количеству продуктивно инфицированных vRNA+ клеток на 106 ядер (клеток) для лучшего понимания и облегчения сравнения с данными количественной ПЦР, но результаты также могут быть представлены по площади ткани вмм2.
Результаты
В предыдущей рукописи 2,6,7,8,9,10,11 мы сообщали, что платформы ISH следующего поколения, обнаруживающие либо вРНК, либо вДНК, могут быть объединены с использованием сенсорных зондов (vDNA), нацеленных на 5'-gag-pol часть генома SIV/HIV, и антисмысловых зондов (vRNA), нацеленных на гены в 3'-половине генома (vif, vpx, vpr, tat, env и nef), а также элемент TAR в 5'-геноме (табл. 1). Этот подход отличает транскрипционно активные клетки (vRNA+, vDNA+) от транскрипционно неактивных (предположительно латентно) инфицированных клеток или клеток, содержащих транскрипционно некомпетентные провирусы (vRNA-, vDNA+) в том же участке ткани2 (рис. 1).
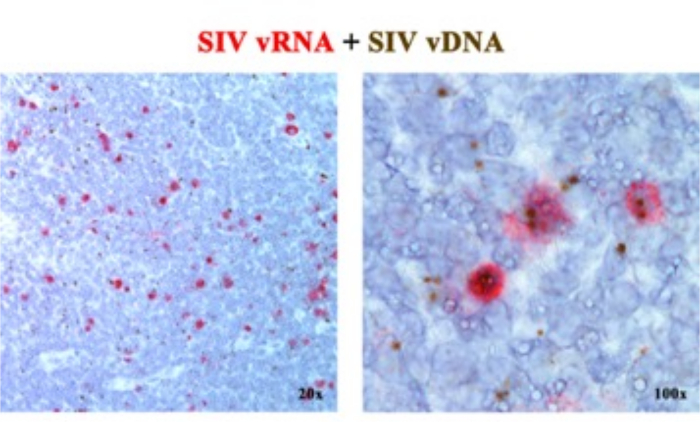
Рисунок 1: Обнаружение вирусной РНК и vDNA в одном и том же срезе ткани. Комбинация анализа гибридизации РНК (красный) и гибридизации ДНК (коричневый) в остро инфицированном SIV лимфатическом узле RM, демонстрирующая способность обнаруживать вРНК и вДНК в одном и том же участке ткани и обеспечивающая эффективный подход к идентификации транскрипционно молчащих vDNA+ vRNA-клеток in situ. Этот рисунок был изменен по Deleage C. et al.2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Наборы зондов для одиночной плексной РНК/ДНК | |||
| Имя | Каталог ACD # | Количество ZZ | Описание |
| SIVmac239 (Антисмысл) | 312811 | 83 | Нацеливание антисмыслового зонда в диапазоне 1251-9420bp от D01065.1 (gag, pol, vif, vpx, vpr, tat, env и nef) |
| SIVmac239 (Чувство) | 314071 | 83 | Сенсорный зонд, нацеленный на обратную цепь в пределах 1251-9420 bp от D01065.1 (gag, pol, vif, vpx, vpr, tat, env и nef) |
| V-HIV1-клада А (антисмысловая) | 416101 | 80 | Нацеливание антисмыслового зонда в пределах 879-7629bp HIV-1 Clade A Consensus (gag, pol, vif, vpr, tat, rev, vpu, env, and nef) |
| V-HIV1-клада А (смысл) | 426341 | 80 | Зонд Sense, нацеленный на обратную цепь в пределах 879-7629 bp от HIV-1 Clade A Consensus (gag, pol, vif, vpr, tat, rev, vpu, env, and nef) |
| V-HIV1-клада B (антисмысловая) | 416111 | 78 | Нацеливание антисмыслового зонда в пределах 854-8291bp от AF324493.2, HIV-1 Clade B NL4-3 (gag, pol, vif, vpr, tat, rev, vpu, env, and nef) |
| V-HIV1-клада B (Sense) | 425531 | 78 | Зонд Sense, нацеленный на обратную цепь в пределах 854-8291.о. от AF324493.2, HIV-1 Clade B NL4-3 (gag, pol, vif, vpr, tat, rev, vpu, env, and nef) |
| V-HIV1-клада D (антисмысловая) | 416121 | 76 | Нацеливание антисмыслового зонда в пределах 894-7697bp HIV-1 Clade D Consensus (gag, pol, vif, vpr, tat, rev, vpu, env, nef) |
| V-HIV1-клада D (смысл) | 426351 | 76 | Зонд Sense, нацеленный на обратную цепь в пределах 894-7697bp от HIV-1 Clade D Consensus (gag, pol, vif, vpr, tat, rev, vpu, env, nef) |
| Наборы мультиплексных зондов для РНК/ДНК | |||
| Имя | Каталог ACD # | Количество ZZ | Описание |
| V-SIVmac239-gag-pol-Sense-C1 | 416141-С1 | 40 | Сенсорный зонд, нацеленный на обратную цепь в пределах 1251-4093bp от D01065.1 (gag и pol) |
| V-SIVmac239-vif-env-nef-tar-C2 (Антисмысл) | 416131-С2 | 47 | Нацеливание антисмыслового зонда в пределах 5381-10257bp от D01065.1 (vif, vpx, vpr, tat, env, nef и элемент TAR) |
| V-HIV1-Clade_B-gag-pol-sense-C1 | 444051-С1 | 40 | Сенсорный зонд, нацеленный на обратную цепь в пределах 854-3940.о. от AF324493.2, HIV-1 Clade B NL4-3 (gag и pol) |
| V-HIV1-Clade_B-vif-vpr-tat-rev-vpu-env-nef-tar-C2 (Антисмысл) | 444061-С2 | 40 | Нацеливание антисмыслового зонда в пределах 5042-9673.о. от AF324493,2,, HIV-1 Clade B NL4-3 (vif, vpr, tat, env, nef и элемент TAR) |
| V-HIV1-Clade_C-gag-pol-sense-C1 | 444021-С1 | 48 | Зонд, нацеленный на обратную цепь в пределах 888-5032.о. последовательности переписи HIV-1 Clade C (gag и pol) |
| V-HIV1-Clade_C-vif-vpr- rev-vpu-env-nef-tar-C2 (Антисмысл) | 444041-С2 | 49 | Нацеливание антисмыслового зонда в пределах 5078-9698.о. последовательности переписи HIV-1 Clad C (vif, vpr, tat, env, nef и элемент TAR) |
| V-HIV1-Clade_AE-gag-pol-sense-C1 | 444011-С1 | 55 | Сенсорный зонд, нацеленный на обратную цепь в пределах 890-4812.о. от AF259954.1, клада ВИЧ-1 AE (кляп и пол) |
| V-HIV1-Clade_AE-vif-vpr-tat-rev-vpu-env-nef-tar-C2 (Антисмысл) | 444031-С2 | 57 | Нацеливание антисмыслового зонда в пределах 5052-9694.о. от AF259954.1, HIV-1 Clade AE (vif, vpr, tat, env, nef и элемент TAR) |
Таблица 1: Список зондов, нацеленных на вРНК и вДНК ВИЧ-1 и ВИО.
Обсуждение
Гибридизация in situ — это тщательный анализ, требующий строгости и базовых знаний химии нуклеиновых кислот, клеточной биологии и гистологии, чтобы иметь возможность адаптировать каждый критический шаг для локализации мишени в хорошо консервативной среде. В этом обсуждении мы хотели бы выделить важнейшие этапы, в которых устранение неполадок имеет решающее значение для получения точных и интерпретируемых результатов.
Фиксация и обработка тканей имеют решающее значение и должны быть рассмотрены заранее, чтобы убедиться, что анализ может дать наилучшие результаты. Нейтральный буферизованный фиксатор PFA (4% свежеприготовленного) является оптимальным для дуплексного анализа. Тем не менее, анализ также может быть выполнен на замороженных тканях (ОКТ) с соответствующими условиями фиксации после криосекции.
Предварительная обработка участков тканей является важным этапом. В этом анализе есть два этапа предварительной обработки: первый — это индуцированное тепловым извлечением эпитопов (HIER). Этот шаг важен для реверсирования поперечных связей метиленового моста и восстановления белковых структур, что необходимо в неподвижных тканях. Эффективность этой обработки зависит от времени, температуры, типа буфера для извлечения и pH. Вторая предварительная обработка представляет собой индуцированное протеазой извлечение эпитопов (PIER). На этом этапе расщепляются пептиды, обнажая антиген или нуклеотиды, и используются ферменты, включая протеиназу К, трипсин и пепсин. Это чрезвычайно чувствительный шаг, который потенциально может повредить как морфологию ткани, так и интересующую мишень. Концентрация фермента, а также время и температура инкубации имеют решающее значение в этом процессе. Переваривание приводит к плохой демаркации ядер и затруднению этапов количественной оценки. Крайне важно найти баланс между оптимальным доступом к мишени РНК/ДНК и условиями до лечения, которые не повреждают интересующую ткань или мишень. Каждый тип тканей имеет разный уровень чувствительности к каждой из этих предварительных обработок, и каждый параметр (концентрация фермента, время, температура) должен быть эмпирически проверен.
Строгость буфера для стирки основана на трех основных параметрах: температуре, концентрации солей и моющих средств, а также времени. Буфер для промывки представляет собой буфер цитрата натрия с солевым раствором (SSC), а концентрация соли в буфере контролирует жесткость на этапах промывки. В своем протоколе ACD советует использовать буфер для промывки при конечной концентрации 0,1x SSC, 0,03% додецилсульфата лития. Работая над оптимизацией ДНК и мультиплексирования, мы определили, что использование промывочного буфера в конечной концентрации 0,05x SSC дало нам лучшие результаты для визуализации сигнала ДНК и значительно помогло снизить неспецифическую нецелевую гибридизацию в результате ночной инкубации сенсорного зонда.
Перед началом анализа необходимо обдумать выбор метода обнаружения, хромогена (красного или коричневого) или флуоресценции, исходя из типа ткани и цели. Хромогенный подход к красному цвету даст хороший контраст, потому что красный цвет в природе не содержится в тканях. Коричневый хромоген даст результаты, аналогичные красному хромогену. Тем не менее, важно иметь в виду, что некоторые продукты деградации крови, присутствующие в ткани, имеют схожий цвет, и чернила для татуировки будет трудно отделить от коричневого сигнала при количественном определении. Подход к обнаружению флуоресценции позволит четко различать различные клеточные маркеры, а мультиплексирование обеспечит идеальный анализ для фенотипирования клеток, несущих вРНК и/или вДНК.
Для обеспечения специфичности зондов и качества анализа необходим многократный контроль. Каждый вновь разработанный зонд должен быть протестирован на известных положительных и отрицательных контрольных тканях или клеточных гранулах. Мы часто генерируем плазмиды, содержащие нашу целевую последовательность, и выполняем трансфекцию в клеточные линии для получения положительного контроля. Для каждого прогона мы добавляем заведомо отрицательную ткань (ВИЧ или SIV отрицательную), контроль без зонда, содержащий только разбавитель зонда, и контроль, обработанный РНКазой, чтобы обеспечить качество и специфичность анализа.
Количественная оценка является чрезвычайно важным этапом и должна быть выполнена с использованием соответствующих инструментов и алгоритмов в зависимости от заданного вопроса. В этой рукописи мы представили программное обеспечение для анализа изображений (например, Cellprofiler), которое мы выбрали после оценки нескольких вариантов. Мы подсчитали, что это программное обеспечение было лучшим для наших нужд, но существует множество программ для анализа изображений, которые можно было бы использовать.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Этот проект был полностью профинансирован за счет федеральных средств от Национального института рака, Национальных институтов здравоохранения, по контракту No. HHSN261200800001E и грантом Орегонского национального исследовательского центра приматов NIH P51OD011092 (J.D.E). Содержание данной публикации не обязательно отражает взгляды или политику Министерства здравоохранения и социальных служб, а упоминание торговых наименований, коммерческих продуктов или организаций не подразумевает одобрения со стороны правительства США. Дуплекс был разработан с помощью Advanced Cell Diagnostics.
Материалы
| Name | Company | Catalog Number | Comments |
| ACD HybEZII Hybridization system (110V) with ACD EZ-Batch Slides system | ACD | 321710 | Hybridization oven |
| CAT Hematoxylin | Biocare medical | CATHE-GAL | colorstain |
| Clear-Mount | ELECTRON MICROSCOPY SCIENCES | 17985-15 | mounting reagent for red chromogen |
| Immpact DAB Peroxidase Kit | Vector | SK-4105 | Used to reveal HRP - DAB (Brown) to replace the DAB coming in the ACD kit |
| lithium carbonate | Fisher chemical | L119-500 | bluing solution |
| paraformaldehyde | ELECTRON MICROSCOPY SCIENCES | 15714-S | for tissue fixation (4%) |
| PBS | life technology | 14190-136 | |
| Permount Mounting Medium | ThermoFisher Scientific | SP15-100 | mounting regaent for brown chromogen |
| Prolong Gold | ThermoFisher Scientific | P36930 | mounting regaent for fluorescence |
| ribonucleases A | ThermoFisher Scientific | 12091039 | for RNAse treatment in DNAscope protocol |
| ribonucleases T1 | Roche | R1003 | for RNAse treatment in DNAscope protocol |
| RNAscope 2.5, 2-plex detection reagent | ACD | 322430 | Brown and red kit chromogen detection |
| RNAscope Target Retrieval Reagents | ACD | 322000 | retrieval buffer |
| SuperFrost Plus Glass Slides | ThermoFisher Scientific | 12-550-17 | |
| TBS | BOSTON BIOPRODUCTS | BM-301-4L | for washes |
| TSA Plus Fluorescence palette kit (Cy3, Cy5, TMR, Fluorescein) | Perkin elmer | NEL760001KT | HRP Fluorescence detection |
| Tween 20 | SIGMA | P1379-1L | for washes |
| XYLENE 20LT | ThermoFisher Scientific | AC422680200 |
Ссылки
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnosis. 14 (1), 22-29 (2012).
- Deleage, C., et al. Defining HIV and SIV Reservoirs in Lymphoid Tissues. Pathogens and Immunity. 1 (1), 68-106 (2016).
- Sengupta, S., Siliciano, R. F. Targeting the Latent Reservoir for HIV-1. Immunity. 48 (5), 872-895 (2018).
- Churchill, M. J., Deeks, S. G., Margolis, D. M., Siliciano, R. F., Swanstrom, R. HIV reservoirs: what, where and how to target them. Nature Reviews Microbiology. 14 (1), 55-60 (2016).
- McQuin, C., et al. CellProfiler 3.0: Next-generation image processing for biology. PLoS Biology. 16 (7), e2005970 (2018).
- Deleage, C., Chan, C. N., Busman-Sahay, K., Estes, J. D. Next-generation in situ hybridization approaches to define and quantify HIV and SIV reservoirs in tissue microenvironments. Retrovirology. 15 (1), 4 (2018).
- Deleage, C., Turkbey, B., Estes, J. D. Imaging lymphoid tissues in nonhuman primates to understand SIV pathogenesis and persistence. Current Opinion in Virology. 19, 77-84 (2016).
- Estes, J. D., et al. Defining total-body AIDS-virus burden with implications for curative strategies. Nature Medicine. 23 (11), 1271-1276 (2017).
- Mavigner, M., et al. Simian Immunodeficiency Virus Persistence in Cellular and Anatomic Reservoirs in Antiretroviral Therapy-Suppressed Infant Rhesus Macaques. Journal of Virology. 92 (18), (2018).
- Peterson, C. W., et al. Differential impact of transplantation on peripheral and tissue-associated viral reservoirs: Implications for HIV gene therapy. PLoS Pathogen. 14 (4), e1006956 (2018).
- Deleage, C., et al. Impact of early cART in the gut during acute HIV infection. Journal of Clinical Investigation Insight. 1 (10), e87065 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены