Method Article
Морфологическая и функциональная оценка аксонов и их синапсов во время смерти Аксона в Drosophila melanogaster
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы предоставляем протоколы для выполнения трех простых травм индуцированной аксон дегенерации (аксон смерти) анализы в Drosophila меланогастер для оценки морфологического и функционального сохранения отрубленный аксонов и их синапсов.
Аннотация
Дегенерация Аксона является общей особенностью в нейродегенеративных заболеваний и когда нервная система оспаривается механических или химических сил. Однако наше понимание молекулярных механизмов, лежащих в основе дегенерации аксона, остается ограниченным. Травма индуцированной аксон дегенерации служит простой моделью для изучения того, как разорванные аксоны выполнять свои собственные разборки (аксон смерти). За последние годы, эволюционно сохраненные аксон смерти сигнализации каскад был определен от мух и млекопитающих, который необходим для разделенного аксона выродиться после травмы. И наоборот, ослабленная смерть аксона приводит к морфологической и функциональной консервации отрубленных аксонов и их синапсов. Здесь мы представляем три простых и недавно разработанных протокола, которые позволяют наблюдать аксональной морфологии, или аксональной и синаптической функции разорванных аксонов, которые были отрезаны от нервного тела клетки, в плодовой мухе Дрозофила. Морфология может наблюдаться в крыле, где частичная травма приводит к смерти аксона бок о бок невредимых аксонов управления в одном и том же нервном пучка. Кроме того, аксональной морфологии также может наблюдаться в головном мозге, где весь нервный пучок подвергается аксон смерти вызвано антенной абляции. Функциональное сохранение разорванных аксонов и их синапсов можно оценить с помощью простого оптогенетического подхода в сочетании с пост-синаптической груминг поведением. Мы представляем примеры с использованием высокой потери функции мутации и чрезмерного выражения dnmnat, как способны задержки аксон смерти в течение нескольких недель до нескольких месяцев. Важно отметить, что эти протоколы могут быть использованы сверх травмы; они облегчают характеристику факторов поддержания нейронов, аксонального транспорта и аксональных митохондрий.
Введение
Морфологическая целостность нейронов имеет важное значение для устойчивой работы нервной системы на протяжении всей жизни. Подавляющее большинство объема нейронов берется аксонами1,,2; таким образом, пожизненное содержание особо длинных аксонов является основным биологическим и биоэнергетическим вызовом для нервной системы. Были выявлены несколько аксонально-внутренних и глиально-внутренних механизмов поддержки, обеспечивающих пожизненное выживание аксональных. Их ухудшение приводит к дегенерации аксона3, которая является общей чертой нервной системы оспаривается в болезни, и механические или химические силы4,5. Тем не менее, основные молекулярные механизмы дегенерации аксона остаются плохо изучены ни в одном контексте, что делает разработку эффективных методов лечения для блокирования потери аксона сложной задачей. Развитие эффективных методов лечения от этих неврологических заболеваний имеет важное значение, так как они создают огромное бремя в нашем обществе6.
Травма индуцированной аксон дегенерации служит простой моделью для изучения того, как разорванные аксоны выполнять свои собственные разборки. Обнаруженный и названный в честь Августа Уоллера в 1850 году, Валлерианская дегенерация (WD) является зонтичным термином, который включает в себя два различных, молекулярно отделяемых процессов7. Во-первых, после аксональной травмы, аксоны отделены от их клеточных тел активно выполнять свои собственные самоуничтожения (аксон смерти) через эволюционно сохранены аксон смерти сигнализации каскад в течение одного дня после травмы8. Во-вторых, окружающие глии и специализированные фагоциты занимаются и очищать полученный аксональный мусор в течение трех-пяти дней. Затухание аксона смерти сигнализации приводит к разорванной аксонов, которые остаются сохраненными в течениенедели 9,10,11,12, в то время как затугание глиального поглощения завершается аксонального мусора, который сохраняется в течение нескольких недель в vivo13,14,15.
Исследования на мух, мышей, крыс и зебры показали несколько эволюционно сохраненных и основных посредников аксон смерти сигнализации8. Мутации смерти Аксона содержат отрубленые аксоны и синапсы, которые не могут подвергнуться смерти аксона; они остаются морфологически и функционально сохраняются в течение нескольких недель, при отсутствии поддержки клеточного тела9,,10,,12,,13,,16,,17,,18,,19,,20,,21,,22,23. Открытие и характеристика этих посредников привели к определению молекулярного пути, исполняющего смерть аксона. Важно отметить, что аксон смерти сигнализации активируется не только тогда, когда аксон разрезан, измельчен или растягивается24,25; он также, как представляется, вклад в различных животных моделей неврологических заболеваний (например, где аксоны вырождаются в травмы независимым образом4, но с рядом полезных результатов4,8). Таким образом, понимание того, как аксон смерти выполняет аксон дегенерации после травмы может предложить понимание за пределами простой модели травмы; она могла бы также предусматривать целевые показатели для терапевтического вмешательства.
Плодовая муха Drosophila melanogaster (Drosophila) оказалась бесценной системой для сигнализации смерти аксона. Исследования в лету показали четыре основных эволюционно сохраненных генов смерти аксона: highwire (hiw)11,14, dnmnat12,26, dsarm10 и axundead (axed)12. Модификация этих посредников - потеря функции мутаций hiw, dsarm и топором,и чрезмерное выражение dnmnat - мощно блокирует смерть аксона для продолжительности жизни мухи. В то время как разорванные аксоны дикого типа подвергаются смерти аксона в течение 1 дня, разорванные аксоны и их синапсы, не имеющие приветопта, dsarm или axed остаются не только морфологически, но и функционально сохранены в течение нескольких недель. Может ли также быть достигнуто функциональное сохранение за счет высоких уровней dnmnat еще предстоит определить.
Здесь мы представим три простых и недавно разработанных протокола для изучения смерти аксона (например, морфология и функция разорванных аксонов и их синапсов с течением времени) при отсутствии поддержки клеточного тела. Мы демонстрируем, как ослабленный аксон смерти приводит к разорванной аксонов, которые морфологически сохраняются с hiw потери функции мутации(приветN) и как ослабленный аксон смерти приводит к разорванной аксонов и синапсов, которые остаются функционально сохраняются в течение по крайней мере 7 дней с чрезмерной экспрессии dnmnat (dnmnatOE). Эти протоколы позволяют наблюдать отдельные аксональные и синаптические морфологии либо в центральной, или периферической нервной системы (ЦНС и PNS, соответственно)13,14, в то время как функциональное сохранение отрубленных аксонов и их синапсов в ЦНС может быть визуализирована с помощью простой оптогенетической установки в сочетании с уходом как поведенческие считывания12.
протокол
1. Наблюдение Аксон Морфологии во время смерти Аксон в PNS
- Травма крыла: частичная травма аксонных пучков
- Используйте 5 девственных самок и 5 самцов из правого генотипа(рисунок 4A,P0 поколения) для выполнения крестов при комнатной температуре (RT). Передайте P0 в новые флаконы каждые 3-4 дня. Собирайте свежезакрытое взрослое потомство (поколение F1) ежедневно и стареете в течение 7-14 дней.
- Анестезия мух на CO2 колодки. Используйте микро ножницы, чтобы сократить переднее крыло вены примерно в середине крыла(Рисунок 1A). Используйте одно крыло для травмы, а другое крыло в качестве возрастного невредимым контролем. Применить одну травму на крыло, и убедитесь, что получить достаточное количество крыльев ранены (примерно 15 крыльев).
ПРИМЕЧАНИЕ: Все крыло может быть разрезано, но достаточно, чтобы сократить только переднее крыло вены. Это самая сильная часть крыла. - Восстановить мух в пищевых флаконах.
- Рассечение крыла и визуализация аксонов
- Распространение 10 л галоуглеродного масла 27 с пипеткой вдоль целой стеклянной горки(рисунок 1B).
- Отрежьте травмированное, а также неповрежденное контрольное крыло в нужных временных точках (например, 1 или 7 дней после травмы). Используйте микро ножницы, чтобы вырезать, и пинцет, чтобы захватить крыло. Установите максимальные 4 крыла в галоуглеродное масло 27(рисунок 1B)и накройте их крышкой слайд.
- Изображение крыла сразу же с помощью вращающегося дискового микроскопа. Приобретите ряд оптических секций вдоль оси z с размером 0,33 мкм и сжимите z-стеки в единый файл для последующего анализа.
ПРИМЕЧАНИЕ: Не хватай переднее крыло вены, где клетки органов и аксонов размещены. Захватите крыло в центре. Ткань в крыльях не фиксируется; держать время от монтажа крыльев для визуализации этих под 8 мин.
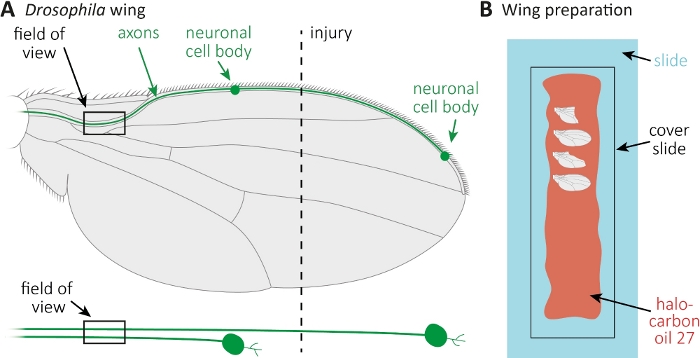
Рисунок 1: Наблюдение аксонной морфологии во время смерти аксона в крыле. (A) Схематическое крыло мухи с двумя редко GFP помечены сенсорных нейронов, которые также отдельно указаны ниже. Указаны место повреждения и поле наблюдения. (B) Схематическая установка для изображения крыла. Поврежденные и неповрежденные крылья управления (серые) крепятся в галоуглеродном масле 27 (красный) на стеклянной горке (светло-голубой) и покрыты крышкой слайда (черный). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
2. Наблюдение Аксона и Синапсе Морфология во время смерти Аксона в ЦНС
- Антенна абляция: травма целых аксонных пучков
- Используйте 5 девственных самок и 5 самцов из правого генотипа(рисунок 5A,P0 поколения) для выполнения крестов на RT. Pass P0 в новые флаконы каждые 3-4 дня. Собирайте свежезакрытое взрослое потомство (поколение F1) ежедневно и дайте им стареть от 7 до 14 дней.
- Анестезия мух на CO2 колодки. Используйте пинцет для абляции правого3-го антенного сегмента для односторонней абляции; или как левый, так и правый3-й антенные сегменты для двусторонней абляции(рисунок 2A-C). Это позволит удалить GFP помечены нейронных клеток органов, в то время как их аксональные прогнозы остаются в ЦНС.
ПРИМЕЧАНИЕ: Антенна абляция разъединяет весь аксон расслоение. При выполнении односторонней абляции расслоение аксона на контралатеральной стороне (неабляционная антенна) служит внутренним контролем. Убедитесь в том, чтобы выполнить достаточное антенные абляции (примерно 15 животных). - Восстановить мух в пищевых флаконах.
- Рассечение мозга и визуализация аксонов
- Смешайте силиконовую эластомерную базу (9 мл) и лечебное средство (1 мл) в соотношении объема 10:1. Перенесите каждую смесь 5 мл в 35-мм культурную пластину и уменьшите воздух, введенный путем смешивания с нежным возбуждением в капоте дыма на ночь. Смесь затвердевает в пределах 24 ч.
ПРИМЕЧАНИЕ: Рассеиотделение пластины должны быть подготовлены только один раз и могут быть использованы несколько раз. - Анестезия мух на CO2 колодки и обезглавить взрослых голов с помощью двух пинцетов в нужных точках времени (например, 1 или 7 дней после антенны абляции). Используйте один пинцет, чтобы захватить шею, а другой пинцет, чтобы исправить грудную клетку. Аккуратно вытяните шею и голову от грудной клетки.
ПРИМЕЧАНИЕ: Оставьте обезглавленные головы на колодке CO2 до достижения желаемого числа, но не забудьте перейти к следующему шагу в течение 30 минут. - Перенесите все головки в микроцентрифугную трубку мощностью 1,5 мл, содержащую 1 мл крепящего раствора, содержащего 4% параформальдегида (PFA) и 0,1% Triton X-100 в фосфатном буферизированном солине (PBS) с помощью пинцета, который был погружен в решение фиксации.
ПРИМЕЧАНИЕ: Fly головы хорошо прилипают на мокрой пинцетом. Это делает возможным перевод всех головок легко в микроцентрифугую трубку. - Исправьте головки в течение 20 минут с нежным возбуждением на RT. Положите микроцентрифугую трубку на лед, головки будут тяготеть к дну микроцентрифуговой трубки. Удалите супернатант с пипеткой и повторите эту процедуру с пятью 2 мин моет с 1 мл стирального буфера, содержащего 0,1% Triton X-100 в PBS с нежным возбуждением на RT, чтобы удалить остаточный решение фиксации.
ПРИМЕЧАНИЕ: Видео о том, как вскрыть взрослых мозга drosophila легко доступны27. - Перенесите головки со стеклянной пипеткой в стеклоблок, наполненный стиральным буфером. Используйте один пинцет, чтобы захватить и вытащить хоботок с головы, удерживая голову с другой пинцетом. Это оставит отверстие было хоботок был прикреплен к экзоскелету.
- Используйте два пинцета, чтобы удалить экзоскелет между отверстием и каждым соединением глаза. Это позволит сделать возможным открыть структуру головы с помощью пинцета, и мягко выцарапать мозг внутри.
- Очистите каждый мозг, удалив трахею или жир, прилипшую к нему(рисунок 2D,сверху). Как только мозг очищается, поместите его в новую микроцентрифуговую трубку, содержащую 1 мл стирального буфера на льду.
ПРИМЕЧАНИЕ: Поврежденные или потерянные доли оптики не повлияют на обонятельную долбу в центре мозга(рисунок 2D, верхняя). - Замените стиральный буфер 1 мл лежу, как только все мозги будут собраны и накопились в нижней части микроцентрифугной трубки. Исправить мозги в течение 10 минут с качания на RT, а затем пять 2 мин моет в 1 мл стирального буфера с качания на RT.
- Применить первичные антитела (1:500) в стиральной буфера на ночь с качания на 4 КС, а затем 10 моет более 2 ч с помощью 1 мл стирального буфера с качания на RT.
- Нанесите вторичные антитела (1:500) в стиральном буфере 2 ч с качанияна на RT и оберните микроцентрифуг трубки в алюминиевой фольге, чтобы блокировать свет. Держите микроцентрифуг трубки покрыты алюминиевой фольгой для остальной части процедуры. Нанесите десять мойков с 1 мл стирального буфера более 2 ч с качания на RT.
- Удалить супернатант и использовать одну каплю антифадерере реагента для покрытия мозга в микроцентрифуге трубки. Инкубировать мозги, по крайней мере 30 минут при 4 градусах Цельсия, прежде чем подготовить их к монтажу и визуализации.
- Подготовьте слайд с обложкой, приклеите на ней лабораторную ленту и вырежьте из ленты форму "T"-(рисунок 2D, внизу). В результате пространство служит областью, где мозг,содержащий антифадед реагент28 будет пипетка в, предпочтительно в обеих камерах.
ПРИМЕЧАНИЕ: Используйте 20-200 л пипетки отзыв, где 3 мм наконечникбыл был отрезан, чтобы расширить отверстие пипетки. Это сделает возможным pipette мозга, содержащих антифадерер. Тщательно накройте мозги слайдом с обложкой. - Используйте глину, чтобы подготовить два небольших четных рулонах. Убедитесь, что глиняные рулоны не выше высоты стеклянной горки. Stick глиняные рулоны на стеклянную горку(рисунок 2D, дно). Поместите мозг содержащие крышку слайд бутерброд на глиняные рулоны.
ПРИМЕЧАНИЕ: GFP-маркированные аксоны и их синапсы расположены в передней части мозга. Поэтому их легче изобразить спереди. Тем не менее, мозги будут либо лицом вверх, или лицом вниз на крышке слайд бутерброд. Глиняные рулоны служат держателями сэндвичей, а во время визуализации сэндвич можно перевернуть с ног на голову. Это позволит получить изображения сфронта из каждого мозга. - Приобретите ряд оптических секций вдоль оси z-axis с шагом размером 1,0 мкм с помощью конфокального микроскопа и сжимите z-стеки в единый файл для последующего анализа, чтобы оценить количество аксональных проекций, остающихся нетронутыми.
- Смешайте силиконовую эластомерную базу (9 мл) и лечебное средство (1 мл) в соотношении объема 10:1. Перенесите каждую смесь 5 мл в 35-мм культурную пластину и уменьшите воздух, введенный путем смешивания с нежным возбуждением в капоте дыма на ночь. Смесь затвердевает в пределах 24 ч.
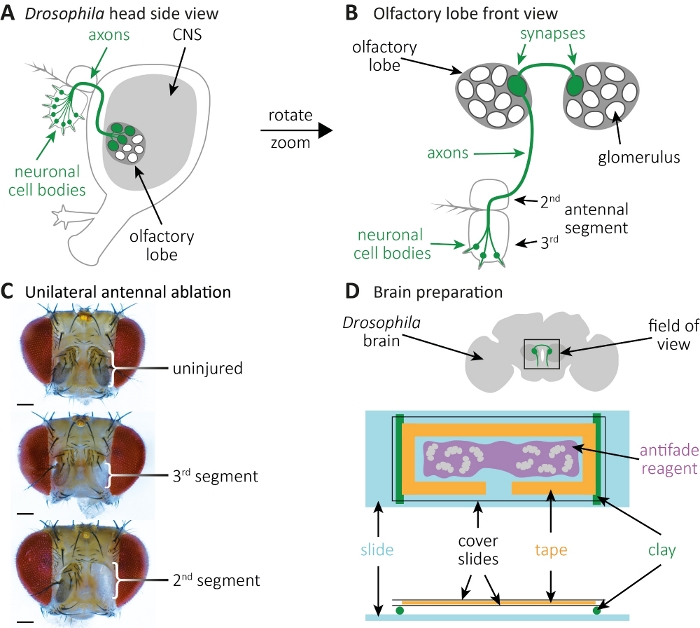
Рисунок 2: Наблюдение аксона и синапсовой морфологии во время смерти аксона в головном мозге. (A) Вид смихи в головку мухи с GFP-маркированных клеточных тел, аксонов и синапсов. (B) Высокоувеличиваемый передний вид нейронов обонятельных рецепторов с маркировкой GPF и их аксонов и синапсов. Сотовые тела размещаются в3-м антенном сегменте, а их аксоны проектируются в ЦНС. Аксоны образуют синапсы в гломеруле в левой обонятельной доле, пересекают средней линии и образуют синапсы в гломеруле на контралатеральной обонятельной доле. (C) Примеры мухгой с односторонней абляцией антенн. Вверху: Неповрежденный контроль. Середина: Абляция3-го антенного сегмента. Внизу: Абляция2-го (и, следовательно, также3-го)антенного сегмента. (D) Подготовка мозга. Вверху: Схемарастеченный муха мозг с указанными обонятельными долей и аксональными проекциями в поле зрения. Внизу: Схематическая настройка для визуализации мозга. Два глиняных рулона (зеленый) установлены на стеклянной горке (светло-голубой), они несут крышку слайд бутерброд, который содержит муха мозги (серый). Мозги монтируются в антифадеде реагент (фиолетовый), окруженный лабораторной лентой (оранжевый), и покрыты двумя слайдами крышки (черный). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
3. Уход индуцированных оптогенетики, как readout для Аксон и Синапсе функции
- Оптогенетическая установка
- Выполните оптогенетический эксперимент в темной комнате. Убедитесь, что установка состоит из 850 нм инфракрасного (ИК) светодиодный прожектор для освещения мух в темноте (Рисунок 3А), мигающий 660 нм красный светодиодный прожектор для активации нейронов, выражающих CsChrimson, и монохромная камера с 700 нм longpass фильтр, который предотвращает запись красных вспышек света.
- Используйте 3D-принтер для создания крошечной круговой камеры поведения диаметром 1 см, накройте его слайдом с крышкой и поместите излучатель 860 нм в сочетании с красным светодиодным прожектором рядом с камерой(рисунок 3B).
ПРИМЕЧАНИЕ: Излучатель указывает, когда красный светодиодный прожектор на, таким образом активации нейронов. - Установите светодиодные прожекторы и камеру на верхней части камеры(рисунок 3A, C).
- Активировать нейроны на 10 Гц мигает в течение 10 с. Продолжительность активации может быть скорректирована в соответствии с экспериментальной конструкцией.
- Подготовка мух к оптогенетике
- Растопить муху пищи в микроволновой печи. После того, как пища остынет, перед затвердеванием, добавьте 1:100 из 20 мм все транс-ретина в этаноле (EtOH) к окончательной концентрации 200 мкм. Хорошо перемешайте и сразу же влейте пищу в пустые флаконы.
ПРИМЕЧАНИЕ: Избегайте добавления всех транс-ретина к горячей пище, это может привести к менее эффективной оптогенетики. - Обложка флаконов, содержащих затвердевную пищу с пробками или ватные шарики. Оберните флаконы алюминиевой фольгой. Затем храните пищевые флаконы в темной, холодной комнате.
- Используйте 5 девственных самок и 5 самцов(рисунок 6A,поколение P0) из правого генотипа для выполнения крестов на RT. Pass P0 в новые флаконы каждые 3-4 дня. Соберите свежезакрытые потомство взрослых (поколение F1)на ежедневной основе и дайте им возраст в течение 7 до 14 дней в алюминиевых флаконах, содержащих 200 мкм все транс-ретиналь в муховой пище.
- Соберите мух, нажав их из пищевых флаконов в пустой флакон без пищи. Охладите флакон в ледяной воде примерно на 30 с. Мухи заснут. Положите отдельные мухи быстро в небольших камерах, покрытых крышкой слайд(Рисунок 3B).
ПРИМЕЧАНИЕ: Как только мухи прогреваются, они просыпаются. Очень важно быстро распространять отдельных мух в отдельные камеры каждый. Избегайте CO2 колодки для анестезии мух, это повлияет на их поведение. - Выполните оптогенетику, чтобы вызвать антенный уход. Здесь протокол состоит из следующих интервалов: 30 с, где отсутствует красный свет, затем 10 с красного света воздействия на 10 Гц. Повторите эту процедуру три раза в общей сложности, а затем дополнительные 30 с интервалом, где красный свет отсутствует12,29,30.
ПРИМЕЧАНИЕ: Этот протокол может быть скорректирован в соответствии с экспериментальными предпочтениями. - Соберите отдельных мух из каждой камеры на CO2 колодки. Приусловите их к травме антенны. Ablate как левый, так и правый2-й антенный сегменты(рисунок 2C). Это позволит удалить клеточные тела нейронов органа (JO) Джонстона, в то время как аксональные проекции остаются в ЦНС. Восстановить мух в алюминиевых флаконов, содержащих 200 мКм все транс-ретиналь.
ПРИМЕЧАНИЕ: Для антенны холить наведенный оптогенетикой, тела клетки сенсорного нейрона расквартирования в 2nd сегменте антенны(рисунок 2C). - В соответствующие временные моменты (например, 7 дней после абляции антенны), предмет летит на другой уход асссе (вернуться к шагу 3.2.4).
- Растопить муху пищи в микроволновой печи. После того, как пища остынет, перед затвердеванием, добавьте 1:100 из 20 мм все транс-ретина в этаноле (EtOH) к окончательной концентрации 200 мкм. Хорошо перемешайте и сразу же влейте пищу в пустые флаконы.
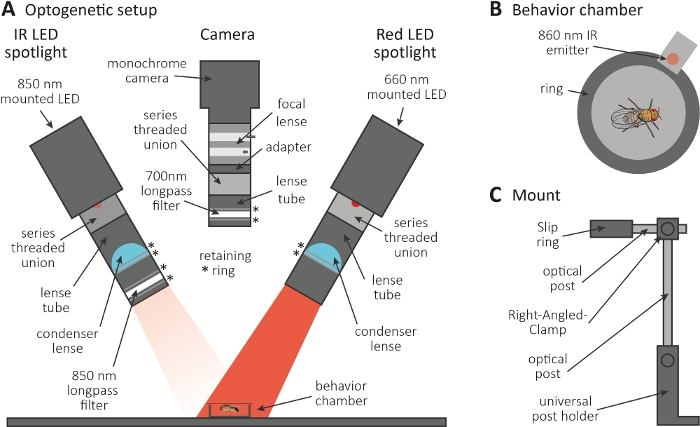
Рисунок 3: Оптогенетическая установка, чтобы вызвать уход в качестве считывания для аксона и синапса функции. (A) Иллюстрация собранных компонентов, необходимых для оптогенетики. Инфракрасный (ИК) светодиодный прожектор, камера и красный светодиодный прожектор (слева направо, соответственно). Компоненты, включая подробное описание, перечислены в таблице материалов. (B) Иллюстрация верхнего просмотра камеры поведения, включая ИК-излучатель, чтобы указать красную активацию светодиодного прожекта. (C) Иллюстрация одной установки крепления. В общей сложности три установки крепления необходимы для двух светодиодных прожекторов и камеры, соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Результаты
Выше мы описали три метода изучения морфологии и функции разорванных аксонов и их синапсов. Первый метод позволяет осуществлять наблюдение с высоким разрешением отдельных аксонов в PNS. Для этого нужны клоны, генерируемые техникой MARCM14,,31. Здесь мы выполнили кресты для создания дикого типа и highwire мутант клонов MARCM(Рисунок 4A). Простой разрез в середине крыла вызывает аксон травмы нейронов размещены дистальные (например, на внешней стороне крыла), в то время как проксимальные нейроны (например, между разрезом и грудной клетки) остаются невредимыми. Такой подход делает возможным наблюдать аксон смерти бок о бок невредимых аксонов управления в том же нервном пучка(Рисунок 1A, Рисунок 4B). Здесь мы использовали генетический фон, в результате чего в низком количестве GFP помечены клонов (например, два в каждом эксперименте14). Мы представляем примеры 1 и 7 дней после повреждения аксонов дикого типа, чтобы привести примеры управления аксонами, аксонами, подвергаемыми аксонной смертью, и аксональными фрагментами, очищаемыми окружающими глиями, соответственно. Кроме того, мы повторили highwire аксональную травму у мутантов, где проанализировали результат через 7 дней после травмы.
Неповрежденные крылья управления гавани два дикого типа клонов, таким образом, два GFP-маркированных диких типа аксонов(Рисунок 4B, дикий тип, невредимым управления). На следующий день после резки середине крыла с помощью микро-ножницы, аксон смерти индуцируется в GFP-маркированных аксонов, где клеточные тела дистальные к разрезу, в то время как аксоны из проксимически расположенных клеточных органов служат внутренним контролем в рамках того же нервного пучка (Рисунок 4B, дикий тип, 1 день после травмы). Обратите внимание на след аксонального мусора в верхней части, указанной стрелкой. 7 дней после травмы аксона, GFP помечены аксонального мусора очищается окружающих глии, в то время как GFP помечены невредимым управления аксоны остаются в нервной расслоение (Рисунок 4B, дикий тип, 7 дней после травмы, стрелка). В отличие от этого, highwire мутант аксоны, которые были разорваны в течение 7 дней остаются морфологически сохранены, в соответствии с предыдущими выводами11,14 (Рисунок 4B, highwire, 7 дней после травмы, стрелка). Эти результаты демонстрируют мощное визуальное разрешение крыла Дрозофилы. Аксон смерти можно наблюдать бок о бок невредимых элементов управления в том же нервном пучка. В то время как аксоны дикого типа подвергаются смерти аксона в течение 1 дня после травмы, и в результате мусор очищается в течение 7 дней, аксон смерти дефицитных мутантов highwire остаются морфологически сохранены в течение 7 дней.

Рисунок 4: Подход к изучению аксона смерти GFP помечены сенсорные нейронные аксоны в крыле. (A) Схематические кресты для создания дикого типа и highwire клонов в крыле (P0 и F1 поколения, соответственно). Девственницы слева, самцы справа. Смотрите таблицу материалов для деталей генотипа. (B) Примеры контроля и поврежденных аксонов с маркировкой GFP. Поле зрения указано в(рисунок 1А). Слева направо: невредимые дикие аксоны управления типом, дикие аксоны типа 1-дневный пост травмы, дикий тип аксонов 7 дней после травмы, highwire мутанта аксоны 7 дней после травмы, соответственно. Стрелки указывают на отрубленных аксонов, шкала бар No 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Второй метод описывает, как визуализировать целые аксонные пучки, проецируя в ЦНС, где они образуют синапсы, которые принадлежат к нейронам, размещенным в левой и правой антеннах(рисунок 2A-C). Здесь мы выполнили кресты для создания дикого типа и highwire мутант клонов MARCM(Рисунок 5A). Неповрежденные, GFP-маркированные аксоны и их синапсы могут быть визуализированы в течение нескольких дней до нескольких недель, при отсутствии травмы(рисунок 5B, Дикий тип, неповрежденный контроль). Кроме того, животные могут быть подвергнуты3-й антенный сегмент абляции, и разорвал GFP помечены аксоны и их синапсы могут наблюдаться в течение времени курса в течение нескольких часов до нескольких дней. Мы сосредоточились на 7 дней после абляции антенны, потому что в этот момент точки, аксоны и их синапсы претерпели аксон смерти, и в результате мусорочищается окружающих глии. Если односторонняя абляция правой антенны выполняется, то правый аксон расслоение отрубается и будет разбирать и в результате мусора полностью очищается 7 дней после травмы(Рисунок 5B, дикий тип, одностороннее ablation, 7 дней после травмы, стрелки), в соответствии с предыдущими выводами13. Кроме того, как правая, так и левая антенны могут быть абляции, которая будет разорвать как аксон расслоения, и 7 дней после травмы, аксоны и их синапсы исчезли(Рисунок 5B, дикий тип, двусторонняя абляция, 7 дней после травмы, стрелка). В отличие от этого, одностороннее абляции правых антенн в мутантов highwire приводит к разорванной аксонов, которые остаются сохраненными 7 дней после травмы, в соответствии с предыдущими выводами11,14 (Рисунок 5B, Highwire, односторонней абляции, 7 дней после травмы, стрелка). Эти результаты показывают, что разорванные аксоны дикого типа подвергаются смерти аксона и в результате мусора очищается в течение 7 дней, в то время как аксон смерти дефицитных мутантов провода не могут пройти аксон смерти и остаются морфологически сохранились в течение 7 дней.
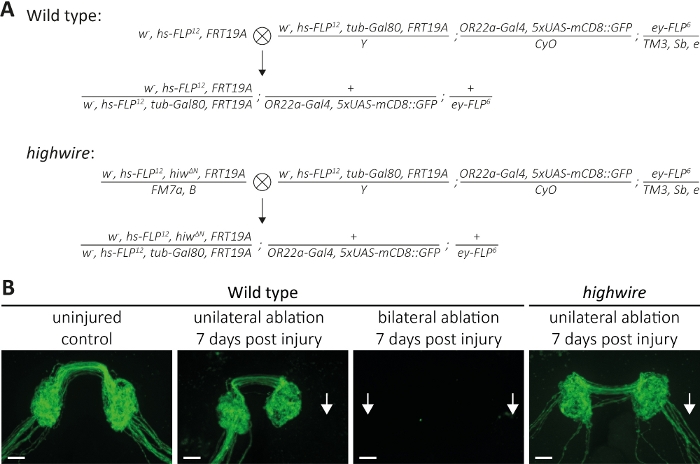
Рисунок 5: Подход к изучению аксона смерти GFP помечены сенсорные нейронные аксоны в головном мозге. (A) Схематические кресты для создания дикого типа и highwire клонов в головном мозге (P0 и F1 поколения, соответственно). Девственницы слева, самцы справа. Смотрите таблицу материалов для деталей генотипа. (B) Примеры контроля и поврежденных аксонов с маркировкой GFP. Слева направо: невредимые дикие элементы управления типа, дикий тип 7 дней после односторонней абляции антенны, дикий тип 7 дней после двусторонней абляции антенны, и мутанты высокого провода 7 дней после односторонней абляции антенны, соответственно. Стрелки указывают на разорванные аксонные пучки, шкала бар No 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Третий метод позволяет наблюдать за функциональным сохранением отрубленых аксонов и их синапсов в ЦНС. Он опирается на манипуляции подмножество нейронов JO размещены в2-й сегмент антенны, которые являются достаточными, чтобы вызвать антенны холить. Выражение красно-сдвигаканала каналродопсина (CsChrimson) в НЕЙРОНах JO, в сочетании с пищевыми добавками всех транс-ретинал, достаточно, чтобы вызвать простой пост-синаптический уход поведение на красный свет воздействия12,30. Здесь мы выполнили кресты для создания диких нейронов типа JO, и НЕЙРОНы JO чрезмерно выражать dnmnat (dnmnatOE)(Рисунок 6A). Дикий тип мух или мух, содержащих JO нейронов с ослабленной смерти аксон(dnmnatOE), как гавань мощное поведение ухода до травмы. Тем не менее, 7 дней после травмы (например, двусторонняя абляция2-го сегмента антенны), уход не может быть вызвано оптогенетики в диком типе мух из-за травмы индуцированной аксон и синапсдевых дегенерации, в то время как животные с ослабленной аксон смерти продолжают жениха(Рисунок 6B, фильм 1,2). Таким образом, ослабленная смерть аксона способна функционально сохранять разорванные аксоны и их синапсы в течение 7 дней.

Рисунок 6: Подход к визуализации аксональной и синаптической функции после акотомии. (A) Схематические кресты для создания дикого типа и dnmnat чрезмерного выражения JO сенсорных нейронов (P0 и F1 поколения, соответственно). Девственницы слева, самцы справа. Смотрите таблицу материалов для деталей генотипа. (B) Индивидуальные этограммы ухода поведение индуцированных оптогенетики. Вверху: отдельные этиграммы дикого типа летают до и через 7 дней после травмы (синий). Внизу: отдельные этиграммы мух, перевыражающих dnmnat (dnmnatOE) в нейронах JO до и через 7 дней после травмы (красный). Каждый ящик указывает по крайней мере 1 уход поведение в течение 1 с. Черная линия указывает сумму всех бункеров. (C) Количественная оценка поведения ухода. Данные отображаются в p качестве среднего стандартного отклонения, р.gt; 0.001 (одностороннее ANOVA, несколько сравнений с послехокастого теста Tukey). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Фильм 1: Представитель дикого типа ухода поведение вызвано оптогенетики до и 7 дней после антенной абляции. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Фильм 2: Представитель ухода поведение вызвано оптогенетики у мух над-выражения dnmnat в JO нейронов до и 7 дней после антенны абляции. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
Описанные здесь протоколы позволяют надежное и воспроизводимое наблюдение морфологии, а также функцию аксонов и их синапсов, отделенных от их клеточных тел в Дрозофиле. Обзор крыла облегчает наблюдение аксона смерти бок о бок невредимых аксонов управления в PNS14, в то время как антенный анализ облегчает наблюдение целых нервных пучков GFP помечены аксоны и их синапсы, для оценки морфологии и функции в головном мозге (CNS)12. Есть критические шаги и определенные преимущества для каждого подхода к изучению морфологии, которые должны быть приняты во внимание при разработке экспериментов.
Для наблюдения аксоновой морфологии в PNS в крыле, эксперименты могут быть легко выполнены, из-за прозрачности крыла: это позволяет обойти рассечение и иммуногистохимии. Однако, из-за отсутствия фиксации, крылья должны быть изображены сразу после монтажа14. В настоящее время часто используются два различных драйвера Gal4, либо ok371Gal4 или dprd1Gal4,и обе ссылки предлагают различные подходы к количественной оценке дегенерации14,26. Разрежение маркировки нескольких нейронов рекомендуется, с помощью "Мозаики Анализ с репрессивным маркером клеток (MARCM)"14,31, как разрешение аксональной морфологии является беспрецедентным. В отличие от этого, наблюдение синапсов не представляется возможным в крыльях, они расположены в брюшной нервной шнур внутри грудной клетки мух. Кроме того, дополнительные аксональные маркеры не могут быть визуализированы иммуногистохимией: восковая кутикула делает невозможным распространение фиксатов и антител в подлежащую ткани.
Для наблюдения аксона и синапсовой морфологии в ЦНС, вскрытие мозга должны быть выполнены. Они предлагают преимущество визуализации дополнительных аксональных и синаптических маркеров с помощью иммуногистохимии, а синапсы можно наблюдать вместе с аксонами в том же поле зрения10,13. Большая коллекция характеризуется обонятельный рецептор нейрона (ORN) Gal4 драйверов легко доступны32, и часто, OR22aGal4 является драйвером выбора. Для абляции антенны, тела клетки нейронов OR22a размещаются в3-м сегменте(рисунок 2B). Флуоресценция интенсивности на основе количественной оценки дегенерации либо аксонов или синапсов13. И наоборот, эксперименты отнимают много времени из-за вскрытия мозга и окрашивания антител.
Для визуализации аксональной и синаптической функции после акотомии, оптогенетика используется для запуска антенного ухода: она служит считыванием для функционального сохранения отрубленные аксоны и их синапсы12. Схема ухода и соответствующие сенсорные, между и motorneuron Gal4 водители были тщательно описаны29,30. GMR60E02Gal4 этикетки подмножество органов Джонастона (JO) сенсорных нейронов, которые необходимы и достаточно для ухода29,30. Для абляции антенны, тела клетки нейронов JO размещаются в2-й сегмент антенны(рисунок 2B). Оптогенетической установки можно легко построить с нуля, или существующие настройки скорректированы. Важно отметить, что эксперименты должны быть выполнены в темной комнате, и мухи таким образом визуализированы с инфракрасным (ИК) светодиодный прожектор. При использовании CsChrimson в качестве канала, очень важно поставлять пищу со всеми транс-ретиналя и красный светодиодный прожектор, чтобы активировать JO нейронов29. Кроме того, синие светочувствительные каналы и синий светодиодный прожектор, или канал TrpA1 и температура может быть использована для активации нейронов29,33. Количественная оценка поведения ухода уже описано12,29.
Когда эти анализы используются для специального изучения смерти аксона, важно отметить, что фенотип морфологического или функционального сохранения должен быть надежным с течением времени. Есть случаи, когда смерть аксона приводит к последовательной, но менее выраженный фенотип в морфологическом сохранении34,35, и является ли такой фенотип переводит в функциональное сохранение еще предстоит определить.
Фенотипы смерти Аксон также наблюдались в нейронах во время развития личинок Дрозофилы, где нервы были раздавлены, а не ранены11,23. Здесь мы специально сосредоточились на взрослых нейронах Дрозофилы, которые завершили разработку. В этом контексте, использование РНК-интерференции36, или ткани конкретных CRISPR/Cas937 может быть легко реализована. Важно отметить, что вышеуказанные методы могут быть использованы в аксон смерти независимого контекста: они облегчают характеристику нейрональных факторов обслуживания38, аксональный транспорт39, возраст-зависимых аксональных митохондрий изменения40, и морфологии аксональной митохондрии41.
Раскрытие информации
Авторы заявляют, что им нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить всю лабораторию Neukomm за вклад. Эта работа была поддержана Швейцарским национальным научным фондом (SNSF) помощник профессора премии (грант 176855), Международный фонд исследований в параплегии (IRP, грант P180), SNSF Spark (грант 190919) и при поддержке Университета Лозанны и кафедры фундаментальных неврологий (Зтат де Во) в LJN.
Материалы
| Name | Company | Catalog Number | Comments |
| Tweezers (high precision, ultra fine) | EMS | 78520-5 | Antennal ablation |
| MicroPoint Scissors (5-mm cutting edge) | EMS | 72933-04 | Wing injury |
| 1.5 mL microcentrifuge tube | Eppendorf | 30120086.0000 | |
| 35mm tissue culture dish | Sarstedt | 83.3900 | |
| Cover Slips, Thickness 1 | Thermo Scientific™ | BB02400600A113MNT0 | |
| Superfrost Microscope Slides | Thermo Scientific™ | AA00008032E00MNT10 | |
| High-Sensitivity USB 2.0 CMOS Camera, 1280 x 1024, Global Shutter | Thorlabs | DCC1240M | Camera setup |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 25mm 1/1.2" C mount Lens | Tamron | M112FM25 | |
| Adapter with External M27 x 0.5 Threads and Internal SM1 Threads | Thorlabs | SM1A36 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 700 nm | Thorlabs | FELH0700 | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 1" Long, Two Retaining Rings Included | Thorlabs | SM1M10 | |
| 850 nm, 900 mW (Min) Mounted LED, 1200 mA | Thorlabs | M850L3 | IR LED spotlight |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 850 nm | Thorlabs | FELH0850 | |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 660 nm, 940 mW (Min) Mounted LED, 1200 mA | Thorlabs | M660L4 | Red LED spotlight |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for One K- or T-Cube | Thorlabs | KPS101 | LED control |
| T-Cube LED Driver, 1200 mA Max Drive Current | Thorlabs | LEDD1B | |
| 150 mm x 300 mm x 12.7 mm Aluminum Breadboard, M6 Double-Density Taps | Thorlabs | MB1530/M | Mount base |
| Ø12.7 mm Universal Post Holder, Spring-Loaded Locking Thumbscrew, L = 75 mm | Thorlabs | UPH75/M | Mount, 3x (IR LED, red LED, cam) |
| Ø1.20" Slip Ring for SM1 Lens Tubes and C-Mount Extension Tubes, M4 Tap | Thorlabs | SM1RC/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 150 mm | Thorlabs | TR150/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 40 mm | Thorlabs | TR40/M | |
| Right-Angle Clamp for Ø1/2" Posts, 5 mm Hex | Thorlabs | RA90/M | |
| M6 x 1.0 Stainless Steel Cap Screw, 16 mm Long, Pack of 25 | Thorlabs | SH6MS16 | screws for mount onto base |
| USB-6001 14-Bit 20 kS/s Multifunction I/O and NI-DAQmx | National Instruments | 782604-01 | Red LED spotlight controller |
| 20k Ohm 1 Gang Linear Panel Mount Potentiometer | TT Electronics/BI | P230-2EC22BR20K | fintuner for indicator |
| IR (860nm) emitter, 100 mA radial | Osram | 475-1365-ND | Red light indicator |
| cable | - | - | Misc |
| All-trans retinal | Sigma | R2625 | |
| Ethanol absolute | Vwr | 20821.296 | |
| Halocarbon Oil 27 | Sigma | H8773 | |
| Mowiol | Merk | 81381 | |
| Paraformaldehyde | Sigma | F8775 | |
| Phosphate buffered saline (PBS) | Sigma | P5493 | |
| Sylgard 184 silicone elastomer base | Dow Corning Corp | 4019862 | |
| Sylgard 184 silicone elastomer curing agent | Dow Corning Corp | 4019862 | |
| Triton X-100 | Sigma | T8787 | |
| Chicken anti-GFP antibodies | Rockland | 600-901-215 | Antibodies |
| Goat Dylight anti-Chicken | Abcam | ab96947 | |
| FM7a, B | BDSC | RRID:BDSC_785 | X chromosome |
| FRT19A[hs-neo] | BDSC | RRID:BDSC_1709 | |
| hiw[ΔN] | BDSC | RRID:BDSC_51637 | |
| hs-FLP[12] | BDSC | RRID:BDSC_1929 | |
| tub-Gal80[LL1] | BDSC | RRID:BDSC_5132 | |
| w[1118] | BDSC | RRID:BDSC_3605 | |
| 20xUAS-IVS-CsChrimson::mVenus | BDSC | RRID:BDSC_55135 | 2nd chromosome |
| 5xUAS-Gal4[12B] | Kyoto | RRID:Kyoto_108492 | |
| 5xUAS-HA::dnmnat | BDSC | RRID:BDSC_39702 | |
| 5xUAS-mCD8::GFP[LL5] | BDSC | RRID:BDSC_5134 | |
| ase-FLP[2d] | Freeman laboratory | Neukomm et al., 2014 (PNAS) | |
| CyO | BDSC | RRID:BDSC_2555 | |
| dpr1-Gal4 | BDSC | RRID:BDSC_25083 | |
| OR22a-Gal4 | BDSC | RRID:BDSC_9952 | |
| ey-FLP[6] | BDSC | RRID:BDSC_5577 | 3rd chromosome |
| GMR60E02-Gal4 | BDSC | RRID:BDSC_39250 | |
| TM3,Sb,e | BDSC | RRID:BDSC_3644 |
Ссылки
- Matsuda, W., et al. Single Nigrostriatal Dopaminergic Neurons Form Widely Spread and Highly Dense Axonal Arborizations in the Neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Wedel, M. J. A Monument of Inefficiency: The Presumed Course of the Recurrent Laryngeal Nerve in Sauropod Dinosaurs. Acta Palaeontologica Polonica. 57 (2), 251-256 (2012).
- Mariano, V., Domínguez-Iturza, N., Neukomm, L. J., Bagni, C. Maintenance mechanisms of circuit-integrated axons. Current Opinion in Neurobiology. 53, 162-173 (2018).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nature reviews Neuroscience. 15 (6), 394-409 (2014).
- Neukomm, L. J., Freeman, M. R. Diverse cellular and molecular modes of axon degeneration. Trends in Cell Biology. 24 (9), 515-523 (2014).
- Gustavsson, A., et al. Cost of disorders of the brain in Europe 2010. European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 21 (10), 718-779 (2011).
- Waller, A. Experiments on the Section of the Glossopharyngeal and Hypoglossal Nerves of the Frog, and Observations of the Alterations Produced Thereby in the Structure of Their Primitive Fibres. Philosophical Transactions of the Royal Society of London. 140, 423-429 (1850).
- Rosell, A. L., Neukomm, L. J. Axon death signalling in Wallerian degeneration among species and in disease. Open Biology. 9 (8), 190118(2019).
- Mack, T. G., et al. Wallerian degeneration of injured axons and synapses is delayed by a Ube4b/Nmnat chimeric gene. Nature Neuroscience. 4 (12), 1199-1206 (2001).
- Osterloh, J. M., et al. dSarm/Sarm1 is required for activation of an injury-induced axon death pathway. Science. 337 (6093), New York, NY. 481-484 (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biology. 10 (12), 1001440(2012).
- Neukomm, L. J., et al. Axon Death Pathways Converge on Axundead to Promote Functional and Structural Axon Disassembly. Neuron. 95 (1), 78-91 (2017).
- MacDonald, J. M., et al. The Drosophila cell corpse engulfment receptor Draper mediates glial clearance of severed axons. Neuron. 50 (6), 869-881 (2006).
- Neukomm, L. J., Burdett, T. C., Gonzalez, M. A., Zuchner, S., Freeman, M. R. Rapid in vivo forward genetic approach for identifying axon death genes in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (27), 9965-9970 (2014).
- Lu, T. Y., et al. Axon degeneration induces glial responses through Draper-TRAF4-JNK signalling. Nature Communications. 8, 14355(2017).
- Lunn, E. R., Perry, V. H., Brown, M. C., Rosen, H., Gordon, S. Absence of Wallerian Degeneration does not Hinder Regeneration in Peripheral Nerve. The European Journal of Neuroscience. 1 (1), 27-33 (1989).
- Adalbert, R., et al. A rat model of slow Wallerian degeneration (Wld(S)) with improved preservation of neuromuscular synapses. The European Journal of Neuroscience. 21 (1), 271-277 (2005).
- Martin, S. M., O'Brien, G. S., Portera-Cailliau, C., Sagasti, A. Wallerian degeneration of zebrafish trigeminal axons in the skin is required for regeneration and developmental pruning. Development. 137 (23), Cambridge, England. 3985-3994 (2010).
- Feng, Y., et al. Overexpression of Wld(S) or Nmnat2 in Mauthner Cells by Single-Cell Electroporation Delays Axon Degeneration in Live Zebrafish. Journal of Neuroscience Research. 88 (15), 3319-3327 (2010).
- Gilley, J., Coleman, M. P. Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons. PLoS Biology. 8 (1), 1000300(2010).
- Babetto, E., Beirowski, B., Russler, E. V., Milbrandt, J., DiAntonio, A. The Phr1 ubiquitin ligase promotes injury-induced axon self-destruction. Cell Reports. 3 (5), 1422-1429 (2013).
- Gerdts, J., Summers, D. W., Sasaki, Y., DiAntonio, A., Milbrandt, J. Sarm1-mediated axon degeneration requires both SAM and TIR interactions. The Journal of Neuroscience. 33 (33), 13569-13580 (2013).
- Gerdts, J., Brace, E. J., Sasaki, Y., DiAntonio, A., Milbrandt, J. SARM1 activation triggers axon degeneration locally via NAD+ destruction. Science. 348 (6233), New York, NY. 453-457 (2015).
- Bridge, P. M., et al. Nerve crush injuries--a model for axonotmesis. Experimental Neurology. 127 (2), 284-290 (1994).
- Maxwell, W. L., Bartlett, E., Morgan, H. Wallerian Degeneration in the Optic Nerve Stretch-Injury Model of Traumatic Brain Injury: A Stereological Analysis. Journal of Neurotrauma. 32 (11), 780-790 (2015).
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Current Biology. 22 (7), 590-595 (2012).
- Janelia Farm Adult Drosophila Brain Dissection. , Available from: https://www.janelia.org/project-team/flylight/protocols (2015).
- Cold Spring Harbor. Mowiol mounting medium. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Seeds, A. M., et al. A suppression hierarchy among competing motor programs drives sequential grooming in Drosophila. eLife. 3, 02951(2014).
- Hampel, S., Franconville, R., Simpson, J. H., Seeds, A. M. A neural command circuit for grooming movement control. eLife. 4, 08758(2015).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Vosshall, L. B., Wong, A. M., Axel, R. An olfactory sensory map in the fly brain. Cell. 102 (2), 147-159 (2000).
- Hampel, S., McKellar, C. E., Simpson, J. H., Seeds, A. M. Simultaneous activation of parallel sensory pathways promotes a grooming sequence in Drosophila. eLife. 6, (2017).
- Farley, J. E., et al. Transcription factor Pebbled/RREB1 regulates injury-induced axon degeneration. Proceedings of the National Academy of Sciences of the United States of America. 23 (6), (2018).
- Wang, H., et al. Rapid depletion of ESCRT protein Vps4 underlies injury-induced autophagic impediment and Wallerian degeneration. Science Advances. 5 (2), 4971(2019).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151-156 (2007).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. bioRxiv. 102, 636076(2019).
- Vagnoni, A., Hoffmann, P. C., Bullock, S. L. Reducing Lissencephaly-1 levels augments mitochondrial transport and has a protective effect in adult Drosophila neurons. Journal of Cell Science. 129 (1), 178-190 (2016).
- Vagnoni, A., Bullock, S. L. A cAMP/PKA/Kinesin-1 Axis Promotes the Axonal Transport of Mitochondria in Aging Drosophila Neurons. Current Biology. 28 (8), 1265-1272 (2018).
- Cao, X., et al. In vivo imaging reveals mitophagy independence in the maintenance of axonal mitochondria during normal aging. Aging Cell. 16 (5), 1180-1190 (2017).
- Smith, G. A., et al. Glutathione S-Transferase Regulates Mitochondrial Populations in Axons through Increased Glutathione Oxidation. Neuron. 103 (1), 52-65 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены