Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микрофлюидическое производство лизолипид-содержащих температурно-чувствительных липосом
В этой статье
Резюме
Протокол представляет оптимизированные параметры для подготовки термочувствительных липосом с помощью ступенчатой елочка микромиксер microfluidics устройства. Это также позволяет совместно инкапсуляции доксорубицина и индоцианина зеленый в липосомы и фототермальных триггеров выпуска доксорубицина для контролируемого / триггерного выпуска препарата.
Аннотация
Представленный протокол обеспечивает высокую пропускную способность непрерывной подготовки низкотемпературно чувствительных липосом (LTSL), которые способны загружать химиотерапевтические препараты, такие как доксорубицин (DOX). Для этого этаноличная липидная смесь и раствор сульфата аммония вводятся в пошатнувшийся микромиксер елочки (SHM). Решения быстро смешиваются SHM, обеспечивая однородную платежеспособную среду для самосборки липосом. Собранные липосомы сначала анзанываются, затем диализуются для удаления остаточного этанола. Аммоний сульфат рН-градиент устанавливается путем буферного обмена внешнего раствора с помощью хроматографии исключения размера. DOX затем удаленно загружается в липосомы с высокой эффективностью инкапсуляции (No gt; 80%). Полученные липосомы однородны по размеру с диаметром 100 нм. Они способны температурного всплеска высвобождение инкапсулированных DOX в присутствии легкой гипертермии (42 градусов по Цельсию). Индоцианин зеленый (ICG) также может быть совместно загружен в липосомы для ближнего инфракрасного лазерного триггера DOX релиз. Микрофлюидный подход обеспечивает высокую пропускную, воспроизводимую и масштабируемую подготовку LTSLs.
Введение
LTSL формулировка является клинически значимым липосомным продуктом, который был разработан для доставки химиотерапевтического препарата доксорубицин (DOX) и позволяет эффективно ежефтом препарат высвобождение при клинически достижимой мягкой гипертермии (Т З 41 КК)1. Формулировка LTSL состоит из 1,2-дипалмитоила-сна -глицеро-3-фосфохолина (ДППК), лисолипида 1-стеароил-2-гидрокси -sn-glycero-3-фосфатидилхолин (MSPC; M означает "моно") и PEGylated липид 1,2-distearoyl-sn-glycero-3-фосфоэтаноламин-N-метокси (полиэтиленгликоль)-2000" (DSPE-PEG2000). По достижении фазы переходной температуры (Tм З 41 КК), лисолипид и DSPE-PEG2000 вместе облегчить образование мембранных пор, в результате чего взрыв релиз препарата2. При подготовке LTSLs в основном используется объемный подход сверху вниз, а именно гидратация липидной пленки и экструзия. По-прежнему сложно подготовить большие партии с идентичными свойствами и в достаточном количестве для клинического применения3.
Microfluidics является новой техникой для подготовки липосом, предлагая tunable размер наночастиц, воспроизводимость, и масштабируемость3. После оптимизации производственных параметров пропускная часть может быть уменьшена путем параллелизации, при этом свойства идентичны тем, которые подготовлены на скамейке3,4,5. Основным преимуществом микрофлюитики по сравнению с обычными методами навалом является способность обрабатывать небольшие объемы жидкости с высокой управляемостью в пространстве и времени через миниатюризацию, что позволяет быстрее оптимизации, при работе в непрерывной и автоматизированной манере6. Производство липосом с микрофлюидными устройствами достигается за счет подхода нанопрейности снизу вверх, который является более эффективным временем и энергоэффективностью, поскольку гомогенизации процессов, таких как экструзия и sonication являются ненужными7. Как правило, органический раствор (например, этанол) липидов (и гидрофобной полезной нагрузки) смешивается с неверным нерастворимым (например, вода и гидрофильные полезные нагрузки). По мере того как органический растворитель смешивается с нерастворимым, растворимость липидов уменьшается. Концентрация липидов в конечном итоге достигает критической концентрации, при которой процесс осадков срабатывает7. Нанопромицираты липидов в конечном итоге растут в размерах и закрываются в липосому. Основными факторами, определяющими размер и однородность липосом, являются соотношение между неплатежеспособным и растворителем (т.е. соотношение скорости между органическим потоком; FRR) и однородность платежеспособной среды при самосборке липидов в липосомы8.
Эффективное смешивание жидкости в микрофлюитике поэтому имеет важное значение для подготовки однородных липосом, и различные конструкции смесителей были использованы в различных приложениях9. Затененный микромиксора елочки (SHM) представляет собой одно из новых поколений пассивных смесителей, что обеспечивает высокую пропускную мощность (в диапазоне мл/мин) с низким коэффициентом разбавления. Это превосходит традиционные микрофлюидные гидродинамические устройства смешивания8,10. SHM имеет узорчатые канавки из елочки, которые быстро смешивают жидкости хаотическим адвакцией9,11. Короткая шкала времени смешивания SHM (Злт; 5 мс, меньше, чем типичная шкала времени агрегации 10-100 мс) позволяет липидной самосборки происходит в однородной среде растворителя, производя наночастицы с равномерной распределения размера3,12.
Подготовка LTSLs с микрофлюитики, однако, не так просто по сравнению с обычными липосомными составами из-за отсутствия холестерина8, без которых липидные двуслойки восприимчивы к этанол индуцированной интерцифровки13,14,15. До сих пор эффект остаточного этанола, представленного при микрофлюидном производстве липосом, не был хорошо понят. Большинство заявленных составов по своей сути устойчивы к межцифровой (содержащий холестерин или ненасыщенные липиды)16, которые в отличие от LTSLs являются как насыщенными, так и без холестерина.
Протокол, представленный в этом проекте, использует SHM для подготовки LTSL для доставки препарата с книжками с книжки с книжкой. В представленном методе мы обеспечили микрофлюидные ПОДГОТОВЛЕННЫе LTSLs нано-размера (100 нм) и однородны (дисперсия злитрона; 0.2) динамическим рассеянием света (DLS). Кроме того, мы инкапсулировали DOX с помощью метода градиента сульфата аммемов transmembrane (также известного как удаленная загрузка)17 в качестве подтверждения целостности липидного двухслойного LTSL. Удаленная загрузка DOX требует липосомы для поддержания рН-градиента для достижения высокой эффективности инкапсуляции (EE), что вряд ли произойдет без нетронутого липидного двухслойного. В этом представленном методе, отличительном от типичных протоколов подготовки микрофлюидных липосом, требуется шаг аннулирования, прежде чем этанол удаляется, чтобы обеспечить возможность удаленной загрузки; т.е. для восстановления целостности липидного двухслойного.
Как упоминалось ранее, гидрофильные и гидрофобные полезные нагрузки могут также быть введены в первоначальные решения для одновременной инкапсуляции полезных нагрузок при формировании ЛТЛ. В качестве доказательства концепции, индоцианин зеленый (ICG), FDA утвержденных ближнего инфракрасного флуоресцентного красителя, который также является перспективным фототермальным агентом, вводится в начальную липидную смесь и успешно совместно загружены в LTSLs. Лазер 808 нм используется для облучения LTSLs, загруженных DOX/ICG, и успешно индуцировать фототермический разрыв, вызванный нагреванием, в течение 5 минут.
Все инструменты и материалы доступны на коммерческой основе, готовы к использованию и без необходимости настройки. Поскольку все параметры для формулирования LTSLs были оптимизированы, после этого протокола, исследователи без предварительного знания микрофлюитики могли бы также подготовить LTSLs, который служит основой термочувствительной системы доставки лекарств.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Установка оборудования
- Соберите шприц насосы и SHM следующим образом.
- Подключите порт "К компьютеру" вторичного шприца насоса (насос 02, для входиного решения) в "К сети" порт мастер шприц насос (насос 01, для этанола липидного раствора) с помощью насоса для насоса сетевого кабеля(рисунок 1, желтый).
- Подключите порт "К компьютеру" мастер насоса в "RS232 Серийный" порт компьютера с помощью ПК для насоса сетевого кабеля(рисунок 1, синий).
- Соедините трубку с каждым из входов и розеток SHM с помощью гайки и ферруле. Преобразуйте терминал труб для обоих входов в женский Luer с помощью другого ореха и ferrule и союзной сборки. Более длинные трубки входов позволяют легче прикрепиться к шприцы(рисунок 2).
- Настройка программного обеспечения для управления насосом.
- Присвоите адрес главного шприца насоса и вторичного шприца насоса "Ad:01" и "Ad:02", соответственно, используя кнопку "Настройка" шприца насоса. Это нужно сделать только в первый раз.
- Откройте программное обеспечение для управления насосом на компьютере. Два шприца насосы должны быть обнаружены автоматически, а затем звуковой сигнал. В противном случае, нажмите насосы и поиск насосов для обновления соединения. (Рисунок 3).
- Присвоить диаметр до 12,45 (мм) по выбору "HSW Норм-Джект 5 cc (Dia-12.45)".
- Присваивай скорость 0,25 мл/мин для насоса 01 (раствор липидов этанола) и 0,75 мл/мин для насоса 02 (вавный раствор). Скорость потока соответствует общей скорости потока (TFR) 1 мл/мин и соотношению скорости потока в результате вака к этанолу (FRR) 3.
- Назначайте объем любым значениям выше 5 мл.
ПРИМЕЧАНИЕ: Целевой объем инфузии устанавливается больше, чем загруженный объем жидкости с учетом пустого объема труб. - Выберите режим INF (инфузии) для обоих насосов.
- Набор нажатий для подтверждения настроек.
2. Подготовьте LTSL
- Подготовка липидной смеси LTSL10 или LTSL10-ICG (см. таблицу 1).
- Снимите 1 мл липидной смеси и не менее 3 мл (NH4)2SO4 раствора с использованием двух 5 мл Luer блокировки шприцев.
- Установите два шприца на шприц насосы в вертикальном положении, сдвинув баррель флангшку шприца на шприц фиксатор насоса, и поршень флангш шприц на толкач блок насоса (Рисунок 4).
- Заверните конец нагревательной ленты в шприц с помощью вавомного раствора. Оберните другой конец нагревательной ленты и температурный зонд термостата вокруг шприца липидным раствором. Полезно практиковать этот шаг с пустыми шприцев на месте для того, чтобы облегчить процесс сборки (Рисунок 5A).
- Соедините два шприца с женскими адаптерами Luer соответствующих входов SHM. Убедитесь, что шприцы, содержащие липидную смесь и (NH4)2SO4 решения подключены этанола входе и входе, соответственно. Отрегулируйте положение поршеня, чтобы удалить пузырьки воздуха из шприцев(рисунок 5B).
ПРИМЕЧАНИЕ: Убедитесь, что шприцы по-прежнему надежно расположены на шприц фиксатор насосов. - Нагрейте шприцы выше 51 градусов по Цельсию с помощью нагревательной ленты с помощью 10-ситопного сеанса. Разрешить термостат для обновления температуры шприцев. Повторите этот шаг в следующих шагах для поддержания температуры во время инфузии.
ВНИМАНИЕ: Выключите нагревательную ленту через 10 с, чтобы предотвратить превышение температуры и позволить термостату обновить фактическую температуру. Отопительная лента также должна быть обработана с осторожностью, как его температура поднимается очень быстро. Отопление непрерывно может повредить оборудование и шприцы, из-за задержки времени термостата для обновления измеренной температуры. - После того, как температура выше 51 градусов по Цельсию, запустить шприц насосы, нажав Run All в программное обеспечение управления насосом (Рисунок 3).
- Убедитесь, что поток жидкости свободен от пузырьков воздуха и любой утечки. Утилизировать первоначальный объем (около 0,5 мл) жидкости из розетки в качестве отходов.
ПРИМЕЧАНИЕ: Этот первоначальный объем отходов не является определенным и зависит от внутреннего объема установки, которая является объем для жидкости для перемещения от шприцев через трубку и SHM в розетку. - Соберите остальную часть жидкости в виде липосомввв в микроцентрифугую трубку или бижу флакон.
- Пауза / остановить настой, когда жидкость в любом из шприцев почти пустой.
ПРИМЕЧАНИЕ: Насосы должны быть остановлены вручную, так как насосы не могут точно определить положение, когда шприцы пусты. - Поместите собранные липосомы в водяную ванну 60 градусов по Цельсию до 1,5 ч.
ПРИМЕЧАНИЕ: Этот шаг имеет важное значение в обеспечении загрузки наркотиков в липосомы. - Перенос растворов на диализные трубки. Диализ решения против 1 L 240 мМ (NH4)2SO4 при 37 градусах по Цельсию, по крайней мере 4 ч для получения очищенных липосом.
ПРИМЕЧАНИЕ: Протокол можно приложить здесь. Липосомы на этом этапе находятся на 5 мМ фосфолипидов. Очищенные липосомы могут храниться при 4 градусах Цельсия. - Для очистки SHM для повторного использования, промыть SHM последовательно с деионизированной водой, этанол и сухой с азотным газом.
3. Удаленная загрузка DOX в LTSLs трансмембранным градиентом рН
- Обмен внешним буфером LTSL на солен hePES-буфер (HBS) с помощью хроматографии исключения размера (SEC) для установления трансмембранного градиента рН.
- Добавьте в общей сложности 25 мл HBS в верхней части столбца SEC для подготовки столбца. Разрешить всем eluent elute через колонку и распоряжаться eluate.
- Добавьте 1 мл диализированных липосом, приготовленных со ступени 2.12, в колонку и распоряжайте элют.
- Добавьте 1,5 мл HBS в колонку и распоряжайте элют.
- Добавьте 3 мл HBS в колонку и соберите 3 мл elute.
ПРИМЕЧАНИЕ: Протокол можно приложить здесь. Липосомы собираются на этом этапе и находятся на уровне 1,67 мМ фосфолипидов. Буфер ные обменливли липосомможно хранить при 4 градусах Цельсия.
- Инкубировать LTSLs с доксорубицином (DOX) и очистить LTSLs.
- Добавьте раствор DOX в 1:20 DOX-к-фосфолипидный молярный соотношение в 1 мл буферно-обменного раствора липосом (1,67 ммоль), содержащегося в бижу-флаконе. Этого можно достичь, добавив 48,4 л раствора DOX 1 мг/мл (83,4 мкм).
- Поместите флакон bijou в водяную ванну 37 градусов по Цельсию в течение 1,5 ч, чтобы позволить DOX нагрузки в липосомы.
- Смешайте 10 зл липосом с 170 зл HBS и 20 ЗЛ 1% (v/v) Раствор Triton X-100 в черной 96-хорошей пластине. Повторите для трех скважин. Эти скважины соответствуют содержанию DOX «до очистки».
- В случае приготовления LTSL10-ICG, смешать 40 л липосом с 160 Л Л ДМСО в прозрачной 96-хорошей пластине. Повторите для трех скважин. Эти скважины соответствуют содержанию ICG «до очистки».
- Очистите липосомный раствор, как описано в шаге 3.1.
ПРИМЕЧАНИЕ: Чтобы повторно использовать столбец для будущей очистки, очистите столбец от свободного DOX, сначала добавив 1 мл разбавленного раствора 0,5 M NaOH, прежде чем выполнить шаг 3.1.1. Бесплатный DOX в красном станет фиолетово-синий и elute через колонку быстро. - Смешайте 30 зл и раствор очищенных липосом с 150 зл и 20 ЗЛ 1% (v/v) Раствор triton X-100 в черной 96-хорошей пластине. Повторите для трех скважин. Эти скважины соответствуют содержанию DOX «после очистки».
- В случае LTSL10-ICG смешайте 40 зл очищенного раствора липосом с 160 Зл ДМСО в прозрачной 96-хорошей пластине. Повторите для трех скважин. Эти скважины соответствуют содержанию ICG «после очистки».
- Измерьте интенсивность флуоресценции DOX скважин до (шаг 3.2.3) и после (шаг 3.2.5) очистки, используя считыватель микроплит(no ex 485 nm,em - 590 nm).
- Рассчитайте эффективность инкапсуляции DOX (DOX EE), взяв соотношение интенсивности флуоресценции до и после очистки.
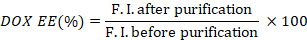
- Измерьте поглощение ICG скважин до и после очистки, используя микроплитный считыватель (от 600 до 1000 нм).
- Рассчитайте эффективность инкапсуляции ICG (ICG EE) с учетом соотношения абсорбции на уровне 792 нм до и после очистки, принимая во внимание фактор разбавления (3 раза) во время очистки.

4. Динамическое рассеяние света (DLS)
- Добавьте 50 л раствора липосом (шаг 2.12) к 450 л деионизированной воды.
- Поместите кювет внутри прибора DLS и выполните измерение в соответствии с инструкциями производителя.
- Запишите средний диаметр и дисперсию по трем измерениям для каждого образца.
5. Дифференциальная сканирующая калория (DSC)
- Концентрата 1 мл образцов липосом (шаг 2.12) с центробежным фильтром до 0,5 мл (окончательная концентрация липидов 10 мМ). Используя ротор с фиксированным углом, вращайтесь при 7500 х г в течение примерно 15 мин.
- Передача 20 qL (NH4)2SO4 раствора и липосомы образцов на две соответствующие кастрюли DSC. Печать кастрюли с DSC герметичные крышки с помощью образца пресс-кит DSC.
- Измерьте образец от 30 до 60 градусов по Цельсию при скорости нагрева 1 кв/мин с помощью дифференциального сканирования калориметра.
- Анализ данных с помощью соответствующего программного обеспечения. Возьмем фазовую температуру перехода (Tm)в качестве начала фазового перехода (пика плавления), который измеряется x-перехватом касательной точки максимального наклона.
6. Доксорубицин релиз
- Разогреть HBS при заданной температуре (37 или 42 градусов по Цельсию) с помощью водяной ванны. Приготовьте ледяную водяную ванну для закалки образцов.
- Добавьте 100 л очищенных DOX-загруженных липосом (шаг 3.2.5) в 1,9 мл HBS в микроцентрифуговой трубке. Поместите трубку в водяную ванну с заданной температурой.
- Немедленно выняйте 200 л образцов из трубки и быстро поместите его в льдовую водяную ванну, чтобы утолить любое последующее высвобождение препарата. Этот образец соответствует начальной (т 0) временной точке.
- Снимите 200 л проб в последующие временные точки (т No 5, 10, 15, 30, 60 мин) и быстро поместите его в ванну с ледяной водой, чтобы утолить любой выброс препарата.
- Смешайте 50 зл и образец каждой временной точки с 150 зл ИФ HBS в черной 96-хорошей пластине. Измерьте интенсивность флуоресценции DOX с помощью считывателя пластин.
- Добавьте 20 КЛ 1% (v/v) Triton X-100 в случайные выбранные скважины, подготовленные в шаге 6.5. Измерьте интенсивность флуоресценции DOX этих скважин с помощью считывателя пластин. Эти значения соответствуют полностью выпущенной (т й й 100% релиз) временной точки.
- Рассчитайте и назначайте процент DOX, выпущенный интерполяцией интенсивности флуоресценции каждого времени (I(t)), по сравнению с начальным (I (0)), и полностью выпущенным значением (I (я)).
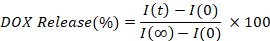
7. Лазерное отопление и спуск выпуска
- Установите температуру водяной ванны до 37 градусов по Цельсию и дайте температуре стабилизироваться.
- Добавьте 200 л ЗАКСа, загруженного LTSL10-ICG («ICG» 10 мкг/мл) к прозрачной 96-хорошей пластине, затем поместите ее в водяную ванну, держите дно погруженным в воду.
- Установите ток лазерной системы до 2.27 A. Поместите коллиматор лазерной системы на 5 см вертикально над поверхностью 96-угольной пластины, что соответствует энергетическому потоку 0,5 Вт/см2 -Рисунок 6.
ПРЕДЕКТО: Лазерная система должна работать в соответствии с соответствующими мерами лазерной безопасности. - Включите лазер и контролировать температуру каждую минуту с помощью волоконно-оптического зонда температуры.
- На 5 и 10 мин, снять 10 зЛ лазерно облученных липосом из ясной 96-ну пластины на и смешать с 190 Л HBS для трех скважин в черной 96-хорошо пластины.
- Смешайте 10 зл липосом с 170 зл HBS и 20 зл 1% (v/v) Triton X-100 раствор для трех скважин в черной 96-хорошей пластине. Эти скважины соответствуют "100% выпущен" DOX содержание. Измерьте интенсивность флуоресцентных doX и вычислите релиз DOX, описанный в шаге 6.7.
Access restricted. Please log in or start a trial to view this content.
Результаты
Для подготовки ЛТЛ с помощью микрофлюиди требуется липидный состав DPPC/MSPC/DSPE-PEG2000 (80/10/10, соотношение моляров; LTSL10). На рисунке 7А (слева) показан опорожнение как подготовленного LTSL10 со ступени 2.9, как прозрачной и невязкийой жидкости. Формул?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Представленный протокол описывает подготовку низкотемпературно чувствительных липосом (LTSLs) с использованием ступенчатой елочки micromixer (SHM). Формулировка LTSL10 позволяет высвобождение доксорубицина с температурой в течение 5 минут при клинически достижимой гипертермической температур?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Рака предстательной железы Великобритании (CDF-12-002 стипендий), и инженерных и физических наук научно-исследовательский совет (EPSRC) (EP/M008657/1) для финансирования.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
Ссылки
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены