Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изображение руководствоваться Transapical Mitral Valve Листовка Прокол Модель контролируемого объема перегрузки от Mitral Regurgitation в Крыса
В этой статье
Резюме
Сообщается о модели грызунов, которая перегружает объем левого сердца от митральной регургитации. Митральная регургитация контролируемой тяжести индуцируется путем продвижения иглы определенных размеров в переднюю листовку митрального клапана, в бьющемся сердце, с ультразвуковым руководством.
Аннотация
Митральная регургитация (Mr) является широко распространенным поражения сердечного клапана, который вызывает ремоделирования сердца и приводит к застойной сердечной недостаточности. Хотя риски неисправленного МР и его плохой прогноз известны, продольные изменения в сердечной функции, структуре и реконструкции не полностью поняты. Этот разрыв знаний ограничил наше понимание оптимального времени для коррекции Mr, и выгоды, что ранняя по сравнению с поздней коррекции MR может иметь на левом желудочке. Для изучения молекулярных механизмов, лежащих в основе ремоделирования левого желудочка в настройках MR, необходимы модели животных. Традиционно, аорто-кавалерийская свищ модель была использована для индуцирования объем перегрузки, которая отличается от клинически значимых поражений, таких как MR. MR представляет собой низкое давление объем перегрузки гемодинамический стрессор, который требует животных моделей, которые имитируют это условие. При этом мы описываем модель грызунов тяжелой МР, в которой передняя листовка крысиного митрального клапана перфорирована иглой 23G, в бьющееся сердце, с эхокардиографическим руководством изображения. Тяжесть Mr оценивается и подтверждается эхокардиографией, и воспроизводимость модели сообщается.
Введение
Митральная регургитация (Mr) является общим поражения клапана сердца, диагностируется в 1,7% населения США в целом и в 9% пожилого населения старше 65 лет1. При этом поражении клапана сердца, неправильное закрытие листовок митрального клапана в систоле, вызывает срыгивание крови из левого желудочка в левое предсердие. MR может произойти из-за различных этиологий; однако, первичные поражения митрального клапана (первичного Mr) диагностируются и лечатся чаще по сравнению со вторичным MR2. Изолированные первичные МР часто является результатом миксоматасной дегенерации митрального клапана, что приводит к удлинению листовок или аккордов, или разрыв некоторых аккордов, все из которых способствуют потере систолического коапации клапана.
MR в результате таких поражений клапана повышает объем крови заполнения левого желудочка в каждом сердцебиении, увеличивая конец диастолического напряжения стены и обеспечивая гемодинамический стрессор, который провоцирует сердечную адаптацию и ремоделирования. Сердечная реконструкция в этом поражении часто характеризуется значительным увеличением камеры3,,4, мягкой гипертрофией стены, с сохраненной сократительной функцией в течение длительных периодов времени. Так как фракция выброса часто сохраняется, коррекция МР с использованием хирургических или транскатетерных средств часто задерживается, до появления таких симптомов, как одышка, сердечная недостаточность и аритмии. Однако неисправленный МР связан с высоким риском сердечных побочных явлений, хотя в настоящее время знания об ультраструктурных изменениях, лежащих в основе этих событий, неизвестны.
Модели животных MR обеспечивают ценную модель для исследования таких ультраструктурных изменений в сердце, а также изучения продольной прогрессии заболевания. Ранее исследователи индуцированных Mr у крупных животных, включая свиней, собак и овец, путем создания внешнего желудочка-предсердий шунт5, интракардиальный разрыв хорда6, или листовка перфорации7. Хотя хирургические методы легче у крупных животных, эти исследования были ограничены суб-хронического наблюдения в небольшой размер выборки, из-за высокой стоимости выполнения таких исследований у крупных животных. Кроме того, молекулярный анализ тканей этих моделей часто является сложным из-за ограниченных видов конкретных антител и аннотированных библиотек генома для выравнивания.
Малые животные модели MR может обеспечить подходящую альтернативу для изучения этого поражения клапана и его влияние на ремоделирование сердца. Исторически использовалась крысиная модель аорто-кавалерийской свищи (АКФ) перегрузки сердечного объема. Впервые описанный в 1973 году Stumpe et al.8, астерио-венозная свищ хирургически создана, чтобы обойти артериальную кровь высокого давления из нисходящей аорты в низкое давление нижней полы вены. Высокая скорость потока в свищей вызывает резкое увеличение объема перегрузки по обе стороны сердца, вызывая значительную гипертрофию правого и левого желудочков и дисфункции, происходящие в течение нескольких дней после создания ACF9. Несмотря на свой успех, ACF не имитирует гемодинамику MR, низкое давление объем перегрузки, которая повышает преднагрузка, но и уменьшает послегруз. Из-за таких ограничений модели ACF мы стремились разработать и охарактеризовать модель MR, которая лучше имитирует перегрузку объемов низкого давления.
При этом, мы описываем протокол для модели митрального клапана прокол алистки для создания тяжелых MR у крыс10,11. Подкожная игла была введена в сердце бьющегося крысы, и продвинулась в переднюю листовку митрального клапана под эхокардиографическим руководством в режиме реального времени. Техника является весьма воспроизводимым и относительно хорошая модель, которая имитирует МР, как видно у пациентов. Тяжесть МР контролируется размером иглы, используемой для перфорации митральной листовки, и тяжесть МР может быть оценена с помощью трансэзофагеальной эхокардиографии (TEE).
протокол
Процедуры были утверждены Программой по уходу и использованию животных в Университете Эмори под протокольным номером EM63Rr, дата утверждения 06/06/2017.
1. Предоперационная подготовка
- Пар стерилизовать хирургические инструменты до процедуры.
- В день процедуры перенесите крыс из жилья в хирургию и взвесьте их.
- Нарисуйте предоперационные и послеоперационные препараты в зависимости от веса: две дозы карпрофена (2,5 мг/кг каждая), одна доза гентамицина (6 мг/кг) и одна доза бупренорфина (0,02 мг/кг).
- Обеспечить достаточный объем изофруран в смесителе газа, и кислорода в баках доступны для операции. Один полный бак кислорода (24фута 3) часто адекватный.
2. Подготовка животных
ПРИМЕЧАНИЕ: Взрослые Sprague-Dawley самцы крыс весом 350-400 г были использованы в этом исследовании. Хирургические методы поддаются немного меньше или больше животных, если по желает.
- Успокойте крысу в индукционной камере с 5% изолюраном, смешанным в 1 LPM (литр в минуту) 100% кислорода. Определите адекватный уровень седативных средств от более медленного дыхания при визуальном наблюдении, и потеря дергаться при щипать ногой крысы.
- Интубировать крысу 16 G ангиокат, установленные для использования в качестве эндотрахея.
- Визуализируйте трахею и голосовые связки с помощью отоскопа и используйте аппликатор кончика хлопка для очистки выделений на фаринге.
- Введите эндотрахеальной трубки на 0,034-дюймовый направляющий провод, в голосовые связки. После того, как трубка надлежащим образом помещены в трахею, нажмите трубку внутрь и снять провод(Рисунок1).
- Поместите крысу на нагретую хирургическую площадку при 37 градусах Цельсия и соедините эндотрахеюлическую трубку с механическим вентилятором. Ввешайте вес крысы в программное обеспечение для управления вентилятором, которое вычисляет скорость вентиляции и приливный объем. 66 вдохов в минуту с приливным объемом 1 мл/100 г массы тела были использованы в этом исследовании(рисунок 1D).
- Используйте 100% кислорода (1 LPM) в смеси с 2-2,5% изофруран в качестве ингаляционной анестезии и подтвердить уровень анестезии с потерей тончелюсти и потерей реакции на щепотку ног.
- Обратите внимание, что при правильном интубировании движение грудной клетки должно синхронизироваться с вентилятором.
- При неправильном интубировании движение грудной клетки не синхронизируется с аппаратом искусственной вентиляции легких. Для проверки на неправильную интубацию сжимают брюшную полость крысы, что создает давление на аппарате искусственной вентиляции легких, создавая тревогу сверхдавления. В этом случае, отказаться от ангиокат мягко, и вернуть крысу в индукционную камеру с 5% изофлуран в течение нескольких минут, чтобы обеспечить крысы достаточно анестезированных и повторно интубировать крысу.
- После правильноинтубированной, закрепите эндотрахеальную трубку, зашив проксимальный конец трубки на щеку крысы с 4-0 шелковым швом, чтобы избежать экстубации во время процедуры.
- Вставьте ректальный зонд температуры для мониторинга температуры тела, и четыре терминала электрокардиограммы для мониторинга ЭКГ в течение всей процедуры.
- Используйте накладную лампу отопления, если тепло от хирургической платформы недостаточно. Выключите лампу, если температура тела поднимается выше 37 градусов по Цельсию.
- Визуально оценить электрокардиограмму для любых аритмий или признаков ишемии миокарда. Если их нет, запишите базовую электрокардиограмму.
- Выполните трансторакальной эхокардиографии (TTE) для исходной сердечной функции(рисунок 2A).
- Поверните крысу на положение на спине и побрить левую сторону грудной клетки. Чтобы получить четкие виды эхо, удалить волосы с помощью крема для депиляции.
- Используйте любую ультразвуковую систему с адекватной частотой для визуализации высокого частоты сердечных приступов. В этом исследовании мы использовали visualsonics 2100 системы с 21 МГц зонд, который подходит для сердечной визуализации у крыс.
- Получение B-режим изображения в парастеральной длинной оси плоскости, чтобы вычислить объемы левого желудочка. В той же плоскости, получить M-режим изображения для измерения размеров стены.
- Поверните зонд на 90 градусов, и получить B-режим и М-режим парастернальной короткой оси мнения на середине папиллярного уровня для измерения поперечного участка размеров стены.
- Выполните трансэзофагеальную эхокардиографию (TEE) для исходной визуализации(рисунок 2B).
- Поместите крысу в нужное положение decubitus и вставьте 8 Fr интракардиальный ультразвуковой зонд (8 МГц) в пищевод крысы с небольшим количеством геля применяется к кончику. Частота ICE (интракардиальная эхокардиография) зонда достаточна для получения 4-6 кадров на сердцебиение, которые являются достаточными для визуализации движения клапана.
ПРИМЕЧАНИЕ: GE Vivid I или Siemens SC2000 премьер система может быть использована для ice изображений. - Получить высокий вид пищевода для получения двухкамерного зрения левой стороны сердца. Этот вид идеально подходит для визуализации левого предсердия, митрального клапана и левого желудочка. Позиция зонда так, что передние и задние листовки визуализированы и coaptation является центральным. Этот угол также позволяет доплеровских измерений по всему митрального клапана, без коррекции угла.
- Измерение оставило область предсердий и размеры аннулуса митрального клапана в этом представлении.
- Выполните цветное изображение Doppler для подтверждения компетентности клапана и отсутствия MR на базовом уровне. Выполните импульсную волну и непрерывную волну доплеровской визуализации для количественной оценки притока митрал и подтверждения отсутствия регургитантного потока.
- Выполните B-режим и импульсную волну доплеровской визуализации аорты для измерения диаметра корня аорты и расчета аортического потока.
- Выполните импульсную волну доплеровской визуализации легочной вены для измерения легочного венозного потока.
- Поместите крысу в нужное положение decubitus и вставьте 8 Fr интракардиальный ультразвуковой зонд (8 МГц) в пищевод крысы с небольшим количеством геля применяется к кончику. Частота ICE (интракардиальная эхокардиография) зонда достаточна для получения 4-6 кадров на сердцебиение, которые являются достаточными для визуализации движения клапана.
- Вводят разовую дозу карпрофена (2,5 мг/кг, СЗ, нестероидные противовоспалительные), гентамицина (6 мг/кг, СЗ, антибиотик) и стерильного солей (1 мл, СЗ), чтобы упреждающе компенсировать кровопотерю во время процедуры.
- Бритье левой стороне грудной клетки по мере необходимости, чтобы удалить все оставшиеся волосы из хирургического поля. Бритье от области нижней части шеи к ксифоиду, и от левой руки до середины стерны должно быть достаточно, чтобы обеспечить поле, которое лишено волос и уменьшить риск хирургического загрязнения сайта.
- Скраб хирургической области с марлей, пропитанной бетадин, а затем марли, пропитанной 70% этанола. Скраб области круговыми движениями на коже, так что марля не контактирует ранее очищенной области.
- Повторите этот шаг три раза, чтобы достичь адекватно стерильной области для хирургии.
- Заденьте животное стерильными крышками, открыв окно для доступа к стерильной хирургической области.
3. Левая торакотомия
- Выполните всю хирургическую процедуру с использованием асептических методов, с изофруран поддерживается на 2-2,5% в 1 LPM кислорода. Поместите все инструменты в стерильный лоток, и поместите обратно в лоток после каждого использования.
- Носите стерильные перчатки, маску и хирургическую шапку хирурга для всей процедуры. Стерильное хирургическое платье можно носить, но это необязательно, если загрязнение не ожидается.
- Используйте хирургический скальпель с лезвием No #15, чтобы сделать разрез кожи на левой стороне грудной клетки, примерно 1 см проксимальной к ксифоиду. Используйте тупые рассекающие наконечник ножницы, чтобы отделить слой кожи от мышечного слоя и сделать продольное разрез.
- Вскрыть мышечные слои таким же образом, пока ребра подвергаются.
- Тщательно сделайте 2-3 см продольной разрез в пятом межреберном пространстве, адекватно вставьте вставителей и разоблачите сердце.
- Используйте тонкие наконечником щипцы, чтобы поднять перикарда, и микро ножницы, чтобы акциз его в регионе, окружающем вершину сердца. Этот шаг помогает избежать послеоперационных приспастей сердца к стенкам грудной клетки и диафрагме.
ПРИМЕЧАНИЕ: Избегайте хирургических разрезов близко к грудине, чтобы свести к минимуму кровотечение. Трансектирование внутренних молочных артерий, которые проходят вдоль грудины, может вызвать чрезмерное кровотечение. Если столкнулись с таким кровотечением, определить кровотечение и прижречь его.
4. Эхо руководствоваться процедурой MR (Рисунок 3 и Рисунок 4)
- Используйте 6-0 prolene шов и держатель микроиглы, чтобы поместить портмоне строки шов на вершине левого желудочка. При необходимости используйте микрощипни для стабилизации сердца.
- Аккуратно привязывать апикальный шов, чтобы стабилизировать вершину и вставить 23 G иглу (покраснение с солевым раствором, и с стоп-коном на его дистальный конец) в центре портмоне строки шов, в левую желудочковую полость.
- Используйте одну руку, чтобы запоздало держать и направлять иглу, а другой рукой, чтобы одновременно манипулировать трансэзофагеальным эхо-зондом для достижения оптимального отголоска для визуализации иглы, как описано выше.
- С помощью ультразвукового руководства в режиме реального времени, заранее иглы к желудочковой стороне передней митральной листовки. После того, как положение иглы подтверждается на УЗИ, заранее иглы в одном тонком движении через клапан листовки. Если сопротивление ощущается, скрутите иглу, как она выдвинута в листовку, чтобы перфорировать его.
ПРИМЕЧАНИЕ: Продвижение иглы слишком далеко в левое предсердие может привести к левой перфорации предсердий, вызывая чрезмерное кровотечение и смерть животных. Игла должна быть визуализирована на УЗИ в любое время. - Включите иглу в левую желудочковую камеру, вдали от митрального клапана, и подтвердите МР, включив цветную визуализацию Доплера.
- Если MR не видно на цветной доплеровской визуализации, повторите шаги 4.4 и 4.5. Отрегулируйте эхо-зонд, если это необходимо для получения лучшего вида. После практики в нескольких крыс, можно вызвать прокол листовки в одном движении иглы, вызывая отверстие, которое размером с внешний диаметр иглы. Это было подтверждено после некропсии крысиных сердец.
- Как только MR подтверждается, убирать иглу из левой желудочковой полости и аккуратно связать кошелек строки шов.
- Используйте стерильную марлю, чтобы замочить любую кровь на вершине и в грудной полости.
ПРИМЕЧАНИЕ: Прикосновение к эхо-зонду хирургическим перчатками может привести к загрязнению стерильной среды. Спрей перчатки с 70% этанола или заменить перчатки с новыми, надлежащим образом.
5. Восстановление животных и послеоперационный уход
- После 5-10 минут стабильной сердечной функции (нормальной ЭКГ и частоты сердечных сокращений), закрыть торакотомию слоями с 4-0 vicryl, при одновременном снижении изофлуран в шагах.
- Используйте прерванный шов, чтобы приблизить ребра, с изофлуран поддерживается на 2%. Вставьте грудную трубку в шестое межреберное пространство и закрепите ее стерильных штор, чтобы избежать непреднамеренного продвижения трубки в грудную полость.
- Используйте непрерывный шов, чтобы закрыть мышечный слой с изофруран поддерживается на 1,5%.
- Используйте непрерывный шов, чтобы закрыть слой кожи с изолюраном поддерживается на 1%.
- Соедините 10 мл клапана Luer-lock наконечником шприц на грудную трубку и слейте 10-12 мл воздуха из грудной полости, а затем удалите грудную трубку.
- Администрирование окончательной дозы карпрофена (2,5 мг/кг, СЗ) и выключите изофлюран.
- Продолжить механическую вентиляцию во время отлучиться от крыс от анестезии, мониторинг жизненно важных признаков (SpO2 и частота сердечных приступов). В начале спонтанного дыхания, выключите вентиляцию, чтобы проверить способность крысы поддерживать такое дыхание и хороший SpO2.
- Если уровни SpO2 начинают опуститься ниже 90%, включите вентилятор. После того, как крыса в состоянии поддерживать уровни SpO2 без вентиляции, якорь шов на эндотрахеальную трубку вырезать, и животное подготовлено для экстубации.
- После того, как крыса показывает признаки бдительности, включая усы или движения глаз, extubate животное.
- Поместите носовой конус со 100% кислородом, пока крыса не будет амбулаторной.
- Передача крысы в чистую клетку с минимальными постельными принадлежностями и продолжать следить за жизненно важными знаками с помощью портативного монитора SpO2, размещенного на ноге или хвосте крысы, пока крыса не будет амбулаторной.
ПРИМЕЧАНИЕ: Если побочные эффекты от операции наблюдаются, животные могут иметь больше времени восстановления и может занять больше времени, чтобы провести высокий уровень SpO2. Если это происходит, носовой конус со 100% кислородом может быть применен до тех пор, пока уровни SpO2 не будут стабильными. - Чтобы снизить риск получения травмы в хирургическом участке и избежать риска заражения, однодомные домашние крысы после операции.
- Администрирование Бупренорфин в течение 3 ч после того, как крыса проснулась и достаточно амбулаторно. Бупренорфин может вызвать дыхательный дистресс при введении в начале периода периоперационного восстановления, таким образом, задержать его, пока крыса дышит без затруднения.
- После операции все животные получают следующие лекарства: гентамицин (6 мг/кг, СЗ, СИД POD 1-3) и римадил (5 мг/кг, СЗ, СИД POD 1-3). Все животные наблюдаются один раз в день в течение пяти дней после операции для обследования участков разреза, и один раз в день в течение первых двух недель после операции для оценки боли.
6. Проверка тяжести МР с эхокардиографией(рисунок 5)
- Повторите TEE через две недели после операции, используя те же шаги, указанные в разделе 2.7. Две недели после операции – это достаточное время для стабилизации гемодинамики.
- Получить цветную визуализацию Доплера на 2-камерном обзоре с помощью трансэзофагеальной ультразвуковой визуализации, визуализации левого желудочка и левого предсердия. Измерьте площадь левого предсердия и струи MR. Рассчитайте фракцию области реактивного двигателя MR с помощью
 (1)
(1)
Тяжелая МР определяется как область реактивной двигателя MR - 30%. - Ориентируйоте область регургитантного обита путем вычисления площади 23 G иглы, используя внешний диаметр иглы. Это уравнение предполагает, что область регургитирующего прозрения равна площади иглы 23G.
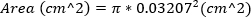 (2)
(2) - Получить непрерывную волну доплеровской визуализации с доплеровскими воротами на луме регургитанта струи. Проследите форму волны, чтобы вычислить VTI регургитантной струи. Объем MR можно оценить с помощью
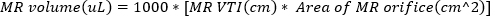 (3)
(3)
Тяжелая МР определяется как объем МР- 95 л. - Получить импульсной волны Доплеровской визуализации легочной вены путем вращения эхо зонд аперео боковой, по часовой стрелке. Измерьте систолические и диастолические скорости волн и используйте следующее уравнение для расчета соотношения.
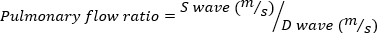 (4)
(4)
Отрицательное соотношение легочного потока указывает на серьезные MR.
7. Шам хирургии
- Выполните разделы 1-3, как описано.
- Изменение раздела 4 было изменено таким образом, что 23 G игла вставляется в левую желудочковую камеру, через портмонную строку шов на левой вершине желудочка, но не продвинулись в митральный клапан для создания MR. Вставьте иглу в левую желудочковую камеру и втягивание немедленно, после затягивания и закрытия желудочковой вершины.
- Выполните раздел 5, как описано.
- Выполните оценку митрального клапана, как описано в разделе 6. Тем не менее, MR не должно присутствовать ни в одном из животных, таким образом, количественная оценка, как описано, не является необходимым.
Результаты
Осуществимость и воспроизводимость
Предлагаемая модель MR является высоко воспроизводимым, с четко определенным отверстием в митральной листовке, достигнутой в 100% крыс, используемых в этом исследовании. На рисунке 6А изображено на?...
Обсуждение
Сообщается о воспроизводимой модели грызунов тяжелой МР с хорошей выживаемостью (93,75% выживаемости после операции) и без значительных послеоперационных осложнений. В режиме реального времени изображения с трансэзофагеальной эхокардиографии и введение иглы в бьющееся сердце, чтобы пр...
Раскрытие информации
M.P является советником компании Heart Repair Technologies (HRT), за которую он получил консультационные сборы. ЗГТ не играет никакой роли в этом исследовании и не предоставляет никаких финансовых средств для поддержки этой работы.
Благодарности
Эта работа была профинансирована грантом 19PRE34380625 и 14SDG20380081 от Американской ассоциации сердца d. Corporan и M. Padala соответственно, дарят HL135145, HL133667, и HL140325 от национальных институтов здоровья к M. Padala, и финансирование инфраструктуры от центра сердца Carlyle Fraser на стационаре университета Emory к M. Padala.
Материалы
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
Ссылки
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation?. The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены