Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка клеточного окисления с помощью подклеточного сулярного редокса-чувствительного зеленого флуоресцентного белка
В этой статье
Резюме
Этот протокол описывает оценку субклеточного отсека-специфического редокса статуса в клетке. Красный флуоресцентный зонд, чувствительный к редоксу, позволяет проводить удобный коэффициентометрический анализ в нетронутых клетках.
Аннотация
Измерение внутриклеточного окисления/снижения баланса обеспечивает обзор физиологического и/или патофизиологического редокса состояние организма. Тиолы особенно важны для освещения состояния редокса клеток через их снижение дитиола и окислимых коэффициентов дисульфида. Инженерные цистеин-содержащие флуоресцентные белки открывают новую эру для редокс чувствительных биосенсоров. Один из них, редокс чувствительных зеленый флуоресцентный белок (roGFP), может быть легко введен в клетки с аденовирусной трансдукции, что позволяет редокс статус субклеточных отсеков, которые будут оцениваться без нарушения клеточных процессов. Снижение цистеин и окислившиеся цистины roGFP имеют экзцинацию максимум на 488 нм и 405 нм, соответственно, с выбросом на 525 нм. Оценка соотношения этих уменьшенных и окислимых форм позволяет удобное расчет баланса редокса внутри клетки. В этой статье метода, увековеченные человека тройной отрицательный раковых клеток молочной железы (MDA-MB-231) были использованы для оценки состояния redox в живой клетке. Протокол шаги включают MDA-MB-231 клеточной линии трансдукции с аденовирусом, чтобы выразить цитозолик roGFP, лечение H2O2, и оценка цистеина и цистина соотношение как с потоком цитометрии и флуоресценции микроскопии.
Введение
Окислительный стресс был определен в 1985 году Гельмут Сис как "нарушение в прооксидант-антиоксидантный баланс в пользупервого" 1, и множество исследований было проведено для получения болезни, питания, и старения конкретных редокс статус организмов1,2,3. С тех пор понимание окислительного стресса стало шире. Тестирование гипотез использования антиоксидантов против болезней и/или старения показало, что окислительный стресс не только причиняет вред, но и имеет другие роли в клетках. Кроме того, ученые показали, что свободные радикалы играют важную роль для переноса сигнала2. Все эти исследования усиливают важность определения изменений в соотношении макромолекулов. Активность ферментов, антиоксиданты и/или окислители, а также продукты окисления могут быть оценены различными методами. Среди них, методы, которые определяют окисление тиола, возможно, наиболее часто используются, потому что они сообщают о балансе между антиоксидантами и прооксидантами в клетках, а также организмов4. В частности, в качестве биомаркеров для мониторинга состояния редокса организмов2используются соотношения между глутатионе (GSH)/глутатион дисульфид (ГСГ) и/или цистеином (CySS).
Методы, используемые для анализа баланса между прооксидантами и антиоксидантами, полагаются главным образом на уровни пониженных/окислимых белков или мелких молекул в клетках. Западные помарки и масс-спектрометрия используются для широкой оценки соотношения уменьшенных/окислимых макромолекул (белков, липидов и т.д.), а коэффициенты GSH/GSSG можно оценить с помощью спектрофотометрии5. Общей чертой этих методов является физическое возмущение системы клеточным лизисом и/или гомогенизацией тканей. Эти анализы также становятся сложными, когда необходимо измерить состояние окисления различных клеточных отсеков. Все эти возмущения вызывают артефакты в среде анализа.
Редокс чувствительных флуоресцентных белков открыл выгодную эру для оценки баланса redox, не вызывая нарушения в клетках6. Они могут быть нацелены на различные внутриклеточные отсеки, что позволяет количественно определить отдельные действия (например, анализ состояния редокса митохондрий и цитозола) для исследования перекрестного разговора между клеточными органеллами. желтый флуоресцентный белок (YFP), зеленый флуоресцентный белок (GFP) и белки HyPeR рассматриваются Мейером и коллегами6. Среди этих белков, редокс чувствительных GFP (roGFP) является уникальным из-за различных флуоресцентных считываний его CyS (например, 488 нм/em. 525 нм) и CySS (например, 405 нм/525 нм) остатки, что позволяет коэффициентический анализ, в отличие от других редокс чувствительных белков, таких как YFP7,8. Коэффициентометрический выход ценен тем, что уравновешивает различия между уровнями выражения, чувствительностью обнаружения и фотосъемки8. Подклеточные отсеки клеток (цитозол, митохондрии, ядра) или различных организмов (бактерий, а также клеток млекопитающих) могут быть направлены путем изменения roGFP7,9,10.
анализы roGFP проводятся с использованием методов флуоресцентной визуализации, особенно для экспериментов по визуализации в режиме реального времени. Цитометрический анализ цитометрических факторов roGFP также возможен для экспериментов с заранее определенными временными точками. Текущая статья описывает как использование флуоресцентной микроскопии и цитометрии потока для выполнения коэффициентной оценки состояния редокса в клетках млекопитающих, переэкспрессионных roGFP (направленных на цитосол) с помощью аденовирусной трансдукции.
Access restricted. Please log in or start a trial to view this content.
протокол
ПРИМЕЧАНИЕ: Этот протокол был оптимизирован для 70%-80% слияния MDA-MB-231 ячеек. Для других клеточных линий, количество клеток и множественность инфекции (MOI) должны быть reoptimized.
1. Подготовка клеток (день 1)
- Поддержание MDA-MB-231 клеточной линии в 75 см2 фляги с 10 мЛ модифицированной среды Орла Dulbecco (DMEM) дополнено 10% фетальной сыворотки крупного рогатого скота (FBS) при 37 градусов по Цельсию в 5% CO2 увлажненной атмосфере.
ПРИМЕЧАНИЕ: DMEM дополняется 10% FBS, 37 градусов по Цельсию, и 5% CO2 увлажненной атмосфере используются для всех вложения и обработки инкубаций на протяжении всего протокола. - Подготовьте клетки MDA-MB-231 к эксперименту.
- Отвлите среду в колбе, отсоедините клетки 2 мЛ 0,25% раствора трипсина-ЭДТА в течение 2 мин, и инактивировать активность трипсина с 6 мЛ полной среды (DMEM с 10% FBS). Центрифуга клетки на 150 х г в течение 5 мин. Аспирировать супернатант и приостановить клетки в 5 мл полной среды.
- Смешайте равный объем суспензии ячейки и 0,4% трипан синий. Возьмите 10 мл этой смеси и подсчитайте клетки с автоматизированным счетчиком ячейки.
ПРИМЕЧАНИЕ: Счетчик Coulter или гемостометр также может быть использован для подсчета клеток. - Семя клетки в 6 хорошо пластины для анализа цитометрии потока и семян 150000 клеток в 1 мл среднего на хорошо. Подождите 16 ч для вложения ячейки.
- Семя клетки в 4 хорошо камеры слайд для флуоресцентной визуализации и семян 25000 клеток в 0,5 мл среднего на хорошо. Подождите 16 ч для вложения ячейки.
ПРИМЕЧАНИЕ: Скважины контроля семян в дополнение к очистным колодцам. Используйте один из контрольных скважин для определения числа клеток (необязательно: если период крепления клеток короче, чем время удвоения, число клеток можно считать таким же, как плотность посева), а другое для неинфицированного контроля (0 MOI).
2. Аденовирусная трансдукции ROGFP (день 2 и 3)
ВНИМАНИЕ: Аденовирусы могут вызывать заболевания. При перепрофилировании клеток используйте фильтрованные наконечники и обеззараживают наконечники, пастерные пипетки и микроцентрифуги с 10% отбеливателем.
ПРИМЕЧАНИЕ: Этот протокол был продемонстрирован с цитосол-специфических roGFP, но другие клеточные отсеки (например, митохондрии или митохондриального межмембранное пространство) могут быть направлены с этим же протоколом.
- Создание кривой дозы-ответа для МВД для получения наивысшей эффективности трансдукции путем расчета объема аденовируса (мЛ), необходимого для каждого значения МВД для клеточной линии MDA-MB-231(Таблица 1):
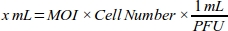
ПРИМЕЧАНИЕ: Функциональный титр каждой партии аденовирусных запасов, который выражается как единица формирования бляшек (PFU) на мЛ, предоставляется компанией. Оптимальный МВД для трансдукции отличается между типами клеток. Для большинства клеток млекопитающих оптимальный диапазон МВД составляет от 10 до 300. Согласно клеточному ответу, значения МВД должны быть пересчитаны (например, диапазон МВД должен быть уменьшен, если клетки имеют цитотоксическую реакцию, или диапазон должен быть увеличен, если клетки имеют низкую эффективность трансдукции). - Сделать 1:100 разбавления 6 х 1010 PFU/ mL аденовирал роГФП раствор с клеточной культуры среды (DMEM с 10% FBS) для надежного pipetting.
- Пипет и добавить 0,0125 мл (12,5 мл), 0,025 мл (25 мл), 0,05 мл (50 мл) аденовирального редогея в каждую скважину из 6-й пластины скважины для того, чтобы провести 150 000 клеток с 50, 100 и 200 МВД соответственно для анализа цитометрии потока(Таблица 1).
- Pipette и добавить 0,0042 мл (4,2 л) аденовирусного редуляции roGFP в 4-камерных слайд скважин для проток 25000 клеток с 100 MOI для флуоресценции изображений (Таблица 1).
ПРИМЕЧАНИЕ: Минимальное количество среды должно быть использовано в скважинах для обеспечения наивысшего взаимодействия между аденовирусной конструкцией roGFP и ячейками. Содержание сыворотки в среде культуры, возможно, потребуется сократить для различных клеточных линий, потому что высокий уровень сыворотки может негативно повлиять на эффективность трансдукции в некоторых типах клеток. - Инкубировать клетки на 16-24 ч в условиях содержания клеток. На следующий день (день 3), изменить среды к клетке культуры (DMEM с 10% FBS), чтобы позволить восстановление клеток для дополнительных 24 ч. Визуалируйте клетки под микроскопом для оценки их морфологии; клетки могут выражать roGFP, даже если у них есть морфологические изменения.
ПРИМЕЧАНИЕ: В третий день ячейки должны начать выражать roGFP; поэтому эффективность трансдукции можно контролировать с помощью флуоресценции микроскопии (фильтры с ex. 488/em. 525). Чтобы получить последовательные результаты анализа, быть в курсе и документировать морфологические изменения под фазовой контрастной микроскоп и наблюдать морфологию при оценке эффективности трансдукции. - Построить кривую реакции дозы с помощью 50, 100 и 200 образцов МВД, подготовленных в шаге 2.3, и результатов их эффективности трансдукции, полученных в результате анализа цитометрии потока (шаги 3.1 и 4.1). Оцените оптимальную эффективность трансдукции с помощью документации морфологических изменений (шаг 2.5) и кривой дозы-реакции МВД.
ПРИМЕЧАНИЕ: Хотя более 98% популяции клеток в 100 МВД и 200 МВД экспресс roGFP (см. репрезентативные результаты), 200 ГРУППА МВД показали существенные изменения в морфологии клеток MDA-MB-231. Следовательно, наиболее эффективным МВД для MDA-MB-231 клетки было установлено, 100 МВД. - После оптимального МВД (здесь было выбрано 100 МВД) для линии Клеток MDA-MB-231, проведение эксперимента с испытательными материалами (10 м H2O2 и ее транспортным средством 0,1% деионированной водой).
- Подготовка и семя клетки в соответствии с разделом 1. Используя аденовирусный объем трансдукции для 100 МВД, рассчитанный в шаге 2.1, повторите шаги 2.2-2.4 для 100 аденовирусных трансдукции клеток МВД. Затем инкубировать пластины и камерные слайды в соответствии с шагом 2.5.
3. Приобретение баланса CyS/CySS
- Цитометрия потока (день 4)
- На 4-й день инкубируют клетки от шага 2.7.1 с 10 мл H2O2 на 1 ч.
ПРИМЕЧАНИЕ: в качестве испытательного вещества было использовано 10 м H2O2, а в качестве лечения в этом протоколе использовалась деионизированная вода 0,1%. Другие окислительных агентов могут быть использованы в качестве положительного контроля здесь. - Aspirate средств от 6 пластины скважины, заменить 750 мл 0,25% трипсин-EDTA решение и ждать 2 мин для клеток, чтобы отделить. Инактивировать трипсин с 2 мл полной среды (DMEM с 10% FBS) и собрать объем в 15 мЛ конические трубки.
- Центрифуга труб при 150 х г в течение 5 мин при 4oC. Откажитесь от супернатанта и приостановите клетки в 500 мл фосфатско-буферизированного солевого раствора (PBS).
- Повторите шаг 3.1.3
- Фильтруй клеточное суспензию в трубы, совместимые с цитометрией, с помощью 40-метровой сетки. Держите трубки на льду и вдали от света и следуйте шагу 4.1 для анализа данных.
- На 4-й день инкубируют клетки от шага 2.7.1 с 10 мл H2O2 на 1 ч.
- Микроскопическая визуализация (день 4)
- На 4-й день лечите клетки с 10 МЛ H2O2,сразу же приобретайте изображения (точка времени 0) и 1 ч после лечения и следуйте шагу 4.2 для анализа данных.
4. Анализ данных
- Количественная количественная оценка цитометрии потока
- Метод цитометрии потока потока для 3 различных анализов с помощью программного обеспечения для приобретения образцов (см. Таблица материалов): передний рассеяние(FCS) на x-оси и боковом рассеянии (SSC) на оси y-оси для оценки размера клеток и сложности клеток (SSC может быть использован для грубой идентификации мертвых и живых клеток); ex. 488 нм/эм. 525 нм (фторсцеин изотиоцианат (FITC) фильтр на оси х и SSC на оси y-оси для оценки CyS-roGFP; ex. 405 нм/эм. 525 нм (Brilliant Violet 510 (BV510) фильтр полос на оси х и SSC на оси y-оси для оценки CySS-roGFP.
- Приобретите 0 элементов управления МВД и визуализируйте ячейки с помощью программного обеспечения для приобретения образцов. Повторите этот шаг для оставшихся образцов (50, 100, 200 групп МВД, а затем 10 м H2O2 обработанных клеток и обработанных транспортных средств клеток). Сохраните файлы для анализа данных.
- Программное обеспечение для анализа открытых данных (см. Таблицу Материалов)и открыть 0 примеров MOI файла. Оцените групповую популяцию, интересующую (Ворота 1). Настройка следующих gatings, чтобы свести к минимуму фоновую флуоресценцию для ex. 488 nm/em. 525 нм (ворота 2) и экс. 405 нм/эм. 525 нм (ворота 3) фильтры полос с неинфицированными (0 MOI) контрольными клетками.
- Откройте 50, 100 и 200 файлов образцов МВД в рамках программного обеспечения для анализа данных для оценки кривой дозы-ответа. Анализ среднего интенсивности флуоресценции с гейтсом 2 и 3 для каждого образца. Повторите этот шаг для тестовых образцов (10 м H2O2 обработанных клеток и обработанных автомобилями клеток).
- Рассчитайте среднее соотношение флуоресцентной интенсивности между окислимыми и уменьшенными формами roGFP со следующим уравнением.

- Оценка изображения
- Используйте микроскоп, содержащий флуоресценции фильтры для CyS-roGFP и CySS-roGFP (например, 488 нм/em. 525 нм и ex. 405 нм/em. 525 нм фильтров, соответственно).
- В каждом колодце камерного слайда выберите 4 случайных области для получения изображений, используя 4x цель визуализировать большие области.
ПРИМЕЧАНИЕ: 20x цель также может быть использована для отображений изображений. - Откройте изображение с помощью программного обеспечения ImageJ11. Применить Анализ (ru) Измерьте команды для каждого изображения и используйте уравнение в шаге 4.1.5 для количественной оценки данных.
ПРИМЕЧАНИЕ: Количественная оценка изображений является коэффициентом; поэтому протокол не включает вычитание фона. Однако, чтобы иметь возможность сравнить изображения, яркость, контрастность и насыщенность должны быть одинаковыми для каждого изображения. Статистическая значимость была оценена с помощью одностороннего анализа дисперсии (ANOVA) и постспеяного теста Туки.
Access restricted. Please log in or start a trial to view this content.
Результаты
Состояние редокса CyS/CySS легко проецируется с помощью трансимированных roGFPs. Флуоресцентный зонд количественно определяет соотношение между уменьшенными и окислимыми формами (длины волн возбуждения 488 нм и 405 нм, соответственно). Данные о флуоресценции могут быть получены как с помощью ц...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Тиол/дисульфидный баланс в организме отражает состояние редокса клеток. В живых организмах есть глутатион, цистеин, белковые тиолы и низкомолекулярные тиолы, все из которых зависят от уровня окисления и повторяют редоксовый статус клеток4. Инженерные roGFPs позволяют ненару?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Конструкция и рекомбинантный аденовирус для выражения цитозолоспецифического roGFP в клетках были созданы в лаборатории Пола Т. Шумакера, PhD, Школы медицины Фрайберга, Северо-Западного университета и Vira'uest Inc., соответственно. Это исследование было поддержано Центром исследований принимающей ответ на рак терапии грант P20GM109005 через NIH Национальный институт общих медицинских наук Центры биомедицинских исследований Excellence (COBRE NIGMS), Национальный институт общих медицинских наук систем фармакологии и токсикологии Учебная программа грант T32 GM106999, Фонд UAMS/Медицинский исследовательский фонд премии AWD00053956, UAMS Год-Конец канцлера Награды AWD00053484. Ядро потока цитометрии ядро было поддержано в части Центра микробных патогенеза и принимающих воспалительных реакций грант P20GM103625 через COBRE NIGMS. Содержание является исключительно ответственностью авторов и не обязательно отражает официальную точку зрения НИЗ. ATA была поддержана Советом по научно-техническим исследованиям Турции (TUBITAK) 2214-A стипендией.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
Ссылки
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены