Method Article
Модель дрозофилы для изучения полиплоидизации, вызванной ранами
В этой статье
Резюме
Рана индуцированной полиплоидизации является консервативной стратегии восстановления тканей, где клетки растут в размерах, а не деления, чтобы компенсировать потерю клеток. Вот подробный протокол о том, как использовать плодовую муху в качестве модели для измерения ploidy и его генетической регуляции в эпителиальной раны ремонта.
Аннотация
Полиплоидия является частым явлением, воздействие которого на здоровье организма и болезни до сих пор плохо изучены. Клетка определяется как полиплоидная, если она содержит больше, чем диплоидная копия ее хромосом, что является результатом эндоресупорации или слияния клеток. В восстановлении тканей, раны индуцированной полиплоидизации (WIP) было установлено, что сохраняется стратегия исцеления от плодовых мушек позвоночных. WIP имеет ряд преимуществ перед пролиферацию клеток, в том числе устойчивость к онкогенного роста и генотоксического стресса. Задача состоит в том, чтобы определить, почему полиплоидные клетки возникают и как эти уникальные клетки функционируют. Предоставляется подробный протокол для изучения WIP у взрослых плодовых мух эпителия, где полиплоидные клетки генерируются в течение 2 дней после прокола раны. Воспользовавшись обширным набором генетических инструментов D. melanogaster, начали идентифицировать гены, необходимые для инициирования и регулирования WIP, включая Myc. Продолжение исследований с использованием этого метода может выявить, как другие генетические и физиологические переменные, включая пол, диету и возраст, регулируют и влияют на функцию WIP.
Введение
Drosophila melanogaster является привлекательной модельной системой для изучения клеточных и молекулярных механизмов эпителиального восстановления ран. Как и у млекопитающих, используемые механизмы восстановления тканей зависят как от ткани, так и от стадии ее развития. Без шрамов заживление ран происходит в эмбрионе плодовой мухи, где актомиозин "кошелек строки" образуется на эпителиальной передний край позволяетраны бесшовно закрыть 1,2. Пост-эмбриональное заживление ран у личинок, куколок и взрослых плодовых мушек приводит к внеклеточной матрице ремоделирования, образования шрамов меланина ироста эпителиальных клеток 3,,4,,5,,6. Эпителиальные клетки увеличиваются в размерах путем слияния клеток и эндоцикла, неполного клеточного цикла, который обходитмитоз 3,,4,,7,,8. В результате, потеря клеток компенсируется ростом полиплоидных клеток, а не делением клеток. Взрослый летать hindgut, midgut, и фолликулярного эпителия также полагаться на рост полиплоидных клеток, чтобы компенсировать потерюклеток после повреждения тканей 9,10,11.
Полиплоидия является хорошо известным аспектом развития организма у растений и насекомых, но в последние несколько лет стало более очевидным, что полиплоидия является консервативной стратегии восстановления тканей у позвоночных12. Зебрафиш, который имеет возможность регенерировать свое сердце, опирается на рост полиплоидных клеток, чтобы исцелить поврежденный эпикардий13. Полиплоидия также способствует регенерации печени млекопитающих и ремонту эпителия труб почек после остройтравмы 14,,15. В этих примерах полиплоидные клетки генерируются путем эндолептизации через эндоцикл или эндомитоз, что приводит к бинуклеированной клетке из-за блока в цитокинезе12. Загадка заключается в том, почему полиплоидные клетки возникают во время ремонта ран и как полиплоидия влияет на функцию тканей. Недавние исследования дают новое представление о том, является ли полиплоидия преимуществом исцеления или недостатком. В эпикардии зебры, полиплоидия повышает скорость заживления ран13. В D. melanogaster hindgut и печени млекопитающих, полиплоидия была обнаружена защитной от онкогенногороста 11,14. У взрослой мухи эпителия недавно было обнаружено, что полиплоидия позволяет восстановить раны при наличии генотоксического стресса16. Эндорепликация устойчива к повреждению ДНК, что позволяет заживление ран, когда пролиферация клеток в противном случае была быскомпрометирована 17. Для кардиомиоцитов в сердцах мышей и зебры, однако, полиплоидия замедляет заживление, в результате чегоусиливается образование рубцов 18,19. Поэтому, в зависимости от типа органа и/или клеток, полиплоидия может быть выгодной или вредной стратегией восстановления тканей. Доступность D. melanogaster генетики в сочетании с анализом раны индуцированной полиплоидизации (WIP) ответ сделать его идеальной моделью системы для выяснения молекулярных и клеточных механизмов, которые направляют эту стратегию заживления ран.
Здесь мы представляем протокол для анализа WIP во взрослом эпителии D. melanogaster. Включены инструкции по травме плодовой мухи, вскрытию, иммуностимулированию, монтажу, визуализации и анализу повторной эпителиализации, клеточного синтеза и эндорепликации (плоидии). Анализ изображений и плоиди также может быть адаптирован к другим моделям для проверки того, происходит ли WIP. Следует отметить, что при увеличении содержания ядерной ДНК часто происходит соответствующее увеличение ядерных размеров. Тем не менее, Есть много примеров в биологии, где ядерный размер не отражает соответствующие изменения в ploidy20. Еще большую осторожность следует проявлять при интерпретации ядерных размеров в контексте раны окружающей среды, где клетки часто распространяются или растягиваются, чтобы покрыть место раны. Таким образом, единственным окончательным доказательством изменения плоиди является измерение содержания ДНК с помощью этого метода (или других, таких как секвенирование всего генома)21. Этот метод повышает пригодность взрослого эпителия брюшной полости D. melanogaster в качестве модели для изучения роли и регуляции полиплоидии в ремонте ран.
протокол
1. Постановка и ранение взрослых плодовых мушек
- Выберите D. melanogaster штамм выбора (т.е. эпи-Gal4 / UAS штамм, см. Таблицу материалов).
ПРИМЕЧАНИЕ: Здесь система Gal4/UAS используется для обеспечения эпителиальной экспрессии генов (epi-Gal4) гена или РНК, закодированных ниже по течению от БАС. В этом исследовании используются флуоресцентный мембранный белок (UAS-Cd8.mRFP), митотический индуктор (UAS-fzrRNAi, UAS-stg) и ингибитор WIP (UAS-E2F1RNAi; UAS-RacDN). - Соберите два флакона по 10-15 недавно заключенных самок плодовых мушек каждый и возраст на свежих флаконах пищи при 25 градусов по Цельсию до 3-5 дней. Один флакон будет служить в качестве невредимого контроля, а другой флакон будет ранен, как описано ниже. Самки мух следует поддерживать у самцов (5 евро/флакон).
- Чтобы ранить мух, собрать несколько держателей булавки каждый с одной 0,10 мм нержавеющей стали булавку. Убедитесь, что острый конец булавки выходит. Пины могут легко согнуть или чип после прокола мухи и зацепили или поврежденные булавки должны быть отброшены.
- Обезботь выдержанных самок плодовыхмушекна CO 2-летной площадке под стереомикроскопом и выровнять их в ряд с помощью кисти. Ношение защитных очков, держа держатель булавки в одной руке и типсы в другой, использовать миппы, чтобы располагать муху с брюшной полости лицом вверх.
- Прокол взрослой самки мух в эпителиальной области плеурита тергита A4 по обе стороны от брюшной кормы средней линии(рисунок 1A). Прокол этой брюшной области обеспечивает оптимальное пространство вдали от мест вскрытия, где края ткани будут разорваны механической обработкой.
- Возвращение раненых мух к пищевому флакону и возраст до желаемой дневной травмы после травмы (dpi). Эпителиальное заживление ран начинается с 1 dpi и заканчивается на 3 dpi. Эндорепликация достигает 2 dpi, что идеально подходит для анализа EdU (раздел 4, рисунок 2).
2. Fly брюшного вскрытия
ПРИМЕЧАНИЕ: Во время этого шага, важно, чтобы избежать прикосновения брюшной брюшной ткани с инструментами вскрытия, потому что это поставит под угрозу целостность эпителия.
- Получить все необходимые материалы для вскрытия: раствор Грейс, типсы, Весенние ножницы Vanna, 0,10 мм булавки, рассечение пластин, 9 хорошо стеклянное рассечение блюдо, фиксативный раствор (4% параформальдегид в 1x PBS), 1x PBS, салфетки, пипетки и советы для 30 мкм, и перчатки (см. Таблицу материалов).
- Подтвердите, что мухи были успешно ранены в результате анестезии раненых мух на CO2-летатьплощадку под стереомикроскопом и проверки на наличие раны шрам (т.е. меланин пятно на животе, см. Рисунок 1B). Выбросьте мух из экспериментальной группы, которые не были успешно ранены.
- Чтобы начать вскрытие, заполните один колодец из 9 хорошо стеклянное блюдо вскрытия с раствором Грейс. Используйте пару типсов, чтобы схватить раненую самку мухи на спинной стороне грудной клетки и погрузить муху в колодец, содержащий раствор Грейс.
- Используя миппы в противоположной руке, не выпуская грудную клетку, проколите спинную кутикулу ниже тергита A6 и стяните кутикулу с задней части плодовой мухи. Внутренние органы (яичники и кишечник), как правило, выходят на этом этапе. Если нет, осторожно нажмите на спинной стороне живота с типсами, чтобы выжать оставшиеся органы и выбросить в пустой колодец.
- Прикрепите полный брюшной полости на стыке грудной клетки над тергитом A2 с помощью типсов и перенесите брюшной полости в пустой колодец, содержащий 100 фунтов стерлингов раствора Грейс.
- Повторите шаги 2.3-2.5 до тех пор, пока все животы мухи не будут вскрыты.
- Уменьшите объем раствора Грейс до 30 йл в хорошо содержащем соединенные, рассеченные животы.
- Филе брюшной полости открытым, позиционирование живота на спинной стороне с типсами в одной руке, а затем вставив нижнее лезвие весенних ножниц Ванна в брюшной полости с другой стороны. Вырезать вдоль спинной средней линии, пока живот полностью открыт, который может потребовать до трех разрезов(рисунок 1C, 1D).
- Установите сухую пластину для вскрытия с четырьмя булавками 0,10 мм на область монтажа брюшной полости. Каждая 35-мм вскрытая пластина может вместить до семи монтажных площадок. Pipette 30 йл раствора Грейс на каждой монтажной области и передачи одного филе живота на каждую каплю.
- Прикрепите филе живота к блюду на четырех спинных углах(рисунок 1E). Убедитесь, что ткань лежит плоская без разрыва или перенапряжения брюшной ткани.
- Чтобы исправить ткани, пипетка от раствора Грейс и добавить 30 йл исправить решение возлагали живота.
ВНИМАНИЕ: Носите перчатки при обработке решения исправить, как параформальдегид является токсичным. - Повторите шаги 2.10-2.11 до тех пор, пока все филе брюшной полости не будут закреплены на вскрытой пластине.
- Поместите этикетку ленты на дно каждого блюда, чтобы отметить каждую контрольную и экспериментальную группу. Исправить образцы в течение 30-60 мин при комнатной температуре (RT).
- Вымойте исправить решение путем трубопроводов на 1,5 мл 1x PBS для каждой пластины. Утилизация раствора и пластмасс в соответствующих контейнерах жидких или сухих химических отходов в соответствии с институциональными руководящими принципами.
- Вымойте пластины 2x с 1,5 мл 1x PBS и хранить фиксированные ткани, покрытые 1,5 мл 1x PBS в пластиковом контейнере с крышкой. Добавьте слой влажного бумажного полотенца на дно контейнера и храните образцы при 4 градусах Цельсия до готовности к иммуностину в течение 1 недели после вскрытия.
3. Иммунофлуоресценция
- Свежеприготовленные реагенты (см. таблицуматериалов): решение буфера мытья (0.3% Triton X 100, 0.3% BSA в 1x PBS). Оставшийся буфер для мытья можно сохранить при 4 градусов по Цельсию и использовать в течение 2-дневного протокола окрашивания. Подготовка достаточно первичного раствора антител на анализ (Рисунок 2) с использованием Anti-FasIII (1:50 мыши анти-Fasciclin-III) в стиральный буфер либо анти-Grh (1:300 сродство очищенных кролика анти-Grainyhead8) или анти-RFP (1:1000 кролика анти-RFP). Первичные антитела решения могут быть сохранены при 4 градусов по Цельсию и повторно использовать несколько раз, пока сигнал значительно снижается.
- Permeabilize ткани путем трубопроводов от 1x PBS, добавив 1,5 мл мыть буфера, и инкубации, по крайней мере 30 минут на орбитальной шейкер (80 об / мин) на RT.
- Удалите буфер мытья и пятно ткани на ночь с 1,5 мл первичного раствора антитела, инкубации на орбитальном шейкере (80 об / мин) при 4 градусов по Цельсию. Соберите первичный раствор антитела и сохраните в трубке при 4 градусов по Цельсию для будущих экспериментов.
- Сначала прополощите образец быстро с 1x PBS, а затем мыть 3x с 1,5 мл буфера мытья. Для каждой стирки, инкубировать образцы на RT на орбитальном шейкере, по крайней мере 30 мин.
- Во время окончательной стирки, подготовить вторичный раствор антитела: 1:1,000 осла анти-кролик Alexa 488 или 568 и 1:1,000 коза анти-мышь Alexa 488 или 568 (или флюорофоры выбора) в буфере мытья.
- Удалить буфер мытья и пятно тканей с 1,5 мл вторичного раствора антитела. Обложка образцов с алюминиевой фольгой и инкубировать на орбитальной шейкер на RT в течение 3 ч. Кроме того, образцы могут быть инкубированы на ночь при 4 градусов по Цельсию на орбитальном шейкере.
- Вымойте образцы, сначала отбрасывая вторичный раствор антитела, а затем быстро промойте образец с помощью 1x PBS, а затем три моет с 1,5 мл буфера стирки. Для каждой стирки, инкубировать образцы на RT на орбитальном шейкере, по крайней мере 30 мин.
- Подготовьте раствор DAPI, разбавляя DAPI до 10 мкг/мл в буфере для мытья. После окончательной стирки, пятна образцов с 1,5 мл DAPI раствор инкубации на RT в течение 30 мин.
- Отбросьте раствор DAPI и промойте образцы 2x в 1,5 мл 1x PBS. Храните окрашенные ткани в 1,5 мл 1x PBS в темноте, покрытой алюминиевой фольгой, при 4 градусов по Цельсию, пока не будет готов к монтажу на стеклянной горке с крышкой. Монтажный этап должен быть выполнен в течение 1 недели.
4. Активность клеточного цикла (EdU Assay)
- Составной 10 мММ EdU фондовый раствор из Click-iT комплект (см. Таблица материалов) путем растворения порошка EdU в dH20 и смешивания в течение 15 мин до полного растворения. Решение по запасу может быть алицитировано (250 мкл на трубку) и храниться при -80 градусах Цельсия.
- Корм летит EdU, сначала разбавляя запас EdU до 5 мМ в dH2O. Добавить сухие дрожжи, пока раствор не облачно и кратко вихрь для смешивания. Отрежьте крышку трубки 0,5 мл и поместите ее на дно флакона с мухой. Нажмите крышку в пищу, так что она стабильна.
- Обезболивать мух и переводить 3-5 дневных мух во флакон. Нажмите мух на один край, чтобы никто не застрял в крышке.
- Пипетка 75 МКЛ дрожжей-EdU раствор в крышку. Мух следует кормить свежими дрожжами-EdU раствор каждый день и переносится на свежий пищевой флакон с крышкой через день, чтобы мухи не застревают в нижней части флакона.
- Для передачи мух, переверните на новый флакон с крышкой, положить мух спать, нажмите мух в одну сторону, и добавить свежие дрожжи-EdU решение.
- На третий день, ранить мух и продолжать кормить дрожжей-EdU до вскрытия на 2 dpi (Рисунок 4A). Можно посмотреть раздел протокола 2 для методов вскрытия и фиксации.
- Подготовка реагентов для окрашивания EdU: буфер для мытья (0,3% Triton X 100, 0,3% BSA в 1x PBS), буфер пермякизации (0,5% Triton X 100 в 1x PBS), блокирование буфера (3% BSA в 1x PBS), и подготовить реагенты из набора анализа EdU (см. Таблицу материалов), в том числе 1x буфер реакции и 1x реакции буферной добавки в соответствии с руководством производителя.
- Вымойте образцы на 1 ч, смешивая на RT в 1,5 мл буфера стирки.
- Добавьте 1,5 мл буфера пермялизации и инкубировать образцы в течение 20 минут.
ПРИМЕЧАНИЕ: Оттепель и подготовить реакцию коктейль решение с использованием объема 500 йл / пластины. - Вымойте образцы 1x быстро с 1x PBS, а затем 3x быстро с 1 мл блокирующего буфера.
- Pipette от всех оставшихся блокирующих буфера и добавить 500 йл реакции коктейль решение на тарелку. Вихревые пластины для обеспечения тканей полностью покрыты. Инкубировать в ящике в темноте в течение 1 ч на RT.
- Вымойте образцы 1x быстро с 1,5 мл блокирующего буфера.
- Пятно с 1,5 мл раствора DAPI при 1:5,000 в буфере для мытья в течение 30 минут.
- Вымойте 2x с 1x PBS быстро, оберните в фольгу, и хранить в темноте при 4 градусов по Цельсию, пока не готовы смонтировать образцы в течение 3 дней.
5. Гора окрашенных тканей
- Получите все необходимые материалы для монтажа: стеклянные горки, стеклянные крышки, чистый лак для ногтей, монтажные средства, пару типсов и салфетки.
- Для установки окрашенных ткани мухи, открепление брюшной полости от вскрытия пластины с помощью типсов под стереомикроскопом. Перенесите ткань на 30 мкл монтажных средств массовой информации на стеклянной крышке, аккуратно хватая ткань типсами за спинные фланги, заботясь о том, чтобы не касаться брюшной зоны типсами.
- Под стереомикроскопом ориентируется брюшная ткань так, чтобы внутренняя область обращена вниз к крышке (т.е. внешняя кутикула/щетина обращены вверх). Потяните ориентированные животы к краю капли мультимедиа с помощью типсов. Поверхностное натяжение поможет сохранить тканиплоскими (рисунок 1F).
ПРИМЕЧАНИЕ: Это полезно для изображений для организации брюшной полости в столбце или строке на данном этапе. - Наклейте этикетку на стеклянную горку (т.е. на контроль или экспериментальную) и подберите крышку, медленно приближая слайд к крышке. Переверните слайд снова и осторожно пятно с салфеткой, чтобы удалить избыток монтажа средств массовой информации.
- Печать края крышки с четким лаком для ногтей и повторить для всех оставшихся экспериментальных групп. Храните слайды в слайд-поле при 4 градусах цельсия до готовности к изображению.
6. Изображение и обработка
- Изображение области брюшной раны мухи, сначала найдя шрам меланина с конфокальным микроскопом(рисунок 1B),либо точечный сканер или структурированное освещение (ApoTome) с 40x маслом или сухой цели.
- Проверьте экспозицию на каждом канале, гарантируя, что сигнал ниже насыщения. Настройки изображения должны быть основаны на самой яркой группе образцов. Это особенно важно для анализа плоиди, так как канал DAPI должен оставаться в линейном диапазоне для точного измерения содержания ДНК.
- Сделайте полное изображение z-stack во всех трех каналах с оптимальным расстоянием не менее 0,50 мкм между ломтиками. Сохранить захваченные изображения и открыть файл в программе анализа изображений Фиджи (также известный как ImageJ).
- Для каждого изображения создайте проекцию z-stack, используя опцию «Сумма срезов» для всех каналов.
- Поверните изображения по мере необходимости, чтобы ядра выстраивались горизонтально по изображениям(рисунок 3A и рисунок 4E).
- Обрежуй все изображения прямоугольным выделением 300 мкм х 300 мкм по центру вокруг раны или центра невредимого контроля. Определите область, нарисовав прямоугольник и выбрав Редактировать Отбор Укажите. Убедитесь, что масштабированные единицы находятся в микронах, чтобы обеспечить одинаковое количество коробки используется для анализа всех изображений.
7. Эндорепликация (плоидный) анализ
- Используя Фиджи, выберите окно канала Grh и дублируйте изображение. Затем используйте пороговый инструмент для создания маски. Вручную отрегулируйте порог, сдвинув верхнюю планку, чтобы свести к минимуму фон, не вызывая резкого сокращения ядер(рисунок 4D).
- Если какие-либо ядра в канале Grh касаются на пороговом изображении, используйте инструмент кисти (ширина 2 пикселя) в том же цвете, что и фон, чтобы провести грань между ядрами. Нажмите, чтобы применить 1x, когда закончите, чтобы создать окончательную маску.
- Создайте карту области интересов (ROI) с помощью функции Analyze Particles: установить размер до 5 мкм-60 мкм, чтобы захватить большую часть ядер без включения фона.
- Вручную отрегулируйте карту рентабельности инвестиций по мере необходимости в менеджере рентабельности инвестиций. Удалите любые выделения, которые не являются ядрами, и добавьте какие-либо ядра в список, которые не были идентифицированы путем выделения ядра с помощью инструмента свободного выбора и добавления его в менеджер roi (рисунок 4D).
- Выберите канал DAPI, а затем нажмите Show All в менеджере рентабельности инвестиций, чтобы применить сгенерированную карту рентабельности инвестиций в канале Grh на канал DAPI.
- Удалите любые выделения, где контур эпителиальных ядер перекрывается непителиальными ядрами (например, ядрами из мышц или жира) с карты рентабельности инвестиций. Зернистый только пятна эпителиальных ядер, в то время как DAPI пятна всех ядер. Убедитесь, что каждый изложенный выбор содержит только одно ядро и удаляет или редактирует любые выделения с более чем одним ядром. Сохранить отредактированный список рентабельности инвестиций.
- Измерьте площадь и интегрированную плотность каждого эпителиального ядра на карте рентабельности инвестиций с помощью инструментов анализа на Фиджи. Экспорт значений в программу электронной таблицы.
- Измерьте средний фон изображения с помощью инструмента кругового отбора. Нарисуйте три круга, которые не пересекаются ни с какими ядрами в различных областях изображения DAPI. Добавьте область и интегрированную плотность каждого из кругов в программу электронной таблицы, чтобы установить яркость фонового изображения.
- Начните с расчета среднего фона на единицу области для каждого изображения путем деления каждого фонового интегрированного значения плотности на соответствующую область. Затем в среднем три интегрированные плотности на область измерений для изображения, с тем чтобы получить средний фон на единицу области.
- Затем вычислите общий фон каждого ядра DAPI, умножая область ядра на средний фон на единицу области. Нормализованная интенсивность DAPI для каждого измеренного ядра может быть рассчитана путем вычитания общего фона каждого ядра из его измеренной интегрированной плотности.
- Среднее значение всех нормализованных значений интенсивности DAPI от невредимого эпителиального контроля. Невредимые эпителиальные ядра ранее были рассчитаны на плоидное значение 2С и могут служить эталоном для расчета плоиди в эпителиальных ядрах из экспериментальныхусловий 8.
- Рассчитайте плоидию каждого ядра, разделив нормализованную интенсивность DAPI каждого ядра на нормализованное значение от ссылки невредимого эпителиального контроля (2С), затем умножьте значение на 2, чтобы равняться нормализованной плоидии (C-значение):
(Ядерная интегрированная плотность - фоновая ядерная интегрированная плотность)/Средняя ядерная интегрированная плотность (невредимые эпителиальные ядра No 2С) х 2 - эпителиальная ядерная плоидия (C) - Ядра графика с плоидными значениями как точечный участок, гистограмма или сгруппированные соответственно в барный график (т.е. 2С (0,6-2,9С), 4С (3,0-5,9С), 8С (6,0-12,9С), 16С (13,0-24,9С) и 32С (25,0С)(рисунок 3F).
Результаты
Подробный протокол предусматривает использование D. melanogaster в качестве модели для изучения раневой полиплоидизации (WIP). Эта модель заживления ран дает много преимуществ перед млекопитающими и другими моделями мух WIP. Полиплоидия была легко индуцирована механическим проколом с булавкой насекомых и полиплоидные клетки были созданы в течение короткого периода времени (2-3 dpi)(рисунок 1A, 1B)4. Основной проблемой является вскрытие нетронутой брюшной ткани без каких-либо возмущений к эпителию. Эпителий D. melanogaster легко случайно наткнулся или поцарапал с острыми инструментами вскрытия. Таким образом, шаги этого протокола должны практиковаться до использования и анализа.
Во-первых, травма была ограничена брюшной полости женщины, которая обеспечивает большую, плоскую непрозрачную область ткани идеально подходит для визуализации. Пункционные раны были нанесены в эпителии плеурита, который лежит по обе стороны от брюшной кормы средней линии и направлены между тергитными (T) сегментами T4-T5(рисунок 1A-C). Это размещение раны обеспечивает большую видимую область, которая не нарушается вскрытием. Сложные шаги включают в себя брюшной весной ножницы вырезать и закрепленияшаги (рисунок 1D, 1E). Весенний шаг резки работал лучше всего, когда животы были сокращены в уменьшенном объеме раствора Грейс (30 йл) для уменьшения движения тканей. Хорошо центрированный разрез вдоль спинной средней линии был необходим, чтобы обеспечить достаточную область на брюшной спинной закрылки, чтобы закрепиться на пластине вскрытия(рисунок 1C). Брюшко должно быть аккуратно закреплено на четырех углах без чрезмерной силы(рисунок 1E). Контактный толчок, который слишком сильно исказит брюшной ткани и может даже подтолкнуть ткани в вскрытии пластины. Если это произойдет, ткань должна быть отброшена. После того, как брюшной ткани была исправлена, он остался на пластине вскрытия до иммунофлуоресценции окрашивание было завершено и животы были установлены на стеклянной крышкой для визуализации (Рисунок 1F).
Заживление ран требует непрерывного эпителиального листа для формирования, который зависит от эндорепликации иклеточного синтеза 4,,16. Септатный узел белка FasIII, который маркирует клеточно-клеточные соединения, дал индикатор того, имели ли место какие-либо возмущения обработки во время подготовки(рисунок 1G, 1H). Абдомены с большими царапинами (необлитаемая область), которые возмущаются областью раны, должны быть отброшены и не использовались для дальнейшегоанализа (рисунок 1H).
Следующим шагом был анализ нетронутых образцов на любые дефекты в WIP. Этот протокол включает различные анализы для обнаружения различных аспектов ответа WIP(рисунок 2). Ремонт раны был завершен, когда центральная, большая, многонуклеированная клетка покрыла раневую парши(рисунок 3A). Здесь слияние клеток было обнаружено путем окрашивания для FasIII/Grh и количественной оценки количестваэпителиальных ядер Grh, охватываемых в области FasIII4. Дефекты в замыкании раны или повторной эпителиализации были обнаружены при наблюдаются зазоры в эпителиальной листе(рисунок 3B,красная стрелка). Так было, например, когда WIP был подавлен активацией митотического цикла через выражение stg, fzrRNAi, как недавносообщалось 16. В этом генетическом состоянии, 52% ран не смогли сформировать непрерывный эпителиальный лист над раны парши(рисунок 3B, 3C).
Другой метод измерения ремонта ран в этой модели был путем визуализации эпителиальной мембраны с эпи-Gal4 выражение UAS-mCD8-ChRFP4 (Рисунок 2, Рисунок 3D). В контроле, 91% эпителиальных ран полностью закрыты на 3dpi,но ингибирование WIP путем блокирования эндорелирования (E2f1 РНК )и клеточногосинтеза ( RacDN ) одновременно, как сообщалось ранее, вызвало 92% эпителиальных ран, чтобы оставаться полностью открытым(рисунок 3D, 3E)8,16. Активация митотического клеточного цикла экспрессией stg, fzrRNAi также привела к дефекту закрытия эпителиальной раны. Однако, визуализируя эпителиальную клеточную мембрану, можно определить степень дефекта повторной эпителиализации. WIP мутант (E2f1 РНК , RacDN )летатьраны были более открытыми, чем stg, fzrРНК раны (рисунок 3D, пунктирной красный контур)16. Эта мембрана раны исцеления анализ предоставил более подробную информацию о степени дефекта восстановления раны. В результате дефекты повторной эпителиализации могут быть сгруппированы как полностью открытые, частично закрытые (т.е. зазоры в 10 мкм), либо полностью закрыты(рисунок 3D, 3E).
В дополнение к слиянию клеток, эпителиальные клетки растут в размерах путем эндорепликации, неполного клеточного цикла, который удваивает содержание ядерной ДНК. Эндорепликация была анализа как активность клеточного цикла и прямых ядерных измерений ploidyДНК (рисунок 2 и рисунок 4). Здесь активность клеточного цикла была обнаружена путем включения аналога тимидин, EdU(рисунок 4A, 4B). D. melanogaster эпителиальных клеток было установлено, чтобы войти в эндоцикл, неполный цикл клеток, который колеблется между фазами S и G без вмешательства Mфазы 4,12. Взрослая диета D. melanogaster была дополнена EdU+ и питанием до травмы, и мухи были сохранены на диете EdU до вскрытия на 2 dpi (Рисунок 4A).+ EdU был обнаружен с помощью протокола Click-iT производителя. Этот анализ EdU был использован, чтобы определить, где, когда и сколько ядер были вызваны, чтобы войти в фазу S в ответ на рану. Используя систему Gal4/UAS, недавно было обнаружено, что эпителиальное специфическое выражение myc может либо блокировать(mycRNAi), либоусугублять (Myc overexpression) компетентность эпителиальных клеток для входа в фазу S. В результате, было показано, что Myc достаточно, чтобы вызвать эндорепликацию в постмитотических клетках, дажебез травм 16,22.
Далее эпителиальная плоидия определялась путем непосредственного измерения содержания ядерной ДНК. Эпителиальные ядра были определены иммунофлуоресценции окрашивания для эпителиального специфического маркера, Grh (Рисунок 4D). В программном обеспечении для визуализации Фиджи эпителиальные ядра были системно идентифицированы, а затем пороговые с использованием ядерного пятна Grh. Ядра были затем разделены и ROIs наложены на SUM стеков DAPI изображение(рисунок 4D ,зеленаястрелка). Любые перекрывающиеся ядра были удалены вручную до того, как была измерена интегрированная плотность выбранных ядер(рисунок 4D,красные стрелки). Этот полуавтомизированный метод позволяет количественно распределения и ploidy большинства ядер по всей невредимым и отремонтированы мухи брюшнойэпителий 8. Как сообщалось недавно, эпителиальные ядра, окружающие рану, состояли из 44% полиплоидных ядер с содержанием ДНК более 3С при 3 dpi(рисунок 4E, 4F)16. Как и ожидалось из результатов EdU, нокдаун myc привело к значительному блоку в эндоребликации, так как только 9% эпителиальных ядер были полиплоидными, в то время как переэкспрессия Myc привела к 100% полиплоидных эпителиальных ядер вокруг раны сайта (Рисунок 4F)16. Эпителиальный ядерный размер также заметно пострадал от экспрессии myc с уменьшенными или увеличенными ядрами. Тем не менее, ядерная область не является точной мерой плоидии и физиологических эффектов, потому что такие факторы, как растяжение клеток, также могут влиять на ядерный размер, не влияя на содержаниеядерной ДНК 20.
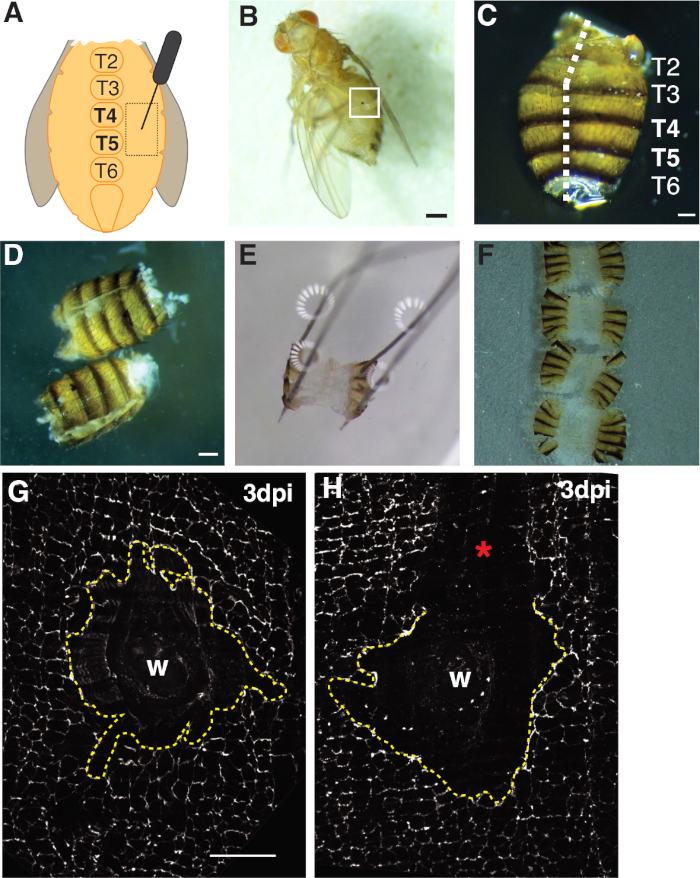
Рисунок 1: Взрослые плоды мухи брюшной раны, вскрытия и ткани монтажа. (A)Диаграмма взрослого брюшного раны анализа. Мухи должны быть повреждены по обе стороны живота при тергите 4 (T4). (B)Взрослые самки плодовой мухи 3 dpi с меланином парши, образованной из заживления ран (белый ящик). Шкала бар 50 мкм. (C) Рассеченные взрослого живота, спинной вид, с тергитами помечены. Abdomens были филе вниз по средней линии спинной стороны (белая пунктирной линии). Шкала бар 50 мкм. (D) Расчлененные и филе взрослых животов до закрепления. Шкала бар 50 мкм. (E) Возлагали взрослого живота на вскрытии пластины. В каждом из четырех уголков живота на спинной стороне была установлена булавка. Ткань была мягко открыта, но не растягивается, чтобы избежать разрыва. (F) Взрослые животы были установлены и помещены на стеклянную крышку с внутренней стороны живота лицом вниз к крышке и кутикуле, ориентированной на стеклянную горку. (G)FasIII окрашивание нетронутой области раны без обработки возмущения и центрального синцития (dashed желтой линии). Шкала бар 50 мкм. (H) Изображение поцарапан раны области (я) с незапачканной области FasIII, что нарушает синцитий. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
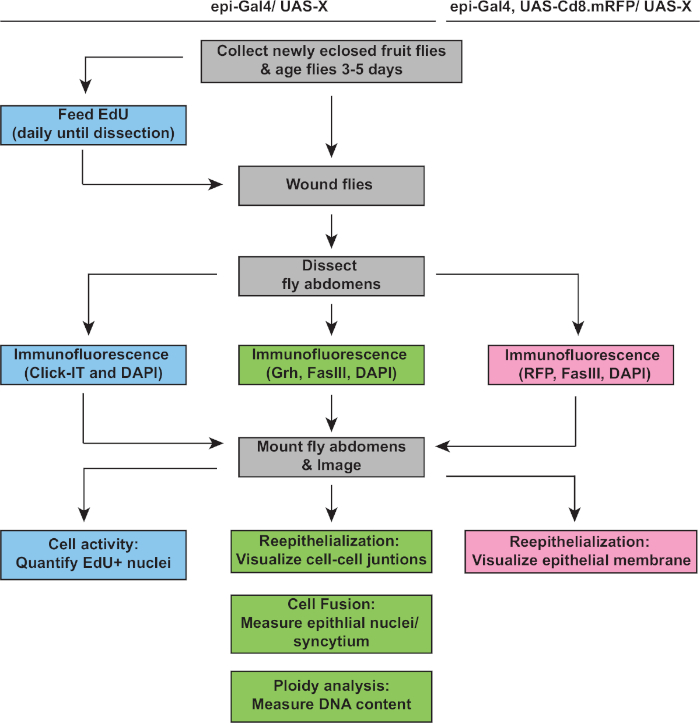
Рисунок 2: рабочий процесс анализа WIP. В отчете изображены три анализа, описанные в данном исследовании, а также перекрывающиеся и различные шаги по обнаружению и измерению реакции WIP. Анализ EdU измеряет активность клеточного цикла (синие коробки), плоидия и реэпителиализация обнаруживаются иммуностенингом Grh/FasIII (зеленые коробки), а экспрессия мембранной RFP позволяет измерять степень эпителиального замыкания ран (розовые коробки). Общие шаги в серых коробках и D. melanogaster штамм генотипы перечислены выше. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
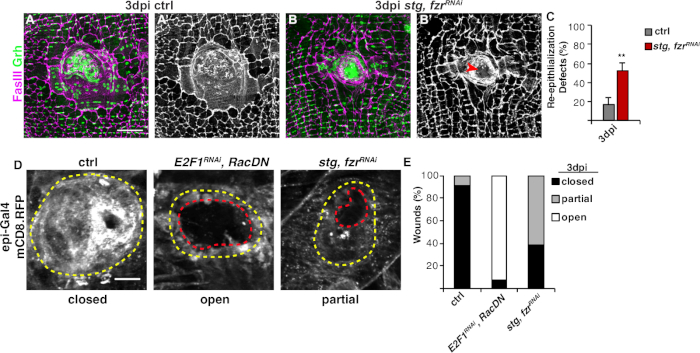
Рисунок 3: Методы обнаружения повторной эпителиализации во время WIP. Повторное эпителиализация была возмущена, когда WIP был генетически ингибирован. Иммунофлюоресцентные изображенияуправления (A) и stg, fzrRNAi (B) при 3 dpi. Эпителиальные ядра и септовые соединения были окрашены Grh (зеленый) и FasIII (магента), соответственно. (A' и B') ФасиИИ окрашивание само по себе показало, что повторное эпителиализация была нарушена (красная стрелка) в stg, fzrRNAi эпителия. Шкала бар 50 мкм. (C) Количественная оценка дефектов повторной эпителиализации (%) на 3 dpi (серый): контроль (n No 8), stg, fzrRNAi (n No 6). Бары ошибок указывают на стандартную ошибку; статистическая значимость была измерена с помощью T-теста студента, йП йлт; 0,01. Повторное эпителиализация во время ремонта ран также может быть обнаружена путем выражения мембраны, связанной с RFP с помощью epi-Gal4, UAS-mCD8-RFP. (D) Иммунофлюоресцентные изображения управления, E2F1РНК, RacDN, и stg, fzrРНК на 3 dpi. Шкала бар 20 мкм. Рана парши (желтый контур) и открытая эпителиальная область раны (красный контур). (E) Количественная оценка замыкания ран в ctrl (n No 11), E2F1RNAi, RacDN (n No 13), и stg, fzrRNAi (n No 13). Адаптировано от Grendler et al.16. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
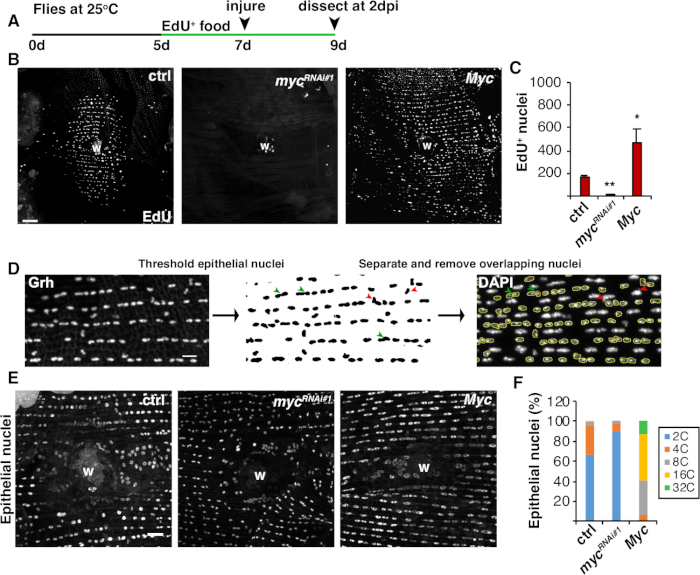
Рисунок 4: Методы обнаружения эндореляции во время WIP. (A) Хронология анализа EdU: взрослый Drosophila кормили 75 йл 5 мМ дрожжей-EdU каждый день 2 дня до травмы и продолжался до 2 dpi. (B)Иммунофторесцентные изображения этикетки EdU в штаммах мух, выраженных с системой epi-Gal4/UAS на 2 dpi. Рана парши (W). Шкала планки 50 мкм. (C) Среднее количество эпителиальных ядер EdU' на муху на 2 dpi: ctrl (n No 37), mycRNAi 1 (n No 10) и Myc (n No 8). Бары ошибок указывают на стандартную ошибку; статистическая значимость измерялась с помощью студенческого T-теста, 0,05, 0,01. (D)Схема обнаружения и измерения эпителиальной ядерной плоидии. Эпителиальные ядра были идентифицированы и пороговые анти-Grh пятно на Фиджи. Перекрывающиеся эпителиальные ядра были разделены (зеленые наконечники стрел) или удалены (красные наконечники стрел), если накладываются непителиальными ядрами. Измерялась интегрированная плотность и ядерная область соответствующего изображения окрашенных ядер DAPI. (E) Эпителиальный ядерный размер (Grh) был изменен выражением myc на 3 dpi. (F)Эпителиальная ядерная плоидия (%) на 3 dpi: ctrl (n No 4), mycRNAi-1 (n No 6) и Myc (n No 3). Адаптировано от Grendler et al.16. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Представлен подробный протокол о том, как вскрыть и использовать взрослый D. melanogaster брюшной эпителий для изучения того, как гены регулируют WIP путем изменения повторной эпителиализации и эндорепликации во время ремонтараны 16. Используя этот метод, прото-онкоген Myc был недавно определен в качестве ключевого регулятора WIP. Myc требуется для эпителиальных клеток, чтобы эндорепликации после травмы и достаточно для тихие эпителиальные клетки для эндоцикла как у взрослых летать эпителияи аксессуаров желез 16,22. Было также установлено, что переключение эпителиальных клеток на митотический клеточный цикл путем выражения stg, fzrRNAi вредно для восстановления ран. Продолжение исследований с использованием этого метода позволит выявить другие гены, необходимые для регулирования повторной эпителиализации и эндорпликации во время WIP, выявление сходства и различия в том, как полиплоидия регулируется и функции в различных тканях.
Эта модель и метод предлагают уникальные преимущества, в том числе легко индукции полиплоидии с механическим проколом и тот факт, что полиплоидные клетки генерируются в течениенескольких дней 4. Протоколы вскрытия и подготовки тканей основаны на методах вскрытияличинок 23,но живот взрослой мухи более жёсткий и поэтому легко возмущается. В результате, этот протокол требует практики и точности, чтобы изолировать нетронутые ткани для изучения WIP. После вскрытия, однако, эпителий хорошо виден и легко изображен, что дает снимок процесса заживления ран. Этот метод предоставляет огромное количество информации об эпителиальной организации взрослой мухи, размере клеток и синцитиума, а также о плоидии клеток и отдельных ядер. Хотя живая визуализация пока невозможна в пределах нетронутой плодовой мухи из-за ее непрозрачной кутикулы, этот протокол может быть адаптирован, чтобы включить в настоящее время доступные условия культуры ex vivo, используемые в D. melanogaster для выполнения краткосрочных исследований живойвизуализации 24.
В будущем, эта модель будет идеально подходит для изучения от клетки к клетке перекрестный разговор и вклад других типов клеток в WIP путем регулирования экспрессии генов с системой Gal4/UAS в других типах клеток интересов. Аналогичные вопросы также могут быть даны ответы с использованием различных генетических и мутантных фонов. Вскрытый брюшной полости взрослой мухи содержит различные типы клеток, которые могут быть легко визуализированы с помощью этого метода, в том числе жирового тела и оеноцитов, боковой мышечных волокон, сенсорных нейронов, трахеи и макрофагов, как гемоциты. Кроме того, эта модель позволит исследователям исследовать, как физиологические переменные влияют на WIP, включая секс, диету, инфекцию, возраст и экологические стрессоры. В то время как протокол использует взрослую самку летать из-за его большего размера, WIP также происходит в мужской плодовой мухи (Gjelsvik и Losick, неопубликованные). Полиплоидные клетки, как было установлено, возникают во время старения и возрастных заболеваний в печени млекопитающих, мозг, глаз и сердце12. Модель плодовой мухи позволит исследователям изучать полиплоидизацию в физиологическом и болезневом контекстах, поскольку гены, связанные с болезнями человека, очень сохранены.
Раскрытие информации
Ни один.
Благодарности
В Бостонском колледже мы хотели бы поблагодарить д-ра Эрика Фолкера за использование камеры его лаборатории и установки стереоскопического микроскопа для визуализации и Брета Джадсона в Бостонском колледже Imaging Core для инфраструктуры и поддержки. Мы также хотели бы поблагодарить летать сообщества ресурсов: Блумингтон Drosophila фондовый центр (NIH P40OD018537), Венский ресурсный центр Drosophila, и TRiP центр Гарвардской медицинской школы (NIH/NIGMS R01-GM084947) для обеспечения трансгенных запасов, используемых в этом исследовании. Мышь FasIII антитела были получены из развития исследований Hybridoma банка при поддержке NICHD NIH и поддерживается в Университете Айовы, Департамент биологии, Айова-Сити, IA. Исследования, о них сообщается в этой публикации, были поддержаны Национальным институтом общих медицинских наук Национальных институтов здравоохранения под номером R35GM124691. Содержание является исключительно ответственностью авторов и не обязательно отражает официальные взгляды Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| 35 mm Petri dishes | Fisher Scientific | FB0875713 | For creating plates to dissect in |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | For preparing staining reagents in |
| AxioImager M2 with Apotome | Zeiss | NA | For imaging samples |
| Blowgun mini | Genesee Scientific | 54-104M | For anethesizing D. melanogaster strains |
| Bovine Serum Albumin, 30% | Sigma | A7284-500ML | For immuostaining |
| Carbon dioxide tank | various distributors | N/A | For anethesizing D. melanogaster strains |
| Click-iT EdU 594 Kit | Thermofisher | C10339 | For EdU assay |
| Coverslips | Thermofisher | 3406 | For mounting |
| DAPI | Sigma | D9542-10MG | For immuostaining |
| Dissecting Plates (use Sylgard 184 Sil Elastic Kit) | Ellsworth Adhesives | 184SIL | For creating plates to dissect in. Mix epoxy as directed, let dry overnight |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A21206 | For secondary immuostaining |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A10042 | For secondary immuostaining |
| Drosophila tubing and fittings | Genesee Scientific | 59-124C, 59-123, 59-140 | For anethesizing D. melanogaster strains |
| Dumont #5 Forceps | Fine Science Tools | 11252-20 | For dissecting |
| epi-Gal4 | Bloomington Drosophila Stock Center (b) | b38793 | Losick et al. Current Biology, 2013 |
| epi-Gal4, UAS-mCD8.RFP | Bloomington Drosophila Stock Center (b) | b38793, b27392 | Losick et al. Current Biology, 2013 |
| Excel | Microsoft | For performing ploidy calculations | |
| Fiji/ImageJ (image analysis software) | NIH | https://imagej.nih.gov/ij | For image analysis |
| Fly food | Archon Scientific | N/A | Corn Syrup/Soy food |
| Flystuff Flypad | Genesee Scientific | 59-114 | For anethesizing D. melanogaster strains |
| Glass dissecting dish | Fisher Scientific | 13-748B | For performing dissections in |
| Glass slides | Fisher Scientific | 12-518-104C | For mounting |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A11001 | For secondary immuostaining |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A11031 | For secondary immuostaining |
| Grace's Insect Medium, unsupplemented | Thermofisher | 11595030 | For dissecting in |
| Insect pins | Fine Science Tools | 26002-10 | For wounding and pinning fly abdomens flat |
| Mouse anti-Fasciclin III (Drosophila) Primary Antibody | Developmental Studies Hybridoma Bank | 7G10 | For immunostaining epithelial cell-cell junctions |
| Mouting media | Vector Laboratories | H-1000 | Anti-fade mounting media to prevent photo bleaching during imaging |
| Nail polish | Electron Microscopy Sciences | 72180 | For sealing slides |
| Ortibal shaker | Fisher Scientific | 02-217-988 | For immuostaining |
| Phosphate Buffered Saline, PH 7.4 | Sigma | P3813-10PAK | For staining |
| Pin holders | Fine Science Tools | 91606-07 | For wounding |
| Rabbit anti-Grainyhead Primary Antibody | N/A | N/A | For immunostaining epithelial nuclei. Protocol to make antibody can be found (Ref. #4 and 8) |
| Rabbit anti-RFP Primary Antibody | MBL | PM005 | For immunostaining mCD8-RFP fly epithelium |
| Stereomicroscope | Olympus | SZ51 | For dissecting and mounting fly tissue |
| Triton X-100 | Sigma | 10789704001 | For immuostaining |
| UAS-E2F RNAi, UAS-RacDN | VDRC (v) and Bloomington Drosophila Stock Center (b) | v108837, b6292 | Losick et al. Current Biology, 2013 |
| UAS-fzr RNAi, UAS-Stg | VDRC (v) and Bloomington Drosophila Stock Center (b) | v25550, b56562 | Grendler et al. Development, 2019 |
| UAS-Myc | Bloomington Drosophila Stock Center (b) | b9674 | Grendler et al. Development, 2019 |
| UAS-myc RNAi | Bloomington Drosophila Stock Center (b) | b36123 | Grendler et al. Development, 2019 |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | For dissecting |
Ссылки
- Abreu-Blanco, M. T., Verboon, J. M., Liu, R., Watts, J. J., Parkhurst, S. M. Drosophila embryos close epithelial wounds using a combination of cellular protrusions and an actomyosin purse string. Journal of Cell Science. 125 (Pt 24), 5984-5997 (2012).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Galko, M. J., Krasnow, M. A. Cellular and genetic analysis of wound healing in Drosophila larvae. PLoS Biology. 2 (8), E239 (2004).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and cell fusion contribute to wound healing in the adult Drosophila epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Wang, Y., et al. Integrin Adhesions Suppress Syncytium Formation in the Drosophila Larval Epidermis. Current Biology. 25 (17), 2215-2227 (2015).
- Ramos-Lewis, W., LaFever, K. S., Page-McCaw, A. A scar-like lesion is apparent in basement membrane after wound repair in vivo. Matrix Biology. 74, 101-120 (2018).
- Lee, C. W., Kwon, Y. C., Lee, Y., Park, M. Y., Choe, K. M. cdc37 is essential for JNK pathway activation and wound closure in Drosophila. Molecular Biology of the Cell. 30 (21), 2651-2658 (2019).
- Losick, V. P., Jun, A. S., Spradling, A. C. Wound-Induced Polyploidization: Regulation by Hippo and JNK Signaling and Conservation in Mammals. PLoS One. 11 (3), e0151251 (2016).
- Tamori, Y., Deng, W. M. Tissue repair through cell competition and compensatory cellular hypertrophy in postmitotic epithelia. Developmental Cell. 25 (4), 350-363 (2013).
- Xiang, J., et al. EGFR-dependent TOR-independent endocycles support Drosophila gut epithelial regeneration. Nature Communications. 8, 15125 (2017).
- Cohen, E., Allen, S. R., Sawyer, J. K., Fox, D. T. Fizzy-Related dictates A cell cycle switch during organ repair and tissue growth responses in the Drosophila hindgut. Elife. 7, e38327 (2018).
- Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. Solving the Polyploid Mystery in Health and Disease. Trends in genetics: TIG. 35 (1), 6-14 (2019).
- Cao, J., et al. Tension Creates an Endoreplication Wavefront that Leads Regeneration of Epicardial Tissue. Developmental Cell. 42 (6), 600-615 (2017).
- Zhang, S., et al. The Polyploid State Plays a Tumor-Suppressive Role in the Liver. Developmental Cell. 44 (4), 447-459 (2018).
- Lazzeri, E., et al. Endocycle-related tubular cell hypertrophy and progenitor proliferation recover renal function after acute kidney injury. Nature Communications. 9 (1), 1344 (2018).
- Grendler, J., Lowgren, S., Mills, M., Losick, V. P. Wound-induced polyploidization is driven by Myc and supports tissue repair in the presence of DNA damage. Development. 146 (15), 173005 (2019).
- Mehrotra, S., Maqbool, S. B., Kolpakas, A., Murnen, K., Calvi, B. R. Endocycling cells do not apoptose in response to DNA rereplication genotoxic stress. Genes & Development. 22 (22), 3158-3171 (2008).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gonzalez-Rosa, J. M., et al. Myocardial Polyploidization Creates a Barrier to Heart Regeneration in Zebrafish. Developmental Cell. 44 (4), 433-446 (2018).
- Webster, M., Witkin, K. L., Cohen-Fix, O. Sizing up the nucleus: nuclear shape, size and nuclear-envelope assembly. Journal of Cell Science. 122 (Pt 10), 1477-1486 (2009).
- Knouse, K. A., Lopez, K. E., Bachofner, M., Amon, A. Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture. Cell. 175 (1), 200-211 (2018).
- Box, A. M., et al. Endocycles support tissue growth and regeneration of the adult Drosophila accessory gland. bioRxiv. , 719013 (2019).
- Karim, M. R., Moore, A. W. Morphological analysis of Drosophila larval peripheral sensory neuron dendrites and axons using genetic mosaics. Journal of Visualized Experiments. (57), e3111 (2011).
- Dai, W., Montell, D. J. Live Imaging of Border Cell Migration in Drosophila. Methods in Molecular Biology. 1407, 153-168 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены