Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Культура перицитов мозга для цитозолических измерений кальция и исследований по визуализации кальция
В этой статье
Резюме
Мозг капиллярных перицитов являются важными игроками в регуляции гемово-мозгового барьера свойства и кровотока. Этот протокол описывает, как перициты мозга могут быть изолированы, культурны, характеризуются по отношению к типу клеток и применяются для исследований внутриклеточного кальция сигнализации с флуоресцентными зондами.
Аннотация
Перициты связаны с эндотелиальными клетками и астроцитическим эндфитом в структуре, известной как нервно-сосудистый блок (NVU). Функция перицита мозга капилляра не до конца известна. Перициты были предложены для участия в развитии капилляров, регулирование эндотелиальной герметичности барьера и трансцитоза деятельности, регулирование капиллярного тона и играть решающую роль в некоторых патологий мозга.
Перициты являются сложными для исследования в нетронутой мозга из-за трудностей в визуализации процессов в мозге parenchyma, а также близость к другим клеткам NVU. Настоящий протокол описывает метод изоляции и культуры первичных капиллярных перицитов мозга крупного рогатого скота и их следующее использование в исследованиях визуализации кальция, где могут быть исследованы эффекты агонистов, участвующих в сигнализации мозга и патологиях. Корковые капиллярные фрагменты могут прикрепляться к нижней части культуры колбы и, после 6 дней, эндотелиальные клетки и перициты выросли из капиллярных фрагментов. Эндотелиальные клетки удаляются нежной трипсинизацией и перициты культурируются в течение 5 дополнительных дней до прохода.
Изолированные перициты посеяны в 96-колодец культуры пластин и загружены с красителем индикатор кальция (Fura-2 ацетоксиметил (AM)), чтобы для измерения внутриклеточного уровня кальция в установке считыватель пластин. Кроме того, перициты сеяются на крышках и устанавливаются в клеточных камерах. После загрузки с индикатором кальция (Cal-520 AM), кальций живой визуализации может быть выполнена с помощью конфокаляновой микроскопии на возбуждение длины волны 488 нм и выбросов длины волны 510-520 нм.
Метод, описанный здесь, был использован для получения первых внутриклеточных измерений кальция от первичных перицитов капилляров мозга, демонстрируя, что перициты стимулируются через АТФ и способны заключить контракт в пробирке.
Введение
Мозг капиллярных перицитов, вместе с эндотелиальными клетками и астроцитами, составляют NVU1,2,3. Эндотелиальные клетки, которые составляют структурную основу капилляров, образуют длинные цилиндрические трубки диаметром 5-8 мкм. Эндотелиальные клетки время от времени покрываются перицитами и окружены выступами астроцитов; эндфит астроцитов.
Гемово-мозговой барьер (BBB), расположенный в капиллярах мозга, является основным местом для обмена питательными веществами, газами и отходами между мозгом и кровью. BBB также защищает мозг от эндогенных и экзогенных нейротоксинов и служит барьером для доставки большого количества лекарственных соединений. Барьерная функция является областью фокусировки, а также препятствием для фармацевтических компаний, разрабатывая лекарства центральной нервной системы (ЦНС). Это вызвало большой интерес к расследованию клеток NVU в культуре4. Астроциты мозга и эндотелиальные клетки были культурны и охарактеризованы в ряде исследований, в то время как исследования и протоколы перицитной культуры являются редкими.
Ранее опубликованные протоколы описали генерации мозга капиллярных перицитных культур в некоторой степени, используя целый ряд различных подходов, таких какиммунопаннинг 5, высокой и низкой глюкозы СМИ 6 , флуоресцентно-активированнойклетки сортировки 7, плотность градиент центрифугации8и т.д. Хотя эти методы кажутся достаточными для получения культур перицитов, некоторые из них относят много времени, стоят дорого и перициты, полученные не может быть идеальным из-за числа культуры проходы, которые могутде-дифференцироватьpericytes 9 . Кроме того, потенциал культурных перицитов в исследованиях в области сигнализации in vitro до сих пор довольно не изучен.
Нынешняя работа посвящена генерации перицитовых культур из изолированных капилляров мозга крупного рогатого скота и последующей установке для измерений и исследований изображений изменений внутриклеточного кальция, важного внутриклеточного второго посланника. Мы кратко описываем изоляцию капилляров от коркового серого вещества (для деталей см. Helms et al.10)и изоляцию и культуру перицитов в чистой монокультуре без загрязнения эндотелиальными или глиальными клетками. Затем мы предоставляем протокол для посева перицитов в 96-хорошо пластин и протоколы загрузки для кальция зонд Fura-2 AM. Наконец, мы показываем, как перициты могут быть использованы в конфокальных изображений в режиме реального времени в камерах микроскопной культуры и описываем протоколы для этого.
протокол
1. Подготовка буферов и решений для культивирования клеток
- Приготовьте раствор коллагенового бульона, растворив 5 мг коллагена IV из человеческой плаценты в 50 мл PBS на ночь при 4 градусах Цельсия. Aliquot фондовый раствор в 5 мл порций и хранить при -20 градусов по Цельсию.
- Приготовьте раствор фибронектина, растворив 5 мг фибронектина в 5 мл стерильной воды на ночь. Храните фибронектинные запасы в алицитах 500 МКЛ при -20 градусов по Цельсию. При оттаивании добавьте PBS к окончательному объему 50 мл, чтобы подготовить рабочий раствор и хранить его при 4 градусах Цельсия.
- Подготовьте модифицированную орлиную среду Dulbecco (DMEM), добавив 50 мл сыворотки крупного рогатого скота плода (FBS), 5 мл несущественных аминокислот MEM и 5 мл пенициллина/стрептомицин (0,1 г/л стрептомицин сульфата и 100 000 U/L пенициллин G натрия) до 500 мл DMEM.
- Приготовьте раствор гепарина 5 мг/мл, растворив соль гепарина натрия в PBS и пройдите через фильтр 0,2 мкм для стерилизации. Храните раствор на складе при 4 градусах Цельсия.
- Подготовка среды роста (GM) непосредственно перед использованием; смешать 10 мл DMEM-компа и 250 мкл гепаринского раствора на Т75-колбу.
2. Изоляция капилляров от свежего мозга крупного рогатого скота
ПРИМЕЧАНИЕ: Капилляры мозга крупного рогатого скота изолированы и культурны, как описано ранее (Helms et al.10).
- Собирайте мозги телят, не старше 12 месяцев, с скотобойни и поднесите непосредственно в лабораторию на льду.
- Удалите опоясывания и соберите все серое вещество из мозга с помощью скальпеля. Определите meninges как пленка покрывая мозг и серое вещество своим серым цветом.
- Используйте 40 мл ткани Dounce шлифовальный станок для гомогенизации серого вещества в Dulbecco в модифицированных Eagle Medium (DMEM). Заполните тонкую часть ткани шлифовальной машины 1/5 с серой подвеской вещества и добавить DMEM до тех пор, пока тонкая часть заполнена.
- Отделить капилляры от свободных клеток и мелких частей ткани путем фильтрации гомогената через 160 мкм нейлоновой сетки фильтра. Промыть фильтры с DMEM-комп. Извлеким капилляры и сгут подвески в трубы центрифугации 50 мл.
- Повторное добавление капилляров в DMEM-комп и добавить ферментную смесь DNase I (170 U/mL), коллагеназы типа III (200 U/mL) и трипсина (90 U/mL). Оставьте суспензию на 1 ч в водяной бане 37 градусов по Цельсию для переваривания капилляров.
- Запустите подвеску через 200 мкм сетчатый фильтр и повторно использовать в FBS с 10% диметил сульфоксид (DMSO). Заморозить капилляры на ночь при -80 градусов по Цельсию и переместить их в жидкий азот на следующий день после длительного хранения.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь.
3. Посев и культивирование капилляров крупного рогатого скота
- День 0: Смешайте 0,7 мл коллагена IV бульона с 6,3 мл PBS. Добавьте раствор в Т75-колбу и оставьте колбу на 2 ч при комнатной температуре (RT) или оставьте на ночь при температуре 4 градусов по Цельсию.
- Удалить раствор коллагена из колбы и мыть три раза с PBS.
- Добавьте 7 мл фибронектина рабочего раствора и оставьте колбу на 30 мин на RT. Затем удалите раствор фибронектина и семя капилляров сразу после.
- В течение 30 минут ожидания, оттепель один флакон капилляров в 37 градусов по Цельсию водяной бане.
- Когда капилляры разморозятся, немедленно перенесите в центрифугированную трубку с 30 мл DMEM-компа и центрифуги в течение 5 мин при 500 x g и RT. Удалите DMEM-комп из трубки и повторно приостановите капиллярную гранулу в 10 мл свежего DMEM-компа.
- Перенесите подвеску 10 мл в покрытую Т75-колбу и оставьте капилляры прилипать к нижней части колбы на 4-6 ч в инкубаторе 37 градусов по Цельсию при 10% CO2.
ПРИМЕЧАНИЕ: Темпы роста клеток выше на 10% CO2, а не обычные 5% CO2. - После 4-6 ч инкубации осмотрите колбу под световым микроскопом. Фракции капилляров теперь должны быть прикреплены к нижней части колбы(рисунок 1, день 0).
- Подготовка ГМ и аспирировать DMEN-комп среды очень осторожны из капилляров и заменить его на 10 мл свежеприготовленного ГМ.
- День 2: Удалить ГМ из капилляров и заменить 10 мл свежеприготовленного ГМ. Сотовый результат из капилляров должен быть виден под световым микроскопом в этот момент(рисунок 1, день 2-3).
4. Изоляция первичных перицитов от капилляров мозга крупного рогатого скота
-
День 4: Осмотрите капилляры под световым микроскопом.
ПРИМЕЧАНИЕ: Колба теперь должна быть примерно 60-70% стечения, чтобы обеспечить соответствующее количество перицитов(рисунок 1, день 4). Если это не так; заменить ГМ на 10 мл свежей среды и оставить колбу в инкубаторе еще на один день. - Аспирировать средний и мыть клетки осторожно в PBS.
- Добавьте 2 мл оттаялого трипсина-ЭДТА для эндотелиальных клеток и оставьте колбу в инкубаторе на 1-3 мин. Вынул колбу часто и наблюдать с микроскопом в течение этого периода времени.
ПРИМЕЧАНИЕ: эндотелиальные клетки должны округляться и отделяться от колбы; перициты должны быть видны как клетки с "призрак"-морфологии и по-прежнему быть прикреплены к поверхности колбы. Это сложный и важный шаг. Важно удалить большинство эндотелиальных клеток, чтобы избежать загрязнения перицитовой монокультуры, но длительная трипсинизация может также отделить перициты. Время трипсинизации может немного варьироваться время от времени, и поэтому крайне важно часто наблюдать колбу с микроскопом во время лечения. - Аккуратно коснитесь колбы, когда эндотелиальные клетки начали округляться, чтобы отсоединить ослабленные эндотелиальные клетки.
- Чтобы остановить трипсинизацию, добавьте в колбу 10 мл DMEM-comp. Промыть колбу тщательно несколько раз со средой, чтобы удалить эндотелиальные клетки. Аспирировать эндотелианую подвеску клетки из колбы. Эндотелиальные клетки теперь могут быть использованы для других целей.
- Добавьте в колбу 10 мл DMEM-компа. Посмотрите под световым микроскопом, чтобы обеспечить перициты по-прежнему присутствуют и прилагается к нижней. Положите колбу обратно в инкубатор, чтобы перицит обогащенной культуры расти.
ПРИМЕЧАНИЕ: Важно наблюдать за культурой в течение следующих дней. Если есть еще достаточное количество эндотелиальных клеток растет другой трипсин-лечение может быть выполнено. - Разрешить перицит монокультуры расти с изменением DMEM-комп. средний каждый второй день. Проверьте рост клеток под световым микроскопом(рисунок 1, день 5-8).
5. Генерация и хранение монокультуры первичных перицитов крупного рогатого скота
-
День 8-9: Осмотр капилляров под световым микроскопом
ПРИМЕЧАНИЕ: Перициты должны были теперь достигли 70-80% слияния и расти на островах в колбе(рисунок 1, день 9). Если слияние перицитов составляет менее 70%, позволяют клеткам расти в течение еще одного дня. Перициты не образуют полный монослой, как эндотелиальные клетки. - Аспирировать DMEM-комп и мыть перициты с 7 мл PBS.
- Добавьте в колбу 2 мл трипсина-ЭДТА и оставьте в инкубаторе на 2-3 мин. Поместите колбу часто под световым микроскопом, чтобы наблюдать, когда перициты округляются и отделяются от колбы. Когда перициты начали округляться, колбу можно аккуратно использовать, чтобы отделить клетки.
- Аккуратно коснитесь колбы, когда перициты начали округляться, чтобы отсоединить клетки.
- Добавьте 10 мл DMEM-компа в колбу, чтобы остановить процесс трипсинизации. Промыть колбу несколько раз со средой, чтобы помочь отделить последние перициты.
- Перенесите 12 мл клеточной подвески в центрифугированную трубку 50 мл и заполните до 30 мл DMEM-компом.
- Центрифуга клеточной подвески в течение 5 мин при 500 х г и RT. Аспират DMEM-комп. тщательно, не касаясь клеточной гранулы. Повторное увеличение клеточной гранулы в 3 мл FBS с 10% DMSO.
- Передача клеточной подвески в криовиалы; добавить 1 мл к каждому, так что будет в общей сложности 3 флакона на T75-колбу перицитов. Заморозить перициты при -80 градусов по Цельсию на ночь и переместить их в жидкий азот на следующий день после длительного хранения.
ПРИМЕЧАНИЕ: Клетки могут быть подсчитаны до замораживания для более поздней оценки процент выживания. Протокол можно приостановить здесь.
6. Создание перицитовой монокультуры для экспериментов
- Пальто T75-колба с коллагеном IV и фибронектин, используя ту же процедуру, как упоминалось в разделе 3.1-3.4.
- В то время как колба покрыта фибронектином, оттаивать один флакон перицитов в водяной бане 37 градусов по Цельсию.
- Перенесите ныне оттаящие перициты из криовиальной в центрифугированную трубку с 30 мл DMEM-comp. Центрифуга клеточной подвески в течение 5 мин при 500 х г, RT.
- Тщательно аспирировать среды, оставляя ячейки гранулы в нижней части трубки. Повторно приостанавливайте гранулы в 10 мл DMEM-comp.
- Соберите и перенесите подвесную клетку в фляговую колбу с покрытием. Оставьте колбу с перицитами расти в инкубаторе 37 градусов по Цельсию при 10% CO2.
- Каждый второй день обновляем среду 10 мл свежего DMEM-компа.
ПРИМЕЧАНИЕ: После 5 дней роста перициты должны были достигнуть приблизительно 80% слияния. Если слияние меньше, оставьте клетки расти еще на один день или два. Клетки теперь должны быть готовы к посеву для дальнейших экспериментов.
7. Посев перицитов в пластине с покрытием 96-хорошо
- Разбавить коллаген IV, как описано в шаге 3.1. Добавьте 100 мкл к каждому колодец в пластине 96-колодец и инкубировать в течение 2 ч на RT или на ночь при 4 градусов по Цельсию.
- Аспирировать раствор и мыть скважины три раза с PBS.
- Добавьте 100 мкл разбавленного фибронектина к каждой колодец и инкубировать в RT в течение 30 мин. Удалите раствор фибронектина и немедленно используйте пластину.
ПРИМЕЧАНИЕ: В зависимости от того, насколько хорошо перицит партии растет, должно быть достаточно клеток для посева двух пластин. - Вынул перициты из инкубатора и аспирировать медиум. Вымойте клетки с помощью PBS.
- Добавьте 2 мл трипсина-ЭДТА в перициты и следуйте той же процедуре, что и в шаге 5.3-5.6.
- Аспирировать носитель, не нанося вреда гранулы клетки и повторно приостановить гранулы в 1 мл свежего DMEM-комп.
- Вынул 12 МКЛ клеточной подвески и добавить в счетную камеру. Под световым микроскопом, рассчитывать по крайней мере 3 из 3x3 сетки и использовать среднее количество клеток на сетку.
- Используйте уравнение ниже, чтобы вычислить объем клеточной подвески, которые должны быть добавлены к каждой хорошо семян 10.000 клеток на колодец, в 96-хорошо пластины.
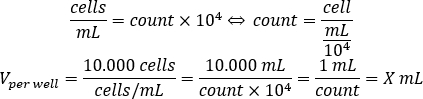
- Добавьте DMEM-комп и рассчитанный объем клеточной подвески в каждой из них, чтобы достичь конечного объема в 200 мл.
- Поместите пластину 96-колодец в инкубатор с 37 градусами по Цельсию при 10% CO2. Оставьте клетки расти в течение 4 дней со сменой среды через 2 дня.
8. Подготовка буферов и решений для Ca2 "-imaging
- Автоклав охватывает камеры клеток и крышки.
- Буфер анализа: Добавьте 1,19 г HEPES до 500 мл буфера HBSS для окончательной концентрации 10 мМ HEPES. Отрегулируйте рН до 7,4.
- Приготовьте 20% (w/v) Pluronic F127 и 1% (v/v) раствор полиэтоксилированного касторового запаса, растворив 0,5 г раствора Pluronic F127 в 2,5 мл ангидроуса DMSO в стеклянном флаконе. Нагрейте до 40 градусов по Цельсию в течение примерно 30 минут или до растворения и вихря. Добавьте 25 мкл полиэтиленоксилового касторового масла и храните в RT. Не замерзай.
- Приготовьте запас 2 мМ Фура-2 АМ, растворив 1 мг в 500 мкл ангидроуса ДМСО. Храните в алицитах 20 МКЛ при -20 градусах Цельсия, защищенных от света.
- Подготовье погрузочного раствора Fura-2 AM, смешивая 20 л 20% Pluronic F-127 и 1% полиэтоксилированного раствора касторового запаса с 20 л 2 мМ Фура-2 AM aliquot. Добавьте 500 МКЛ буфера анализа и вихря. Добавьте буфер анализа к окончательному объему 8 мл. Раствор должен быть подготовлен непосредственно перед использованием и защищен от света.
- Приготовьте 4 мММ Cal-520 AM путем растворения 1 мг в 226,7 л ангидроуса DMSO. Храните в алицитах 20 МКЛ при -20 градусах Цельсия, защищенных от света.
- Подготовье 20 МКМ Cal-520 AM погрузочный раствор, смешивая 20 л 20% Pluronic F-127 и 1% полиэтоксилированный раствор касторового запаса с 20 йл 4 мМ Cal-520 aliquot. Добавьте 500 МКЛ буфера анализа и вихря. Добавьте буфер анализа к окончательному объему 4 мл. Раствор должен быть подготовлен непосредственно перед использованием и защищен от света.
9. Загрузка перицитов с красителем индикатора кальция Fura-2 AM в установке считыватель пластин
ПРИМЕЧАНИЕ: Все решения должны быть на RT до начала эксперимента.
- Вывихи 96-хорошо пластины с клетками из инкубатора и аспирировать среды из колодцев. Вымойте клетки дважды с помощью буфера анализа.
- Добавьте 100 йл погрузочного раствора к каждой колодец и оберните пластину фольгой, чтобы избежать отбеливания фотографий. Инкубационный в течение 45 мин с 30 об / мин встряхивания на RT.
ПРИМЕЧАНИЕ: Не загружайте Fura-2 AM при 37 градусах Цельсия, так как он может загружать внутренние отсеки. Не забудьте оставить колодцы с ячейками в буфере анализа вместо загрузки буфера; это "пустые", используемые для измерения фоновых флуоресценций. - Аспирировать погрузочный буфер и мыть клетки с помощью буфера анализа в два раза. Добавьте 100 МКЛ свежего буфера анализа и оставьте клетки инкубировать в течение 30 минут на RT; это позволяет непрерывно расщепления AM-эстер и тем самым захвата Fura-2 AM внутри клеток.
- До того, как Ca2"-изображение, мыть и заменить буфер с 100 йл свежего буфера анализа.
10. Ну пластины флуоресценции чтения перицитов в пластины читателя установки
- Установите температуру считыватель пластины до 37 градусов по Цельсию и перенесите пластину 96-колодец с клетками в положение образца пластины. Поместите реагентную пластину с агонистом в положение реагентной пластины.
- Начните с измерения нагрузки ячеек для обеспечения равной загрузки Fura-2 AM во всех скважинах.
- Выполните измерения с возбуждением флуоресценции длины волны на 340 нм/380 нм и длины волны выброса на 510 нм. Добавьте 50 МКЛ агониста со скоростью 150 мкл/с от реагентной пластины к каждому колодец с клетками в положении образца пластины.
- Сохранить данные и экспортировать в качестве xlsx файлов для дальнейшего анализа. Рисунок 2 показывает цитозоловый Ca2 "-ответизмеряется как соотношение между двумя длинами волн возбуждения с течением времени, где фон флуоресценции вычитается.
ПРИМЕЧАНИЕ: Плита-читатель должен быть двойной микроплюй читатель с комнатой для "ячейки лоток" и "образец лоток" и интегрированной системы трубоуправления.
11. Посев перицитов в камере с покрытием для живой визуализации
ПРИМЕЧАНИЕ: Coverslips также могут быть помещены в нижней части культуры колодцы, покрытые и посеяны с перицитами, как описано выше, а затем установлен в камере до экспериментов.
- Намонтировать крышку в камеру клетки и сделать его жесткой, чтобы избежать утечки.
- Разбавить коллаген IV, как описано в шаге 3.1. Добавьте 500 мкл в каждую камеру клетки и инкубировать в течение 2 ч на RT или на ночь при 4 градусах Цельсия.
- Аспирировать раствор коллагена и мыть камеры три раза с 500 йл PBS.
- Добавьте 500 мкл разбавленного фибронектина к каждой колодец и инкубировать на RT в течение 30 мин. Удалите раствор фибронектина и используйте камеру клетки сразу после этого.
- В то же время, вынюхить колбу с слиянием перицитов и мыть с 7 мл PBS.
- Добавьте 2 мл трипсина-ЭДТА в перициты и следуйте той же процедуре, что и в шаге 5.3-5.6.
- Следовать тем же шагам, что и в шаге 8.6-8.7.
- Используйте уравнение ниже, чтобы рассчитать объем клеточной подвески, которая должна быть добавлена в каждую камеру, чтобы посеять 90.000 клеток на камеру.
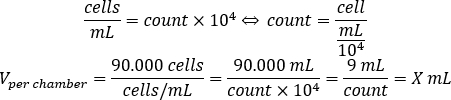
- Добавьте DMEM-комп и рассчитанный объем клеточной подвески в каждой камере, чтобы достичь конечного объема в 500 мкл.
- Поместите камеры клеток в инкубатор при 37 градусов по Цельсию, 10% CO2. Оставьте клетки расти в течение 6 дней (или до слияния).
ПРИМЕЧАНИЕ: перициты растут медленнее на стеклянных слайдах по сравнению с пластиком; больше дней роста необходимы.
12. Загрузка перицитов с красителем кальция Cal-520 AM для живой визуализации
ПРИМЕЧАНИЕ: Все решения должны быть на RT до начала эксперимента.
- Подготовь буфер загрузки 20 МКМ Cal-520 AM: Смешайте 20 л 20% Pluronic F-127 и 1% полиэтоксилированного раствора касторового запаса с 20 МКЛ 4 мМ Cal-520 aliquot. Добавьте 500 буфера анализа и вихря. Добавьте буфер анализа к окончательному объему 4 мл. Раствор должен быть подготовлен непосредственно перед использованием и защищен от света.
ПРИМЕЧАНИЕ: Защитите решения, содержащие Cal-520 AM от воздействия света. - Вывихите камеры клетки из инкубатора и аспирировать среду. Вымойте клетки дважды с помощью буфера анализа.
- Добавьте 500 МКЛ буфера загрузки в каждую камеру и инкубировать на RT в течение 45 минут.
- Аспирировать буфер загрузки и мыть клетки дважды с помощью буфера анализа.
- Добавьте 500 мкл свежего буфера анализа в каждую камеру и инкубировать в течение 30 минут на RT, чтобы расщепление AM-эфира.
- Замените буфер на 500 мкл буфера свежего анализа перед выполнением живой визуализации в конфокальце.
13. Живая визуализация внутриклеточных уровней Ca2
ПРИМЕЧАНИЕ: Различные типы микроскопов могут быть использованы для визуализации. Можно использовать вертикальные или перевернутые обычные флуоресцентные микроскопы, а также вертикальные или перевернутые конфокальные лазерные сканирующие микроскопы с соответствующим источником возбуждения (488 нм) и фильтрами выбросов (510-520 нм). Цели должны подходить для флуоресценции и быть высокого качества и с высокой численной диафрагмой (NA).
- Намонтировать камеру клетки на стадии конфокального микроскопа как можно мягче, чтобы избежать нарушения клеток.
- Выберите восклицательный длина волны 488 нм, выброс на 515 нм, последовательное получение изображения с интервалами 5 секунд, размер изображения XY 512 х 512 пикселей и мера в течение 2 минут для измерения базовых сигналов кальция.
- Добавьте 3 МКЛ 100 мМ АТФ в камеру клетки с помощью пипетки и продолжайте последовательное получение изображения. Выполните добавление медленно и осторожно, чтобы не нарушить подготовку и переместить клетки из фокуса.
- Наблюдайте за степенью изменений и увеличьте интервал времени с течением времени по мере необходимости в течение приблизительно 18 минут до тех пор, пока не будут отмечены дальнейшие морфологическиеизменения (рисунок 3).
- Сохранить покадровые изображения и экспортировать их в качестве файлов TIFF и/или AVI для дальнейшего анализа.
ПРИМЕЧАНИЕ: Один флакон перицитов должен дать достаточно клеток для посева в 1-2 96-хорошо пластин и несколько coverslips, то есть вы можете подготовить клетки для обоих типов кальция измерений.
Результаты
Капилляры мозга крупного рогатого скота были выделены из свежей ткани мозга и рисунок 1 представляет капиллярного посева и клеточного роста в течение нескольких дней и последующей очистки перицитов. Капилляры полностью прикреплены к колбе на 1 день и ?...
Обсуждение
В этом исследовании мы представили метод изоляции первичных перицитов от крупного рогатого скота. Описанный протокол позволяет культуре этого иначе довольно недоступный тип ячейки. Впоследствии полученная культура клеток была почти однородной популяцией перицитов, практически без ?...
Раскрытие информации
Авторы заявляют об отсутствие конкурирующих финансовых интересов.
Благодарности
Авторы хотели бы отметить финансирование из Лундбек Фонд исследовательской инициативы по мозга барьеров и доставки наркотиков (RIBBDD) и Саймон Hougners семьи фонда.
Материалы
| Name | Company | Catalog Number | Comments |
| ATP | Tocris | 3245 | |
| Cal-520 AM | AAT Bioquest | 21130 | |
| Cell incubator | Thermo Fisher | ||
| Centrifuge | Thermo Fisher | Heraeus Multifuge 3SR+ | Standard large volume centrifuge for spinning down cells |
| Collagen IV | Sigma Aldrich | C5533 | |
| Confocal laser scanning microscope | Carl Zeiss | Zeiss LSM 510 | Inverted microscope |
| Counting chamber | FastRead | 102 | |
| Coverslip cell chamber | Airekacells | SC15022 | |
| Cremophor EL | Sigma Aldrich | C5135 | Formerly known as Kolliphor EL |
| DMSO | Sigma Aldrich | 471267 | |
| Dulbecco's Modified Eagles Medium | Sigma Aldrich | D0819 | |
| Fetal bovine serum (FBS) | PAA/GE Healthcare | A15-101 | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Fura-2 AM | Thermo Fisher | F1201 | |
| Glass coverslips 22x22 mm | VWR International | 631-0123 | |
| HBSS | Gibco | 14065-049 | |
| Heparin | Sigma Aldrich | H3149 | |
| HEPES | AppliChem Panreac | A1069 | |
| Light microscope | Olympus | Olympus CK2 | Upright light microscope with phase contrast |
| MEM nonessential amino acids | Sigma Aldrich | M7145 | |
| Microplate Reader | BMG LabTech | NOVOstar | |
| PBS | Sigma Aldrich | D8537 | Phosphate-buffered saline |
| penicillin G sodium/streptomycin sulfate | Sigma Aldrich | P0781 | |
| Pluronic F127 | Sigma Aldrich | P2443 | |
| Trypsin-EDTA | Sigma Aldrich | T4299 | |
| T-75 flask | Sigma Aldrich | CLS3972 | |
| 96-well plate | Corning incorporated | 3603 |
Ссылки
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: Developmental, Physiological, and Pathological Perspectives, Problems, and Promises. Developmental Cell. 21 (2), 193-215 (2011).
- Abbott, N. J., Ronnback, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Mathiisen, T. M., Lehre, K. P., Danbolt, N. C., Ottersen, O. P. The Perivascular Astroglial Sheath Provides a Complete Covering of the Brain Microvessels: An Electron Microscopic 3D Reconstruction. Glia. 58 (9), 1094-1103 (2010).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Zhou, L., Sohet, F., Daneman, R. Purification of Pericytes from Rodent Optic Nerve by Immunopanning. Cold Spring Harbor Protocols. , 608-617 (2014).
- Liu, G. H., et al. Isolation, Purification, and Cultivation of Primary Retinal Microvascular Pericytes: A Novel Model Using Rats. Microcirculation. 21 (6), 478-489 (2014).
- Nayak, R. C., Herman, I. M. Bovine retinal microvascular pericytes: isolation, propagation, and identification. Methods In Molecular Medicine. 46, 247-263 (2001).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology-Heart and Circulatory Physiology. 302 (1), H69-H84 (2012).
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Helms, H. C., Brodin, B., Milner, R. Methods in Molecular Biology. Cerebral Angiogenesis: Methods and Protocols. 1135, 365-382 (2014).
- Abbracchio, M. P., Burnstock, G., Verkhratsky, A., Zimmermann, H. Purinergic signalling in the nervous system: an overview. Trends in Neurosciences. 32 (1), 19-29 (2009).
- Cai, C., et al. Stimulation-induced rises in cerebral blood flow and local capillary vasoconstriction depend on conducted vascular responses in brain capillaries. PNAS. , (2018).
- Tigges, U., Welser-Alves, J. V., Boroujerdi, A., Milner, R. A novel and simple method for culturing pericytes from mouse brain. Microvascular Research. 84 (1), 74-80 (2012).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant Outgrowth, Propagation and Characterization of Human Pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Orlidge, A., Damore, P. A. Cell specific effects of glycosaminoglycans on the attachment and proliferation of vascular wall components. Microvascular Research. 31 (1), 41-53 (1986).
- Rhinehart, K., Zhang, Z., Pallone, T. L. Ca2+ signaling and membrane potential in descending vasa recta pericytes and endothelia. American Journal of Physiology-Renal Physiology. 283, F852-F860 (2002).
- Bintig, W., et al. Purine receptors and Ca2+ signalling in the human blood-brain barrier endothelial cell line hCMEC/D3. Purinergic Signalling. 8 (1), 71-80 (2012).
- Neuhaus, A. A., Couch, Y., Sutherland, B. A., Buchan, A. M. Novel method to study pericyte contractility and responses to ischaemia in vitro using electrical impedance. Journal of Cerebral Blood Flow and Metabolism. 37 (6), 2013-2024 (2017).
- Kamouchi, M., et al. Calcium influx pathways in rat CNS pericytes. Molecular Brain Research. 126 (2), 114-120 (2004).
- Das, A., et al. ATP Causes Retinal Pericytes to Contract In vitro. Experimental Eye Research. 46, 349-362 (1988).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены