Method Article
Выделение мононуклеарных клеток периферической крови человека и CD4+ Т-клеток у пациентов с синдромом Сезари для транскриптомного профилирования
В этой статье
Резюме
Представлен простой протокол выделения мононуклеарных клеток периферической крови из цельной крови, полученной у пациентов с диагнозом синдром Сезари, с последующим отбором CD4+ Т-клеток, их стимуляцией форбол12-миристатом13-ацетатом и ионофором А23187 и подготовкой РНК для транскриптомного профилирования.
Аннотация
Кожные Т-клеточные лимфомы (CTCL) получены из трансформации и неконтролируемой пролиферации зрелых Т-клеток, ориентированных на кожу, а фунгоиды микоза (MF) и синдром Сезари (SS) представляют собой наиболее распространенные подтипы. Несмотря на ряд исследований по характеристике экспрессии генов, генетических изменений и эпигенетических аномалий CTCL, молекулярный патогенез MF / SS остается неясным. MF относится к более распространенному CTCL с преобладанием кожи и обычно ограничивается кожей, тогда как SS является агрессивным лейкемическим вариантом CTCL с широко распространенным поражением кожи и характеризуется опухолевым распределением, главным образом с участием крови, кожи и лимфатических узлов. Сосредоточив внимание на клинической практике, идентификация биомаркеров экспрессии генов имеет огромный потенциал для улучшения диагностики и лечения MF / SS. Действительно, недавние транскриптомные исследования выявили потенциальные диагностические биомаркеры от различий в экспрессии генов между нормальными и злокачественными Т-клетками, что может улучшить наше понимание биологии SS и выявить потенциальные терапевтические цели. В этой рукописи описывается подробный воспроизводимый протокол выделения мононуклеарных клеток периферической крови из свежей цельной крови у пациентов с диагнозом SS, выбор Т-клеток памяти CD4 + (CD4 + CD45RO + Т-клеток), химическая стимуляция и подготовка РНК, подходящей для транскриптомного профилирования, чтобы обнаружить новые прогностические молекулярные маркеры для получения дополнительного понимания этиологии заболевания. Стимуляция с использованием химического агониста для активации ядерной регуляции обеспечивает более конкретную оценку путей, важных для динамической регуляции транскрипции и экспрессии генов, и устраняет смешанные дефекты, которые могут возникнуть из-за дефектов передачи сигналов, возникающих в результате потери антигена TCR на клеточной мембране. Данные, полученные в результате сравнения транскриптома нестимулированных с стимулированными Т-клетками SS, разоблачают функциональные регуляторные дефекты экспрессии генов, не очевидные из анализа покоящихся нестимулированных клеток. Кроме того, метод, изложенный в этом подходе, может быть адаптирован для изучения дефектов экспрессии генов Т-клеток при других иммунных заболеваниях Т-клеток.
Введение
Кожная Т-клеточная лимфома (CTCL), включающая наиболее распространенные подтипы mycosis fungoides (MF) и синдром Сезари (SS), представляет собой гетерогенную группу заболеваний, полученных в результате трансформации и неконтролируемой пролиферации зрелых Т-клеток 1,2. Опухолевые Т-клетки имеют зрелый CD4 + CD45RO +, фенотип памяти3 и экспрессируют маркеры адгезии кожи, увеличивая эпидермотропизм4, который проявляется в виде сыпи, особенно при раннем заболевании. Клиническое течение МФ часто вяло, когда он находится под рутинным управляемым уходом, но подмножество пациентов может прогрессировать до более распространенного заболевания. В этих случаях поражения кожи растут и утолщаются в крупные опухоли, а опухолевые Т-клетки могут распространяться в лимфатические узлы и висцеральные органы. Напротив, SS является более агрессивным, лейкемическим вариантом CTCL5, характеризующимся триадой симптомов: генерализованная эритродермия (определяемая как поражающая >80% общей площади поверхности тела), лимфаденопатия и наличие более 1000/мм3 циркулирующих клональных атипичных Т-клеток с церебриформными ядрами, так называемыми клетками Сезари 6,7 . Прогноз для пациентов с СС значительно хуже, чем у МФ. СС встречается редко с частотой заболеваемости 0,1/100 000 и составляет примерно 3% от общего числа случаев CTCL 8,9. CTCL обычно присутствует у пожилых людей со средним возрастом около 60 лет10. Уровень заболеваемости КТКЛ увеличивался, и, хотя причина неясна, с 1998 года этот показатель стабилизировалсяи составил 11,12.
Молекулярный патогенез SS остается неясным. Генетические, эпигенетические и генные исследования экспрессии дали множество новых данных, однако остаются противоречивые результаты, в первую очередь из-за небольших когорт пациентов, изученных2, а также различий в экспериментальном дизайне и контрольных популяциях13,14. Улучшенная геномная и транскриптомная характеристика может пролить свет как на механизмы заболевания, так и на ранее неизведанные терапевтические мишени. Поэтому необходимы дополнительные исследования из большей популяции пациентов, чтобы лучше понять эту гетерогенную злокачественность. Панели биомаркеров, которые являются высокочувствительными и специфичными в одной когорте SS, показали менее однородные результаты в других когортах15, что представляет собой серьезное препятствие в разработке надежных диагностических и прогностических биомаркеров для SS16. Идеальные диагностические биомаркеры будут последовательно и сильно переэкспрессированы в злокачественных Т-клетках, в то время как отсутствуют или почти отсутствуют в нормальных Т-клетках17. Открытие специфических для заболевания биомаркеров важно для продвижения диагностических и терапевтических протоколов для SS.
Высококачественные транскриптомные данные как для злокачественных, так и для нормальных Т-клеток требуют эффективного и надежного подхода к пробоподготовке. Здесь мы обсудим подробную, но простую стратегию получения образцов РНК из популяций Т-клеток, имеющих отношение к SS. Мы обсудим выделение мононуклеарных клеток периферической крови (PBMC) из цельной крови, отрицательный магнитный отбор популяций CD4 + CD45RO + Т-клеток, связанных с заболеванием, химическую активацию для выявления различий в функциональных реакциях и подготовку РНК к транскриптомному профилированию. В текущем протоколе химическая активация была выполнена с использованием форбол миристата ацетата (PMA) и ионофора кальция (A23187)18,19, поскольку предыдущие исследования показали дефектную передачу сигналов рецептора Т-клеток в CTCL, а стимуляция PMA / A23187 обходит Т-клеточный рецептор20,21. Кроме того, PMA/A23187 позволяет более прямую проксимальную активацию ядерных сигналов, необходимых для активации гена цитокинов. Наконец, стимуляция Т-клеток обеспечивает дополнительный уровень понимания регуляции экспрессии генов, который не может быть получен из покоящихся Т-клеток, где динамические изменения отсутствуют.
протокол
Клетки человека потенциально заразны. Поэтому эксперименты проводятся строго в соответствии с требуемыми мерами предосторожности и процедурами, обсуждаемыми как управление по безопасности и гигиене труда (OSHA) и средства индивидуальной защиты (PPE).
1. Выделение ПБМК из цельной крови
- Соберите все необходимые материалы из таблицы 1 и доведите их до комнатной температуры (RT). Теплый RP10F до 37 °C. Отрегулируйте центрифугу на RT. За исключением центрифугирования и подсчета клеток, выполните все этапы, используя жизнеспособные ячейки в шкафу биологической безопасности.
- Получают кровь в пяти пробирках по 10 мл (необходимое количество), содержащих антикоагулянт. Хранить цельную кровь при температуре окружающей среды (18\u201224 °C). Маркировка разделительных пробирок объемом 50 мл с номером субъекта исследования на людях для образца крови, подлежащего обработке.
- Переведите 10\u201215 мл крови в каждую разделительную трубку (трубки) с соответствующим номером субъекта. Разбавьте кровь не менее чем в 2 раза сбалансированным солевым раствором Хэнка (HBSS). Не превышать 35 мл разбавленной крови на пробирку.
- Осторожно и медленно подложите кровь ~13 мл плотности среды. Следите за прозрачной плотной средой в нижней части трубки и прекратите пипетку, когда пипетка почти пуста (чтобы предотвратить высвобождение пузырьков). Осторожно снимите пипетку, чтобы избежать смешивания слоев крови и плотности среды.
- Аккуратно перенесите заполненные разделительные трубки на центрифугу, не нарушая слои.
- Центрифуга при 500 x g в течение 30 мин с выключенным тормозом центрифуги (замедление установлено на ноль).
ПРИМЕЧАНИЕ: Если центрифуга отображает только обороты, обратитесь к спецификациям ротора, чтобы оценить эквивалент оборотов для 500 x g. - Осторожно снимите разделительные трубки с центрифуги, не нарушая слоев. Наблюдайте за пышной оболочкой, которая образовалась между плотностью среды и слоями плазмы.
- Пипетку сверху удаляют и выбрасывают большую часть верхней фракции плазмы, чтобы 10 мл оставалось над пухлым слоем. Аккуратно и медленно соберите пышную шерсть. Переложите баффи из двух разделительных трубок в новую предварительно маркированную и стерильную трубку объемом 50 мл, как показано на рисунке 1.
- Разбавить НБМК не менее чем в 2 раза HBSS, доведя объем в каждой новой трубке до 50 мл. Не забудьте переключить тормоз центрифуги на полный. Пеллетные НБМК центрифугированием при 400 х г в течение 10 мин. Удалите супернатант как можно больше и постучите по дну трубки, чтобы ослабить гранулу.
- Чтобы лизировать остаточные эритроциты (эритроциты), повторно суспендируйте каждую клеточную гранулу в 1\u20122 мл буфера лизиса аммония-хлорида-калия (ACK) на 10 мл исходного объема крови. Инкубировать ровно 5 мин. Своевременно прекратить лизис с равным или большим объемом HBSS и отрегулировать объем до 50 мл. Центрифуга при 400 х г в течение 10 мин.
- Извлеките супернатант и постучите по дну трубки, чтобы ослабить гранулу ячейки. Объединяйте клетки от одного донора. Доведите объем до 50 мл с HBSS. Центрифуга при 400 х г в течение 10 мин.
- Извлеките супернатант и постучите по дну трубки, чтобы ослабить гранулу ячейки. Повторно суспендировать клетки в 10 мл теплой среды RP10F и взять аликвоту для подсчета жизнеспособных клеток с использованием трипан-синего.
- Рассчитайте общее количество клеток в каждом образце с помощью гемоцитометра.
2. Очистка CD4 +CD45RO+ Т-клеток от PBMCs
ПРИМЕЧАНИЕ: Очистка CD4+CD45RO+ Т-клеток от НБМК осуществляется с использованием коммерчески доступной магнитной сепарации (см. Таблицу материалов) с незначительными модификациями. Предпочтительно следовать руководству по набору для инкубационного времени, так как каждый коммерческий комплект имеет свои собственные инструкции.
- Промыть нужное количество НБМК в 10 мл селекционного буфера. Центрифуга при 400 х г в течение 10 мин. Удалите супернатант и постучите по дну трубки, чтобы ослабить гранулу.
- Разбавьте НБМК до 5 x 107 ячеек/мл в буфере отбора и переложите их в трубку круглого дна 5 мл полистирола (12 x 75 мм).
- Добавьте 50 мкл коктейля антител на 1 мл образца и аккуратно перемешайте. Инкубировать при комнатной температуре в течение 5 мин.
- Непосредственно перед использованием вихревые магнитные частицы в течение 30 сек на высокой скорости. Добавьте 50 мкл магнитных частиц на 1 мл образца в пробирку, содержащую МПК, и осторожно перемешайте.
- Доведите объем до 2,5 мл с буфером выделения и аккуратно перемешайте. Поместите трубку (без крышки) в магнит и инкубируйте на RT в течение 2,5 мин.
- Поднимите магнит и в непрерывном движении переверните магнит и трубку, чтобы налить обогащенную клеточную суспензию в новую стерильную трубку.
- Чтобы увеличить извлечение, добавьте 2,5 мл буфера отбора в трубку, оставшуюся в магните, не нарушая обездвиженные шарики. Держите в магните еще 2,5 минуты и повторите шаг 2,6, чтобы восстановить дополнительные ячейки.
- Возьмите аликвоту для подсчета жизнеспособных клеток с помощью трипан-синего цвета. Рассчитайте общее количество ячеек с помощью гемоцитометра или счетчика клеток.
- Подтвердите чистоту методом проточной цитометрии (рисунок 3).
3. Химическая активация
- Отрегулируйте CD4 +CD45RO+ Т-клетки до 5 x 106 клеток/мл с теплой средой RP10F и распределите клетки по чашкам для культивирования нужного размера. Покоящиеся клетки в увлажненном инкубаторе 37 °C 5% CO2 в течение ночи.
- Гранулированные отстоявшие ячейки центрифугированием при 400 х г в течение 10 мин. Извлеките супернатант и постучите по дну трубки, чтобы ослабить гранулу ячейки.
- Отрегулируйте концентрацию клеток до 5 x 106 клеток/мл с теплой средой RP10F и распределите 0,5\u20121 x 107 клеток в каждую из трех стерильных трубок с винтовой крышкой.
ПРИМЕЧАНИЕ: При наличии достаточного количества клеток в экспериментальный проект могут быть включены дублирующие стимуляции или дополнительные временные точки. - Стимулируют клетки в пробирках 2 и 3 с помощью PMA и A23187. Добавьте PMA до 25 нг/мл и A23187 до 500 нг/мл и аккуратно перемешайте. Добавьте равный объем диметилсульфоксида (ДМСО) к ячейкам в трубке 1, которая будет служить транспортным средством (контролем). Например, если используется 1 мкл PMA и 1 мкл A23187, то добавьте 2 мкл DMSO в трубку транспортного средства. Держите конечную концентрацию ДМСО ниже 0,5% во всех пробирках.
- Ослабьте колпачки на трубках и верните ячейки в инкубатор 37 °C 5% CO2 в течение 2 ч (трубка 2) и 6 ч (трубки 1 и 3). В указанное время центрифужные ячейки по 500 х г в течение 10 мин.
- Перед лизисом выбросьте как можно больше супернатанта, не нарушая клеточную гранулу.
- Быстро лизируйте клетки, как указано в инструкциях из коммерчески доступного комплекта изоляции РНК (см. Таблицу материалов). Продолжайте выделение РНК или замораживайте лизат при -80 °C для последующей обработки дополнительными образцами.
ПРИМЕЧАНИЕ: Чистота и целостность РНК могут быть проверены с помощью микрокапиллярного электрофореза. - Необязательно: Чтобы полностью удалить все следы ДНК из очищенного образца РНК, используйте набор для очистки РНК (см. Таблицу материалов) в соответствии с инструкциями производителя.
Результаты
Этот протокол включает в себя процедуры выделения PBMCs из крови SS, очистку CD4 + CD45RO + Т-клеток отрицательным отбором, стимуляцию очищенных Т-клеток и выделение общей РНК для транскриптомного профилирования. На рисунке 1 описан процесс выделения ПБМК из цельной крови. Обратите внимание, что общий выход SS PBMCs будет варьироваться в зависимости от начального объема крови и циркулирующей опухолевой нагрузки каждого пациента. В нашей лаборатории средний выход SS PBMCs составил 4,6 × 106 клеток/мл цельной крови (1,85 × 106 – 3,25 х 107 клеток/мл на 7 SS). Средняя жизнеспособность изолированных НБМК составила 95\u201299%. На рисунке 2 показана высокая чистота и жизнеспособность выбранных Т-клеток памяти CD4+CD4+. Средний выход CD4+CD45RO+ Т-клеток из SS PBMCs составил 75% (75,6% – 84%), по сравнению с 15,9% (3% – 30%) из нормальных донорских (ND) PBMC, полученных из камер системы лейкоредукции (LRS). Жизнеспособность и чистота CD4+CD45RO+ Т-клеток, полученных по этому протоколу отрицательного отбора, неизменно высока (рисунок 3).
Ранее мы объединили протокол активации выше с микрочипами для изучения функциональных изменений в транскриптомах как SS, так и ND Т-клеток и продемонстрировали, что Т-клетки памяти SS и SS PBMCs плохо экспрессируют цитокин и другие гены иммунного ответа по сравнению с ND T-клетками и PBMCs 19,22,23. На рисунке 4 показана надежная активация нескольких генов цитокинов, включая IL4, IL 10, IL13 и IL22 в ND Т-клетках, но не в Т-клетках SS. Этот дефект функциональной экспрессии генов в Т-клетках SS с тех пор был подтвержден другими группами24. Кроме того, многие гены, обычно не экспрессируемые в ND Т-клетках, высоко экспрессируются в Т-клетках SS, как в состоянии покоя, так и после стимуляции (рисунок 4). К ним относятся ранее описанные гены биомаркеров SS DNM3, PLS3, TOX и TWIST1 25,26,27, а также ANK1 и SGCE, о которых впервые сообщила наша группа. Эти положительные биомаркеры высоко выражены в SS, но не ND, и избегают технических ловушек, связанных с отрицательными биомаркерами.
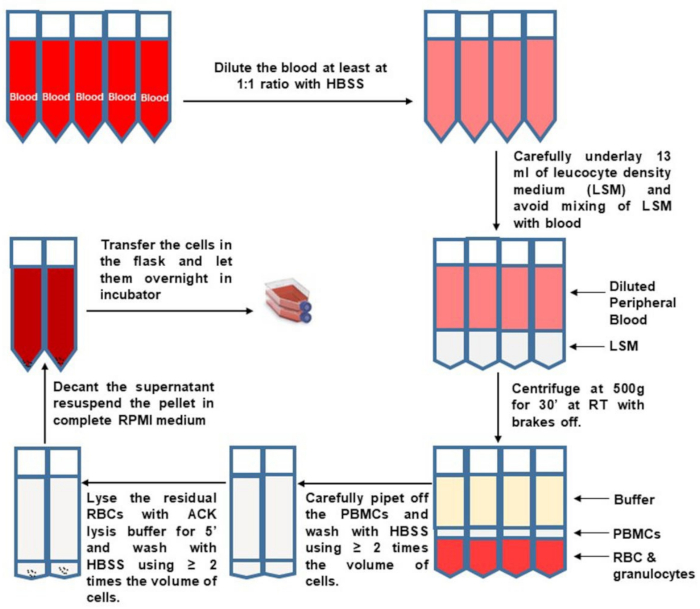
Рисунок 1: Выделение ПБМК из цельной крови. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
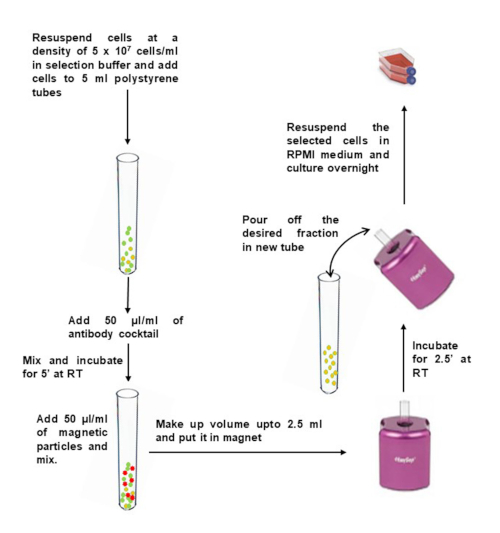
Рисунок 2: Отрицательный выбор Т-клеток памяти CD4+ из изолированных PBMC. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
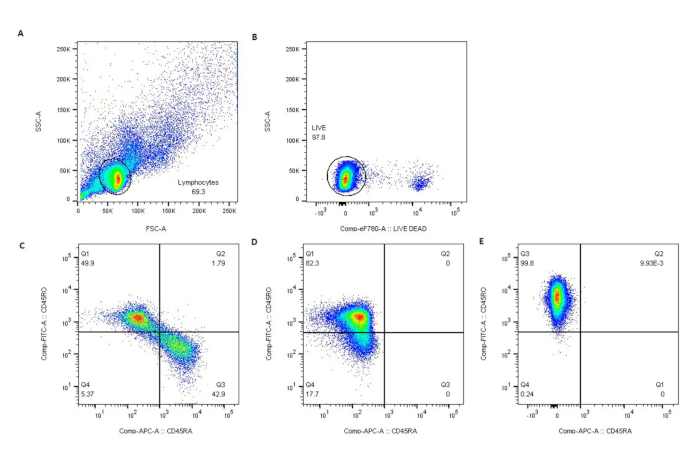
Рисунок 3: Чистота CD4+CD45RO+ Т-клеток была подтверждена проточной цитометрией. Лимфоциты были закрыты рассеянием света (A), живые лимфоциты исключали краситель жизнеспособности eFluor780 (B) и (C) представляли собой невыбранных нормальных доноров (ND). Отрицательный отбор привел к почти чистым популяциям CD45RO+ Т-клеток у пациентов с ND (D) и SS (E). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
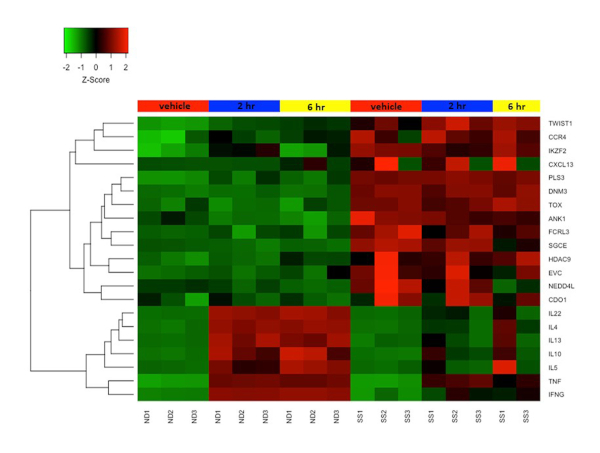
Рисунок 4: Дифференциальная экспрессия генов в покоящихся и активированных Т-клетках памяти CD4+CD45RO+ из SS и ND. Экспрессия гена z-score представлена цветовой шкалой от красного (высокая экспрессия) до зеленого (низкая экспрессия). Цветные полосы в верхней части тепловой карты представляют собой клеточные обработки: макет / транспортное средство обработано (красный), 2 ч стимулировано (синий) и 6 ч стимулировано (желтое). Несколько генов биомаркеров SS высоко экспрессированы, а гены цитокинов плохо экспрессируются в Т-клетках SS по сравнению с ND Т-клетками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Реагентов | |
| Среда плотности | Среда разделения лимфоцитов, Фиколл-Гипак или эквивалентная среда плотности с плотностью = 1,077-1,080 г/мл при20oC. |
| HBSS | 1x сбалансированный солевой раствор Хэнка, 4,2 мМ NaHCO3, 10 мМ HEPES, рН 7,2 |
| РП10Ф | RPMI 1640 среда, 10 % термоинактивированная фетальная бычья сыворотка (FBS), 1x пенициллин-стрептомицин раствор, рН 7,2 |
| Буфер лизиса ACK | 155 мМ NH4Cl, 10 мМ KHCO3, 0,1 мМ Na2ЭДТА, нет необходимости регулировать рН. Он должен быть ~ 7.3. |
| Буфер выбора | 1x HBSS, 2% FBS, 2 мМ ЭДТА |
| форбол12-миристат13-ацетат (ПМА) | 50 мкг/мл в ДМСО |
| Ионофор A23187 | 500 мкг/мл в ДМСО |
Таблица 1: Реагенты.
Обсуждение
Разработано несколько способов изоляции НБМК, и каждый из них имеет свои преимущества и ограничения28. Мы обычно собираем до 50 мл крови в пяти пробирках по 10 мл, содержащих антикоагулянты. Объем крови для выделения PBMC зависит от нескольких факторов, таких как здоровье и возраст субъекта исследования, а также от опыта флеботомиста. Важнейшим процедурным этапом в протоколе является формирование градиента шага. Плохое наслоение может привести к частичному или полному отказу МПК отложения на границе раздела. Мы предпочитаем метод подслоения, описанный здесь, так как легко начать нижний слой. Чтобы полностью дозировать всю плотность среды ниже крови, очень важно использовать помощь пипетки без утечек воздуха. Загрязнение фракции PBMC нежелательными типами клеток может быть сведено к минимуму путем тщательного и последовательного сбора пышного слоя, который должен выполняться одинаково для каждой изоляции. Если НБМК не будут дополнительно фракционироваться, следует избегать сбора различных количеств градиента плотности и слоев плазмы между выделениями. Лизис эритроцитов проводится для минимизации потенциального воздействия загрязняющих РНК и РНК, полученных из ретикулоцитов, на последующие анализы экспрессии генов. Гипотонический лизис будет ингибироваться избытком изотонического буфера.
Дальнейшая изоляция подмножества Т-клеток важна для молекулярных исследований. Здесь мы описали последующий выбор CD4 + CD45RO + Т-клеток отрицательным выделением для удаления нежелательных типов клеток. Отрицательный отбор опирается на антитела, распознающие специфические маркеры клеточной поверхности для всех нежелательных клеток. Клетки, покрытые антителами, затем удаляются магнитными шариками. Этот протокол отбора удаляет нежелательные клетки, позволяя нетронутым и нестимулированным клеткам-мишеням оставаться свободно плавающими, что важно для изучения активации генов. Тем не менее, необходимо соблюдать осторожность, чтобы избежать сгустков клеток, которые снижают окончательную чистоту выбранных CD4 + CD45RO + Т-клеток. Этилендиаминтетрауксусная кислота (ЭДТА), присутствующая в буфере отбора, сводит к минимуму слипание клеток. Выход Т-клеток зависит от таких факторов, как начальный объем крови, переменные пациента, такие как лечение, вводимое пациенту, и стадия заболевания во время сбора образца. Лечение, проводимое пациентам, может также влиять на жизнеспособность клеток. Кроме того, сбор образцов перед любой процедурой, такой как фотоферез, также оказывает положительное влияние на чистоту CD4 + CD45RO + Т-клеток. Мы заметили, что сбор образцов после процедуры лечения фотоферезом оказывает негативное влияние на выход CD4 + CD45RO + Т-клеток.
Клоны опухолевых Т-клеток пациентов с SS чаще всего экспрессируют поверхностные маркеры, согласующиеся со зрелым фенотипом CD4 Т-клеток памяти29,30. Однако фенотипическая пластичность иногда наблюдалась в отношении поверхностных маркеров, включая CD4, CD45RO, CD45RA, CD7 и/или CD2631. Предыдущие исследования также показали гетерогенность экспрессии CD45RO и CD45RA среди пациентов с SS29, тогда как большинство случаев SS по-прежнему являются CD45RO+. Roelens et al.31 также показали, что SS может демонстрировать межиндивидуальную и внутриотраждаемую гетерогенность со смешанной популяцией наивной (TN), центральной памяти (TCM), переходной памяти (TTM), эффекторной памяти (TEM) и терминальной эффекторной памяти (TEMRA). Однако их результаты ясно показывают, что большинство клеток SS имеют фенотип ТКМ. Мы сосредоточили наше исследование на поверхностном иммунофенотипе CD45RO+, наиболее распространенном у пациентов с SS, и подтвердили фенотип с помощью проточной цитометрии. При планировании исследований подмножеств Т-клеток у пациентов важно учитывать фенотипическую гетерогенность изучаемого заболевания, и поэтому стратегия очистки может быть скорректирована по мере необходимости для получения желаемой популяции Т-клеток для анализа.
Существует несколько способов стимуляции Т-клеток и PBMCs для изучения функциональной экспрессии генов. Мы предпочитаем химическую активацию (PMA + Ионофор A23187), так как нас интересует регуляция генов в ядре. Химическая активация является лучшим вариантом для этой цели, поскольку она действует как широкий активатор и является более однородной по сравнению с антиген-специфической стимуляцией. ПМА представляет собой небольшое органическое соединение, которое диффундирует через клеточную мембрану в цитоплазму и непосредственно активирует протеинкиназу C. A23187 позволяет кальцию проходить через мембраны. Эти соединения обходят поверхностные рецепторы и вместе имитируют эффекты лигирования рецепторов Т-клеток с костимуляцией, опосредованной CD28. Химические вещества активируют несколько внутриклеточных сигнальных путей, что приводит к активации фактора ядерной транскрипции и повышению регуляции генов цитокинов, которые доступны для активации транскрипции. Хотя химическая активация и лигирование CD3CD28 производят поразительно похожие глобальные профили экспрессии генов в нормальных клетках32, химическая активация с PMA + A23187 является хорошим выбором, поскольку Т-клетки SS могут терять экспрессию поверхностных рецепторов, включая компонентыTCR 33. Chong et al.22 сравнили активацию генов цитокинов между PMA/A23187 с антителами против CD3 и анти-CD28 в PBMCs у нормальных, ранних MF/CTCL и поздних MF/CTCL пациентов. Они сообщили, что PMA / A23187 вызвал более быструю и интенсивную активацию гена IL-2 по сравнению со стимуляцией против CD3 / CD28. Кроме того, они показали, что более медленная кинетика активации с антителами против CD3 / CD28 потенциально происходит от сшивки и мембранной сигнализации, необходимой для стимуляции. Кроме того, тенденции экспрессии цитокинов среди различных изученных клеточных популяций были сохранены с PMA/A23187. Поскольку мы заинтересованы в активации экспрессии генов, химическая стимуляция является идеальным подходом, поскольку она действует как широкий активатор и более последовательна по сравнению с антиген-специфической стимуляцией. Лигирование CD3/CD28 идеально подходит для исследования путей, важных для мембранной сигнальной трансдукции. Кроме того, химическая активация дешевле и не требует специального оборудования. В текущем исследовании PMA + A23187 значительно активировали гены цитокинов в ND, но не в Т-клетках SS, предполагая, что Т-клетки SS имеют функциональные недостатки после TCR.
Таким образом, этот протокол обеспечивает фенотипически чистые Т-клетки из драгоценной крови пациента и метод оценки общегеномных изменений в функциональной экспрессии генов. Мы демонстрируем, что транскриптомное профилирование Т-клеток SS по сравнению с нормальными CD45RO+ Т-клетками выявляет глубокие различия в активации генов в свежих Т-клетках человека у пациентов с CTCL. Эти исследования помогут в разработке диагностических биомаркеров и терапевтических стратегий, нацеленных на новые маркеры в CTCL. Кроме того, эта стратегия и протокол при изучении первичных Т-клеток человека могут быть полезны для адаптации к исследованиям других Опосредованных Т-клетками заболеваний.
Раскрытие информации
Авторам нечего раскрывать.
Этическое раскрытие:
Этот протокол исследования был одобрен Институциональным наблюдательным советом (IRB) Университета Арканзаса по медицинским наукам (UAMS, Little Rock, AR) Данные микрочипов, представленные в этом исследовании, были сделаны на образцах, набранных в соответствии с протоколом исследования, одобренным IRB больницы Генри Форда (Детройт, штат Мичиган).
Благодарности
Мы благодарим пациентов и добровольцев, которые участвовали в нашем исследовании.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 ml microcentrifuge tubes | Fisher Scientific | 02-681-320 | |
| 10 ml Disposable Plastic Pipette | Thermo Scientific | 170356 | |
| 1000 ul Pipet tips | VWR | 10017-038 | |
| 15 ml Conical Tubes | Corning | 352196 | |
| 25 ml Disposable Plastic Pipette | Thermo Scientific | 170357 | |
| 5 ml Disposable Plastic Pipette | Thermo Scientific | 170355 | |
| 50 ml Conical Tubes | Thermo Scientific | 339652 | |
| A23187 ionophore | Fisher Scientific | BP595 | |
| Centrifuge | Thermo Scientific | 75004381 | |
| DMSO | Sigma | D2650-5x5ml | |
| EasySep Human Memory CD4+ T cell Enrichment Kit | StemCell | 19157 | |
| FBS | GIBCO | 16140-071 | |
| HBSS | GIBCO | 14185-052 | |
| HEPES | Fisher Bioreagents | BP310-500 | |
| KHCO3 | Fisher Bioreagents | P184-500 | |
| Lymphocyte Separation Medium | Corning | 25-072-CV | |
| Na2EDTA | ACROS | 10378-23-1 | |
| NaHCO3 | Fisher Bioreagents | S233-500 | |
| NH4Cl | Fisher Bioreagents | A661-500 | |
| Penicillin-streptomycin solution | GIBCO | 15140122 | |
| phorbol12-myristate13-acetate (PMA) | Sigma | P-8139 | |
| Pipet-Lite LTS Pipette L-1000XLS+ | RAININ | 17014382 | |
| Pipet-Lite LTS Pipette L-10XLS+ | RAININ | 17014388 | |
| Pipet-Lite LTS Pipette L-200XLS+ | RAININ | 17014391 | |
| Pipet-Lite LTS Pipette L-20XLS+ | RAININ | 17014392 | |
| RNA Clean & Concentrator-5 | Zymo Research | R1013 | |
| Rneasy Plus Mini Kit | Qiagen | 74136 | |
| RPMI 1640 | GIBCO | 31800-022 | |
| T-25 Flask | Thermo Scientific | 2024-10 |
Ссылки
- Kim, E. J., et al. Immunopathogenesis and therapy of cutaneous T cell lymphoma. Journal of Clinical Investigation. 115, 798-812 (2005).
- Wong, H. K., et al. Evolving Insights in the Pathogenesis and Therapy of Cutaneous T-cell lymphoma (Mycosis Fungoides and Sezary Syndrome). British Journal of Haematology. 155 (2), 150-166 (2011).
- Whittaker, S. Biological insights into the pathogenesis of cutaneous T-cell lymphomas (CTCL). Seminars in oncology. 33 (3), 3-6 (2006).
- Kallinich, T., et al. Chemokine receptor expression on neoplastic and reactive T cells in the skin at different stages of Mucosis Fungoides. Journal of Investigative Dermatology. 121 (5), 1045-1052 (2003).
- Rodd, A. L., et al. Current and Emerging Therapeutics for Cutaneous T-Cell Lymphoma: Histone Deacetylase Inhibitors. Lymphoma. 2012, Article ID 290685 1-10 (2012).
- Olsen, E., et al. Revisions to the staging and classification of mycosis fungoides and Sezary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the cutaneous lymphoma task force of the European Organization of Research and Treatment of Cancer (EORTC). Blood. 110, 1713-1722 (2007).
- Hameetman, L., et al. EPHA4 is overexpressed but not functionally active in Sézary syndrome. Oncotarget. 6 (31), 31868-31876 (2015).
- Willemze, R., et al. WHO-EORTC classification for cutaneous lymphomas. Blood. 105, 3768-3785 (2005).
- Bradford, P. T., et al. Cutaneous lymphoma incidence patterns in the United States: a population-based study of 3884 cases. Blood. 113, 5064-5073 (2009).
- Wilson, L. D., et al. Age, race, sex, stage, and incidence of cutaneous lymphoma. Clinical Lymphoma Myeloma and Leukemia. 12, 291-296 (2012).
- Li, Y., et al. Management of cutaneous T cell lymphoma: new and emerging targets and treatment options. Cancer Management and Research. 4, 75-89 (2012).
- Korgavkar, K., et al. Changing incidence trends of cutaneous T-cell lymphoma. Jama Dertmatology. 149 (11), 1295-1299 (2013).
- Dulmage, B. O., Geskin, L. J. Lessons learned from gene expression profiling of cutaneous T-cell lymphoma. British Journal of Dermatology. 169 (6), 1188-1197 (2013).
- Boonk, S. E., et al. Evaluation of Immunophenotypic and Molecular Biomarkers for Sézary Syndrome Using Standard Operating Procedures: A Multicenter Study of 59 Patients. Journal of Investigative Dermatology. 136 (7), 1364-1372 (2016).
- Scarisbrick, J. J., et al. Cutaneous Lymphoma International Consortium Study of Outcome in Advanced Stages of Mycosis Fungoides and Sézary Syndrome: Effect of Specific Prognostic Markers on Survival and Development of a Prognostic Model. Journal of Clinical Oncology. 10 (33), 3766-3773 (2015).
- Benoit, B. M., et al. CD164 identifies CD4+ T cells highly expressing genes associated with malignancy in Sézary syndrome: the Sézary signature genes, FCRL3, Tox, and miR-214. Archives of Dermatological Research. 309, 11-19 (2017).
- Dulmage, B., et al. The biomarker landscape in mycosis fungoides and Sézary syndrome. Experimental Dermatology. 26 (8), 668-676 (2017).
- Pick, E., et al. Intracellular Mediation of Lymphokine Action: Mimicry of Migration Inhibitory Factor (MIF) Action by Phorbol Myristate Acetate (PMA) and the Ionophore A23187. Annals of the New York Academy of Sciences. 94 (332), 378-394 (1979).
- Chong, B. F., et al. Induced Sézary syndrome PBMCs poorly express immune response genes up-regulated in stimulated memory T cells. Journal of Dermatological Science. 60 (1), 8-20 (2010).
- Fargnoli, M. C., et al. Diminished TCR signaling in cutaneous T cell lymphoma is associated with decreased activities of Zap70, Syk and membrane-associated Csk. Leukemia. 11, 1338-1346 (1997).
- Hansen, E. R., et al. Leukemic T cells from patients with cutaneous T-cell lymphoma demonstrate enhanced activation through CDw60, CD2, and CD28 relative to activation through the T-cell antigen receptor complex. Journal of Investigative Dermatology. , 667-673 (1993).
- Chong, B. F., et al. Immune Function Abnormalities in Peripheral Blood Mononuclear Cell Cytokine Expression Differentiates Stages of Cutaneous T-Cell Lymphoma/Mycosis Fungoides. Clinical Cancer Research. 14 (3), 646-653 (2008).
- Moerman-Herzog, A. M., et al. Transcriptome analysis of Sézary syndrome and lymphocytic-variant hypereosinophilic syndrome T cells reveals common and divergent genes. Oncotarget. 10, 5052-5069 (2019).
- Fanok, M. H., et al. Role of Dysregulated Cytokine Signaling and Bacterial Triggers in the Pathogenesis of Cutaneous T-Cell Lymphoma. Journal of Investigative Dermatology. 138, 1116-1125 (2018).
- Su, M. W., et al. Aberrant expression of T-plastin in Sezary cells. Cancer Research. 63, 7122-7127 (2003).
- van Doorn, R., et al. Aberrant expression of the tyrosine kinase receptor EphA4 and the transcription factor twist in Sezary syndrome identified by gene expression analysis. Cancer Research. 64, 5578-5586 (2004).
- Booken, N., et al. Sezary syndrome is a unique cutaneous T-cell lymphoma as identified by an expanded gene signature including diagnostic marker molecules CDO1 and DNM3. Leukemia. 22, 393-399 (2008).
- Dagur, P. K., McCoy, J. P. Collection , storage, and preparation of human blood cells. Current Protocol Cytometry. 73, 1-16 (2016).
- Fierro, M. T., et al. Heterogeneity of Circulating CD4+ Memory T-cell Subsets in Erythrodermic Patients: CD27 Analysis Can Help to Distinguish Cutaneous T-cell Lymphomas From Inflammatory Erythroderma. Dermatology. 216 (3), 213-221 (2008).
- Campbell, J. J., et al. Sézary syndrome and mycosis fungoides arise from distinct T-cell subsets: a biologic rationale for their distinct clinical behaviors. Blood. 116 (5), 767-771 (2010).
- Roelens, M., et al. Circulating and skin-derived Sezary cells: clonal but with phenotypic plasticity. Blood. 130 (12), 1468-1471 (2017).
- Diehn, M., et al. Genomic expression programs and the integration of the CD28 costimulatory signal in T cell activation. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11796-11801 (2002).
- Fuji, K. New therapies and immunological findings in cutaneous T-cell lymphoma. Frontiers in Oncology. 8, 12-28 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены