Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Включение компенсации в режиме реального времени в быстрых фотохимических окислениях белков для определения изменений топографии белка
В этой статье
Резюме
Быстрое фотохимическое окисление белков является новым методом структурной характеристики белков. Различные растворители добавок и лигандов имеют разнообразные гидроксиловые радикальные свойства очистки. Для сравнения структуры белка в различных условиях для нормализации реакции требуется компенсация в режиме реального времени гидроксиловых радикалов, генерируемых в реакции.
Аннотация
Быстрое фотохимическое окисление белков (FPOP) является методом структурной биологии на основе масс-спектрометрии, который зондирует доступную к растворителям поверхностную область белков. Этот метод опирается на реакцию аминокислотных боковых цепей с гидроксильными радикалами, свободно рассеивающихся в растворе. FPOP генерирует эти радикалы на месте с помощью лазерного фотолиза перекиси водорода, создавая взрыв гидроксиловых радикалов, который истощается в порядке микросекунды. Когда эти гидроксиловы радикалы реагируют с растворителем доступной аминокислотной боковой цепи, реакционные продукты демонстрируют массовый сдвиг, который может быть измерен и количественно масс-спектрометрии. Поскольку скорость реакции аминокислоты частично зависит от средней доступной поверхности растворителя этой аминокислоты, измеренные изменения в количестве окисления данной области белка могут быть непосредственно связаны с изменениями в доступности растворителя этого региона между различными конформациями (например, лиганд-связанных по сравнению с лиганд-бесплатно, мономер против агрегата и т.д.) FPOP был применен в ряде проблем в биологии, в том числе белково-белковых взаимодействий, белковых конформациальных изменений, а также связывания белка-лиганда. Поскольку доступная концентрация гидроксиловых радикалов варьируется в зависимости от многих экспериментальных условий в эксперименте FPOP, важно контролировать эффективную радикальную дозу, которой подвергается белковый аналит. Этот мониторинг эффективно достигается путем включения inline дозиметра для измерения сигнала от реакции FPOP, с лазерным гриппом регулируется в режиме реального времени для достижения желаемого количества окисления. С помощью этой компенсации изменения в топографии белка, отражающие конформацию изменений, лиганд-связывающих поверхностей, и / или белково-белкового взаимодействия интерфейсы могут быть определены в неоднородных образцов с использованием относительно низкого количества выборки.
Введение
Быстрая фотохимическая окисление белков (FPOP) является новым методом определения топографических изменений белка сверхбыстрой ковалентной модификацией поверхности растворителя, за которой следует обнаружение LC-MS1. FPOP генерирует высокую концентрацию гидроксиловых радикалов на месте с помощью ультрафиолетового лазерного флэш-фотолиза перекиси водорода. Эти гидроксиловые радикалы очень реактивны и недолговечны, потребляются примерно на микросекундной шкале времени в условиях FPOP2. Эти гидроксиловые радикалы рассеиваются через воду и окисляют различные органические компоненты в растворе с кинетической скоростью, как правило, начиная от быстрых(10 6 М -1 с-1) додиффузионнно-контролируемых3. Когда гидроксил радикал сталкивается с белковой поверхностью, радикал окисляет аминокислотные боковые цепи на поверхности белка, что приводит к массовому сдвигу этой аминокислоты (чаще всего чистого добавления одного атома кислорода)4. Скорость реакции окисления у любой аминокислоты зависит от двух факторов: присущей реакции этой аминокислоты (которая зависит от боковой цепи и контекстапоследовательности) 4, 5идоступности этой боковой цепи к диффузиву гидроксильного радикала, который тесно коррелирует со средней доступнойплощадью поверхности растворителя 6,,7. Все стандартные аминокислоты, за исключением глицина, были отмечены как помеченные этими высокореактивными гидроксиловыми радикалами в экспериментах FPOP, хотя и с широко отличающимися урожаями; на практике, Ser, Thr, Asn и Ala редко рассматриваются как окисленые в большинстве образцов, за исключением высоких радикальных доз и выявленных тщательной и чувствительной целевой фрагментации ETD8,9. После окисления, образцы утоляются для удаления перекиси водорода и вторичных окислителей (супероксид, синглетный кислород, пептидил гидропероксиды и т.д.) Утоленые образцы затем протеолитически усваиваются для генерации смесей окисленых пептидов, где структурная информация замораживается как химический "снимок" в моделях продуктов окисления различных пептидов(рисунок 1). Хроматография жидкости в сочетании с масс-спектрометрией (LC-MS) используется для измерения количества окисления аминокислот в данном протеолитическом пептиде на основе относительной интенсивности окисленных и неоксидированных версий этого пептида. Сравнивая этот окислительный след одного и того же белка, полученного при различных конформативных условиях (например, лиганд-связанный по сравнению с лиганд-свободным), различия в количестве окисления данной области белка могут быть непосредственно связаны с различиями в растворительной доступной поверхностиобласти этого региона 6,7. Возможность предоставления белковой топографической информации делает FPOP привлекательной технологией для определения структуры высшего порядка белков, в том числе в белковых терапевтическихоткрытиях и разработках 10,,11.

Рисунок 1: Обзор FPOP. Поверхность белка ковалентно модифицирована высокореактивными гидроксильными радикалами. Гидроксиловы радикалы будут реагировать с аминокислотными боковыми цепями белка со скоростью, которая сильно зависит от растворителя доступности боковой цепи. Топографические изменения (например, из-за связывания лиганда, как показано выше) защитят аминокислоты в области взаимодействия от реакции с гидроксильными радикалами, что приведет к снижению интенсивности модифицированного пептида в сигнале LC-MS. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Различные компоненты, присутствующие в растворе FPOP (например, лиганды, эксципиенты, буферы) имеют различную активность очистки по отношению к гидроксильным радикалам, генерируемым лазерным фотолизом перекисиводорода 3. Аналогичным образом, небольшое изменение концентрации перекиси, лазерной беглости и буферного состава может изменить эффективную радикальную дозу, что делает воспроизведение данных FPOP сложным в образцах и между различными лабораториями. Поэтому важно иметь возможность сравнить дозу гидроксилового радикала, доступную для реакции с белком в каждом образце с использованием одного из нескольких доступныхгидроксилов радикальных дозиметров 12,,13,,14,,15,,16. Гидроксил радикальные дозиметры действуют, конкурируя с аналитом (и со всеми падальщиками в растворе) за пул гидроксиловых радикалов; эффективная доза гидроксиловых радикалов измеряется путем измерения количества окисления дозиметра. Отметим, что "эффективная гидроксиловая радикальная доза" является функцией как начальной концентрации генерируемого гидроксилового радикала, так и полуиллиона радикала. Эти два параметра частично зависят друг от друга, что делает теоретическое кинетическое моделирование несколько сложным(рисунок 2). Два образца могут иметь дико разные первоначальные радикальные периоды полуиму жизни, сохраняя при этом ту же эффективную радикальную дозу, изменяя начальную концентрацию гидроксилового радикала; они будут по-прежнему генерировать идентичныеследы 17. Аденин13 и Tris12 являются удобными гидроксильно-радикальными дозиметрами, потому что их уровень окисления может быть измерен с помощью УФ-спектроскопии в режиме реального времени, что позволяет исследователям быстро определить, когда есть проблема с эффективной гидроксиловой радикальной дозой и решить их проблему. Для решения этой проблемы важен стационарный дозиметр, расположенный в системе потока непосредственно после места облучения, который может контролировать сигнал от изменения абсорбции аденина в режиме реального времени. Это помогает в проведении экспериментов FPOP в буферах или любой другой excipient с широко различными уровнями гидроксиловой радикальной очистки потенциала17. Эта радикальная компенсация дозировки может быть выполнена в режиме реального времени, что дает статистически неразличимые результаты для того же конформера путем корректировки эффективной радикальной дозы.
В этом протоколе, у нас есть подробные процедуры для выполнения типичного эксперимента FPOP с радикальной компенсации дозировки с использованием аденина в качестве внутреннего оптического радикала дозиметра. Этот метод позволяет следователям сравнивать следы в условиях FPOP, которые имеют различную емкость очистки, выполняя компенсацию в режиме реального времени.
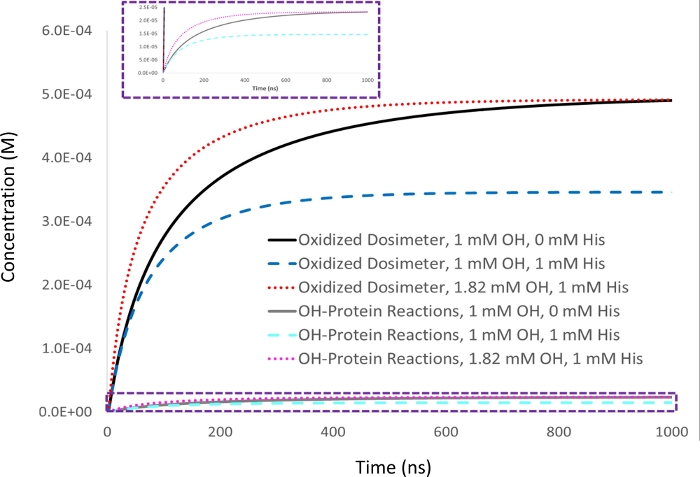
Рисунок 2: Кинетическое моделирование компенсации на основе дозиметрии. 1 мМ аденин дозиметр ответ измеряется в 5 мкм лизозима аналит с 1 мм начальной концентрации гидроксилового радикала (▪OH t1/2 и53нс), и установить в качестве целевого дозиметра ответ (черный). При добавлении 1 мМ от мусорщика экстракции гистидина, дозиметр ответ (синий) уменьшается вместе с количеством окисления белка в пропорциональном порядке (голубой). Сокращается также срок полусысли гиоксилового радикала (▪OH t1/2и39 ns). Когда количество гидроксилового радикала увеличивается, чтобы дать эквивалентный выход окисленного дозиметра в образце с 1 мМ гистидина мусорщика, как достигнуто с 1 мМ гидроксил радикал в отсутствие мусорщика (красный), количество окисления белка, что происходит аналогичным становится идентичным (пурента), в то время как гидроксил радикальных период полуиссяка уменьшается еще больше (▪OH t1/2).= Адаптировано с разрешения Sharp J.S., Am Pharmaceut Rev 22, 50-55, 2019. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
протокол
1. Подготовка оптической скамьи и капилляра для FPOP
ВНИМАНИЕ: KrF excimer лазеры являются крайними опасностями для глаз, и прямой или отраженный свет может привести к необратимому повреждению глаз. Всегда носите соответствующую защиту глаз, избегайте присутствия любых отражающих объектов вблизи пути луча, когда это возможно, и используйте инженерные элементы управления для предотвращения несанкционированного доступа к активному лазеру и для сдерживания любых бродячих отражений.
- Подготовь оптическую скамейку FPOP.
- Включите лазер, чтобы согреться. Установите лазер на внешний триггер, постоянная энергия, без замены газа. Установите лазерную энергию на пульс (обычно между 80-120 мДж/пульс).
- Настройка оптической скамейке с плано-выпуклый объектив (30 мм Dia. х 120 мм FL без покрытия) непосредственно на пути лазерного луча и не отражающей backstop поглощать свет, как показано на рисунке 3A.

Рисунок 3: Оптическая скамейка для эксперимента FPOP. (A) Образец смешивается с H2O2, аденин радикальный дозиметр, и глутамин мусорщик и загружается в шприц. Образец проталкивается через сплавленную капиллярную часть кремнезема через сфокусированную траекторию пучка ультрафиолетового лазера KrF excimer. УФ-излучение фотолизов H2O2 в гидроксиловые радикалы, который окисляет белок и дозиметр аденина. Поток шприца выталкивает освещенный образец с пути лазера перед следующим лазерным импульсом, с неосвещенным объемом исключения между освещенными областями. Сразу после окисления образец проходит через рядный УФ-спектрофотометр, который измеряет абсорбцию аденина в 265 нм. Затем образец откладывается в буфер утоления для устранения оставшихся H2O2 и вторичных окислителей. (B) размер пятна измеряется после облучения цветной липкой ноте, прикрепленной за капилляром с лазером на 248 нм. Ширина пятна используется для расчета скорости потока выборки, а силуэт капилляра в центре пятна используется для выравнивания оптической скамейки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- Вырежьте соответствующую длину сплавленного капилляра кремнезема (360 мкм внешнего диаметра и 100 мкм внутреннего диаметра) и с помощью рукава подключим к газоутягому шприцу с помощью разъема с низким мертвым объемом.
- Аккуратно сожгите полиимидное покрытие капилляра бутановым факелом в том месте, где рядный дозиметр считывает сигнал поглощения на 265 нм после лазерного воздействия образцов. Протрите мусор на капилляре осторожно с помощью метанола на ворсинке без салфетки. Полиимидное покрытие на месте лазерной заболеваемости может быть либо аналогичным образом сожжены с бутан факелом или сожгли с excimer лазерной стрельбы при низкой мощности.
ПРИМЕЧАНИЕ: Подождите, пока капилляр остынет, так как использование метанола на горячем капилляре является пожароопасным. - Поместите эту капиллярную часть через лучевой путь лазера и в стационарный дозиметр.
- Нажмите на рычаг в верхней части inline дозиметра, чтобы открыть шарнир. Удалите магнитные держатели. Поместите капилляр в обуздавленную канавку прикройного дозиметра, используя магнитные держатели, чтобы сохранить капилляр на месте. Закройте дозиметр шарниром над капилляром, прижимая его до тех пор, пока рычаг не запирается на месте.
- Используя программное обеспечение дозиметрии, нажмите на кнопку Start Flash, чтобы начать стрельбу эксимерным лазером. Установите заданную лазерную мощность между 50-100 мДж/пульс на само программное обеспечение лазерного управления и установите заданную частоту повторения между 10-20 Гц во вкладке Настройки программного обеспечения дозиметрии.
- Сосредоточьте лазерный луч с помощью плано выпуклый объектив, установленный на линейной моторизованной сцене. Измерьте ширину и высоту лазерного пятна в положении капилляра на липкой ноте именно с помощью калипера для расчета случайности (mJ/mm2), как показано на рисунке 3B.
- Поместите непрозрачную диафрагму рядом с капилляром, чтобы обеспечить последовательную освещенную ширину капилляра независимо от изменений в размере луча из-за движения объектива или изменения энергии на пульслазера 18.
- С лазерной стрельбой, переместить моторизованный этап через его диапазон движения. Убедитесь, что луч остается по центру диафрагмы и силуэт капилляра можно наблюдать во всем. Диаметр диафрагмы должен быть меньше, чем ширина посягающей сфокусированной балки в каждой точке диапазона моторизованной ступени.
- Запуск воды через капилляр на 20 йл / мин, по крайней мере одну минуту, чтобы вымыть капилляр.
- Нажмите кнопку «Стартовые данные» и «Автозеро» на программном обеспечении дозиметра, чтобы обнулить дозиметр до воды и начать сбор данных.
ПРИМЕЧАНИЕ: Если буферная система для FPOP имеет значительное абсорбцию УФ-излучения на уровне 265 нм, система FPOP должна быть обнулена буфером, а не водой.
- Нажмите кнопку «Стартовые данные» и «Автозеро» на программном обеспечении дозиметра, чтобы обнулить дозиметр до воды и начать сбор данных.
- Установите расчетную скорость потока на шприц-насосе.
- Скорость потока образца белка зависит от облученных объем на выстрел ( VIrr),количество лазерныхвыстрелов в секунду (R), и желаемого необлученных фракции объема исключения (FEx) для коррекции для эффектов ламинарного потока и диффузии образца (0,15-0,30 рекомендуется)2,19,20. Рассчитайте VIrr (в йл) на основе внутреннего диаметра капилляра в мм (d)и ширины лазерного пятна, посягая на капилляр (т.е. ширина диафрагмы) в мм (w) используя следующее уравнение:
VIrr и π (d/2)2w - Рассчитайте желаемую скорость потока (в йЛ/мин) на основе следующего уравнения:
Поток No 60RиVIrr (1 й FEx)»
- Скорость потока образца белка зависит от облученных объем на выстрел ( VIrr),количество лазерныхвыстрелов в секунду (R), и желаемого необлученных фракции объема исключения (FEx) для коррекции для эффектов ламинарного потока и диффузии образца (0,15-0,30 рекомендуется)2,19,20. Рассчитайте VIrr (в йл) на основе внутреннего диаметра капилляра в мм (d)и ширины лазерного пятна, посягая на капилляр (т.е. ширина диафрагмы) в мм (w) используя следующее уравнение:
2. Приготовление белкового раствора для FPOP
- Подготовка белка в двух или более различных условиях, которые будут сравниваться (например, лиганд-связанных и лиганд-бесплатно; агрегат и мономер; в одиночку и с белково-белковым связующим партнером; и т.д.) для обнаружения изменений конформации.
- Установите общий объем, используемый для FPOP, чтобы соответствовать потребностям эксперимента. Минимальный предел обычно зависит от объема капилляра облучения и материала, необходимого для надежного обнаружения и относительной количественной оценки, и будет варьироваться в зависимости в значительной степени от используемой системы LC-MS/MS и метода обработки образцов после маркировки. Общий объем растворов FPOP, обычно используемых в нашей группе, составляет 20 ЗЛ после добавления перекиси водорода. Окончательная концентрация белка, как правило, 1-10 МКМ, с 17 мМ глутамин (для ограничения срока службы гидроксилового радикала), 1 мМ аденин (действоватькак радикальный дозиметр) 13,17 и 10 мМ фосфат буфер (буфер, который является бедным мусорщик гидроксилов радикалов). Образцы, как правило, готовятся с несколькими репликациями, чтобы обеспечить статистическое моделирование результатов.
- Для большинства общих целей, подготовить образцы в тройной в обоих штатах, а также по крайней мере один образец для использования в качестве не-лазерного контроля для измерения фонового окисления. Подготовь 18 мл этой смеси растворов FPOP.
ПРИМЕЧАНИЕ: Многие буферы и добавки, обычно используемые в биохимии, являются гидроксильными радикальными падальщиками. Эти добавки и буферы могут быть использованы; однако, сокращение окисления из-за гидроксиловой радикальной очистки буфера может произойти. В целом, держать все добавки до минимума, необходимого биологической системы для максимального окисления белка выход. Диметил сульфоксид следует избегать из-за склонности к генерации вторичных радикалов; диметилформамид был полезной альтернативой в наших руках. При использовании буферов, которые являются сильными гидроксилов радикальных падальщиков, глутамин часто могут быть исключены из смеси раствора FPOP.
- Для большинства общих целей, подготовить образцы в тройной в обоих штатах, а также по крайней мере один образец для использования в качестве не-лазерного контроля для измерения фонового окисления. Подготовь 18 мл этой смеси растворов FPOP.
- Приготовьте перекись водорода 1 М непосредственно перед экспериментом FPOP.
ПРИМЕЧАНИЕ: 30% перекиси водорода, как обычно продаются поставщиками включает в себя стабилизатор, который увеличивает срок годности. После разбавления перекись водорода следует использовать быстро, определенно в течение того же дня. Перекись водорода также должна регулярно проходить тестирование на разложение FPOP с помощью гидроксилового радикального дозиметра. - Подготовь микроцентрифуговые трубки, содержащие 25 МКЛ раствора закалки 0,5 мкг/йл метамфетамина амида и 0,5 мкг/йл каталазы. Если для FPOP используется объем выборки, более 20 МКЛ, увеличьте объем раствора утоления пропорционально.
3. Выполните эксперимент FPOP
- Добавьте 2 мкл перекиси водорода в 18 МКЛ смеси раствора FPOP. Смешайте содержимое осторожно с пипеткой и быстро спина вниз раствор на дно микроцентрифуг труб. Немедленно соберите с газовым шприцем и загрузите в шприц-насос.
- Начните поток на насосе шприца с скоростью потока, определяемой в шаге 1.8.1 (обычно между 8-16 йл/мин), нажав кнопку Start Pump на программном обеспечении дозиметра.
- Мониторинг чтения аденина в режиме реального времени с помощью рядного дозиметра (см. таблицуматериалов) и собирать образец в отходах. Подождите, пока сигнал Abs265 стабилизируется.
- Нажмите на кнопку Start Flash в программном обеспечении дозиметра, чтобы начать стрельбу лазером с заданной скоростью повторения и энергией.
- Мониторинг чтения аденина в режиме реального времени с помощью рядного дозиметра (см. таблицу материалов); Разница в Abs265 с лазером выключен и лазером на является чтением qAbs265.
ПРИМЕЧАНИЕ: Появление крайне нестабильных показаний Abs265 при стрельбе лазером в присутствии перекиси водорода связано с генерацией пузырьков в растворе. Уменьшите количество лазера и/или концентрацию перекиси водорода для устранения пузырьков.
4. Выполнить компенсацию
ПРИМЕЧАНИЕ: Различные лиганды, буферы и т.д. могут иметь различную емкость очистки к гидроксильным радикалам. Важно обеспечить, чтобы сопоставимые эффективные дозы гидроксилового радикала были доступны для реакции с белком в различных образцах. Это достигается путем обеспечения равной гидроксиловой радикальной дозиметровой реакции между образцами. Используя аденин дозиметрию, изменение абсорбции УФ-излучения на уровне 265 нм(NoAbs 265) отражает эффективную дозу гидроксилового радикала; чем больше qAbs265, тем выше эффективная доза гидроксилового радикала.
- Сравните показания qAbs265, полученные с помощью inline дозиметра, с желаемымсчитыватель «Abs 265», полученный предыдущими экспериментами или управлением. Показания «AAbs265» ниже желаемых показаний указывают на недостаточную эффективную дозу гидроксиловых радикалов; показания «Abs265» указывают на слишком высокую эффективную радикальную дозу. Если показания qAbs265 находится на нужном уровне, соберите образец сразу после лазерного облучения в буфереутоления 17.
- Компенсируйте эффективную радикальную дозу, чтобы уравнять qAbs265. Эта компенсация может быть выполнена тремя способами: изменение концентрации перекиси водорода, увеличение лазерной флюенс путем изменения лазерной энергии на пульс, или увеличение лазерного гриппа путем изменения фокусной плоскости фокусировки объектива.
- Чтобы внести большие изменения (Nogt;10 mAU) в чтении qAbs265, переделать образец с более или менее перекиси водорода и повторно провести выборку в соответствии с разделом 3.
- Чтобы внести небольшое изменение в показаниях qAbs265 в режиме реального времени, отрегулируйте фокусную плоскость луча инцидента, регулируя положение фокусировки объектива с помощью 50-мм моторизованной ступени. Приближая фокусную плоскость к положению капилляра увеличит показания qAbs265; приведение фокусной плоскости дальше от положения капилляра уменьшит показания «Abs265».
- Мониторинг аденина qAbs265 для измерения эффективного количества гидроксильного радикала, присутствуют в образце после лазерного облучения13. Мониторинг в режиме реального времени с помощью inline УФ-капиллярного детектора позволяет получить компенсацию в режиме реального времени, описанную в 4.2.2; отрегулируйте положение объектива с помощью моторизованной ступени до тех пор, покапоказания qAbs 265 не будут равны желаемому чтению. Пост-экспериментальные измерения абсорбтности с УФ-спектрофотометром также точны, но требуют использования новых образцов для каждой эффективной радикальной дозы.
5. Переваривать образцы белка
ПРИМЕЧАНИЕ: Трипсин чаще всего используется для переваривания образцов белка для FPOP, и является протеазой, используемой в этом протоколе. Это надежная протеаза, которая генерирует пептиды с основными участками как на N- и C-терминуса, содействие умножить заряженные пептидные ионы в MS. Кроме того, он расщепляется после лизина и аргинина, двух аминокислот, которые лишь умеренно реагируют на гидроксиловые радикалы; поэтому изменения в структуре пищеварения из-за окисления аналита редки. Другие протеасы были успешно использованы с FPOP21, но следует позаботиться, чтобы обеспечить пищеварение модели сопоставимы между неоксидированных и окисленных образцов.
- Измерьте окончательный объем затухаемого образца FPOP. Добавьте 500 мм Трис, рН 8,0 с 10 мМ CaCl2, содержащий 50 мм дитиотрейтол (DTT) в белковый раствор после затухания до конечной концентрации 50 мМ Трис, 1 мМ CaCl2 и 5 мМ ДТТ.
- Нагрейте образец белка при температуре 95 градусов по Цельсию в течение 15 минут.
- Немедленно охладить образец на льду в течение 2 мин.
- Добавьте к образцам соотношение веса 1:20 трипсина/белка.
- Перемешайте белок на ночь при 37 градусов по Цельсию при смешивании.
- Остановить реакцию пищеварения путем добавления 0,1% formic кислоты и / или нагрева образца до 95 градусов по Цельсию в течение 10 мин.
- Добавьте 2 мММ DTT в образцы и нагревайте при температуре 60 градусов по Цельсию в течение 15 минут непосредственно перед LC-MS/MS.
ПРИМЕЧАНИЕ: В то время как другие группы сообщили об алкилировании тиолов в экспериментах FPOP, в наших руках мы отметили побочные продукты на алкилирование окисленных белков (возможно, из-за реакции с нуклеофильными карбонилами, образованными как незначительный продукт окисления). Таким образом, мы решили, чтобы избежать алкиляции тиол, когда это возможно.
6. Выполнить жидкую хроматографию-тандемную масс-спектрометрию (LC-MS/MS)
- Подготовка мобильной фазы А, состоящей из воды, содержащей 0,1% мякотиновой кислоты и мобильной фазы В, состоящей из ацетонитрила с 0,1% formic кислоты.
- Загрузите образец сначала на столбец ловушки C18 (300 мкм I.D. x 5 мм 100 й pore размер, 5 мкм размер частицы) захвата картриджа и мыть с 2% растворителя B в течение 3 минут при скорости потока 5,0 йл/мин для удаления солей и гидрофильных малых молекул.
- Затем отделяем пептиды на наноколумне C18 (0,75 мм х 150 мм, размер частиц 2 мкм, размер 100 й пор) со скоростью потока 300 нл/мин. Градиент состоит из линейного увеличения с 2 до 35% растворителя B в течение 22 мин, увеличили до 95% растворителя B в течение 5 мин и провел в течение 3 минут, чтобы вымыть колонку, а затем вернулся к 2% B в течение 3 мин и провел в течение 9 минут, чтобы повторно уравноть столбец.
ПРИМЕЧАНИЕ: Этот градиент достаточен для LC-MS/MS большинства одно- и двух белковых смесей FPOP, стремящихся сделать квантификацию пептидного уровня. Процент растворителя B, возможно, потребуется изменить, чтобы увеличить разрешение пептида в редких случаях, когда пептиды мешают друг другу из-за аналогичного времени удержания и значения m/z. Proteome масштаба FPOP22 или экспериментальных конструкций, стремящихся отделить пептид окисления продукт изомеры1,23,24,25 может потребоваться больше LC градиентов и выходят за рамки настоящего доклада. - Улизнйте пептиды непосредственно в источник наноспрей масс-спектрометра высокого разрешения с помощью проводящих излучателей наноспрей.
- Приобретайте данные в положительном ионом режиме. Установите напряжение брызг до 2400 В, а температуру ионные трубки передачи до 300 градусов по Цельсию.
- Приобрети полное сканирование MS от m/z 250 до 2000 при номинальном разрешении на m/z 200 из 60,000, а затем восемь последующих зависящих от данных линейных ионных ловушек MS/MS сканирует на восьми наиболее распространенных пептидных ионах с использованием столкновения индуцированной диссоциации на 35% нормализованной энергии для идентификации пептидов. Фрагмент пептидов до пяти раз в течение 30 с, а затем передать в список исключений на 60 с.
7. Обработка данных и расчет среднего окисления пептидов
- Определите последовательность покрытия белков, значений m/z и времени хранения неоксидированных пептидов с помощью поисковой системы MS/MS proteomics.
- Установите толерантность к массе прекурсора до 10 промилле и позвольте до двух пропущенных участков расщепления для трипсина усваивается образцов, используя стандартную специфику расщепления трипсина.
- Установите пептидный массовый фрагмент массовой толерантности к 0,4 Далтона.
- На основе соотношения м/з обнаруженных неизмененных пептидов и известных массовых сдвигов основных продуктов окисления вычислите м/з различных теоретических продуктов окислениякаждого пептида 4,,26,,27,,28,,29.
- Определите извлеченную ионно-хроматограмму этих значений m/z с помощью программного обеспечения для просмотра масс-спектрометрического запуска(рисунок 4). Определите продукты окисления пептида на основе их m/z,их состояния заряда и сходства во времени элюции с неизмененным пептидом. В наших руках, пептид окисления продуктов elute между 240 секунд до 180 секунд после неизмененного пептида с использованием градиента LC выше. Поскольку окисление часто приводит к множественным продуктам окисления изомерик, часто наблюдается несколько частично разрешенных пиков в извлеченных ионных хроматограммах продуктов окисления пептидов, как показано на рисунке 4. Продукты окисления пептида количественно определены на основе области пика (ы) в извлеченных ионных хроматограммах.
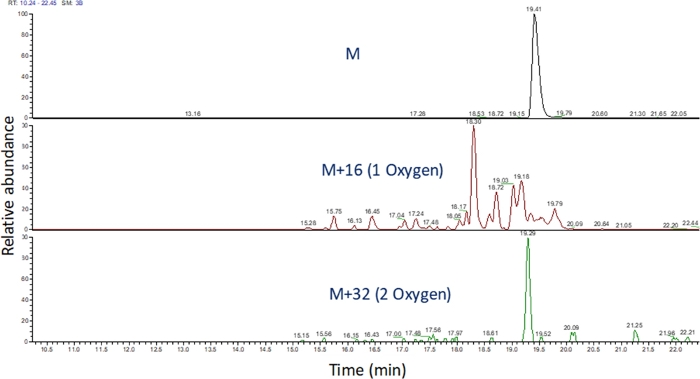
Рисунок 4: Извлеченная ионная хроматограмма пептида и его продуктов окисления после FPOP. м/з продуктов окисления пептида рассчитывается на основе м/з неоксидированных пептидов и известных продуктов окисления; и определяются области этих пептидных продуктов. Область пептидных продуктов затем используется для расчета средних событий окисления на пептид. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- Рассчитайте среднее окисление пептидов с помощью следующего уравнения.
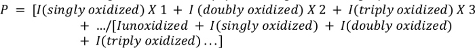
где P обозначает среднее количество событий окисления на молекулу пептида, и я представляет пиковую область неоксидированных пептидов(Инокисленых)и пептид с n окисления событий. Обратите внимание, что i (отдельно окисленный) будет включать в себя не только дополнения одного атома кислорода, но и другие менее распространенные события окисления, которые следователь может выбрать для измерения (например, окислительное декарбоксилирование, образование карбонила и т.д.) 4,26,27,28,29.
Результаты
Сравнение тяжелой цепи пептидного следа адалимумаба биоаналога в фосфатном буфере и при нагревании при 55 градусов по Цельсию на 1 ч показывают интересные результаты. Студенческий т-тест используется для идентификации пептидов, которые существенно изменились в этих двух условиях (p ≤ 0....
Обсуждение
Массовые спектрометрические структурные методы, в том числе водород-дейтерийный обмен, химическая перекрестная связь, ковалентная маркировка, а также родная масс-спектрометрия и ионная мобильность быстро растут в популярности из-за их гибкости, чувствительности и способности обраба?...
Раскрытие информации
Джошуа С. Шарп раскрывает значительный финансовый интерес к GenNext Technologies, Inc., небольшой компании, стремятся коммерциализировать технологии для анализа структуры высшего порядка белка, включая гидроксил радикальный белок след.
Благодарности
Мы признаем финансирование исследований от Национального института общих медицинских наук грант R43GM125420-01 для поддержки коммерческой разработки скамейки FPOP устройства и R01GM127267 для разработки стандартизации и дозиметрии протоколов для высокой энергии FPOP.
Материалы
| Name | Company | Catalog Number | Comments |
| Adenine | Acros Organics | 147440250 | Soluble in water upto 3.5 mM |
| Aperture | Edmund Optics | 39-905 | 1000 μm Aperture Diameter, Gold-Plated Copper Aperture |
| Aperture holder | Edmund Optics | 53-287 | 25.8mm Outer Diameter, Precision Pinhole Mount |
| Catalse | Sigma Aldrich | C-40 | Catalase from bovine liver, lyophilized powder, ≥10,000 units/mg protein |
| COMPex Pro laser | Coherent | 1113836 | COMPexPRO 102, F-Vversion, KrF laser, No XeCl |
| Dithiotheitol (DTT) | Promega | V3151 | DTT, Molecular Grade (DL-Dithiothreitol) |
| Fraction collector | GenNext Technologies, Inc. | N/A | Automated fraction collector |
| Fused silica capillay | Molex | 1068150023 | Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 100 µm, Outer Diameter 375 µm, TSP100375 |
| Glutamine | Acros Organics | 119951000 | L(+)-Glutamine, 99% |
| Holder for lens | Edmund Optics | 03-668 | 53 mm Outer Diameter, Three-Screw Adjustable Ring Mount |
| Hydrogen peroxide | Fisher Scientific | H325-100 | Hydrogen Peroxide, 30% (Certified ACS), Fisher Chemical |
| LC-MS/MS system | Thermo Scientific | IQLAAEGAAPFADBMBCX | Dionex Ultimate 3000 coupled to Orbitap Fusion Tribrid mass spectrometer |
| Mas spec grade Acetonitrile | Fisher Scientific | A955-1 | Acetonitrile, Optima LC/MS Grade, Fisher Chemical |
| Mass spec grade formic acid | Fisher Scientific | A117-50 | Formic Acid, 99.0+%, Optima™ LC/MS Grade, Fisher Chemical |
| Mass spec grade water | Fisher Scientific | W6-4 | Water, Optima LC/MS Grade, Fisher Chemical |
| MES buffer | Sigma Aldrich | M0164 | MES hemisodium salt |
| Methionine amide | Bachem | 4000594.0005 | H-met-NH2.HCl |
| Micro V clamp | Thor Labs | VK250 | Micro V-clamp with stainless steel blades |
| Motorized stage | Edmund Optics | 68-638 | 50mm Travel Motorized Stage System with Manual Control |
| Nano C18 colum | Thermo Scientific | 164534 | Acclaim PepMap 100 C18 HPLC Columns |
| Optical bench | Edmund Optics | 56-935 | 18" x 18" breadboard |
| Pioneer FPOP Module System | GenNext Technologies, Inc. | N/A | Inline FPOP Radical Dosimetry System |
| Post holder | Edmund Optics | 58-979 | 3" Length, ¼-20 Thread, Post Holder |
| Sodium phosphate dibasic | Fisher Scientific | BP331-500 | Sodium Phosphate Dibasic Heptahydrate (Colorless-to-White Crystals), Fisher BioReagents |
| Sodium phosphate monobasic | Fisher Scientific | BP330-500 | Sodium Phosphate Monobasic Monohydrate (Colorless-to-white Crystals), Fisher BioReagents |
| Syringe | Hamilton | 81065 | 100 µL, Model 1710 RN SYR, Small Removable NDL, 22s ga, 2 in, point style 3 |
| Syringe pump | KD Scientific | 788101 | Legato 101 syringe pump |
| Trap C18 column | Thermo Scientific | 160454 | Thermo Scientific Acclaim PepMap 100 C18 HPLC Columns |
| Tris | Sigma Aldrich | 252859 | Tris(hydroxymethyl)aminomethane |
| Trypsin | Promega | V5111 | Sequencing Grade Modified Trypsin |
| UV plano convex lens | Edmund Optics | 84-285 | 30 mm Dia. x 120 mm FL Uncoated, UV Plano-Convex Lens |
Ссылки
- Kaur, P., Kiselar, J., Yang, S., Chance, M. R. Quantitative protein topography analysis and high-resolution structure prediction using hydroxyl radical labeling and tandem-ion mass spectrometry (MS). Molecular & Cellular Proteomics. 14 (4), 1159-1168 (2015).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Buxton, G. V., Greenstock, C. L., Helman, W. P., Ross, A. B. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O- in Aqueous Solution. Journal of Physical and Chemical Reference Data. 17 (2), 513 (1988).
- Xu, G., Chance, M. R. Radiolytic modification and reactivity of amino acid residues serving as structural probes for protein footprinting. Analytical Chemistry. 77 (14), 4549-4555 (2005).
- Sharp, J. S., Tomer, K. B. Effects of anion proximity in peptide primary sequence on the rate and mechanism of leucine oxidation. Analytical Chemistry. 78 (14), 4885-4893 (2006).
- Huang, W., Ravikumar, K. M., Chance, M. R., Yang, S. Quantitative mapping of protein structure by hydroxyl radical footprinting-mediated structural mass spectrometry: a protection factor analysis. Biophysical Journal. 108 (1), 107-115 (2015).
- Xie, B., Sood, A., Woods, R. J., Sharp, J. S. Quantitative protein topography measurements by high resolution hydroxyl radical protein footprinting enable accurate molecular model selection. Scientific Reports. 7 (1), 4552 (2017).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Li, X., et al. Structural analysis of the glycosylated intact HIV-1 gp120-b12 antibody complex using hydroxyl radical protein footprinting. Biochemistry. 56 (7), 957-970 (2017).
- Li, K. S., Shi, L., Gross, M. L. Mass spectrometry-based fast photochemical oxidation of proteins (FPOP) for higher order structure characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-834 (2019).
- Roush, A. E., Riaz, M., Misra, S. K., Weinberger, S. R., Sharp, J. S. Intrinsic buffer hydroxyl radical dosimetry using Tris(hydroxymethyl)aminomethane. Journal of the American Society for Mass Spectrometry. 31 (2), 169-172 (2020).
- Xie, B., Sharp, J. S. Hydroxyl radical dosimetry for high flux hydroxyl radical protein footprinting applications using a simple optical detection method. Analytical Chemistry. 87 (21), 10719-10723 (2015).
- Niu, B., Zhang, H., Giblin, D., Rempel, D. L., Gross, M. L. Dosimetry determines the initial OH radical concentration in fast photochemical oxidation of proteins (FPOP). Journal of the American Society for Mass Spectrometry. 26 (5), 843-846 (2015).
- Niu, B., et al. Incorporation of a reporter peptide in FPOP compensates for adventitious scavengers and permits time-dependent measurements. Journal of the American Society for Mass Spectrometry. 28 (2), 389-392 (2017).
- Garcia, N. K., Sreedhara, A., Deperalta, G., Wecksler, A. T. Optimizing hydroxyl radical footprinting analysis of biotherapeutics using internal standard dosimetry. Journal of the American Society for Mass Spectrometry. 31 (7), 1563-1571 (2020).
- Sharp, J. S., Misra, S. K., Persoff, J. J., Egan, R. W., Weinberger, S. R. Real time normalization of fast photochemical oxidation of proteins experiments by inline adenine radical dosimetry. Analytical Chemistry. 90 (21), 12625-12630 (2018).
- Zhang, B., Cheng, M., Rempel, D., Gross, M. L. Implementing fast photochemical oxidation of proteins (FPOP) as a footprinting approach to solve diverse problems in structural biology. Methods. 144, 94-103 (2018).
- Konermann, L., Stocks, B. B., Czarny, T. Laminar flow effects during laser-induced oxidative labeling for protein structural studies by mass spectrometry. Analytical Chemistry. 82 (15), 6667-6674 (2010).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast photochemical oxidation of protein footprints faster than protein unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Li, K. S., et al. Hydrogen-Deuterium exchange and hydroxyl radical footprinting for mapping hydrophobic interactions of human bromodomain with a small molecule Inhibitor. Journal of the American Society for Mass Spectrometry. 30 (12), 2795-2804 (2019).
- Espino, J. A., Jones, L. M. Illuminating biological interactions with in vivo protein footprinting. Analytical Chemistry. 91 (10), 6577-6584 (2019).
- Charvatova, O., et al. Quantifying protein interface footprinting by hydroxyl radical oxidation and molecular dynamics simulation: application to galectin-1. Journal of the American Society for Mass Spectrometry. 19 (11), 1692-1705 (2008).
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Gau, B. C., Chen, J., Gross, M. L. Fast photochemical oxidation of proteins for comparing solvent-accessibility changes accompanying protein folding: Data processing and application to barstar. Biochimica et Biophysica Acta. 1834 (6), 1230-1238 (2013).
- Garrison, W. M. Reaction mechanisms in the radiolysis of peptides, polypeptides, and proteins. Chemical Reviews. 87 (2), 381-398 (1987).
- Xu, G., Chance, M. R. Radiolytic modification of sulfur-containing amino acid residues in model peptides: fundamental studies for protein footprinting. Analytical Chemistry. 77 (8), 2437-2449 (2005).
- Xu, G., Chance, M. R. Radiolytic modification of acidic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 76 (5), 1213-1221 (2004).
- Xu, G., Takamoto, K., Chance, M. R. Radiolytic modification of basic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 75 (24), 6995-7007 (2003).
- Misra, S. K., Orlando, R., Weinberger, S. R., Sharp, J. S. Compensated hydroxyl radical protein footprinting measures buffer and excipient effects on conformation and aggregation in an adalimumab biosimilar. AAPS Journal. 21 (5), 87 (2019).
- Simmons, D. A., Konermann, L. Characterization of transient protein folding intermediates during myoglobin reconstitution by time-resolved electrospray mass spectrometry with on-line isotopic pulse labeling. Biochemistry. 41 (6), 1906-1914 (2002).
- Vahidi, S., Konermann, L. Probing the time scale of FPOP (fast photochemical oxidation of proteins): radical reactions extend over tens of milliseconds. Journal of the American Society for Mass Spectrometry. 27 (7), 1156-1164 (2016).
- Chance, M. R. Unfolding of apomyoglobin examined by synchrotron footprinting. Biochemical and Biophysical Research Communications. 287 (3), 614-621 (2001).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Zhang, Y., Rempel, D. L., Zhang, H., Gross, M. L. An improved fast photochemical oxidation of proteins (FPOP) platform for protein therapeutics. Journal of the American Society for Mass Spectrometry. 26 (3), 526-529 (2015).
- Cornwell, O., Radford, S. E., Ashcroft, A. E., Ault, J. R. Comparing hydrogen deuterium exchange and fast photochemical oxidation of proteins: a structural characterisation of wild-type and ΔN6 β(2)-microglobulin. Journal of the American Society for Mass Spectrometry. 29 (2), 2413-2426 (2018).
- Xie, B., Sharp, J. S. Relative Quantification of sites of peptide and protein modification using size exclusion chromatography coupled with electron transfer dissociation. Journal of the American Society for Mass Spectrometry. 27 (8), 1322-1327 (2016).
- Srikanth, R., Wilson, J., Vachet, R. W. Correct identification of oxidized histidine residues using electron-transfer dissociation. Journal of Mass Spectrometry. 44 (5), 755-762 (2009).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Improved identification and relative quantification of sites of peptide and protein oxidation for hydroxyl radical footprinting. Journal of the American Society for Mass Spectrometry. 24 (11), 1767-1776 (2013).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Supercharging by m-NBA Improves ETD-Based Quantification of Hydroxyl Radical Protein Footprinting. Journal of the American Society for Mass Spectrometry. 26 (8), 1424-1427 (2015).
- Khaje, N. A., Sharp, J. S. Rapid quantification of peptide oxidation isomers from complex mixtures. Analytical Chemistry. 92 (5), 3834-3843 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены