Method Article
Манипуляция одиночными нервными стволовыми клетками и нейронами в ломтиках мозга с помощью роботизированной микроинъекции
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол демонстрирует использование роботизированной платформы для микроинъекции в одиночные нервные стволовые клетки и нейроны в срезах мозга. Этот метод является универсальным и предлагает метод отслеживания клеток в тканях с высоким пространственным разрешением.
Аннотация
Центральным вопросом в нейробиологии развития является то, как нервные стволовые клетки и клетки-предшественники образуют мозг. Чтобы ответить на этот вопрос, нужно маркировать, манипулировать и следовать одиночные клетки в ткани мозга с высоким разрешением с течением времени. Эта задача является чрезвычайно сложной из-за сложности тканей в головном мозге. Недавно мы разработали робота, который направляет микроинъекцию иглы в ткани мозга при использовании изображений, полученных из микроскопа для доставки фемтолитера объемы раствора в одиночные клетки. Роботизированная операция увеличивается в результате общей урожайности, которая на порядок больше, чем ручной микроинъекции и позволяет для точной маркировки и гибкой манипуляции одиночных клеток в живой ткани. При этом можно микроинъектность сотни клеток в рамках одного органотипического ломтика. Эта статья демонстрирует использование микроинъекции робота для автоматизированной микроинъекции нейронных клеток-предшественников и нейронов в срезах тканей мозга. В более широком смысле, он может быть использован на любой эпителиальной ткани с изображением поверхности, которые могут быть достигнуты пипеткой. После настройки робот микроинъекции может выполнять 15 или более микроинъекций в минуту. Микроинъекционный робот из-за своей пропускной способности и обратности сделает микроинъекцию широко простой высокой производительности метод манипуляции клеток, которые будут использоваться в биоинженерии, биотехнологии и биофизики для выполнения одноклеточного анализа в органотипических ломтиков мозга.
Введение
Этот протокол описывает использование робота для таргетинга и манипулирования одиночными клетками в срезах тканей мозга, сосредоточив внимание, в частности, на одиночных нервных стволовых клетках и нейронах. Робот был разработан для решения центрального вопроса в развитии нейробиологии, то есть как нервные стволовые клетки и клетки-предшественникиспособствуют морфогенезу мозга 1,2,3,4,5. Чтобы ответить на этот вопрос, нужно маркировать и отслеживать одиночные нервные стволовые клетки и следовать их прогрессии линии с течением времени, чтобы соотнести поведение одной клетки с морфогенезом тканей. Это может быть достигнуто по-разному, например, путем электропорации ткани мозга в утробе матери или путем маркировки одной клетки с помощью липофильных умирает. Хотя эти методы являются мощными, они не имеют точного разрешения одной клетки (электропорация) и/или возможности манипулировать внутриклеточным пространством (липофилинический краситель). Микроинъекция в одиночные клетки была разработана, чтобы преодолетьэту проблему 6,7,8. Во время микроинъекции, пипетка кратко вставляется в одну клетку в нетронутой ткани под давлением микроинъекции фемтолитера объемовреагентов 9. Ранее мы описали ручную процедуру микроинъекта одиночных нервных стволовых клеток в органотипическойткани (рисунок 1A)10,11. Микроинъекция в нервные стволовые клетки опирается на использование микропипюты, которая вставляется в одиночные нервные стволовые клетки для введения раствора, содержащего флуоресцентный краситель, наряду с другими молекулами, представляющими интерес. Селективное ориентации нервных стволовых клеток достигается путем приближения развивающихся теленцефалона через желудочковой поверхности (или желудочка, см. мультфильм на рисунке 1A), который формируется апической плазменной мембраны апических прародителей (мультфильм на рисунке 1A). Этот процесс должен быть повторен для каждой клетки, что экспериментатор желает ввести. Кроме того, успех микроинъекции зависит от точного контроля глубины и продолжительности инъекций микропипюты в ткани. Таким образом, несмотря на уникальные преимущества, ручная микроинъекция крайне утомительна и требует значительной практики для выполнения при разумной пропускной способности и урожайности, что затрудняет использование этой техники в масштабируемой форме. Чтобы преодолеть это ограничение, мы недавно разработали изображение управляемого робота, Autoinjector12 (или микроинъекции робота), который может автоматически выполнять микроинъекции в одиночные клетки.
Робот микроинъекции использует микроскопические алгоритмы визуализации и компьютерного зрения, чтобы точно ориентироваться на конкретные места в 3-D пространстве в ткани для микроинъекции(рисунок 1B). Робот микроинъекции может быть построен путем внесения относительно простых изменений в существующую установку микроинъекции. Общая схема микроинъекции робота показана на рисунке 1C. Пипетка устанавливается в держатель пипетки, прикрепленный к трехосевому манипулятору. Микроскоп камера используется для получения изображений ткани и микроинъекции иглы. Для контроля давления внутри пипетки используется система регулирования пользовательского давления, а для контроля положения микроинъекторной пипетки используется программируемый микроманипулятор. Изображения камеры ткани и микроинъекции пипетки используются для определения пространственного расположения микроинъекции пипетки кончика и места, в которых микроинъекции должны быть выполнены. Программное обеспечение затем вычисляет траектории, необходимые для перемещения пипетки в ткани. Все оборудование контролируется программным обеспечением, которое мы ранее разработали. Все программное обеспечение написано на языке кодирования (например, Python и Arduino) и может быть загружено https://github.com/bsbrl/Autoinjector с инструкциями. Графический пользовательский интерфейс (GUI) позволяет пользователю изображение ткани и микропипюты, а также настроить траекторию микроинъекции. Наша система может быть создана с использованием относительно простых модификаций перевернутого микроскопа, оснащенного фильтрами яркого поля и эпифлуоресценции.
Во-первых, мы предоставляем инструкции по подготовке ломтиков органотипической ткани мозга для микроинъекции. Затем протокол иллюстрирует запуск микроинъекции робота с последующими подготовительными шагами, такими как калибровка движения пипетки, которые должны быть сделаны до микроинъекции. За этим следует определение параметров впрыска. После этого пользователь может определить траекторию, используемую роботом микроинъекции, и начать процедуру впрыска. Микроинъектируемые ткани (в данном случае ломтики органотипической ткани мозга) могут храниться в культуре в течение разных периодов времени взависимости от экспериментального дизайна 10,11. Ткань может быть обработана, чтобы следить и изучать идентичность и судьбу инъекционных клеток и их потомства. Кроме того, за микроинъектными клетками можно следить с помощью живой визуализации. В рамках этого протокола мы демонстрируем использование робота для автоматического микроинъекции нейронных клеток-предшественников в органотипических ломтиках мыши E14.5 спинного теленцефалона. Робот также способен микроинъекции в новорожденных нейронов в мыши теленцефалона, а также в теленцефалонеплода человека 12.
Таким образом, мы описываем роботизированную платформу, которая может быть использована для следовать и манипулировать одиночными клетками в тканях. Платформа использует давление и, следовательно, чрезвычайно универсальна в отношении химического характера соединения для инъекций. Кроме того, он может быть адаптирован к клеткам-мишеням, кроме стволовых клеток. Мы ожидаем, что наша система будет легко адаптирована к другим модельным системам.
протокол
Все исследования на животных проводились в соответствии с немецким законодательством о защите животных, а необходимые лицензии были получены от региональной этической комиссии по экспериментам на животных Дрездена, Германия (Tierversuchskommission, Landesdirektion Dresden). Органотипические ломтики были подготовлены из E14.5 или E16.5 C57BL/6 мыши эмбрионального теленцефалона (Janvier Labs).
1. Установка программного обеспечения
- Следуйте инструкциям по установке программного обеспечения https://github.com/bsbrl/Autoinjector.
2. Подготовка реагентов и пипеток
- Агароза: Подготовка 3% агарозы путем отдельного растворения 3 г широкого диапазона агарозы и 3 г низкоплавильной точки агарозы в 100 мл клеточной культуры класса PBS в двух отдельных 200 мл стеклянных бутылок, соответственно. Хранить при комнатной температуре до 3 месяцев.
- Раствор тирода: Растворите 1 г бикарбоната натрия и соли тирода (используйте содержимое всей бутылки) и 13 мл 1 М HEPES в 1 л дистиллированной воды. Отрегулируйте рН до 7,4. Фильтр решения через фильтр 0,2 мкм бутылки сверху.
- Нарежьте культуру среды (СКМ): Добавьте 10 мл крысиной сыворотки, 1 мл 2 м глутамина, 1 мл пенициллина-стрептомицина (100x), 1 мл дополнения N-2 (100x), 2 мл дополнения B27 (50x) и 1 мл дополнения HEPES (pH 7.3) буфер в 84 мл neurobasal среды. Aliquot 5 мл СКМ в 15 мл труб. Хранить при -20 градусов по Цельсию.
- CO2-Independent Microinjection Medium (CIMM): Приготовьте 5x DMEM модифицированный низко глюкозный раствор (без фенола красного цвета) путем растворения порошка в 200 мл дистиллированной воды. Фильтр решение через 0,2 мкм бутылки верхней фильтр (для порошка DMEM, использовать содержимое всей бутылки). Чтобы подготовить 100 мл CIMM, смешать 20 мл 5x DMEM модифицированный раствор, 1 мл буфера HEPES, 1 мл дополнения N2 (100x), 2 мл дополнения B27 (50x), 1 мл пенициллина-стрептомицина (100x), 1 мл 2 м глютамина и 74 мл дистилляционной воды. Храните раствор при 4 градусах Цельсия.
- Буфер восстановления: Подготовь буфер восстановления путем растворения 262 мМ NaHCO3, 0.05 N NaOH, 200 мМ HEPES в дистиллированной воде. Стерилизовать раствор путем фильтрации через бутылку-топ 0,22 мкм фильтровальной системы в стерильную стеклянную бутылку. Aliquot 500 йл буфера восстановления в герметичные трубки микроцентрифуга. Хранить при 4 градусов по Цельсию.
- Запас микроинъекционного красителя: Растворите флуоресцентно помеченный Декстран в свободной дистиллированной воде RNase (окончательная концентрация 10 мкг/йл). Подготовьтесь к алицитам 5 мкл и храните при -20 градусах по Цельсию до их использования.
- Вытяните микроинъекции пипетки из борозиликатных стеклянных капилляров (1,2 мм внешнего диаметра, 0,94 мм внутреннего диаметра) с помощью шкива микропипта. Защитите пипетки от пыли. Не храните пипетки более 2 - 3 дней. Для этого эксперимента, потянув параметры были HEAT: температура рампы No 1 - 5; ПУЛУ: 100; VEL: 110; ДЕЛ: 100. HEAT и VEL являются параметрами, которые влияют на наиболее форму и размер пипетки.
ПРИМЕЧАНИЕ: Оптимальная микроинъекция пипетка имеет длинный и гибкий наконечник, чтобы избежать повреждения клеток во время микроинъекции.
3. Ткань ломтик подготовки
- Растопить 3% широкий диапазон агарозы с помощью микроволновой печи до вскрытия тканей мозга. Не позволяйте агарозы затвердеть, держа в водяной бане при 37 градусов по Цельсию до встраивания. Убедитесь, что пипетки защищены от пыли. Не храните пипетки более 2 - 3 дней.
- Оттепель aliquot SCM и тепло 10 - 12 мл CIMM и 20 мл раствора Тирода до 37 градусов по Цельсию с помощью водяной ванны.
- Смешайте флуоресцентный трассировщик (Dextran-3000 или Dextran-10000-Alexa конъюгированный; окончательная концентрация 5 - 10 мкг/ йл) с другим химическим веществом (ы), которые будут введены. Центрифуга раствора микроинъекции при 16 000 х г в течение 30 мин при 4 градусах Цельсия. Соберите супернатант и перенесите в новую трубку. Держите раствор микроинъекции на льду до его использования.
- Используйте головки эмбрионов мыши E13.5 - E16.5 для подготовки ломтиков органотипической ткани теленцефалона. Снимите кожу и откройте череп с помощью типсов, двигаясь вдоль средней линии. Рассекаете эмбриональный мозг из открытого черепа и удалите оковы, покрывающие ткани мозга, начиная с брюшной стороны мозга. Оставьте расчлененный весь мозг в растворе Тирода на нагревательном блоке с 37 градусами Цельсия.
ПРИМЕЧАНИЕ: Все шаги вскрытия, описанные в 3.4, должны быть выполнены в растворе prewarmed Tyrode. - Налейте широкий ассортимент расплавленной агарозы в одноразовые встраивания формы. Когда агароза охлаждается до 38 – 39 градусов по Цельсию, тщательно перенесите мозги (максимум 4) в него с помощью пипетки Pasteur. Всегда используйте сократить советы для этого шага.
- Перемешать агарозу вокруг ткани либо с помощью шпателя или пару типсов Дюмона#1 не касаясь ткани. Пусть агароза затвердевет при комнатной температуре. После того, как агароза затвердевла, обрезать избыток агарозы, окружающей ткани.
- Заполните буферный лоток PBS. Ориентация мозга с ростро-каудальной оси ткани перпендикулярно лоток (использовать в качестве ориентира обонятельные луковицы, представляющие ростральной большей части мозга). Вырезать 250 мкм ломтиками с помощью вибромы.
- Заполните 3,5 см чашки Петри с 2 мл довоенных средств массовой информации. Используя пластиковую пипету Pasteur, перенесите ломтики (10 - 15) на это блюдо. После этого переложите чашку Петри с ломтиками в инкубатор культуры ломтиков. Поддерживайте ломтики при 37 градусов по Цельсию во влажной атмосфере, содержащей 40% O2 / 5% CO2 / 55% N2 до использования.
4. Микроинъекция
- Включите компьютер, микроскоп, микроскоп камеры, манипуляторы, давление установки, и датчик давления. Загрузите приложение, нажав на файл«launchapp.py»в основной папке, загруженной с GitHub, и укажите настройки устройства на всплывающем экране (см. шаг 1.1 для инструкций по установке).
- Создайте внешнее давление, чтобы предотвратить нежелательное засорение перед погружением пипетки в раствор. Чтобы оказать давление на пипетку, сдвиньте планку компенсационного давления до 24 - 45% и нажмите Set Values. Затем настройте давление на достаточное давление, повернув ручку клапана механического давления до 1 - 2 PSI (69 - 138 мбар), как указано датчиком давления.
- Перенесите ломтики в чашку Петри длиной 3,5 см, содержащую 2 мл предварительно разогретого CIMM. Поместите ломтики, которые будут микроинъектированы в центре чашки Петри. Перенесите чашку Петри на стадию разогретой (37 градусов по Цельсию) микроинъекции.
- Загрузите микроинъекции пипетки с 1,4 - 1,6 мл микроинъекции раствора (от шага 3,3) с помощью длинного наконечника пластиковой пипетки. Вставьте микроинъекцию пипетки на держатель пипетки.
- Используя наименьшее увеличение на микроскопе, довейте кусочек в фокус и направляйте микропайпетт в это поле зрения (FOV), чтобы он был сфокусирован на той же плоскости, что и цель среза. Переключитесь выход микроскопа на камеру, чтобы увидеть FOV в приложении.
- Нажмите кнопку увеличения в левом верхнем слева от интерфейса, чтобы инициировать калибровку устройства. Окно подскажет выбрать увеличение. Выберите 10x увеличение, или любое увеличение объектив установлен на (например, 4x, 10x, 20x, 40x) и нажмите Ok. Программное обеспечение предполагает, что внутренний объектив цели 10x (наиболее распространенное объективное увеличение объектива).
- Переориентация наконечника пипетки с помощью микрометрического колеса микроскопа и нажмите на кончик пипетки курсором. Затем нажмите кнопку шага 1.1 и нажмите OK в всплывающем окне. Пипетка будет двигаться в направлении Y. Нажмите на кончик пипетки и нажмите кнопку шаг 1.2. Наконец, введите 45 в угол коробки Pipette и нажмите угол набора.
- Введите желаемые параметры в панель управления автоматизированной микроинъекции. Для микроинъекции в апические прародители устанавливают расстояние инъекции до 20 – 40 мкм и глубину до 10 – 15 мкм. Для микроинъекции в нейроны устанавливают расстояние инъекций 30 - 40 мкм с базальной стороны, а глубину до 10 - 30 мкм в зависимости от того, что в настоящее время мишенью. Всегда устанавливай скорость до 100%. Нажмите Набор значений.
ПРИМЕЧАНИЕ: Расстояние подхода расстояние пипетка вытаскивает из ткани, прежде чем перейти к следующему расстоянию впрыска, глубина глубины в ткани микроинъекции идет, расстояние расстояние вдоль линии между последовательными инъекциями, скорость скорость пипетки в мкм / с. - Нажмите кнопку Кромки Draw и перетащите курсор по нужной траектории в всплывающем окне, чтобы определить траекторию впрыска. Для микроинъектирования стволовых клеток-предшественников, вентраловая сторона поверхности теленцефалона ориентирована, как показано на рисунке 2A. Довейте пипетку до начала линии и нажмите на кончик пипетки. Нажмите Вы запустите траекторию, чтобы начать микроинъектирование. Повторите этот шаг для каждой плоскости инъекций целевых (как правило, делается для 3 - 4 самолетов с 40 - 75 инъекций на плоскость).
5. Культура тканей и обработка ломтиков тканей для иммунофторесценции
- Приготовьте коллагеновую смесь (1,5 мг/мл): в трубку добавить 1,25 мл матричного раствора, 0,5 мл дистиллированной воды, 0,5 мл 5-х раствора DMEM-F12 и 0,25 мл буфера восстановления. Держите его на льду до использования.
- Получить чашку Петри, содержащую микроинъекции ломтиками из ломтик культуры инкубационой камеры и погрузить ломтики в коллагеновой смеси.
- Передача ломтиков вместе с 200 - 300 йл коллагеновой смеси в 14 мм хорошо 35 мм стеклянно-нижней блюдо. Убедитесь, что ломтики покрыты очень меньше коллагена. Эта настройка обеспечивает оптимальные условия для поглощения питательных веществ и кислорода.
- Ориентируйте ломтики, обеспечивая при этом достаточно места между ломтиками, используя две пары типсов. Инкубировать чашку Петри в течение 5 минут при 37 градусов по Цельсию с помощью нагревательного блока, чтобы коллаген затвердеть. Рассматривайте это время как t q 0 культуры ломтика.
- Переместите чашку Петри обратно в инкубатор культуры ломтиков еще на 40 минут. Затем добавьте 2 мл довоенной СКМ. Кусочки хранятся в культуре до нужной точки времени.
- Возьмите ломтики из среза культуры инкубатора и аспирировать СКМ. Вымойте коллаген-встроенные ломтики с 1x PBS. Добавьте 4% (wt/vol) параформальдегид (в 120 мм фосфатный буфер, рН 7,4) и оставьте ткань на RT на 30 мин. Затем переместите его на 4 градуса по Цельсию, чтобы обеспечить ночную фиксацию.
- Аспирировать раствор параформальдегида на следующий день и выполнить 1x PBS моет. Чтобы удалить ломтики из коллагена, используйте две пары типсов, чтобы аккуратно извлечь ломтики под стереомикроскопом.
- Используйте микроволновую печь, чтобы расплавить 3% (wt/vol) низкой точки плавления агарозы для обработки микроинъектных ломтиков. Налейте расплавленную агарозу в одноразовую встраиваемую форму и дайте ей остыть до 38 – 39 градусов по Цельсию.
- Перенесите ломтики ткани из шага 5.7 в эту форму, содержащую низкоплавильную агарозу с помощью пластиковой трубы Pasteur. Убедитесь, что pial сторона ломтик вверх и желудочковой поверхности лица вниз. При необходимости ориентируйте соответственно. Пусть агароза остынет до RT, чтобы укрепить.
- Обрежьте дополнительную агарозу, окружающую ломтики. Ориентируйте блок агарозы, чтобы убедиться, что срезанной поверхности параллельно режущей лезвию вибромы. Используя вибром, вырежьте секции толщиной 50 мкм.
- Заполните 24 хорошо блюдо с 1x PBS. Перенесите секции в это блюдо с помощью тонкой кисти. Выполняем иммунофторесценцию в соответствии со стандартными протоколами.
Результаты
Микроинъекция служит цели отслеживания и манипулирования одиночными нервными стволовыми клетками и их потомством в живой ткани и следовать их прогрессии линии в физиологической среде. В этой статье мы продемонстрировали использование микроинъекции робота для таргетинга и автоматического микроинъекции органотипических ломтиков телецефалона мыши. Рисунок 2 иллюстрирует репрезентативные изображения успешно введенных клеток-предшественников, а рисунок 3 иллюстрирует инъекционные новорожденные нейроны. При введении с Dextran Alexa-488 (или Alexa-A555) красителя, клетки появляются полностью заполнены красителем. Что касается апических прародителей(рисунок 2) конфокальной визуализации позволяет реконструировать с высоким пространственным разрешением морфологии клеток, наличие - или отсутствие- апической и базальной привязанности, а также объединить морфологический запрос с маркером выражения. Объединив эти критерии, пользователь может назначить конкретную судьбу клеток микроинъектумированным клеткам и их потомствам. Что касается инъекций нейронов, пользователь может реконструировать нейрональной морфологии, в том числе структуры и особенности апического дендрита и аксона. Автоматизированная микроинъекция может обеспечить значительно более высокую пропускную способность по сравнению с ручной микроинъекции(рисунок 2B). Кроме того, маркировка EdU подтверждает, что жизнеспособность клеток не зависит от автоматизации(рисунок 2C). Сохранение органотипического ломтика в культуре позволяет после линии прогрессии микроинъектных клеток (мы показали 4 - 24h на рисунке 2D). Если раствор микроинъекции содержит генетический материал (ДНК, мРНК, руководства CRISPR-Cas9) или рекомбинантные белки, то это позволяет изучить, влияет ли манипуляция на прогрессирование линии и как на нее.
Микроинъекция в одиночные нервные стволовые клетки в ткани обеспечивает превосходное разрешение одиночных клеток и для этой причины она была использована для того чтобы вскрыть биологию клетки нервной прогрессии стволовой клетки и переходасудьбы (рисунок 3A). Микроинъекция позволяет доставить сложную смесь химических веществ. Ранее мы использовали эту функцию для изучения соединения в нейронных клетках-предшественниках, смешивая разрыв-соединение проницаемое с разрывом непроницаемых флуоресцентныхкрасителей 12. Мы продлили предыдущую работу, изучая соединение в новорожденных нейронов, путем введения Люцифер желтый вместе с Dextran-A555 (Рисунок 3B). Как показано на рисунке 3B, доля новорожденных пирамидальных нейронов соединены через разрыв соединений с соседними нейронами. Это наблюдение согласуется с идеей, что незрелые нейроны общаться черезразрыв-соединение 13,14. Кроме того, таргетинг нейронов показывает, что использование микроинъекции робота может быть обобщено до нескольких типов клеток в развивающемся мозге млекопитающих. Эта экспериментальная установка будет полезна для вскрытия клеточной биологии нейронов в тканях, например, путем доставки конкретных олигопептидов вмешиваться в белково-белковых взаимодействий.
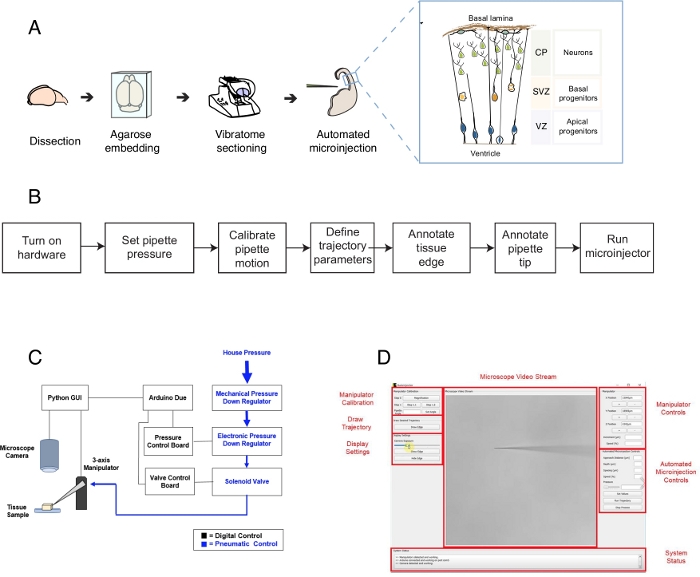
Рисунок 1: Автоматизированная настройка микроинъекции и протокол. (A)Общий протокол для подготовки тканей и автоматизированных микроинъекций с помощью микроинъекции робота. Право вставка: Мультфильм схема мыши Telencephalon предназначены для микроинъекции в этом протоколе. (B)Flowchart автоматизированных шагов микроинъекции. (C)Схема микроинъекции робота оборудования. (D)Графический пользовательский интерфейс (GUI) программного обеспечения, используемого для управления и работы микроинъекции робота. Эта цифра адаптирована из ref.12. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
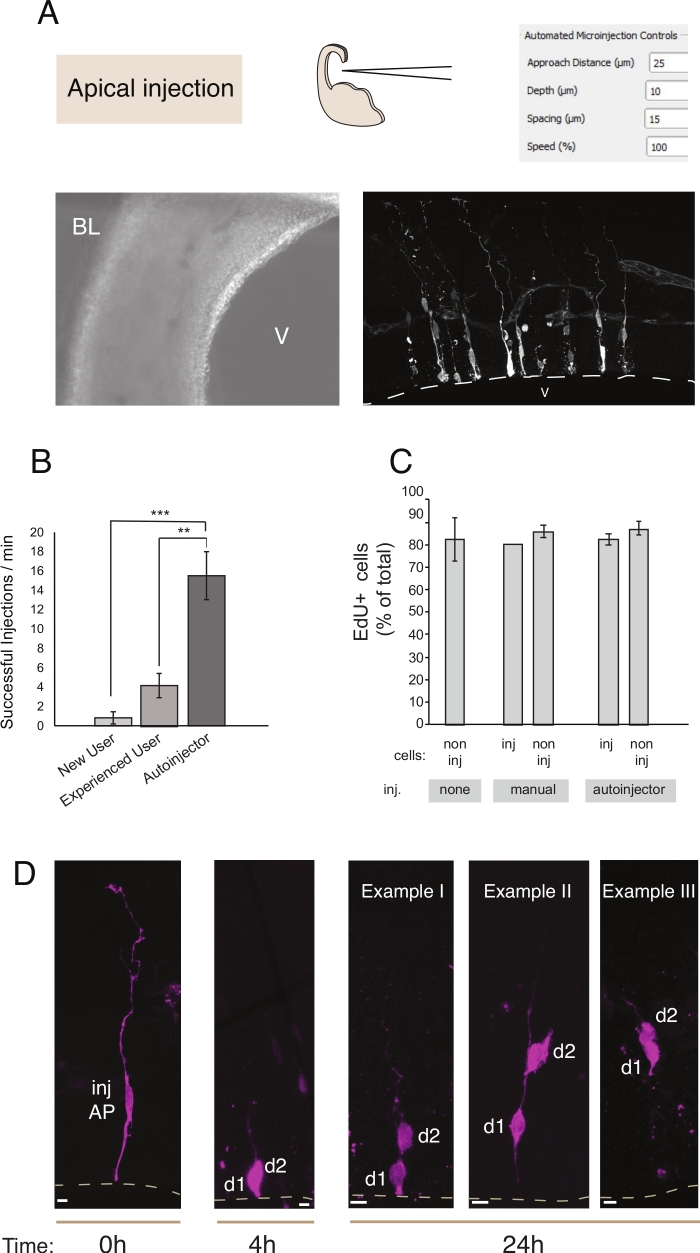
Рисунок 2: Роботизированная микроинъекция в апические прародители. Схематические и ожидаемые результаты при использовании микроинъекции робота для целевой апических прародителей (АП) через апикаль поверхности (апическая инъекция). (A)Верхний ряд. Слева: схема процесса. Справа: графический интерфейс с соответствующими параметрами для апической инъекции. Нижний ряд. Слева: фазовое контрастное изображение, взятое во время процедуры инъекции (V: желудочек; BL: базальная ламина). Справа: репрезентативные результаты, показывающие микроинъектные APs. Dashed линия представляет желудочек (V). Шкала бар: 10 мкм . (B) Успешные инъекции в минуту для начинающего пользователя на ручной микроинъекции системы, опытный пользователь на ручной микроинъекции системы, и микроинъекции робота. (C)Включение ЭдУ в микроинъектные клетки и в неинъектные клетки в инъекционной области. Органотипические ломтики мыши E14.5 спинного теленцефалона были либо (i) не вводили или (ii) подвергаются ручной или автоматизированной микроинъекции (инъекционный ломтик) с помощью Dextran-A488 (для ручного и автоинжектора). Фрагменты хранились в культуре в присутствии EdU в течение 24 ч, затем они были зафиксированы и окрашены для DAPI и EdU. Инъекционные и не введенные клетки в инъекционной области были забиты за положительность ЭдУ. (D)Использование микроинъекции робота Lineage трассировки. Флуоресцентный краситель (Dx3-A555, пурпурный) вводится в одну нейронную стволовую клетку (т 0 ч). Флуоресцентный краситель перепеется на клетки дочери (d1, d2) во время митоза. Это позволяет следить за потомством инъекционной клетки (т 4 ч и 24 ч) и выявление прогрессии линии с течением времени. Для t q 24 h, мы показываем несколько примеров потомства одно надеется найти. Шкала баров: 10 мкм. Графики в B и C взяты из ref.12 Пожалуйста, нажмитездесь, чтобы просмотреть большую версию этой цифры.
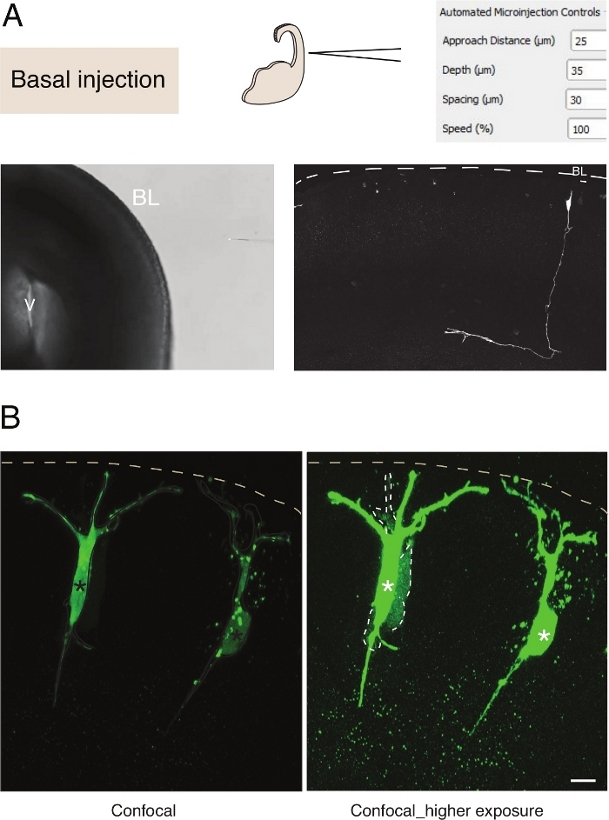
Рисунок 3: Роботизированная микроинъекция в нейроны. Схематические и ожидаемые результаты при использовании микроинъекции робота для целевой пирамидальных нейронов (N) через базальную поверхность (базальная инъекция). (A)Верхний ряд. Слева: схема процесса. Справа: графический интерфейс с соответствующими параметрами для базальной инъекции. Нижний ряд. Слева: фазовое контрастное изображение, взятое во время процедуры инъекции (V: желудочек; BL: базальная ламина). Справа: репрезентативные результаты, показывающие микроинъектированную линию N. Dashed, представляющую базальную ламину (BL). Шкала бар: 10 мкм . (B) Использование автоинъектора для изучения разрыва связи в тканях. Пирамидальные нейроны были введены с раствором, содержащим два красителя: разрыв соединения непроницаемой Dx-A555 (не показано) и разрыв-соединение проницаемый Люцифер желтый (зеленый). Dx-A555 ограничивается целевой ячейкой (звездочками), в то время как LY рассеивается на ячейки, которые соединены через разрыв соединения с целевой ячейкой (разбитые линии). Левая панель: Низкая экспозиция, видны только микроинъектуальные клетки. Правая панель: Высокая экспозиция позволяет визуализировать инъекционные клетки, а также соединенные клетки (разбитые линии). Шкала бар: 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительный файл: Устранение нескольких распространенных ошибок, возникающих при микроинъекции. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Микроинъекция в одиночные нервные стволовые клетки в ткани обеспечивает превосходное разрешение одиночных клеток и по этой причине она была использована для вскрытия клеточной биологии прогрессии нервных стволовыхклеток и перехода судьбы (рисунок 2;см. также 10,11,12). Автоматизированная процедура микроинъекции может быть выполнена на других типах клеток как у эмбриональных мышей, так и у тканей мозга человека. Репрезентативные результаты микроинъекции новорожденных нейронов путем ориентации на базальную поверхность теленцефалона показаны на рисунке 3.
Принцип, установленный здесь, может быть применен к целевой несколько различных типов клеток в эмбриональных мозгах мыши и человеческого мозга. Мы ранее показали, что микроинъекции робот также может быть использован для целевой одиночных клеток-предшественников в мышиного заднего мозга и теленцефалона и новорожденных нейронов в мыши и человека развивающихся neocortex12. Чтобы получить наилучшие результаты процедуры инъекции, следует оптимизировать все шаги перед началом инъекции. Важно тщательно продумать и оптимизировать подготовку жизнеспособных и хорошо сохранившихся органотипических ломтиков тканей из тканей мозга(рисунок 1). Очень важно быть быстрым в процедуре вскрытия и нарезки, иллюстрированной на рисунке 1. Для апической инъекции ориентации APs, следует выбрать ломтики, показывающие идеальную ориентацию апической поверхности. Для инъекций АП идеальной ориентацией является апическая поверхность перпендикулярно нижней части чашки Петри. Любая другая ориентация будет вседозволенной, однако, апическая поверхность перпендикулярно чашке Петри обеспечивает более широкую площадь поверхности для инъекций, тем самым увеличивая успех инъекций. Для инъекций в нейроны, ориентация ломтик играет практически никакого эффекта.
После того, как ломтики для инъекций выбраны, процедура инъекции на срез занимает около 5 минут. Учитывая, что человек работает с живой тканью, настоятельно рекомендуется ускорить процедуру инъекций. С этой целью мы рекомендуем установить все параметры для инъекций через графический интерфейс(рисунок 1D) до того, как ткань будет готова, чтобы уменьшить ненужное время ожидания. Для устранения неполадок, пожалуйста, обратитесь к дополнительному файлу.
В случае долгосрочной культуры ломтика, шаги после автоматизированной процедуры микроинъекции могут повлиять на здоровье клеток и, таким образом, эксперимент. Поэтому настоятельно рекомендуется продать тест на контроль качества и оптимизировать условия культуры среза. Для оценки жизнеспособности клеток после нарезки и инъекции процедуры, мы выполнили EdU маркировки во время культуры, и мы количественно количество пикнотических ядер (прокси для апоптотических клеток) в культурах и вводилиткани 12. Эти количественные оценки не выявили какого-либо существенного влияния микроинъекции на жизнеспособность тканей(рисунок 2C). Мы рекомендуем проводить аналогичные контроль качества при установлении органотипической нарезки тканей и микроинъекции трубопровода в лаборатории.
По сравнению с ручной микроинъекции, микроинъекции робот обеспечивает ряд преимуществ. Во-первых, кривая обучения для пользователя менее крутой по сравнению с ручной инъекции: новый пользователь достигнет высокого уровня знаний после ограниченного числа сессий, как правило, 1 или 2. Во-вторых, в случае ручного микроинъекции сопоставимый уровень знаний требует месяцев обучения. Процедура инъекций быстрее и эффективнее(рисунок 2B). Мы количественно эти параметры и обнаружили, что микроинъекции робот превзошел квалифицированного ручного пользователя по отношению к успеху инъекции (% от успешной инъекции / общее количество инъекций) и в общее количество инъекций наединицу времени 12. Это приводит к общему 300% повышению эффективности инъекций (% от успешной инъекции/мин) для микроинъекции робота по сравнению с квалифицированным пользователем. Повышение эффективности было еще более выраженным при сравнении микроинъекции робота с начинающим пользователем и достигло 700%. И последнее, но не менее последнее, робот микроинъекции может быть легко запрограммирован на систематическое изучение всех пространственных параметров. Это особенно выгодно при адаптации микроинъекции робота к новым клеткам или тканям, или при использовании микроинъекции робота для целей, требующих различного пространственного разрешения.
Создание микроинъекции робота требует минимальных изменений в существующий эпифлуоресцентный микроскоп12. Ранее мы предоставили инструкции по этой адаптации в https://github.com/bsbrl/Autoinjector. После установки оборудования этот протокол предоставляет ключевые методологические детали для успешного проведения автоматизированных микроинъекций. В целом, микроинъекция робот имеет успешную скорость впрыска 15,52 и 2,48 инъекций / мин, что в 15 раз больше, чем неопытный пользователь (1,09 ± 0,67 инъекции / мин), и в 3 раз больше, чем опытный пользователь (4,95 ± 1,05 инъекций / мин)12. Это улучшение успешной скорости инъекций дает возможность как начинающим, так и экспертным пользователям вводить больше клеток в более короткое количество времени, которое имеет важное значение для сохранения жизнеспособности тканей. Кроме того, микроинъекции робот настраивается и траектории, глубина инъекции, количество инъекций, интервал между инъекциями все могут быть настроены с помощью графического интерфейса. Эти функции позволяют использовать микроинъекции робота в качестве инструмента для оптимизации ранее трудоемких экспериментов, а также для изучения принципиально новых экспериментов, которые требуют более высокой урожайности, чем это было возможно ранее.
Основные ограничения процедуры микроинъекции, описанной здесь, связаны с подготовкой ломтиков тканей, что является важным шагом, который требует обширной оптимизации. Кроме того, микроинъекция зависит от наличия поверхности, к ней можно подойти стеклянной пипеткой. Эта функция ограничивает тип тканей и тканей местах, которые могут быть направлены через микроинъекции с помощью нынешней установки.
Микроинъекции робот в настоящее время использует яркие изображения поля и был использован в пробирке мозга ломтик подготовки. В будущем робот микроинъекции может быть объединен с 2-фотонной визуализацией, чтобы увеличить специфичность одноклеточного таргетинга in vivo для молекулярной или красителной маркировки. Такие усилия уже были предприняты для одноклеточной электрофизиологии15,16. Текущее устройство требует ручного наблюдения за процедурой микроинъекции. Будущие версии могут включать в себя стратегии для очистки забиты микроинъекциипипетки 17 или интеграциижидкости обработки роботов 18 для мультиплексных, полностью автономных микроинъекций. Эти устройства могут увеличить масштаб микроинъекции на порядок. Адаптация алгоритмов параллельного контроля нескольких микроинъекциипипеток 19 может позволить мультиплексированную доставку десятков красителей и молекулярных реагентов в те же клетки в рамках тех же экспериментов. Это может открыть новые возможности для молекулярного скрининга в тканях.
Робот микроинъекции может быть использован для метки функционально идентифицированных клеток с помощью ДНК или РНК штрих-кодов. Это, в свою очередь, может быть объединено с другими методами анализа одноклеточных клеток, такими как одноклеточное секвенирование РНК (scRNAseq) и электронная микроскопия. Наши предварительные результаты показывают, что микроинъекции клеток и их потомство могут быть восстановлены и изолированы с помощью диссоциации тканей следуют FACS сортировки (Таверна, неопубликованные результаты). Отсортированные ячейки FACS могут быть использованы для scRNAseq. Кроме того, предварительные результаты показывают, что возможности разрешения одной клетки робота микроинъекции могут быть использованы в сочетании с электронным микроскопическим анализом для изучения клеточной биологии нервных стволовых клеток в тканях с высоким пространственным разрешением (Taverna и Wilsch-Br'uninger, неопубликованные результаты). Эти данные свидетельствуют о том, что микроинъекции робот может быть использован в качестве инструмента для коррелятивного света и электронной микроскопии в тканях и в более широком смысле, для мультимодального анализа идентичности клеток и поведения в тканях.
Микроинъекция опирается на использование давления, и можно позволить себе инъекционные растворы с высокой молекулярной сложностью (например, весь транскриптом). Эта особенность микроинъекции была использована в прошлом для изоляции и клонирования лиганд-закрытых рецепторов20. Вдоль этой линии, микроинъекции робот может быть использован для моделирования и изучения мультигенных черт на клеточном уровне. В сочетании со стратегией суб-пулирования робот микроинъекции также может использоваться в качестве платформы для определения минимального набора генов, вождения определенной черты/клеточного поведения. До сих пор робот микроинъекции использовался для манипулирования биохимией клетки с помощью доставки мРНК, ДНК или рекомбинантныхбелков 10,21,22. Мы предвидим применение микроинъекционного робота для зондирования биофизики внутриклеточного пространства, например, путем доставки наноматериалов или наномашин, позволяющих зондировать и/или манипулировать биофизическими свойствами внутриклеточного пространства.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Авторы хотели бы отметить Фонд Номиса (ET). СБК признает средства департамента машиностроения, Колледж науки и техники, MnDRIVE RSAM инициативе Университета Миннесоты, Миннесота департамент высшего образования, Национальные институты здравоохранения (NIH) 1R21NS103098-01, 1R01NS111028, 1R34NS11654, 1R21NS112886 и 1R21 NS111196. GS была поддержана Национальным научным фондом Высшей научно-исследовательской стипендии и NSF IGERT учебный грант.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Agarose, Low Melt | Carl Roth | Cat# 6351.2 | |
| Agarose, Wild Range | Sigma-Aldrich | Cat# A2790 | |
| Best-CA 221 Glue | Best Klebstoffe GmbH & Co.KG | Cat# CA221-10ml | |
| B-27 Supplement | Thermo Fisher Scientific | Cat# 17504044 | |
| Cellmatrix Type-IA (Collagen, Type !) | FUJIFILM Wako Chemicals | Cat# 637-00653 | |
| Distilled Water | |||
| DMEM-F12, CO2 independent (w/o Phenol red) | Sigma-Aldrich | Cat# D2906 | |
| DMEM-F12, CO2 independent (with Phenol red) | Sigma-Aldrich | Cat# D8900 | |
| HEPES-NAOH, pH 7.2, 1M (HEPES buffer) | Carl Roth | Cat# 9105.3 | |
| L-Glutamine, 200 mM | Thermo Fisher Sientific | Cat# 25030024 | |
| Mowiol 4-88 | Sigma-Aldrich | Cat# 81381 | |
| N-2 Supplement | Thermo Fisher Scientific | Cat# 17502048 | |
| Neurobasal Medium | Thermo Fisher Scientific | Cat# 21103049 | |
| Nuclease-free water | Thermo Fisher Scientific | Cat# AM9937 | |
| O2 (40%), CO2 (5%), N2 (55%) Mix, 50 liters | |||
| Paraformaldehyde | Merck | Cat# 818715 | |
| PBS | |||
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | Cat# 15140122 | |
| Rat serum | Charles River Laboratories | ||
| Japan | |||
| Sodium bicarbonate (NaHCO3) | Merck | Cat# 106323 | |
| Sodium hydroxide (NaOH) | Merck | Cat# 106482 | |
| Tyrode’s salt | Sigma | Cat# T2145-10x1L) | |
| Equipment | |||
| Borosilicate glass capillaries, 1.2 mm outer diameter x 0.94 mm inner diameter | Sutter Instruments | Cat# BF-120-94-10 | |
| Bottle-top filter system, 500 mL | Corning | Cat# 430769 | |
| Computer PC | |||
| Custom pressure rig | Custom pressure rig | ||
| Electronic pressure regulator | Parker Hannifin | Cat# 990-005101-002 | |
| Falcon tubes, 15 mL | Corning | Cat# 430791 | |
| Falcon tubes, 50 mL | Corning | Cat# 430829 | |
| Fine-tip paintbrush | |||
| Flaming/ Brown micropipette puller | Sutter Instruments | Cat# P-97 | |
| Forceps, Dumont no. 3 | Fine Science Tools | Cat# 11231-30 | |
| Forceps, Dumont no. 5 | Fine Science Tools | Cat# 11255-20 | |
| Forceps, Dumont no. 55 | Fine Science Tools | Cat# 11252-20 | |
| Heating block | Labtech International | Cat # Dri block Digi2 | |
| Inverted fluorescence microscope | Zeiss | Cat# Axiovert 200 | |
| Light source | Olympus | Cat# Highlight 3100 | |
| Manual pressure regulator | McMaster Carr | Cat# 0-60 PSI 41795K3 | |
| Microloader Tips | Eppendorf | Cat# 5242956.003 | |
| Microcontroller | Arduino | Cat# Arduino Due | |
| Microscope camera Hamamatsu Orca Flash 4.0 V3 | |||
| Motorized stage XY for microscope | |||
| Multiwell plate, 24 wells | Nunc | Cat# 142475 | |
| Pasteur pipettes, plastic | |||
| Petri dish, 60 x 15 mm | Greiner | Cat# 628102 | |
| Petri dish, 35 x 10 mm | Nunc | Cat# 153066 | |
| Petri dish, 34 x 14 mm, including Microwell no. 1.5 cover glass | MatTek | Cat# P35G-1.5-14-C | |
| Pipette holder | Warner Instruments | Cat# 64-2354 MP-s12u | |
| Pipette and tips | |||
| Puller filament, 3.0-mm square box filament | Sutter Instrument | Cat# FB330B | |
| Slice culture incubation box | MPI-CBG | Cat# custom made | |
| Solenoid valve | Cat# LHDA053321H-A | ||
| Stereomicroscope | Olympus | Cat# SZX12 | |
| Tabletop centrifuge | Heraeus | Cat# 5431622 | |
| Thermometer | |||
| Three-axis Manipulator | Sensapex Inc | Cat# tree-axis uMP | |
| Vibratome | Leica | Cat# VT1000s | |
| Whole-embryo-culture-system incubator | Ikemoto Company | Cat# RKI-10-0310 | |
| Waterbath | |||
| Software and Algorithms | |||
| Arduino | Arduino | ||
| Fiji | RRID: SCR_002285 | ||
| Python | Python Software foundation | Python 2.7.12 | |
| ZEN | RRID: SCR_013672 |
Ссылки
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Götz, M., Huttner, W. B. The cell biology of neurogenesis. Nature Reviews Molecular Cell Biology. 6 (10), 777-788 (2005).
- Di Lullo, E., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Lancaster, M. A., Knoblich, J. A. Organogenesisin a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38 (6), 590-600 (2016).
- Pepperkok, R. et al. Automatic microinjection system facilitates detection of growth inhibitory mRNA. Proceedings of the National Academy of Sciences of the United States of America. 85 (18), 6748-6752 (1988).
- Pepperkok, R., Lowe, M., Burke, B., Kreis, T. E. Three distinct steps in transport of vesicular stomatitis virus glycoprotein from the ER to the cell surface in vivo with differential sensitivities to GTPγS. Journal of Cell Science. 111 (13), 1877-1888 (1998).
- Pepperkok, R. et al. β-COP is essential for biosynthetic membrane transport from the endoplasmic reticulum to the Golgi complex in vivo. Cell. 74 (1), 71-82 (1993).
- Ansorge, W., Pepperkok, R. Performance of an automated system for capillary microinjection into living cells. Journal of Biochemical and Biophysical Methods. 16 (4), 283-292 (1988).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nature Neuroscience. 15 (2), 329-337 (2012).
- Wong, F. K., Haffner, C., Huttner, W. B., Taverna, E. Microinjection of membrane-impermeable molecules into single neural stem cells in brain tissue. Nature Protocols. 9 (5), 1170-1182 (2014).
- Shull, G., Haffner, C., Huttner, W. B., Kodandaramaiah, S. B., Taverna, E. Robotic platform for microinjection into single cells in brain tissue. EMBO Reports. 20 (10), e47880 (2019).
- Jabeen, S., Thirumalai, V. The interplay between electrical and chemical synaptogenesis. Journal of Neurophysiology. 120 (4), 1914-1922 (2018).
- Nagy, J. I., Pereda, A. E., Rash, J. E. Electrical synapses in mammalian CNS: Past eras, present focus and future directions. Biochimica et Biophysica Acta - Biomembranes. 1860 (1), 102-123 (2018).
- Suk, H.J. et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo. Neuron. 95 (5), 1037-1047 (2017).
- Annecchino, L. A. et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology. Neuron. 95 (5), 1048-1055 (2017).
- Kolb, I. et al. Cleaning patch-clamp pipettes for immediate reuse. Scientific Reports. 6, 35001 (2016).
- Holst, G. L. et al. Autonomous patch-clamp robot for functional characterization of neurons in vivo: development and application to mouse visual cortex. Journal of Neurophysiology. 121 (6), 2341-2357 (2019).
- Kodandaramaiah, S. B. et al. Multi-neuron intracellular recording 1 in vivo via interacting autopatching 2 robots. ELife. 7, 24656 (2018).
- Lubbert, H. et al. cDNA cloning of a serotonin 5-HT1c receptor by electrophysiological assays of mRNA-injected Xenopus oocytes (RNA fractionation/hybrid depletion/hybrid selection/choroid plexus/voltage clamp). Neurobiology. 84 (2) 4332-4336 (1987).
- Florio, M. et al. Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science. 347 (6229), 1465-1470 (2015).
- Kalebic, N. et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO Reports. 17 (3), 338-348 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены