Method Article
Иррадиатор ввод в эксплуатацию и дозиметрия для оценки параметров α и β, радиационного дозирования схемы и осаждения дозы in vivo
* Эти авторы внесли равный вклад
В этой статье
Резюме
Радиационная дозиметрия обеспечивает методику повышения точности доклинических экспериментов и обеспечения того, чтобы поставленные дозы радиации были тесно связаны с клиническими параметрами. В этом протоколе описаны шаги, которые должны быть предприняты на каждом этапе в ходе доклинических радиационных экспериментов для обеспечения надлежащего экспериментального проектирования.
Аннотация
Радиационная дозиметрия имеет решающее значение для точной доставки и воспроизводимости радиационных схем в доклинических моделях для высокой трансляционной значимости. Перед выполнением любых экспериментов in vitro или in vivo необходимо оценить конкретный выход дозы для облучения и отдельных экспериментальных конструкций. С помощью ионизации камеры, электрометра и установки твердой воды можно определить выход дозы широких полей в изоцентре. Используя аналогичную установку с радиохромными пленками в месте ионизации камеры, можно также определить ставки дозы для небольших полей на разных глубинах. В пробирке клоногенные анализы выживаемости раковых клеток в ответ на лучевую терапию являются недорогими экспериментами, которые обеспечивают меру присущей радиочувствительность клеточных линий путем установки этих данных с традиционной линейно-квадратной моделью. Параметры модели, оцененные на основе этих анализов, в сочетании с принципами биологически эффективных доз позволяют разрабатывать различные графики фракционирования для лучевой терапии, которые обеспечивают эквивалентные эффективные дозы в опухоленосных экспериментах на животных. Это важный фактор, чтобы рассмотреть и исправить при сравнении in vivo графики лучевой терапии для устранения потенциального путаницы результатов из-за дисперсии в доставленных эффективных дозах. В совокупности в этой статье содержится общий метод проверки дозы выходных данных доклинкологических животных и облучения кабинета, в пробирке оценки радиочувствительность, а также проверки доставки радиации в небольших живых организмах.
Введение
Рак коллективно представляют собой вторую по величине причину смерти в США и во многих странах по всему миру1. Лучевая терапия является краеугольным камнем лечения для многих подтипов опухоли и вводится около половины всех больныхраком 2,3. Исходы пациентов почти для всех видов рака улучшились с течением времени, как оборудование, используемое для доставки дозы облучения неуклонно передовые и некоторые эффективные подходы мультимодальной терапиибыли разработаны 4,5,6, но рецидивы и смертность для пациентов с определенными типамиопухолей остаются высокими 7,8,9. Таким образом, лучевая терапия рака продолжает оставаться активной областью фундаментальных и клинических исследований. Во многих доклинических лучевых исследованиях используется мелкомасштабное облучение для доставки доз радиации в пробирку или животных моделей рака. С множеством потенциальных экспериментов для проведения изучения механистической радиобиологии детали или новые методы лечения, общие ловушки могут возникнуть, которые приводят к неправильным выводам, плохой воспроизводимости, и впустую ресурсов. Эти подводные камни подпадают под три важные области: дозиметрия облучения, характеристика в пробирке модельных клеточных линий, а также график и настройка облучения виво. Точные и воспроизводимые результаты более продвинутых экспериментов трудно достичь без предварительного внимания к этим фундаментальным аспектам исследований лучевой терапии.
В протоколе, подробно описанном в этом документе, описывается обобщенная стратегия избежания или смягчения этих проблем и используется несколько ранее разработанных методологий, предназначенных для независимого использования. Эти различные методы были объединены так, что исследователь заинтересован в начале или улучшении доклинкальной лучевой терапии эксперименты могут использовать это в качестве надежного экспериментального макета. Предлагаемые рамки включают методологию ввода в эксплуатацию мелких животных облучателей, для определения основных радиобиологических свойств модельных линий раковых клеток, а также для надлежащей разработки и администрирования графика досирования и фракционирования для моделей опухолей in vivo.
протокол
Любые шаги этого протокола, связанные с использованием лабораторных животных, включая обращение с животными и процедуры, были одобрены Институциональным комитетом по уходу за животными и использованию в Университете Западной Вирджинии в Моргантауне, Западная Вирджиния (номер протокола: 1604001894).
1. Определение выходной дозы
- Используйте этот протокол, основанный на протоколе «В фантомном методе» Американской ассоциации физиков в медицине Task Group (AAPM TG) 6110 и аналогичный протоколу ввода в эксплуатацию, установленного Xstrahl, для определения выходного луча облучения мелких животных в отношении конкретной геометрии при следующих условиях установки.
- Установите облучение для доставки излучения на 220 кВт и 13 мА, с открытым полем (17 см на 17 см), расположенным в изоцентре, или 35 см от источника. Кроме того, фильтруй луч с фильтром Cu диаметром 0,15 мм с широким фокусом. Некоторые клеточные облучители содержат только радиоактивный источник, этот протокол может быть использован только для рентгеновских облучения.
- Выровнять сплошные водяные фантомы в следующем порядке: 1 см плиты, 2 см плиты с слотом ионизации камеры, 2 см плиты, 1 см плиты. Укладка твердых водяных фантомов в этом порядке позиционирует ионизацию камеры на глубине 2 см, что позволяет 4 см, а также для backscatter. Смотрите рисунок 1 для графического изображения настройки дозиметрии.
ПРИМЕЧАНИЕ: Для размещения большой, довольно тяжелый стек твердой воды, авторы рекомендуют приобретение пользовательских 3D печатных диван с переменной поддержкой для обеспечения фантомный стек уровне и на правильном расстоянии от источника по всей поверхности материала, а не только в центре.
- Использование измерительных приборов (т.е. откалиброванной ионизации ADCL, электрометра) и объяснение используемых факторов коррекции можно найти в таблице материалов и таблице 1 соответственно.
ПРИМЕЧАНИЕ: ЧТО ADCL обеспечивает значения Nk в нескольких точках для различных слоев half Value (HVL, мера качества пучка). Значение Nk, которое будет использоваться в протоколе, должно основываться на интерполяции значений ADCL для измеренного HVL единицы. Производитель измерил HVL нашего подразделения, и мы использовали это в определении скорости дозы. - Настройка фантомного стека и вставка камеры ионизации в фантом, как указано в шаге 1.1.2.
- Отрегулируйте фантомный стек таким образом, чтобы расстояние источника до поверхности (SSD) или расстояние от источника излучения до первой поверхности составляет 33 см при соответствующем выравниваемом уровне.
ПРИМЕЧАНИЕ: Авторы предлагают создать обычай, 3D печатных диван, достаточно большой, чтобы поддержать размеры твердых плит воды. Кроме того, тот, который используется в этом протоколе, имеет регулируемый компонент для выравнивания фантомного стека.
- Отрегулируйте фантомный стек таким образом, чтобы расстояние источника до поверхности (SSD) или расстояние от источника излучения до первой поверхности составляет 33 см при соответствующем выравниваемом уровне.
- Возьмите в среднем три отдельных рентгеновских экспозиций, одна минута показания с напряжением электрометра смещения установлен на 300 В. Результат будет терминомМ..
ПРИМЕЧАНИЕ: Облучение осуществляется с помощью прибора, установленного для доставки излучения на 220 кВт и 13 мА. Это то же самое для следующих двух шагов (шаги 1,5-1,6). Для безопасности пользователей убедитесь, что двери остаются закрытыми во время процедур. - Выполните еще один набор из трех отдельных рентгеновских экспозиций, 1 мин показания с напряжением электрометра смещения установлен на -150 V. Результат будет назвали ML.
- Выполните еще один набор из трех отдельных рентгеновских экспозиций, 1 мин показания с напряжением электрометра смещения установлен на -300 V. Результат будет назвали MH,или также M-.
- РассчитайтеP pol и Pион с помощью Equation 1 и Equation 2 соответственно, как описано ниже:
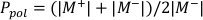 (Уравнение 1)
(Уравнение 1)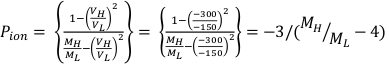 (Уравнение 2)
(Уравнение 2) - Измерьте температуру, в Цельсии, и давление, в kPa, внутри облучения с помощью откалиброванного цифрового термометра и барометра. Затем вычислите PTP, как указано ниже в Equation 3.
ПРИМЕЧАНИЕ: Этот расчет предполагает, что ADCL использовал стандартные значения температуры и давления 22 градусов по Цельсию и 101,33 кПа при объявлении их значения для фактора калибровки керма воздуха.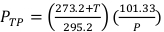 (Уравнение 3)
(Уравнение 3) - Рассчитайте исправленное чтение камеры, M, путем умножения чтения сыройкамеры,M H , по Pelec, Ppol, Pион, и PTP. Это уравнение можно найти ниже в уравнении 4.
ПРИМЕЧАНИЕ: Этот расчет предполагает, что ADCL выполнили свою калибровку с напряжением смещения, установленным до -300V, что является довольно распространенной практикой.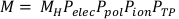 (Уравнение 4).
(Уравнение 4). - Далее умножьте исправленное чтение камеры Nk, (μ en/p)wвоздуха,P, cham, и Pоболочки. Pоболочка необходима только для измерений, полученных в воде. Таким образом, для этого протокола Pоболочка составляет всего 1.
ПРИМЕЧАНИЕ: Используя условия в этом протоколе, последние три пункта дают значение 1.0731. Это значение зависит от качества луча, поэтому HVL должен быть известен, чтобы определить его. Значение 1.0731 специфичен для нашего подразделения и приводится в качестве примера. Чтобы определить значенияP, cham и (μen/p)w воздухаи воды, специфичной для вашего подразделения, используйте измеренный HVL и интерполировать из таблицы VII, и таблица VIII, и правильно для размера эталонного поля в соответствии с рисунком 3 и рисунок 4 из протокола AAPM TG6110. В нашем случае,умножение N k на 1,0731 обеспечивает дозу воды, DW, в Gy в течение номинального времени 1 мин, предполагая, ADCL Nk значение дается в Gy / Coulumbs. - Определите конечный эффект используемого облучения. Когда рентгеновские лучи впервые генерируются, выход поднимается до полной стоимости в течение некоторого конечного времени. Аналогичным образом, когда рентгеновский источник выключен, выход уменьшается до нуля в течение некоторого конечного времени.
- Учитывать время для этого перехода, или конечный эффект. Это можно сделать, взяв в среднем три показания с напряжением электрометра смещения установлен на -300 V, для различных настроек времени. Делайте это в течение 6, 12, 18, 24, 30 и 60 секунд.
- Участок показания электрометра со временем и найти лучшую прямую линию. Общее время, т, за 1 минуту лечения можно рассчитать по уравнению 5:
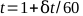 (Уравнение 5).
(Уравнение 5).
- Рассчитайте скорость дозы для данного облучения по уравнению 6:
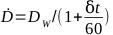 (Уравнение 6)
(Уравнение 6)
2. Создание кривой калибровки радиохромной пленки
- Список необходимых материалов можно посмотреть в таблице материалов.
- Используя почти идентичный набор, как предыдущий протокол, поместите пленку на глубину 2 см в твердой воде фантом стек. Порядок твердых фантомов воды является незначительным до тех пор, пока Есть 2 см твердой воды выше и 4 см твердой воды ниже для накопления и backscatter эффекты.
- Используя установленную дозу, введенную в протокол 1, определите время лечения доз, перечисленных в таблице 2, используя уравнение 7:
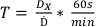 (Уравнение 7)
(Уравнение 7) - Подготовь несколько частей пленки, гарантируя, что каждый фильм имеет одинаковый размер и остается в той же ориентации от лечения через сканирование приобретения. Это можно сделать, поместив небольшой диагональный разрез в левом нижнем углу. Каждый фильм с этого момента вперед должен быть из той же партии пленки.
ПРИМЕЧАНИЕ: Подготовка 3 отдельных репликаций для каждой точки дозы, которые будут оцениваться. - Сканирование вырезать штук с помощью 48-битного цветного фото сканера со всеми исправлениями выключен. Убедитесь, что каждая пленка находится в точном центре сканирующей кровати. Полученные значения являются предэкспозицией, используемой для определения неэкспонированной оптическойплотности 11,12. Сохранить все изображения в . Формат файла Tiff, чтобы избежать сжатия ключевых данных.
ПРИМЕЧАНИЕ: Авторы рекомендуют сканировать пленки три раза и использовать полученное среднее значение в качестве единого значения для данного фильма. - Начните облучение пленок, поместив кусок пленки на вершине 4 см твердой воды и располагаемые оставшиеся 2 см твердой воды выше, как описано ранее в этом разделе.
- Отрегулируйте фантомный набор так, чтобы пленка была на том же расстоянии от источника, что и камера ионизации при определении выходной дозы. Это изоцентрическая точка облучения.
- Программа время лечения рассчитывается в шаге 2,3 выше для одной предписанной дозы.
- Повторите лечение для каждой из доз, перечисленных в таблице 2.
- Разрешить пленки для отдыха в течение 24 часов защищены от света.
- Приобретайте сканирование пленки после экспозиции так же, как и выше.
- Импорт изображения в программное обеспечение анализа ImageJ и выполнять все измерения на красном канале.
- Перетащите изображение в . Формат файла Tiff в ImageJ.
- Нажмите на меню падения изображения. Выберите цвет из меню падения изображения. Выберите разделенные каналы из опции Color.
- Используя только красный канал изображения, нарисуйте область интереса с помощью прямоугольника инструмента. Нажмите Ctrl-M. Транскрибировать среднее значение из окна результатов.
- Повторите шаги 2.12.1-2.12.4 для всех отсканированных фильмов.
- Получите пиксельное значение в централизованно расположенном квадрате 1 см на 1 см как для неэкспонированных, так и для открытых пленок. Эти значения будут обозначаться как PVU(D) и PV(D) соответственно, и могут быть использованы для расчета чистой оптической плотности, как описано в Equation 8.
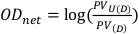 (Уравнение 8) 13 Лет
(Уравнение 8) 13 Лет
- Повторите шаг 2.13 для каждой пары изображений фильма, как до экспозиции, так и после экспозиции.
- Участок график дозы по сравнению с чистой оптической плотности и подходят кривой к кубическим полиномиальным в формате уй топор 3 и bx2 х й d. Пример можно найти на рисунке 2B.
3. Определение α/β для конкретных линий раковых клеток с помощью клоногенного анализа
ПРИМЕЧАНИЕ: Следующий протокол представляет 14-ю модифицированную версию методов,описанных Франкеном и др., и ее можно увидеть на рисунке 3.
- Выращиваемые клетки до 80% стечения. Избегайте использования чрезмерно стеченных источников клеток для этого эксперимента, так как необходимо, чтобы клетки находятся в стадии входа в клетку роста. Для репрезентативных клоногенных результатов анализа отображается на рисунке 3C, мозг-тропик MDA-MB-231 раковые клетки молочной железы были выучены в Dulbecco в модифицированных Eagle Medium (DMEM) дополнены 10% плода бычьей сыворотки и пенициллина / стрептомицина и были инкубированы при 37 градусов по Цельсию и 5% углекислого газа во влажном инкубаторе.
- Семя клеток при желаемой плотности для анализа колонии. Точные разбавления во время посева имеют решающее значение для определения эффективности покрытия анализа. Не забудьте пластины несколько репликаций.
- Продолжить этот шаг, если лучевая обработка будет предшествовать покрытие клеток (Рисунок 3A). Кроме того, перейти к шагу 3.4, если покрытие клеток будет предшествовать лучевой терапии.
- Выполняем желаемую лучевую обработку на культурных колбы. Любые дополнительные процедуры (т.е. медикаментозное лечение) могут быть проведены в любой момент до или после этого. Для репрезентативных результатов на рисунке 3C,лучевая обработка произошла после покрытия клеток, подробно описанных в шаге 3.4.
- Извлекайте клетки с помощью предпочтительного метода трипсинизации и создайте одноклеточную подвеску. Удалите культурные средства массовой информации и добавьте рекомбинантный фермент (например, TrypLE Express), чтобы отделить клетки от колбы. Инкубировать клетки с ферментом в течение примерно 3 минут, пока клетки были отделены, как обнаружено с помощью светового микроскопа. Нейтрализуйте фермент, используя равный объем средств массовой информации клеточной культуры. Центрифуги клетки на 300 х г в течение 10 мин и resuspend к желаемой концентрации в среде культуры.
- Плита клеток при желаемой плотности в нескольких репликациях.
- Заменить свежими средствами массовой информации после первых 24 ч.
- Продолжайте заменять мультимедиа каждые 2-3 дня.
- Продолжайте культивирование клеток до тех пор, пока контрольные колонии не превысят 50 клеток на колонию, 9-14 дней. Контрольные колонии – это те лечебные группы, которые не получают дозы облучения. Для экспериментов с использованием лечения наркомании, а также, другая контрольная группа с дозированием наркотиков, но не лучевая обработка также не потребуется.
- Продолжить этот шаг при посеве клеток до лучевой терапии (рисунок 3B).
- Извлекайте клетки, используя предпочтительный метод трипсинизации и создавайте одноклеточную подвеску.
- Поместите клетки при желаемой плотности в несколько репликаций.
- Разрешить ячейки придерживаться пластины на ночь.
- Выполняем желаемые дозы облучения. Дополнительные процедуры, такие как допинг, могут быть выполнены в любой момент до или после этого шага, до тех пор, как клетки прикрепили к их лечения пластин. Для репрезентативных результатов на рисунке 3C,1250 мозг-тропических клеток MDA-MB-231 были поцааканы до лечения (шаг 3.4). Затем клетки обработали 15 nM доксорубицином за 3 часа до облучения 3 г рентгеновских лучей.
- Замените мультимедиа после первых 24 ч.
- Замена мультимедиа каждые 2-3 дня.
- Культура обработанных клеток до тех пор, пока колонии контрольной группы не превысят 50 клеток, 9-14 дней. Контрольные колонии – это те лечебные группы, которые не получают дозы облучения. Для экспериментов с использованием лечения наркомании, а также, другая контрольная группа с дозированием наркотиков, но не лучевая обработка также не потребуется.
- Удалите культурные средства массовой информации из колодцев или посуды, и мыть с PBS.
- Исправить клетки в течение 15 минут в 1:7 (v:v) раствор ледниковой уксусной кислоты и метанола.
- Удалите решение фиксации.
- После фиксации, пятна клеток в течение 30 минут, или 2 ч, если время доступно, при комнатной температуре с 2,5-5,0 мг / мл раствора кристалло-фиолетового в 4:1 (V:V) раствор дистиллированной воды и метанола.
- Удалите раствор окрашивания и промыть клетки в большой, комнатной температуре водяной бани.
ПРИМЕЧАНИЕ: Не мыть под проточной водой. - Подсчитайте в результате количество колоний в каждой группе лечения и вычислить выживаемость фракции каждой пластины.
- Участок выживания фракции против соответствующей дозы доставлены, и соответствовать кривой с экспоненциальной подходят.
- Для оценки α/β значения используйте экспоненциальный припадок приведенного выше участка для оценки значений для каждого из регулируемых параметров в линейно-квадратном уравнении, найденном ниже:
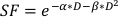 (Уравнение 9)
(Уравнение 9)
ПРИМЕЧАНИЕ: Облучение клеток, как правило, может быть сделано в изоцентре без какой-либо коллимации при условии, что размер поля достаточно велик, чтобы вместить хорошо пластины или чашки Петри. Потенциальные подводные камни в этом протоколе могут включать такие урожаи, как отсутствие образования колонии, значительная миграция клеток с явным ростом клеток, но без истинных колоний, или загрязнение из-за лечения в нестерильную камеру облучения.
4. Определение конкретной дозы для переменных экспериментальных конструкций
- Определите желаемый размер поля и расстояние от источника.
ПРИМЕЧАНИЕ: Коллимация изменит скорость дозы независимо от размера или расстояния коллиматора от рентгеновского источника. - Использование твердой воды фантомы для обеспечения накопления и backscatter, положение кусок пленки в правильной ориентации, которая наилучшим образом изображает экспериментальный дизайн.
ПРИМЕЧАНИЕ: Для любой экспериментальной установки твердая вода не может обеспечить наиболее точное представление данной конструкции. Вместо этого мы рекомендуем использовать сосуды фактического эксперимента (т.е. чашку Петри, хорошо пластины, мелкие фантомы животных и т.д.). - Облучать пленки в течение 1 (N-3) и 2 (N-3) минут.
- Разрешить пленки для отдыха в течение 24 часов защищены от света.
- Определите чистую оптическую плотность каждого пленки после процедур из раздела 2. Используйте кривую калибровки пленки для определения дозы от чистой оптической плотности.
- Определите дозу в 1 минуту, D1, как выходная доза, Ḋ, для этой экспериментальной установки, определенной Equation 10 следующим образом:
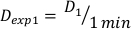 (Уравнение 10)
(Уравнение 10) - Аналогичным образом, калуцировать дозу на 2 минуты по уравнению 11 следующим образом:
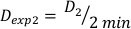 (Уравнение 11)
(Уравнение 11) - В связи с конечный эффект, доза ставка для вышеуказанных расчетов может быть несколько иной. По этой причине для расчета Dexp для желаемого экспериментального дизайна, используйте среднее количество отдельных Dexp, как указано в уравнении 12:
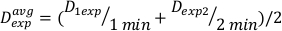 (Уравнение 12)
(Уравнение 12) - Используя это среднее значение, определите время для лечения любой желаемой дозы для этой конкретной установки в Equation 13:
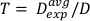 (Уравнение 13)
(Уравнение 13)
5. Лечение опухолей мышей, несущих в анатомическом месте, представляющих интерес
- Анестезия мыши с безопасными и гуманными методами анестезии, утвержденными МАКУК учреждения.
- Поместите обезболивающее животное в сдержанность, как указано в желаемом экспериментальном дизайне.
- Этот шаг является необязательным, если он недоступен, переходить к шагу 5.6. Получить радиограмму, используя камеру бортового портала, мыши без коллимации с помощью алюминиевого фильтра.
- Получить вторую радиограмму с коллимацией на месте.
- Наложить радиограммы в ImageJ, чтобы продемонстрировать позиционирование луча.
- Используя предопределенное значение α/β, определите схему дозы, которая обеспечивает наиболее разумный подход к ответу на исследовательский вопрос (т.е. при желании смоделировать эффекты дозы 30Gy, поставляемой в 10 фракциях 3 Gy, но только хотите дать четыре фракции). Используя уравнение 14, с предполагаемой стоимостью α/β 10 (это значение может быть определено для отдельных линий раковых клеток в протоколе 3)и BED, аналогичном значению 30 Gy/10 F, лечить 24 Gy в 4 фракции 6 Gy.
- Лечить животное в течение установленного времени, данного для желаемой дозы.
6. Гистологическое подтверждение осаждения дозы in vivo
- Следуя протоколу 5, собирать ткани, представляющие интерес в течение 1 часалечения 15,16. После сбора тканей, приступить к предпочтительной иммуногистохимии протокола. Пример приведен ниже.
- Perfuse животных с ледяной 4% параформальдегид (PFA).
- Постфикс в ПФА при 4 градусов по Цельсию.
- После фиксации, исправить ткани последовательно в 10%, 20%, и 30% сахарозы в течение 24 часов каждый при комнатной температуре.
- Вставлять ткани в желатин и последовательно фиксировать в 4% PFA и снова в 10-30% сахарозы в течение 24 часов каждый при комнатной температуре.
- Обрезать блок и поместить при -80 градусов по Цельсию в течение 30 минут.
- Нарежьте ткани на 20-30 мкм секций.
- Иммуностин слайды, как свободные плавающие разделы в шесть хорошопластины 17,18.
- Вымойте три раза и проницайте в течение 30 минут на шейкере с 1,83% лизина в 1% Тритон, и 4% тепловой инактивированной сыворотки козы.
- Инкубировать секции с антителами против ЗГ2АКС в течение 24 часов, а затем 2 часа инкубации с желаемым вторичным антителом.
- Слайды Coverslip со стеклянными крышками с использованием предпочтительных монтажных средств массовой информации.
- Изображение на флуоресцентном микроскопе.
Результаты
Следуя протоколу 1 обеспечит дозу в Gy/min, которая специфична для используемого облучения. Однако, независимо от типа облучения, с известной скоростью дозы кривая калибровки может быть создана с помощью протокола 2, уступая аналогичные пленки и аналогичные кривой калибровки, что на рисунке 2A-B. Успешное анализ протокола 3 даст различные, хорошо разграничено колоний клеток, которые пятна однородно фиолетовый. Оценку α/β можно сравнить с литературными значениями или другими группами лечения для интерпретации радиочувствительность данной клеточной линии. Использование кривой калибровки, разработанной по протоколу 2 и отображаемой на рисунке 2B,протокол 4 даст два образца пленки, напоминающие рисунок 2A, которые могут быть использованы для оценки требуемого экспериментального времени облучения. Если для использования облучителя доступна камера визуализации на борту портала, радиограммы мелких животных можно получить с коллимацией и без нее. Наложение этих изображений продемонстрирует точное позиционирование коллимированного луча излучения по отношению к маленькому животному, которое рассматривается как изображенное на рисунке 4A. Успешное осаждение дозы в протоколе 5 может быть подтверждено в соответствии с протоколом 6. Одним из признаков того, что излучение откладывается в системах in vivo или in vitro, является обнаружение двойных разрывов ДНК. Иллюстрированная на рисунке 4B,та же мышь, обработанная исключительно через правое полушарие на рисунке 4A,демонстрирует положительное окрашивание h2AX только в обработанное полушарие. На этом рисунке ядра окрашены DAPI, чтобы показать две вещи; 1) целое из мозга, к которому в ходе гистологического анализа применялось анти-антитело КХ2АКС, а 2) необработанное полушарие мозга остается неочищенное.
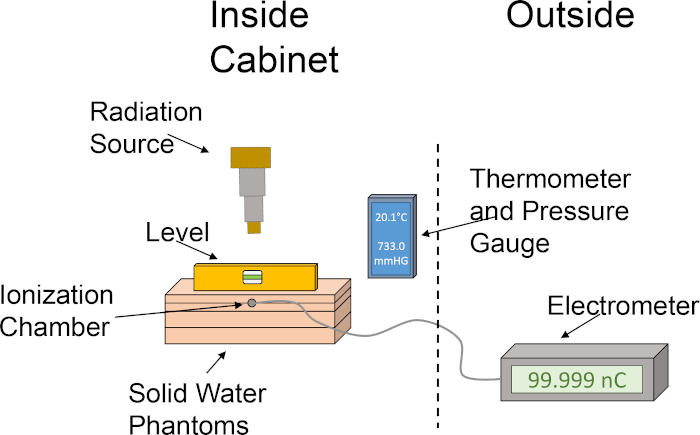
Рисунок 1: Грубая настройка ионизации камеры и воды фантом создан для определения дозы выход. Пиктограмма иллюстрирует основную установку с использованием различных компонентов, необходимых для дозиметрии с помощью ионизации камеры и твердых фантомов воды в шкафу облучения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Поколение кривой калибровки с использованием радиохромной пленки. (A)Представитель изменение цвета радиохромной пленки с увеличением дозы. Вверху слева (0 cGy); в правом нижнем углу (2000 cGy). (B)Потенциальная кривая калибровки радиохромной пленки, сравнивающая чистую оптическую плотность и дозу. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
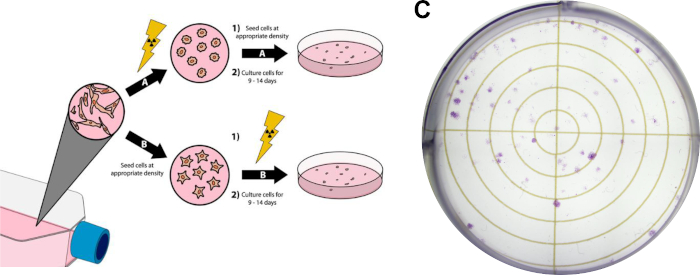
Рисунок 3: Клоногенный анализ раковых клеток. Лучевая обработка клеток может быть сделано до покрытия в шести хорошо пластин / Петри блюда (A), или после (B). В панели(C), репрезентативное изображение отображается успешного клоногенного анализа с MDA-MB-231 раковых клеток молочной железы после следовать протоколу раздел 3. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
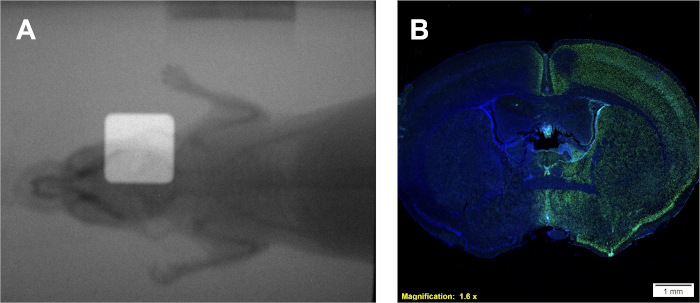
Рисунок 4: Использование двойных накладных радиограмм для позиционирования (при наличии) и положительного иммуногистохимического окрашивания для подтверждения осаждения дозы. (A)Представитель накладывается радиограммы, изображающие размещение луча излучения. (B)Репрезентативные результаты, указывающие на осаждение дозы в правом полушарии, о чем свидетельствует повышенная интенсивность х2AX. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Коэффициент коррекции | Объяснение | |
| НС | Коэффициент калибровки воздушной кермы | |
| (μан/к)Wвоздуха вода | Рацион коэффициентов поглощения массы энергии воды в воздух; приблизительно 1,05 | |
| Pq,Чам | Коррекция учета стебля камеры, влияющих на пертербирование фотон-гриппа камерой; приблизительно 1,022 | |
| Pоболочка | Исправление учета оболочки, защищающей ионизацию камеры; значение 1, так как камера водонепроницаема | |
| Ppol | Коэффициент коррекции, учитывая полярность; определены в Протоколе 1 | |
| Pион | Коэффициент коррекции, учитываемый рекомбинацией ионов; определены в Протоколе 1 | |
| PTp | Коэффициент коррекции, акукунирование для темерпатуры и давления в день эксперимента; определены в Протоколе 1 | |
Таблица 1: Факторы коррекции, необходимые для определения скорости дозы в Протоколе 1.
| Доза | N |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| * Только необходимы для доз, превышающих 10 для индивидуальных экспериментов. | |
Таблица 2: Дозы, которые будут использоваться в генерации кривой калибровки радиохромной пленки.
Обсуждение
Вышеупомянутый протокол описывает удобный подход к радиационной дозиметрии, определение значений α/β в линиях раковых клеток и краткий пример подхода к облучению в доклинковой модели метастазов в мозг рака молочной железы. Эти методы могут быть использованы для изучения любой модели рака и не ограничиваются только метастазами мозга рака молочной железы. В этом разделе мы обсудим соответствующие тонкости, лежащие в основе доклинкологических экспериментов лучевой терапии.
Дозиметрия включает в себя две части: 1) калибровать выход с фермером камеры, так что скорость дозы рентгеновского блока устанавливается, и 2) подготовить практическую дозиметрическую систему измерения с использованием радиохромной пленки. Что касается калибровки выходов, то ТГ-61 обеспечивает воспроизводимый метод в воде. Протокол здесь использует Gammex RMI 457 твердой воды, как рекомендовано XStrahl, производитель облучения. Хотя относительная дозиметрия (профили или кривые глубинной дозы нормализуется до максимальной дозы) анализ с твердой водой, соглашается лучше, чем 1% с водой, есть разница от 3 до 4% в абсолютной дозе из-за более высокого коэффициента поглощения массы энергии для твердой воды по сравнению с водой. Однако, поскольку все установки системы XStrahl используют протокол твердой воды для калибровки вывода, мы не исправили эти различия. Знание вывода позволяет вычислить время воздействия, необходимое для доставки желаемой дозы. Размещение пленки в той же установке, что и фермерская камера, позволяет нам доставлять известные дозы в пленку. Сканирование пленки затем обеспечивает оптическую плотность. Доза пленки может быть на графике против соответствующей чистой оптической плотности (разница в оптической плотности после и до экспозиции). Это создает кривую калибровки пленки. Когда мы меняем экспериментальные установки, доза в этой ситуации может измениться, так как скорость дозы зависит от размера поля, глубины и материала облучения. Разоблачение пленки с экспериментальной установкой обеспечивает нам чистую оптическую плотность, и с помощью кривой калибровки пленки, мы можем определить соответствующую дозу. Разделив эту дозу к тому времени, когда пленка была облучена, мы получаем дозу. Эта доза ставка может быть использована для расчета времени воздействия доставить желаемую дозу для данной экспериментальной установки. Описанный выше протокол обрабатывает несколько нюансов, связанных с дозиметрией пленки. Например, после экспозиции пленке требуется около 24 часов, чтобы химические реакции в активном слое пленки были практически завершены. Не дожидаясь этого количества времени приведет к снижению оптической плотности.
Для любого исследования, чтобы иметь воспроизводимую дозиметрию важно знать и понимать некоторые из ключевых элементов данного облучения. В частности, очень важно знать и подробно другим исследователям сделать и модель облучения используется, тип источника (рентгеновский, радиоактивный и т.д.), энергия, слой половины стоимости, размер поля, источник к поверхности и источник к расстояниям изоцентра, размер материала облученный, attenuation перед и backscatter после облученное материал, эксперимент-специфический тариф дозы, схема фракции, точно используемое оборудование дозиметрии, и протокол dosimetry использованный. Все эти точки информации являются то, что сплоченно описать качество пучка данного облучения до доставки дозы для любого животного или клетки19. Еще одним актуальным моментом информации из этого протокола и других является то, что доза, достигнутая в Протоколе 1, является просто выходом используемого облучения. Для любого данного эксперимента важно определить скорость дозы для этой конкретной установки (Протокол 4) по сравнению с генерируемой кривой калибровки радиохромной пленки (Протокол 2).
Эксперименты in vitro содержат важные сведения о радиобиологическом поведении линий раковых клеток. In vitro клоногенных клеток выживания анализы точно оценить и количественно присущиерадио-чувствительность клеточной линии 20, помогая в разработке графиков фракциотации в последующих клеточных или малых экспериментов наживотных 21. В частности, эти анализы приблизительные значения параметров α и β, которые используются в линейно-квадратной модели для прогнозирования смерти клеток в ответ на лучевую терапию в соответствии с уравнением:
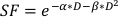 (Уравнение 9)
(Уравнение 9)
где SF является уцелевшие фракции клоногенно жизнеспособных клеток, D дозы радиации в Gy, и α и β установленыпараметры 22. Соотношение между α/β является неотъемлемой мерой клеточной радиочувствительностью, при этом более высокие значения коррелируют с повышенной чувствительностью клеточнойлинии 22. Поскольку эта функциональная связь нелинейна по отношению к дозе, биологические эффекты схемы фракциоции лучевой терапии связаны не только с общей дозой, но и с количеством и размеромфракций 23. Биологическая эффективная доза (BED) является мерой истинной биологической дозы, доставленной в ткань, и позволяет прямо сравнивать различные схемы фракционноедело 24,25. Уравнение BED требует только оценки α/β и отображается ниже:
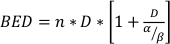 (Уравнение 14)
(Уравнение 14)
где n является число фракций дозы D. Клоногенные клетки выживания анализы оценки α/β и облегчить прямое сравнение схем разфракации лучевой терапии через уравнение BED. Неправильные выводы могут быть сделаны в отношении ткани или органа ответ на лучевую терапию (или комбинации лучевой терапии с другими способами), если BED в группах лечения не является справедливым в рамках или между экспериментами. Например, 2 фракции 10 Gy по сравнению с 4 фракциями 5 Gy не дают той же BED, и, таким образом, эти схемы досирования не могут быть непосредственно сопоставлены с точки зрения биологической реакции. Уравнение BED, хотя и несовершенно из-за присущих ограничений в линейно-квадратной модели, надежно оценивает справедливые эффекты для широкого спектра экспериментальныхусловий лечения 24,25.
Клоногенные анализы выживаемости клеток явно играют важную роль в изучении эффектов лучевой терапии в моделях рака, но эксперименты in vitro предлагают ряд дополнительных вариантов для дальнейшего изучения механистических деталей радиобиологии раковых клеток. Простые модификации анализа выживаемости клеток клоногенных были использованы для определения способов действия для некоторых радио-сенсибилизации химиотерапии, таких как паклитаксель илиэтопозид 26,27. Дальнейшие экспериментальные варианты in vitro включают иммуноцитохимию исследований для изучения конкретных клеточных путей ремонта, таких как γ-H2AX очагов и / или 53BP1 окрашивания для двойной мель ДНК перерывремонт 28. Эти эксперименты могут быть особенно заинтересованы при сравнении лучевой терапии как единой модальности с комбинированной терапии, особенно при зондировании механистических деталей для данной клеточной линии. Другие экспериментальные варианты включают измерения цитокинов для изучения врожденной роли воспалительной реакции клетки на облучение или анализ способа смерти клеток (т.е. апоптоза, некроза, митотической катастрофы и т.д.) приразличных терапевтических условиях 29,30,31. Этот тип экспериментов может дополнить или заменить эксперименты на животных и обеспечить более полное понимание радиобиологии линии раковых клеток. Независимо от выбора дополнительных экспериментов для проведения, стандартный анализ выживаемости клоногенных клеток, описанный в протоколе 3, является важной первоначальной радиобиологической оценкой клеточной линии.
Клоногенные анализы и радиационная дозиметрия предоставляют исследователю средства для точного планирования экспериментов, чтобы более непосредственно напоминать клинические сценарии. С добавлением доклинций рака малых моделей грызунов, можно изучить реакцию на радиацию в одиночку или в контексте плана лечения in vivo. Перед использованием животных, важно определить относительную дозу выход конкретной установки, если она отличается от установки, используемой дляопределения дозы выход 32,33. Когда дело доходит до определения скорости дозы для размеров поля lt;10 мм, использование ионизации камеры становится менее точным из-за выравнивания в пределах небольшого поля и частичного эффекта усредненияобъема 33. Использование радиохромной пленки для определения выхода в сочетании с in vivo иммуногистохимических экспериментов было использовано для определения выходных данныхи осаждения дозы в последние 16,34,35,36,37,38.
Раскрытие информации
Авторы не имеют раскрытия информации, чтобы сделать.
Благодарности
Авторы хотели бы поблагодарить микроскоп и животных моделей изображений Facilites на WVU за использование их оборудования при поддержке гранта номер P20GM103434. Кроме того, эта работа была поддержана грант номер P20GM121322 от Национального института общих медицинских наук, Национальный институт рака грант номер F99CA25376801, и Mylan Председатель фонда.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
Ссылки
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5 (2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001 (2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104 (2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. . Radiobiology for the radiologist. Eighth edition. , (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96 (2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251 (2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204 (2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134 (2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены