Method Article
Атомно-силовая микроскопия в сочетании с инфракрасной спектроскопией в качестве инструмента для исследования химии одиночных бактерий
В этой статье
Резюме
Атомно-силовая микроскопия-инфракрасная спектроскопия (AFM-IR) обеспечивает мощную платформу для бактериальных исследований, позволяющую достичь наноразмерного разрешения. Как картирование субклеточных изменений (например, при делении клеток), так и сравнительные исследования химического состава (например, возникающие из лекарственной устойчивости) могут проводиться на уровне одной клетки у бактерий.
Аннотация
Атомно-силовая микроскопия-инфракрасная спектроскопия (AFM-IR) - это новый комбинаторный метод, позволяющий одновременно характеризовать физические свойства и химический состав образца с наноразмерным разрешением. Комбинируя AFM с ИК, преодолевается ограничение пространственного разрешения обычного ИК, что позволяет достичь разрешения 20–100 нм. Это открывает двери для широкого спектра новых применений ИК для прощупшения образцов размером менее нескольких микрометров, ранее недостижимых с помощью обычной ИК-микроскопии. AFM-IR в высшей степени подходит для бактериальных исследований, предоставляя как спектральную, так и пространственную информацию на одноклеточном и внутриклеточном уровне. Растущие глобальные проблемы со здоровьем и неблагоприятные прогнозы будущего в отношении бактериальных инфекций, и особенно быстрое развитие устойчивости к противомикробным препаратам, создали настоятельную потребность в исследовательском инструменте, способном к фенотипическому исследованию на одноклеточном и субклеточном уровне. AFM-IR предлагает потенциал для удовлетворения этой потребности, позволяя детально охарактеризовать химический состав одной бактерии. Здесь мы предоставляем полный протокол для подготовки образцов и сбора данных о единых спектрах и модальности картирования для применения AFM-IR для бактериальных исследований.
Введение
Бактерии представляют собой одноклеточные прокариотические организмы, встречающиеся в различных формах и размерах, обычно в диапазоне от нескольких сотен нанометров до микрометров. Они существуют в различных местах обитания и необходимы для существования жизни. В организме человека большинство бактерий, присутствующих в кишечнике, безвредны, и многие из них на самом деле полезны1. Однако некоторые виды бактерий являются патогенными и вызывают целый ряд инфекционных заболеваний. Бактериальные инфекции могут привести к развитию сепсиса и септического шока: опасного для жизни состояния, возникающего в результате реакции организма на инфекцию2. Сепсис является глобальной серьезной угрозой для здоровья, с высокой распространенностью во всем мире и тяжелыми показателями смертности. Только в 2017 году, по оценкам, во всем мире было зарегистрировано 50 миллионов случаев сепсиса, причем 11 миллионов из них привели к смерти (примерно 20%)2. Кроме того, было показано, что снижение шансов на выживание пациента из-за задержки терапии происходит ежечасно3,4.
Бактериальные инфекции лечатся антибиотиками. Тяжесть потенциальных последствий бактериальных инфекций кровотока (BSI) вместе с явным значением быстрого начала антимикробной терапии обусловляют необходимость немедленного введения антибиотиков. Однако, поскольку современные диагностические подходы, используемые в клинической практике (например, культивирование крови), требуют относительно длительного времени, введение антибиотиков часто происходит до положительного диагноза BSI5. Этот фактор приводит к широкому чрезмерному использованию антибиотиков, что вместе с чрезмерным использованием антибиотиков в других секторах, таких как сельское хозяйство, создает серьезное эволюционное давление на развитие устойчивости к противомикробным препаратам (УВМ)6,7. УОМ в настоящее время является одной из наиболее актуальных глобальных проблем здравоохранения7,8 и, по прогнозам, к 2050 году станет основной причиной смерти9. Развитие резистентности вместе с распространением штаммов УВМ происходит тревожными темпами7,8,9 и превышает, на сегодняшний день, темпы открытия новыхантибиотиков 10. Новые устойчивые фенотипы постоянно появляются во всем мире, в то время как
исследования, направленные на понимание изменений, связанных с УУО, часто медленны и ограничены имеющимися подходами11. Кроме того, широко используемые методы, такие как полимеразная цепная реакция (ПЦР) и секвенирование целых генов (WGS), фокусируются только на генотипических изменениях. Этого недостаточно для выявления механизмов резистентности11,что вызывает острую потребность в исследовательском инструменте, позволяющем понять химический состав бактерий.
Инфракрасная спектроскопия (ИК) обеспечивает молекулярную характеристику образца и, таким образом, является перспективным кандидатом для фенотипического бактериального исследования. С момента его раннего применения12,большая величина примеров его использования была продемонстрирована в литературе13,14. К ним относятся фенотипическая идентификация бактерий на уровне рода15,вида16иштамма 17,18. Однако пространственное разрешение обычного ИК ограничено несколькими микронами из-за дифракции длины волны, пространственного предела разрешения19. Поскольку размер большинства бактерий лежит ниже этого предела (например, ось зернистого стафилококка ≈ 400 нм в диаметре), обычный ИК не применим для прощупления на одноклеточном или внутриклеточном уровне.
Ограничение пространственного разрешения было недавно преодолено путем объединения ИК-спектроскопии с атомно-силовой микроскопией (AFM-IR). В этом случае ИК-поглощение обнаруживается косвенно, через тепловое расширение материала19,20,21,22. Короче говоря, поглощение ИК-излучения приводит к локальному повышению температуры. Это может быть измерено либо непосредственно23, либо путем измерения колебаний консольного зонда AFM, возникающих в результате силового импульса, создаваемого ИК-поглощением20,21. Комбинаторная методика AFM-IR позволяет достичь пространственного разрешения, приближающегося к 20 нм, предоставляя одновременную информацию о локальных физических свойствах образца (AFM) и его химическом составе (AFM-IR). Возможно сбор как одиночных спектров из выбранных точек, так и отображение интенсивности выбранных значений волнового числа в пределах выбранной области.
Рассматривая достижимое пространственное разрешение AFM-IR, очевидно, что методика открывает возможность химического/фенотипического исследования одиночных бактерий клеток и их внутриклеточного состава24. До сих пор несколько примеров применения AFM-IR для одиночных бактерий были продемонстрированы в литературе19,20,21,22,25,26,27,28. Они включают в себя одиночный спектральный анализ19,21,22 и картирование на субклеточном уровне19,22,25,26,27,28. Например, описана способность обнаруживать внутриклеточные липидные везикулы27 и вирусы28 в пределах одной бактерии. Эти результаты демонстрируют полезность AFM-IR для наноразмерных исследований отдельных бактерий и клинически значимых патогенов19.
Таким образом, мы представляем метод пробоподготовки и сбора данных AFM-IR многослойных, однослойных и одноклеточных бактериальных образцов. Протокол, описанный в настоящем описании, применялся для изучения различных видов бактерий22 и изменений их химического состава. В частности, развитие in vivo резистентности к ванкомицину и невосприимливости к даптомицину исследовали в клинических парах S. aureus19. Как прерывистая резистентность к ванкомицину, так и непредприязанность к даптомицину у S. aureus (VISA и DpR) появились относительно недавно, после более широкого использования и введения этих антибиотиков в клиники, что представляет собой значительную медицинскую проблему. Кроме того, в частности, механизм невосприимчивости даптомицина по-прежнему остается неуловимым, препятствуя разработке альтернативного препарата19,29. Представленный протокол фокусируется на предоставлении надежных AFM-IR спектров отдельных бактерий, которые могут быть дополнительно проанализированы с использованием различных хемометрических подходов, в соответствии с экспериментальными целями. Он дополнительно включает в себя картографический подход, который применим для внутриклеточных исследований.
протокол
Вся работа, проводимая с патогенными бактериями, должна проводиться с соответствующими мерами безопасности. К ним относятся работа в лаборатории с адекватным уровнем биобезопасности и в кабине биобезопасности (PC2), а также тщательная дезактивация рабочей зоны соответствующим дезинфицирующим средством, например, 80% раствором этанола. Соответствующие СИЗ необходимо носить постоянно.
1. Приготовление растворителей и материалов
- Растворители: Используйте сверхчистую воду в качестве растворителя. Используйте очищенную воду, автоклавную перед экспериментом, чтобы избежать любого потенциального перекрестного загрязнения.
- Подложка: Используйте любую из этих подложек для AFM-IR, например, ZnSe, CaF2,BaF2и т. Д. Поскольку AFM-IR является, в принципе, неразрушающим методом, можно применить множество других исследовательских инструментов к той же выборке после анализа AFM-IR. Например, корреляция результатов с рамановской спектроскопией может быть выполнена, если используются рамановские слайды CaF2 или BaF2.
- Используйте стеклянные флаконы вместо пластиковых трубок, так как пластик может загрязнить образец.
2. Пробоподготовка для AFM-IR
- Рост/инкубация образца
- Выращивайте бактерии в жидких средах или на твердых пластинах. Выберите тип среды, условия роста (например, температура, наличие кислорода) и время роста в соответствии с конкретными требованиями исследуемого вида бактерий. Например, для S. aureus Heart Infusion (HI) могут использоваться агаровые пластины, с ростом в течение 16 ч при 37 °C в аэробных условиях.
ПРИМЕЧАНИЕ: Для достижения наилучших результатов рост/инкубация должна давать достаточное количество бактерий, которые позволили бы получить микро-гранулу образца. Конкретное количество колониеобразующих единиц или бактериальных клеток зависит от типа и размера бактерии.
- Выращивайте бактерии в жидких средах или на твердых пластинах. Выберите тип среды, условия роста (например, температура, наличие кислорода) и время роста в соответствии с конкретными требованиями исследуемого вида бактерий. Например, для S. aureus Heart Infusion (HI) могут использоваться агаровые пластины, с ростом в течение 16 ч при 37 °C в аэробных условиях.
- Осаждение проб
- Используя стерильную петлю, аккуратно соберите бактерии из колоний на агаре и перенесите их в стеклянную трубку. Собирайте бактерии только с вершины колоний. При сборе образцов из жидкой культуры с помощью пипетки переложите примерно 1 мл бактериальной суспензии в стеклянную трубку. Объем может быть изменен в зависимости от бактериальной нагрузки.
ПРИМЕЧАНИЕ: Важно стараться не собирать (или максимально минимизировать сбор) любую среду из-под колонии. Последующие этапы подготовки образцов направлены на удаление любых потенциальных остатков среды. Минимизация потенциального остаточного среды с самого начала позволяет спектрально получать данные от очищенных бактериальных клеток. Этапы 2.2.2 и 2.2.3 применяются к образцам, полученным из пластин с агаром. Для образцов, полученных из жидких сред, перейдите к этапу 2.2.4. - Добавьте в трубку 1 мл сверхчистой воды. Вихрь до тех пор, пока собранные бактериальные гранулы больше не будут видны на дне трубки (обычно 1-2 мин).
- Оцените грубую мутность раствора, используя, например, стандарты Макфарланда путем визуального сравнения30 между приготовленным раствором и стандартами Макфарланда. Если мутность бактериальной суспензии кажется очень низкой, добавьте больше бактерий из пластины, используя стерильную петлю и снова вихрь. Повторяют до тех пор, пока грубая мутность раствора не будет сопоставима со стандартами Макфарланда 0,5 и 1. Это, как правило, дает хорошее количество бактериальных гранул.
- Центрифугируют бактериальную суспензию по 3 000 х г в течение 5 мин до получения гранулы.
ПРИМЕЧАНИЕ: Параметры центрифугирования могут быть модифицированы для получения бактериальных гранул. Следует соблюдать осторожность при увеличении g-силы, чтобы не вызвать поломку бактерий (особенно в случае грамотрицательных бактерий). - Используя пипетку, аккуратно удалите супернатант сверху гранулы. Добавьте 1 мл сверхчистой воды в трубку и вихрь, чтобы повторно приостановить гранулу. Впоследствии центрифугируют образец, как это было сделано на этапе 2.2.4.
- Повторите процедуру стирки (этапы 2.2.2 и 2.2.4) не менее трех раз. В случае сбора исходного образца из жидкой среды повторите процедуру не менее четырех раз (удаление среды с последующей тремя промывами).
- После окончательной стирки удалите супернатант, добавьте сверхчистую воду и вихрь не менее 2 мин. Впоследствии нанесите 5 мкл образца на подложку (например, рамановский класс CaF2).
- Если желаемая толщина образца представляет собой многослойность бактерий, оставьте образец на воздухе-сухости.
- Если желаемая толщина является однослойной или отдельной бактерией, сразу после осаждения образца (этап 2.2.7) добавляют от 20 до 100 мкл сверхчистой воды и аккуратно смешивают с наконечником пипетки. Оставьте на воздухе- высохнуть.
ПРИМЕЧАНИЕ: Точный объем воды может варьироваться между экспериментами, поскольку он зависит от многих факторов (например, размера организма, плотности гранул и т. Д.) И, следовательно, лучше всего определяется эмпирически. Подготовка серии образцов с различными объемами сверхчистой воды позволяет выбрать образец с желаемой толщиной/плотностью бактерий. Толщина/плотность бактерий может быть легко визуализирована с помощью AFM на последующих этапах. Примеры изображений AFM из однослойных и одноэлечеек показаны на рисунке 1A–H. - Установите подложку на металлический диск AFM с помощью двусторонней клейкой ленты.
- Используя стерильную петлю, аккуратно соберите бактерии из колоний на агаре и перенесите их в стеклянную трубку. Собирайте бактерии только с вершины колоний. При сборе образцов из жидкой культуры с помощью пипетки переложите примерно 1 мл бактериальной суспензии в стеклянную трубку. Объем может быть изменен в зависимости от бактериальной нагрузки.
3. Подготовка приборов
ПРИМЕЧАНИЕ: Инструментальные процедуры, описанные здесь, предназначены для инструмента, перечисленного в Таблице материалов. Детализация инструментальной процедуры может незначительно отличаться от описанной здесь при использовании более новой модели прибора AFM-IR.
- Включите и инициализируйте инструмент, нажав кнопку Инициализировать. Убедитесь, что лазерный затвор находится в открытом положении для лазерного теста.
- Если настроена система продувки, продувочи прибор с N2, включив поток N2. Отрегулируйте азотную продувку для достижения стабильного уровня влажности (например, 20%). Убедитесь, что влажность не колеблется во время измерений и между сбором фоновых и выборочных данных. Рекомендуется дать приблизительно 20 минут для стабилизации уровня влажности.
- Загрузите образец в камеру для отбора проб, нажав кнопку Load. Загрузка образцов осуществляется с помощью мастера программного обеспечения. Во время работы мастера программного обеспечения сначала сосредоточьтесь на наконечнике, используя стрелки, чтобы переместить ступень микроскопа в Z-направлении и нажмите далее. Во-вторых, отрегулируйте точку сбора данных, используя стрелки, направляющие движение в плоскости, и выровняйте лазер AFM и детектор AFM с помощью ручек в верхней части головки AFM. Впоследствии сосредоточьтесь на поверхности образца, переместив ступень микроскопа в Z-направлении.
ПРИМЕЧАНИЕ: Подробные иллюстрации каждого этапа загрузки образца приведены в руководстве по программному обеспечению31. Фокусировка на образце должна проводиться с осторожностью. При приближении к поверхности образца в Z-направлении используйте медленную скорость двигателя. - Подойдите к образцу без вовлечения, нажав на кнопку Подход.
4. Сбор данных
- Фон
- Перед сбором данных соберите фон. Для сбора фона убедитесь, что лазерный затвор находится в открытом положении. Выберите спектральный диапазон и разрешение (в зависимости от цели анализа), а также количество сканирований и количество сосреднических значений фона. Обычно рекомендуется, чтобы они были высокими (например, 1024 сканирования и 3 сосредновых показателя).
ПРИМЕЧАНИЕ: В целом, спектральное разрешение 4 см-1 или 8 см-1 и спектральные диапазоны 3 200 см-1-2 800 см-1 и 1 800 см-1-900 см-1. - После получения фона сохраните фоновый файл. Файл не сохраняется автоматически. Измените положение лазерного затвора на Закрыть.
- Перед сбором данных соберите фон. Для сбора фона убедитесь, что лазерный затвор находится в открытом положении. Выберите спектральный диапазон и разрешение (в зависимости от цели анализа), а также количество сканирований и количество сосреднических значений фона. Обычно рекомендуется, чтобы они были высокими (например, 1024 сканирования и 3 сосредновых показателя).
- Образец – одиночные спектры
- Нажмите кнопку Engage ( Вовлечь, чтобы принять участие в выборке. Система начнет приближаться к поверхности образца, пока не будет обнаружен прямой контакт.
ПРИМЕЧАНИЕ: Заданное значение, используемое в этой работе, варьировалось в диапазоне от 0,15 до 2 В, а коэффициент усиления обратной связи (I Gain и P Gain) обычно устанавливался на 3 и 10. Контактные датчики NIR2 обычно используются с системой nanoIR2 (модель: PR-EX-nIR2-10, резонансная частота (кГц): 13 +/−4 кГц, постоянная пружины (Н/м): 0,07−0,4Нм-1). - Соберите изображение AFM для визуализации поверхности. В первом случае сканируйте большую площадь (например, 50 x 50 мкм) с более низким пространственным разрешением (например, 200 x 200 точек)(рисунок 1I).
ПРИМЕЧАНИЕ: Данные AFM-IR всегда собираются в контактном режиме, однако данные AFM могут быть собраны в режиме контакта или касания. - На изображении высоты/отклонения AFM выберите конкретную интересуемую область и повторно изобразите ее с более высоким пространственным разрешением(рисунок 1J–K). Убедитесь, что скорость сбора данных соответствует скорости с медленным движением наконечника (например, Scan Rate 0,2–0,4 Гц).
- Выберите место измерения (например, одну бактерию) и переместите наконечник в точку.
- Выровняете ИК-лазер. Для этого используйте волновое число, при котором образец будет поглощаться. Для биологических материалов это может быть, например, амид I (1655 см-1). Убедитесь, что фильтр Band Pass Filter выключен, и нажмите «Запустить ИК». Правый график в наноИР-измерителе (БПФ отклонения, отображаемый как амплитуда против частоты) должен показывать по крайней мере один четкий пик, а левый график (отклонение против времени) должен иметь периодическую форму сигнала. Если это не так, приступайте к оптимизации ИК-пятен.
ПРИМЕЧАНИЕ: Даже если быстрое преобразование Фурье (FFT) и отклонение показывают ожидаемый профиль, рекомендуется провести оптимизацию ИК-пятен по крайней мере для нескольких волновых номеров, где ожидаются полосы. - Оптимизируйте горячие точки для сбора ИК-данных, используя выбранные значения волнового номера. Может быть полезно использовать обычный ИК-спектр бактерий (например, спектр ATR бактериальных гранул) для определения положений полос и использования их для оптимизации горячих точек. Выберите различные значения волнового числа (например, 8–10) из различных спектральных областей.
ПРИМЕЧАНИЕ: Если обычный ИК-спектр интересующих бактерий не может быть собран до сбора данных AFM-IR, бактериальные спектры, доступные в литературе, могут быть использованы в качестве приблизительного руководства. Результатом оптимизации ИК-пятна является изображение, которое представляет карту сигнала величины БПФ в каждом месте x и y. Местоположение с наибольшим сигналом выбирается автоматически. Примеры таких изображений приведены в руководстве по программному обеспечению31. - После оптимизации ИК-пятен для выбранных значений волнового числа определите параметры сбора спектральных данных: спектральную область, спектральное разрешение, количество сканирований, а также приложенную мощность и введите их в соответствующие окна в программном обеспечении. Спектральное разрешение должно соответствовать разрешению фона, а спектральная область должна находиться в пределах спектральной области, для которой был собран фон.
ПРИМЕЧАНИЕ: Общий начальный набор параметров может быть: спектральный диапазон: 3200 см-1–2800см-1 и 1800 см-1–900 см-1,спектральное разрешение: 4 см-1 или 8 см-1,количество сканирований: 512–2048. - При необходимости отрегулируйте мощность лазера в зависимости от сигнала. В целом, значения между 8%-10% мощности лазера должны быть достаточными для хорошего качества сигнала. Более высокие значения можно использовать с осторожностью, так как они могут привести к повреждению образца.
ПРИМЕЧАНИЕ: Процент мощности лазера может варьироваться в зависимости от типа ИК-лазера. Процентные значения, приведенные здесь, относятся к лазеру OPO. - Нажмите «Получить», чтобы собрать спектр AFM-IR.
- Повторно соберите данные AFM из той же области после сбора спектра AFM-IR. Это настоятельно рекомендуется, так как это выявит любой потенциальный дрейф и/или разрушительное влияние на образец.
- Если спектр AFM-IR является удовлетворительным и не наблюдается разрушительного воздействия на образец, приступайте к сбору данных. При необходимости определите посередку точек для сбора данных с помощью параметра «Массив» и собранного изображения высоты или отклонения AFM. Эта опция позволяет последовательно собирать спектры из каждой точки с теми же спектральными параметрами, которые определены для одного спектра.
- Если изображение АСМ, собранное после сбора спектра AFM-IR, выявляет разрушительное воздействие на образец (обычно сгоревшего пятна), уменьшите мощность; выберите другое место и повторите шаги 4.3.8–4.3.11.
- Если сигнал в спектре AFM-IR неудовлетворительный, проверьте правильность оптимизации ИК-пятен (шаг 4.3.6). Если это так, немного увеличьте мощность лазера и повторите шаги 4.3.7–4.3.11. Это может повторяться до тех пор, пока не будет достигнут удовлетворительный сигнал.
- Нажмите кнопку Engage ( Вовлечь, чтобы принять участие в выборке. Система начнет приближаться к поверхности образца, пока не будет обнаружен прямой контакт.
- Образец – подход к визуализации
ПРИМЕЧАНИЕ: Настоятельно рекомендуется записать один спектр AFM-IR бактерии перед сбором изображения распределения интенсивности для выбранного значения волнового числа.- Запишите AFM-изображение выбранной области выборки. Для этого сначала соберите AFM-изображение большей площади с более низким пространственным разрешением (например, 50 x 50 мкм, 200 x 200 точек), затем выберите интересующая область и соберите изображение AFM с увеличенным пространственным разрешением (как показано на рисунке 1I–K).
- Выберите значения волнового числа для afM-IR-визуализации.
- Убедитесь, что ИК-пятно лазера оптимизировано для выбранных значений волнового числа (шаг 4.3.6). Если ИК-пятно не оптимизировано для некоторых волновых номеров (нет четкого максимума), оптимизируйте его для них.
- Определите параметры изображенной области: ширину и высоту, количество точек данных в направлении X и Y.
ПРИМЕЧАНИЕ: Если применяется последовательный выбор пятен из предыдущих изображений AFM (как показано на рисунке 1I–K),поля ширины и высоты будут автоматически заполнены при разметке области. - Определите параметры получения спектрального сигнала: длину волны, количество сканирований и мощность лазера.
ПРИМЕЧАНИЕ: Количество сканирований должно быть в пределах разумного. 64 или 32 сканирования обычно позволяют обеспечить достаточное количество сигнала. - Определите параметры движения наконечника AFM, нажав на кнопку Scan Rate. Чем выше количество сканирований на предыдущем шаге и количество точек данных в направлении X, тем медленнее должны быть движения наконечника. Отсутствие регулировки между этими параметрами приведет к слишком быстрому движению наконечника, препятствуя фактическому получению определенного количества сканирований из каждой точки.
ПРИМЕЧАНИЕ: Например, для соответствующего сбора ИК-сигнала с 64 со-сложениями и 200 точками установите скорость сканирования на уровне 0,07 кГц. - Убедитесь, что установлен флажок Включить ИК-образ.
- Начните визуализацию. AFM-IR интенсивности сигнала при выбранном волновом числе будет собираться одновременно с данными AFM из этой области.
ПРИМЕЧАНИЕ: При использовании лазера OPO можно дополнительно собирать одновременно контактно резонансное пиковое частотное изображение. Это может быть использовано для получения информации об относительной жесткости образца в разных местах. - Используйте окно «Последовательность захвата», чтобы задать последовательную коллекцию данных AFM-IR из одной и той же области с теми же параметрами, но для разных значений волнового числа. Для этого откройте окно Capture Sequence (Последовательность захвата), введите каждый номер волны и определите приложенную мощность лазера (для каждого волнового числа).
- Экспортировать собранные данные (AFM и AFM-IR, одиночные спектры и изображения) в различные форматы и анализировать их с использованием методов, адекватных конкретным целям исследования.
Результаты
Описанный протокол позволяет получить ряд типов клеточных распределений бактерий на субстрате в зависимости от начальной концентрации образца и количества добавленной воды. На фиг.1 показаны примеры изображений ОВМ (высота и отклонение), записанных с монослоев и одноклеточных образцов, полученных с использованием описанного протокола от грамположительных(S. aureus)и грамотрицательных(Escherichia coli)бактерий.
Протокол, описанный здесь, может быть использован для AFM-IR визуализации внутри- и внеклеточных структур отдельных бактерий. Пример этого применения показан на рисунке 2,который демонстрирует результаты мониторинга пространственно локализованных химических изменений, происходящих при делении клетки S. aureus. Хотя воздушная сушка обычно рассматривается как подход фиксации для бактериального препарата, бактерии по своей природе демонстрируют очень высокую устойчивость к внешним факторам, таким как температура, и, как сообщается, выживают при обезвоживание32. Результаты, представленные здесь, были получены из высушенного на воздухе образца. Образование перегородки, происходящее до деления клеток, наблюдали и контролировали с помощью визуализации AFM(рисунок 2A–D)путем последовательного сбора 12 изображений одной и той же области (сбор одного изображения ≈ 20 мин). На рисунке 2A–D показаны 4 выбранных изображения AFM, время между сбором каждого изображения составляет примерно 40 минут. Сформированная структура (перегородка) достигает высоты 45 нм. Сформированная перегородка хорошо видна на изображениях высоты и отклонения AFM(рисунок 2E–F). Спектры AFM-IR, записанные из области ячейки и перегородки(рисунок 2G,точки происхождения, отмеченные на рисунке 2F),были нормализованы до амидной I полосы перед сравнением, чтобы минимизировать влияние изменяющейся толщины образца между точками сбора данных. Спектр AFM-IR перегородки характеризуется более высокой относительной интенсивностью полос при 1240 и 1090см-1 по сравнению с спектром AFM-IR, собранным из области клеток. Они относятся к углеводным и фосфодиэстерным группам компонентов клеточной стенки (включая, например, пептидогликан и тейхоновую кислоту)22.
Описанный протокол также может быть использован для сравнения одного спектра между несколькими различными образцами. Пример этого приложения вместе с результатами показан на рисунках 3 и 4. Целью исследования является определение химических изменений, происходящих в результате развития in vivo прерывистой резистентности ванкомицина у S. aureus (VISA). Для этой цели клинические пары образцов были собраны у пациентов, причем родительский штамм был выделен при поступлении в больницу и до антибиотикотерапии (ванкомицин восприимчивый S. aureus,VSSA), а дочерний штамм был выделен у того же пациента после приема антибиотиков и клинической недостаточности. Образцы дополнительно выращивали на агартовой среде и готовили в соответствии с протоколом(рисунок 3А–В). Спектры AFM-IR были собраны из нескольких отдельных бактерий (и нескольких образцов) для VSSA и VISA и впоследствии проанализированы с использованием нескольких хемометрических подходов(рисунок 3C).
Морфологических различий между ячейками VSSA и VISA не наблюдалось(рисунок 4A–C). Однако спектры AFM-IR(Рисунок 4D,F)и их вторые производные(Рисунок 4E,G)продемонстрировали четкое различие в химическом составе между резистентными и восприимчивыми штаммами. Относительная интенсивность полос, связанных с углеводными и фосфодиэстерными группами из компонентов клеточной стенки (в частности, полосы на 1088см-1),явно увеличивалась у резистентного штамма, по сравнению с восприимчивым аналогом. Следует отметить тот факт, что все перекодированные спектры (VISA: 81, VSSA: 88) показывают небольшое стандартное отклонение. Это демонстрирует хорошую воспроизводимость данных, записанных из различных образцов, полученных из одного и того же штамма, поскольку не было возможности различить спектры, записанные из разных образцов одного и того же штамма. Наблюдаемые различия указывали на увеличение толщины клеточной стенки у резистентных штаммов, по сравнению с восприимчивым аналогом, что остается в согласии с другими литературными отчетами33,34.

Рисунок 1: Репрезентативные изображения AFM различных бактериальных образцов для измерений AFM-IR. В зависимости от разведения на субстрате протокол позволяет получать многослойные и монослойные бактерии, а также одноклеточные образцы. Репрезентативные изображения AFM: (A–D)монослойного и(E–H)одноклеточного образца для(A,B,E,F)грамположительных(S. aureus)и(C,D,G,H)грамотрицательных(E. coli)бактерий. (A, C, E, G) демонстрируют изображения высоты и (B, D, F , H) показывают соответствующие изображения отклонения. Размер изображений областей: (A-D, G, H) 20 x 20 мкм, (E,F) 50 x 50 мкм. (I–K) последовательный выбор области для AFM-IR картирования. Это достигается с помощью АСМ-визуализации с возрастающим пространственным разрешением в примере одной клетки S. aureus. Каждое изображение собирается путем выборки 200 х 200 точек, с увеличением пространственного разрешения за счет уменьшения размера изображения области. Размер изображений областей: (I) 40 x 40 мкм, (J) 20 x 20 мкм и (K) 2,24 x 2,24 мкм. Черный квадрат в (I) обозначает область, изображенную в (J). Черный квадрат в (J) обозначает область, изображенную в (K). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
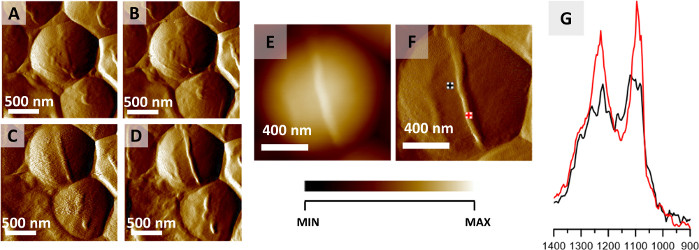
Рисунок 2: Мониторинг деления клеток S. aureus с помощью AFM-IR. (A–D)AFM-изображения клетки S. aureus, показывающие образование перегородки, предшествующей делению клеток. Размер изображения области: 2 x 2 мкм. Изображения были отобраны из более крупной серии (12 изображений, записанных каждые 20 минут) и представляют собой данные, записанные каждые 40 мин.(E–F)AFM высоты и отклонения изображения, записанного в конце формирования клеточной перегородки с отмеченными точками сбора спектров AFM-IR. Размер изображения области 1,17 x 1,15 мкм. Высота вновь образованной конструкции составляет 45 нм. (G)СПЕКТРЫ AFM-IR регистрируются из площади ячейки (черный) и области перегородки (красный) (отмечены в(F)),в диапазоне 1400–900см-1. Оба спектра были нормализованы до амидной I полосы и демонстрируют увеличение относительной интенсивности компонентов клеточной стенки из перегородки. Эта цифра была изменена с K. Kochan et al.22. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
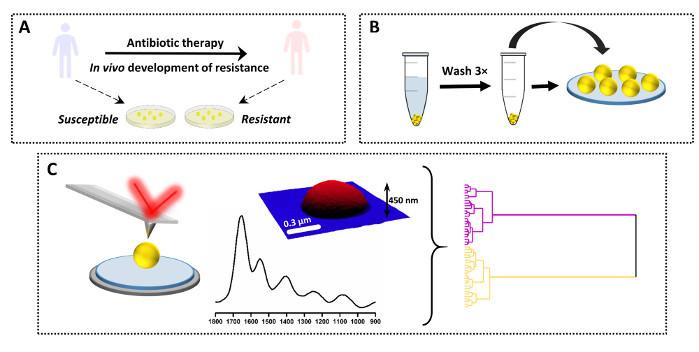
Рисунок 3: Обзор экспериментального проекта исследования устойчивости к противомикробным препаратам AFM-IR. (A) Происхождение образца и начальная подготовка: восприимчивый родительский штамм был собран у пациента до антибиотикотерапии, а дочерний резистентный штамм был получен от того же пациента после антибиотикотерапии и клинической неудачи (развитие резистентности in vivo). Бактерии были выделены и культивированы на агаре Heart Infusion (HI) в течение 16 ч при 37 °C. (B)Последующая подготовка образцов для AFM-IR, включая отбор образца с последующей промывкой бактериального поддона (3×) и осаждением пробы. (C) Сбор и анализ данных AFM-IR: высота AFM и спектр AFM-IR (1800–900см-1). Размер изображения области AFM: 1,7 x 1,4 мкм. Спектр AFM-IR собирали из середины ячейки. Впоследствии данные были проанализированы с использованием хемометрических подходов, включая иерархический кластерный анализ. Эта цифра была изменена с K. Kochan et al.19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
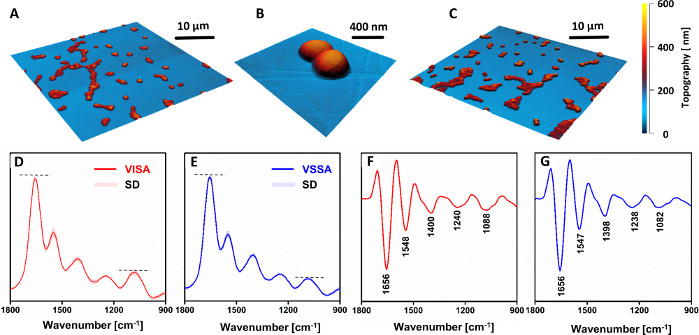
Рисунок 4: AFM и AFM-IR результаты исследования химических изменений в ванкомицине промежуточного S. aureus (VISA) по сравнению с ванкомицин-чувствительным S. aureus (VSSA) в клинических парах. AFM изображения(A–B)VISA и(C)VSSA одноклеточных образцов. Размер сфокусированных областей: (A,C) 40 x 40 мкм, (B) 2,56 x 2,45 мкм. (D–E) Средние спектры AFM-IR и их(F–G)вторые производные для: (D,F) VISA и (E,G) VSSA ячеек, в спектральном диапазоне 1800–900 см-1. Представленные спектры имеют в среднем 81 (VISA) и 88 (VSSA) индивидуальных спектров и представлены вместе со стандартным отклонением (SD). Усреднение проводилось после нормализации всех отдельных спектров вместе. Основные полосы отмечены в (F–G). Эта цифра была изменена с K. Kochan et al.19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Дрейф изображения по последовательной регистрации карт AFM-IR при выбранных значениях волнового числа для ячейки S. aureus. (Верхняя строка):изображения AFM записывались одновременно с соответствующими(нижний ряд)картами AFM-IR на основе интенсивности ИК-сигнала при выбранных значениях волнового числа. Значения волнового числа (966, 1055, 1079, 1106, 1234, 1398, 1454, 1540, 1656, 1740 см-1)аннотируются над нижним рядом. Каждый набор (изображение AFM и карта AFM-IR) был записан непосредственно после предыдущего изображения (примерно 40 минут на набор). Размер изображенной/картографированной области: 1,54 x 1,57 мкм. Между изображениями виден четкий дрейф. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Полезность ИК-спектроскопии для характеристики широкого спектра биологических образцов в контексте их химического состава хорошо известен. За последнее десятилетие ИК-спектроскопия стала перспективным инструментом для бактериальных исследований12,13,14,15,16,17. Он продолжает привлекать значительный интерес в области микробиологии, как один из немногих методов, позволяющих фенотипическую характеристику через химический состав. В этом контексте основным недостатком обычной FTIR-микроскопии является ограниченное пространственное разрешение, препятствуя одноклеточным и субклеточным исследованиям бактерий. На самом деле, небольшой размер бактерий представляет собой препятствие не только для ИК, но и для подавляющего большинства методов. Таким образом, имеющиеся исследовательские инструменты для одноклеточных и субклеточных исследований бактерий существенно ограничены. Сочетание AFM с ИК позволяет преодолеть ограничение пространственного разрешения ИК-спектроскопии, предоставляя новый инструмент для бактериальных исследований, способный к наноразмерным исследованию химического состава.
Метод не ограничивается исследованиями одной клетки и позволяет исследовать различные образцы, варьирующиеся по толщине. Несомненно, чистая и тщательная подготовка образцов имеет решающее значение для достижения высокого качества изображений. Протокол в настоящем описании предусматривает способ получения многослойных, монослойных и/или одноклеточных образцов различных бактерий(фиг.1). Подготовленный образец зависит от нескольких факторов, включая начальную бактериальную нагрузку, разбавление после промывки, а также дальнейшее разбавление на субстрате. Количество образца, полученного после разбавления промытых гранул и до осаждения на подложку, обычно позволяет подготовить многочисленные образцы. Поэтому для получения нужного распределения образца на подложке часто выгодно подготовить серию образцов, варьирующихся в их разбавлении. Для исследований, направленных на сбор спектров AFM-IR, а не субклеточную визуализацию, изменение количества образца (например, от однослойного до многослойного) может быть полезным для увеличения интенсивности сигнала.
Другим важным аспектом в подготовке проб является надлежащее удаление остатков среды. В зависимости от выбранных методов культивирования образца, образец собирают либо из жидкой среды, либо из агаровой пластины. В обоих случаях остаточная среда, вероятно, будет присутствовать в образце, хотя и в гораздо меньшей степени при сборе из агаровых пластин. Поскольку бактериальные питательные среды содержат обилие различных биологических компонентов, крайне важно обеспечить надлежащее удаление среды. Мы рекомендуем три промывки сверхчистой водой для образцов агаровой пластины и не менее четырех промывок для образцов, собранных из среды. При необходимости количество стирок может быть увеличено; однако для сравнения различных образцов важно поддерживать его согласованность между выборками. В продемонстрированной протоколе используется вода, а не растворители, такие как фосфатный буферный раствор (PBS) или физиологический раствор. Как PBS, так и физиологический раствор приводят к образованию кристаллов при воздушной сушке, что может повредить бактерии. Кроме того, оба являются источником интенсивных ИК-диапазонов, причем PBS, в частности, содержит несколько полос в области отпечатков пальцев. Отсутствие способности к использованию физиологического раствора или PBS, в настоящее время представляет собой важное ограничение для техники. Как правило, использование воды для промывания не вызывает какого-либо разрушительного воздействия на бактерии; однако следует проявлять осторожность и, по возможности, время воздействия воды должно быть ограничено. Если протокол пробоподготовки необходимо приостановить на этапе промывки, рекомендуется оставить образец в гранулированном виде после удаления воды. Это имеет особое значение для грамотрицательных бактерий, содержащих более тонкую клеточную стенку, так как они более склонны к разрыву.
Для обеспечения надлежащих и высококачественных данных AFM-IR несколько аспектов в протоколе сбора данных имеют решающее значение. Во-первых, для сбора данных необходим правильный сбор справочной информации. В частности, необходимо поддержание стабильных уровней влажности на протяжении всего фонового сбора, а также между фоновым сбором и сбором проб. Для этого рекомендуем продувку прибора азотом и поддержание уровня влажности не выше 25%. Отсутствие продувки может наложить значительное ограничение, особенно в местах с повышенной влажностью. Во-вторых, следует подчеркнуть важность правильной оптимизации ИК-пятен. Для достижения наилучших результатов априорные знания о положении максимумов полосы могут быть полезны. Например, обычный ИК-спектр бактериальных гранул может быть использован для определения положений полос, ожидаемых от образца. Если это невозможно приобрести, в качестве альтернативного подхода пользователь может использовать ИК-спектры, доступные в литературе, или начать оптимизацию, используя положение полосы, которое разумно ожидать в бактерии (например, амид I и амид II). В-третьих, для сбора данных важно подчеркнуть важность тщательного отбора мощности (позволяющего достичь хорошего соотношения S/N), так как это может иметь разрушительный эффект. Рекомендуемая мощность зависит от толщины образца, с приблизительным руководством, доступным в руководстве по прибору31. Мы рекомендуем эмпирически проверить состояние образца после измерения путем сбора изображения AFM, так как это выявит любое разрушительное воздействие. Кроме того, коллекция изображений AFM из одной и той же области до и после сбора спектров AFM-IR служит хорошим подтверждением того, что дрейфа не произошло, и спектры действительно происходят из выбранной точки в ячейке. Возможность дрейфа особенно важна при применении модальности визуализации посредством последовательной визуализации интенсивности ИК при выбранных значениях волнового числа. Пример этого проиллюстрирован на рисунке 5. Изображенная область была определена в начале эксперимента и предназначена для согласованности для всех значений волнового числа. Тем не менее, между каждым изображением высоты AFM (и соответствующей интенсивности ИК-волн) виден четкий дрейф, при этом время получения каждой карты составляет примерно 40 минут. В связи с этим для пользователей, собирающих данные изображений, мы рекомендуем всегда выбирать область, немного большую, чем интересующий образец, чтобы гарантировать, что даже при наличии дрейфа интересующий образец останется в пределах изображенной области.
Потенциальные ограничения протокола включают отсутствие способности собирать данные в гидратированном состоянии в физиологических растворах (например, физиологическом растворе или PBS), описанных выше. Более того, особенно в районах с высокой влажностью, часто возникает необходимость в азотной продувке. Кроме того, протокол позволяет исследовать организмы размером до 100 нм, исключая возможность его использования для небольших структур. Хотя это может быть преодолено с помощью другого лазера (например, квантового каскадного лазера, позволяющего достичь пространственного разрешения 20 нм), это также связано с ограниченным спектральным диапазоном, а также трудностями в получении хорошего отношения сигнал/шум. Наконец, прощание мягких поверхностей может представлять собой проблему, поскольку наконечник не обнаруживает поверхность должным образом и выходит за пределы точки контакта до поломки. Хотя это, как правило, не является проблемой с бактериальными образцами, это может произойти при измерениях более мягких образцов. В таких случаях рекомендуется попытаться зацепиться за чистую поверхность подложки в непосредственной близости от образца.
Описанный протокол может быть использован для многочисленных видов бактериальных исследований, включая сравнительные исследования между различными образцами, а также субклеточное исследование. Данные могут быть проанализированы с использованием хемометрических подходов для одиночных спектров и методов визуализации35,в зависимости от цели исследования. Кроме того, протокол также может быть модифицирован для применения к другим биологическим материалам (таким как грибы, дрожжи, клетки и т. Д.), Путем добавления фиксации.
Раскрытие информации
Мы хотели бы поблагодарить Bruker за оплату издательского сбора. KK, BRW, AP и PH являются изобретателями по международному патенту (PCTIB2020/052339), который описывает некоторые фундаментальные аспекты подхода.
Благодарности
Мы хотели бы поблагодарить Bruker за их поддержку. Эта работа была поддержана грантом Университета Монаш по продвижению женского успеха (К. Кочан). A.Y.P признает поддержку со стороны Австралийского национального совета по здравоохранению и медицинским исследованиям (APP1117940). Эта работа финансировалась Австралийским исследовательским советом Discovery Project DP180103484. Мы хотели бы поблагодарить г-на Финлея Шенкса за его инструментальную поддержку и г-жу Ксении Костулиас за ее техническую помощь с образцами.
Материалы
| Name | Company | Catalog Number | Comments |
| AFM metal specimen disc | PST ProSciTech Pty Ltd | GA530-15 | Recommended 15 mm |
| Anasys AFM-IR nanoIR2 | Anaysys Instruments | model: nanoIR2 | |
| Contact mode NIR2 Probes for nanoIR 2 | Bruker / Anasys Instruments | - | Model: Model: PR-EX-NIR2 |
| Heraeus Pico 17 Microcentrifuge | Thermo Scientific | - | - |
| Matlab | Mathworks Inc | - | Multivariate data analysis software |
| Micro-centrifuge tubes, 1.5 mL | Heathrow Scientific | HEA4323 | Can be replaced with any other micro-centrifuge tube |
| NanoIR 2 instrument | Bruker / Anasys Instruments | - | - |
| PLS toolbox | Mathworks Inc | - | GUI for Matlab |
| Selected bacterial medium (e.g. HBA Columbia Plates) | Thermo Fisher | PP2001 | Provided type of medium is an example and can be replaced by others, depending on the type of experiment |
| Selected bacterial strain | - | - | The source depends on the aim of research (patient isolates, ATCC strains, etc.) |
| Substrate (e.g. Raman grade CaF2) | Crystran | CAFP13-2R | Recommended size: 13 mm Ø x 2.0 mm |
| Tip pipette 1000 µl | Axygen | T-1000-B | - |
| Tip pipette 200 µl | Axygen | T-200-C | - |
| Tip pipette 0.5-10 µl | Axygen | T-300-R | - |
| Ultrapure water | - | - | - |
Ссылки
- Sears, C. L. A dynamic partnership: celebrating our gut flora. Anaerobe. 11 (5), 247-251 (2005).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Seymour, C. W., et al. Time to treatment and mortality during mandated emergency care for sepsis. The New England Journal of Medicine. 376 (23), 2235-2244 (2017).
- Weiss, S. L., et al. Delayed antimicrobial therapy increases mortality and organ dysfunction duration in pediatric sepsis. Critical Care Medicine. 42 (11), 2409-2417 (2014).
- Peker, N., Couto, N., Sinha, B., Rossen, J. W. Diagnosis of bloodstream infections from positive blood cultures and directly from blood samples: recent developments in molecular approaches. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. 24 (9), 944-955 (2018).
- Aminov, R. I. The role of antibiotics and antibiotic resistance in nature. Environmental Microbiology. 11 (12), 2970-2988 (2009).
- Levy, S. B., Marshall, B. Antibacterial resistance worldwide: causes, challenges and responses. Nature Medicine. 10 (12), 122-129 (2004).
- Roca, I., et al. The global threat of antimicrobial resistance: science for intervention. New Microbes and New Infections. 6, 22-29 (2015).
- O'Neill, J. The review on antimicrobial resistance. Tackling drug-resistant infections globally: final report and recommendations. Wellcome Trust. , (2016).
- Perry, J. A., Westman, E. L., Wright, G. D. The antibiotic resistome: what's new. Current Opinion in Microbiology. 21, 45-50 (2014).
- Piddock, L. J. Assess drug-resistance phenotypes, not just genotypes. Nature Microbiology. 1 (8), 16120 (2016).
- Naumann, D., Helm, D., Labischinski, H. Microbiological characterizations by FT-IR spectroscopy. Nature. 351 (6321), 81-82 (1991).
- Zarnowiec, P., Lechowicz, L., Czerwonka, G., Kaca, W. Fourier Transform Infrared Spectroscopy (FTIR) as a tool for the identification and differentiation of pathogenic bacteria. Current Medicinal Chemistry. 22 (14), 1710-1718 (2015).
- Quintelas, C., Ferreira, E. C., Lopes, J. A., Sousa, C. An overview of the evolution of infrared spectroscopy applied to bacterial typing. Biotechnology Journal. 13 (1), 1700449 (2018).
- San-Blas, E., Cubillán, N., Guerra, M., Portillo, E., Esteves, I. Characterization of xenorhabdus and photorhabdus bacteria by Fourier transform mid-infrared spectroscopy with attenuated total reflection (FT-IR/ATR). Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 93, 58-62 (2012).
- Sousa, C., et al. Discrimination of the acinetobacter calcoaceticus-acinetobacter baumannii complex species by Fourier transform infrared spectroscopy. European Journal of Clinical Microbiology & Infectious Diseases. 33 (8), 1345-1353 (2014).
- Rodriguez-Saona, L. E., Khambaty, F. M., Fry, F. S., Calvey, E. M. Rapid detection and identification of bacterial strains by Fourier transform near-infrared spectroscopy. Journal of Agricultural and Food Chemistry. 49 (2), 574-579 (2001).
- Dawson, S. E., et al. Implementation of Fourier transform infrared spectroscopy for the rapid typing of uropathogenic Escherichia coli. European Journal of Clinical Microbiology & Infectious Diseases. 33 (6), 983-988 (2014).
- Kochan, K., et al. Detection of Antimicrobial Resistance-Related Changes in Biochemical Composition of Staphylococcus aureus by Means of Atomic Force Microscopy-Infrared Spectroscopy. Analytical Chemistry. 91 (24), 15397-15403 (2019).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Dazzi, A., et al. AFM-IR: combining atomic force microscopy and infrared spectroscopy for nanoscale chemical characterization. Applied Spectroscopy. 66 (12), 1365-1384 (2012).
- Kochan, K., et al. et al. In vivo atomic force microscopy-infrared spectroscopy of bacteria. Journal of the Royal Society, Interface. 15 (140), (2018).
- Katzenmeyer, A. M., et al. Mid-infrared spectroscopy beyond the diffraction limit via direct measurement of the photothermal effect. Nanoscale. 7 (42), 17637-17641 (2015).
- . Bruker Life Science Applications Available from: https://www.bruker.com/products/surface-and-dimensional-analysis/nanoscale-infrared-spectrometers/nanoscale-ir-spectroscopy-applications/life-sciences.html (2020)
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J. M., Jaillard, D. In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy. Analyst. 135 (10), 2540-2545 (2010).
- Baldassarre, L., et al. Mapping the amide I absorption in single bacteria and mammalian cells with resonant infrared nanospectroscopy. Nanotechnology. 27 (7), 075101 (2016).
- Vitry, P., et al. Combining infrared and mode synthesizing atomic force microscopy: Application to the study of lipid vesicles inside Streptomyces bacteria. Nano Research. 9 (6), 1674-1681 (2016).
- Dazzi, A., et al. Chemical mapping of the distribution of viruses into infected bacteria with a photothermal method. Ultramicroscopy. 108 (7), 635-641 (2008).
- Steenbergen, J. N., Alder, J., Thorne, G. M., Tally, F. P. Daptomycin: a lipopeptide antibiotic for the treatment of serious Gram-positive infections. The Journal of Antimicrobial Chemotherapy. 55 (3), 283-288 (2005).
- Garcia, L. S. MacFarlan Standards. Clinical Microbiology Procedures Handbook, 3rd Edition. , (2010).
- NanolR-2 System Manual. Anasys Instruments Available from: https://www.anasysinstruments.com/downloadpr/nanoIR2_s_System_Manual.pdf (2020)
- Whelan, D. R., et al. Detection of an en masse and reversible B- to A-DNA conformational transition in prokaryotes in response to desiccation. Journal of the Royal Society, Interface. 11 (97), 20140454 (2014).
- McGuinness, W. A., Malachowa, N., DeLeo, F. R. Vancomycin Resistance in Staphylococcus aureus. The Yale Journal of Biology and Medicine. 90 (2), 269-281 (2017).
- Howden, B. P., Peleg, A. Y., Stinear, T. P. The evolution of vancomycin intermediate Staphylococcus aureus (VISA) and heterogenous-VISA. Infection, Genetics and Evolution: Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases. 21, 575-582 (2014).
- Perez-Guaita, D., et al. Multispectral Atomic Force Microscopy-Infrared Nano-Imaging of Malaria Infected Red Blood Cells. Analytical Chemistry. 90 (5), 3140-3148 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены