Method Article
Подготовка образцов для метаболического профилирования с использованием масс-спектрометрии MALDI
* Эти авторы внесли равный вклад
В этой статье
Резюме
Целью этого протокола является предоставление подробных рекомендаций по подготовке образцов при планировании экспериментов с использованием MALDI MSI для максимального метаболического и молекулярного обнаружения в биологических образцах.
Аннотация
Метаболомика, исследование для выявления и количественной оценки малых молекул и метаболитов, присутствующих в экспериментальном образце, стало важным инструментом для исследования биологической активности во время развития и заболеваний. Метаболомические подходы широко используются в изучении рака, питания / диеты, диабета и других физиологических и патологических состояний, связанных с метаболическими процессами. Удовлетворительным инструментом, который помогает в метаболомическом профилировании, пропагандируемом в этой статье, является матричная лазерная десорбция / ионизация масс-спектрометрической визуализации (MALDI MSI). Его способность обнаруживать метаболиты in situ без маркировки, структурных модификаций или других специализированных реагентов, таких как те, которые используются в иммуноокрашивающих средствах, делает MALDI MSI уникальным инструментом в продвижении методологий, актуальных в области метаболомики. Соответствующий процесс подготовки образцов имеет решающее значение для получения оптимальных результатов и будет в центре внимания настоящего документа.
Введение
Метаболиты, промежуточные продукты или конечные продукты метаболизма, включая нуклеотиды, амино- или органические кислоты, липиды, являются ключевыми компонентами биологических функций и процессов. Метаболомика, изучение метаболитов, позволяет исследовать их биохимические взаимодействия и понимать их роли в контексте фундаментальных, трансляционных и клинических исследований. Метаболиты тесно связаны с фенотипами организмов и предоставляют информацию о биохимической активности, которая происходит во время клеточногометаболизма1. Поэтому, помимо геномики и протеомики, метаболомика стала важным инструментом в понимании как физиологических, так и патологических состояний. Например, метаболомика используется для выяснения механизмов, лежащих в основе существующих лекарств, а также их переносимости. При разработке лекарств ксенобиотический метаболизм полезен для оценки активности или токсичности метаболитов между видами, что позже переводится в поддержку персонализированной медицины2. Несмотря на широкое применение метаболомики, визуализация метаболитов может быть сложной задачей из-за химической реакционной способности метаболитов, структурной неоднородности и широкого диапазона концентраций3. Однако концентрации лабильных метаболитов, включая высокоэнергетические соединения, глюкозу, лактат, гликолитические, пентозные шунтовые пути и промежуточные продукты цикла ТЦА, фосфолипиды, нейротрансмиттеры, сигнальные соединения, могут изменяться в течение секунд и прогрессировать в течение нескольких минут, когда тканевые ферменты активны во время процедур сбора тканей, таких как посмертная ишемия при сборе мозга4,5,6 . Для обеспечения точного сбора метаболомных данных решающее значение имеет надлежащая и тщательная пробоподготовка7,8. Современные платформы для измерения метаболитов включают ЯМР, ферментные анализы и масс-спектрометрию (включая жидкостную и газовую хроматографию), последняя из которых обсуждается ниже.
MALDI-MSI - это современный метод, который позволяет анализировать сложные образцы путем обнаружения отдельных молекулярных видов. MALDI MSI дает преимущество возможности быстрого и воспроизводимого измерения различных молекулярных соединений в биологических образцах. Масс-спектрометрическая визуализация дополнительно позволяет получать изображения, которые представляют биологию ткани на основе ее составных метаболитов, и делает это при сохранении пространственного распределения метаболитов в образце9. Способность MALDI обнаруживать аналиты в образце без использования маркировки антител, структурных модификаций или других специализированных реагентов, таких как те, которые используются в иммуноокрашивающих веществах, в сочетании с его способностью контролировать сотни молекул в рамках одного эксперимента, составляют лишь некоторые из преимуществ визуализации РС, когда речь идет о метаболическом профилировании10, 11. В дополнение к широко используемым матрицам, таким как 2,5-дигидроксибензойная кислота (DHB) и 9-аминоакридин (9-AA), недавно обнаруженная новая матрица N-(1-нафтил) этилендиамина дигидрохлорид (NEDC), которая хорошо подходит для анализа различных низкомолекулярных метаболитов, еще больше улучшила применение MALDI MSI в метаболическом профилировании12.
Несмотря на широкое применение MALDI MSI, высокая стоимость прибора и сложность экспериментальной процедуры препятствует его более широкому внедрению в отдельных исследовательских лабораториях. Поэтому большинство исследований MALDI MSI поддерживаются через общие основные средства. Подготовка образцов, включая подготовку слайдов и покрытие матрицы, является наиболее важным этапом в MALDI MSI. Тем не менее, подготовка слайдов обычно проводится в лаборатории отдельного исследователя, что создает потенциальные вариации в последующем приобретении MALDI MSI. Здесь мы стремимся предоставить подробный протокол для пробоподготовки биологических образцов, прежде чем приступать к измерениям MALDI MSI, и использовать метаболомическое профилирование мозга мыши развития в качестве примера.
протокол
Протокол следует руководящим принципам Городского университета Нью-Йорка (CUNY) Advanced Science Research Center (ASRC) институционального комитета по уходу за животными и их использованию (IACUC).
1. Соберите ткань
- Подготовьте алюминиевую лодку. Подготовьте прямоугольник алюминия 10см х 20 см, сложите посередине, чтобы сделать 10 см двухслойным квадратом. Пометьте образец информации на одной стороне и сложите другую сторону, чтобы сформировать лодку с нижней поверхностью около 4 см х 4 см.
- Предварительно охлаждайте лодку на жидком азоте(LN 2)в пенопластовой коробке.
ПРИМЕЧАНИЕ: Если лодка слишком мала, образец может выпасть из лодки и замерзнуть при непосредственном контакте с LN2,что может привести к фрагментации во время криосекции. - Усыпить животное путем вывиха шейки матки в соответствии с институциональными рекомендациями IACUC, немедленно рассекнуть интересуятую ткань.
- Держите интервал между анестезией животных и замораживанием как можно короче, чтобы свести к минимуму изменение метаболитов во время сбора тканей, особенно губных метаболитов в мозге из-за посмертной ишемии.
ПРИМЕЧАНИЕ: Перфузия животного с фосфатно-буферным физиологическим раствором (PBS) увеличит продолжительность ишемии, еще больше изменяя концентрации лабильных метаболитов и преувеличивая артефактные результаты. Поэтому перфузия или промывка тканей PBS не рекомендуется, если только загрязнение крови или жидкости организма не вызывает большего беспокойства, чем ухудшение или вымывание метаболитов для отдельного проекта.
- Держите интервал между анестезией животных и замораживанием как можно короче, чтобы свести к минимуму изменение метаболитов во время сбора тканей, особенно губных метаболитов в мозге из-за посмертной ишемии.
- Немедленно поместите ткань в алюминиевую лодку, плавающую на жидком азоте, закройте крышку пенополистирофонной коробки и заморозьте на 2-10 минут в зависимости от размера ткани: 2 мин, 5 мин, 7 мин для постнатального дня 1 (P1), P21, P60 мозга мыши, соответственно, и 10 мин для мозга крысы P60.
ПРИМЕЧАНИЕ: Не замораживайте ткань в течение длительного времени (например, 5 минут для мозга мыши P1), так как чрезмерно замороженная ткань может привести к фрагментации ткани во время криосекции. - Снимите лодку щипцами, сложите фольгу, чтобы обернуть ткань, транспортировать на сухом льду и хранить при -80 °C для последующего использования. Если за этим последует немедленное секционирование, перенесут образцы на сухом льду в криостат.
ПРИМЕЧАНИЕ: Чтобы лучше сохранить метаболиты, предпочтительно хранить образец в интактной ткани и разделять его непосредственно перед тем, как приступить к визуализации MALDI. Ткань может храниться при -80 °C до 24 месяцев.
2. Криосекция ткани
ПРИМЕЧАНИЕ: Всегда надевайте перчатки при работе с горками из олова индия (ITO). Избегайте прямого дыхания на горке или носите маски (по желанию), чтобы предотвратить загрязнение человеческой слюны на участке ткани.
- Перед разделкой ткани соберите необходимое количество совместимых с MALDI стеклянных слайдов с покрытием ITO.
- Проверьте проводимость затвора с помощью вольтметра, настроенного на сопротивление. Пометьте сторону, на которой считывается измерение сопротивления: это будет сторона, к которой прилипают участки ткани. Всегда размещайте слайд на чистом бумажном полотенце, чтобы избежать загрязнения.
- Предварительно охладите слайды в криостате, установленном на -20 °C.
- Если образцы тканей были удалены при -80 °C, дайте ткани уравновеситься в криостатной камере около 45-60 мин в зависимости от размера ткани. Если образцы удаляются из сухого льда, уравновешивают его в течение примерно 30 минут.
- Тщательно очистите криостат 70% этанолом. Предварительно охладите все необходимые инструменты, включая кисть художника с тонким наконечником и щипцы в криостатной камере.
- Установите температуру криостатной камеры и головки образца в соответствии с типом ткани: -14 °C для печени, -20 °C для мышц и -25 °C для кожи9.
- Установите ткань на патрон с помощью криотказного встраиваемого соединения OCT, избегая OCT из интересующей области.
- Поместите чистое лезвие в сцену и зафиксируйте. Отрегулируйте положение ступени и угол наклона образца для достижения желаемого угла резания.
ПРИМЕЧАНИЕ: Если необходимо разрезать различные типы /генотипы ткани, обязательно либо переместите образец так, чтобы использовалась чистая часть лезвия, либо переключитесь на новое лезвие перед разрезанием следующего образца, чтобы предотвратить перекрестное загрязнение. - Продолжайте резку до тех пор, пока не будет найдена интересуящая область (например, мозолистое тело в мозге). Обязательно держите сцену в чистоте, смахивая лишние части кистью художника, которая была уравновешена в криостате.
- Как только нужный участок будет выявлен, вырежьте более мелкие участки толщиной 10-12 мкм. Если секция имеет тенденцию к отслаиванию или легкому развалу, повысьте температуру криостата, оставаясь в диапазоне от -22 ° C до -11 ° C. Мы обнаружили, что оптимальная температура резания для мозговой ткани составляет от -15 °C до -18 °C.
- После того, как хороший участок был разрезан, приклейте его к слайду ITO (работайте в криостатной камере).
- Перенесите один участок ткани на слайды ITO с помощью кончика кисти художника.
- Прогрейте секцию пальцем, поместив палец под заскольжение, чтобы прогреть секцию для обеспечения надежного монтажа. Срез ткани сначала станет прозрачным через 5-10 с, а затем станет непрозрачным примерно через 30-60 с.
- Аккуратно отложите слайд в сторону в криостате.
- Повторите шаги для других образцов ткани, гарантируя, что каждый участок ткани равномерно размещен на слайде и максимально выровнен.
- Поскольку мишень MALDI может содержать до двух слайдов, поместите секции из нескольких образцов одной и той же когорты на один слайд или на два слайда, чтобы их можно было анализировать одновременно.
- По завершении поместите слайды ITO в вакуумную коробку и переложите в адсорбатор с адсорбцией. Вакуумная сушка горки в течение 45-60 мин.
ПРИМЕЧАНИЕ: Если вакуумный адсорбатор недоступен в лаборатории, держите слайды под -20 °C все время, чтобы избежать ухудшения состояния метаболитов. - Хранение и транспортировка слайдов: если только образец не подготовлен объектами визуализации керна MALDI для непосредственного хранения изображений MALDI, хранения слайдов при -80 °C или отправки в кернные установки или другие исследовательские лаборатории MALDI на сухом льду.
- Чтобы наилучшим образом сохранить образцы, поместите слайды в транспортер слайдов, заполните его азотом (необязательно), запечатайте парапленкой, поместите в пакет-молнию, который затем помещается в другой пакет-молнию, содержащий адсорбцию. Наклейте этикетку на внешнюю сумку-молнию.
- Переходите к хранению при -80 °C (до 6 месяцев) или транспортировке с достаточным количеством сухого льда.
3. Подготовка матрицы
- Подготовьте матрицу.
ПРИМЕЧАНИЕ: Все реагенты должны быть класса ВЭЖХ.- Готовят NEDC в концентрации 10 мг/мл. Готовят 10 мл матрицы, растворенные в растворителе 70% метанола (100 мг NEDC, 7 мл метанола, 3 млH2O).
- Дополнительно приготовьте дополнительные 10 мл 70% раствора метанола: воды для промывки системы опрыскивателя перед заполнением матрицы.
- После обезвоживания слайдов на этапе 2.17 поместите метки «X» на пустое пространство стеклянного слайда за пределами участков ткани, используя жирный маркер, а затем поместите второй «x» с черным маркером тонкой точки поверх серебряного «X». Черная «X» с резким контрастом на серебристом фоне (жирный серебристый «X») позже послужит фидуциарным маркером для последующего получения масс-спектров в инструменте MALDI.
- Загрузите слайд в металлическую мишень maldi. Используйте пластиковую крышку и нарисуйте / нарисуйте / контур, где находятся образцы, на пластиковой крышке. Откладывать.
- Сканируйте изображение слайда вместе с мишенью MALDI с помощью планшетного сканера. Винты на поверхности мишени будут служить прокладкой для предотвращения повреждения или загрязнения сечения ткани сканером. Предварительный просмотр и сканирование выбранной области слайда в 16-битных оттенках серого и разрешением 2400 тоск. Сохраните изображение для последующего использования в MALDI MSI.
4. Матричное осаждение
ПРИМЕЧАНИЕ: Существует несколько методов нанесения равномерного слоя матрицы в мелкодисперсном размере на слайд MALDI, включая сублимацию, капельную струйную печать, автоматический матричный распылитель и ручное распыление с использованием artist airbush9. Мы будем использовать автоматический матричный опрыскиватель в качестве примера в этом протоколе для его высокой воспроизводимости.
- Запуск: Включите матричный опрыскиватель, убедившись, что клапан расположен на LOAD, и запустите программное обеспечение опрыскивателя. Убедитесь, что выхлопной вентилятор работает хорошо. Не запускайте насос растворителя, если активная вентиляция не функционирует должным образом.
- Подтвердите на вкладке Comms, что все передается, а затем запустите насос растворителя со скоростью 0,1 мл / мин с обратным давлением ~ 500 фунтов на кв. дюйм (или 3,4 МПа).
- Начните подачу сжатого воздуха в матричный распылитель, установив в резервуаре азота значение 30 psi. Затем отрегулируйте регулятор давления на передней панели опрыскивателя до 10 фунтов на дюйм и установите температуру сопла опрыскивателя по желанию.
ПРИМЕЧАНИЕ: Если давление воздуха в молитве ниже 5 фунтов на дюйм, сопло опрыскивателя не сможет нагреться для защиты. - Когда клапан все еще находится в положении LOAD, используйте шприц, чтобы промыть петлю 7 мл 70% метанола, а затем заполните петлю 6 мл матрицы.
- Поместите скольжение ткани в держатели в распылителе, заклеив оба конца, чтобы предотвратить движение, и сохранить край без матрицы, чтобы избежать загрязнения металлического зажима на мишени MALDI матрицей.
ПРИМЕЧАНИЕ: Настоятельно рекомендуется сначала протестировать матричный спрей на пустом слайде микроскопа, прежде чем переходить к драгоценным образцам слайдов. - Убедитесь, что скорость потока и температура стабильны, чтобы начать распыление.
- Выберите нужный метод предварительно протестированный с помощью бланка из чистого стекла.
- Нажмите кнопку Пуск. Это установит температуру сопла и отрегулирует расход насоса в соответствии с выбранным методом. Переключите клапан из положения Load в Положение Распыления, затем подтвердите, нажав Продолжить.
- Позвольте системе работать, что займет 5-20 минут на слайд в зависимости от метода. Переключите клапан из положения Распыление в положение Загрузки, а затем подтвердите, нажав кнопку Продолжить по завершении.
- Снимите слайд(ы) с опрыскивателя, осмотрите рисунок матричного покрытия под микроскопом, чтобы обеспечить равномерный слой тонкого матричного кристалла.
- После матричного осаждения поместите затвор (слайды) в металлический держатель MALDI для немедленного использования. Если имеется только один образец слайда, добавьте еще один пустой слайд, чтобы заполнить два пробела держателя MALDI.
- Очистите систему сразу после использования, следуя инструкции производителя, чтобы предотвратить засорение форсунок опрыскивателя.
- После того, как образец покрыт матрицей, либо немедленно приступайте к инструменту визуализации MALDI, либо отправляйте его с сухим льдом, используя ту же подготовку двойного пакета на молнии, описанную на этапе 2.19.
ПРИМЕЧАНИЕ: В чрезвычайных обстоятельствах, таких как прибор MALDI недоступен для немедленного использования, храните затвор с покрытием в вакуумном состоянии или при -20 °C в течение 24 часов, хотя ухудшение некоторых метаболитов может произойти во время хранения, что не было тщательно изучено.
Результаты
Репрезентативный эксперимент проводился в соответствии с рабочим процессом, показанным на рисунке 1. Развивающийся мозг мыши дикого типа C57BL послеродового дня 1, 21, 60 (взрослый) был собран, как описано выше в соответствии с рекомендациями CUNY IACUC, и был заморожен в течение 2, 5 и 7 минут соответственно на алюминиевой лодке, плавающей на жидком азоте. Замороженные ткани были криосекционированы на участках толщиной 10 мкм при −15 °C, установленных как для головки образца, так и для камеры. Затем криосекции тканей были аккуратно перенесены на предварительно охлаждаемую проводящую сторону стеклянных слайдов с покрытием ITO для визуализации MALDI. Установленные криосекции на слайдах ITO высушивались в вакууме в течение 45 мин при комнатной температуре с последующим матричным осаждением с помощью автоматического матричного опрыскивателя. Матричный NEDC использовали для обнаружения метаболитов, а матричный раствор 10 мг/мл в метаноле/воде (70/30, v/v) осаждать при расходе 0,1 мл/мин и температуре сопла 75 °C в течение 12 циклов с 5 с сушкой между каждым циклом. Использовалась скорость распыления 1300 мм/мин, расстояние между гусеничной дорожкой 2 мм, давление газаN2 10 фунтов на дюйм и расход 3 л/мин и высота сопла 40 мм.
Масс-спектры MALDI были получены в режиме отрицательных ионов прибором MALDI time of flight (TOF). 0,5-1 мкл эмульсии красного фосфора (Pn кластеры с n = 1 - 90) в метаноле наносили на слайды ITO, рядом с установленными тканями, и использовали для калибровки прибора в диапазоне масс 100 - 1000 м/з путем применения квадратичной калибровочной кривой13. Диаметры лазерных пятен были сфокусированы на «средний» модулированный профиль луча для ширины растра 50 мкм. Спектры в диапазоне масс от м/з 50 до 1000 были получены при частоте 1000 Гц за 500 выстрелов. Данные масс-спектров были записаны, и изображение было дополнительно проанализировано с использованием передового программного обеспечения для анализа данных MALDI MSI. Ионные изображения были сгенерированы с нормализацией среднеквадратичной основе (RMS) при ширине бункера ±0,25 Да.
Результаты на рисунке 2 показывают выходные изображения из программного обеспечения для анализа данных MALDI MSI спектров m/z, выбранных из каждых 100 дальтонных интервалов, четко изображая полезность для идентификации спектров от метаболитов малых молекул до высокомолекулярных липидов. Каждая строка изображает соответствующие ионные тепловые карты, содержащие как пространственную, так и спектральную информацию об определенных видах метаболитов в трех тканях, собранных на постнатальный день 1, 21 и 60. Для каждого репрезентативного м/з анализ регионального распределения и обилия ионов может быть использован для сравнения относительных количеств соответствующих видов между различными возрастами. Сильной стороной методологии MALDI MSI является способность различать специфичность определенных видов, идентифицированных по m/z к вехам развития или конкретным анатомическим структурам. Некоторые метаболиты, как наблюдается, обогащаются у новорожденных P1 (m/z 320,1), обогащаются у взрослых P60 (m/z 846,5) или равномерно распределяются по возрасту (m/z 480,3); другие молекулярные виды специально обогащены серым веществом (m/z 117.1; 524.3; 765.1), белым веществом (m/z 673.4; 846.5) или CSF/желудочками (m/z 239.0)(рисунок 2A). Также показано пространственное распределение репрезентативных метаболитов, включая гипоксантин (m/z 135.0), N-ацетил-L-аспарагиновую кислоту (m/z 174.0), арахидоновую кислоту (m/z 303.2) и несколько липидов, таких как лизофосфатидилэтаноламин LPE (18:1) (m/z 478.3), LPE(20:4) (m/z 500.3), LPE (22:6) (m/z 524.3), фосфатидилэтаноламин PE (44:10) (m/z 838.5), Phosphatidylinositol PI(38:4) (m/z 885.6) также показано(рисунок 2B).
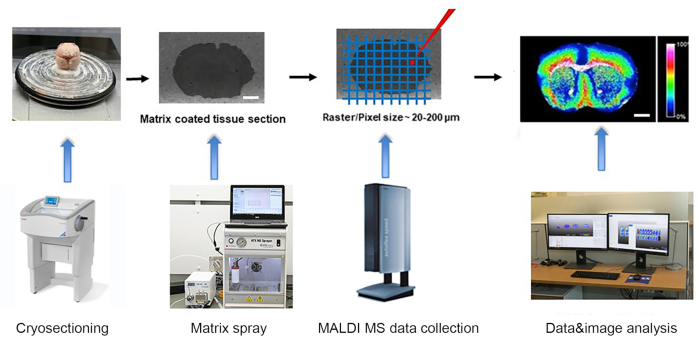
Рисунок 1. Рабочий процесс масс-спектрометрии MALDI-time of flight (TOF). Замороженная ткань криосецируется в криостате и устанавливается на слайд ITO. → Горка с участками ткани покрыта тонким слоем матрицы с помощью автоматического матричного опрыскивателя. → масс-спектры собираются прибором MALDI-TOF MSI на растре 20-200 мкм. → Данные анализируются, а изображения генерируются с использованием передового программного обеспечения для анализа данных MALDI MSI. Шкала: 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
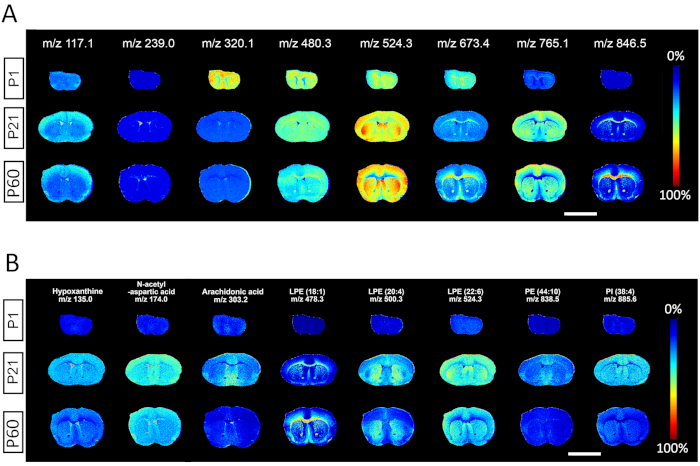
Рисунок 2. Репрезентативный выход с выбранными спектрами m/z из масс-спектрометрии, полученный при боковом разрешении 50 мкм. Тепловаякарта изображает пространственное распределение конкретных видов метаболитов, отобранных из каждых 100 дальтонов m/z интервала по трем вехам развития, определенным на P1, P21 и P60. (B)Пространственное распределение репрезентативных метаболитов в P1, P21 и P60, включая: гипоксантин, N-ацетил-L-аспарагиновую кислоту, арахидоновую кислоту и различные липидные виды, такие как лизофосфатидилэтаноламин (LPE), фосфатидилэтаноламин (PE), фосфатидилинозитол (PI). Шкала, 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
MALDI-Imaging (MALDI-MSI) - это метод визуализации без меток, который позволяет исследователям исследовать распределение различных биомолекул и их модификаций в тканях, молекулярную основу патологии. Совместное использование MALDI-MSI с традиционными подходами LC-MS для анализа тканей обеспечивает ту же молекулярную глубину, что и традиционные рабочие процессы Omics, но также сохраняет пространственную связь этих сигналов в клеточной сети. Пробоподготовка является наиболее важным этапом в MALDI MSI и учитывает вариации в окончательных показаниях метаболомических исследований, проведенных в разных лабораториях4. Здесь мы предоставляем всеобъемлющий, но практический протокол для стандартизации подготовки образцов для метаболомного профилирования с использованием MALDI MSI в надежде, что это принесет пользу широкому исследовательскому сообществу для внедрения MALDI MSI в их текущих и будущих исследованиях от фундаментальной биологии до трансляционных исследований.
Необходимо всегда помнить обо всех мерах предосторожности, чтобы свести к минимуму изменения в молекулярных профилях (как в изобилии, так и в пространственном распределении) во время подготовки образцов и избежать загрязнения. Во-первых, минимизируйте время между эвтаназией животных и сбором тканей, таких как замораживание in situ или нагревание микроволновой фиксацией для инактивации ферментов в мозге, чтобы уменьшить ответственность за посмертную ишемию4,5,6. Во-вторых, состояние мгновенного замораживания образца является критическим. Недостаточное замораживание приведет к деградации и потере метаболитов, в то время как чрезмерное замораживание приведет к фрагментации тканей во время криосекции. Время замораживания всегда должно быть проверено в первую очередь в соответствии с предыдущими исследованиями, а исследование мозга мыши, представленное в этой статье, обеспечивает ориентиры для мозговой ткани грызунов. В-третьих, разрезание биологических тканей и перенос их участков на слайды МТО потребует адекватной практики. Важно отметить, что при использовании кисти для подъема участка со сцены кисть следует использовать деликатно. Позвольте щетинкам щетки соприкасаться только с краями участка ткани, чтобы снизить риск загрязнения и фрагментации сечения. Максимально сглажьте срез на слайде, это предотвратит скручивание секции во время разогрева пальцев. В-четвертых, при монтаже на слайд ITO убедитесь, что вся секция хорошо прикреплена к слайду ITO, так как разные области ткани могут потребовать разного времени нагрева пальцев. Например, опухолевая ткань головного мозга требует более длительного времени нагрева, чем нормальная ткань мозга. Плохое крепление может привести к отслоению и фрагментации ткани во время сканирования MALDI-MS. Имейте в виду, что согревание пальцев может обеспечить действие ферментов и метаболизм, вызывающих артефактные изменения метаболитов. В-пятых, тонкое и равномерное осаждение матрицы MALDI играет важную роль в получении точной пространственной информации и сильного сигнала MALDI-MS. Рекомендуется протестировать напыление матрицы на пустом слайде и наблюдать за кристаллическим рисунком под микроскопом, чтобы убедиться в правильном покрытии, прежде чем приступать к покрытию драгоценного образца слайда. И, наконец, поскольку отдельный исследователь выполняет сбор ткани и подготовку слайдов с разной скоростью, было бы идеально иметь одного человека для обработки образца для образца в одной и той же когорте, чтобы свести к минимуму вариации.
В приведенном выше протоколе подробно описываются стандартные процедуры, которые могут быть адаптированы к потребностям конкретных экспериментов. Например, криосекционный гель OCT, который обычно используется при криосекредении образца, может быть дополнительно использован в качестве монтажного клея к тканевому патрону (как в исследовании, описанном выше). Предыдущие исследования показали, что полимерный компонент в ОКТ вызывает сильное подавление ионов14. Однако встраивание образца может быть неизбежным в тех случаях, когда ткань слишком хрупкая, чтобы ее можно было разрезать без дополнительной поддержки полимерного геля. Для борьбы с подавлением сигнала в этих случаях ткани может потребоваться промывка при последовательной промывке 70% этанола и 95% этанола для удаления остаточного ОКТ для обнаружения белков или липидов, в то время как промывка не рекомендуется для обнаружения малых молекулярных метаболитов9.
MALDI MSI становится все более актуальным как в исследовательской лаборатории, так и в клинической практике. Например, MALDI MSI недавно оказался полезным в исследованиях протеомики для характеристики фенотипического функционального статуса организма15и в качестве агента для микробной идентификации и диагностики последующего заболевания16. Хотя MALDI MSI поддерживает широкий спектр применений, существуют некоторые ограничения, связанные с опорой исключительно на этот метод, особенно когда речь идет о дифференциации между аналогичными видами или метаболитами и идентификации конкретных мишеней. Другой проблемой является количественная оценка концентрации метаболитов в соответствии с сигналами MALDI MSI. Часто предполагается, что обилие ионов в спектрах MALDI MSI и пространственное распределение (или относительное изобилие) соответствующих молекулярных видов в рассеченных тканях хорошо коррелируют. Однако всегда следует иметь в виду, что связь между интенсивностью ионов и количеством соответствующих молекулярных видов осложняется многочисленными факторами, включая, но не ограничиваясь, эффектами подавления ионов, изменениями структуры тканей и ионно-молекулярными реакциями17. Методы, использующие внутренние стандарты, могут быть реализованы для абсолютной количественной оценки (мкмоль/г ткани) в MALDI-MSI18. Эти две проблемы обычно решаются с помощью комбинированного рабочего процесса MALDI MSI с методами жидкостной хроматографии тандема MS (LC-MS / MS), в соответствии с которым MALDI-MS позволяет отображать интересующую область, которая впоследствии подвергается микроэкстракции и LC-MS / MS для предоставления дополнительной информации для идентификации метаболита19.
Методы визуализации на основе РС были разработаны в последние годы в качестве альтернативы предыдущим методам визуализации метаболитов малых молекул. С развитием и растущей популярностью MALDI MSI ожидается, что визуализация MALDI станет новым стандартным инструментом для визуализации малых молекул. Особый интерес представляют визуализация липидных и эндогенных малых молекул (например, нейротрансмиттеров и метаболитов) в биологическом контексте, а также визуализация ксенобиотиков для разработки новых фармацевтических агентов. Ожидается, что в ближайших20годах эти три области будут быстро прогрессировать с применением MALDI MSI.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Благодарности
Ye He и Ринат Абзалимов поддерживаются Программой научных премий Конгресса профессиональных сотрудников Городского университета Нью-Йорка (PSC-CUNY). Юки Чен и Келли Вирасамми поддерживаются Летней исследовательской программой бакалавриата Фонда Альфреда. Слоуна CUNY.
Материалы
| Name | Company | Catalog Number | Comments |
| Andwin Scientific Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Artist brush MSC #5 1/8 X 9/16 TRIM RED SABLE | Fisher Scientific | 50-111-2302 | |
| Autoflex speed MALDI-TOF MS system | Bruker Daltonics Inc | MALDI-TOF MS instrument | |
| BD Syringe with Luer-Lok Tips | Fisher Scientific | 14-823-16E | |
| BD Vacutainer General Use Syringe Needles | Fisher Scientific | 23-021-020 | |
| Bruker Daltonics GLASS SLIDES MALDI IMAGNG | Fisher Scientific | NC0380464 | |
| Drierite, with indicator, 8 mesh, ACROS Organics | Fisher Scientific | AC219095000 | |
| Epson Perfection V600 Photo Scanner | Amazon | Perfection V600 | |
| Fisherbrand 5-Place Slide Mailer | Fisher Scientific | HS15986 | |
| Fisherbrand Digital Auto-Range Multimeter | Fisher Scientific | 01-241-1 | |
| FlexImaging v3.0 | Bruker Daltonics Inc | Bruker MS imaging analysis software | |
| HPLC Grade Methanol | Fisher Scientific | MMX04751 | |
| HPLC Grade Water | Fisher Scientific | W5-1 | |
| HTX M5 Sprayer | HTX Technologies, LLC | Automatic heated matrix sprayer | |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers | Fisher Scientific | 06-666A | |
| MSC Ziploc Freezer Bag | Fisher Scientific | 50-111-3769 | |
| N -(1-Naphthyl) Ethylenediamine Dihydrochloride (NEDC) | Millipore Sigma Aldrich | 222488 | |
| SCiLS Lab (2015b) | SCiLS Lab | Advanced MALDI MSI data analysis software | |
| Thermo Scientific CryoStar NX50 Cryostat | Fisher Thermo Scientific | 95-713-0 | |
| Thermo Scientific Nalgene Transparent Polycarbonate Classic Design Desiccator | Fisher Scientific | 08-642-7 |
Ссылки
- Watkins, S. M., German, J. B. Metabolomics and biochemical profiling in drug discovery and development. Current Opinion in Molecular Therapeutics. 4, 224-228 (2002).
- Fernie, A. R., Trethewey, R. N., Krotzky, A. J., Willmitzer, L. Metabolite profiling: from diagnostics to systems biology. Nature Reviews Molecular Cell Biology. 5, 763-769 (2004).
- Theodoridis, G. A., Gika, H. G., Want, E. J., Wilson, I. D. Liquid chromatography-mass spectrometry based global metabolite profiling: a review. Analytica Chimica Acta. 711, 7-16 (2012).
- Dienel, G. A. Metabolomic and Imaging Mass Spectrometric Assays of Labile Brain Metabolites: Critical Importance of Brain Harvest Procedures. Neurochemistry Research. 45, 2586-2606 (2020).
- Dienel, G. A. Metabolomic Assays of Postmortem Brain Extracts: Pitfalls in Extrapolation of Concentrations of Glucose and Amino Acids to Metabolic Dysregulation In Vivo in Neurological Diseases. Neurochemistry Research. 44, 2239-2260 (2019).
- Wasek, B., Arning, E., Bottiglieri, T. The use of microwave irradiation for quantitative analysis of neurotransmitters in the mouse brain. Journal of Neuroscience Methods. 307, 188-193 (2018).
- Andres, D. A., et al. Improved workflow for mass spectrometry-based metabolomics analysis of the heart. Journal of Biological Chemistry. 295, 2676-2686 (2020).
- Lu, W., et al. Metabolite Measurement: Pitfalls to Avoid and Practices to Follow. Annual Review of Biochemistry. 86, 277-304 (2017).
- Norris, J. L., Caprioli, R. M. Analysis of tissue specimens by matrix-assisted laser desorption/ionization imaging mass spectrometry in biological and clinical research. Chemical Reviews. 113, 2309-2342 (2013).
- Miura, D., et al. Ultrahighly sensitive in situ metabolomic imaging for visualizing spatiotemporal metabolic behaviors. Analytical Chemistry. 82, 9789-9796 (2010).
- Han, J., et al. Towards high-throughput metabolomics using ultrahigh-field Fourier transform ion cyclotron resonance mass spectrometry. Metabolomics. 4, 128-140 (2008).
- Wang, J., et al. MALDI-TOF MS imaging of metabolites with a N-(1-naphthyl) ethylenediamine dihydrochloride matrix and its application to colorectal cancer liver metastasis. Analytical Chemistry. 87, 422-430 (2015).
- Sladkova, K., Houska, J., Havel, J. Laser desorption ionization of red phosphorus clusters and their use for mass calibration in time-of-flight mass spectrometry. Rapid Communication in Mass Spectrometry. 19, 3114-3118 (2019).
- Schwartz, S. A., Reyzer, M. L., Caprioli, R. M. Direct tissue analysis using matrix-assisted laser desorption/ionization mass spectrometry: practical aspects of sample preparation. Journal of Mass Spectrometry. 38, 699-708 (2003).
- Greco, V., et al. Applications of MALDI-TOF mass spectrometry in clinical proteomics. Expert Review of Proteomics. 15, 683-696 (2018).
- Singhal, N., Kumar, M., Kanaujia, P. K., Virdi, J. S. MALDI-TOF mass spectrometry: an emerging technology for microbial identification and diagnosis. Frontiers in Microbiology. 6, 791(2015).
- Hankin, J. A., Murphy, R. C. Relationship between MALDI IMS intensity and measured quantity of selected phospholipids in rat brain sections. Analytical Chemistry. 82 (20), 8476-8484 (2010).
- Prentice, B. M., Chumbley, C. W., Caprioli, R. M. Absolute Quantification of Rifampicin by MALDI Imaging Mass Spectrometry Using Multiple TOF/TOF Events in a Single Laser Shot. Journal of the American Society for Mass Spectrometry. 28 (1), 136-144 (2017).
- Quanico, J., Franck, J., Wisztorski, M., Salzet, M., Fournier, I. Combined MALDI Mass Spectrometry Imaging and Parafilm-Assisted Microdissection-Based LC-MS/MS Workflows in the Study of the Brain. Methods in Molecular Biology. 1598, 269-283 (2017).
- Trim, P. J., Snel, M. F. Small molecule MALDI MS imaging: Current technologies and future challenges. Methods. 104, 127-141 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены