Method Article
Скрининг фрагментов на основе ЯМР в режиме минимальной выборки, но максимальной автоматизации
В этой статье
Резюме
Скрининг на основе фрагментов с помощью ЯМР является надежным методом быстрой идентификации низкомолекулярных связывающих веществ с биомакромолекулами (ДНК, РНК или белками). Представлены протоколы, описывающие автоматическую пробоподготовку, эксперименты ЯМР и условия сбора данных, а также рабочие процессы анализа. Этот метод позволяет оптимально использовать как 1H, так и 19F ЯМР-активных ядер для обнаружения.
Аннотация
Скрининг на основе фрагментов (FBS) является хорошо проверенной и общепринятой концепцией в процессе открытия лекарств как в академических кругах, так и в промышленности. Самым большим преимуществом скрининга фрагментов на основе ЯМР является его способность не только обнаруживать связующие вещества со сродством более 7-8 порядков, но и контролировать чистоту и химическое качество фрагментов и, таким образом, производить высококачественные попадания и минимальное количество ложноположительных или ложноотрицательных результатов. Предварительным условием в FBS является выполнение начального и периодического контроля качества библиотеки фрагментов, определение растворимости и химической целостности фрагментов в соответствующих буферах и создание нескольких библиотек для покрытия различных каркасов для размещения различных классов мишеней макромолекул (белки/РНК/ДНК). Кроме того, требуется обширная оптимизация протокола скрининга на основе ЯМР в отношении количества образцов, скорости сбора и анализа на уровне биологического конструкта / фрагментного пространства, в пространстве условий (буфер, добавки, ионы, pH и температура) и в лигандном пространстве (аналоги лигандов, концентрация лигандов). По крайней мере, в академических кругах эти усилия по скринингу до сих пор предпринимались вручную в очень ограниченном объеме, что приводило к ограниченной доступности инфраструктуры скрининга не только в процессе разработки лекарств, но и в контексте разработки химических зондов. Для того, чтобы удовлетворить требования экономно, представлены расширенные рабочие процессы. Они используют преимущества новейшего современного оборудования, с помощью которого сбор жидких проб может быть заполнен в ЯМР-пробирки с регулируемой температурой в автоматическом режиме. 1Затем спектры на основе ЯМР-лигандов H/19F собираются при заданной температуре. Высокопроизводительный сменщик образцов (HT sample changer) может обрабатывать более 500 образцов в блоках с регулируемой температурой. Это вместе с передовыми программными инструментами ускоряет сбор и анализ данных. Кроме того, описано применение процедур скрининга на образцах белков и РНК, чтобы ознакомить с установленными протоколами для широкой пользовательской базы в биомакромолекулярных исследованиях.
Введение
Скрининг на основе фрагментов в настоящее время является широко используемым методом идентификации довольно простых и низкомолекулярных молекул (MW <250 Da), которые демонстрируют слабое связывание с макромолекулярными мишенями, включая белки, ДНК и РНК. Первоначальные попадания с первичных экранов служат основой для проведения вторичного скрининга коммерчески доступных более крупных аналогов попаданий, а затем для использования стратегий роста фрагментов или связывания на основе химии. Для успешной платформы обнаружения лекарств на основе фрагментов (FBDD), как правило, требуется надежный биофизический метод для обнаружения и характеристики слабых попаданий, библиотека фрагментов, биомолекулярная мишень и стратегия последующей химии. Четырьмя широко применяемыми биофизическими методами в рамках кампаний по открытию лекарств являются анализы теплового сдвига, поверхностный плазмонный резонанс (SPR), кристаллография и спектроскопия ядерного магнитного резонанса (ЯМР).
ЯМР-спектроскопия показала различные роли на разных этапах FBDD. Помимо обеспечения химической чистоты и растворимости фрагментов в библиотеке фрагментов, растворенных в оптимизированной буферной системе, эксперименты с ЯМР, наблюдаемые лигандом, могут обнаруживать связывание фрагмента с мишенью с низким сродством, а эксперименты с ЯМР-мишенью могут очертить эпитоп связывания фрагмента, что позволяет проводить детальные исследования взаимосвязи между структурой и активностью. В рамках эпитопного картирования изменения химического сдвига на основе ЯМР не только идентифицируют ортостерические сайты связывания, но и аллостерические сайты, которые могут быть загадочными и доступными только в так называемых возбужденных конформационных состояниях биомолекулярной мишени. Если биомолекулярная мишень уже связывает эндогенный лиганд, идентифицированные фрагментные попадания можно легко классифицировать как аллостерические или ортостерические, проводя конкурентные эксперименты на основе ЯМР. Определение константы диссоциации (KD) взаимодействия лиганд-мишень является важным аспектом в процессе FBDD. Химическое титрование на основе ЯМР, как лиганда, так и мишени, может быть легко выполнено для определения KD. Основным преимуществом ЯМР является то, что исследования взаимодействия проводятся в растворе и близких к физиологическим условиям. Таким образом, все конформационные состояния для анализа взаимодействия лиганда/фрагмента с мишенью могут быть исследованы. Кроме того, подходы, основанные на ЯМР, не только ограничены скринингом хорошо свернутых растворимых белков, но также применяются для размещения большего целевого пространства, включая ДНК, РНК, связанные с мембраной и внутренне неупорядоченные белки1.
Библиотеки фрагментов являются неотъемлемой частью процесса FBDD. Как правило, фрагменты действуют как начальные предшественники, которые в конечном итоге становятся частью (субструктурой) нового ингибитора, разработанного для биологической мишени. Сообщалось, что несколько препаратов (Венетоклакс2, Вемурафениб3, Эрдафитиниб4, Пексидартниб5) начинались как фрагменты и в настоящее время успешно используются в клиниках. Как правило, фрагменты представляют собой низкомолекулярные (<250 Да) органические молекулы с высокой растворимостью и стабильностью в воде. Тщательно продуманная библиотека фрагментов, содержащая, как правило, несколько сотен фрагментов, уже может обещать эффективное исследование химического пространства. Общий состав библиотек фрагментов развивался со временем и чаще всего получался путем рассечения известных лекарств на более мелкие фрагменты или разрабатывался вычислительно. Эти разнообразные библиотеки фрагментов в основном содержат плоские ароматические или гетероатомы и придерживаются правила Липински 5 6 или текущего коммерческого тренда правила 3 7, но избегают реакционноспособных групп. Некоторые библиотеки фрагментов также были получены или состояли из хорошо растворимых метаболитов, натуральных продуктов и/или их производных8. Общая проблема, возникающая в большинстве библиотек фрагментов, заключается в простоте последующей химии.
Центр биомолекулярного магнитного резонанса (BMRZ) при Университете Гёте во Франкфурте является партнером iNEXT-Discovery (Infrastructure for NMR, EM and X-rays for Translational research-Discovery), консорциума структурных исследовательских инфраструктур для всех европейских исследователей из всех областей биохимических и биомедицинских исследований. В рамках предыдущей инициативы iNEXT, которая завершилась в 2019 году, была создана библиотека фрагментов, состоящая из 768 фрагментов, с целью «минимального количества фрагментов и максимального разнообразия», охватывающего большое химическое пространство. Кроме того, в отличие от любой другой библиотеки фрагментов, библиотека фрагментов iNEXT также была разработана на основе концепции «уравновешенных фрагментов» с целью облегчения последующего синтеза сложных лигандов с высоким сродством и отныне известна как внутренняя библиотека (Diamond, Structural Genomic Consortium и iNEXT).
Создание FBDD с помощью ЯМР требует рабочей силы, знаний и инструментов. На БМРЗ были разработаны оптимизированные рабочие процессы для поддержки технической помощи в скрининге фрагментов с помощью ЯМР. К ним относятся контроль качества и оценка растворимости библиотеки фрагментов 9, оптимизация буфера для выбранных мишеней, скрининг на основе 1D-лиганда, наблюдаемый 1H или 19F, конкурентные эксперименты по дифференциации ортостерического и аллостерического связывания, эксперименты по ЯМР-наблюдению за мишенями на основе 2D для картирования эпитопов и для характеристики взаимодействия со вторичным набором производных исходных попаданий фрагментов. BMRZ установил автоматизированные процедуры для анализа, как также обсуждалось ранее в литературе 10,11, низкомолекулярных и белковых взаимодействий и имеет всю необходимую автоматизированную инфраструктуру для скрининга фрагментов на основе ЯМР. В нем реализованы ЯМР с переносом насыщения (STD-ЯМР), водный лиганд, наблюдаемый с помощью градиентной спектроскопии (waterLOGSY), и релаксационные эксперименты на основе Карра-Перселла-Мейбума-Гилла (на основе CPMG) для идентификации фрагментов в широком диапазоне режимов сродства, а также современные автоматизированные приборы и программное обеспечение ЯМР для открытия лекарств. В то время как скрининг фрагментов на основе ЯМР хорошо зарекомендовал себя для белков, этот подход реже используется для поиска новых лигандов, взаимодействующих с РНК и ДНК. BMRZ доказал концепцию новых протоколов, позволяющих идентифицировать взаимодействия малых молекул РНК / ДНК. В следующих разделах этого вклада сообщается, что применение процедур скрининга на образцах белков и РНК позволяет узнать об установленных протоколах для широкой базы пользователей в биомакромолекулярных исследованиях.
протокол
1. Библиотека фрагментов
- Собственная библиотека фрагментов
ПРИМЕЧАНИЕ: В рамках одной из совместных исследовательских работ iNEXT была разработана надежная и последующая библиотека фрагментов первого поколения12 , а затем второе поколение библиотеки было собрано в сотрудничестве с Enamine и известно как библиотека фрагментов DSI (Diamond-SGC-iNEXT) (отныне называемая «Внутренняя библиотека»). Эта библиотека может быть доступна в BMRZ для целей скрининга.- Оцените библиотеку фрагментов на предмет ее целостности и растворимости, используя ранее зарегистрированный протокол на основе ЯМР9.
ПРИМЕЧАНИЕ: Внутренняя библиотека состоит из 768 фрагментов с очень высоким химическим разнообразием (>200 синглтонов). Проведение просеивания во фрагментных смесях может значительно ускорить кампанию по просеиванию; однако количество фрагментов в смеси ограничено из-за перекрытия сигнала в спектре 1H-ЯМР. Более высокое химическое разнообразие, предлагаемое собственной библиотекой, позволяет получать смеси, содержащие 12 различных фрагментов, без какого-либо значительного перекрытия химического сдвига в наблюдаемых спектрахЯМР 1 H. - 103 фрагмента в 768 фрагментах обладают атомом фтора. Для целей скрининга 19 F разделите все 103 фрагмента, обладающих фторсодержащей группой, на 5 смесей на основе минимального перекрытия химического сдвига 19F. Чтобы свести к минимуму перекрытие сигналов при экранировании 19F, используйте информацию о химическом сдвиге из измерений отдельных соединений для проектирования смесей с максимальным количеством фрагментов и минимальным перекрытием сигнала. Каждая смесь состоит из 20-21 фрагмента с отчетливыми химическими сдвигами 19F, что позволяет однозначно назначать фрагменты.
- Оцените библиотеку фрагментов на предмет ее целостности и растворимости, используя ранее зарегистрированный протокол на основе ЯМР9.
- Определяемая/предоставляемая пользователем библиотека фрагментов
- Проводить скрининговые кампании с помощью пользовательской или предоставленной библиотеки фрагментов; Тем не менее, следующие шаги должны предшествовать скрининговой кампании.
- Если это не указано пользователем заранее, выполнить контроль качества фрагментов на основе ЯМР (на БМРЗ для этого используются передовые программные средства; пункт 9, глава 6.1.1).
- Перед использованием проверьте растворимость фрагментов в выбранном буфере для биомолекулярной мишени, целостности структуры и концентрации фрагментов.
- Спроектируйте смесь таким образом, чтобы уменьшить как перекрытие сигналов в спектрах ЯМР, так и время измерения.
- Расчет смесей в соответствии с этапом 4.2.
- Экранируйте отдельные фрагменты или подмножество смесей вместо всей библиотеки.
2. Пробоподготовка
ПРИМЕЧАНИЕ: При высокопроизводительном скрининге с помощью ЯМР для подготовки проб используется робот-пипетировщик. Спектры ЯМР, а также стабильность в течение нескольких дней приема сигналов белков, РНК и ДНК чрезвычайно чувствительны к колебаниям температуры, и поэтому автоматизированные системы с регулируемой температурой значительно облегчат стабильность образцов, которым пипетку. Для этого к роботу-пипетирующему роботу подключено дополнительное дополнительное устройство, работающее при температуре от 4 до 40 °C, для работы с жидкими образцами ЯМР в среде с контролируемой температурой.
- Приготовление смеси лигандов
- Подготовьте просеивающие образцы для измерений ЯМР с помощью робота-пробоподготовки. Гибкая конфигурация робота позволяет использовать его в широком спектре применений (например, извлечение образцов из пробирок ЯМР обратно в контейнеры для хранения или общие задачи по обработке жидкостей). Можно использовать ЯМР-трубки с различным диаметром (1,7, 2,0, 2,5, 3,0 и 5,0 мм). Роботизированная система для отбора проб вместе с передовым управляющим программным обеспечением считывает штрих-код, присвоенный для каждого типа контейнера, и оптимально выполняет протокол наполнения жидкостью.
- Для приготовления лигандных смесей собственной библиотеки используйте флаконы со штрих-кодом. Флаконы со штрих-кодом гарантируют высочайший уровень надежности и оптимальную прослеживаемость образцов.
- Распределите 768 соединений на 8 планшетов 96-луночного формата. Исходная концентрация каждого отдельного фрагмента составляет 50 мМ в d6-DMSO/D2O (9:1). Всего приготовьте 64 смеси, каждая из которых содержит по 12 фрагментов. Конечная концентрация каждого фрагмента в смеси составляет 4,2 мМ.
ПРИМЕЧАНИЕ: Робот-пипетировщик может работать с различными типами контейнеров различной геометрии (флаконы с крио- или автоматическим пробоотборником, 96-луночные пластины круглой или квадратной глубины, стандартные флаконы со штрих-кодом, микроцентрифужные пробирки) и способствует эффективному переносу жидкости в различные пробирки и стойки ЯМР.

Рисунок 1: (A) Высокопроизводительный робот для пробоподготовки ЯМР и наполнения ЯМР-пробирок, установленный на BMRZ. (B) Высокопроизводительная установка смены проб с индивидуальными стойками с регулируемой температурой, установленная на спектрометре с частотой 600 МГц на объекте BMRZ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Просеивание пробоподготовки холостым (эталонный спектр лиганда) и с мишенью (лиганд в присутствии мишени)
- Для подготовки образцов для скрининга ЯМР в присутствии биомолекулы-мишени (белок/РНК/ДНК) и смеси лигандов используйте 3-миллиметровые пробирки для смены образцов ЯМР HT, выбранные из портфеля стандартных пробирок ЯМР Bruker.
- Перенесите биомолекулярную мишень (например, 1час скрининга: 10 мкМ РНК или белок) в определенный скрининговый буфер в ЯМР-пробирку диаметром 3 мм (конечный объем 200 мкл) вручную или с помощью робота-пипетки.
- Перенесите 10 мкл (например, 1ч скрининга) лигандной смеси на следующем этапе с помощью роботизированной системы в пробирки ЯМР со штрих-кодом 3 мм, содержащие целевую биомолекулу, и смешайте с использованием встроенного протокола управляющего программного обеспечения.
ПРИМЕЧАНИЕ: Номер штрих-кода ЯМР-трубки удобно и автоматически включается в полученный набор данных ЯМР, что обеспечивает рабочий процесс, ориентированный на идентификацию, без какой-либо путаницы. Аксессуар для контроля температуры робота-пипетки позволяет хранить подготовленные образцы в пробирках ЯМР при постоянной температуре.
- Собственные условия и параметры
- Установить оптимальные буферные условия для проведения скрининга РНК и белка по собственной библиотеке фрагментов. Для РНК на БМРЗ используются следующие кондиционированные образцы: 25 мМ KPi, 50 мМ KCl, рН 6,2. Mg2+ не является обязательным.
- Белки чрезвычайно чувствительны к условиям раствора; Используйте буферы, оптимальные для выбранной цели. Для каждого из этих буферов приобретите дополнительные эталонные спектры лигандов, которые будут служить заготовкой для анализа.
- Условия, заданные пользователем
ПРИМЕЧАНИЕ: В тех случаях, когда внутренние условия не подходят для целей, подлежащих проверке от потенциального пользователя, следует предпринять следующие шаги.- Выполните 1H-ЯМР только буфера, чтобы обеспечить минимальное вмешательство со стороны компонентов буфера при выполнении и анализе экспериментов по скринингу с лигандом. Мешающие компоненты могут быть соответствующим образом заменены дейтерированными эквивалентами.
- Ограничения в производстве образцов (целевые количества)/условия и доступность
ПРИМЕЧАНИЕ: Выделение или рекомбинантное производство определенных биомакромолекул может в некоторых случаях оказаться сложной задачей и привести к ограниченной доступности мишени для проведения успешной кампании скрининга лекарств. В случае ограниченной или неограниченной доступности мишеней для успешного скрининга фрагментов на основе ЯМР могут быть использованы следующие альтернативы.- Если это ограничено, используйте скрининг на основе 19F-ЯМР. Типичные фторированные лиганды имеют один сигнал 19F; Поэтому используйте коктейли с 25-30 фрагментами без какого-либо сигнального перекрытия. Меньше сигналов для анализа, нет помех сигнала от компонентов буфера и меньше сигналов, на которые можно полагаться для идентификации попаданий.
- Если нет ограничений, используйте экраны большего размера, такие как 1H-NMR. Можно просмотреть большую библиотеку фрагментов. Как правило, фрагменты состоят из более чем одного протона, что означает больше сигналов, на которые можно полагаться при анализе.
3. Условия приобретения ЯМР
- Внутренние общепринятые условия
- Спектрометр, оснащенный устройством смены образцов HT (автоматизация)
- Для высокопроизводительного скрининга используйте 96-луночные планшеты, которые можно измерить только с помощью устройства смены образцов HT. Устройство смены образцов HT также дает возможность закалки каждой стойки по отдельности.
- Для оптимального соотношения сигнал/шум используйте спектрометр с криогенным зондом, охлаждаемым гелием или азотом. Для автоматизации необходим модуль автоматической настройки и согласования (ATM).
- Наборы параметров и последовательности импульсов
ПРИМЕЧАНИЕ: Многие эксперименты ЯМР могут характеризовать события связывания. Идентификация попадания варьируется в зависимости от экспериментальной установки. Следующие эксперименты обычно используются в скрининговых кампаниях BMRZ. Тем не менее, изменения могут быть внесены в определяемые пользователем скрининговые кампании и в соответствии с пользовательскими спецификациями.- Если вы используете программное обеспечение TopSpin, включите набор параметров для экспериментов на основе лигандов: SCREEN_STD, SCREEN_T1R, SCREEN_T2, SCREEN_WLOGSY. Набор параметров включает в себя все необходимые параметры и последовательности импульсов: STD: stddiffesgp.3; Т1ρ: t1rho_esgp2d; Т2: cpmg_esgp2d; и waterLOGSY: ephogsygpno.2.
- Для всех перечисленных экспериментов используйте лепкувозбуждения 13 в качестве подавления воды. Для справки используйте 1D-скульптинг возбуждения (zgesgp). Количество сканирований зависит от чувствительности системы (напряженность магнитного поля и головки зонда), концентрации образца и выбора эксперимента. Рекомендация: 1D с NS = 64, T1ρ и T2 с NS = 128, STD с NS = 256 и waterLOGSY с NS = 384 или 512.
- Для скрининга 19 F используйте эксперименты 1D и T2: 1D: F19CPD (pp = zgig) для 19 F{1 H}-зондовой головки и F19(pp=zg) для 19F/1H-зондовой головки; SCREEN_19F_T2 (pp = cpmgigsp).
- Используйте ширину спектра 220 ppm и частоту возбуждения -140 ppm. Время эксперимента составляет от 1 до 5 часов (обеспечивает долгосрочную стабильность биомакромолекулы) в зависимости от аппаратного обеспечения и концентрации образца. Для T2 время CPMG должно чередоваться между 0 мс и 200 мс.
- Обработка
- Запишите эксперименты STD,T1ρ и T2 как псевдо 2D. Для обработки двух одиночных 1D-спектров IconNMR использует proc_std au-program с опцией relax или без нее. Первый вариант обеспечивает эталонное 1D и разность двух спектров. Второй вариант дает два отдельных спектра с коротким и длинным временем релаксации. waterLOGSY представляет собой одиночный 1D, который должен быть фазирован с отрицательным сигналом растворителя.
- Спектрометр, оснащенный устройством смены образцов HT (автоматизация)
- Пользовательские условия
- Адаптируйте любой из ранее упомянутых параметров к заданным пользователем условиям. Например, если белок, предоставленный пользователем, не стабилен при обычно используемой температуре, могут быть проведены эксперименты по оптимизации с изменяющейся температурой, концентрацией, буферными условиями и т.д.
4. Анализ данных
- Контроль качества библиотеки фрагментов (d6-DMSO/специфический буфер) и количественная оценка
- CMC-q
ПРИМЕЧАНИЕ: Контроль качества библиотек фрагментов имеет важное значение до начала кампаний по отбору. Кроме того, необходимо обеспечить долгосрочную стабильность библиотеки фрагментов для проведения нескольких скрининговых кампаний, поэтому необходимо проводить периодическую оценку качества библиотеки. Для этого для оценки качества и количества используется интегрированное программное обеспечение CMC-q и CMC-a от TopSpin. CMC-q и CMC-a - это программные модули в Topspin, которые обеспечивают беспрепятственный сбор и анализ, включая проверку структуры с использованием спектра 1H-ЯМР, полученного из небольших органических молекул 9.- Для обеспечения целостности подготовьте оценочные образцы с концентрацией фрагментов 1 мМ в d6-ДМСО. Подготовьте образцы в автоматическом режиме с помощью робота-пипетировщика, заполнив жидкий пробоотборник в ЯМР-пробирку диаметром 3 мм.
- Для оценки растворимости используйте образец, состоящий из соединения 1 мМ в буфере фосфата натрия 50 мМ при рН 7,4, хлорида натрия 150 мМ, 90% H 2 O / 10% D 2 O и 1 мМ натриевой соли3-(триметилсилил)пропионовой кислоты-2,2,3,3-d4 (TMSP-Na).
- Собирайте спектры ЯМР при 298 К или 293 К с помощью ЯМР-спектрометра с частотой 600 МГц, оснащенного криогенным зондом TCI с тройным резонансом 5 мм и устройством смены образцов HT, которое может обрабатывать 579 образцов одновременно.
- Для настройки программного обеспечения CMC-q следуйте инструкциям руководства пользователя, в котором реализовано создание пользователя IconNMR, активация FastLaneNMR и замена устройства смены образцов HT.
- Откалибруйте импульс 90° и сохраните его в таблице TopSpin.
- Поместите пластину скважины для 96 образцов в одно из 5 положений стойки в устройстве смены образцов HT.
- Чтобы загрузить файл SDF (файл структурных данных), который должен содержать предлагаемую химическую структуру, уникальный идентификатор и положение в устройстве смены образцов HT каждого образца в партии, перейдите в раздел «Обзор» в окне «Настройка CMC-q» и нажмите «Открыть» после выбора файла, который заканчивается на .sdf.
- В настройках CMC.q Batch Automation установите тип проверки, определяющий эксперимент, который будет измеряться, пользователя IconNMR и определите растворитель.
- Определите SDF-файлы для пути к SDF-файлу, идентификатора молекулы и положения образца.
- Начните приобретение, нажав « Пуск». Нажмите « Начать приобретение » еще раз. Настройку CMC-q также можно сохранить, нажав « Сохранить».
- Для подробного описания шагов настройки CMC-q следуйте инструкциям руководства пользователя от Bruker.
- КМЦ-а
- Для CMC-a используйте программный модуль в Topspin, который позволяет проводить анализ, включая проверку структуры, с использованием спектра 1H-ЯМР, полученного из небольших органических молекул9.
- CMC-q
- Конструкция смеси
ПРИМЕЧАНИЕ: Надлежащая конструкция смеси играет важную роль для скрининга с использованием ЯМР в качестве платформы. Большое количество фрагментов в смеси позволяет ускорить скрининг, но увеличивает риск ложноположительных и отрицательных результатов. Меньшее число снижает этот риск, но увеличивает время, необходимое для проведения скрининга. Как правило, при создании смесей следует избегать перекрытия сигналов. Используя внутреннюю библиотеку, этим можно пренебречь для скрининга 1H, поскольку библиотека была специально разработана, чтобы быть разнообразной и демонстрировать небольшое перекрытие сигналов, сохраняя при этом высокое химическое разнообразие. Это, в свою очередь, означает, что для создания 64 миксов не требуется никакой специальной процедуры проектирования.- Поскольку скрининг 19F основан на фрагментах внутренней библиотеки, содержащих фтор, а библиотека не была создана для уменьшения перекрытия сигналов для этих конкретных фрагментов, разработайте правильную смесь.
- Измерьте спектры одного соединения для всех фрагментов, содержащих 19F.
- Обратите внимание на информацию о химическом сдвиге каждого сигнала.
- Исходя из этой информации, выбирайте 20-21 фрагмент на смесь. Это, в свою очередь, дает 5 смесей, каждая из которых содержит 20-21 фрагмент без перекрытия сигнала, и позволяет проводить полуавтоматический анализ данных.
- Выполните идентификацию попадания в лиганд, наблюдаемое биомакромолекулярно-лигандное взаимодействие
ПРИМЕЧАНИЕ: Существуют разные определения попадания между процедурой скрининга 19F и 1H. Следующие идентификаторы попаданий были настроены нами и соответствуют определенным правилам. Предмет определения попадания очень субъективен и может отличаться от пользователя к пользователю. Тем не менее крайне важно, чтобы правила идентификации попаданий не менялись после их согласования для поддержания достоверности и достоверности.- 1H Экран
- Чтобы уверенно определять попадания, приобретают спектры 1D 1H, waterLOGSY и T2 релаксационные эксперименты как в наличии, так и в отсутствии мишени для идентификации связующих. Все три эксперимента могут показать событие связывания. Если CSP более 6 Гц виден в спектрах образца по сравнению с пустыми спектрами, это считается признаком попадания. То же самое происходит, если виден сильный положительный сигнал в waterLOGSY, а также снижение T2 более чем на 30% в спектрах образца. События связывания могут быть продемонстрированы во всех трех экспериментах при сравнении образца, содержащего спектры, с соответствующими пустыми спектрами. Однако события связывания могут быть не видны во всех трех экспериментах. Из-за этого было решено, что по крайней мере два из ранее описанных событий должны произойти, чтобы классифицировать фрагмент как связующее попадание.
- Используйте инструмент FBS в TopSpin, чтобы определить состояние фрагментов на связывающие, неоднозначные, неизвестные, агрегаты и несвязывающие.
- Когда закончите со смесью, одобрите ее в инструменте FBS.
- На вкладке «Сводка» в проекте FBS нажмите « Создать отчет о скрининге». Откроется окно, в котором создается файл .xlsx. Затем пользователь может выбрать между всеми лигандами, только связывающим лигандом, а не только связывающим лигандом, и неоднозначными лигандами, о которых будет сообщено в электронной таблице.
- 19 См.F Экран
- Чтобы провести различие между несвязующим, недельным связующим и сильным связующим, разделите коэффициент интегрирования между целевым измерением 200 мс и пустым измерением 200 мс на частное целевого измерения 0 мс и измерения пустого 0 мс:
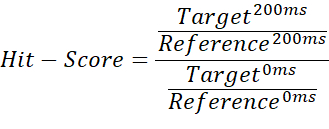
ПРИМЕЧАНИЕ: Это дает значения в диапазоне от 0 до ~ 1 (оценка попадания), что позволяет назначать пороговые значения для каждого состояния привязки. - Используйте среднее значение эталонного измерения 200 мс в качестве базового порогового значения, чтобы отметить случаи, когда оценка попадания превышает 1. Это может произойти, если импортированные интегралы содержат отрицательные значения или эталонное измерение выше целевого измерения. Оценка попадания ≤ 0,67 считается слабым попаданием, < 0,33 - сильным попаданием, а все, что > 0,67, - отсутствием попадания. Пример показан на рисунке 2.
- Чтобы провести различие между несвязующим, недельным связующим и сильным связующим, разделите коэффициент интегрирования между целевым измерением 200 мс и пустым измерением 200 мс на частное целевого измерения 0 мс и измерения пустого 0 мс:
- 1H Экран
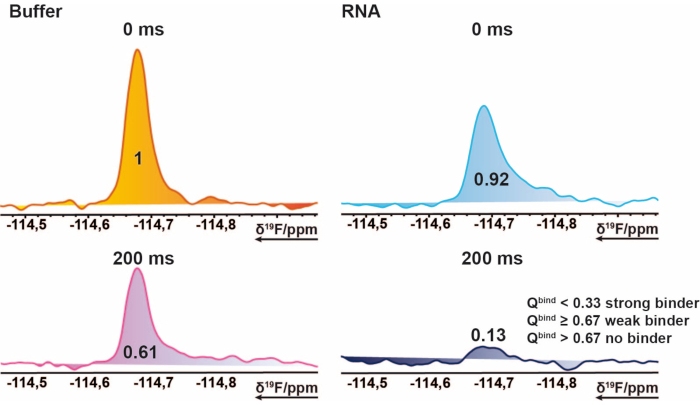
Рисунок 2: Идентификация попадания для скрининга 19F. Секция 19F ЯМР-СПЕКТРОВ CPMG примерного соединения. Это графическое изображение объясняет свойства связующего. 19 См.Спектры F-CPMG соединения, полученные из образцов смеси в присутствии и отсутствии РНК. Значения представляют собой нормированные интегральные значения соответствующего пика. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Анализ данных
- Подготовка данных для анализа
ПРИМЕЧАНИЕ: Важно, чтобы полученные данные не имели видимых недостатков. Это означает, что данные, в которых шимминг был проблематичным или подавление воды было недостаточным, не должны рассматриваться для анализа. Вместо этого рекомендуется снова записать данные и убедиться, что с образцом все в порядке (например, нет пузырьков воздуха), с температурой, мерцанием и подавлением воды. Корректность данных всегда можно оценить при сравнении сигналов ДМСО. - 1Скрининг H
- Для анализа данных скрининга за 1час используйте инструмент FBS (требуется дополнительная лицензия) в TopSpin 4.0.9.
- Следуйте инструкциям в руководстве по инструменту FBS, чтобы начать анализ данных. Следующие шаги обобщают процедуру, описанную в руководстве.
- Храните данные ЯМР BMRZ из кампаний скрининга таким образом, чтобы каждая отдельная просеивающая смесь имела свой собственный каталог, в котором подкаталог содержит различные эксперименты, измеренные на образце.
- Для использования инструмента FBS сохраните эталонные спектры, в которых все данные сохранены из образцов без биомолекулярной мишени, но со смесями, а также с одним соединением, измеренным в разных каталогах /nmr. Это важно, так как инструмент FBS запросит путь к каталогу каждого в отдельности.
ПРИМЕЧАНИЕ: Инструмент FBS распознает каталог как проект скрининга, если следующие наборы данных были сохранены в том же каталоге, где хранятся смеси просеивающей выборки (csv, XML-документы FragmentScreen и файл BAK). - При использовании TopSpin 4.0.9 создайте прямой путь к каталогу, содержащему полученные данные, так называемый DIR. Выберите каталог /nmr, в котором все смеси должны иметь отдельный каталог.
- Чтобы запустить инструмент FBS с распространённым образцом, перетащите проект символа FBS в середину окна TopSpin. В выбранном каталоге должен появиться символ проекта FBS, если ранее в него были скопированы указанные наборы данных.
- Окно Fragment Based Screening Options должно автоматически открыться при первой загрузке нового проекта FBS. В этом окне выберите файл для коктейля. Коктейльный файл представляет собой csv-файл, содержащий присвоение названия миксам, название каждого фрагмента и их разделение на миксы. Также определите папку спектров эталонных лигандов, в которой есть все измеренные спектры отдельных фрагментов. Наконец, определите ссылочную пустую папку эксперимента, которая обычно является папкой, содержащей наборы данных миксов без исследуемой цели.
- В разделе «Параметры скрининга на основе фрагментов» есть вкладка « Типы спектров », которая позволяет определить исследуемые спектры, а также цвет для отображения спектров. Установите Spectype в соответствии с предварительно обработанными данными. На вкладке «Макет дисплея » определите спектры, которые будут сравниваться друг с другом в соответствии с их типами спецификаций.
- Нажмите Ok, чтобы запустить проект FBS.
- При просмотре данных откроется отдельное окно, в котором будут собраны все коктейльные смеси и все лиганды каждой смеси в таблице. При двойном щелчке по ячейке откроются соответствующие наборы данных, сравнивающие, например, 1 спектр H 1DBlank с набором данных, содержащим цель.
- Перед назначением связующих убедитесь, что контрольные пики (ДМСО всех измерений, а также отдельные соединения) совпадают друг с другом и имеют одинаковый химический сдвиг. Если наблюдаются различия, исправьте их с помощью опции последовательной обработки от TopSpin.
- Параметр последовательной обработки находится на вкладке « Процесс » в разделе «Дополнительно». Он применяет изменения ко всем выбранным спектрам из набора данных. Таким образом, Spectypes могут быть легко назначены номерам экспериментов, и все спектры могут быть смещены одновременно, чтобы выровнять их с эталоном.
- 19 См.F Скрининг
- Для первого анализа смесей 19F создайте файл интеграции для каждой смеси. Чтобы определить регион интеграции, нажмите на функцию « Интеграция » на вкладке «Анализ ». Убедитесь, что для каждого фрагмента в смеси определена четкая область интегрирования для соответствующего 19F-singal.
- Используйте кнопку Сохранить/Экспортировать регионы интеграции, чтобы экспортировать файл интеграции для дальнейшего использования. Сохраните все использованные файлы интеграции в C:\Bruker\TopSpin4.0.9\exp\stan\nmr\lists\intrng или по соответствующему пути к каталогу установки TopSpin.
- Для данных 19F откройте набор данных с исследуемой целью или без нее.
- Чтобы загрузить интеграционный файл в текущий спектр, снова откройте вкладку Анализ , перейдите в раздел Интеграция и с помощью кнопки Чтение/Импорт регионов интеграции загрузите соответствующий интеграционный файл. Это загрузит все определенные области этого файла в текущий спектр.
- Сохраните и вернитесь, чтобы найти список всех интегрированных регионов на вкладке Интегралы . Скопируйте это в электронную таблицу или любой другой инструмент, используемый для дальнейшего анализа данных.
- Повторяйте эту процедуру для каждой смеси, с мишенью и без нее.
- Управление данными
- Для простоты использования и повышения производительности создайте единый рабочий процесс для дальнейшего анализа и хранения полученных данных. Для скрининга 1H и 19F используйте специально разработанную электронную таблицу для каждого из них.
ПРИМЕЧАНИЕ: Для скрининга 1Н это использовалось исключительно для управления данными и для обобщения каждой цели, в то время как для скрининга 19F использовалось объясненное в главе 4.3 коэффициент для автоматической маркировки каждого фрагмента как попадание/отсутствие попадания после того, как в него были скопированы интегральные данные. Это снижает риск человеческой ошибки во время анализа, предполагая, что файл был настроен правильно, и упрощает обмен информацией, поскольку вся важная информация собирается в одном месте в файле, который может быть открыт практически любым человеком без необходимости дополнительных программ для первоначального взгляда на данные.
- Для простоты использования и повышения производительности создайте единый рабочий процесс для дальнейшего анализа и хранения полученных данных. Для скрининга 1H и 19F используйте специально разработанную электронную таблицу для каждого из них.
- Подготовка данных для анализа
Результаты
Контроль качества библиотеки фрагментов
Фрагменты из собственной библиотеки поставлялись в виде исходных растворов по 50 мМ в 90% d6-DMSO и 10% D 2 O(10% D2O обеспечивает минимизацию деградации соединения из-за повторяющихся циклов замораживания-оттаивания14). Образцы отдельных соединений состояли из 1 мМ лиганда в 50 мМ фосфатном буфере (25 мМ KPi, рН 6,2 + 50 мМ KCl + 5 мМ MgCl 2), рН 6,0 в 90% H 2 O / 9% D2O / 1% d6-DMSO. 1Эксперименты H-ЯМР фрагментов из библиотеки iNEXT измерялись на ЯМР-спектрометре 500/600 МГц. Эти данные были в дальнейшем использованы для идентификации отдельных соединений в кампаниях скрининга 1H с использованием программного обеспечения CMC-q, которое позволяет пользователю полностью получать спектры в автоматическом режиме, а также для анализа CMC-a оценивалось качество (растворимость и целостность) фрагментов. Результаты автоматизированного анализа с помощью CMC-a показаны в виде графического вывода, аналогичного тому, что показано на рисунке 3. На графическом выходе показано представление 96-луночной пластины. Красный цветной круг означает, что этот фрагмент показывает несоответствие структуры или концентрации. Лунки зеленого цвета указывают на то, что фрагмент является последовательным.
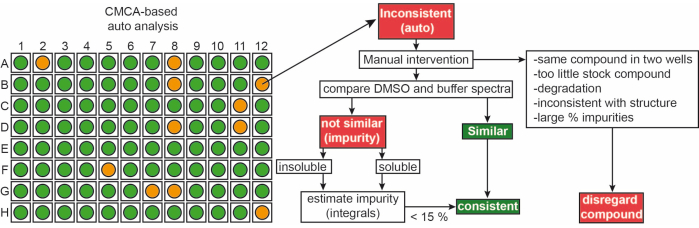
Рисунок 3: Контроль качества библиотеки фрагментов. Схематическое изображение автоматизированного вывода на основе CMC-a. Оцениваются свойства фрагментов, такие как концентрация и структурная целостность. Зеленый цвет означает последовательность, оранжевый в данном случае означает непоследовательность. Несогласованные фрагменты редактируются вручную в соответствии с показанным рабочим процессом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Приблизительно 65% и 35% фрагментов были классифицированы как последовательные и несогласованные, соответственно, как в ДМСО, так и в буфере. Кроме того, 30% несогласованных классифицированных лигандов стали последовательными после тщательной ручной проверки спектров9.
19F Конструкция смеси
103 фрагмента, содержащих одну или несколько фторсодержащих групп из собственной библиотеки, были разделены на 5 смесей (A, B, C, D, E). Каждая смесь состоит из 20-21 фрагмента. В этом случае смеси должны были быть тщательно спроектированы, чтобы избежать перекрытия сигналов. 19 См.Эксперименты по поперечной релаксации F были измерены для каждой смеси, в которой применяются последовательности импульсов CPMG. Эти эксперименты могут быть изменены путем изменения задержек релаксации. Химический сдвиг смесей A-E 19F можно увидеть на рисунке 4.
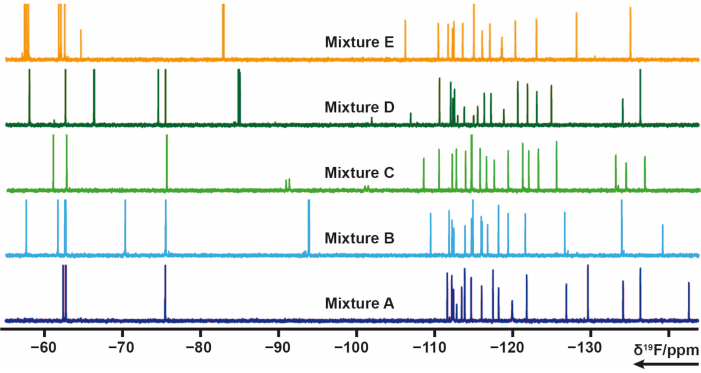
Рисунок 4: 19спектров F 1D-ЯМР образцов смесей из собственной библиотеки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Пробоподготовка
Пробоподготовка в процедуре скрининга 19F проводилась либо вручную, либо с помощью автоматического пипетирования с использованием робота-пипетки. Фрагменты в каждой смеси имели концентрацию 2,5 мМ в 90% d6-ДМСО и 10%D2O. Конечный объем просеиваемого образца составлял 170 мкл с 5% D2O в качестве запирающего агента. Каждую смесь пипетировали два раза, один в растворе, содержащем буфер (без мишени), и один в мишень, содержащую буферный раствор. Соотношение мишени и фрагмента было установлено на 1:1, в результате чего конечная концентрация мишени/лиганда составила 50 мкМ. Кроме того, контрольными образцами являются биомолекула-мишень в просеивающем буфере без смеси для обеспечения целостности мишени, а также контрольный образец только с буфером иD2O для обеспечения качества буфера.
Данные ЯМР-скрининга 19 F-1D и 19F-CPMG-T2 были измерены, как описано в разделе 3.1. Например, в случае РНК эхо-последовательность прыжка и возврата (pp = zggpjrse,15) была получена для единственного целевого образца в буфере.
Анализ данных
Процедура скрининга 19F была применена к рибопереключателю ТЭС thiM из E. coli и протеинтирозинкиназе (PtkA) из M. tuberculosis, а также к нескольким другим мишеням16. Библиотека скрининга 19F содержит 103 фрагмента, которые разделены на 5 смесей, помеченных от смеси A до E. Подготовка просеивающих образцов может быть выполнена вручную без использования робота-пипетки. Раствор, содержащий 40 мкМ тиМ РНК (буферные условия), смешивали с 3,2 мкл из смесей. Далее были подготовлены контрольные образцы, состоящие только из буфера, буфера с 5% ДМСО (предварительно обеспечивающего стабильность биомакромолекулы в присутствии желаемой концентрации ДМСО) и буфера с РНК. Эти 13 скрининговых образцов были подготовлены и перенесены в ЯМР-пробирки диаметром 3 мм. Штрих-коды ЯМР-пробирок сканируются, и каждая смесь в наличии и отсутствии РНК, а также контрольные образцы были измерены в соответствии с вышеупомянутыми экспериментами ЯМР 19F, выполненными при 298 К. Скрининг thiM РНК по внутренней библиотеке проводили путем проведения измерений T2 с CPMG 0 мс и 200 мс для каждого отдельного образца. Надлежащий шимминг и подавление воды контролировались после завершения измерений путем сравнения всех пиков ДМСО с точки зрения уширения линии и потери интенсивности дополнительно измеренных экспериментов 1 H 1Dдля всех образцов. Обработка полученных релаксационных спектров CPMG T2 19F проводилась с использованием заранее подготовленного и автоматизированного макроса в TopSpin соответственно. Анализ данных проводился в соответствии с инструкциями в разделе протокола. Интегральные данные, полученные от TopSpin (следуя инструкциям в протоколе), можно быстро и легко оценить с помощью готовой электронной таблицы или любой аналогичной программы, установив правильные условия и пороговые значения. Как описано ранее, пороговые значения полезны при определении связующего, слабого связующего или несвязующего. На рисунке 5 показаны типичные результаты спектров CPMG РНК thiM и PtkA соответственно. В некоторых случаях потребовалась дальнейшая экспертная доработка.
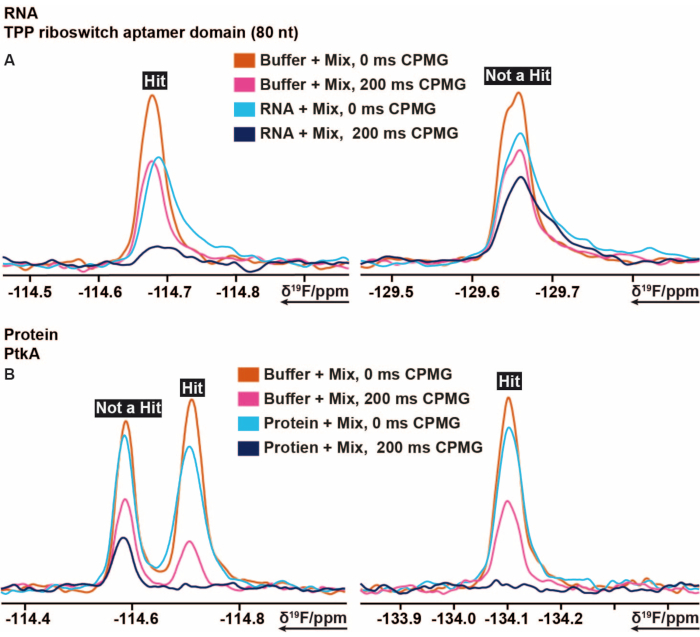
Рисунок 5: Вырезано из спектров ЯМР19 F CPMG, показывающих изменения интенсивности, полученные при различных временах задержки экспериментов на основе CPMG . (A) Представление связующего (хита) и несвязывающего вещества в скрининге на основе фрагментов 19F, проведенном на рибопереключателе ТТП РНК из E. coli. (B) Представление связующего и несвязующего вещества при скрининге на основе фрагментов 19F, проведенном на PtkA от M. tuberculosis. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1час скрининга
Конструкция смеси
Используемая собственная библиотека настолько разнообразна, что для целей просеивания в течение 1часа не было выполнено проектирование смеси. Это означает, что 64 смеси были приготовлены путем случайного выбора 12 для смешивания в одной смеси.
Подготовка образцов
Для скрининга образцовойРНК SARS-CoV-2 в течение 1 часа для подготовки образцов было выполнено автоматизированное пипетирование с использованием робота-пипетки. Фрагменты в каждой смеси имели концентрацию 4,2 мМ в 90% d6-ДМСО и 10% D2O. Конечный объем просеиваемого образца составлял 200 мкл с 5% D2O в качестве запирающего агента. 64 образца, каждый из которых содержал различную смесь в 25 мМ KPi, 50 мМ KCl при рН 6,2, были пипетированы без целевой РНК. Соответственно, 64 образца были пипетированы с целевой РНК, каждый из которых содержал свою смесь. Соотношение РНК:лиганд было установлено на 1:20, в результате чего концентрация РНК составила 10 мкМ, а концентрация лиганда - 200 мкМ.
Анализ данных
Для анализа 1H использовался инструмент FBS в TopSpin. Чтобы определить, является ли фрагмент ударом, были проведены эксперименты по релаксации 1D, waterLOGSY, T2 . Для релаксацииТ2 снижение интенсивности более чем на 30% считалось попаданием, в то время как для химического сдвига сдвиг более 6 Гц был отсечкой. waterLOGSY должен был показать значительное изменение сигнала (в данном случае от отрицательного к положительному). Если любые два из этих трех критериев были положительными, фрагмент засчитывался как попадание. Два примера этого можно увидеть на рисунке 6.
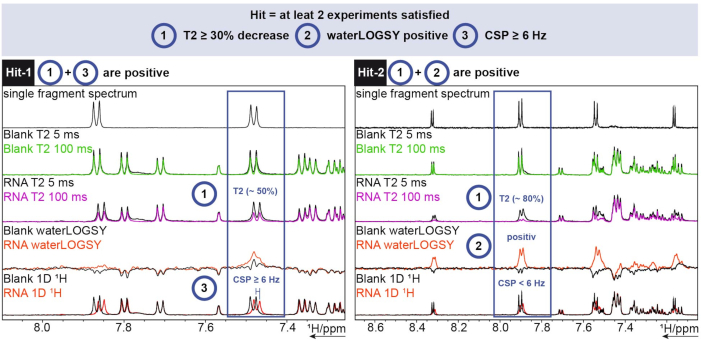
Рисунок 6: Скрининг за 1час, проведенный на образцовой РНК SARS-CoV-2 с критериями определения попадания. Получение трех различных экспериментов (1 H T2 CPMG (5/100 мс), waterLOGSY, и 1D 1H). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Hit-1 показывает снижение T2 на ~ 50% и CSP ≥ 6 Гц. waterLOGSY не показывает достаточно значительного изменения сигнала, чтобы его можно было считать положительным. Поскольку два из трех экспериментов положительные, этот фрагмент засчитывается как попадание. Для Hit-2 T2 показывает снижение интенсивности сигнала на ~ 80%, и для waterLOGSY, можно увидеть явное изменение сигнала. CSP в этом случае недостаточно, но, поскольку два предыдущих критерия являются положительными, он все равно считается хитом.
Обсуждение
Универсальность скрининга фрагментов/лекарств на основе ЯМР. BMRZ успешно внедрил самые современные автоматизированные приборы ЯМР, а также эксперименты по ЗППП-ЯМР, waterLOGSY и релаксации для идентификации фрагментов в широком диапазоне аффинного режима для открытия лекарств. Установленное оборудование включает в себя высокопроизводительный робот для подготовки образцов и высокопроизводительный блок хранения, смены и сбора данных, связанный со спектрометром 600 МГц. Недавно приобретенный криогенный зонд для 1 H, 19 F, 13 C и 15N обеспечивает требуемую чувствительность для предлагаемых измерений и позволяет разъединять 1 H (1) во время обнаружения 19F. Этот датчик подключен к консоли ЯМР последнего поколения, которая дает возможность использовать передовые программные инструменты Bruker, включая CMC-q, CMC-assist, CMC-se и FBS (входит в состав TopSpin). Инструмент скрининга на основе фрагментов (FBS) включен в последнюю версию TopSpin и помогает анализировать высокопроизводительные данные, включающие эксперименты STD, waterLOGSY, T2 / T1 r-релаксации. Жидкостный пробоотборник 1D 1H может быть заполнен в ЯМР-пробирки автоматическим способом с помощью робота для наполнения проб. Как правило, блок из 96 трубок (3 мм) заполняется примерно за два часа. 96-луночные пластинчатые стойки непосредственно расположены в устройстве смены образцов HT, которое считывает штрих-код блока и назначает ЯМР-трубки для экспериментов, контролируемых программным обеспечением автоматизации (IconNMR). Пять 96-луночных пластинчатых стеллажей могут храниться и программироваться в устройстве смены образцов HT одновременно. Температуру каждой из отдельных стоек можно контролировать и регулировать отдельно. Кроме того, каждый отдельный образец может быть предварительно подготовлен (предварительный нагрев и сушка в пробирке для удаления конденсированной влаги) до желаемой температуры перед измерением.
Пригодность для широкого спектра применений. Одним из широких применений этого автоматизированного скрининга на основе ЯМР является идентификация и разработка новых лигандов, связывающихся с биомакромолекулярной мишенью (ДНК / РНК / белки). Эти лиганды могут включать ортостерические и аллостерические ингибиторы, которые обычно связываются нековалентно. Кроме того, FBDD с помощью ЯМР обычно используется в качестве первого шага для выбора перспективных соединений, требования, которые должны быть выполнены, - это наличие биомолекулярной мишени в достаточных количествах. Эта цель подразделяется на две основные задачи.
Первая задача состоит в том, чтобы разработать и охарактеризовать собственную библиотеку фрагментов по следующим причинам: начальный и периодический контроль качества, характеристика и количественная оценка более 1000 фрагментов; определение растворимости фрагментов в буферах, оптимизированных для каждой мишени, в частности для белковых мишеней; и создание нескольких библиотек для размещения различных каркасов и распространения на другие классы макромолекул. Вторая задача состоит в том, чтобы интегрировать рабочие процессы для разработки лекарств на основе фрагментов (FBDD) с помощью ЯМР с использованием: автоматизированного скрининга под наблюдением 1D-лиганда (1H и 19F); автоматизированные замещающие анализы (конкурентные эксперименты с (природным) лигандом) для дифференциации ортостерического и аллостерического связывания; автоматизированные вторичные скрининги с несколькими фрагментами; автоматизированный скрининг 2D-белков и вторичный скрининг набора производных вокруг начального попадания с использованием библиотеки EU-OPENSCREEN или любой другой библиотеки; и повторное профилирование скрининга библиотеки FDA в соответствии с выбранными целевыми показателями.
Кроме того, метаботипирование различных клеточных линий (связанных с заболеванием) может быть проведено для того, чтобы разгадать регуляторные механизмы, которые связывают контроль клеточного цикла и метаболизм. Кроме того, существует функциональная характеристика элементов регуляции РНК/ДНК/белка in vivo и in vitro для оптимизации конструкции / оптимизации домена (оптимизация стабильности для структурных исследований (скрининг буфера, pH, температуры и соли) и расширение скрининга фрагментов на основе ЯМР на мембранные белки и внутренне неупорядоченные белки, которые, как правило, недоступны для других методов.
Ограничения. Использование библиотек фрагментов 19F и 1H имеет свои плюсы и минусы, некоторые из которых будут упомянуты ниже. Самым большим преимуществом измерений 19F по сравнению с 1H является скорость как фактического времени измерения, так и последующего анализа, поскольку смеси содержат почти вдвое больше фрагментов и необходимо проводить меньше экспериментов. Последующий анализ также проще для скрининга 19F, поскольку нет помех от буферов и, кроме того, предлагается более широкий диапазон химического сдвига практически без перекрытия сигналов для оптимально спроектированной смеси фрагментов. Сами спектры значительно упрощены, обычно имеют только один или два сигнала на фрагмент, в зависимости от количества атомов фтора. Таким образом, анализ этих спектров может быть автоматизирован, что опять же сокращает время. Это происходит за счет химического разнообразия, по крайней мере, для библиотеки, используемой в этом исследовании. Поскольку только ~ 13% библиотеки содержит 19 F, но, естественно, все они могут быть использованы при скрининге 1H, разнообразие фрагментов скрининга 19F будет ниже. Это можно было бы обойти, используя специально разработанные библиотеки 19F с большим количеством фрагментов и большим химическим разнообразием. Еще одним недостатком экранирования 19F является малое количество сигналов на фрагмент. Фрагменты обычно состоят из более чем одного атома водорода. Таким образом, экспериментыпо скринингу 1 H могут полагаться на разные сигналы для одного и того же фрагмента для обнаружения связывания. Это дает более высокую степень достоверности при идентификации попаданий для скрининга 1H, тогда как скрининг 19F должен полагаться на один или два сигнала, подаваемых на фрагмент.
Представлен подробный отчет о современных автоматизированных приборах скрининга фрагментов на основе ЯМР, программном обеспечении и методах и протоколах их анализа. Установленное оборудование включает в себя высокопроизводительного робота-пробоподготовки и высокопроизводительный блок хранения, смены и сбора данных, связанный со спектрометром 600 МГц. Недавно установленная криогенная зондовая головка для 1 H, 19 F, 13C и 15 N обеспечивает требуемую чувствительность для предлагаемых измерений и позволяет развязывать 1H во время обнаружения 19F. Кроме того, последнее поколение консоли ЯМР предлагает возможность использовать передовое аналитическое программное обеспечение для облегчения сбора данных и анализа на лету. Рассмотренная выше технология, рабочие процессы и описанные протоколы должны способствовать значительному успеху пользователей, использующих FBS с помощью ЯМР.
Раскрытие информации
Никакой.
Благодарности
Эта работа была поддержана iNEXT-Discovery, проект No 871037, финансируемый программой Horizon 2020 Европейской комиссии.
Материалы
| Name | Company | Catalog Number | Comments |
| Bruker Avance III HD | Bruker | 600 MHz NMR Spectrometer | |
| Matrix Clear Polypropylene 2D Barcoded Open-Top Storage Tubes | 3731-11 0.75ML V-BOTTOM TUBE/LATCH RACK | ThermoFisher Scientific | Barcoded Tubes |
| Matrix SepraSeal und DuraSeal& | 4463 Cap Mat, SeptraSeal 10/CS | ThermoFisher Scientific | |
| SampleJet | Bruker | HT Sample Changer | |
| SamplePro Tube | Bruker | Pipetting Robot |
Ссылки
- Yanamala, N., et al. NMR-Based Screening of Membrane Protein Ligands. Chemical Biology & Drug Design. 75, 237-256 (2010).
- Souers, A. J., et al. ABT-199, a potent and selective BCL-2 inhibitor, achieves antitumor activity while sparing platelets. Nature Medicine. 19, 202-208 (2013).
- Su, M. C., Te Chang, C., Chu, C. H., Tsai, C. H., Chang, K. Y. An atypical RNA pseudoknot stimulator and an upstream attenuation signal for -1 ribosomal frameshifting of SARS coronavirus. Nucleic Acids Research. 33, 4265-4275 (2005).
- Perera, T. P. S., et al. Discovery & pharmacological characterization of JNJ-42756493 (Erdafitinib), a functionally selective small-molecule FGFR family inhibitor. Molecular Cancer Therapeutics. 16, 1010-1020 (2017).
- Zhang, C., et al. Design and pharmacology of a highly specific dual FMS and KIT kinase inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 110, 5689-5694 (2013).
- Lipinski, C. A., Lombardo, F., Dominy, B. W., Feeney, P. J. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Advanced Drug Delivery Reviews. 23, 3-25 (1997).
- Congreve, M., Carr, R., Murray, C., Jhoti, H. A 'Rule of Three' for fragment-based lead discovery. Drug Discovery Today. 8, 876-877 (2003).
- Chávez-Hernández, A. L., Sánchez-Cruz, N., Medina-Franco, J. L. A Fragment Library of Natural Products and its Comparative Chemoinformatic Characterization. Molecular Informatics. 39, 2000050 (2020).
- Sreeramulu, S., et al. NMR quality control of fragment libraries for screening. Journal of Biomolecular NMR. , 00327-00329 (2020).
- Gao, J., et al. Automated NMR Fragment Based Screening Identified a Novel Interface Blocker to the LARG/RhoA Complex. PLoS One. 9, 88098 (2014).
- Peng, C., et al. Fast and Efficient Fragment-Based Lead Generation by Fully Automated Processing and Analysis of Ligand-Observed NMR Binding Data. Journal of Medicinal Chemistry. 59, 3303-3310 (2016).
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7, 2322-2330 (2016).
- Hwang, T. L., Shaka, A. J. Water Suppression That Works. Excitation Sculpting Using Arbitrary Wave-Forms and Pulsed-Field Gradients. Journal of Magnetic Resonance, Series A. 112, 275-279 (1995).
- Gossert, A. D., Jahnke, W. NMR in drug discovery: A practical guide to identification and validation of ligands interacting with biological macromolecules. Progress in Nuclear Magnetic Resonance Spectroscopy. 97, 82-125 (2016).
- Sklenar, V., Bax, A. A new water suppression technique for generating pure-phase spectra with equal excitation over a wide bandwidth. Journal of Magnetic Resonance. 75, 378-383 (1987).
- Binas, O., et al. 19F NMR-Based Fragment Screening for 14 Different Biologically Active RNAs and 10 DNA and Protein Counter-Screens. ChemBioChem. , (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены