Method Article
Естественный киллер (NK) и метод расширения клеток CAR-NK с использованием мембранно-связанной IL-21-модифицированной В-клеточной линии
В этой статье
Резюме
Здесь мы представляем метод расширения естественного киллера периферической крови (PBNK), NK-клеток из тканей печени и химерных антигенных рецепторов (CAR)-NK-клеток, полученных из мононуклеарных клеток периферической крови (PBMCs) или пуповинной крови (CB). Этот протокол демонстрирует расширение NK и CAR-NK клеток с использованием питающих ячеек 221-mIL-21 в дополнение к оптимизированной чистоте расширенных NK-клеток.
Аннотация
Терапия иммунными клетками, модифицированная рецептором химерного антигена (CAR), стала новым методом лечения рака и инфекционных заболеваний. Иммунотерапия на основе NK, особенно CAR-NK-клетки, является одной из наиболее перспективных «готовых» разработок без тяжелой опасной для жизни токсичности. Тем не менее, узким местом для разработки успешной терапии CAR-NK является достижение достаточного количества неисчерпывающих, долгоживущих, «готовых» CAR-NK клеток от третьей стороны. Здесь мы разработали новый метод расширения CAR-NK с использованием трансформированной вирусом Эпштейна-Барр (EBV) В-клеточной линии, экспрессирующей генетически модифицированную мембранную форму интерлейкина-21 (IL-21). В этом протоколе предусмотрены пошаговые процедуры по расширению NK и CAR-NK клеток из пуповинной крови и периферической крови, а также твердых тканей органов. Эта работа значительно усилит клиническую разработку иммунотерапии CAR-NK.
Введение
Естественные клетки-киллеры (NK) являются важным подмножеством лимфоцитов, которые экспрессируют CD56 и не экспрессируют маркер Т-клеток, CD3 1,2. Обычные NK-клетки классифицируются как врожденные иммунные клетки, ответственные за иммунонадзор вирусно инфицированных клеток и раковых клеток. В отличие от Т-клеток, NK-клетки распознают инфицированные или злокачественные клетки с помощью CD16 или других активирующих рецепторов и не требуют образования комплекса между антигенными пептидами и основным комплексом гистосовместимости (MHC) класса I молекул 3,4. Недавние клинические исследования с использованием рецепторов химерного антигена (CAR)-NK-клеток для лечения рецидивирующих или рефрактерных CD19-положительных раковых заболеваний (неходжкинская лимфома или хронический лимфоцитарный лейкоз [CLL]) показали выдающиеся преимущества безопасности CAR-NK-клеток5. Например, инфузия клеток CAR-NK связана с минимальным или незначительным трансплантатом по сравнению с болезнью хозяина (GVHD), нейротоксичностью, кардиотоксичностью и синдромом высвобождения цитокинов (CRS)6,7,8,9,10. Однако традиционные методы расширения NK-клеток человека показали исчерпывающие фенотипы с сильным братоубийственным уничтожением и нехваткой теломер, что представляет собой серьезную проблему в получении достаточного количества функциональных NK-клеток для приемной иммунотерапии11.
Для преодоления этих проблем был разработан метод расширения первичных NK-клеток непосредственно из нефракционированных мононуклеарных клеток периферической крови (PBMCs) или пуповинной крови (CB) с использованием облученной и генетически модифицированной клеточной линии 721.221 (далее 221), линии В-лимфобластоидных клеток человека с низкой экспрессией молекул MHC класса I3. Предыдущие исследования показали важность IL-21 в расширении NK-клеток; поэтому генетически модифицированный мембранно-связанный IL-21, экспрессирующий версию клеточной линии 721.221 (начиная с настоящего времени, 221-mIL-21), был разработан 11,12,13,14,15. Результаты показали, что 221-mIL-21 питательно-клеточные расширенные первичные NK-клетки были расширены в среднем до >40 000 раз с персистирующей высокой чистотой NK-клеток в течение примерно 2-3 недель. Дополнительную информацию о применении этого протокола можно найти в Yang et al.16.
Этот протокол направлен на демонстрацию пошаговой процедуры нового расширения PBNK, CBNK, тканевых NK и CAR-NK клеток ex vivo.
протокол
Ткани человека и работа, связанная с кровью, в этом протоколе соответствует руководящим принципам Совета по институциональному обзору Университета Рутгерса (IRB).
1. Расширение NK-клеток из тканей печени (день 0), как показано на рисунке 1.
ПРИМЕЧАНИЕ: Начальное количество клеток и жизнеспособность сильно коррелируют со временем с момента удаления органа и начальным количеством образца ткани. Однако, если ткани поместить в 30 мл сбалансированного соляного раствора Хэнка (HBSS) и хранить на льду или в холодильнике при 4 °C в течение ночи, NK-клетки все еще могут быть расширены с высокой чистотой и жизнеспособностью до 24 ч спустя.
- Идентификация жизнеспособных участков тканей для получения лимфоцитов из тканей и срезов с помощью стерильного хирургического оборудования.
- Поместите ткани в 30 мл HBSS (без кальция или магния) и держите на льду до готовности к выделению.
- Измельчите ткань на кубики <0,5 см с помощью стерильных бритвенных лезвий или ножниц и щипцов внутри шкафа для биобезопасности.
- Приготовьте 1x раствор коллагеназы IV (1 мг/мл), разбавив 10x бульон в HBSS (10x Collagenase IV: 10 мг/мл или ~200 Ед/мл).
- Поместите измельченные кусочки ткани в тканевые диссоциаторные трубки. Заполните пробирки не более чем 4 г ткани и погрузите кусочки ткани в ~10 мл 1x коллагеназы IV.
ПРИМЕЧАНИЕ: Использование ДНКазы I не рекомендуется, так как это может немного снизить жизнеспособность и выход NK. Пожалуйста, обратитесь к Таблице материалов для конкретных используемых тканевых диссоциаторных трубок. - Поместите трубки тканевого диссоциатора в тканевой диссоциатор и смешайте при 37 °C, чтобы тщательно измельчить ткань.
ПРИМЕЧАНИЕ: Для ткани печени это может занять более 30 минут. Для более рыхлой ткани может быть достаточно около 15 минут. Пожалуйста, обратитесь к Таблице материалов для конкретных тканевых диссоциаторных трубок и используемого тканевого диссоциатора. - Удалите тканевые диссоциаторные трубки и тритурируйте через ситечко нейлоновых клеток 40 мкм, используя заднюю часть шприца объемом 5 мл. Соберите элюент и выбросьте крупные непереваренные фрагменты.
- Открутите элюент при 400 х г в течение 5 мин при комнатной температуре. Аспирировать супернатанта.
- Повторное суспендирование клеточных гранул в 30% покрытом поливинилпирролидоном (PVP) кремнеземом для удаления жировых клеток, которые в противном случае загрязнят конечную фракцию лимфоцитов.
- Чтобы приготовить 1 кремнезем с PVP-покрытием, используйте разбавление кремнезема с PVP-покрытием 9:1 в 10x PBS.
ПРИМЕЧАНИЕ: Обратитесь к Таблице материалов для конкретного используемого кремнезема с PVP-покрытием. - Для получения 30% кремнезема с PVP-покрытием разбавьте 1 кремнезем с PVP-покрытием PBS/HBSS.
- Чтобы приготовить 1 кремнезем с PVP-покрытием, используйте разбавление кремнезема с PVP-покрытием 9:1 в 10x PBS.
- Открутите ячейку гранулы при 400 х г в течение 5 мин при комнатной температуре. Аспирировать супернатанта.
- Повторно суспендируют гранулу ячейки в 9 мл среды R-10.
ПРИМЕЧАНИЕ: См. Таблицу материалов для состава сред R-10 - Осторожно нанесите клеточную суспензию на 4 мл Ficoll или среды разделения лимфоцитов, чтобы отделить лимфоциты от эритроцитов и полиморфноядерных клеток.
- Отделите слои центрифугированием при 400 х g в течение 23 мин при комнатной температуре с выключенным ускорением и торможением или при самой низкой настройке. Тщательно декантируйте верхний средний слой и собирайте межфазные, содержащие инфильтрирующие ткань лимфоциты.
- Промыть клетки 10 мл среды и приступить к подсчету клеток, проточной цитометрии, аликотированию и замораживанию клеток или первичному протоколу расширения NK.
2. Первичное расширение NK-клеток из НБМК (или CB или тканей органов) (День 0), как показано на рисунке 2.
- Разморозьте замороженный PBMC и замороженные, облученные питательные клетки на водяной бане с температурой 37 °C.
- Промыть PBMC и 100 гамма-облученных (Gy-облученных) 221-mIL-21 клеток центрифугированием при 400 х г в течение 5 мин с 10 мл среды R-10 отдельно.
- Сохраните 1 x 106 клеток PBMC для проточной цитометрии.
ПРИМЕЧАНИЕ: Начальная чистота NK-ячейки является важным фактором при расчете скорости расширения NK-ячейки. - Повторное суспендирование клеток в 1 мл среды R-10. Подсчитайте ячейки с помощью Trypan Blue.
- Смешайте 5x 106 клеток PBMC с 10 x 106 ячейками 100 Gy-облученными 221-mIL-21 ячейками в специальной 6-луночной пластине (см. Таблицу материалов).
- Добавить 30 мл среды R-10, дополненной человеческим IL-2 (200 ЕД/мл) и человеческим IL-15 (5 нг/мл) (см. Таблицу материалов).
- Инкубируйте специальную плиту из 6 скважин при 37 °C с 5% CO2.
- Замените среду средой R-10, дополненной человеческим IL-2 (200 Ед / мл) и человеческим IL-15 (5 нг / мл) для поддержания NK-клеток каждые 3-4 дня.
ПРИМЕЧАНИЕ: Поддерживайте менее 20 x 106 ячеек на лунку для дальнейшего расширения при каждом изменении среды. Для лучшей жизнеспособности убедитесь, что общее количество клеток в каждой лунке не превышает 100 х 106 клеток. - Записывайте общее количество клеток, жизнеспособность и выполняйте проточную цитометрию каждые 3-4 дня, чтобы рассчитать скорость расширения NK-клеток.
3. Прикрепление клеток 293T (День 2), как показано на рисунке 2.
- Разделение 1,8 x 106 293T клеток в 11 мл среды D-10 на обработанную пластину 100 мм.
ПРИМЕЧАНИЕ: См. Таблицу материалов для состава сред Д-10 - Инкубировать клетки 293T при 37 °C с 5% CO2.
4. Ретровирусная трансфекция (День 3)
- В пробирке объемом 1,7 мл смешайте 470 мкл восстановленной сывороточной среды с 30 мкл трансфекционного реагента.
ПРИМЕЧАНИЕ: Обратитесь к Таблице материалов для конкретных восстановленных сывороточных сред и трансфекционных реагентов, используемых. - В отдельной пробирке объемом 1,7 мл добавьте 2,5 мкг плазмиды pRDF, 3,75 мкг плазмиды Pegpam3 и 2,5 мкг конструкции CAR в векторе SFG в восстановленную сывороточную среду, чтобы конечный объем составлял 500 мкл.
- Смешайте растворы на шагах 4.1 и 4.2 по каплям.
- Инкубировать пробирку при комнатной температуре в течение 15 мин.
- Добавьте 1 мл смеси со стадии 4,4 до 293T клеточной пластины на 1-й день по каплям.
- Инкубировать пластину (пластины) при 37 °C с 5% CO2 в течение 48-72 ч.
5. Ретронектиновое покрытие пластин (День 3)
- Разбавить белок ретронектина фосфатным буферизованным физиологическим раствором (PBS) до конечной концентрации 50-100 мкг/мл.
- Добавьте 500 мкл разбавленного ретронектина в каждую скважину необработанной плиты из 24 скважин (5 скважин на конструкцию CAR). Запечатайте пластину с помощью парапленки и инкубируйте пластину при 4 °C в течение ночи.
6. Трансдукция (День 4)
- Центрифугировать ретронектиновую пластину при 2103 х г в течение 30 мин при 4 °C. Выбросьте супернатант.
- Заблокируйте каждую скважину 24-луночной плиты 1 мл среды R-10.
- Инкубировать пластину при 37 °C с 5% CO2 в течение 1 ч.
- Предварительно нагрейте центрифугу до 32 °C, пока ретронектиновая пластина блокируется.
- Соберите супернатант ретровируса, фильтруя трансфектированные клетки 293T с помощью фильтра 0,45 мкм.
- Aliquot 2 мл фильтрованного супернатанта ретровируса в каждую лунку.
- Центрифугировать 24-луночную пластину при 2103 х г в течение 2 ч при 32 °C.
- Во время пластинчатого центрифугирования соберите расширенные ячейки PBNK с дня 0 и подсчитайте клетки с помощью Trypan Blue.
ПРИМЕЧАНИЕ: Продолжайте расширять ячейки PBNK путем добавления среды R-10, дополненной IL-2 (200 ЕД/мл) и IL-15 (5 нг/мл). - Разбавляйте расширенные ячейки ПБНК средой R-10, дополненной IL-2 (200 Ед/мл) и IL-15 (5 нг/мл) до 2,5 х 105-5 х 105 клеток/мл (0,5 х 106-1 х 106 ячеек на лунку).
ПРИМЕЧАНИЕ: Запишите общее количество клеток, жизнеспособность и сохраните 5 x 105 расширенных PBNK клеток для проточной цитометрии, поскольку эти значения важны для определения скорости расширения NK-клеток. - После центрифугирования частично аспирируют супернатант ретровируса из каждой лунки.
ПРИМЕЧАНИЕ: Не следует полностью аспирировать, т.е. оставлять примерно 100 мкл ретровирусного супернатанта на лунку, так как это снизит эффективность трансдукции. - Аликвота 2 мл разбавленных расширенных ПБНК клеток от стадии 6,8 до каждой лунки.
- Центрифугировать пластину при 600 х г в течение 10 мин при 32 °C. Инкубировать пластину при 37 °C с 5% CO2 в течение 48-72 ч.
ПРИМЕЧАНИЕ: Не парафильмируйте пластину.
7. Сбор клеток CAR-NK (день 6 или 7), как показано на рисунке 2.
- Аккуратно соберите ячейки с 24-луночной пластины и перенесите ячейки в центрифужную трубку объемом 50 мл.
ПРИМЕЧАНИЕ: Старайтесь не генерировать пузырьки, так как это приведет к снижению жизнеспособности клеток. - Центрифугируйте трубку при 400 х г в течение 5 мин.
- Повторно суспендируйте гранулу 1 мл среды R-10 и подсчитайте клетки с помощью Trypan Blue.
ПРИМЕЧАНИЕ: Сохраните 5 x 105 клеток для проточной цитометрии для определения эффективности трансдукции. - Переложите повторно суспендированные ячейки на специальную 6-луночную пластину, содержащую 30 мл среды R-10, дополненную IL-2 (200 Ед/мл) и IL-15 (5 нг/мл).
- Инкубируйте специальную плиту из 6 скважин при 37 °C с 5% CO2.
- Замените носители R-10, дополненные IL-2 (200 Ед/мл) и IL-15 (5 нг/мл) для поддержания NK-клеток каждые 3 - 4 дня.
ПРИМЕЧАНИЕ: Поддерживайте менее 20 x 106 ячеек на скважину для дальнейшего расширения при каждом изменении. Для лучшей жизнеспособности убедитесь, что общее количество клеток в каждой лунке не превышает 100 х 106 клеток. - Записывайте общее количество клеток, жизнеспособность и выполняйте проточную цитометрию каждые 3-4 дня, чтобы рассчитать скорость расширения NK-клеток.
- Используйте клетки для соответствующих анализов in vitro или in vivo .
ПРИМЕЧАНИЕ: Расширенный PBNK ex vivo и CAR-NK клетки можно культивировать в инкубаторе с температурой 37 °C в течение примерно 4 недель. - Исследуйте количество и чистоту NK-клеток на 7-й день, 11-й день, 14-й день, 18-й день и 21-й день с помощью проточной цитометрии.
Результаты
Схематический рабочий процесс изоляции NK-клеток, инфильтрирующих ткани, и расширения клеток PBNK с использованием методологии 221-mIL-21 фидерных клеток показан на рисунке 1 и рисунке 2. Расширенные PBNK-клетки собирали каждые 3 или 4 дня для проточной цитометрии для определения чистоты NK-клеток путем окрашивания клеток античеловеческим CD56 и античеловеческим CD3. Эксперимент был повторен с использованием двух разных доноров, чтобы показать воспроизводимость системы расширения (рисунок 3). Было показано, что клетки PBNK, расширенные на 221-mIL-21, расширяются почти в 5 × 104 раза (рисунок 3A). Кроме того, чистота NK-клеток поддерживалась высоко, около 85% на протяжении всего 21-дневного расширения (рисунок 3B). Используя систему расширения фидерных клеток 221-mIL-21, чистота NK-клеток постоянно колебалась в пределах 85-95%, независимо от доноров (данные не показаны). Чтобы продемонстрировать надежность системы расширения 221-mIL-21, NBMC были окрашены для анти-CD56 и анти-CD3 перед расширением, что показало чистоту клеток 7,09% для NK-клеток и высокий процент Т-клеток (рисунок 4A). PBMC кокультурировали с 221-mIL-21 для расширения NK-клеток; чистота NK была проверена перед трансдукцией CAR-NK на 4-й день (рисунок 4A). CAR-NK-клетки были собраны и окрашены для анти-CD56, анти-CD3 и анти-hIgG(H+L) F(ab')2, которые показали высокую популяцию NK-клеток (86,9% на 7-й день) и высокую эффективность трансдукции CAR примерно 70% (Рисунок 4). Более высокая эффективность трансдукции (до 95%) также наблюдалась с использованием системы упаковки ретровирусов. В целом, эти данные показывают, что фидерные клетки 221-mIL-21 могут успешно расширять NK-клетки и сохранять чистоту NK-клеток ex vivo.
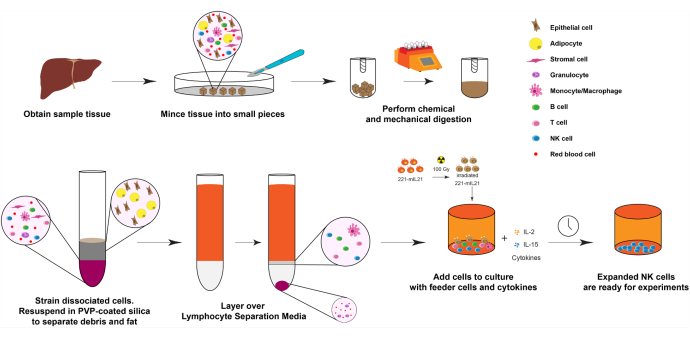
Рисунок 1: Диаграмма расширения NK-клеток из твердых образцов органов человека. Вкратце, полученные образцы печени человека измельчают в небольшие кубики для механического пищеварения. Диссоциированные клетки затем изолируют с использованием кремнезема, покрытого PVP, и среды разделения лимфоцитов. Далее NK-клетки расширяются с использованием протокола расширения, описанного на рисунке 2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
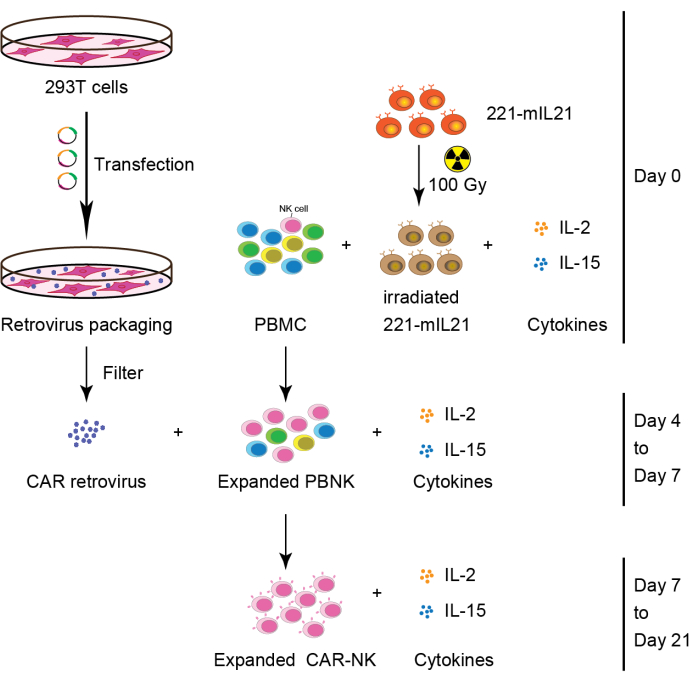
Рисунок 2: Схематический рабочий процесс генерации клеток CAR-NK из НБМК. Вкратце, 221-mIL21 фидерные клетки были облучены при 100 Гр перед кокультурированием с ПОМОЩЬЮ PBMCs, дополненных IL-2 и IL-15 на 0-й день. Параллельно 293T-клетки были трансфектированы системой упаковки ретровируса для получения ретровируса CAR, который затем трансдуцировался в расширенные клетки PBNK в присутствии IL-2 и IL-15. Первичные клетки CAR-NK были собраны на 7-й день и продолжали расширяться в течение 21 дня. Эта цифра была изменена по сравнению с Yang et al.16. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
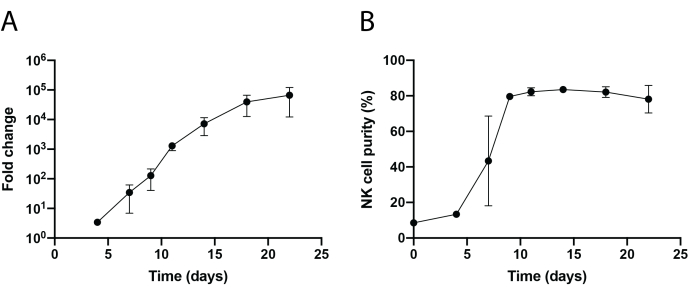
Рисунок 3: Динамическое повременное расширение ячеек ПБНК. (А) Складное расширение ПБНК в течение 22-дневного времени. Клетки окрашивали анти-CD56 и анти-CD3 в указанные дни для проточной цитометрии. Общее количество NK-клеток определяли путем умножения чистоты NK-клеток на общее количество клеток. Скорость расширения была сгенерирована следующим образом: (Количество NK-клеток)Tn/(Число NK-клеток)T0, где Число NK-клеток = (процент чистоты NK-клеток) × (общее количество клеток),T0 - количество NK-клеток в момент 0-го дня, а Tn - количество NK-клеток в момент времени дня n. (B) Чистота NK-клеток в течение 22-дневного временного курса. Расширение NK-клеток повторялось два раза с двумя разными донорами. Полосы ошибок представляют ± SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
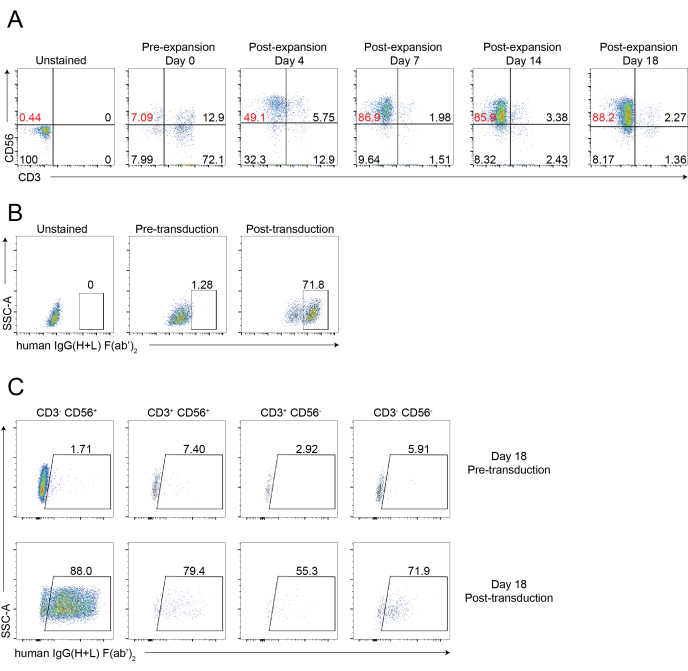
Рисунок 4: Репрезентативный цитометрический анализ цитометрических клеток CAR-NK. (A) Репрезентативные точечные графики, показывающие динамическую покадровую четкость NK-клеток CAR-NK клеток в течение 18-дневного курса. Анализ проточной цитометрии оценивали путем окрашивания клеток анти-CD56 и анти-CD3 в указанные моменты времени. День 0 указывает на предварительное расширение ПБНК. День 4 указывает на пострасширение ПБНК и претрансдукцию CAR-NK клеток. День 7 указывает на посттрансдукцию CAR-NK клеток. (B) Репрезентативные точечные графики, показывающие эффективность трансдукции клеток CAR-NK с использованием системы упаковки ретровирусов. Клетки окрашивали анти-CD56, анти-CD3 и анти-hIgG(H+L) F(ab')2 для проточной цитометрии. (C) Репрезентативные точечные графики, показывающие выражение CAR в различных подмножествах, включая CD56+CD3-, CD56-CD3+, CD56+CD3+ и CD56-CD3- на 18-й день. Клетки окрашивали анти-CD56, анти-CD3 и анти-hIgG(H+L) F(ab')2 (что указывает на экспрессию CAR) для проточной цитометрии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Большинство современных продуктов CAR-NK в клинических испытаниях используют клеточные линииNK 17, такие как NK-92, клеточная линия, выделенная из пациента с неходжкинской лимфомой18, NK-92MI, IL-2 независимая клеточная линия NK-9219 и NKL, выделенная из большого гранулированного пациента с лимфоцитами20, поскольку эти клеточные линии легко пролиферативны для «готовых» продуктов. Однако эти клеточные линии, например, клетки NK-92, имеют предельную клиническую эффективность и расширение in vivo, поскольку они требуют облучения перед инфузией, тем самым ограничивая их пролиферацию и цитотоксичность in vivo21. Учитывая эти причины, в настоящее время изучаются различные стратегии для расширения первичных NK-клеток из нескольких источников, включая периферическую кровь, CB, костный мозг (BM), эмбриональные стволовые клетки человека (HSC), индуцированные плюрипотентные стволовые клетки (iPSCs) и опухолевые ткани 21,22,23. Например, NK-клетки могут быть расширены ex vivo с использованием интерлейкинов, включая IL-15, IL-18 и IL-21. Лимфобластоидные клеточные линии, такие как клетки K562 или трансформированные вирусом Эпштейна-Барра лимфобластоидные клеточные линии, такие как клетки 721.221, также используются для расширения NK-клеток16. Однако вышеупомянутые стратегии часто генерируют недостаточное количество NK-клеток для принятия иммунотерапии CAR-NK22,24. Чтобы помочь решить эту проблему, исследование здесь показывает протокол для расширения клеток ex vivo NK с использованием генетически модифицированной EBV-трансформированной клеточной линии, 221-mIL-21 фидерных клеток.
Методология расширения с использованием 221-mIL-21 фидерных клеток, показанная в этом протоколе, оптимизирована для расширения NK-клеток со скоростью расширения по меньшей мере в 10-100 раз выше, чем другие клеточные линии лейкемии, включая HL-60 и OCl-AML3, экспрессирующие мембрану IL-21, K562 и K652-mIL21, экспрессирующую лиганд OX40 22,24,25. Выражение CAR также вычисляется в течение примерно 2 недель ex vivo. Что еще более важно, стратегия расширения 221-mIL-21 фидерных клеток может быть применена для расширения NK-клеток из различных источников, включая НБМК, CB и твердые органы, такие как печень, без начальной стадии обогащения NK. Хотя фидерная система 221-mIL-21 не так зависима от доноров, как вышеупомянутые клеточные линии кормушки, она не полностью независима от доноров. В среднем, система расширения 221-mIL-21 может достичь 90% чистоты NK-клеток с высоким числом NK-клеток, при этом примерно <5% загрязнения Т-клеток на 14-й день после расширения. Поэтому, чтобы исключить возможности загрязнения Т-клеток, необходимо изолировать NK-клетки из полученных образцов до расширения ex vivo или использовать систему отбора CD3+ для устранения Т-клеток после расширения ex vivo.
Одно из критических замечаний при использовании системы расширения NK-клеток заключается в том, что питательные клетки, возможно, не были полностью уничтожены после расширения или до переливания, что может иметь значительные регуляторные проблемы; поэтому полная эрадикация питательных клеток перед переливанием имеет решающее значение. Тем не менее, недавние клинические испытания CAR-NK, в которых клетки кормушки K562-mIL21-4-1BBL использовались для расширения клеток CBNK ex vivo 24,25, не показали осложнений. Кроме того, наши предварительные данные показали постепенное уменьшение облученной популяции 221-mIL-21 по мере продвижения расширения (данные не показаны). Однако для реализации этого метода расширения в клинических условиях требуются более обширные исследования. В совокупности система расширения 221-mIL-21 помогает решить проблему расширения первичных CAR-NK-клеток и, следовательно, будет значительно способствовать более широкому использованию иммунотерапии на основе car-NK-клеток в ближайшем будущем.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы хотели бы поблагодарить членов лаборатории Лю (д-ра Сян-чи Цзэна, д-ра Сюэнина Вана и д-ра Чи-Сюн Чэня) за их комментарии к рукописям. Мы хотели бы поблагодарить д-ра Джанпьетро Дотти за векторы SFG и д-ра Эрика Лонга за 721.221 клетки. Эта работа была частично поддержана HL125018 (D. Liu), AI124769 (D. Liu), AI129594 (D. Liu), AI130197 (D. Liu) и Rutgers-Health Advance Funding (программа NIH REACH), U01HL150852 (R. Panettieri, S. Libutti и R. Pasqualini), S10OD025182 (D. Liu) и Rutgers University-New Jersey Medical School Startup funding for D. Liu Laboratory.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 mm surface treated sterile tissue culture dishes | VWR | 10062-880 | For transfection |
| 293T cells | ATCC | CRL-3216 | For transfection |
| 6-well G-REX plate | Wilson Wolf | 80240M | For NK cell expansion |
| AF647-conjugated AffiniPure F(ab')2 fragment goat anti-human IgG (H+L) | Jackson ImmunoResearch | 109-606-088 | For flow cytometry |
| CAR construct in SFG vector | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Collagenase IV | Sigma | C4-22-1G | For TILs isolation |
| Cryopreserve media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 90% |
| Cryopreserve media Ingredient: Dimethyl sulfoxide (DMSO) | Sigma | D2050 | 10% |
| D-10 media Ingredient: DMEM | VWR | 45000-304 | |
| D-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| D-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| FastFlow & Low Binding Millipore Express PES Membrane | Millex | SLHPR33RB | For transduction |
| Genejuice transfection reagent | VWR | 80611-356 | For transfection |
| gentleMACS C-tubes | Miltenyi Biotec | 130-093-237 | For TILs isolation |
| gentleMACS Octo | Miltenyi Biotec | Quote | For TILs isolation |
| Hank's Balanced Salt Solution (HBSS - w/o calcium or magnesium) | ThermoFisher | 14170120 | For TILs isolation |
| Human IL-15 | Peprotech | 200-15 | For NK cell expansion |
| Human IL-2 | Peprotech | 200-02 | For NK cell expansion |
| Irradiated 221-mIL21 feeder cells | Generated in Dr. Dongfang Liu's lab | Frozen in cryopreserve media | |
| Lymphocyte Separation Media | Corning | 25-072-CV | For TILs isolation |
| OPTI-MEM | ThermoFisher | 31895 | For transfection |
| PE anti-human CD3 clone HIT3a | Biolegend | 300308 | For flow cytometry |
| PE/Cy7 anti-human CD56 (NCAM) clone 5.1H11 | BioLegend | 362509 | For flow cytometry |
| Pegpam3 plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| Percoll | GE Healthcare | 17089101 | For TILs isolation |
| Peripheral blood mononuclear cells (PBMCs) | New York Blood Center | Isolated from plasma of healthy donors, frozen in cryopreserve media | |
| Phosphate Buffer Saline (PBS) | Corning | 21-040-CV | For transduction |
| pRDF plasmid | Generated in Dr. Dongfang Liu's lab | For transfection | |
| R-10 media Ingredients: RPMI 1640 | VWR | 45000-404 | |
| R-10 media Ingredient: L-glutamine | VWR | 45000-304 | 1% |
| R-10 media Ingredient: Penicillin Streptomycin | VWR | 45000-652 | 1% |
| R-10 media Ingredient: Fetal Bovine Serum (FBS) | Corning | 35-010-CV | 10% |
| Retronectin | Generated in Dr. Dongfang Liu's lab | home-made | For transduction |
| Trypan Blue | Corning | 25-900-Cl | For cell counting |
| Untreated 24-well plate | Fisher Scientific | 13-690-071 | For transduction |
Ссылки
- Van Acker, H. H., et al. CD56 in the immune system: More than a marker for cytotoxicity. Frontiers in Immunology. 8, 892 (2017).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Shimizu, Y., et al. Transfer and expression of three cloned human non-HLA-A,B,C class I major histocompatibility complex genes in mutant lymphoblastoid cells. Proceedings of the Nationall Academy of Sciences of the United States of America. 85 (1), 227-231 (1988).
- Wu, J., Lanier, L. L. Natural killer cells and cancer. Advances in Cancer Research. 90, 127-156 (2003).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. The New England Journal of Medicine. 382 (6), 545-553 (2020).
- Alonso-Camino, V., et al. Efficacy and toxicity management of CAR-T-cell immunotherapy: a matter of responsiveness control or tumour-specificity. Biochemical Society Transactions. 44 (2), 406-411 (2016).
- Bonifant, C. L., Jackson, H. J., Brentjens, R. J., Curran, K. J. Toxicity and management in CAR T-cell therapy. Molecular Therapy Oncolytics. 3, 16011 (2016).
- Kalaitsidou, M., Kueberuwa, G., Schitt, A., Gilham, D. E. CAR T-cell therapy: toxicity and the relevance of preclinical models. Immunotherapy. 7 (5), 487-497 (2015).
- Gust, J., et al. Endothelial activation and blood-brain barrier disruption in neurotoxicity after adoptive immunotherapy with CD19 CAR-T cells. Cancer Discovery. 7 (12), 1404-1419 (2017).
- Hay, K. A., et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood. 130 (21), 2295-2306 (2017).
- Zhang, Y., et al. In vivo kinetics of human natural killer cells: the effects of ageing and acute and chronic viral infection. Immunology. 121 (2), 258-265 (2007).
- Vidard, L., et al. CD137 (4-1BB) Engagement fine-tunes synergistic IL-15- and IL-21-driven nk cell proliferation. Journal of Immunology. 203 (3), 676-685 (2019).
- Venkatasubramanian, S., et al. IL-21-dependent expansion of memory-like NK cells enhances protective immune responses against Mycobacterium tuberculosis. Mucosal Immunology. 10 (4), 1031-1042 (2017).
- Ojo, E. O., et al. Membrane bound IL-21 based NK cell feeder cells drive robust expansion and metabolic activation of NK cells. Scientific Reports. 9 (1), 14916 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), 30264 (2012).
- Yang, Y., et al. Superior expansion and cytotoxicity of human primary NK and CAR-NK cells from various sources via enriched metabolic pathways. Molecular Therapy. Methods & Clinical Development. 18, 428-445 (2020).
- Liu, S., et al. NK cell-based cancer immunotherapy: from basic biology to clinical development. Journal of Hematology & Oncology. 14 (1), 7 (2021).
- Gong, J. H., Maki, G., Klingemann, H. G. Characterization of a human cell-line (Nk-92) with phenotypical and functional-characteristics of activated natural-killer-cells. Leukemia. 8 (4), 652-658 (1994).
- Tam, Y. K., et al. Characterization of genetically altered, interleukin 2-independent natural killer cell lines suitable for adoptive cellular immunotherapy. Human Gene Therapy. 10 (8), 1359-1373 (1999).
- Robertson, M. J., et al. Characterization of a cell line, NKL, derived from an aggressive human natural killer cell leukemia. Experimental Hematology. 24 (3), 406-415 (1996).
- Hu, Y., Tian, Z. G., Zhang, C. Chimeric antigen receptor (CAR)-transduced natural killer cells in tumor immunotherapy. Acta Pharmacologica Sinica. 39 (2), 167-176 (2018).
- Tseng, H. C., et al. Efficacy of anti-CD147 chimeric antigen receptors targeting hepatocellular carcinoma. Nature Communications. 11 (1), 4810 (2020).
- Easom, N. J. W., et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction. Frontiers in Immunology. 9, 1009 (2018).
- Granzin, M., et al. Highly efficient IL-21 and feeder cell-driven ex vivo expansion of human NK cells with therapeutic activity in a xenograft mouse model of melanoma. Oncoimmunology. 5 (9), 1219007 (2016).
- Liu, E. L., et al. Cord blood derived natural killer cells engineered with a chimeric antigen receptor targeting CD19 and expressing IL-15 have long term persistence and exert potent anti-leukemia activity. Blood. 126 (23), (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены