Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Функциональная оценка барьера плотного соединения кишечника и ионной проницаемости в нативной ткани с помощью метода использования камеры
В этой статье
Резюме
Кишечный эпителий обеспечивает не только всасывание питательных веществ, но и защиту от вредных веществ. Наиболее апикально-эпителиальное межклеточное соединение, т. е. плотное соединение, регулирует параклеточную растворенную и ионную проницаемость. Здесь описан протокол подготовки листов слизистой оболочки и оценки селективности ионов плотных соединений методом камеры Уссинга.
Аннотация
Метод камеры Уссинга был впервые изобретен датским ученым Хансом Уссингом в 1951 году для изучения трансклеточного транспорта натрия через кожу лягушки. С тех пор этот метод был применен ко многим различным тканям для изучения физиологических параметров транспорта через мембраны. Метод камеры Юссинга предпочтительнее других методов, потому что можно использовать нативную ткань, что делает его более применимым к тому, что происходит in vivo. Однако, поскольку используется нативная ткань, пропускная способность низкая, время ограничено, а подготовка тканей требует навыков и обучения. Эти камеры использовались для изучения специфических белков-транспортеров в различных тканях, понимания патофизиологии заболеваний, таких как при муковисцидозе, изучения транспорта и поглощения лекарств и особенно способствовали пониманию транспорта питательных веществ в кишечнике. Учитывая весь процесс эпителиального транспорта ткани, важны не только трансэпителиальные пути, но и параклеточные пути. Плотные соединения являются ключевым фактором, определяющим тканеспецифическую параклеточную проницаемость по всему кишечнику. В этой статье метод камеры Уссинга будет использоваться для оценки параклеточной пермселективности ионов путем измерения трансэпителиальной проводимости и потенциалов разбавления.
Введение
Метод камеры Уссинга был впервые разработан датским ученым Хансом Уссингом. Уссинг впервые использовал его для измерения тока короткого замыкания транспорта натрия через кожу лягушки после того, как было замечено, что NaCl может транспортироваться через кожу против крутого градиента концентрации1. Его система состояла из лягушачьей шкуры, установленной между двумя камерами с доступом к обеим сторонам кожи. Каждая камера содержала раствор Рингера, который циркулировал и аэрировался. Два узких агаровых звеньевых моста, расположенных рядом с кожей и соединенных с насыщенными электродами KCl-каломеля, измеряли разность потенциалов, считываемую потенциатором. Вторая пара агаровых кольцевых мостиков была расположена на противоположном конце каждой камеры, соединенной с стаканами с насыщенным KCl, насыщенным AgCl, для приложения электродвижущей силы, обеспечиваемой батареей. Делитель потенциалов использовался для регулировки напряжения таким образом, чтобы разность потенциалов по всей коже оставалась нулевой, создавая тем самым условия короткого замыкания. Микроамперометр также был подключен для считывания тока, проходящего через кожу (см. рисунок в ref.1 для оригинальной конструкции камеры).
За последние 70 лет этот метод был применен ко многим различным тканям, особенно к кишечной ткани, для изучения транспорта питательных веществ и ионов. Например, механизм диареи, вызванной холерой, был изучен путем установки подвздошной кишки кролика в этих камерах, и было обнаружено, что диарея, вызванная холерой, опосредована цАМФ2. Кроме того, эти камеры также использовались для изучения механизма, лежащего в основе транспорта глюкозы через Na+-глюкозный котранспортер 1 (SGLT1)3. Наша лаборатория фокусируется на трансклеточном и параклеточном транспорте в эпителиальных клетках кишечника. Используя метод камеры Уссинга, транспорт пептидов оценивали у нокаутирующих мышей Claudin 15, у которых нарушен параклеточный транспорт натрия, с использованием камер Ussing для измерения поглощения негидролизуемого дипептида глицилсаркозина. Установлено, что люминальный гомеостаз Na+ важен для протонно-связанного транспорта пептидов4. Кроме того, эти камеры также использовались для исследования секреции аниона в слепой кишке мышей в ответ на подслизистую активацию рецептора протеиназы 1 сериновой протеазой трипсина5.
Камеры Ussing также недавно использовались для оценки параклеточных путей в эпителиальной ткани. Параклеточные пути регулируются плотными соединениями, которые представляют собой комплексы белков, образующихся в точке, где встречаются две или более клетки6. Барьерная функция и селективность ионов (способны ли анионы или катионы избирательно проходить через плотное соединение) определяется наличием белков семейства клаудинов; некоторые из которых действуют как барьеры (клодин 3 и 7), анионные поры (клаудин 10а) или катионные поры (клаудин 2, 10b и 15)7. Другие методы были использованы для оценки параклеточного пути, такие как пероральный прием FITC, сопровождаемый концентрацией FITC в плазме крови ИЛИ EDTA-Cr9; однако эти методы имеют более низкое разрешение и не могут оценить селективность ионов или определенный участок отделов кишечного тракта. Однако камеры ussing могут быть использованы для оценки потенциала разбавления целевых ионов и, следовательно, определения селективности ионов плотных соединений. Например, с NaCl селективность плотных соединений для Na+ и Cl- может быть рассчитана путем разбавления одной стороны мембраны (обычно стороны слизистой оболочки) и измерения изменения разности трансэпителиальных потенциалов. Относительные проницаемости Na+ и Cl- могут быть оценены по уравнению Голдмана-Ходжкина-Каца10, а селективность плотного соединения может быть оценена с помощью уравнения Кимидзука-Кокецу11. Эти камеры, таким образом, имеют преимущество измерения электрофизиологических параметров ткани и в результате предоставляют больше информации о прохождении ионов через плотные соединения, чем другие методы с более низким разрешением.
Метод камеры Юссинга не ограничивается только кишечным трактом, хотя он широко используется в исследованиях, касающихся кишечника, он также имеет много других применений. Например, эти камеры использовались для изучения муковисцидоза и, в частности, трансмембранного регулятора проводимости муковисцидоза хлоридного канала (CFTR)12. Муковисцидоз вызван мутацией CFTR13, которая приводит к нарушению секреции хлоридов и транспорта жидкости дыхательными эпителиальными клетками и, как следствие, более толстому, сухому слизистому слою14. Исследование CFTR эпителия дыхательных путей было проведено с помощью этих камер, чтобы не только понять болезнь, но и найти способы лечения заболевания. Например, у пациентов с редкими мутациями, вызывающими муковисцидоз, анализ респираторных эпителиальных клеток пациента использовался для тестирования таких методов лечения, как Orkambi и усилительная котерапия15.
Камеры Ussing также использовались для изучения путей доставки лекарств, таких как биопсия ткани человека для изучения поглощения лекарств и фармакокинетики16. Кишечное поглощение не является единственным путем доставки лекарств. Эти камеры также использовались для изучения носовых систем доставки лекарств17. Исследования доставки лекарств с камерами Ussing также были выполнены для глаз. В роговице кролика были проведены исследования проницаемости и поглощения с помощью Лабразола, препарата, который предназначен для увеличения абсорбции лекарств через ткани18. В другом исследовании изучалось влияние бензилалкония хлорида на транссклеральную доставку лекарств в склере кролика19.
Метод камеры Ussing полезен, потому что можно использовать нативную ткань. Таким образом, он предпочтительнее моделей in vitro , таких как клеточные линии Caco-2. Тем не менее, метод требует навыков и времени для подготовки образцов, поэтому он не подходит для приложений с высокой пропускной способностью. Электрофизиологические свойства клеточных монослоев могут быть изучены с помощью вставок клеточной культуры в этих камерах. Недавние открытия позволили культивировать органоиды, которые являются мини-органами, выращенными в культуре из извлечения эпителиальных или эндотелиальных стволовых клеток20. Органоидной культурой можно манипулировать, чтобы она была выращена в монослое, что позволяет устанавливать органоиды в камеру Ussing21. Органоиды различных эпителиальных и эндотелиальных тканей могут быть изучены, снижая количество необходимых животных, так как органоидная культура может поддерживаться в течение длительного времени. Это также увеличит пропускную способность, так как трудоемкие и трудоемкие этапы рассечения тканей и подготовки не понадобятся. В будущем камерные исследования Ussing будут по-прежнему очень полезны для изучения транспорта тканей, и они будут особенно важны в области персонализированной медицины.
Следующий протокол демонстрирует применение метода камеры Уссинга для оценки пермселективности и барьерной функции плотных соединений в тонкой кишке нокаутных мышей Claudin 15 (Cldn15-/-) и контроля дикого типа (WT) путем измерения потенциала разбавления NaCl. Плотные соединения (TJ) образуются в точке, где встречаются две или более клетки в эпителиальной и эндотелиальной ткани. Считается, что двухклеточные плотные соединения (bTJ), особенно белки семейства клаудинов, обнаруженные в bTJ, определяют барьерную функцию и пермселективность TJ7. Cldn15-/- мыши имеют мега тонкую кишку22 и сниженную способность поглощения питательных веществ из-за потери кишечной рециркуляции Na+, которая происходит через клаудин 154,23,24. Cldn15-/- мыши имеют нарушенный гомеостаз Na+, что делает их интересной моделью для изучения пермселективности TJ. Следующий протокол оценивает проницаемость TJ к NaCl путем измерения потенциала разбавления NaCl (PNa/PCl) в средней тонкой кишке. Вкратце, изменение разности мембранных потенциалов, которое происходит при разбавлении одной стороны мембраны (сторона M или сторона S, оба измеряются в приведенном ниже протоколе), может быть использовано для расчета проницаемости Na+ (PNa) и Cl- (PCl), а потенциал разрежения (PNa/PCl) покажет, имеет ли плотное соединение катионную или анионную селективность.
Эксперименты по этому протоколу проводились с использованием кастомизированной камеры Ussing (рисунок 1A), которая состоит из двух половин, между которыми вертикально установлен кишечный препарат, усилителя зажима напряжения, электрического регистратора, электродов, солевых мостиков, раствора Рингера, буфера HEPES (150 мМ NaCl), разбавленного буфера HEPES (75 мМ NaCl), кишечной подготовки (подробнее об оборудовании см. в Таблице материалов).
протокол
Все животные, используемые в этих экспериментах, содержались в учреждении по уходу за животными в Университете Сидзуоки, и эксперименты проводились в соответствии с руководящими принципами исследований на животных, установленными Университетом Сидзуоки. Все эксперименты проводились с одобрения Комитета по уходу за животными и их использованию в Университете Сидзуока (разрешения No 205272 и No 656-2303).
1. Подготовка электродов NaCl
ПРИМЕЧАНИЕ: Электроды, используемые в этих экспериментах, состоят из концентрированных NaCl или KCl. Электроды KCl/calomel приобретаются на коммерческой основе. Перед началом эксперимента убедитесь, что все электроды заполнены сверху концентрированным раствором NaCl или KCl.
- Приготовьте небольшие стеклянные баночки с пластиковыми крышками (объем 20 мл).
- Просверлите два отверстия в пластиковых крышках, одно для соляного моста NaCl (диаметр 2,5 мм), а другое для серебряной проволоки (диаметр 1 мм; Рисунок 1С, электрод NaCl).
- Наполните стеклянную банку насыщенным раствором NaCl (около 15 мл, до полного заполнения).
- Вставьте в банку серебряную проволоку (диаметром 0,8 мм, длиной 7 см), но убедитесь, что проволочная часть снаружи банки может быть подключена с помощью зажимов аллигатора (небольшого размера) к усилительной системе.
- Когда электроды не используются, оберните электроды и убедитесь, что отверстия закрыты парапленкой, чтобы предотвратить высыхание.
2. Подготовка соляных мостиков
ПРИМЕЧАНИЕ: Подготовьте солевые мостики по крайней мере за день до эксперимента, чтобы обеспечить достаточное время для затвердевания. Солевые мостики можно использовать повторно, но использовать через 2 месяца не рекомендуется.
- Соляные мосты NaCl
- Подготовьте полиэтиленовые трубки No7 (наружный диаметр 2,3 мм, внутренний диаметр 1,3 мм), игольчатый шприц 19 г и шприц замкового типа, 200 мл раствора 1 М NaCl, 2 г агара, герметичный пластиковый контейнер для хранения соляного мостика.
- Подготовьте соответствующее количество соляных мостиков, разрезав трубки до размера, необходимого для установки камеры Уссинга (для каждой камеры требуется два соляных моста).
- Перед инъекцией агара сделайте U-образную форму с трубками и поместите их в стакан с теплой водой (чтобы создать легкую форму для установки соляных мостиков).
- Получают 200 мл 1 M NaCl, растворяя 11,688 г NaCl в 200 мл в деионизированной воде.
- Разделите 1 M NaCl на порции по 100 мл: Сделайте 100 мл 2% агара в 1 M NaCl (смешайте 2 г агара в NaCl, нагрейте в микроволновой печи для растворения).
- Используя иглу 19 г и запирающий шприц, заполните шприц 1 М Раствор NaCl/агара. Осторожно начинайте выталкивать раствор по каплям и при этом вставляйте иглу в один конец пробирки и заливайте до тех пор, пока смесь не выйдет с другой стороны.
- Медленно вынимайте иглу, все еще экспрессируя раствор, и повторяйте до тех пор, пока не будут сделаны все необходимые солевые мостики. (Если раствор затвердевает в шприце или игле, ненадолго нагрейте его в горячей воде до тех пор, пока раствор не сможет быть выражен снова.)
- Проверьте соляные мостики, чтобы убедиться в отсутствии пузырьков, и храните в оставшемся 1 M растворе NaCl в герметичном контейнере.
- Соляные мосты KCl
ПРИМЕЧАНИЕ: Более тонкие трубки используются для агаровых мостиков KCl, чтобы избежать увеличения концентрации K+ в буфере, так как наконечники солевых мостиков могут растворяться, а K+ может просачиваться в буфер.- Подготовьте полиэтиленовые трубки No3 (наружный диаметр 1,0 мм, внутренний диаметр 0,5 мм), шприц 23 г иглы и замка, 200 мл раствора 1 М ККл, 2 г агара, герметичный пластиковый контейнер для хранения соляного моста.
- Подготовьте соответствующее количество соляных мостиков, разрезав трубку до размера, необходимого для установки камеры Ussing (для каждой камеры требуется два соляных моста).
- Получить 200 мл 1 Мкл растворив 14,91 г KCl в 200 мл деионизированной воды.
- Разделить на две порции по 100 мл: Сделать 100 мл 2% агара в 1 МКл (смешать 2 г агара в ККл, нагреть в микроволновой печи для растворения).
- Используя иглу 23 г и запирающий шприц, вводите трубку с 2% смесью агара 1 M KCl (убедитесь, что трубки полностью заполнены и нет пузырьков) так же, как и с соляными мостиками NaCl.
- Проверьте соляные мостики, чтобы убедиться в отсутствии пузырьков, и храните оставшийся раствор 1 M KCl в герметичном контейнере.
3. Приготовление раствора Рингера и буфера HEPES
ПРИМЕЧАНИЕ: В зависимости от ткани, установленной в камере Ussing, компоненты раствора Рингера могут отличаться. Представленные здесь рецепты специфичны для тонкого и толстого кишечника.
- Сделайте раствор Рингера свежим в день экспериментов, как описано в таблице 1.
- Пузырьковый раствор с 95% O2/5% CO2 , чтобы обеспечить O2 в ткань и буферную способность.
| Раствор Рингера (тонкая кишка) | Раствор Рингера (толстая кишка) |
| NaHCO3 – 21,0 мМ | NaHCO3 – 21,0 мМ |
| K2HPO4 – 2,4 мМ | K2HPO4 – 2,4 мМ |
| Х2ПО4 – 0,6 мМ | Х2ПО4 – 0,6 мМ |
| NaCl – 119,0 мМ | NaCl – 119,0 мМ |
| MgCl2 – 1,2 мМ | MgCl2 – 1,2 мМ |
| CaCl2 – 1,2 мМ | CaCl2 – 1,2 мМ |
| Индометацин – 10 мкМ (Сделайте 1 мМ запаса в 21 мМ NaHCO3, добавьте 10 мл запаса на 1 л раствора Рингера) | Индометацин – 10 мкМ (Сделайте 1 мМ запаса в 21 мМ NaHCO3, добавьте 10 мл запаса на 1 л раствора Рингера) |
| 1 мМ глутамина (0,146 г/л) | 10 мМ Глюкоза |
Таблица 1: Рецепт решения Рингера. Чтобы приготовить раствор Рингера, смешайте все компоненты вместе с деионизированной водой. Раствор Рингера лучше всего делать свежим перед экспериментами. Хранить в холодильнике или на льду до использования. Перед использованием газ с 95% O2/5% CO2.
- Сделайте буфер HEPES свежим в день эксперимента, как описано в таблице 2 , путем смешивания ингредиентов в деионизированной воде.
- Не приспосабливайтесь к конечному объему буфера до тех пор, пока не произойдет регулировка pH.
- Нагрейте буфер HEPES до 37 °C и отрегулируйте pH до 7,4, медленно добавляя капли 1 M Tris раствора при перемешивании.
- Отрегулируйте конечный объем, добавив соответствующее количество деионизированной воды.
| Буфер HEPES | Буфер разбавления HEPES |
| HEPES – 10 мМ | HEPES – 10 мМ |
| Глюкоза – 10 мМ (Толстая кишка) | Глюкоза – 10 мМ (Толстая кишка) |
| 1 мМ глутамина (0,146 г/л) (тонкая кишка) | 1 мМ глутамина (0,146 г/л) (тонкая кишка) |
| NaCl – 150 мМ | NaCl – 75 мМ + 150 мМ маннит (для корректировки различий осмоляльности) |
| MgCl2 – 1 мМ | MgCl2 – 1 мМ |
| CaCl2 – 2 мМ | CaCl2 – 2 мМ |
| Индометацин – 10 мкМ (Сделайте 1 мМ запаса в 21 мМ NaHCO3, добавьте 10 мл запаса на 1 л раствора Рингера) | Индометацин – 10 мкМ (Сделайте 1 мМ запаса в 21 мМ NaHCO3, добавьте 10 мл запаса на 1 л раствора Рингера) |
| Отрегулируйте pH 7,40 (37°C) с помощью 1 M Tris | |
Таблица 2: Рецепт буфера HEPES. Чтобы сделать HEPES буферным и разбавляющим HEPES буфером, растворите все ингредиенты в деионизированной воде. Растворы должны быть отрегулированы с помощью 1 M Tris раствора, поэтому не добавляйте полный объем воды (например, при приготовлении 1 л растворите все ингредиенты примерно в 800 мл воды). Затем нагрейте раствор до 37 °C, отрегулируйте рН до 7,4, а затем отрегулируйте конечный объем.
4. Установка усадочной камеры
ПРИМЕЧАНИЕ: Камеры Ussing, используемые в этом протоколе, являются изготовленными на заказ камерами непрерывной перфузии. Для оценки кишечной барьерной функции мыши или поглощения питательных веществ рекомендуются камеры с отверстием диаметром 4 или 5 мм25 (рисунок 1A-C).
- Чтобы уменьшить эффект кромки26 и помочь запечатать камеры, прикрепите 4 или 5 мм отверстия перфорированной парафиновой пленки (около 4 см2) перед настройкой (рисунок 1B).
- Устанавливается в условиях разомкнутого контура для измерения потенциала разрежения. Установлен в режим текущего зажима. Установите выходной ток и установите импульс тока на ±20 мкА.
- При настройке в условиях короткого замыкания для измерения тока короткого замыкания и трансмукозального сопротивления устанавливают в режиме зажима напряжения. Установите выходное напряжение и установите импульс напряжения на ±5 мВ.
- Убедитесь, что вода при температуре 37 °C циркулирует в водяной рубашке.
- Заполните каждую камеру раствором Рингера или буфером HEPES (количество зависит от используемой системы, используемые здесь камеры требуют 5 мл для каждой стороны) и убедитесь, что нет утечек.
- Соедините соляные мостики и электроды.
- Убедитесь, что напряжение равно 0 и стабильно, импульсный ток, чтобы убедиться, что солевые мостики и электроды правильно настроены.
- Позвольте температуре системы и раствора Рингера уравновешиваться в течение не менее 20 минут.
- После уравновешивания скорректируйте асимметричную разницу напряжений между электродами KCl и компенсируйте сопротивление жидкости, изменив его на ноль (проверьте руководство для системы камер Ussing, используемой для определения правильного пути).
5. Рассечение кишечной ткани
ПРИМЕЧАНИЕ: Все эксперименты на животных должны проводиться в соответствии с правилами, установленными страной и университетом.
- Перед приемом кишечной ткани приготовьте свежий ледяной раствор Рингера и пузырьки с 95% O2 и 5% CO2 в течение 15 мин (шаг 3).
- Обезболивание мышей в соответствии с руководящими принципами, регулирующими использование животных в исследованиях. Для этого эксперимента мышей анестезировали 2%-3% изофлураном, вводимым анестетиком. Проверьте правильность анестезии, защемляя пальцы ног и гарантируя, что нет болевой реакции.
- Сделать разрез в животе ножницами от таза до диафрагмы; найти желудок и разрезать пилорический конец желудка.
- Захватите часть желудка, прикрепленную к тонкой кишке, щипцами и осторожно потяните тонкую кишку, отрезав брыжеечные прикрепления. Будьте осторожны, чтобы не разрезать или не повредить кишечную ткань каким-либо образом.
- Продолжайте рассечение кишечника вплоть до ануса. Для полного удаления толстой кишки отрежьте кости таза, чтобы выявить дистальную часть толстой кишки и осторожно удалите остальную часть кишечника, отрезав вложения.
- Измерьте длину кишечника и разделите на нужные сегменты. Для этого эксперимента разделите тонкую кишку на три сегмента и используйте средний сегмент.
- Поместите нужные сегменты в ледяной, пузырьковый раствор Рингера; затем откройте каждый сегмент продольно, разрезав вдоль брыжеечных насадок. Обрежьте жир и соединительную ткань.
- Верните сегменты в ледяной раствор Рингера и тщательно промыть (даже в ледяном растворе кислородная оксигенация просветного эпителия важна для поддержания функции эпителия).
6. Удаление мышечного слоя и подготовка кишечного листа
ПРИМЕЧАНИЕ: Удаление серозы (мышечного слоя) важно для транспортных исследований с использованием кишечника. Если сероза остается, кишечная ткань может подвергаться случайным мышечным сокращениям, которые будут искажать электрофизиологические данные, и транспорт может быть ингибирован. Нестриженная ткань быстро ухудшается при установке в камерах Ussing, так как сероза является значительным диффузионным барьером для субстрата и кислорода. В некоторых особых случаях может потребоваться сохранить мышечный слой, поэтому решение остается за исследователем и экспериментальным дизайном. Кишечные листы могут быть приготовлены двумя способами в зависимости от того, какой слой удаляется (рисунок 2). Для этого эксперимента требуются препараты слизистой оболочки и подслизистой оболочки (рисунок 2, 2-я панель).
- Подготовьте рассеченные пластины (диаметром 10 см), покрытые силиконовой резиной, штифты (небольшие иглы для акупунктуры), перфорированную фильтровальную бумагу 5 мм и квадраты парапленки (2 см х 2 см; могут не понадобиться для других систем).
- Налейте свежий, ледяной, пузырьковый раствор Рингера в рассеченную пластину (достаточно, чтобы покрыть ткань, около 2-3 мл).
- Под стереомикроскопом зафиксируйте концы кишечной ткани (слизистая сторона вниз).
- Используя тонкие щипцы, тупо рассекают мышечный слой от подлежащей слизистой.
- Будьте осторожны, чтобы не порвать и не ввести какие-либо отверстия в ткань.
- Как только мышечный слой будет удален, вырежьте кусок, достаточно большой для отверстия диаметром 5 мм. При подготовке тонкой кишки удаление серозно-мышечного слоя должно быть сделано в течение 10 мин, так как просветная оксигенация в этих условиях затруднена.
- Смочите 5 мм перфорированный квадрат фильтровальной бумаги в растворе Рингера и поместите на него ткань кишечника слизистой стороной вниз, так как подслизистые препараты самопроизвольно оборачиваются слизистой стороной снаружи.
- Убедитесь, что отверстие полностью покрыто кишечной тканью и нет морщин. Используйте черную доску под препаратом, чтобы проверить, полностью ли закрыто отверстие.
- Повторите эту процедуру для необходимого количества препаратов слизистой оболочки (в этом эксперименте требуется два препарата: один препарат будет использоваться для измерения потенциала разбавления, а другой будет использоваться для измерения исходных электрических параметров).
7. Монтаж кишечных препаратов в ussing камерах
ПРИМЕЧАНИЕ: Настройка будет зависеть от типа камерной системы Ussing и используемой системы записи.
- Всасывание раствора Рингера/буфера HEPES из камеры Ussing.
- Разберите камеру Ussing и уложите фильтровальную бумагу слизистой оболочкой кишечного препарата стороной вниз на боковую камеру слизистой оболочки и отрегулируйте так, чтобы окно камеры выровнялось с отверстием фильтровальной бумаги (рисунок 1A, черная маркировка вокруг окна камеры полезна для выравнивания препаратов).
- Осторожно поместите серосальную боковую камеру на боковую камеру слизистой оболочки и плотно закройте, но убедитесь, что лист кишечника не сдвинулся во время соединения.
- Быстро заполните обе камеры раствором Рингера или буфером HEPES и поместите пузырьковые палочки (раствор Рингера: 95% O2/5% CO2; Буфер HEPES: 100% O2) на противоположном конце камер, вдали от мембраны (пузырьки слишком близко к препарату могут повлиять на измерения).
- Снова подключите соляные мостики и проверьте, стабильно ли напряжение и импульсный ток, чтобы убедиться, что соединения в порядке (рисунок 1C).
- Повторить для каждого кишечного препарата.
- Дайте системе уравновеситься в течение примерно 15 минут. Если используется система записи, позвольте проводимости и разности потенциалов Isc/мембраны стабилизироваться перед началом экспериментов.
8. Эксперимент с потенциалом разрежения (условия разомкнутого контура)
- Промывайте обе стороны камеры, всасывая буфер HEPES и добавляя по 5 мл свежего предварительно нагретого буфера HEPES с каждой стороны.
- Включите систему записи. Установите диапазон 250 мВ (используемая здесь система усиливает выходное напряжение в 10 раз), установите положение маркера и установите систему записи для измерения.
- Переверните камерные системы Ussing в режим зажима и начните измерение. Как только мембранный потенциал стабилизируется (~15-20 мин), может начаться оценка.
- Всасывают буфер HEPES со стороны слизистой оболочки и быстро заменяют 5 мл нагретого разбавляющего буфера HEPES, содержащего 75 мМ NaCl.
- Как только мембранный потенциал достигнет пика (5-10 мин), удалите буфер разбавления со стороны «слизистой оболочки» и замените его буфером HEPES.
- При необходимости повторите шаг 3 для серосальной стороны, добавив разбавляющий буфер HEPES на серозальную сторону.
- Чтобы убедиться, что ткань жизнеспособна, добавьте активатор аденилатциклазы Форсколин (конечная концентрация 10 мкМ) на серосальную сторону.
- Как только разность мембранных потенциалов достигла пика и начала снижаться, эксперимент заканчивается.
9. Измерение трансэпителиальной электропроводности и исходного Isc (условия короткого замыкания)
- Промывайте обе стороны камеры, всасывая раствор Рингера и добавляя по 5 мл свежего пузырькового раствора Рингера с каждой стороны.
- Включите систему записи. Установите диапазон 2,5 В (используемая здесь система усиливает выходное напряжение в 10 раз), установите положение маркера и установите систему записи для измерения.
- Поворот камерных систем Ussing в режим зажима и запуск измерений; как только Isc и проводимость стабилизируются (~15-20 мин), можно получить исходные измерения.
- Чтобы обеспечить жизнеспособность ткани, добавьте активатор аденилатциклазы Форсколин (конечная концентрация 10 мкМ) на серосальную сторону.
- Как только разность мембранных потенциалов достигла пика и начала снижаться, эксперимент проводится.
10. Анализ результатов
- В условиях разомкнутой цепи рассчитайте трансмукосальную проводимость от изменения напряжения в ответ на импульсы тока в соответствии с законом Ома. Определите эквивалентный ток короткого замыкания (Isc) от трансмукозального напряжения и проводимости, применяя закон Ома.
- Используйте потенциал разбавления NaCl для вычисления относительной ионной селективности (PNa/PCl) с помощью уравнения Голдмана-Ходжкина-Каца10.
- Оцените абсолютную селективность плотного перехода для каждого иона с помощью уравнения Кимидзука-Кокетсу11.
- Рассчитайте PNa/PCl, используя уравнение Голдмана-Ходжкина-Каца из потенциалов разбавления, и определите абсолютные проницаемости PNa и PCl из уравнения Кимидзука-Кокецу, как описано Yu et al.10 следующим образом:
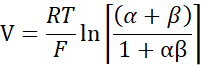

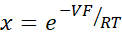

где, V: потенциал разрежения (мВ); α: Коэффициент активности. Расчетная активность NaCl в буфере HEPES, деленная на расчетную активность NaCl в буфере разбавления HEPES (для этого эксперимента она была рассчитана как 1,8966); e: Математическая константа, 2,71828; ГМ: Трансмукозальная проводимость (мСм/см2); F: постоянная Фарадея (96 485,3329 C/моль); R: Газовая постоянная (8,314 Дж/моль К); T: Температура (310.15 K)
Результаты
Результаты, показанные в настоящем документе, являются результатами, которые были частью более крупного проекта, который был завершен (см. ref.4,23,24).
Трансэпителиальная электропроводность тонкой кишки снижается <...
Обсуждение
В этом эксперименте камеры Ussing использовались для измерения исходных электрических параметров и потенциала разбавления NaCl в тонком кишечнике мышей Cldn15-/- и WT. При проведении экспериментов с камерой Уссинга очень важно убедиться, что мембранный препарат, используемый в экспе...
Раскрытие информации
У авторов нет потенциальных конфликтов интересов для раскрытия.
Благодарности
Эта работа поддерживается 17K00860 (до HH) и 19K20152 (до NI). WH хотел бы поблагодарить Стипендиальный фонд Оцука Тосими за их финансовую поддержку с 2018 по 2021 год.
Материалы
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
Ссылки
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907 (2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032 (2018).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, 1-19 (2017).
- Östh, K. . The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703 (2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376 (2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены