Method Article
Инъекции векторов AAV для оптогенетики в обезболенном и бодрствующем мозге нечеловеческих приматов
В этой статье
Резюме
В настоящее время оптогенетика у нечеловеческих приматов требует инъекции вирусных векторов в мозг. Оптимальный метод инъекции должен быть надежным и, для многих применений, способным нацеливаться на отдельные участки произвольной глубины, которые легко и однозначно идентифицируются в посмертной гистологии. Представлен инъекционный метод с этими свойствами.
Аннотация
Оптогенетические методы произвели революцию в исследованиях в области неврологии и готовы сделать то же самое для неврологической генной терапии. Клиническое использование оптогенетики, однако, требует, чтобы безопасность и эффективность были продемонстрированы на животных моделях, в идеале у нечеловеческих приматов (NHP), из-за их неврологического сходства с людьми. Количество векторов-кандидатов, которые потенциально полезны для нейробиологии и медицины, огромно, и никаких высокопроизводительных средств для проверки этих векторов пока не существует. Таким образом, существует потребность в методах, позволяющих сделать множественные пространственно и объемно точные инъекции вирусных векторов в мозг NHP, которые могут быть однозначно идентифицированы с помощью посмертной гистологии. Описанным здесь является такой способ. Инжекционные канюли изготовлены из связанных политетрафторэтиленовых и нержавеющих труб. Эти канюли являются автоклавируемыми, одноразовыми и имеют низкие минимальные объемы нагрузки, что делает их идеальными для инъекций дорогих, высококонцентрированных вирусных векторных растворов. Инертное минеральное масло, окрашенное в красный цвет, заполняет мертвое пространство и образует видимый мениск с векторным раствором, позволяя мгновенно и точно измерять скорость и объемы инъекций. Масло загружается в заднюю часть канюли, снижая риск совместной инъекции с вектором. Канюли могут быть загружены за 10 минут, а инъекции могут быть сделаны за 20 минут. Эта процедура хорошо подходит для инъекций бодрствующим или обезболенным животным. При использовании для доставки высококачественных вирусных векторов эта процедура может производить надежную экспрессию оптогенетических белков, что позволяет оптически контролировать нейронную активность и поведение в НХЛ.
Введение
Оптогенетика у нечеловеческих приматов (NHP) обычно включает в себя инъекцию вирусного вектора непосредственно в мозг. Один класс векторов, который хорошо подходит для этого приложения, основан на аденоассоциированном вирусе (AAV). Эти векторы состоят из белкового капсида, окружающего одноцепочечный геном ДНК, который, в свою очередь, состоит из промотора, гена опсина и, необязательно, других белково-кодирующих и генно-регуляторных элементов. Достижения в области молекулярного клонирования облегчили манипулирование и сочетание этих компонентов для разработки новых векторов. Следовательно, коллекция векторов AAV, которая потенциально полезна для оптогенетики NHP, велика и быстро растет.
В настоящее время полезность вектора AAV для оптогенетики NHP требует тестирования in vivo. Этот факт является существенным препятствием на пути прогресса. Животные должны использоваться экономно, и тестирование нескольких векторов на одном животном требует, чтобы места инъекций были расположены разумно относительно нейронной архитектуры и хорошо разделены относительно распространения вируса. Точная гистологическая оценка требует, чтобы инъекции были пространственно и объемно точными. Метод инъекций, ранее использовавшийся для фокальной доставки фармакологических средств 1,2,3,4, был адаптирован и упрощен для совершения таких инъекций. Этот метод инъекции является недорогим, использует одноразовые, стерилизуемые компоненты, может использоваться у анестезируемых или бодрствующих обезьян и может быть использован для нацеливания на различные области мозга любой глубины. Следующий протокол описывает пошаговые процедуры изготовления одноразовых компонентов и инъекций в мозг NHP. Обсуждаются преимущества и недостатки методики.
протокол
Все эксперименты проводились в соответствии с Руководством по уходу за лабораторными животными и их использованию и превышали минимальные требования, рекомендованные Институтом ресурсов лабораторных животных и Международной ассоциацией по оценке и аккредитации по уходу за лабораторными животными. Все процедуры были оценены и одобрены Комитетом по уходу за животными и их использованию Вашингтонского университета (протокол UW IACUC #4167-01). В этом исследовании приняли участие пять здоровых макак (2 Макака мулатта, 3 Макака Неместрина; самец 4-11 лет). Стерильные инструменты и техника использовались во всех хирургических процедурах.
1. Изготовление канюли (рисунок 1А)
- Подготовка каждой части
- Притупить кончик подкожной иглы (30 г, длина 13 мм) дисковой шлифовальной машиной.
- Вырежьте трубку из нержавеющей стали (30 Г, внутренний диаметр = 0,16 мм, наружный диаметр = 0,31 мм) на длину, адаптированную к глубине целевой области мозга (25 мм хорошо подходит для введения дорсальной поверхности коры головного мозга). С помощью дисковой шлифовальной машины скосите один конец разрезанной трубки и сгладьте другой. Снимите заусенцы с внутренней части трубки с помощью протяжки.
- Разрезать трубку из политетрафторэтилена (PFTE) (внутренний диаметр = 0,23 мм ± 0,02 мм, стенка = 0,23 мм ± 0,02 мм, 1 мм соответствует 42 нЛ ± 7 нл жидкости) на длину, соответствующую количеству загружаемого векторного раствора (1 мкл векторного раствора занимает 24 мм трубки). Вспыхните оба конца трубки из PTFE путем введения притупленной подкожной иглы.
- Вставьте притупленную подкожную иглу примерно на 5 мм в один конец трубки из ПТФЭ. Вставьте скошенный конец трубы из нержавеющей стали примерно на 5 мм в другой конец (рисунок 1А).
- Выполните тестирование перед инъекцией. Введите фильтрованную воду через подкожную иглу канюли. Убедитесь, что вода выходит из скошенной трубы из нержавеющей стали из наконечника и что вода не просачивается ни из одного соединения.
2. Процедура инъекций для анестезированных животных
- Подготовка к операции
- Стерилизуйте хирургические инструменты и расходные материалы, используя процедуры, указанные в таблице материалов.
- При необходимости сделайте МРТ головы для нацеливания на глубокие структуры мозга (рисунок 2А).
- Непосредственно перед операцией успокаивайте животных кетамином (10-15 мг/кг) и вводите антибиотики (цефазолин) и анальгетики (бупренорфин и мелоксикам) с пролонгированным высвобождением) внутримышечно. Затем доставляют пропофол через внутривенный (IV) катетер в подкожные или цефальные вены.
- Интубировать животное и перевести его в газ изофлуран. Подтвердите правильную анестезию стабильным сердечным ритмом, артериальным давлением, частотой дыхания, расслабленными скелетными мышцами и отсутствием пальпебральных или абстинентных рефлексов.
- Побрить голову животного. Нанесите искусственную слезную мазь на роговицу для предотвращения пересыхания.
- Подготовка области инъекции
- Поместите голову животного в стереотаксическую рамку. Нанесите раствор хирургического скраба на бритую кожу марлевыми губками, нанесите мягкое давление, чтобы освободить от мусора, и промойте изопропиловым спиртом. Повторите этот процесс три раза. Накройте животное стерильной фенестрированной драпировкой. Разрезайте кожу и отражайте мышцы. Поместите манипулятор на стереотаксическую руку, расположите его так, чтобы он целился в целевую область мозга, и отметьте положение трепанации черепа стерилизованной ручкой.
- Извлеките стереотаксический манипулятор и выполните трепанацию черепа. При желании сделайте урезание твердой мозговой оболочки (например, для визуализации бороздчатых ориентиров). Верните манипулятор на стереотаксическую руку.
- Загрузка векторного решения (рисунок 1С)
- Аккуратно перенесите векторный раствор в стерилизованную ПЦР-трубку с пипетром P20, избегая пузырьков.
- Прикрепите канюлю со скошенным наконечником, обращенным вниз, к вертикально ориентированному стереотаксическому держателю. Подключите шприц Luer-lock объемом 1 мл к подкожной игле канюли.
- Погрузите скошенный кончик канюли в векторный раствор.
ПРИМЕЧАНИЕ: Шприц должен быть уже прикреплен; прикрепление его в этот момент приведет к появлению пузырьков в векторном решении. - Загрузите раствор в канюлю, прикладывая мягкое отрицательное давление шприцем 1 мл. Визуально отслеживайте мениск между раствором и воздухом.
- После того, как векторный раствор был загружен, продолжайте мягкое отрицательное давление до тех пор, пока раствор не достигнет ступицы иглы. Извлеките шприц объемом 1 мл и введите цветное минеральное масло в иглу для подкожных инъекций.
ПРИМЕЧАНИЕ: Масло следует вводить медленно вдоль внутренней стенки ступицы иглы, чтобы сформировать четкий мениск с векторным раствором и избежать пузырьков воздуха. - Прикрепите концентратор иглы для подкожных инъекций к одному из двух открытых портов 3-позиционного запорного крана Luer-lock.
ПРИМЕЧАНИЕ: Прикрепление иглы для подкожных инъекций к закрытому порту приведет к нежелательному давлению воздуха за маслом. - Закройте порт, подключенный к концентратору иглы для подкожных инъекций, заполните воздухом шприц объемом 1 мл и прикрепите его к любому из двух других портов. Наконец, закройте оставшийся порт запорного крана, чтобы соединить шприц с канюлей.
- Медленно протолкните воздух в канюлю. Как только окрашенное масло появится на кончике тупой иглы в трубке из PTFE, проверьте наличие воздуха между раствором и цветным маслом.
- Если воздух присутствует, приложите отрицательное давление к шприцу, чтобы вернуть окрашенное масло в концентратор иглы. Удалите пузырь и приложите положительное давление до тех пор, пока на кончике канюли не будет видна капля векторного раствора.
- Снимите шприц объемом 1 мл, чтобы выпустить нежелательное давление воздуха за маслом, и закройте запорный кран, чтобы предотвратить выход вектора из канюли под действием силы тяжести.
- Прикрепите пластиковую линейку к трубке из PTFE для измерения движения мениска во время инъекции (рисунок 1B, D, F).
- Вставка канюли в целевую область мозга (рисунок 1B)
- Прикрепите канюлю к стереотаксическому манипулятору.
- Вручную перенесите трубку насоса (которая заканчивается в разъеме Luer-lock) от нестерильного помощника хирургу. Хирург должен схватить соединитель Luer-lock через стенку стерильной втулки, прикрепить к разъему второй стерильный запорный кран, плотно заклеить втулку вокруг нее, а затем опустить воротник рукава, позволяя ему простираться вдоль трубки под действием силы тяжести.
- Подключите запорный кран, прикрепленный к трубке канюли, к запорному крану, прикрепленному к воздушному насосу. Установите воздушный насос на низкое давление, включите его и увеличивайте давление до тех пор, пока масло не пройдет через канюлю и капля векторного раствора не будет видна на кончике канюли.
- Отрегулируйте положение пластиковой линейки на трубке из PTFE, чтобы измерить движение мениска во время инъекции.
- Опустите канюлю вниз с помощью стереотаксического манипулятора и запишите глубину, на которой наконечник достигает поверхности (dura или pia mater).
- Отведите канюлю к самому глубокому месту, которое будет введено вдоль дорожки. Поверхность будет ямочкой. Если вводите поверхностную кору, подтвердите визуально, что канюля проникла в поверхность, с помощью хирургического микроскопа или увеличительных луп, если таковые имеются.
- Чтобы свести к минимуму мистаргетинг из-за сжатия тканей, медленно (1 мм/мин), быстро (0,5 мм/с) с 1-5 минным ожиданием на дне или перепрыгните самое глубокое место инъекции на 500 мкм, а затем втягивайтесь.
- Инъекция
- Впрыскивание 0,5 мкл векторного раствора электрическим воздушным насосом в течение 10-30 с. Подтвердите поток инъекции, отслеживая мениск между цветным маслом и векторным раствором в трубке PTFE.
- Подождите 1 мин и втяните канюлю к следующему месту инъекции по дорожке.
- После последней инъекции оставьте канюлю на месте в течение 10 минут, чтобы избежать векторного эффлюкса.
- Втяните канюлю и выбросьте ее в контейнер с биологической опасностью.
- Необязательно вводят небольшое количество (≤1 мкл) флуоресцентных микрошариков вблизи места инъекции вектора, чтобы облегчить идентификацию места инъекции после вскрытия.
- Повторите эту процедуру по желанию для других векторных решений в других местах (рисунок 2B).
- Закрытие операции
- Зашить твердую мозговую оболочку, мышцы и кожу.
- Извлеките обезьяну из стереотаксической рамки и отсоедините все кабели монитора.
- Удалите обезьяну из изофлурановой анестезии и экстубируйте после возвращения глотательного рефлекса.
- Предусматривают послеоперационное лечение (3-5 дней мелоксикама и 7-10 дней цефалексина). Наблюдайте за животным не реже одного раза в 10 минут, пока оно не сможет поддерживать стабильное вертикальное положение сидя.
3. Хирургия и векторная инъекция AAV для бодрствующих животных (Рисунок 1D)
ПРИМЕЧАНИЕ: Вариант техники может быть использован для инъекций в мозг бодрствующих, ведущих себя обезьян, как описано ниже.
- Одновременная инъекция с записью
- Для регистрации электрической активности в месте инъекции покрывают внешнюю часть канюли эпоксидной (дно ~15 мм) и полиимидными трубками (оставшаяся длина). Раскройте металл на наконечнике, соскоблив с него эпоксидную смолу (Injectrode, рисунок 1F)2. В качестве альтернативы можно вставить канюлю и отдельный внеклеточный электрод, бок о бок, в двуствольную направляющую трубку (двуствольная направляющая трубка, рисунок 1Е).
- Вставка канюли в целевую область мозга.
- Поместите обезьяну в экспериментальную кабину, ограничьте движение головы и очистите камеру записи, установленную на черепе, используя стандартные методы.
- Закрепите направляющую трубку на микроприводе. Вставьте инъекционную канюлю в направляющую трубку.
- Выдвигайте канюлю до тех пор, пока наконечник не выступит из направляющей трубки.
- Подключите запорный кран к электрическому воздушному насосу. Чтобы подтвердить правильную работу системы, вытолкните каплю векторного раствора из наконечника с помощью воздушного насоса и подтвердите движение масляно-векторного раствора мениска.
- Выведите канюлю ~ 5 мм в направляющую трубку, чтобы защитить ее от повреждений во время введения трубки в мозг. Вставьте направляющую трубку в мозг.
- Подведите канюлю к месту инъекции с помощью микродискурса. Определите целевой участок с помощью электрической записи (рисунок 2C) или стимуляции.
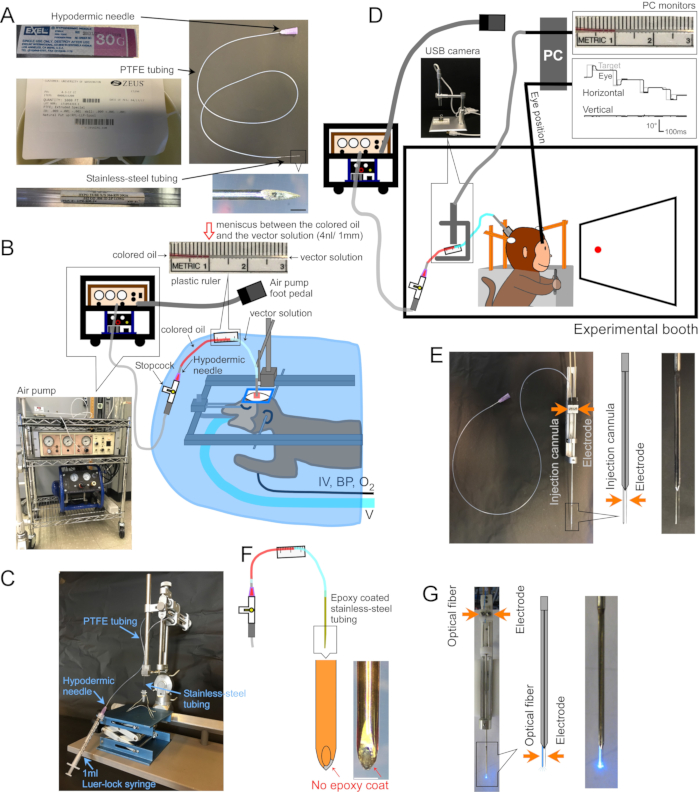
Рисунок 1: Установка хирургии и аппарата. (А) Инъекционная канюля. Показана каждая часть канюли. Вставка в правом нижнем углу: увеличенное изображение кончика канюли, шкала: 500 мкм. (B) Хирургическая установка для анестезируемых обезьян. Обезьяну помещают в стереотаксическую рамку под хирургическую драпировку. Вентилятор (V), внутривенная линия (IV), монитор артериального давления (BP) и монитор насыщения кислородом (O2) подключены к обезьяне. Инъекционная канюля вводится в целевую область с помощью стереотаксического микроманипулятора. Векторный раствор впрыскивается электрическим воздушным насосом (нижняя левая вставка, коричневый), соединенным с воздушным компрессором (нижняя левая вставка, синяя). Пластиковая линейка (верхняя вставка) приклеивается к трубке из PTFE для измерения движения мениска между цветным маслом (верхняя вставка, красная) и векторным раствором (верхняя вставка, прозрачная) во время инъекции. (C) Настройка для загрузки векторного раствора в канюлю. (D) Обезьяна во время инъекции векторного раствора в экспериментальной кабине. Голова животного удерживается на месте тремя стабилизирующими стойками, а положение глаз регистрируется склеральной системой поисковой катушки. Инъекционная канюля удерживается и приводится на целевую глубину с помощью микроэлектродного держателя/драйвера. Инъекция контролируется путем наблюдения за мениском между цветным маслом и векторным раствором через USB-камеру (вставное изображение). (E) Двуствольная направляющая трубка впрыска. Держатель/драйвер двуствольной направляющей трубки вмещает инъекционную канюлю и микроэлектрод (см. вставку). (F) Инжектор. Металл на кончике канюли, обнажаемый путем соскабливания эпоксидного слоя, обеспечивает электрический доступ к нейронам (вставка, шкала бара: 500 мкм). (G) Установка лазерной стимуляции. Двуствольный держатель/драйвер направляющей трубки вмещает как оптическое волокно, так и микроэлектрод (см. вставку). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
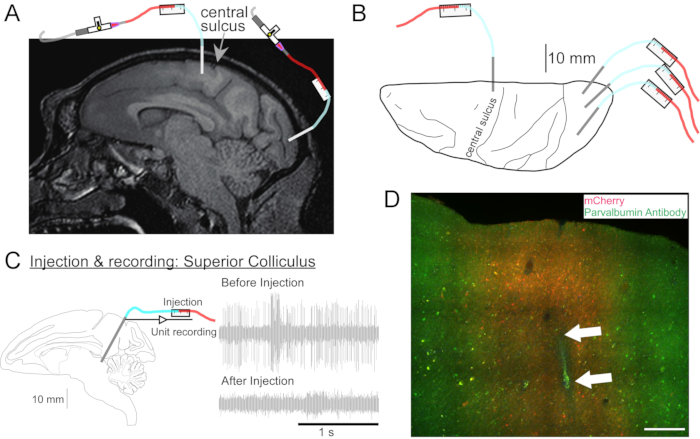
Рисунок 2: Диаграмма мест инъекций AAV. (A) Сагиттальный участок МР головного мозга, показывающий места инъекций в первичной моторной коре и первичной зрительной коре Макаки Неместрины. (B) Вид с дорсальной поверхности на соответствующей пластине Атласа, показывающей расположение канюли относительно центральной борозды (первичной моторной коры) и первичной зрительной коры. (C) Единица регистрации путем инъектрода в верхнюю колликулус. Блок, который был изолирован перед инъекцией (правый верх), исчез после инъекции (правый нижний). (D) Впрыскная дорожка (белые стрелки). Шкала: 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Обработка тканей головного мозга для гистологии
- Подождите 6-8 недель после инъекции, чтобы максимизировать экспрессию трансгенов.
ПРИМЕЧАНИЕ: Оптимальная продолжительность зависит от точного вирусного вектора, используемого в эксперименте. - Обработать мозг с помощью обычных гистологических методов для оценки эффективности трансдукции и селективности 5,6,7.
Результаты
Чтобы продемонстрировать трансгенную экспрессию путем стереотаксической инъекции in vivo в мозг NHP с использованием метода хирургической инъекции, описанного здесь, были выбраны два вектора, которые содержали энхансеры, управляющие экспрессией супержелтого флуоресцентного белка-2 (SYFP2) в различных нейронных типах 8,9. Вирусные векторы упаковывали в капсид PHP.eB10, очищали центрифугированием йодиксанола, а затем концентрировали до высокого титра (вирусные геномы >1E13 / мл), измеренного qPCR. Объем 0,5 мкл вводили на каждую из десяти глубин вдоль десяти дорожек через кору головного мозга для общего объема инъекции 5 мкл / дорожка. На рисунке 3A-C показана экспрессия SYFP2 через иммуноокрашивание анти-GFP через 113 дней после инъекции вектора AAV, специфичного для подкласса PVALB, CN2045, в первичную зрительную кору взрослого мужчины Macaca nemestrina. Трансген SYFP2 надежно обнаруживается в многочисленных непирамидных нейронах, разбросанных по глубине коры, и большинство нейронов, экспрессирующих SYFP2, также были иммунореактивными для PVALB7. На рисунке 3D показана нативная экспрессия SYFP2 в первичной моторной коре через 64 дня после инъекции вектора AAV, специфичного для подкласса нейронов L5, CN2251. Все нейроны, меченые SYFP2, имеют четкую пирамидальную морфологию с соматами, ограниченными слоем 5, и характерными толстыми апикальными дендритами. Эти данные однозначно демонстрируют точный контроль экспрессии трансгенов в отдельных популяциях неокортикальных нейронов в мозге NHP путем стереотаксической инъекции векторов AAV клеточного типа.
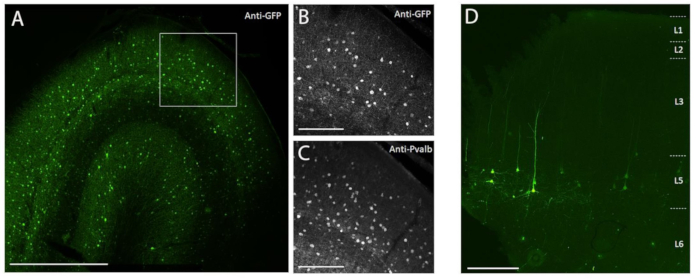
Рисунок 3: Пример специфической для типа клетки экспрессии SYFP2, опосредованной векторами AAV, введенными в мозг NHP. (A) Эпифлуоресцентная микрофотография фиксированного участка первичной зрительной коры макак через 113 дней после инъекции вектора AAV, специфичного для подкласса PVALB. Шкала: 1 мм. (В,С) Изображение с более высоким увеличением области в коробке, отображаемое в A. (B) Сигнал анти-GFP. (C) Анти-PVALB сигнал. Шкала баров: 250 мкм. (D) Эпифлуоресцентная микрофотография нативной флуоресценции SYFP2 в фиксированном срезе первичной моторной коры макак через 64 дня после инъекции экстрателенцецефального подклассового вектора AAV слоя 5. Шкала: 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Чтобы продемонстрировать полезность этой инъекционной техники для нейрофизиологических и поведенческих оптогенетических манипуляций, были проведены три эксперимента, каждый на отдельной обезьяне (Macaca mulatta). В первом эксперименте (рисунок 4A-D) векторы AAV, несущие трансген каналродопсин-2 (AAV1-hSyn1-ChR2-mCherry), вводили в левый верхний колликулус (SC). Вектор вводили каждые 250 мкм на 19 глубинах в общей сложности 12 мкл. Во втором эксперименте (рисунок 4E-G) 3 мкл раствора AAV1-hSyn-ArchT-EYFP вводили в ядро reticularis tegmenti pontis (NRTP). В третьем эксперименте (рисунок 4H-K) 24 мкл раствора AAV9-L7-ChR2-mCherry вводили в кору мозжечка6. Через шесть-восемь недель после каждой инъекции оптическое волокно и вольфрамовый электрод вводились в мозг через двуствольную направляющую трубку (рисунок 1G).
На рисунке 4B показан ответ нейрона SC на синий свет (450 нм). Непрерывный свет (1,2 с) при 40 мВт создавал серию последовательных потенциалов действия (рисунок 4B, вверху). Световые импульсы длительностью 1 мс не смогли вызвать потенциалы действия при 40 мВт (рисунок 4B, середина), но надежно вызывали потенциалы действия при 160 мВт, единственном другом проверенном уровне мощности, с задержкой 2,7 ± 0,6 мс (рисунок 4B, внизу). Импульсная передача (160 мВт, частота: 300 Гц, рабочий цикл: 15%, длительность: 300 мс) вызывала саккады последовательно со средней задержкой 97 ± 32 мс, средней амплитудой 10,4° и средним углом 47° (вверх и вправо; Рисунок 4C).
В соответствии с исследованиями, которые модифицировали усиление саккады с использованием подпороговой электрической стимуляции SC 11,12, оптическая стимуляция SC после 15°, 18° и 20° влево и вниз (225°) саккад постепенно уменьшала усиление саккады (рисунок 4D). Это снижение прироста потребовало ~ 250 испытаний (зеленые круги), чтобы вернуться к предадаптационному усилению (черные круги), подтверждая его основу в долгосрочной пластичности.
Во втором эксперименте (рисунок 4E) проекция мшистого волокна от NRTP к глазодвигательной вермисе (OMV) коры мозжечка (дольки VIc и VII) была оптически подавлена. На рисунке 4F показаны флуоресцентно меченые мшистые волокна и розетки в OMV (вставка). Желтый лазерный свет (589 нм) доставлялся в OMV через оптическое волокно, а близлежащий вольфрамовый электрод использовался для записи активности клеток Purkinje. На рисунке 4G показана простая пиковая активность до (серый) и после (оранжевый) оптогенетической инактивации проекций NRTP (рисунок 4G, вверху). Перед инактивацией клетка Пуркинье демонстрировала двойной паттерн всплеска для 12° правых саккад (рисунок 4G, средний, серый). Во время инактивации скорость стрельбы уменьшалась и изменялась на паттерн очередей-пауз (рисунок 4G, средний, оранжевый). Сравнение этих двух паттернов ответа предполагает, что вход мшистого волокна в клетки Пуркинье влияет на фазу замедления саккады, приводя во второй всплеск (рисунок 4G, средний, зеленый). Изменчивость саккад вправо была снижена во время оптогенетической инактивации, что согласуется с идеей о том, что некоторая изменчивость метрик саккады от испытания к испытанию обусловлена изменчивостью сигналов, переносимых мшистыми волокнами (рисунок 4G, дно, оранжевый).
В третьем эксперименте (рисунок 4H) клетки Пуркинье OMV стимулировали оптогенетически (рисунок 4I). Шлейф коротких световых импульсов (импульсы 1,5 мс, 65 мВт, 50 Гц) увеличивал простую пиковую активность изолированной ячейки Пуркинье (рисунок 4J, вверху). Отдельные световые импульсы 1,5 мс часто вызывали простой всплеск >1 (рисунок 4J, внизу). Оптогенетическая простая активация шипов, приуроченная к саккаде (световой импульс 10 мс, 60 мВт), увеличение амплитуды саккады (рисунок 4K), подтверждающая дезингибиторную роль клеток Пуркинье в генераторе глазодвигательных всплесков.
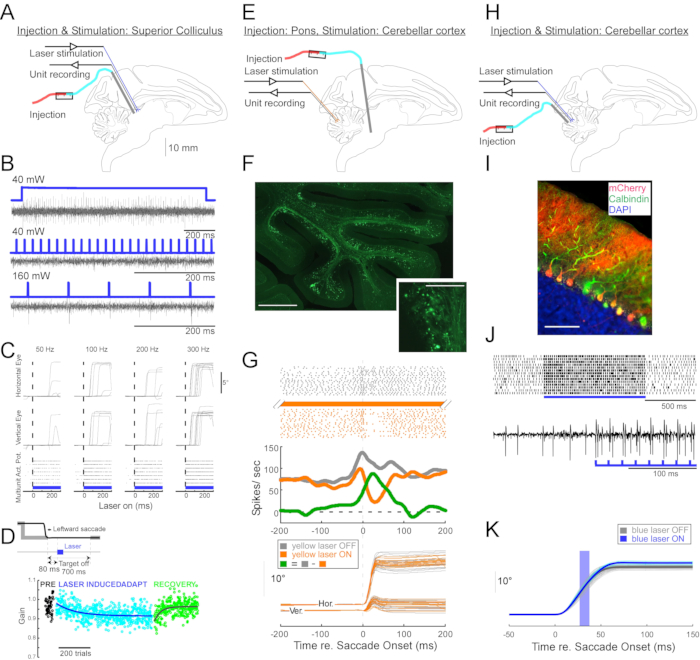
Рисунок 4: Краткое изложение трех оптогенетических экспериментов, выполненных на бодрствующих обезьянах. (A-D) Эксперимент 1, паннейрональное возбуждение: вирусная инъекция, лазерная стимуляция и запись единиц были проведены в верхнем колликуле (A). (B) Репрезентативная активность единицы, вызванная лазерной стимуляцией. (C), Горизонтальный (вверху) и вертикальный (средний) компоненты движений глаз и растровый график единичной активности (внизу), вызванный лазерной стимуляцией. (D) Репрезентативный сеанс адаптации саккады, индуцированный лазерной стимуляцией. Стимуляция (100 0,5-мс лазерных импульсов) доставлялась через 80 мс после каждой саккады (вставки). Усиление саккады (амплитуда саккады / амплитуда мишени) постепенно уменьшалось на протяжении всех испытаний. (Е-Г) Эксперимент 2, путь-специфическое ингибирование: вирусный вектор вводили в ядро reticularis tegmenti pontis, а лазерную стимуляцию и регистрацию единиц проводили в глазодвигательном вермисе (E). (F) Гистологический участок глазодвигательного вермиса, показывающий меченые мшистые волокна (шкала: 1 мм) и их розетки (вставка, шкала: 100 мкм). (G) Активность клеток Пуркинье (вверху: растр, середина: средняя скорость стрельбы) и траектории визуально управляемых саккад (внизу) с лазерной стимуляцией и без нее. Серый: лазер вне испытаний, оранжевый: лазер на испытаниях, зеленый: разница между серым и оранжевым. (Н-К) Эксперимент 3, клеточная типоспецифическая активация: вирусная инъекция, лазерная стимуляция и запись единиц были проведены в глазодвигательной вермисе (H). (I) Гистологический участок глазодвигательного вермиса, показывающий меченые клетки Пуркинье. Шкала: 100 мкм. (J) Простая пиковая активность клетки Пуркинье, вызванная лазерной стимуляцией. Вверху: растровый график из 14 испытаний. Внизу: трассировка напряжения из одного репрезентативного испытания. (K) Траектории визуально управляемых саккад с лазерной стимуляцией и без нее. Световой импульс 10 мс во время саккад увеличивал амплитуды саккады. Индивидуальные траектории саккады (голубой) и их средние (синие) на лазерных испытаниях. Отдельные траектории саккад (светло-серый) и их средние (темно-серые) на испытаниях с лазерным выключением. Длина волны света составляла 450 нм в экспериментах 1 и 3 и составляла 589 нм в эксперименте 2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Достижения в области оптогенетики NHP создали потребность в точных, надежных методах внутричерепной инъекции. Преимущества метода, описанного в этом отчете, заключаются в том, что он недорог, использует стерилизуемые и одноразовые компоненты и обладает способностью нацеливаться на различные области мозга любой глубины. Он также позволяет контролировать скорость и объем впрыска в силу скорости, с которой можно управлять воздушным клапаном. Давление воздуха может быть увеличено временно, чтобы выбить засор, а затем быстро уменьшено, чтобы избежать последующего перенапрыска, который будет вызван устойчивым давлением. Одноразовые компоненты снижают риск перекрестного загрязнения между местами инъекций.
Критические шаги в этом протоколе инъекции включают в себя строительство высококачественных канюль, загрузку их без введения пузырьков и выбор мест инъекции, которые не слишком близко друг к другу. Инъекции ≥1 см друг от друга обычно трансдуцируют непересекающиеся области, но эта эвристика зависит от вирусного серотипа, титра, промотора, объема, мишени и метода обнаружения. Выбор мест инъекций, которые не связаны напрямую, позволяет избежать потенциальных путаниц, возникающих в результате незаконного оборота опсина вдоль аксонов, и склонности некоторых серотипов AAV к ретроградной трансдукции.
Метод может быть использован для введения NHP во время анестезии и в стереотаксической рамке (рисунок 3) или предупредительной и фиксированной головой (рисунок 4). Преимущество первого заключается в том, что он позволяет направлять инъекции в стереотаксических координатах, и он позволяет визуально подтвердить проникновение канюли через острую дуротомию (разрезание твердой мозговой оболочки у бодрствующей обезьяны через хроническую трепанацию черепа повышает риск заражения). Последний подход имеет преимущества в уменьшении количества операций по выживанию и, следовательно, стресса для животного, будучи совместимым с электрофизиологическими записями во время поведения и используя ту же координатную рамку и приборы, используемые для вставки оптических волокон для экспериментов после инъекций. Техника инъекций у бодрствующих обезьян может быть дополнительно улучшена путем инъекций через искусственную твердую мозговую оболочку 13,14,15. Это даст дополнительные преимущества прямой визуализации мест инъекций и флуоресценции тканей, что указывает на успешную трансдукцию.
Несколько других методов инъекции AAV были использованы в NHP. Недавно было разработано многоканальное инъекционное устройство для равномерной доставки векторов AAV в большие корковые области NHP16. Аналогичные результаты можно получить, используя конвекционно-усиленную доставку17,18. Эти методы направлены на максимизацию распространения трансдукции, что является важной целью, но отличается от пространственной точности, которую стремится достичь наш метод.
Другим альтернативным методом является введение векторов AAV через боросиликатную трубку, которая скошена до острого наконечника на одном конце и прикреплена к шприцу Гамильтона на другом 5,6. Этот метод имеет много общего с методом, описанным в данной статье. Вирусный вектор удерживается в длине трубки, пространство в трубке за вирусом заполняется окрашенным маслом, а поток вектора контролируется через движение мениска масляного вектора. Этот альтернативный метод требует меньшего оборудования и подготовки, но он требует втягивания масла в боросиликатную трубку через скошенный наконечник под отрицательным давлением и последующей загрузки вектора по тому же маршруту. Это неизбежно приводит к следам масла, доставляемого в мозг. Кроме того, по нашему опыту, боросиликатная трубка должна иметь диаметр ~ 350 мкм, чтобы проникать в твердую мозговую оболочку даже при скошенном состоянии и, следовательно, наносить большие механические повреждения, чем более тонкая металлическая канюля, описанная в этой статье (рисунок 2D). Трубка 30 G была использована, потому что ее критическая нагрузка на изгиб достаточно высока, чтобы опосредовать проникновение твердой мозговой оболочки, несмотря на длину 1-10 см, потому что она плотно прилегает к трубке из PTFE и потому что она редко становится затрудненной. Трубка 33 G засоряется и изгибается легче и ее труднее соединить с трубкой из PTFE. Трубка 36 G недостаточно жесткая, чтобы проникнуть в тяжелую оболочку NHP.
Другой альтернативный метод впрыска заключается в сопряжении выхода воздушного насоса с задней частью векторной стеклянной пипетки19. Вектор выталкивается из наконечника пипетки прямым, прерывистым давлением воздуха из насоса, устраняя необходимость в масле. Подобно однотрубному методу, описанному выше, отсутствие каких-либо материальных соединений между мениском и кончиком канюли снижает риск утечек. Однако острый конус и тонкие кончики стеклянных пипеток не позволяют им проникать в твердую мозговую оболочку NHP или нацеливаться на глубокие структуры.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано грантами WaNPRC/ITHS P51OD010425 (JTT), Национальным институтом здравоохранения (NIH) EY023277 (R01 для YK), EY030441 (R01 для GH), MH114126 (RF1 для JTT, Boaz Levi, Ed Lein), MH120095 (UG3 для JTT и GH), EY028902 (R01 для RS) и стало возможным благодаря грантам NIH OD010425 (P51 для WaNPRC) и Исследовательскому фонду A148416 Вашингтонского университета. Авторы хотели бы поблагодарить Ясмин Эль-Шамайле и Викторию Омстед за гистологию, Рефуджио Мартинеса за клонирование вирусных векторов и Джона Мича за помощь в обработке тканей мозга NHP.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment: Stereotaxic set | |||
| Item | |||
| Allen keys | BONDHUS | 10936 | STERRAD |
| Cannula holder | KOPF | 1770 | STERRAD |
| Carrier (manipulator) | KOPF | 1404 | STERRAD |
| Carrier platform | KOPF | 1430 | NA |
| Carrier stand | KOPF | 1449 | STERRAD |
| Eye, ear, mouth bars | KOPF | 1430 | NA |
| Stereotaxic base | KOPF | 1210 | NA |
| Equipment: Cannula | |||
| Item | |||
| 1 mL Luer-lock syringes | BD | 309628 | NA (sterilized package) |
| Cannulas* | (homemade - see below) | NA | steam (autoclave) |
| Colored oil** | (homemade - see below) | NA | NA |
| Elevator (for tube rack) | Cole-Parmer | UX-08057-10 | STERRAD |
| Filter tip | Genesee Scientific | 23-404 | NA (sterilized package) |
| Fluorescent microbeads | Lumafluor | R170 | NA |
| P20 pipetman | Gilson | FA10003M | NA |
| PCR tubes | Olympus Plastics | 22-161 | STERRAD |
| Stopcock | Cole-Parmer | 3060004 | STERRAD |
| Tube rack | homemade | NA | STERRAD |
| Vector solution | (homemade) | NA | NA |
| Equipment: Electric air pump set | |||
| Item | |||
| Electric air pump | World Precision Instruments | PV830 | NA |
| Foot pedal | World Precision Instruments | 3260 | NA |
| Tube cover | EZ Drape | A400-1000 | NA (sterilized package) |
| Equipment: General surgery tools | |||
| Item | |||
| Beaker | MEDLINE | azlon | STERRAD |
| Burrs | STRYKER | 277-10-235 | STERRAD |
| Double pronged tissue pick | Fine Science Tools | 18067-11 | STERRAD |
| Drapes | MEDLINE | DYNJP3004 | NA (sterilized package) |
| Dressing forceps | Miltex | 6-118 | STERRAD |
| Drill | STRYKER | Q9R-5400 | NA |
| Drill bits | STRYKER | 277-82-87 | STERRAD |
| Gauze | MEDLINE | NON26334 | NA (sterilized package) |
| Hemostatic mosquito forceps | Miltex | 7-2, 7-4 | STERRAD |
| Light handles | SKYTRON | Stellar XL | STERRAD |
| Needle hodler | Miltex | 8-2 | STERRAD |
| Periosteal elevator | Miltex | 18-1968 | STERRAD |
| Rongeurs | Miltex | 17-4800 | STERRAD |
| Saline | BAXTER | 2F7122 | STERRAD |
| Scalpel | Bard-Parker | 372610 | STERRAD |
| Scissors | Miltex | 5-12, 5-114 | STERRAD |
| Senn retractors | Miltex | 28065 | STERRAD |
| Sterile gloves | MEDLINE | Triumph Micro | NA (sterilized package) |
| Suction | medela | 200-4869 | NA |
| Suction tip | MEDLINE | DYNDFR12S | NA (sterilized package) |
| Suction tube | COVIDEN | 8888301614 | NA (sterilized package) |
| Surgical gowns | MEDLINE | DYNJP2002S | NA (sterilized package) |
| Surgical pens & ruler | MEDLINE | DYNJSM03 | NA (sterilized package) |
| Suture | COVIDEN | SL-635 | NA (sterilized package) |
| Tissue forceps | Miltex | 6-114 | STERRAD |
| Towel clamps | Miltex | 7-504 | STERRAD |
| Wood swabs | MEDLINE | MDS202095 | NA (sterilized package) |
| Equipment: *cannulas | |||
| Item | |||
| Hypodermic needle | EXELINT INTERNATIONAL | 26437 | NA (sterilized package) |
| Stainless steel tube | K-TUBE | K30R | NA |
| PTFE tube | ZEUS | 216200 | NA |
| Equipment: **colored oil | |||
| Item | |||
| Liquid Candle Dye Concentrate | PremiumCraft | Red/Pink | NA |
| Mineral oil | Vi-Jon | S0883 | NA |
| STERRAD: low-temperature hydrogen peroxide gas plasma |
Ссылки
- Kojima, Y., Robinson, F. R., Soetedjo, R. Cerebellar fastigial nucleus influence on ipsilateral abducens activity during saccades. Journal of Neurophysiology. 111 (8), 1553-1563 (2014).
- Kojima, Y., Soetedjo, R. Elimination of the error signal in the superior colliculus impairs saccade motor learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (38), 8987-8995 (2018).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effects of GABA agonist and antagonist injections into the oculomotor vermis on horizontal saccades. Brain Research. 1366, 93-100 (2010).
- Kojima, Y., Soetedjo, R., Fuchs, A. F. Effect of inactivation and disinhibition of the oculomotor vermis on saccade adaptation. Brain Research. 1401, 30-39 (2011).
- De, A., El-Shamayleh, Y., Horwitz, G. D. Fast and reversible neural inactivation in macaque cortex by optogenetic stimulation of GABAergic neurons. eLife. 9, 52658(2020).
- El-Shamayleh, Y., Kojima, Y., Soetedjo, R., Horwitz, G. D. Selective optogenetic control of Purkinje cells in monkey cerebellum. Neuron. 95 (1), 51-62 (2017).
- Mich, J. K., et al. Functional enhancer elements drive subclass-selective expression from mouse to primate neocortex. Cell Reports. 34 (13), 108754(2021).
- Graybuck, L. T., et al. Enhancer viruses for combinatorial cell subclass-specific labeling. Neuron. (21), 00159(2020).
- Michel, J., Benninger, D., Dietz, V., van Hedel, H. J. Obstacle stepping in patients with Parkinson's disease. Complexity does influence performance. Journal of Neurology. 256 (3), 457-463 (2009).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Kaku, Y., Yoshida, K., Iwamoto, Y. Learning signals from the superior colliculus for adaptation of saccadic eye movements in the monkey. Journal of Neuroscience. 29 (16), 5266-5275 (2009).
- Soetedjo, R., Fuchs, A. F., Kojima, Y. Subthreshold activation of the superior colliculus drives saccade motor learning. Journal of Neuroscience. 29 (48), 15213-15222 (2009).
- Kleinbart, J. E., et al. A modular implant system for multimodal recording and manipulation of the primate brain. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual International Conference. 2018, 3362-3365 (2018).
- Arieli, A., Grinvald, A., Slovin, H. Dural substitute for long-term imaging of cortical activity in behaving monkeys and its clinical implications. Journal of Neuroscience Methods. 114 (2), 119-133 (2002).
- Ruiz, O., et al. Optogenetics through windows on the brain in the nonhuman primate. Journal of Neurophysiology. 110 (6), 1455-1467 (2013).
- Fredericks, J. M., et al. Methods for mechanical delivery of viral vectors into rhesus monkey brain. Journal of Neuroscience Methods. 339, 108730(2020).
- Bankiewicz, K. S., et al. Convection-enhanced delivery of AAV vector in parkinsonian monkeys; in vivo detection of gene expression and restoration of dopaminergic function using pro-drug approach. Experimental Neurology. 164 (1), 2-14 (2000).
- Yazdan-Shahmorad, A., et al. Widespread optogenetic expression in macaque cortex obtained with MR-guided, convection enhanced delivery (CED) of AAV vector to the thalamus. Journal of Neuroscience Methods. 293, 347-358 (2018).
- Nathanson, J. L., Yanagawa, Y., Obata, K., Callaway, E. M. Preferential labeling of inhibitory and excitatory cortical neurons by endogenous tropism of adeno-associated virus and lentivirus vectors. Neuroscience. 161 (2), 441-450 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены