Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование постнатальной электропорации in vivo для изучения морфологии нейронов мозжечковых гранул и развития синапсов
В этой статье
Erratum Notice
Резюме
Здесь мы описываем метод визуализации синаптогенеза гранулярных нейронов в мозжечке мыши в течение периода постнатального развития мозга, когда эти клетки уточняют свои синаптические структуры и образуют синапсы, чтобы интегрироваться в общую цепь мозга.
Аннотация
Нейроны претерпевают динамические изменения в своей структуре и функционируют во время развития мозга, образуя соответствующие связи с другими клетками. Мозжечок грызунов является идеальной системой для отслеживания развития и морфогенеза одного типа клеток, мозжечкового гранулярного нейрона (CGN), во времени. Здесь in vivo была использована электропорация предшественников гранулярных нейронов в развивающемся мозжечке мыши для редкой маркировки клеток для последующего морфологического анализа. Эффективность этого метода продемонстрирована в его способности демонстрировать ключевые стадии развития созревания CGN с особым акцентом на формирование дендритных когтей, которые представляют собой специализированные структуры, в которых эти клетки получают большую часть своих синаптических входов. В дополнение к предоставлению снимков синаптических структур CGN на протяжении всего развития мозжечка, этот метод может быть адаптирован для генетического манипулирования гранулярными нейронами клеточно-автономным образом для изучения роли любого интересующего гена и его влияния на морфологию CGN, развитие когтей и синаптогенез.
Введение
Развитие мозга - это длительный процесс, который простирается от эмбриогенеза до постнатальной жизни. В течение этого времени мозг интегрирует комбинацию внутренних и внешних стимулов, которые формируют проводку синапсов между дендритами и аксонами, чтобы в конечном итоге направлять поведение. Мозжечок грызунов является идеальной модельной системой для изучения того, как развиваются синапсы, потому что развитие одного типа нейронов, мозжечкового гранулярного нейрона (CGN), можно отслеживать, когда он переходит от клетки-предшественника к зрелому нейрону. Отчасти это связано с тем, что большая часть коры мозжечка развивается постнатально, что позволяет легко проводить генетические манипуляции и маркировку клеток после рождения1.
У млекопитающих дифференцировка CGN начинается в конце эмбрионального развития, когда подмножество пролиферативных клеток в заднем мозге мигрирует через ромбическую губу, образуя вторичную зародышевую зону на поверхности мозжечка 2,3,4. Несмотря на то, что они полностью привержены идентичности предшественника гранулярных нейронов (GNP), эти клетки продолжают пролиферировать во внешней части внешнего слоя гранул (EGL) до 14-го дня после рождения (P14). Пролиферация этого слоя приводит к массивному расширению мозжечка, поскольку эти клетки дают начало исключительно CGN5. Как только новорожденные CGN выходят из клеточного цикла в EGL, они мигрируют внутрь к внутреннему слою гранул (IGL), оставляя после себя аксон, который раздваивается и перемещается в молекулярном слое мозжечка, образуя параллельные волокна, которые синапсы на клетках Пуркинье6. Положение этих волокон в молекулярном слое зависит от времени выхода из клеточного цикла.
CGN, которые дифференцируются первыми, оставляют свои параллельные волокна к нижней части молекулярного слоя, тогда как аксоны CGN, которые дифференцируются позже, группируются в верхнейчасти 7,8. Как только клеточные тела CGN достигают IGL, они начинают развивать дендриты и образовывать синапсы с близлежащими тормозными и возбуждающими нейронами. Зрелое дендритное дерево CGN демонстрирует стереотипную архитектуру с четырьмя основными процессами. В ходе созревания CGN структуры на концах этих дендритов образуют коготь, который обогащается постсинаптическими белками 9,10. Эти специализированные структуры, называемые дендритными когтями, содержат большинство синапсов на гранулярных нейронах и важны для получения как возбуждающих входов от иннерваций мшистых волокон, происходящих из моста, так и ингибирующих входов от местных клеток Гольджи. После полной настройки синаптические связи CGN позволяют этим клеткам передавать входные сигналы от предмозжечковых ядер к клеткам Пуркинье, которые проецируются из коры мозжечка в глубокие ядра мозжечка.
Постнатальная электропорация GNP in vivo является преимуществом по сравнению с другими методами, основанными на маркировке, такими как вирусная инфекция и генерация трансгенных линий мышей, поскольку экспрессия желаемых конструкций может быть достигнута в короткие сроки, и метод нацелен на небольшую популяцию клеток, что полезно для изучения клеточно-автономных эффектов. Этот метод использовался в предыдущих исследованиях для изучения морфологического развития CGN; Однако эти исследования были сосредоточены либо на одном моменте времени, либо на коротком промежутке времени 9,10,11,12,13. Этот метод маркировки был сопряжен с анализом изображений для документирования изменений в морфологии CGN, которые происходят на протяжении всего периода дифференцировки CGN в течение первых трех недель постнатальной жизни. Эти данные раскрывают динамику развития дендритов CGN, лежащих в основе построения мозжечковых контуров.
протокол
ПРИМЕЧАНИЕ: Все процедуры были выполнены в соответствии с протоколами, утвержденными Институциональным комитетом по уходу за животными и их использованию (IACUC) Университета Дьюка.
1. Подготовка ДНК для электропорации in vivo или IVE (за 1 день до операции)
- Соберите следующие материалы: очищенную ДНК (0,5-25 мкг на животное), 3 М ацетат натрия, этанол, краситель Fast Green, сверхчистую дистиллированную воду, фосфатный буферный раствор (PBS) (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Для ДНК конструкция, экспрессирующая зеленый флуоресцентный белок (GFP) под человеческим промотором убиквитина, была получена из Addgene (FUGW, https://www.addgene.org/14883/). Любая конструкция, экспрессирующая GFP или другой флуоресцентный белок под контролем вездесущего промотора, должна работать. CGN-специфическая маркировка с помощью этого метода зависит не от конструкции, а скорее от электропорации. - Подготовьте ДНК к электропорации, смешав желаемое количество ДНК, 10% по объему 3 М ацетата натрия и 250% по объему 100% ледяного этанола. Обратите внимание, что ДНК немедленно выпадет в осадок из раствора.
- Продолжайте осаждать смесь ДНК в течение ночи при -20 ° C или в течение часа при -80 ° C.
- Гранулы осаждают ДНК в настольной центрифуге в концентрации >16 000 × г и дважды промывают 70% этанолом.
- Дайте гранулам ДНК полностью высохнуть и восстановите их в 1x PBS + 0,02% растворе Fast Green.

Рисунок 1: Ограничение глубины впрыска до 1,5 мм с помощью прокладки. (A) Сегмент диаметром 11,2 мм отрезается от загрузочной пипетки с помощью бритвенного лезвия. (B) Прокладка устанавливается на наконечник шприца Hamilton (общая длина составляет 1,27 см или 0,5 дюйма) и закрепляется либо клеем, либо парапленкой. Открытый наконечник должен быть 1,5 мм в длину. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Электропорация предшественников гранулярных нейронов in vivo у семидневных постнатальных мышей
ПРИМЕЧАНИЕ: Все операции по электропорации проводились в стерильном хирургическом отделении с высокой вентиляцией, и весь персонал носил полные средства индивидуальной защиты, включая перчатки, маску для лица, чепчик для волос, халат и бахилы. Кроме того, операции могут проводиться в вентилируемом и стерильном капюшоне.
- Соберите следующие материалы: ДНК для электропорации, небольшие хирургические ножницы, небольшие хирургические пинцеты, индивидуальный шприц Hamilton, аппликатор с ватным наконечником, грелка, бетадин, 70% этанол, 1x PBS, парапленка, тканевый клей (цианоакрилат н-бутилового эфира), изофлуран, электропоратор и электроды пинцетного типа (см. Таблицу материалов).
- Отрежьте прокладку от стерилизованного загрузочного наконечника, чтобы она поместилась над шприцем Hamilton, чтобы ограничить глубину впрыска до 1.5 мм (рис. 1A, B). Закрепите прокладку клеем или парапленкой.
- Анестезируют щенка P7 в изофлурановой камере со скоростью доставки 0,8 л/мин. Подтвердите полную анестезию, наблюдая за животным на предмет снижения дыхания и отсутствия реакции на ущипывание пальца ноги или хвоста (рис. 2A).
- После того, как животное будет полностью обезболено, поместите щенков на пьедестал, оснащенный носовым конусом, доставляя постоянный 4% изофлуран со скоростью доставки 0,8 л / мин. Очистите верхнюю часть головы щенка 3 раза стерильным тампоном бетадина, затем 70% этанола, чередуя их, чтобы подготовить место. Дайте раствору высохнуть, прежде чем продолжить.
- Используя стерилизованные ножницы, сделайте небольшой разрез с одним разрезом, который охватывает расстояние от верхней части до основания ушей, чтобы открыть задний мозг (рис. 2B).
- Найдите мозжечок (рис. 2C), вставьте открытый наконечник шприца Гамильтона через череп, перпендикулярно мозгу, и введите 1,5 мкл смеси ДНК в паренхиму мозжечка, медленно нажимая на задний поршень шприца. После доставки смеси ДНК медленно потяните иглу назад, чтобы предотвратить обратный разлив, и дайте раствору ДНК диффундировать в течение 30 с.
- Выключите изофлуран и поместите щенка на грелку с температурой 37 °C. Подготовьте электрод пинцетного типа к электропорации, погрузив оба конца в стерильный 1x PBS.
ПРИМЕЧАНИЕ: Смачивание электрода пинцетного типа предотвратит контактные ожоги кожи щенка во время введения электрических импульсов. - Направьте пинцет-электрод над местом инъекции плюсовым концом вниз, а отрицательным — над головой животного (рис. 2D). Подайте пять электрических импульсов от электропоратора со следующими настройками: межимпульсный интервал 50 мс, 130 В и 950 мс.
ПРИМЕЧАНИЕ: При необходимости выполните пробную инъекцию, чтобы убедиться, что место инъекции расположено на червях мозжечка (рис. 2E). - Зажмите разрез и запечатайте рану нетоксичным тканевым клеем на основе цианоакрилата н-бутилового эфира. Очистите рану 70% этанолом, так как любое следовое количество крови увеличивает вероятность родительского детоубийства и каннибализма.
- Дайте животному восстановиться на грелке с температурой 37 °C, прежде чем возвращать щенка на плотину. Наблюдайте за щенком каждые 30 минут в течение не менее 2 часов после операции, чтобы обеспечить полное выздоровление.
ПРИМЕЧАНИЕ: Детоубийство одним из родителей является довольно распространенным явлением. Чтобы предотвратить каннибализм, поместите отца в другую клетку перед началом электропорации и всегда возвращайте очищенных и восстановленных щенков (т. е . без пятен крови, полностью подвижных) в исходную клетку на оригинальной подстилке. Щенков также можно протирать пометом из оригинальной клетки, чтобы свести к минимуму запах крови. Использование суррогатной плотины может быть необходимо, если первоначальная плотина продолжает пожирать своих детенышей.
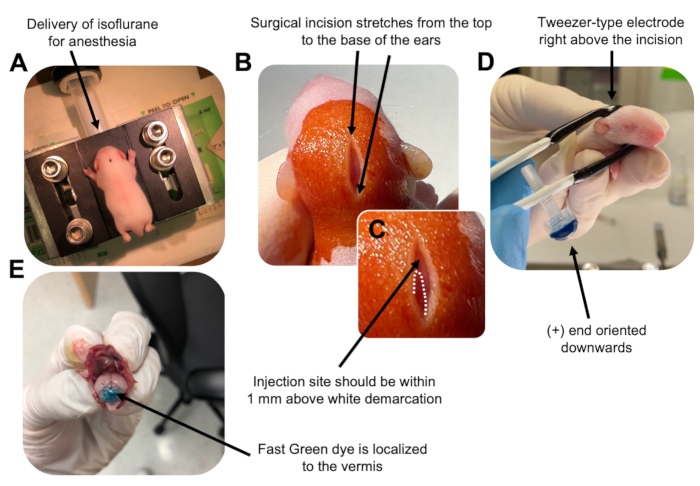
Рисунок 2: Электропорация мозжечка in vivo предшественников гранулярных нейронов у детенышей мышей дикого типа P7. (A) Детенышей анестезируют 4% изофлураном, доставляемым со скоростью 0,8 л / мин, чтобы обеспечить анестезию на протяжении всей инъекции раствора ДНК. Изофлуран доставляется со скоростью 0,8 л/мин. (B) После 3-кратной стерилизации мыши бетадином и 70% этанолом делается разрез, который охватывает расстояние до ушей, обнажая задний мозг. (C) Увеличенное изображение белого разграничения на черепе, ориентира для места инъекции. Конструкцию ДНК следует вводить в пределах 1 мм выше отметки; Пунктирными линиями обозначена демаркация, а черной стрелкой обозначено место инъекции. Гребни червя мозжечка могут быть видны и могут быть полезны для поиска места инъекции. (D) Ориентация электрода пинцетного типа для эффективной электропорации. Плюс (+) конец должен быть ориентирован вниз, чтобы втянуть отрицательно заряженную ДНК в паренхиму мозжечка перед введением электрических импульсов. (E) Тестовая инъекция 1 мкл 0,02% красителя Fast Green показывает, что инъекция локализуется в середине червя мозжечка между дольками 5-7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Иммуногистохимия электропорированных ХГН
- Соберите следующие материалы: изофлуран, 1x PBS, 4% параформальдегид (PFA), 30% сахарозы, нормальная козья сыворотка, неионогенное моющее средство, предметные стекла, стеклянные покровные стекла, лак для ногтей, монтажные материалы, ядерный краситель Hoechst и соответствующие первичные и вторичные антитела (см. Таблицу материалов).
- Обезболите подопытное животное изофлураном и подтвердите полную анестезию защемлением пальца ноги и хвоста.
- Выполните транскардиальную перфузию, медленно вводя 1x PBS и 4% PFA в левый желудочек сердца животного. Дайте крови стечь животному, разрезав полую вену.
- Зафиксируйте мозг на ночь, погрузив его в 4% PFA при 4 ° C. На следующий день быстро промойте мозг 1x PBS и переведите мозг в 30% сахарозу в 1x PBS для криозащиты в течение не менее 24 часов.
- При необходимости разрежьте мозг пополам вдоль рострально-каудальной оси и подтвердите экспрессию трансфицированной репортерной конструкции с помощью вертикального флуоресцентного препарирующего микроскопа.
ПРИМЕЧАНИЕ: Держите мозг погруженным в 1x PBS в небольшой посуде, чтобы предотвратить его высыхание. - Установите мозг на замораживающий микротом, нарежьте сагиттальные срезы размером 25 мкм и дайте срезам развернуться в смеси 1: 1 из 1x PBS и глицерина.
ПРИМЕЧАНИЕ: Срезы можно хранить в этом растворе криопротектора при температуре -20 °C для длительного хранения. - Промойте срезы три раза в 1x PBS в течение 10 мин каждый, чтобы удалить криопротектор, и заблокируйте ткань в 1x PBS + 10% нормальной козьей сыворотки + 0,2% неионогенного моющего средства на орбитальном шейкере при комнатной температуре в течение 1 часа.
- Приготовьте первичный раствор антител: 1x PBS, 10% нормальная козья сыворотка, 0,2% неионогенное моющее средство и антитело против GFP и центрифугируйте раствор в течение 5 минут при >16 000 × г. Инкубируют срезы в растворе антител при 4 °С на орбитальном шейкере в течение 48 ч.
- Смойте раствор первичных антител в течение 15 мин пять раз 1x PBS + 0,2% неионогенным моющим средством.
- Приготовьте раствор вторичных антител: 1x PBS, 10% нормальная козья сыворотка, 0,2% неионогенное детергент и соответствующее вторичное антитело для обнаружения GFP; центрифугируют раствор при >16 000 × г. Инкубируют срезы в растворе антител на орбитальном шейкере при комнатной температуре в течение 2-3 ч. Защищайте срезы от воздействия света, чтобы предотвратить обесцвечивание.
- Смойте раствор вторичных антител три раза 1x PBS + 0,2% неионогенным моющим средством в течение 15 мин каждый раз. Инкубируйте срезы в 1x PBS + Hoechst в течение 5 минут, чтобы окрасить ядра.
- Смойте раствор Hoechst 1x неионогенным моющим средством PBS + 0,2% и установите на предметные стекла. Накройте секции монтажным материалом, закройте слайды и запечатайте слайд лаком для ногтей, чтобы предотвратить испарение.
4. Морфологический анализ CGN - трехмерная (3D) реконструкция и площадь поверхности и клеточный объем
- Изображение одиночных электропорированных CGN на конфокальном микроскопе с 63-кратным объективом с 2-кратным увеличением, получение изображений z-стека со скоростью 0,5 мкм на стек. Изображение по одной ячейке в окне изображения, чтобы упростить анализ и реконструкцию изображения.
- Установите подключаемый модуль Simple Neurite Tracer для FIJI, используя следующую ссылку (https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions), чтобы легко и эффективно отслеживать структуру электропорированных CGN в трехмерном (3D) пространстве.
ПРИМЕЧАНИЕ: Существует обновленная версия плагина (https://imagej.net/SNT). - Анализируйте длину нейритов и образование дендритных когтей вслепую с помощью Simple Neurite Tracer. Загрузите одноканальные z-stack изображения электропорированных CGN на FIJI и нажмите « Плагины» | Сегментация | Простой индикатор нейритов (рис. 3D).
- Откройте выпадающее меню и выберите Create New 3D Viewer (рисунок 3D).
- Прокрутите до основания дендрита, где он соединяется с клеточной сомой и начните путь, нажав на соединение. Вручную проведите трассировку пути, щелкнув участки, где сигнал заполнения ячейки наиболее яркий, нажав [y], чтобы сохранить трассировку. Проследите до конца дендрита, если он не содержит когтя, или до основания когтя и подтвердите путь, нажав [f] (рис. 4D).
- Затем проследите коготь, начав путь у основания конструкции и проследив до конца самого длинного нейрита. Для трассировки вторичных и третичных ветвей нажмите на путь, удерживая нажатой клавишу [ctrl] в Windows или [alt] в Mac OS. Подтвердите путь, нажав [f].
- Обратите внимание, что измерения следов видны на отдельном окне; Сложите все измерения ветвей когтей (первичные, вторичные, третичные), чтобы получить общую длину каждого когтя.
- Для анализа площади поверхности и ячеистого объема электропорированных CGN загрузите программное обеспечение для анализа клеток Imaris (https://imaris.oxinst.com/).
ПРИМЕЧАНИЕ: FIJI также можно использовать для реконструкции ячеек в 3D из изображений z-stack с использованием легкодоступных и бесплатных плагинов. Кроме того, в Simple Neurite Tracer есть функция объемного рендеринга, но Imaris использовался по причинам, изложенным ниже. - Загрузите z-stack изображение электропорированного CGN на Imaris. Чтобы получить доступ к набору инструментов 3D-реконструкции, нажмите Surpass.
- Чтобы восстановить CGN, нажмите клавишу «Поверхности» и выберите интересующую область, охватывающую всю ячейку в окне изображения. Когда закончите, нажмите синюю стрелку вперед в правом нижнем углу в разделе «Создать».
- Если изображение содержит несколько каналов для разных сигналов, выберите канал, содержащий электропорированную CGN, и нажмите синюю стрелку вперед.
- С помощью ползунка установите нужный порог, который наиболее точно соответствует сигналу электропорированной ячейки. Увеличьте масштаб ближе к поверхности ячейки, чтобы точно определить порог. После завершения нажмите двойную зеленую стрелку, чтобы реконструировать ячейку и получить площадь поверхности и размер тома из метаданных.
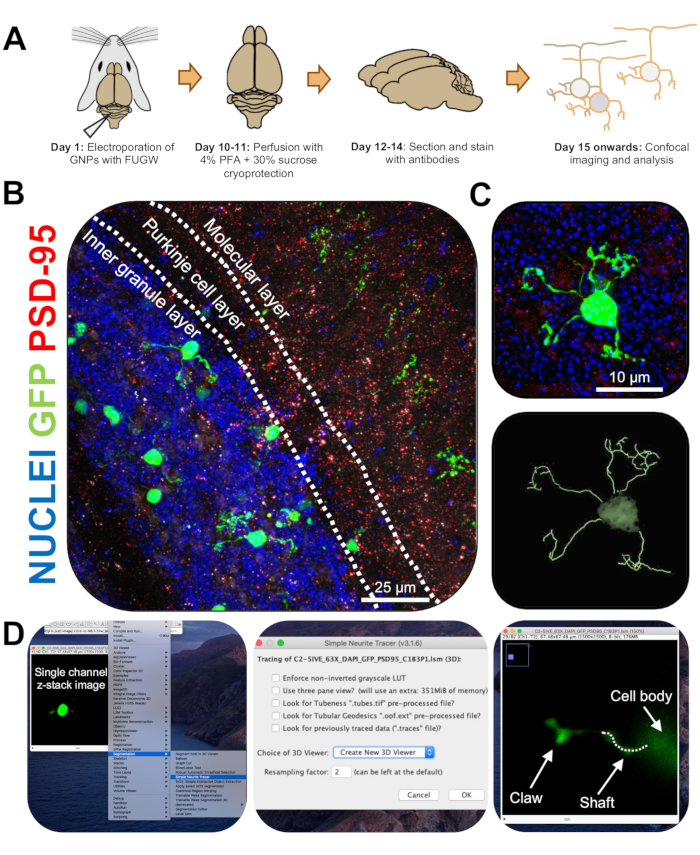
Рисунок 3: Иммуногистохимический анализ и трехмерная реконструкция электропорированных гранулярных нейронов. Мышей P7 CD-1 подвергали электропорации конструкцией, экспрессирующей GFP. Мозг был собран и подвергнут иммуногистохимии, конфокальной микроскопии и 3D-реконструкции для морфологического анализа. (A) Временная шкала от электропорации до обработки изображений мыши с разрешением 10 точек на дюйм. (B) Максимальное проекционное изображение сагиттального поперечного сечения электропорированного мозжечка 10-DPI; Белые линии разграничивают мозжечковые слои, а масштабная линейка составляет 25 мкм. (C) Максимальное проекционное изображение одного электропорированного гранулированного нейрона 10-DPI и соответствующего 3D-следа, масштабная линейка составляет 10 мкм. (D) 3D-реконструкции были сгенерированы с помощью плагина FIJI Simple Neurite Tracer. Все измерения были прослежены через z-стек по сигналу заполнения ячейки. Измерения ствола и когтя были прослежены отдельно для каждого дендрита; Пунктирная линия обозначает часть дендрита в текущей плоскости. Сокращения: 3D = трехмерный; GFP = зеленый флуоресцентный белок; DPI = дни после инъекции; PSD-95 = белок постсинаптической плотности 95; GNP = предшественники гранулярных нейронов; PFA = параформальдегид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
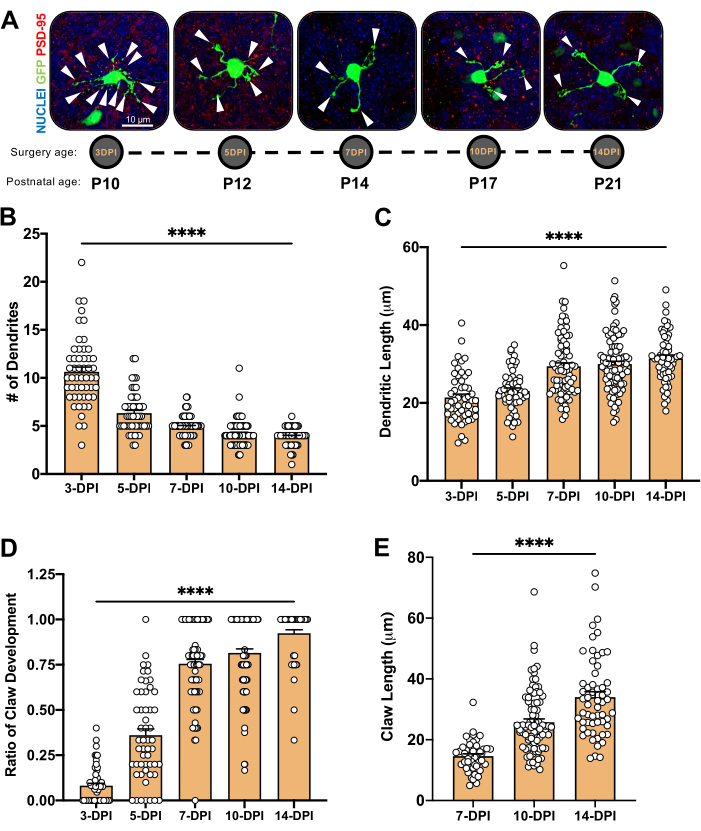
Рисунок 4: Анализ морфологии гранулярных нейронов в процессе развития мозжечка. (A) Максимальные проекционные изображения электропорированных CGN от 3 до 14 точек на дюйм (постнатальный возраст от P10 до P21), яде...
Обсуждение
Мозжечковые гранулярные нейроны являются наиболее распространенными нейронами в мозге млекопитающих, составляя почти 60-70% от общей популяции нейронов в мозге грызунов 1,14. Мозжечок широко использовался для выяснения механизмов клеточной пролиферации, ?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Работа была поддержана грантами NIH R01NS098804 (A.E.W.), F31NS113394 (U.C.) и Летней программой неврологии Университета Дьюка (D.G.).
Материалы
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions | |
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
Ссылки
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Erratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 4/06/2023. Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
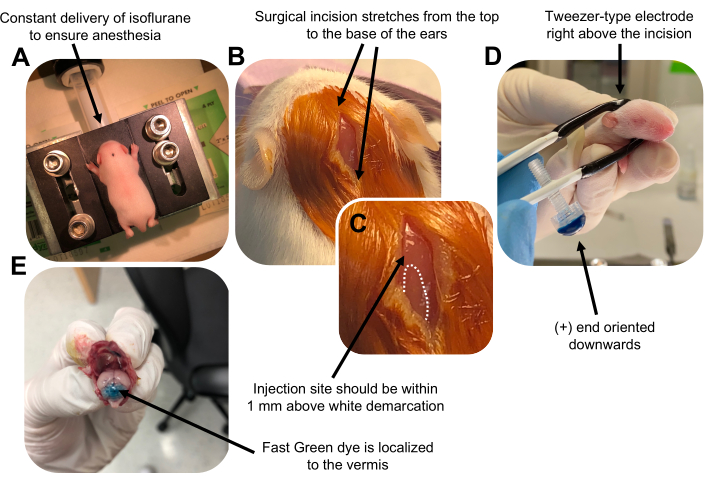
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:

Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены