Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Водородно-дейтериевый обмен на основе капиллярного электрофореза для конформационной характеристики белков с помощью масс-спектрометрии сверху вниз
В этой статье
Резюме
Здесь представлен протокол для подхода на основе капиллярного электрофореза на основе водорода / дейтерия (HDX) в сочетании с масс-спектрометрией сверху вниз. Этот подход характеризует различие в структурах более высокого порядка между различными видами белков, включая белки в разных состояниях и различные протеоформы, путем проведения одновременного дифференциального HDX и электрофоретического разделения.
Аннотация
Разрешение конформационной гетерогенности множественных белковых состояний, сосуществующих в растворе, остается одним из основных препятствий в характеристике белковой терапии и определении конформационных путей перехода, критически важных для биологических функций, начиная от молекулярного распознавания до ферментативного катализа. Реакция водородно-дейтериевого обмена (HDX) в сочетании с масс-спектрометрическим анализом сверху вниз (MS) обеспечивает средство для характеристики структур и динамики белка более высокого порядка в зависимости от конформера. Конформационная разрешающая способность этого метода в значительной степени зависит от эффективности разделения белковых состояний на уровне интактного белка и минимизации остаточного недейтерированного протического содержания во время реакций HDX.
Здесь мы описываем вариант подхода HDX MS на основе капиллярного электрофореза (CE), который направлен на улучшение конформационного разрешения. При таком подходе белки подвергаются реакциям HDX при миграции через дейтерированный раствор фонового электролита (BGE) во время капиллярного электрофоретического разделения. Различные белковые состояния или протеоформы, которые сосуществуют в растворе, могут быть эффективно разделены на основе их различного соотношения заряда к размеру. Разница в электрофоретической подвижности между белками и молекулами протического растворителя сводит к минимуму остаточный недететерированный растворитель, что приводит к почти полной дейтерирующей среде во время процесса HDX. Проточный микроволичный интерфейс CE-MS обеспечивает эффективную электрораспылительную ионизацию элюированных белковых веществ после быстрого смешивания с раствором модификатора закалки и денатурации на выходе из опрыскивателя. Онлайн-анализ РС сверху вниз измеряет глобальный уровень дейтрации элюированных интактных белковых видов и, следовательно, дейтрацию их фрагментов газовой фазы. В данной работе демонстрируется этот подход в дифференциальном HDX для систем, включая естественные варианты белка, сосуществующие в молоке.
Введение
Различение белковых видов в различных конформационных, связывающих или модифицирующих состояниях и характеристика их структурных различий важны для мониторинга путей переходов между этими видами, участвующими в биологических событиях, начиная от молекулярного распознавания до ферментативного катализа, и понимания механизмов, лежащих в основе этих событий. Обычные биофизические методы не обеспечивают полного решения из-за таких ограничений, как недостаточное разрешение и потеря динамической информации в растворе. Водородно-дейтериевый обмен в сочетании с масс-спектрометрией (HDX MS) представляет собой метод, который маркирует структурные и конформационные особенности белков дейтерием (2H) посредством обмена между лабильными атомами водорода белков и 2H из преднамеренно введенного раствора 2H2O. Протоны, участвующие в водородной связи или изолированные от растворителя внутри белка, не обмениваются легко1. Таким образом, поскольку обменный курс на обменном участке сильно зависит от его участия в структурах более высокого порядка, белковые структуры могут быть выявлены с высоким пространственным разрешением MS, который исследует степень и скорость поглощения 2H на основе различных атомных масс между 1H и 2H. За последние десятилетия HDX MS стал чрезвычайно успешным методом изучения конформаций и динамики белка2.
В классическом восходящем подходе HDX MS ансамбль белковых видов в различных конформационных, связывающих или модифицирующих состояниях протеолизируется без разделения на интактном белковом уровне, что делает невозможным характеристику отдельных видов путем анализа полученных протеолитических фрагментов с запутанным содержанием дейтерия. Напротив, в нисходящем подходе различные белковые состояния или протеоформы, которые включали различное содержание дейтерия, приводят к множественному распределению неповрежденных белковых масс при сканировании РС. Это позволяет отдельным видам быть разделенными путем массового отбора ионов, соответствующих каждому распределению массы, с использованием надлежащего массового фильтра (такого как квадруполь) и характеристики их конформационных различий в последующем тандемном анализе МС 3,4,5,6. Однако эффективность разделения белковых состояний или протеоформ в этой стратегии ограничена степенью разницы в их соответствующих массовых распределениях.
Капиллярный электрофорез (СЕ) обеспечивает средство для разделения белковых видов на основе их различных зарядов и гидродинамических размеров в фазе раствора с высокой эффективностью7. Сочетание CE с HDX обеспечивает дополнительное разделение белковых состояний или протеоформ в фазе раствора. Кроме того, небольшой объем капилляра CE позволяет использовать полностью дейтерированный раствор в качестве фонового раствора электролита (BGE), т. е. работающего буфера, превращая капилляр в реактор HDX для образцов белка. Из-за разницы в электрофоретической подвижности между белками и протическими реагентами в процессе электрофореза, проведение HDX во время CE приводит к почти полной дейтерирующей среде для белковых аналитов с минимальным остаточным недететерированным содержимым, тем самым повышая чувствительность структурного анализа с использованием данных HDX. Таким образом, мы разработали дифференциальный подход HDX на основе CE в сочетании с нисходящим MS для характеристики белковых структур более высокого порядка специфическим для состояния или протеоформа способом8.
В этом документе описываются протоколы для этого подхода путем подробного описания этапов подготовки материала, экспериментальной процедуры и анализа данных. Факторы, которые могут повлиять на производительность метода или качество данных, перечислены в кратких примечаниях. Репрезентативные результаты, представленные здесь, включают дифференциальные данные HDX смесей различных белков и природных вариантов бычьего β-лактоглобулина (β-lg), основного сывороточного белка, присутствующего в молоке9. Мы демонстрируем эффективность разделения, воспроизводимость и производительность 2H-маркировки двух распространенных вариантов β-lg, т.е. A и B10,11 во время HDX на основе CE и характеризацию их конформаций для конкретных вариантов.
протокол
ПРИМЕЧАНИЕ: По возможности используйте высокоэффективные реагенты для жидкостной хроматографии (ВЭЖХ) или РС, чтобы свести к минимуму загрязняющие вещества, которые могут мешать анализу РС. Не прикасайтесь к интерфейсу CE-MS голыми руками во время измерения, чтобы избежать возможности поражения электрическим током, вызванного электрофоретическим напряжением или напряжением электрораспыления.
1. Подготовка материала
- Модификация плавленого капилляра кремнезема для CE
- Готовят 5% (мас./мас.) раствор гидроксипропилцеллюлозы (HPC) путем растворения порошка HPC (молекулярная масса [MW]: 100 кДа) в воде с непрерывным перемешиванием при комнатной температуре на магнитной мешалке в течение ~12 ч или до полного исчезновения твердых частиц12. Удалите все видимые пузырьки воздуха с помощью ультразвукового аппарата.
- Смонтируйте в прибор CE расплавленный капилляр из кремнеземистого стекла (внутренний диаметр [ID]: 50 мкм, наружный диаметр [OD]: 360 мкм) длиной приблизительно 85 см. Промыть капилляр путем непрерывного настаивания органического растворителя, такого как ацетон13, используя автосамплер CE при давлении инфузии 40 фунтов на квадратный дюйм в течение 10-15 мин.
- Заполните очищенный капилляр раствором HPC с помощью автопробоотборника при давлении инфузии 40 фунтов на квадратный дюйм (что часто занимает ~ 40 минут). Вливайте воздух в заполненный HPC капилляр со скоростью 40 фунтов на квадратный дюйм, чтобы обеспечить свободный воздушный поток в капилляре, о чем свидетельствуют пузырьки воздуха, выбрасываемые из капилляра при погружении в воду.
- Выпекать капилляр с покрытием HPC в температурно-программируемой печи (в идеале колонной печи с контролируемой температурой газового хроматографа) с газообразным азотом (25 фунтов на кв. дюйм), протекающим через капилляр, следуя температурной программе, показанной на рисунке 1.
- Охладите духовку до комнатной температуры, прежде чем вынуть капилляр. Используйте этот капилляр, модифицированный HPC, для разделения CE.
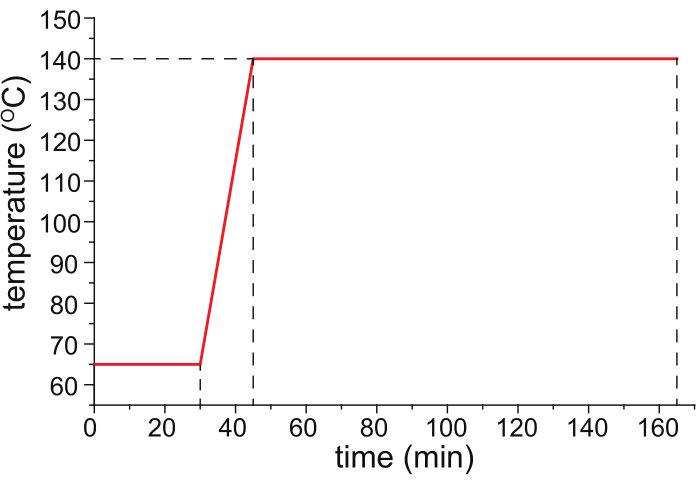
Рисунок 1: Рекомендуемая температурная программа для капиллярной выпечки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Раствор фонового электролита (БГЭ) и раствор модификатора8
- Готовят 1-10 мл БГЭ в желаемой концентрации (например, 10 мМ), растворяя соответствующее количество ацетата аммония в 2 Ч2О. Поместите 200мкл-аликвот БГЭ в отдельные флаконы БГЭ и запечатайте флаконы парапленкой, чтобы свести к минимуму реакцию HDX между БГЭ и водяным паром в воздухе.
- Готовят 10 мл раствора модификатора с 75% (v/v) метанолом и 25% (v/v) воды, с рН, скорректированным до 2,5 с использованием муравьиной кислоты.
ПРИМЕЧАНИЕ: Используйте 2H2Oи дейтерированный метанол для приготовления раствора модификатора, если атомы дейтерия в боковых цепях и незащищенные амиды позвоночника должны быть сохранены для обнаружения РС.
- Обессоливание белковых образцов
- Готовят раствор ацетата аммония в недетерированной воде в нужной концентрации.
ПРИМЕЧАНИЕ: Рекомендуется использовать концентрацию менее 100 мМ, чтобы избежать сильного электрического тока во время электрофореза и возникающего в результате эффекта нагрева Джоуля. - При необходимости отрегулируйте рН раствора ацетата аммония до нужного уровня с помощью муравьиной кислоты (для рН < 6,8) или гидроксида аммония (для рН > 6,8).
- Заменить исходные буферы белкового раствора раствором ацетата аммония (приготовленным в недететерированной воде в желаемой концентрации; рН, скорректированным до 7,5 с гидроксидом аммония) через по меньшей мере пять последовательных концентраций и стадий разбавления при 4 °C с использованием центробежного фильтра с надлежащим отключением MW.
ПРИМЕЧАНИЕ: Образцы белка, подлежащие обессоливанию, могут быть либо получены в результате предыдущих производственных процедур (например, очистки или состава), либо получены путем растворения лиофилизированного порошка белка. «Соли», подлежащие удалению из растворов образцов на этом этапе, относятся в целом ко всем малым ионам или молекулам, которые являются нелетучими. Хотя эти виды могут быть эффективно отделены от белков в процессе электрофореза, этот этап рекомендуется, чтобы избежать компрометации электрофоретического разрешения и, таким образом, свести к минимуму загрязнение масс-спектрометра. Когда белковые аналиты должны быть стабилизированы специфическими солями или добавками, включите их в состав БГЭ. - Определить концентрацию белка можно с помощью микрообъемного спектрофотометра UV-Vis.
- Готовят раствор ацетата аммония в недетерированной воде в нужной концентрации.
2. Работа анализа HDX MS на основе CE
ПРИМЕЧАНИЕ: Масс-спектрометр, используемый в этом подходе, должен быть оснащен анализатором массы со сверхвысоким разрешением, таким как циклотронный резонанс с преобразованием Фурье (FTICR) или орбитрап, массовым фильтром, таким как квадруполь, который позволяет выбирать массу ионов-предшественников для фрагментации, и функциями диссоциации переноса электронов (ETD) или диссоциации захвата электронов (ECD) для выполнения нисходящего анализа с надежными тандемными данными MS (в идеале изотопно разрешенные сигналы фрагментов ионов).
- Оптимизация настроек CE и MS
- Выполните пилотное измерение MS с использованием стандартного источника электрораспылительной ионизации (ESI) путем распыления либо предварительно загруженного образца из боросиликатного стеклянного капилляра с металлическим покрытием («статическая» схема nanoESI), либо непрерывно вводимого образца из металлического излучателя для оптимизации настроек MS для измерения неповрежденных белков (MS1) и их газофазных фрагментов (MS2). Фрагментировать интересующие белковые виды путем массового отбора ансамбля его ионов в однозарядном состоянии с последующим ETD или ECD ионов-предшественников.
ПРИМЕЧАНИЕ: Основные настройки включают параметры, влияющие на дезинсервацию, массовый отбор ионов-предшественников (во избежание вмешательства со стороны других видов) и эффективность фрагментации. Как центр, так и ширина окна выбора массы должны быть увеличены, чтобы соответствовать результирующему массовому распределению ионов анализируемого вещества после HDX. Поскольку окно элюирования вида белка в CE обычно колеблется от 0,5 мин до 2 мин, оцените эффективность фрагментации на основе сканирования MS2, накопленного за сопоставимое временное окно. Оптимальные значения этих параметров являются белково-специфическими; читатели ссылаются на ранее опубликованные отчеты по примерным настройкам 8,14. - Выполните пилотное измерение CE с помощью прибора CE, оснащенного оптическим детектором, то есть детектором фотодиодной решетки (PDA) или УФ-детектором для оптимизации настроек CE для разделения белковых видов и времени миграции, что эквивалентно времени реакции HDX.
ПРИМЕЧАНИЕ: Этот шаг является необязательным в зависимости от наличия оптического детектора CE. При отсутствии оптического детектора настройки CE могут быть оптимизированы с использованием CE-MS после завершения раздела 2.2, следуя инструкциям, описанным в разделе 2.3. Основные настройки включают параметры, которые влияют на эффективность разделения, пиковые формы, показанные на электроферограммах, и время элюирования.
- Выполните пилотное измерение MS с использованием стандартного источника электрораспылительной ионизации (ESI) путем распыления либо предварительно загруженного образца из боросиликатного стеклянного капилляра с металлическим покрытием («статическая» схема nanoESI), либо непрерывно вводимого образца из металлического излучателя для оптимизации настроек MS для измерения неповрежденных белков (MS1) и их газофазных фрагментов (MS2). Фрагментировать интересующие белковые виды путем массового отбора ансамбля его ионов в однозарядном состоянии с последующим ETD или ECD ионов-предшественников.
- Предварительное кондиционирование установки CE-HDX
- Очистите проточный микровизионный интерфейс CE-MS смесью 50% метанола, 49% воды и 1% муравьиной кислоты (v/v) с использованием ультразвука в течение не менее 30 мин при комнатной температуре.
- После установки HPC-модифицированного капилляра на инструмент CE промойте капилляр с помощью автопробоотборника в течение 10 минут и оставьте капилляр заполненным BGE.
- Получить надлежащую длину немодифицированной плавленой капиллярной трубки кремнезема (ID: 50 мкм, OD: 360 мкм) в качестве инфузионной трубки для раствора модификатора. Соедините трубку-модификатор с газонепроницаемым стеклянным шприцем с тупым наконечником с помощью соединения и соответствующей втулки и промойте трубку раствором модификатора с помощью инфузионного насоса в течение не менее 10 мин.
- Вставьте выпускные отверстия капиллярной и модификаторной трубки CE с покрытием HPC, которые были загружены соответствующими решениями, в очищенный интерфейс CE-MS, как показано на рисунке 2.
- Выдвигайте шприц для инфузии модификатора либо вручную, либо с помощью инфузионного насоса, чтобы убедиться, что раствор модификатора достигает кончика интерфейса. Установите собранный интерфейс CE-MS на корпус источника nanoESI масс-спектрометра.
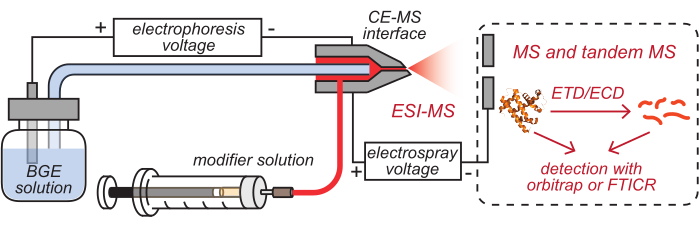
Рисунок 2: Схематическая иллюстрация установки HDX MS на основе CE. Эта цифра была изменена с8. Сокращения: BGE = раствор фонового электролита; CE = капиллярный электрофорез; MS = масс-спектрометрия; HDX = водородно-дейтериевый обмен; ESI = электрораспылительная ионизация; FTICR = циклотронный резонанс ионов с преобразованием Фурье; ETD = диссоциация переноса электронов; ECD = диссоциация захвата электронов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Одновременное разделение CE, реакция HDX и анализ MS
ПРИМЕЧАНИЕ: Дейтерированный БГЭ рекомендуется использовать в течение 1 дня после вскрытия.- Приложите напряжение распыления 3-5 кВ к интерфейсу CE-MS.
- Начните вливание раствора модификатора с инфузионным насосом со скоростью потока от 0,1 до 10 мкл/мин и обеспечьте стабильное электрораспыление на кончике интерфейса CE-MS.
- Поместите флакон с образцом, содержащий BGE, в автопробоотборник и используйте его на этапе 2.3.4 для получения пустых электроферограмм и пустых масс-спектров.
- Вводите раствор образца с помощью автопробоотборника при 2 фунтах на квадратный дюйм и в течение надлежащего периода времени, чтобы обеспечить инъекцию желаемого количества образца. Оцените объем впрыска, используя соотношение между объемом впрыска и параметрамивпрыска 15 , определенным уравнением (1).
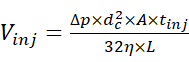 (1)
(1)
Где Vinj - объем инъекции, Δp - давление инъекции, dc - внутренний диаметр капилляра, A - поперечное сечение капилляра, tinj - продолжительность инъекции, η - вязкость жидкости в капилляре, а L - длина капилляра. - Начните разделение СЕ, применив электрофоретическое напряжение 30 кВ и давление инфузии в диапазоне от 0 до 2 фунтов на квадратный дюйм, и получите электроферограмму. Между тем, начать сбор данных МС в хроматографическом режиме, где график ионного тока получается в зависимости от времени, а соответствующие МС-сканы автоматически не объединяются в единый спектр.
ПРИМЕЧАНИЕ: Белки подвергаются спонтанной реакции HDX в точке контакта молекул 2H2O в BGE во время их электрофоретической миграции на этом этапе. Оптическое обнаружение для CE может использоваться в дополнение к обнаружению MS. Поскольку обнаружение на колонне требует удаления определенной длины полиимидного покрытия на выходном конце расплавленного капилляра кремнезема, следует проявлять дополнительную осторожность, чтобы избежать повреждения капилляров во время сборки интерфейса CE-MS. - Сохраните пустую электроферограмму и масс-спектры в качестве ссылок.
ПРИМЕЧАНИЕ: Пустые данные должны использоваться для устранения неполадок, а не для базового вычитания. - Поместите флаконы с образцом, содержащие желаемые концентрации растворов образца белка, в автопробоотборник. Получите электроферограммы и масс-спектры для образцов белка, выполнив шаги 2.3.4-2.3.5. Соберите достаточное количество ms-сканирований для получения спектров MS1 электрофоретически разделенных и 2H-меченых белковых форм.
- Выполняйте тандемные измерения MS для интересующих видов либо после получения спектров MS1 в рамках того же пробега, либо в последующем, отдельном прогоне.
- При необходимости отрегулируйте время миграции/время реакции HDX, изменив давление инфузии или длину капилляра CE. Если время реакции HDX должно быть короче, чем время миграции, используйте подход, описанный ранее8, который использует как дейтерированный, так и невейтерированный BGE в капилляре во время процесса CE.
- Промывайте капилляр CE BGE при давлении 20 фунтов на квадратный дюйм в течение не менее 10 минут после каждого измерения.
- По завершении экспериментов очистите интерфейс CE-MS и все трубки для хранения.
- Получить набор данных образца «конечной точки» HDX (который может быть подготовлен с использованием подходов, описанных ранее 6,16) с MS в режиме прямой инфузии.
ПРИМЕЧАНИЕ: Этот шаг требуется только в том случае, если для HDX на основе CE используется дейтерированное модификаторное решение.
3. Анализ данных
- Анализ данных CE
- Используйте один из следующих графиков в качестве электроферограммы для определения электрофоретических характеристик, включая количество пиков, время миграции и эффективность разделения: (a) поглощение УФ-излучения против времени миграции, полученное оптическим детектором прибора CE (при наличии); b) график общего ионного тока (ТИЦ), полученный MS; c) график извлечь ионного тока (EIC/XIC), полученный MS.
ПРИМЕЧАНИЕ: EIC/XIC обеспечивает оптимальное соотношение сигнал/шум (S/N), в целом, среди вышеупомянутых форматов электроферограмм. Примечательно, что даже при отсутствии каких-либо инструментальных смещений, в то время как поглощение УФ-излучения пропорционально массовой концентрации белка, сигнал РС пропорционален молярной концентрации. Следовательно, разумно наблюдать различия в пиковых паттернах между электроферограммами, полученными из CE и MS. - Используйте площадь под кривой (AUC) пиков, показанных в электроферограммах, для полуквантования. Для образцов, включающих белковые комплексы, используйте подход, описанный ранее17 , для вывода данных о концентрации массы из электроферограмм TIC/EIC.
- Используйте один из следующих графиков в качестве электроферограммы для определения электрофоретических характеристик, включая количество пиков, время миграции и эффективность разделения: (a) поглощение УФ-излучения против времени миграции, полученное оптическим детектором прибора CE (при наличии); b) график общего ионного тока (ТИЦ), полученный MS; c) график извлечь ионного тока (EIC/XIC), полученный MS.
- Анализ данных MS
- Получите спектры MS1 и MS2, объединив сканы MS1 и MS2, полученные в соответствующих окнах элюирования соответственно.
- Определите массы интактного белка (M (интактный белок)) и фрагментов одним из следующих двух методов.
- Рассчитайте средние массы ионов, дающих начало изотопно разрешенным сигнальным кластерам.
- Используйте центр гауссовских кривых, возникающих в результате подгонки соответствующих изотопных оболочек6.
- Используйте программное обеспечение, такое как Biopharma Finder, ProSight18 или MASH Suite19 , для создания массового списка фрагментов ионов и их идентификации.
- Анализ данных HDX
- Определите общий уровень дейтрации интактного вида белка с помощью уравнения (2).
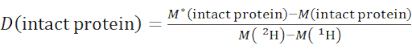 (2)
(2)
где M (2H) или M (1H) — атомные веса 2H или 1H. Звездочкой обозначены данные образца с маркировкой 2H. - Определите кумулятивную защиту или кумулятивную дейтрацию магистральных амидов определенного сегмента.
- Для данных, полученных с помощью дейтерированного модификатора, используйте уравнения (3) и (4) для определения кумулятивного уровня защиты.
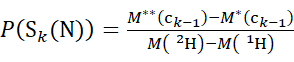 (3)
(3)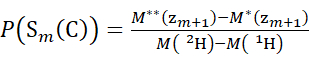 (4)
(4)
Где P(Sk(N)) - полная защита N-концевого сегмента, охватывающего остатки от 1 до k, P(Sm(C)) - полная защита C-концевого сегмента, содержащего m остатков, M (2H) или M (1H) - атомные массы 2H или 1H, а M (ci) или M (zi) - молекулярные массы ионов ci или zi .
ПРИМЕЧАНИЕ: Двойная звездочка указывает на данные образца "конечной точки" HDX. - Для данных, полученных с помощью невыполненного решения модификатора, используйте уравнения (5) и (6) для определения кумулятивного уровня дейтерации.
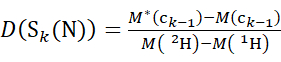 (5)
(5)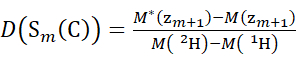 (6)
(6)
Где D(Sk(N)) - кумулятивное поглощение дейтерия N-концевым сегментом, охватывающим остатки от 1 до k; D(Sm(C)) - кумулятивное поглощение дейтерия С-концевым сегментом, содержащим м-остатки .
- Для данных, полученных с помощью дейтерированного модификатора, используйте уравнения (3) и (4) для определения кумулятивного уровня защиты.
- Определение уровня дейтрации в локальной амидной группе позвоночника
- Для данных, полученных с помощью дейтерированного модификаторного решения, используйте уравнения (7), (8), (9), (10) и (11) для определения локального уровня защиты.
для данных, полученных из с-ионов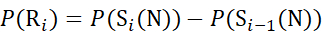 (7)
(7)
для данных, полученных из z-ионов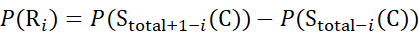 (8)
(8)
Где P(Ri) — защита основного амида при остатке i, а подстрочный индекс «total» обозначает общее остаточное число белка.
Для участков остатков, где последующие фрагменты ионов отсутствовали, назначьте P(Ri), используя уравнения (9) и (10).
для данных, полученных из с-ионов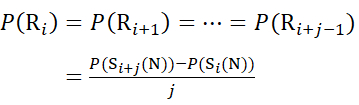 (9)
(9)
для данных, полученных из z-ионов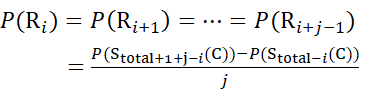 (10)
(10)
Затем определите уровень дейтрации D(Ri) в локальной амидной группе позвоночника с помощью уравнения (11).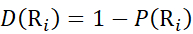 (11)
(11) - Для данных, полученных с помощью невыполненного решения модификатора, используйте уравнения (12), (13), (14) и (15) для определения локального уровня защиты.
для данных, полученных из с-ионов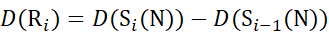 (12)
(12)
для данных, полученных из z-ионов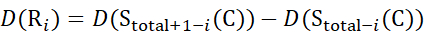 (13)
(13)
Где D(Ri) — защита амида позвоночника при остатке i, а подстрочный индекс «всего» обозначает общее остаточное число белка.
Для участков остатков, где последующие фрагменты ионов отсутствовали, назначьте D(Ri), используя уравнения (14) и (15).
для данных, полученных из с-ионов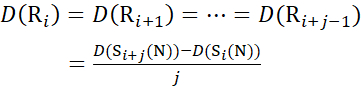 (14)
(14)
для данных, полученных из z-ионов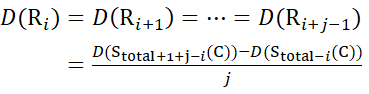 (15)
(15)
- Для данных, полученных с помощью дейтерированного модификаторного решения, используйте уравнения (7), (8), (9), (10) и (11) для определения локального уровня защиты.
- Определите общий уровень дейтрации интактного вида белка с помощью уравнения (2).
Результаты
Изменение давления инфузии BGE позволяет регулировать как эффективность разделения, так и время миграции, что эквивалентно времени реакции HDX разделяемых белков (рисунок 3). Более низкое давление инфузии приводит к лучшему разделению пиков CE за счет продолжительности эк?...
Обсуждение
Цели покрытия внутренней стенки капилляра CE включают минимизацию электроосмотического потока и поглощения белка во время процессаCE 13. Хотя электроосмотический поток полезен для обычного анализа СЕ малых молекул из-за его способности направлять нейтральные или противоп?...
Раскрытие информации
D. D. Y. Chen является одним из основателей Института биомолекул Knowledge for Health, который коммерциализирует проточный микровизионный интерфейс CE-MS. Другим авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантами Национального фонда естественных наук Китая (NSFC 21974069). Авторы также получили поддержку от Института клеточного анализа, Шэньчжэньская лаборатория залива, Китай; Цзянсуский коллаборативный инновационный центр биомедицинских функциональных материалов; и Ключевая лаборатория биомедицинских материалов Цзянсу в Нанкинском педагогическом университете, Китай.
Материалы
| Name | Company | Catalog Number | Comments |
| ammonium acetate | Fisher Chemical | A/3446/50 | ≥99% |
| CESI 8000 plus capillary electrophoresis system | Sciex, USA | ||
| centrifuge | Eppendorf | 5406000097 | |
| centrifugal filter | Merck | UFC201024 | 10 kDa cutoff |
| deuterium oxide | Energy Chemical | E090001 | 99.9 % D |
| formic acid | Acros Organics | 270480250 | |
| fused silica glass capillary | Polymicro Technologies | 1068150017 | ID 50μm, OD 360μm |
| gas chromatography | Agilent | GC6890N | |
| hydrochloric acid | Sigma Aldrich | 258148 | |
| hydroxypropyl cellulose | Aladdin | H113415 | MW 100000 |
| magnetic stirrers | DLAB | 8030101212 | |
| methanol | Fisher Chemical | A456-4 | MS grade |
| microvolume UV-Vis spectrophotometer | DeNovix | 84677JK7731 | |
| myoglobin | Sigma Aldrich | M1882 | |
| Orbitrap Fusion Lumos mass spectrometer | Thermo Fisher Scientific, USA | ||
| PA 800 Plus Pharmaceutical Analysis CE System | Beckman Coulter, USA | ||
| Q Exactive UHMR mass Spectrometer | Thermo Fisher Scientific, Germany | ||
| sodium hydroxide | Sigma Aldrich | S5881 | |
| ubiquitin | Sigma Aldrich | U6253 | |
| ultrasonicator | SCIENTZ | SB-5200 | |
| β-lactoglobulin | Sigma Aldrich | L0130 |
Ссылки
- Kaltashov, I. A., Bobst, C. E., Pawlowski, J., Wang, G. Mass spectrometry-based methods in characterization of the higher order structure of protein therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 184, 113169 (2020).
- Engen, J. R., Botzanowski, T., Peterle, D., Georgescauld, F., Wales, T. E. Developments in hydrogen/deuterium exchange mass spectrometry. Analytical Chemistry. 93 (1), 567-582 (2021).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Conformer-specific hydrogen exchange analysis of Abeta(1-42) oligomers by top-down electron capture dissociation mass spectrometry. Analytical Chemistry. 83 (13), 5386-5393 (2011).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Structure and dynamics of small soluble Abeta(1-40) oligomers studied by top-down hydrogen exchange mass spectrometry. Biochemistry. 51 (17), 3694-3703 (2012).
- Pan, J., Borchers, C. H. Top-down structural analysis of posttranslationally modified proteins by Fourier transform ion cyclotron resonance-MS with hydrogen/deuterium exchange and electron capture dissociation. Proteomics. 13 (6), 974-981 (2013).
- Wang, G., Abzalimov, R. R., Bobst, C. E., Kaltashov, I. A. Conformer-specific characterization of nonnative protein states using hydrogen exchange and top-down mass spectrometry. Proceedings of the National Academy of Sciences of the United. States of America. 110 (50), 20087-20092 (2013).
- Mironov, G. G., Clouthier, C. M., Akbar, A., Keillor, J. W., Berezovski, M. V. Simultaneous analysis of enzyme structure and activity by kinetic capillary electrophoresis-MS. Nature Chemical Biology. 12 (11), 918-922 (2016).
- Shen, Y., Zhao, X., Wang, G., Chen, D. D. Y. Differential hydrogen/deuterium exchange during proteoform separation enables characterization of conformational differences between coexisting protein states. Analytical Chemistry. 91 (6), 3805-3809 (2019).
- Kontopidis, G., Holt, C., Sawyer, L. Invited review: β-lactoglobulin: binding properties, structure, and function. Journal of Dairy Science. 87 (4), 785-796 (2004).
- Qin, B. Y., et al. Structural basis of the Tanford transition of bovine β-lactoglobulin. Biochemistry. 37 (40), 14014-14023 (1998).
- Qin, B. Y., Bewley, M. C., Creamer, L. K., Baker, E. N., Jameson, G. B. Functional implications of structural differences between variants A and B of bovine beta-lactoglobulin. Protein Science. 8 (1), 75-83 (1999).
- Wang, L., et al. High resolution capillary isoelectric focusing mass spectrometry analysis of peptides, proteins, and monoclonal antibodies with a flow-through microvial interface. Analytical Chemistry. 90 (15), 9495-9503 (2018).
- Busch, M. H. A., Kraak, J. C., Poppe, H. Cellulose acetate-coated fused-silica capillaries for the separation of proteins by capillary zone electrophoresis. Journal of Chromatography A. 1695 (2), 287-296 (1995).
- Zhao, X., Shen, Y., Tong, W., Wang, G., Chen, D. D. Y. Deducing disulfide patterns of cysteine-rich proteins using signature fragments produced by top-down mass spectrometry. Analyst. 143 (4), 817-823 (2018).
- Sutera, S. P., Skalak, R. The history of Poiseuille's law. Annual Review of Fluid Mechanics. 25 (1), 1-20 (1993).
- Wang, G., Kaltashov, I. A. Approach to characterization of the higher order structure of disulfide-containing proteins using hydrogen/deuterium exchange and top-down mass spectrometry. Analytical Chemistry. 86 (15), 7293-7298 (2014).
- Wang, G., Johnson, A. J., Kaltashov, I. A. Evaluation of electrospray ionization mass spectrometry as a tool for characterization of small soluble protein aggregates. Analytical Chemistry. 84 (3), 1718-1724 (2012).
- Fellers, R. T., et al. ProSight Lite: graphical software to analyze top-down mass spectrometry data. Proteomics. 15 (7), 1235-1238 (2015).
- Cai, W., et al. MASH Suite Pro: A comprehensive software tool for top-down proteomics. Molecular & Cellular Proteomics. 15 (2), 703-714 (2016).
- Paterson, G. R., Hill, J. P., Otter, D. E. Separation of β-lactoglobulin A, B and C variants of bovine whey using capillary zone electrophoresis. Journal of Chromatography A. 700 (1), 105-110 (1995).
- Wang, G., Kaltashov, I. A. Approach to characterization of the higher order structure of disulfide-containing proteins using hydrogen/deuterium exchange and top-down mass spectrometry. Analytical Chemistry. 86 (15), 7293-7298 (2014).
- Nicolardi, S., et al. On-line electrochemical reduction of disulfide bonds: improved FTICR-CID and -ETD coverage of oxytocin and hepcidin. Journal of the American Society for Mass Spectrometry. 24 (12), 1980-1987 (2013).
- Adhikari, S., Xia, Y., McLuckey, S. A. Top-down analysis of disulfide-linked proteins using photoinduced radical reactions and ET-DDC. International Journal of Mass Spectrometry. 444, 116173 (2019).
- Rush, M. J. P., Riley, N. M., Westphall, M. S., Coon, J. J. Top-down characterization of proteins with intact disulfide bonds using activated-ion electron transfer dissociation. Analytical Chemistry. 90 (15), 8946-8953 (2018).
- Zhong, X., Maxwell, E. J., Chen, D. D. Y. Mass transport in a micro flow-through vial of a junction-at-the-tip capillary electrophoresis-mass spectrometry interface. Analytical Chemistry. 83 (12), 4916-4923 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены