Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерения резонансного переноса энергии Фёрстера в живых растительных клетках
В этой статье
Резюме
Предусмотрен протокол для установки стандартного конфокального лазерного сканирующего микроскопа для измерений резонансной передачи энергии in vivo Förster с последующей оценкой данных.
Аннотация
Эксперименты с резонансным переносом энергии Фёрстера (FRET) на основе сенсибилизированного излучения легко выполняются, но зависят от микроскопической установки. Конфокальные лазерные сканирующие микроскопы стали рабочей лошадкой для биологов. Коммерческие системы обеспечивают высокую гибкость в регулировке мощности лазера и чувствительности детектора и часто объединяют различные детекторы для получения идеального изображения. Однако сравнение данных, основанных на интенсивности, из разных экспериментов и установок часто невозможно из-за этой гибкости. Удобные для биологов процедуры являются преимуществом и позволяют легко и надежно настраивать настройки лазера и детектора.
Кроме того, поскольку эксперименты FRET в живых клетках зависят от изменчивости экспрессии белка и соотношения донор-акцептор, для оценки данных необходимо учитывать уровни экспрессии белка. Здесь описан простой протокол для надежных и воспроизводимых измерений FRET, включая процедуры оценки экспрессии белка и регулировки интенсивности лазера и настроек детектора. Оценка данных будет проводиться путем калибровки с флуорофорным слиянием известной эффективности FRET. Для повышения простоты сравнивались поправочные коэффициенты, полученные в клетках и путем измерения рекомбинантных флуоресцентных белков.
Введение
Резонансный перенос энергии Фёрстера ((F)RET) обычно наблюдается с помощью флуоресцентной спектроскопии, хотя сам процесс не ограничивается происходящим между флуорофорами. Лежащая в основе диполь-дипольная связь просто требует светоизлучающей донорской молекулы и светопоглощающего акцептора. Это получено из требуемого спектрального перекрытия интеграла J нормализованных спектров излучения донора и акцепторного поглощения1. Однако, поскольку RET конкурирует с флуоресценцией, передача энергии становится измеримой за счет изменений в флуоресцентном излучении: RET вызывает закалку донора и сенсибилизированную акцепторную эмиссию.
RET на основе флуорофора был назван флуоресцентным резонансным переносом энергии (FRET), чтобы отделить его от биолюминесцентного резонансного переноса энергии (BRET). RET сильно зависит от расстояния между донором и акцептором, которое широко находится в диапазоне 0,5-10 нм2 и, таким образом, в том же диапазоне, что и размеры белков и их комплексов. Во-вторых, RET зависит от дипольно-дипольной ориентации каппа в квадрате. В сочетании с тем, что вращательной свободой связанных с белком флуорофоров можно пренебречь из-за молекулярной массы и медленной вращательной релаксации, RET позволяет анализировать конформационные изменения3.
Так называемый радиус Фёрстера основан на спектральном интеграле перекрытия и диапазоне длин волн перекрытия, так что красные хромофоры, поглощающие свет, приводят к более длинным радиусам Фёрстера, чем поглощающие синий свет красители. Поскольку динамический диапазон измерений FRET ограничен 0,5 × R0 и 1,5 × R0, пара FRET ECFP-EYFP имеет динамический диапазон 2,5-7,3 нм благодаря своему R0 4,9 нм4.
Яркость флуорофора задается произведением его коэффициента молярного вымирания и его квантового выхода. Для измерений FRET выгодно выбирать флуорофоры почти одинаковой яркости. Это улучшает обнаружение закалки доноров и сенсибилизированного акцепторного излучения. Это также способствует калибровке системы микроскопии. Глядя на часто используемые пары FRET синих и флуоресцентных белков, становится очевидной более низкая яркость синих флуоресцентных белков (рисунок 1A).
Однако срок службы акцептора должен быть ниже срока службы донора, обеспечивая доступность акцептора для передачи энергии. Если срок службы акцептора превышает срок службы донора, акцептор все еще может находиться в возбужденном состоянии, когда донор снова возбуждается. Усовершенствованные голубые флуоресцентные белки, такие как mTurquoise, показывают увеличенное время жизни и, таким образом, способствуют увеличению вероятности FRET (рисунок 1B). Вероятность FRET также зависит от коэффициента молярного вымирания акцептора.
протокол
ПРИМЕЧАНИЕ: Для следующего протокола была выполнена транзиторная трансфекция протопластов, как описано ранее12. Краткое описание приведено ниже.
1. Транзиторная трансфекция протопластов
- Нарежьте ~4 г здоровых листьев Arabidopsis thaliana экотипа Columbia на ломтики по 1 мм и перенесите их в 20 мл раствора фермента (1,5% целлюлазы; 0,4% мацероцима; 0,1% бычьего сывороточного альбумина фракции V; 0,4 мМ маннитола; 20 мМ KCl; 20 мМ 2-(N-морфолино)этанесульфоновой кислоты (MES), рН 5,7; 10 мМ CaCl2).
- Вакуумно-инфильтрируют ломтики листьев с последующей инкубацией с перемешиванием в течение 2 ч при комнатной температуре. Собирают клетки методом центрифугирования в течение 3 мин при 100 × г.
- Промыть протопласты W5-раствором (154 мМ NaCl; 125 мМ CaCl2; 5 мМ ККл; 2 мМ MES, рН 5,7) и повторно суспендировать их в растворе ММГ (0,4 М маннитола; 15 мМ МгКл2; 4 мМ MES, рН 5,7).
- Выполняют трансфекцию в 8-луночном скольжении осмотическим ударом в присутствии полиэтиленгликоля (ПЭГ) 4000. Смешайте 20 мкл суспензии протопласта с 5 мкл плазмидной ДНК (5 мкг/мкл) и 25 мкл раствора ПЭГ (0,2 М маннитола, 0,1 М CaCl2, 40% ПЭГ 4000).
- Обратите вспять осмотический шок путем мягкой корректировки осмотических состояний.
ПРИМЕЧАНИЕ: Помимо интересующей выборки, для определения спектрального кровотечения донора и акцептора, соответственно, требуется выражение только донора и акцептора. Слияние белка донора и акцептора также должно быть выражено для целей калибровки. Экспрессия флуоресцентного белка находилась под контролем промотора вируса мозаики цветной капусты 35S (pCaMV35S). Для всех измерений использовались два конфокальных лазерных сканирующих микроскопа (LSM1 и LSM2). LSM1 имеет два типа детекторов: для измерений FRET донорский сигнал был обнаружен GaAsP-детектором, в то время как FRET и акцепторное излучение регистрировались фотоумножителем. LSM2 имеет два фотоумножителя, которые использовались для обнаружения донорского, FRET и акцепторного излучения.
2. Лазерная регулировка
ПРИМЕЧАНИЕ: Здесь 458 нм и 514 нм линии аргоно-ионного лазера были применены для анализа FRET между улучшенным голубым флуоресцентным белком (ECFP) и улучшенным желтым флуоресцентным белком (EYFP), меченым белками. Для воспроизводимого сбора данных обе линии были скорректированы на одинаковую интенсивность. Это было достигнуто либо с помощью фотоумножителя передачи, либо с помощью режима отражения.
- Лазерная регулировка с помощью пропускающего фотоумножителя
- Используйте пустой колодец для регулировки.
- Выберите режим линейного сканирования и режим гистограммы.
- Уменьшите интенсивность лазера до минимума и отрегулируйте усиление детектора до обнаруживаемого фонового шума.
- Увеличьте интенсивность лазера с шагом 0,5% и запишите соответствующий сигнал.
- Примените процедуру для обеих лазерных линий.
- Лазерная регулировка с режимом отражения
- Используйте пустой колодец для регулировки.
- Примените фильтр отражения, включите режим отражения, если таковой имеется.
- Убедитесь, что диапазон длин волн детектора покрывает длину волны лазера.
- Выберите режим линейного сканирования и режим гистограммы.
- Уменьшите интенсивность лазера до минимума и отрегулируйте усиление детектора до обнаруживаемого фонового шума.
- Переместите объект в самое низкое положение.
- Перемещайте цель вверх до тех пор, пока не будет видно отражение крышки.
- Увеличьте интенсивность лазера с шагом 0,5% и запишите соответствующий сигнал.
- Примените процедуру для обеих лазерных линий.
- Оценка данных
- Сведите данные в таблицу и отсортируйте их по интенсивности сигнала.
- Постройте интенсивность сигнала по отношению к относительной мощности лазера.
- Выберите интенсивность лазера, которая приводит к аналогичной интенсивности сигнала.
3. Регулировка фотоумножителей
ПРИМЕЧАНИЕ: После лазерной регулировки фотоумножители были настроены на индивидуальные усиления для получения аналогичной чувствительности. Эта калибровка была выполнена с помощью лазерной линии 514 нм, которая находится в центре интересующего диапазона длин волн.
- Используйте пустой колодец для регулировки.
- Примените фильтр отражения и переключитесь в режим отражения, если таковой имеется.
- Убедитесь, что диапазон длин волн детектора покрывает длину волны лазера (514 нм).
- Выберите режим сканирования строки и вид гистограммы.
- Уменьшите коэффициент усиления детектора до половины максимального и отрегулируйте интенсивность лазера в соответствии с обнаруживаемым фоновым шумом.
- Переместите объект в самое низкое положение.
- Перемещайте цель вверх до тех пор, пока не будет видно отражение крышки.
- Увеличьте коэффициент усиления детектора с шагом от 50 до 100 В и запишите соответствующий сигнал.
- Примените шаги 3.1-3.8 для обоих детекторов.
- Оценка данных
- Постройте диаграмму интенсивности по отношению к коэффициенту усиления детектора для каждого детектора.
- Выберите отдельный детектор усиления для получения аналогичной чувствительности.
4. Получение изображения FRET
ПРИМЕЧАНИЕ: Начните с примера, представляющего интерес для настройки получения изображений.
- Выберите подходящие фильтры/дихроичные зеркала, например, двойное дихроичное зеркало MBS 458/514 для FRET-пары ECFP/EYFP. Используйте одно и то же дихроичное зеркало для всех каналов, чтобы включить построчное сканирование. Выберите цель погружения в воду для визуализации живых клеток. Выберите 12-битное или 16-битное сканирование и умеренную скорость сканирования.
- Определите диапазон обнаружения, предпочтительно 470-510 нм для обнаружения доноров и 530-600 нм для детектирования акцептора/FRET в случае ECFP/EYFP. При использовании диодного лазера 445 нм или 440 нм используйте диапазон обнаружения от 450 до 510 нм. В случае акустооптического светоделителя (AOBS) определите обнаружение донора в диапазоне от 450 до 500 нм для предотвращения обнаружения нежелательных акцепторов.
- Примените настройку детектора в соответствии с пунктом 3.10.2.
- Примените настройку лазера в соответствии с пунктом 2.3.2. При необходимости пересмотрите интенсивность лазера на основе полученной таблицы мощности лазера. Убедитесь, что отношение сигнал/шум охватывает весь динамический диапазон детекторов (интенсивность от 0 до 4095 для 12-битного сканирования).
- Держите интенсивность лазера и прирост детектора постоянными. Используйте диаметр точечного отверстия для тонкой настройки.
ПРИМЕЧАНИЕ: Имейте в виду, что изменения диаметра точечного отверстия влияют на пространственное разрешение. - Выполните измерения (сделайте снимки не менее 20 клеток).
5. Определение перекрестных коллизионных исправлений
ПРИМЕЧАНИЕ: Клетки, экспрессирующие только донора или акцептор, должны определять спектральное кровотечение донора (DSBT) и акцепторное спектральное кровотечение (ASBT), соответственно. Сохраните те же параметры, которые описаны в разделе 4.
- Выполните измерения FRET с клетками, экспрессирующими донорский флуорофор.
- Выполняйте измерения FRET с клетками, экспрессирующими акцепторный флуорофор.
6. Калибровка измерений по Beemiller et al.13
ПРИМЕЧАНИЕ: Требуются клетки, экспрессирующие донорско-акцепторное слияние известной эффективности FRET. Здесь использован ECFP-5 aa-EYFP-fusion с КПД FRET 0,464. Сохраните те же параметры, которые описаны в разделе 4.
- Выполнение измерений FRET с клетками, экспрессирующими слияние донор-акцептор
7. Оценка данных
- Получите линейные профили ячеек, убедившись, что каждый профиль содержит не более одной ячейки. Сохраните профили в виде текстовых файлов.
- Импортируйте текстовые файлы в электронную таблицу с помощью параметра импорта текстовых файлов в разделе Данные .
- Считывание максимальных значений путем применения функции Max .
- Перечислите полученные значения в таблице, укажите столбец для идентификатора выбросов донора, МФ излучения FRET, акцепторного излучения IA и по крайней мере четырех наборов данных: только донор, только акцептор, слияние донор-акцептор и измерение.
ПРИМЕЧАНИЕ: Возбуждение донора также приводит к прямому возбуждению акцептора и вызывает ASBT, который описывается значением α. - Вычислите значения ASBT α с помощью набора данных только для акцептора с помощью уравнения (1).
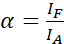 (1)
(1)
ПРИМЕЧАНИЕ: Используйте медиану всех значений α в следующих уравнениях. Донор демонстрирует широкий спектр излучения, что приводит к перекрестным помехам излучения с сенсибилизированным излучением акцептора. Этот DSBT задается значением β. - Рассчитайте спектральные значения β донора с помощью набора данных, предназначенного только для донора, используя уравнение (2).
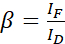 (2)
(2)
ПРИМЕЧАНИЕ: Используйте медиану всех значений β в следующих уравнениях. Калибровочный коэффициент ξ описывает линейную зависимость закалки донора, полученного из ФРЕТ, и сенсибилизированного излучения акцептора. Используйте медианы 7,5 и 7,6 в следующих уравнениях. - Рассчитайте калибровочные коэффициенты ξ с набором данных о слиянии донор-акцептор и его эффективность FRET E (0,46) с использованием уравнения (3).
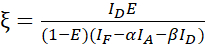 (3)
(3)
ПРИМЕЧАНИЕ: Используйте медиану всех значений ξ в следующих уравнениях. - Рассчитайте эффективность FRET интересующей белковой пары, используя уравнения (4) и (5).
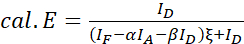 (4)
(4)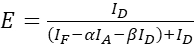 (5)
(5) - Оцените влияние силы экспрессии и/или соотношения донор-акцептор: постройте сумму ID, IF и IA в сравнении с эффективностью FRET. Выполнить линейную регрессию; Обратите внимание, что чем круче график и чем выше R2 , тем выше влияние уровня выражения или тем больше разница в изобилии донора и акцептора.
Результаты
Настройка конфокального лазерно-сканирующего микроскопа
Лазерная регулировка выявила линейное увеличение излучения с увеличением интенсивности лазера (рис. 2 и табл. 1). Как и ожидалось для аргон-ионных лазеров, излучение линии 514 нм было намного выш?...
Обсуждение
Закалка донором и сенсибилизированная акцепторная эмиссия характеризуются линейной зависимостью, которая позволяет проводить расчет FRET на основе донора или акцептора. Соответствующие факторы линейности называются либо G-фактором (донор к акцептору), либо xi (акцептор к донору), которы?...
Раскрытие информации
Мы гарантируем, что все авторы раскрыли все конфликты интересов и не имеют конкурирующих финансовых интересов.
Благодарности
Эксперименты проводились на технологической платформе световой микроскопии (LiMiTec) биологического факультета Билефельдского университета. Эта работа была профинансирована Билефельдским университетом.
Материалы
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
Ссылки
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены