Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Флуоресцентная микроскопия для интернализации АТФ, опосредованной макропиноцитозом в опухолевых клетках человека и опухоле-ксенотрансплантированных мышах
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы разработали воспроизводимый метод визуализации интернализации негидролизуемого флуоресцентного аденозинтрифосфата (АТФ), суррогата АТФ, с высоким клеточным разрешением. Мы подтвердили наш метод, используя независимые анализы in vitro и in vivo - клеточные линии опухоли человека и иммунодефицитные мыши, ксенотрансплантированные опухолевой тканью человека.
Аннотация
Было показано, что аденозинтрифосфат (АТФ), включая внеклеточную АТФ (эАТФ), играет значительную роль в различных аспектах опухолевого генеза, таких как лекарственная устойчивость, эпителиально-мезенхимальный переход (ЭМТ) и метастазирование. Внутриопухолевая эАТФ в 10-3-10-4 раза выше по концентрации, чем в нормальных тканях. В то время как eATP функционирует как мессенджер для активации пуринергической сигнализации для индукции EMT, он также интернализуется раковыми клетками через повышенный макропиноцитоз, специфический тип эндоцитоза, для выполнения широкого спектра биологических функций. Эти функции включают в себя обеспечение энергией биохимических реакций, требующих АТФ, донорство фосфатных групп во время трансдукции сигнала и облегчение или ускорение экспрессии генов в качестве транскрипционного кофактора. АТФ легко доступен, и его изучение в раке и других областях, несомненно, увеличится. Тем не менее, исследование eATP остается на ранней стадии, и нерешенные вопросы остаются без ответа, прежде чем важные и универсальные действия, выполняемые eATP и интернализованной внутриклеточной АТФ, могут быть полностью разгаданы.
Вклад лабораторий этих авторов в эти ранние исследования eATP включает микроскопическую визуализацию негидролизуемых флуоресцентных АТФ в сочетании с высоко- и низкомолекулярным флуоресцентным декстраном, которые служат индикаторами макропиноцитоза и эндоцитоза, а также различными ингибиторами эндоцитоза для мониторинга и характеристики процесса интернализации eATP. Этот метод визуализации был применен к опухолевым клеточным линиям и иммунодефицитным мышам, ксенотрансплантированным с раковыми опухолями человека, для изучения интернализации eATP in vitro и in vivo. В данной работе описываются эти протоколы in vitro и in vivo с акцентом на модификацию и тонкую настройку условий анализа, чтобы макропиноцитоз-/эндоцитоз-опосредованные eATP анализы интернализации eATP могли быть успешно выполнены в различных системах.
Введение
Оппортунистическое поглощение внутриопухолевых внеклеточных (т.е.) питательных веществ недавно было названо ключевой отличительной чертой метаболизма рака1. Одним из таких важных питательных веществ является АТФ, так как концентрация т.е. АТФ в 103 и10 4 раза выше, чем та, что содержится в нормальных тканях, в диапазоне от нескольких сотен мкМ до низкихмМ 2,3,4,5. Как ключевая энергетическая и сигнальная молекула, АТФ играет центральную роль в клеточном метаболизме в раковых и здоровых клетках6,7,8. Внеклеточный АТФ не только участвует в росте раковых клеток, но и способствует лекарственной устойчивости9. Недавно были выявлены ранее непризнанные функции АТФ, такие как гидротропная активность, что связано с участием АТФ в таких заболеваниях, как болезнь Альцгеймера10. Действительно, кажется, что наше понимание АТФ и его функций в раковых клетках, здоровых клетках и других больных клетках далеко не полное. Однако из-за нестабильности АТФ и высокой скорости оборота в клетках технически сложно контролировать движение АТФ через клеточную мембрану и в клетку.
Для решения этой проблемы и восполнения потребности данной области исследований был разработан метод, в котором негидролизуемая флуоресцентная АТФ (NHF-АТФ)(Рисунок 1)использовалась в качестве суррогата для визуализации интернализации АТФ и наблюдения внутриклеточной пространственной локализации интернализованной АТФ, как in vitro, так и in vivo11,12 . Было продемонстрировано, что NHF-АТФ заменяет эндогенную АТФ для исследования движения АТФ через клеточные мембраны животных, как в линиях раковых клеток, так и в опухолевой ткани человека, ксенотрансплантированной на иммунодефицитных мышах11,12. Более того, введение ингибиторов макропиноцитоза клеткам блокировало интернализацию eATP, предполагая, что внутриклеточное поглощение eATP включает макропиноцитотический механизм9,11,12. Этот протокол допускает иммунобабелирование против клеточных специфических белков и, таким образом, идентификацию того, какой тип клеток интернализует NHF-АТФ. Используя in vivo опухолевые ксенотрансплантаты и микроскопию высокого разрешения, NHF-АТФ может быть визуализирована пространственно по всему образцу ткани и даже в пределах одной клетки. Эти методы также позволяют проводить количественный анализ, такой как процент поглощения клеток, количество макропиноцитарных везикул и кинетика интернализации. В данной работе подробно описывается, как NHF-АТФ, работающий отдельно или вместе с флуоресцентным декстрансом 13, 14, 15, 16 эндоцитозом или вместе с эндоцитозом-индикаторным декстрансом13,14,15,16,может быть использован в различных экспериментальных условиях для изучения интернализации АТФ и внутриклеточной локализации после интернализации в клетках.

Рисунок 1:Структуры негидролизуемых флуоресцентных АТФ и тетраметилродамина, меченных высокомолекулярным флуоресцентным декстраном. (А)Структура NHF-АТФ. (B)Схематическое изображение HMWFD. Сокращения: АТФ = аденозинтрифосфат; NHF-АТФ = негидролизуемый флуоресцентный АТФ; TMR = тетраметилродамин; HMWFD = высокомолекулярный флуоресцентный декстран. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры, описанные в настоящем документе, были выполнены в соответствии с IACUC Университета Огайо и NIH.
1. Выбор негидролизуемых флуоресцентных АТФ (NHF-АТФ) и декстранса
- Выбор флуорофор-конъюгированных NHF-АТФ(Рисунок 1A)и индикаторов эндоцитоза, высоко- и низкомолекулярных флуоресцентных декстранов (TMR-HMWFD и TMR-LMWFD)(Рисунок 1B)на основе предпочтительных длин волн излучения (например, система визуализации, оснащенная соответствующими фильтрами) и конкретного процесса эндоцитоза, подлежащего изучению.
2. Исследования локализации АТФ in vitro (Рисунок 2)
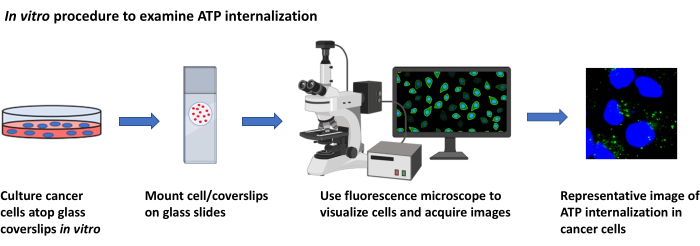
Рисунок 2:Процедура in vitro для изучения интернализации АТФ. Схематическое представление протокола визуализации интернализации внеклеточной АТФ в культивируемых раковых клетках с помощью флуоресцентной микроскопии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Клеточная культура и подготовка клеток
ПРИМЕЧАНИЕ: Проводите культивирование клеток в стерильных условиях в вытяжке для культивирования тканей.- Приготовьте модифицированную орлиную среду Dulbecco (DMEM), содержащую 10% (v/v) фетальной бычьей сыворотки (FBS) и 1% (v/v) пенициллин/стрептомицин (далее DMEM/FBS), стерильный фосфат-буферный физиологический раствор (PBS) и 0,25% трипсина/этилендиаминтетрауксусной кислоты (ЭДТА) на водяной бане с температурой 37 °C.
- Культивируйте раковые клетки человека в DMEM/FBS в чашке для культивирования тканей толщиной 100 мм. Поддерживайте ячейки в инкубаторе, установленные на 37 °C с 5% атмосферой CO2.
- Когда клетки достигнут слияния, пройдите клетки, сначала удалив культуральную среду. Затем промойте блюдо 5 мл стерильного PBS, удалите PBS и добавьте 3 мл 0,25% трипсина. Инкубировать при 37 °C в атмосфере 5% CO2 в течение 5 мин.
- Извлеките блюдо, затем добавьте 6 мл DMEM / FBS, чтобы остановить трипсинизацию. Переведите ячейки в суспензии в коническую трубку 15 мл и центрифугу при 800 × г в течение 5 мин для гранулирования клеток.
- После центрифугирования аспирируют супернатант и используют 10 мл DMEM/FBS для повторного суспендирования гранулы ячейки путем пипетки.
- Подсчитайте плотность и жизнеспособность клеток с помощью гемоцитометра. Используйте DMEM/FBS для разбавления клеточной суспензии до плотности ~7,5 × 104 клеток/мл.
- Подготовка покровов и посевных клеток
- Вымойте 12-миллиметровые крышки с 70% этанолом и тщательно протрите их деликатными салфетками. Стерилизуйте крышки и одну пару щипцов с помощью автоклавирования.
- В вытяжке для культивирования тканей используйте щипцы, чтобы поместить один крышки в каждую лунку 24-луночной пластины для посева тканей.
ПРИМЕЧАНИЕ: Позже крышка с клетками будет установлена непосредственно на предметном стекле микроскопа для визуализации. - Дозировать 300 мкл клеточной суспензии (ячейки в DMEM/FBS) при плотности посева ~2,5 × 104 ячейки на лунку в 24-луночную пластину, содержащую стерилизованные крышки. Инкубировать в стерильных условиях при 37 °C с 5% потоком CO2.
- Голодание клеток
- Через двадцать четыре часа после посева удалите DMEM/FBS из каждой лунки. Немедленно добавьте 300 мкл предварительного сывороточного DMEM в каждую лунку, чтобы сыворотка голодала клетки в течение 15-18 ч, чтобы индуцировать поглощение внеклеточных питательных веществ.
ПРИМЕЧАНИЕ: Период голодания 15-18 ч является критическим параметром.
- Через двадцать четыре часа после посева удалите DMEM/FBS из каждой лунки. Немедленно добавьте 300 мкл предварительного сывороточного DMEM в каждую лунку, чтобы сыворотка голодала клетки в течение 15-18 ч, чтобы индуцировать поглощение внеклеточных питательных веществ.
- Подготовка решений NHF-ATP и HMWFD/LMWFD
- Используйте аналитические весы для взвешивания высокомолекулярных (70 кДа) флуоресцентных TMR-декстран (TMR-HMWFD, 1 мг/мл), индикатор для визуализации макропиносом или NHF-АТФ (10 мкмоль/л) в dmEM без сыворотки в микроцентрифужной пробирке объемом 1,5 мл. Поместите трубки, защищенные от света, в водяную баню с температурой 37 °C на 15 минут.
- Центрифуга при 12 000 × г в течение 5 мин при комнатной температуре. Осторожно перенесите прозрачный супернатант в новую микроцентрифужную трубку объемом 1,5 мл, оставив любые гранулы или мусор нетронутыми, чтобы удалить нерасторжимые кристаллы.
- Добавляют растворы со стадии 2.4.1 к клеткам в каждой лунке и инкубируют клетки в течение 30 мин при 37 °C.
ПРИМЕЧАНИЕ: Если растворы HMWFD и NHF-ATP должны быть смешаны для совместной инкубации с клетками, приготовьте оба раствора в 2 раза больше конечных концентраций. Растворы будут смешиваться позже в соотношении 1:1 для достижения конечных точных рабочих концентраций. Избегайте света, так как реагенты светочувствительны.
- Лечение клеток и фиксация
- В свежей 24-луночной пластине дозируйте 500 мкл предварительно расплавленного PBS в каждую из пяти скважин.
- После инкубации клеток тщательно подберите каждый обшивочный лист с помощью щипцов. Промойте каждую крышку, окунув ее в 500 мкл предварительно расплавленной PBS. Повторите пять раз, используя пять скважин, заполненных PBS.
ПРИМЕЧАНИЕ: Бережное промывание клеток на крышках имеет решающее значение для успеха этого эксперимента. - После заключительной промывки PBS постучите по крышке деликатной салфетки, чтобы впитать лишний PBS, и немедленно перенесите крышку в холодный (4 ° C) 3,7% формальдегида, предварительно загруженный в 24-луночную пластину. Зафиксируйте ячейки на 15 мин при комнатной температуре.
- Пока клетки фиксируются, предварительно очищают микроскоп слайдами с 70% этанолом. Снимите крышки из колодцев и установите их на слайды, используя 5 мкл водной монтажной среды, содержащей ядерное пятно 4',6-диамидино-2-фенилиндол (DAPI), на крышку. Аккуратно промокните излишки PBS бумажным полотенцем или деликатной салфеткой.
- Флуоресцентная микроскопия и получение изображений
- Через два-24 часа после описанных выше шагов захватывайте изображения клеток и интернализованных HMWFD и/или NHF-ATP с использованием системы эпифлуоресцентной визуализации и программного обеспечения для сбора данных.
ПРИМЕЧАНИЕ: В этом подразделе описываются этапы получения изображений с помощью микроскопа Nikon NiU, оснащенного возможностью эпифлуоресцентной визуализации, и программного обеспечения Nikon NIS Elements. Однако могут использоваться другие сопоставимые системы визуализации и программное обеспечение для сбора данных. Следуйте инструкциям производителя по эксплуатации.- Поместите слайд на ступень вертикального эпифлуоресцентного микроскопа в бинокулярном режиме. Доступ к программе создания образов.
- Выберите цель 10x, отрегулируйте рабочую область, чтобы определить фокус, и отсканируйте слайд слева направо серпантином, чтобы определить интересующие области.
ПРИМЕЧАНИЕ: Определение областей, представляющих интерес, будет варьироваться между типами клеток, причем некоторые клеточные линии / типы рака демонстрируют разнообразные и различные степени поглощения TMR-HMWFD и / или NHF-ATP. - Выберите объектив 40x и переключитесь из бинокулярного режима в режим захвата изображения с помощью переключателя на микроскопе.
- Нажмите на значок Live Quality в программе обработки изображений, чтобы просмотреть и впоследствии получить изображения.
- С помощью панели OC на панели инструментов «Аннотации и измерения» определите параметры экспозиции для каждого куба фильтра или флуоресцентного канала.
ПРИМЕЧАНИЕ: Выберите подходящее время экспозиции для каждого канала, так как интенсивность сигнала отличается. Например, выберите время экспозиции 200 мс для DAPI, 2 с для HMWFD и 4 с для NHF-ATP. Как только время экспозиции определено для каждого канала, используйте эту настройку для всех изображений, для каждого канала, с различной обработкой или условиями. - После установки параметров экспозиции для каждого канала используйте многоканальную панель инструментов сбора для получения 3-канального изображения с заданными параметрами экспозиции.
ПРИМЕЧАНИЕ: Получение изображения через многоканальный режим ND-захвата позволяет автоматически захватывать изображения для каждого канала одного и того же поля зрения. Затвор закрывается автоматически между сменами башни. - Кроме того, можно получить многоканальные изображения вручную, переключаясь между кубами фильтров, устанавливая время экспозиции, закрывая/открывая затвор между получением изображения для каждого канала и накладывая каждое изображение, сделанное для отдельных каналов.
ПРИМЕЧАНИЕ: Режим сбора ND автоматизирует этот процесс и предоставляет объединенные изображения. - Сохраните изображение в виде файла .nd2 (формат Nikon Elements сохраняет метаданные). Сохраняйте TIF-файлы, включая объединенное изображение канала и отдельные изображения канала.
ПРИМЕЧАНИЕ: Файлы TIF могут использоваться с более широким выбором программных приложений. - Используйте функцию «Количество объектов» на панели инструментов «Анализ» для подсчета количества NHF-ATP-, TMR-HMWFD- и/или TMR-LMWFD-положительных ячеек в сохраненном файле изображения .nd2.
- Экспортируйте данные в электронную таблицу с помощью программы анализа.
- Через два-24 часа после описанных выше шагов захватывайте изображения клеток и интернализованных HMWFD и/или NHF-ATP с использованием системы эпифлуоресцентной визуализации и программного обеспечения для сбора данных.
- Количественная оценка и анализ данных
- Для каждого проанализированного состояния визуализируйте от 50 до 100 клеток для количественной оценки. Используя программное обеспечение для анализа данных (программное обеспечение, входящее в систему эпифлуоресцентной визуализации или другое программное обеспечение), подсчитайте и рассчитайте среднее количество флуоресцентных везикул на клетку.
- Используйте соответствующие статистические методы для анализа количественных результатов.
3. Интернализация АТФ в опухолях, ex vivo (Рисунок 3)

Рисунок 3:Процедура in vivo для изучения интернализации СПС. Схематическое представление протокола визуализации интернализации внеклеточной АТФ в опухолевых ксенотрансплантатах с помощью криосекционной и флуоресцентной микроскопии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Подготовка клеточных культур к имплантации
- Вырастите раковые клетки до 80% слияния при 37 °C в колбе размером 225см2, используя DMEM, дополненный FBS, до конечной концентрации 10% (v/v) и пенициллин/стрептомицин при 1% (v/v).
- Промыть клетки два раза 10 мл PBS. Предварительно нагреть 0,25% трипсина/ЭДТА до 37 °C. Добавьте 8 мл трипсина/ЭДТА и инкубируйте при 37 °C в течение 2 мин.
- Как только клетки начнут отделяться от нижней части колбы, используйте стерильную серологическую пипетку объемом 10 мл, чтобы добавить 8 мл DMEM / FBS. Аспирировать два раза, чтобы вытеснить любые адгезивные клетки. Используйте пипетку для переноса отсоединенных клеток из колбы в коническую трубку объемом 50 мл.
- Добавьте 10 мл DMEM/FBS с помощью пипетки объемом 10 мл и соберите все оставшиеся плавающие ячейки в ту же коническую трубку объемом 50 мл.
- Центрифугируют клеточную суспензию при 600 × г,4 °С в течение 4 мин. Удалите супернатант и повторно суспендируйте клетки в 1 мл ледяного PBS.
- Подсчитайте плотность клеток с помощью гемоцитометра. Держите клеточную суспензию на льду во время подсчета.
- Центрифугируют клеточную суспензию при 600 × г,4 °С в течение 4 мин. Удалите супернатант и суспендируйте клетки в ледяном PBS таким образом, чтобы плотность клеток стала 5 × 106 клеток на 100 мкл PBS. Перенесите клеточную суспензию в микроцентрифужную трубку объемом 1,5 мл.
- Подкожная инъекция раковых клеток для развития опухоли ксенотрансплантата
- Используйте шприц без латекса (1 мл) с прецизионной скользящей иглой (игла 27 Г) для инъекции раковых клеток.
- Перенесите клеточную суспензию (5 ×10 6 в 100 мкл PBS) в микроцентрифужную трубку объемом 1,5 мл. Втяните ячейки в шприц.
- Выберите место инъекции на боку иммунодефицитной (обнаженной) мыши и аккуратно очистите кожу, используя 75% этанола. Вытрите лишний этанол деликатным салфеткой.
- Для подкожной инъекции держите иглу под углом примерно 10° к коже. Вставьте кончик иглы, скосом вверх, прямо под кожей, чтобы только 1-2 мм иглы было видно снаружи кожи. Дозируйте клетки из шприца медленно в течение примерно 10 с.
- После введения всего объема продолжайте удерживать иглу на месте в течение 3-5 с, затем выньте иглу и используйте палец, чтобы оказать мягкое, но твердое давление на место инъекции еще 3-5 секунд, чтобы предотвратить утечку введенного содержимого.
- Контролировать и измерять рост опухоли с помощью суппортов Вернье до тех пор, пока опухоли не достигнут объема 200-500мм3.
- Подготовка растворов HMWFD и NHF-ATP для использования после опухолевой резекции
- Растворить 300 мкл 16 мг/мл HMWFD в не содержащей сыворотки DMEM (культуральной среде), инкубировать на водяной бане с температурой 37 °C в течение 30 мин и центрифугу при 12 000 × г в течение 5 мин, как описано выше. Переложите раствор в микроцентрифужную трубку объемом 1,5 мл.
- Добавьте 40 мкл аналогового материала NHF-ATP (1 мМ) к 160 мкл бессывороточного DMEM для приготовления раствора NHF-ATP 0,2 мМ.
- Подготовка экспериментальных скважин
ПРИМЕЧАНИЕ: Эта экспериментальная конструкция будет анализировать внутриклеточную интернализацию HMWFD + NHF-ATP, что свидетельствует о поглощении макропиносомами.- Подготовьте скважины следующим образом: Скважина No1, Контроль: 200 мкл бессывороточного DMEM; Скважина No2, Контроль: 100 мкл 16 мг/мл НМЗФД + 100 мкл бессывороточного ДМЭМ = 200 мкл 8 мг/мл ЛМЗФД; Скважина No3, Контроль: 100 мкл 0,2 мМ NHF-АТФ + 100 мкл бессывороточного DMEM = 200 мкл 0,1 мМ NHF-АТФ; Скважина No4; Экспериментально: 100 мкл 16 мг/мл HMWFD + 100 мкл 0,2 мМ NHF-АТФ = 200 мкл 0,1 мМ NHF-АТФ и 8 мг/мл HMWFD.
- Подготовка опухолевых тканей
- Усыпление мыши при вывихе шейки матки или в соответствии с протоколом, одобренным IACUC.
- Используйте скальпель размером 10, чтобы разрезать изолированные опухоли толщиной ~ 500-1000 мкм.
- Инкубировать срезы опухоли в бессывороточных DMEM, дополненных 100 мкМ NHF-АТФ и/или 8 мг/мл H/LMWFD в микроцентрифужных пробирках в течение 40 мин при 37°C с 5% потокомCO2.
ПРИМЕЧАНИЕ: После инкубации метаболизм опухолевой ткани вызывает изменение цвета среды. - Промыть ткани при предварительном нагревании PBS при температуре 37 °C (2 мл на каждое ополаскивание в 24-луночной пластине).
- Переложите ткань на новую 24-луночную пластину с предварительно выровненным свежим PBS, промойте и повторите четыре раза с нежным встряхиванием.
- Криоинстинг (подготовка замороженных тканевых блоков)
- Подготовьте идентификационные этикетки для каждой опухоли, которая будет собрана. Вырежьте 2 см кусок лабораторной ленты и сложите пополам, склеив стороны вместе, вдоль. Используйте маркировочную ручку для маркировки метки, например, идентификационным номером мыши / опухоли.
- Подготовьте встраиваемые формы, поместив тканевые формы из нержавеющей стали непосредственно на сухой лед.
ПРИМЕЧАНИЕ: Сухой лед может вызвать обморожение, ожоги и удушье. Надевайте изолированные перчатки при работе с сухим льдом. Используйте сухой лед в хорошо проветриваемом помещении. Не храните сухой лед в плотно закрытой емкости. Вместо этого храните в контейнере (например, в охладителе из пенополистирола), который позволяет газу выходить. - Пока плесень охлаждается, поместите небольшой бассейн тканевой морозильной среды в 10-миллиметровую тканевую культуральную пластину. Убедитесь, что объема достаточно, чтобы погрузить опухолевую ткань, которая будет собрана.
- Используйте перфорированную ложку, чтобы зачерпнуть резецированную опухолевую ткань и немедленно поместить ткань в морозильную среду, гарантируя, что ткань погружена. Используя перфорированную ложку, аккуратно сверните ткань в морозильную среду, убедившись, что среда омывает все поверхности тканей.
- Осторожно переместите ткань во встраиваемую форму, содержащую морозильную среду. Поместите соответствующую этикетку вертикально в морозильную среду/форму, чтобы заморозить на месте. Убедитесь, что написанная метка видна за пределами носителя.
- Когда замораживание будет завершено (морозильная среда станет непрозрачно-белой), удалите блок ткани из плесени, поместите его на сухой лед и повторите для каждой опухоли. Храните тканевые блоки при -80 °C в течение нескольких месяцев перед процедурой криосекции.
- Подготовка слайдов образцов тканей
- Чтобы максимизировать вероятность обнаружения интернализирующих положительных клеток и иметь более репрезентативные области ткани, собирайте серийные криосекции при -18--20 ° C с помощью криостата.
- Криостатные инструменты Prechill (лезвие, лезвие бритвы, стабилизатор поперечной устойчивости, держатель тканевого патрона, кисть) и уравновешивают блоки опухолевой ткани, помещая их в криостатную камеру при температуре от -18 до -20 °C. Установите угол держателя лезвия на 5-10°. Тщательно обрежьте тканевый блок, по мере необходимости, лезвием бритвы и установите его на держатель патрона, используя среду замораживания тканей в качестве «клея».
- Зафиксируйте держатель патрона в вертикальном положении на микротомовом блоке, который продвигается на заданное расстояние (например, 10 мкм) с каждым поворотом рукоятки. Расположите стабилизатор поперечной устойчивости так, чтобы она располагалась чуть выше высоты лезвия. Чтобы предотвратить скручивание тканей перед продвижением микротома, осторожно проведите большим пальцем по нижнему краю блока тканей.
- По мере продвижения микротома и падения участка ткани на металлическую пластину используйте кисть, чтобы направить участок ткани и развернуть ткань, если это необходимо.
- Наведите курсор микроскопа на участок ткани, не прикасаясь к нему, чтобы участок был притянут к слайду.
ПРИМЕЧАНИЕ: Лезвия криостата (высокопрофильные, одноразовые) чрезвычайно острые и могут привести к серьезным травмам. Соблюдайте осторожность при обращении с лезвиями и работе с криостатом. Используйте протектор лезвия, если таковой имеется. Требуется надлежащая подготовка. - Нарежьте опухоль на участки толщиной 10 мкм. Немедленно переложите нарезанные участки на положительно заряженный стеклянный микроскоп.
ПРИМЕЧАНИЕ: Для последовательных секций сначала соберите секцию толщиной 10 мкм в левый верхний угол каждого из восьми положительно заряженных слайдов. Продвиньте криостат через последующие 100-200 мкм ткани и отбросьте ткань. Немедленно переложите все разрезанные участки на предметные стекла микроскопа. - Затем соберите еще один участок толщиной 10 мкм, рядом с ранее размещенным участком ткани, для каждого из восьми слайдов. Повторяйте этот последовательный процесс сбора до тех пор, пока каждый из восьми слайдов не будет содержать восемь участков ткани, каждый из которых находится на расстоянии 100-200 мкм друг от друга. Держите участки ткани в темноте, чтобы сохранить флуоресценцию.
ПРИМЕЧАНИЕ: Участки ткани на слайдах могут храниться в коробке для слайдов при -80 °C в течение нескольких месяцев.
- Чтобы максимизировать вероятность обнаружения интернализирующих положительных клеток и иметь более репрезентативные области ткани, собирайте серийные криосекции при -18--20 ° C с помощью криостата.
- Фиксация тканевых слайдов
- КРИТИЧЕСКИЙ ШАГ: Зафиксируйте участки тканей в 95% этаноле при -18 -20 °C в течение 5 мин.
- Промыть неподвижную секцию в течение 5 мин при комнатной температуре PBS, а затем установить неподвижные опухолевые участки под стеклянным покровным слоем, используя 10 мкл водной монтажной среды с DAPI.
- От двенадцати до 24 часов после установки исследуйте неподвижные участки опухоли с помощью флуоресцентной микроскопии и получайте изображения, как описано для культивируемых клеток выше.
- Флуоресцентная микроскопия и получение изображений
- Определите интересующие области и получите изображения, как описано в разделе 2.6.
- Количественная оценка и анализ данных
- Количественно оценить ячейки и провести соответствующий статистический анализ, как в разделе 2.7.
4. Интернализация АТФ в опухолях, in vivo
- Подготовьте клеточные культуры к имплантации, как описано в разделе 3.1.
- Подкожная инъекция раковых клеток для развития опухоли ксенотрансплантата
- Генерировать ксенотрансплантированные опухоли, как описано в разделе 3.2.
- Инъекция АТФ и/или декстрана в опухоли ксенотрансплантата
- Готовят лечебные растворы ДМЭМ (транспортное средство) или 8 мг/мл HMWFD или LMWFD, с NHF-АТФ(100 мкМ) в ДМЭМ или без него, как описано выше.
- Используйте шприц объемом 1 мл, чтобы собрать 50 мкл одного лечебного раствора и ввести раствор непосредственно в каждую опухоль ксенотрансплантата. Повторите процедуру для четырех биологических реплик каждого лечения.
- Сбор и криоинстрирование тканей
- Подготовьте идентификационные этикетки для каждой опухоли, которая будет собрана. Вырежьте 2 см кусок лабораторной ленты и сложите пополам, склеив стороны вместе, вдоль. Используйте маркировочную ручку для маркировки метки, например, идентификационным номером мыши / опухоли.
- Примерно через 5 минут после инъекции усыпляют мышь путем вывиха шейки матки или в соответствии с протоколом, одобренным IACUC.
- Используя скальпель размером 10, сделайте разрез рядом с опухолью и примерно перпендикулярно направлению инъекции иглы. Используйте щипцы и хирургические ножницы для резекции опухолевой ткани из окружающих тканей.
- Разделите опухоль на две-четыре части по 1 см2 в зависимости от общего размера опухоли.
- Подготовьте встраиваемые формы и встройте ткань, как описано выше в разделе 3.6. Убедитесь, что время сбора урожая, от внутриопухолевой инъекции декстрана до криоинстрирования, составляет не более 7-8 мин.
- Подготовка слайдов образцов тканей
- Соберите серийные участки опухоли, как описано в разделе 3.7.
- Фиксация тканевых слайдов
- Зафиксируйте ткань, как описано в разделе 3.8.
- Флуоресцентная микроскопия и получение изображений
- Определите интересующие регионы и получите изображения, как описано в разделе 2.6.
- Количественная оценка и анализ данных
- Количественно оценить клетки и провести соответствующий статистический анализ, как описано в разделе 2.7.
Access restricted. Please log in or start a trial to view this content.
Результаты
Исследование in vitro
Внутриклеточная интернализация NHF-АТФ была продемонстрирована совместной локализацией NHF-ATP с HMWFD или LMWFD(рисунок 4). Успех этой процедуры в первую очередь зависит от использования соответствующих концентраций NHF-АТФ и декстра?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Разработан метод пространственного, временного и количественного анализа клеточной интернализации негидролизуемых АТФ. Этот метод широко применим для использования в различных биологических системах, включая различные опухолевые модели, для которых мы предоставляем технические ин...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Криосекционирование проводилось на месте в гистопатологическом ядре Университета Огайо. Эта работа была частично поддержана стартовыми фондами (Ohio University College of Arts & Sciences) для C Nielsen; Грант NIH R15 CA242177-01 и награда RSAC X Chen.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker - orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical - sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
Ссылки
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008(2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101(2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg's contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154(2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены