Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Тромбоцитарные внеклеточные везикулы функционализация Ti имплантатов
В этой статье
Резюме
Здесь мы представляем метод выделения внеклеточных везикул (EV), полученных из лизатов тромбоцитов (PL), и их использование для покрытия титановых (Ti) поверхностей имплантатов. Мы описываем метод капельного литья, профиль высвобождения EV с поверхностей и биосовместимость in vitro поверхностей EV, покрытых Ti.
Аннотация
Внеклеточные везикулы (EV) являются биологическими нановезикулами, которые играют ключевую роль в клеточной коммуникации. Их содержание включает активные биомолекулы, такие как белки и нуклеиновые кислоты, которые представляют большой потенциал в регенеративной медицине. Совсем недавно EV, полученные из лизата тромбоцитов (PL), показали остеогенную способность, сравнимую с PL. Кроме того, биоматериалы часто используются в ортопедии или реставрации зубов. Здесь мы предлагаем метод функционализации ti-поверхностей с помощью ЭЛЕКТРОМОБИЛей, полученных из PL, с целью улучшения их остеогенных свойств.
Электромобили выделяются из PL с помощью хроматографии исключения размеров, а затем ti-поверхности функционализируются PL-EV путем капельного литья. Функционализация доказана высвобождением EV и его биосовместимостью с помощью анализа высвобождения лактатдегидрогеназы (LDH).
Введение
EV представляют собой мембранные везикулы (30-200 нм), секретируемые любой клеткой и играющие ключевую роль в межклеточной коммуникации, доставляя свой груз. Они содержат различные активные биомолекулы, которые могут включать нуклеиновые кислоты, факторы роста или биологически активные липиды1. По этим причинам электромобили были оценены на предмет их потенциального использования в терапии. С точки зрения ортопедии и регенерации костей, были протестированы электромобили из разных источников. Среди них было показано, что тромбоцитарные EV индуцируют дифференцировочный эффект на стволовые клетки при сохранении низкого цитотоксического профиля2,3. Поэтому необходимы дальнейшие исследования для изучения возможности сочетания EV с биоматериалами с целью их использования в повседневной клинической практике.
Биоматериалы на основе титана широко используются в качестве каркасов для клинических вмешательств по заживлению костей из-за их механических свойств, высокой биосовместимости и долговечности4. Тем не менее, имплантаты Ti являются биоинертным материалом и, следовательно, обладают плохой способностью связываться с окружающей костной тканью5. По этой причине изучаются модификации титана с целью улучшения их характеристик за счет достижения более функционального микросреды на его поверхности4,6,7. В этом смысле электромобили могут быть привязаны к титану химическими8 или физическими взаимодействиями9,10. Иммобилизованные EV, полученные из стволовых клеток или макрофагов, повышают биоактивность Ti, способствуя клеточной адгезии и пролиферации, тем самым вызывая остеогенный эффект8,9,10.
Эта статья будет подробно посвящена стратегии капельного литья для покрытия поверхностей Ti электромобилями, полученными из PL. Кроме того, мы оценим профиль высвобождения электромобилей с поверхности покрытия с течением времени и подтвердим его клеточную биосовместимость in vitro.
протокол
Лизат тромбоцитов (PL) получают, как описано ранее, в соответствии с институциональными руководящими принципами3 с использованием свежих пушистых покрытий, предоставленных биобанком IdISBa в качестве исходного материала. Их использование для текущего проекта было одобрено его Комитетом по этике (IB 1995/12 BIO).
1. Изоляция электромобилей от PL
- Удаление более крупных тел
- Разморозить PL при комнатной температуре.
- Центрифуга PL при 1 500 х г в течение 15 мин при 4 °C. Выбросьте гранулу, так как она содержит клеточный мусор.
- Соберите супернатант и выполните две последовательные центрифугации при 10 000 х г в течение 30 мин при 4 °C.
ПРИМЕЧАНИЕ: Гранула соответствует более крупным электромобилям, таким как микровезикулы, и в этом случае она выбрасывается. - Фильтруют супернатант сначала через пористую мембрану 0,8 мкм, а затем через пористую мембрану 0,2 мкм.
ПРИМЕЧАНИЕ: Эти шаги удаляют все ненужные электромобили. - Объедините фильтрованный PL и храните при температуре -20 °C до использования.
- Исключение размеров хроматография
- Уравновешивайте колонну, соединенную с хроматографическим оборудованием, с требуемой скоростью потока с фильтрованным PBS.
ПРИМЕЧАНИЕ: Используемый расход зависит от характеристик колонны; в этом случае он установлен на 0,5 мл/мин. - Загрузите обработанный PL (5 мл) шприцем на оборудование.
- Введите PL в колонну и начните собирать фракции 5 мл в пробирках по 15 мл.
- Соберите фракции, обогащенные электромобилями, и храните их при -80 °C до использования.
ПРИМЕЧАНИЕ: При проведении эксперимента в первый раз охарактеризуйте все фракции путем количественной оценки белка и иммунодетекции для определения фракции, обогащенной EV3,11. В этом эксперименте собирается 9-я фракция. - Промыть хроматографическую колонку 30 мл 0,2% раствора NaOH и хранить его в 20% растворе этанола, как только он достигнет равновесия.
- Уравновешивайте колонну, соединенную с хроматографическим оборудованием, с требуемой скоростью потока с фильтрованным PBS.
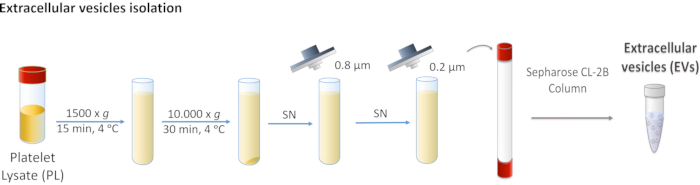
Рисунок 1: Принципиальная схема изоляции внеклеточного везикула (EV) лизата тромбоцитов (PL). PL центрифугируется сначала при 1 500 x g, а затем при 10 000 x g для удаления более крупных тел. Супернатант фильтруется через фильтры 0,8 и 0,2 мкм. Обработанные PL загружаются в колонну, а электромобили разделяются хроматографией исключения размеров. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Характеристика электромобилей
ПРИМЕЧАНИЕ: Характеристика электромобилей необходима для проведения функциональных исследований12. Ранее сообщалось о электронной микроскопии или характеристике западного пятна13. В настоящем докладе основное внимание будет уделено основным методам характеристик функционализации поверхности Ti.
- Анализ отслеживания наночастиц (NTA)
- Разбавьте электромобили (1:1000) в 0,2 мкм отфильтрованной PBS.
ПРИМЕЧАНИЕ: Слишком концентрированные образцы или слишком разбавленные пробы будут находиться вне диапазона для определения НТА, и потребуется корректировка. - Загрузите 1 мл разбавленных электромобилей шприцем в оборудование NTA и впрыскивайте их в оборудование NTA.
- Следуйте протоколу производителя для определения концентрации частиц и распределения по размерам.
- Разбавьте электромобили (1:1000) в 0,2 мкм отфильтрованной PBS.
- Концентрация белка
- Определяют концентрацию, используя 1 мкл раствора EV. Измерьте поглощение с помощью спектрофотометра на длине волны 280 нм.
ПРИМЕЧАНИЕ: EV должны иметь низкий уровень белков по сравнению с количеством частиц. - Следуйте инструкциям производителя, чтобы получить показания абсорбции с помощью спектрофотометра.
- Определяют концентрацию, используя 1 мкл раствора EV. Измерьте поглощение с помощью спектрофотометра на длине волны 280 нм.
3. Функционализация поверхности титана
ПРИМЕЧАНИЕ: В этом методе используются обработанные титановые диски, c.p. grade IV, диаметром 6,2 мм и высотой 2 мм. Дисками можно манипулировать с помощью пинцета Ti, но важно не царапать поверхность. Кроме того, обработанная сторона должна быть обращена вверх в течение всего процесса.
- Мойка дисков Ti
ПРИМЕЧАНИЕ: Объем растворов, используемых для мойки Ti, должен быть достаточным для покрытия Ti-дисков. Поместите диски Ti в стеклянный стакан и налейте на них растворы. Затем удалите раствор путем декантирования.- Промойте имплантаты Ti деионизированной (DI) водой, а затем выбросьте воду.
- Промыть имплантаты Ti этанолом на 70%, а затем декантировать для удаления раствора.
- Поместите имплантаты в воду DI и соникуйте при 50 °C в течение 5 минут. Выбросьте воду.
- Инкубировать имплантаты Ti в 40% растворе NaOH при 50 °C в течение 10 мин с перемешиванием. Выбросьте раствор.
ВНИМАНИЕ: Раствор NaOH нагревается во время приготовления. Раствор является коррозионным и должен использоваться внутри вытяжной вытяжки. - Обработайте имплантаты ультразвуком в воде DI при 50 °C в течение 5 минут, а затем удалите воду.
- Выполните несколько промывок водой DI (не менее 5), пока она не достигнет нейтрального рН. Проверьте pH с помощью индикаторов pH.
- Обработайте имплантаты ультразвуком в воде DI при 50 °C в течение 5 минут и удалите воду.
- Инкубировать имплантаты Ti в 50% растворе HNO3 при 50 °C в течение 10 мин с перемешиванием. Удалите раствор.
ВНИМАНИЕ: HNO3 является коррозионным и окислительным веществом, и его следует использовать внутри вытяжного шкафа. - Обрабатывайте имплантаты ультразвуком в воде DI при 50 °C в течение 5 мин. Удалите воду.
- Выполните несколько промывок водой DI (не менее 5) до получения нейтрального рН. Проверьте pH с помощью индикаторов pH.
- Обрабатывайте имплантаты ультразвуком в воде DI при 50 °C в течение 5 мин. Удалите воду.
ПРИМЕЧАНИЕ: На этом этапе эксперимент можно остановить, сохранив имплантаты Ti в 70% растворе этанола.
- Ти пассивация
ПРИМЕЧАНИЕ: Этапы пассивации Ti выполняются путем полного покрытия дисков Ti различными решениями в порядке, указанном ниже. Диски Ti помещают в стеклянный стакан и аккуратно наливают на них растворы. Объемы, используемые на всех этапах стирки, должны полностью покрывать имплантаты и удаляться с помощью декантирования.- Инкубируйте имплантаты Ti в 30% растворе HNO3 в течение 30 мин при комнатной температуре при мягком перемешивании. Удалите раствор.
- Выполните несколько промывок водой DI (не менее 5), пока она не достигнет нейтрального рН. Проверьте pH с помощью индикаторов pH.
- Инкубируйте имплантаты Ti на ночь при комнатной температуре в воде DI.
- Высушите имплантаты в вакуумных условиях при 40 °C в течение 10 мин.
- Капельное литье электромобилей
ПРИМЕЧАНИЕ: Для функциональных исследований клеток важно работать в шкафу клеточной культуры.- Поместите имплантаты Ti в 96-луночную пластину, обработанную стороной вверх.
ПРИМЕЧАНИЕ: Если имплантаты перевернуты вверх дном, можно использовать иглу, чтобы установить их обратно. - Разморозьте раствор электромобилей и смешайте их с перемешиванием. Используйте вихрь для пульса в течение 3 с.
- Поместите электромобили на поверхность Ti. В этом исследовании капли 40 мкл раствора EV помещают на Ti для иммобилизации максимум 4 x 1011 EV на имплантат в соответствии с концентрацией, определенной NTA.
- Поместите пластины, содержащие Ti, в вакуумных условиях при 37 °C до полного высыхания капель (~2 ч).
ПРИМЕЧАНИЕ: Отрегулируйте время в зависимости от количества имплантатов и воды, присутствующей в вакуумной камере.
- Поместите имплантаты Ti в 96-луночную пластину, обработанную стороной вверх.
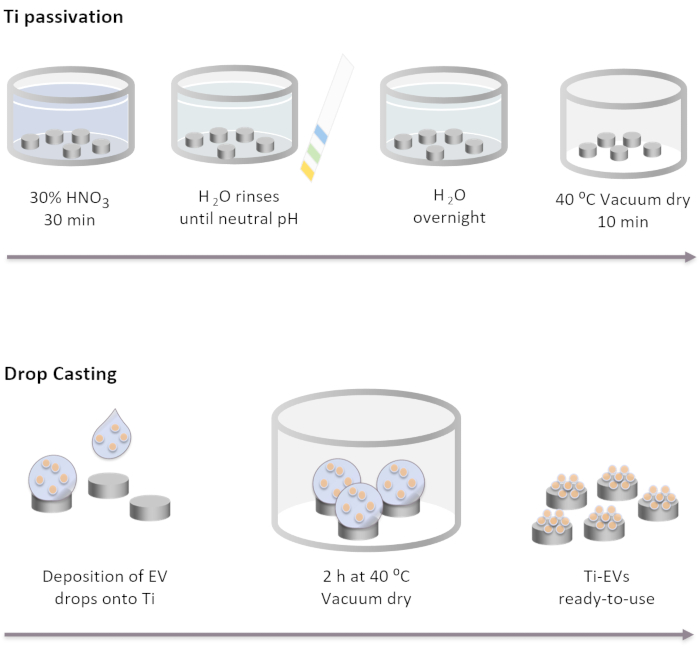
Рисунок 2: Принципиальная схема пассивации Ti и функционализации электромобилей методом капельного литья. Имплантаты Ti сначала пассивируют путем инкубации в течение 30 мин в 30% растворе HNO3 при комнатной температуре. После нескольких смывов водой DI рН достигает нейтрального уровня. Затем имплантаты Ti инкубируют в течение ночи при комнатной температуре в воде DI. После этого имплантаты высушиваются в вакуумных условиях при 40 °C. Для иммобилизации электромобилей 40 мкл раствора EV наносятся на имплантаты Ti. Затем имплантаты инкубируют в вакууме в течение 2 ч, пока EV физически не будут связаны с поверхностью. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Характеристика поверхности Ti
- Исследование релиза
- Инкубировать поверхность Ti с 200 мкл фильтрованного PBS при 37 °C.
ПРИМЕЧАНИЕ: PBS фильтруется во избежание помех измерению NTA. - Замените PBS в разные моменты времени и храните при -80 °C.
ПРИМЕЧАНИЕ: В этом исследовании были проанализированы 2-, 6-, 10- и 14-дневные временные точки. - Анализ хранимых PBS для исследования частиц NTA в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Концентрация частиц в PBS в разное время является представлением профиля высвобождения EV с течением времени.
- Инкубировать поверхность Ti с 200 мкл фильтрованного PBS при 37 °C.
- Исследования биосовместимости
ПРИМЕЧАНИЕ: Мезенхимальные стволовые клетки, полученные из пуповины человека (hUC-MSC), получают из биобанка IdISBa в соответствии с институциональными руководящими принципами.- Поддерживать hUC-MSC в DMEM с низким содержанием глюкозы, дополненной 20% FBS до использования. Меняйте среду два раза в неделю.
- Для посева клеток промыть клетки в колбах с 5 мл PBS дважды.
- Трипсинизируют hUC-MSC путем добавления 1 мл раствора трипсина. Убедитесь, что он полностью покрывает монослой клеток. Удалите раствор трипсина и поместите колбу для культивирования клеток при 37 °C примерно на 2 мин. Просмотр отслоения клеток под микроскопом. Отсоединившиеся клетки будут выглядеть округлой формы и будут находиться во взвешенном состоянии.
- Повторное суспендирование клеток в DMEM с низким содержанием глюкозы с 1% EV истощенным FBS.
ПРИМЕЧАНИЕ: Подготовьте носитель, дополненный 1% FBS, а затем ультрацентрифугу при 120 000 х г в течение 18 ч для удаления FBS-EV. Важно удалить ev, чтобы избежать помех с тромбоцитарными EV. - Определение концентрации клеток путем подсчета количества клеток с камерой Нойбауэра14.
- Доведите hUC-MSC до концентрации 50 000 клеток/мл.
- Посадите 200 мкл клеточного раствора на имплантаты Ti.
- Через 48 ч собрать 50 мкл среды и выполнить цитотоксическое определение с использованием набора активности лактатдегидрогеназы (ЛДГ) в соответствии с протоколом производителя.
Результаты
Метод, представленный в данной статье, позволяет получить электромобили функционализированных титановых дисков. Электромобили физически связаны с поверхностью, что обеспечивает устойчивое высвобождение с течением времени. Количество выпущенных электромобилей может быть измерено NT...
Обсуждение
Этот протокол направлен на предоставление четких инструкций по функционализации электромобилей на поверхностях Ti. Представленный метод основан на стратегии капельного литья, которая является физисорбционным типом функционализации. Существует плохая библиография в отношении функц?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование финансировалось Институтом спасения Карлоса III, Министерством экономики и конкуренции, совместно финансируемым Европейским социальным фондом ESF и Европейским фондом регионального развития ERDF (MS16/00124; СР16/00124; PI17/01605), Direcció General d'Investigació, Conselleria d'Investigació, Govern Balear (FPI/2046/2017) и PROGRAMA JUNIOR del projecte TALENT PLUS, construyendo SALUD, generando VALOR (JUNIOR01/18), финансируемые за счет налога на устойчивый туризм Балеарских островов.
Материалы
| Name | Company | Catalog Number | Comments |
| 0,8 µm syringe filter | Sartorius | 16592K | |
| 1.5 mL Centrifuge tube | SPL life sciences | PLC60015 | |
| 1mL syringe | BD | 303174 | |
| 96-well culture plate | SPL life sciences | PLC30096 | |
| Absolut ethanol | Scharlau | ET0006005P | Used to prepare 20 % ethanol with Milli-Q® water |
| AKTA purifier System | GE Healthcare | 8149-30-0014 | |
| Allegra X-15R Centrifuge | Beckman Coutler | 392934 | SX4750A swinging rotor |
| Centrifuge 5430 R | Eppendorf | 5428000210 | F-45-48-11 rotor |
| Conical Tube, Conical Bottom, 50ml | SPL life sciences | PLC50050 | |
| Cytotoxicity Detection Kit (LDH) | Roche | 11644793001 | |
| Disposable Syringes 10 ml | Becton Dickinson | BDH307736 | |
| DMEM Low Glucose Glutamax | GIBCO | 21885025 | |
| Dulbecco's PBS (1x) | Capricorn Scientific | PBS-1A | |
| Fetal Bovine Serum (FBS) Embrionic Certified | GIBCO | 16000044 | |
| Filtropur S 0.2 µm syringe filter | Sarstedt | 83.1826.001 | |
| HiPrep 16/60 Sephacryl S-400 HR | GE Healthcare | 28-9356-04 | Precast columns |
| human umbilical cord-derived mesenchymal stem cells (hUC-MSC) | IdISBa Biobank | ||
| Nanodrop 2000 spectrophotometer | ThermoFisher | ND-2000 | |
| NanoSight NS300 nanoparticle tracking analysis | Malvern | NS300 | Device with embedded laser at λ= 532 nm and camera sCMOS |
| Needle | Terumo | 946077135 | |
| Nitric acid 69,5% | Scharlau | AC16071000 | |
| Optima L-100 XP Ultracentrifuge | Beckman Coulter | 8043-30-1124 | SW-32Ti Rotor |
| Penicillin-Streptomycin Solution 100X | Biowest | L0022 | |
| pH Test strips 4.5-10.0 | Sigma | P-4536 | |
| Platelet Lysate (PL) | IdISBa Biobank | Obtained from buffy coats discarded after blood donation | |
| Polypropylene centrifuge tubs | Beckman Coutler | 326823 | |
| Power wave HT | BioTek | 10340763 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstedt | 62554502 | |
| Sodium hidroxide | Sharlau | SO04251000 | |
| Titanium implants replicas | Implantmedia, SA | NA | Titanium grade IV. Diameter: 6,2 mm. Height: 1,95 mm |
| Trypsin-EDTA 1 X | Biowest | L0930 | |
| Tryton X100 | Sigma | T8787 |
Ссылки
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19 (4), 213-228 (2018).
- Torreggiani, E., et al. Exosomes: novel effectors of human platelet lysate activity. European Cells & Materials. 28, 137-151 (2014).
- Antich-Rosselló, M., et al. Platelet-derived extracellular vesicles promote osteoinduction of mesenchymal stromal cells. Bone and Joint Research. 9 (10), 667-674 (2020).
- Li, Y., et al. New developments of Ti-based alloys for biomedical applications. Materials. 7 (3), 1709-1800 (2014).
- Lan, W. C., et al. The potential of a nanostructured titanium oxide layer with self-assembled monolayers for biomedical applications: Surface properties and biomechanical behaviors. Applied Sciences. 10 (2), 590 (2020).
- Jemat, A., Ghazali, M. J., Razali, M., Otsuka, Y. Surface modifications and their effects on titanium dental implants. BioMed Research International. 2015, 791725 (2015).
- Damiati, L., et al. Impact of surface topography and coating on osteogenesis and bacterial attachment on titanium implants. Journal of Tissue Engineering. 9, 2041731418790694 (2017).
- Chen, L., et al. Self-assembled human adipose-derived stem cell-derived extracellular vesicle-functionalized biotin-doped polypyrrole titanium with long-term stability and potential osteoinductive ability. ACS Applied Materials & Interfaces. 11 (49), 46183-46196 (2019).
- Wei, F., Li, M., Crawford, R., Zhou, Y., Xiao, Y. Exosome-integrated titanium oxide nanotubes for targeted bone regeneration. Acta Biomaterialia. 86, 480-492 (2019).
- Wang, X., et al. Exosomes influence the behavior of human mesenchymal stem cells on titanium surfaces. Biomaterials. 230, 119571 (2020).
- Lozano-Ramos, I., et al. Size-exclusion chromatography-based enrichment of extracellular vesicles from urine samples. Journal of Extracellular Vesicles. 4, 27369 (2015).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Liu, J., et al. Isolation and characterization of extracellular vesicles from adult schistosoma japonicum. Journal of Visualized Experiments: JoVE. (135), e57541 (2018).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2021).
- Chouirfa, H., Bouloussa, H., Migonney, V., Falentin-Daudré, C. Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomaterialia. 83, 37-54 (2019).
- Córdoba, A., Monjo, M., Hierro-Oliva, M., González-Martín, M. L., Ramis, J. M. Bioinspired quercitrin nanocoatings: A fluorescence-based method for their surface quantification, and their effect on stem cell adhesion and differentiation to the osteoblastic lineage. ACS Applied Materials and Interfaces. 7 (30), 16857-16864 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены