Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Глубокие и пространственно контролируемые объемные абляции с использованием двухфотонного микроскопа в гаструле рыбок данио
В этой статье
Резюме
Эмбриональное развитие требует масштабной координации движения клеток. Двухфотонное возбуждение опосредованной лазерной абляцией позволяет осуществлять пространственно управляемую 3-мерную абляцию больших групп глубоких клеток. Кроме того, этот метод может исследовать реакцию коллективно мигрирующих клеток in vivo на возмущения в их механической среде.
Аннотация
Морфогенез включает в себя множество движений клеток для организации клеток в ткани и органы. Для правильного развития все эти движения должны быть тесно скоординированы, и накопленные данные свидетельствуют о том, что это достигается, по крайней мере частично, посредством механических взаимодействий. Тестирование этого на эмбрионе требует прямых физических возмущений. Лазерные абляции являются все более используемым вариантом, который позволяет снять механические ограничения или физически изолировать две клеточные популяции друг от друга. Тем не менее, многие абляции выполняются ультрафиолетовым (УФ) лазером, который предлагает ограниченное осевое разрешение и проникновение в ткани. Здесь описан способ абляции глубоких, значительных и пространственно четко определенных объемов с помощью двухфотонного микроскопа. Абляции демонстрируются в трансгенной линии рыбок данио, экспрессирующей зеленый флуоресцентный белок в осевой мезендодерме, и используются для разрыва осевой мезендодермы, не затрагивая вышележащую эктодерму или нижележащую желтковую клетку. Поведение клеток контролируется живой визуализацией до и после абляции. Протокол абляции может использоваться на разных стадиях развития, на любом типе клеток или тканей, в масштабах от нескольких микрон до более ста микрон.
Введение
Клеточно-клеточные взаимодействия играют жизненно важную роль в развитии. Клетки предоставляют сигналы, которые могут воспринимать их прямые соседи или клетки, находящиеся дальше, тем самым влияя на их судьбу и / или поведение. Многие из этих сигналов носят химический характер. Например, в хорошо охарактеризованных событиях индукции одна группа клеток производит диффузные молекулы, влияющие на судьбу другой клеточной популяции1. Другие сигналы, однако, являются механическими; клетки оказывают на соседей силы и ограничения, которые соседи воспринимают и на которые реагируют2.
Одним из способов изучения важности этих клеточно-клеточных взаимодействий in vivo является устранение некоторых клеток и наблюдение за последующим развитием. К сожалению, доступные методы удаления или уничтожения клеток ограничены. Клетки могут быть удалены хирургическим путем3,4 с помощью игл или небольших проводов, но такие методы лечения являются инвазивными, не очень точными и обычно выполняются под стереомикроскопом, предотвращая немедленную визуализацию под микроскопом. Кроме того, нацеливание на глубокие клетки подразумевает прокалывание отверстия в вышележащих тканях, создавая нежелательные возмущения. Генетически закодированные фотосенсибилизаторы, такие как KillerRed, использовались для индуцирования гибели клеток с помощью светового освещения5. Фотосенсибилизаторы представляют собой хромофоры, которые генерируют активные формы кислорода при световом облучении. Их основным ограничением является то, что они требуют длительного светового освещения (около 15 минут), чего может быть трудно достичь, если клетки движутся, и что они вызывают гибель клеток через апоптоз, который не является немедленным.
Наконец, лазерные абляции были разработаны и широко используются в последние 15 лет6,7,8,9,10,11,12. Лазерный луч фокусируется на целевой клетке/ткани. Он индуцирует его абляцию посредством нагревания, фотоабляции или плазменной абляции; задействованный процесс зависит от плотности мощности и времени экспозиции13. Большинство протоколов абляции используют УФ-лазеры для их высокой энергии. Однако ультрафиолетовый свет поглощается и рассеивается биологическими тканями. Таким образом, нацеливание на глубокие клетки требует высокой мощности лазера, который затем вызывает повреждения в более поверхностных, внеплановых тканях. Это ограничивает использование УФ-лазеров поверхностными структурами и объясняет их относительно низкое осевое разрешение. Нелинейная оптика (так называемая двухфотонная микроскопия) использует нелинейные свойства света для возбуждения флуорофора двумя фотонами примерно половинной энергии в инфракрасной области. При применении к абляциям это имеет три основных преимущества. Во-первых, инфракрасный свет меньше рассеивается и меньше поглощается биологическими тканями, чем ультрафиолетовый свет14, что позволяет достигать более глубоких структур без увеличения необходимой мощности лазера. Во-вторых, использование фемтосекундного импульсного лазера обеспечивает очень высокие плотности мощности, создавая абляцию за счет плазменной индукции, которая, в отличие от нагрева, не диффундирует пространственно15. В-третьих, плотность мощности, индуцирующая плазмообразование, достигается только в фокальной точке. Благодаря этим свойствам двухфотонная лазерная абляция может быть использована для точного нацеливания на глубокие клетки, не влияя на окружающую среду тканей.
Коллективные миграции являются отличным примером процессов развития, в которых взаимодействие клеток и клеток является фундаментальным. Коллективные миграции определяются как миграции клеток, в которых соседние клетки влияют на поведение одной клетки16. Природа этих взаимодействий (химических или механических) и то, как они влияют на миграцию клеток, может сильно различаться и часто не совсем понятна. Способность удалять клетки и наблюдать, как это влияет на других, имеет решающее значение для дальнейшего разгадывания этих коллективных процессов. Несколько лет назад мы установили — используя хирургические подходы — что миграция полстера во время гаструляции рыбок данио является коллективной миграцией17. Полстер представляет собой группу клеток, которые составляют первые интернализующие клетки на дорсальной стороне эмбриона18. Эти клетки, помеченные зеленым цветом в трансгенной линии Tg(gsc:GFP), расположены глубоко в эмбрионе, ниже нескольких слоев клеток эпибластов. Во время гаструляции эта группа возглавляет расширение осевой мезодермы, мигрируя от эмбрионального органайзера к полюсу животного19,20,21,22,23 (рисунок 1А). Мы установили, что клеткам требуется контакт со своими соседями, чтобы сориентировать свою миграцию в направлении полюса животных. Тем не менее, лучшее понимание клеточных и молекулярных основ этой коллективной миграции включает в себя удаление некоторых клеток, чтобы увидеть, как это влияет на оставшиеся. Поэтому мы разработали абляции больших и глубоких объемов с использованием двухфотонной микроскопической установки. Здесь мы демонстрируем использование этого протокола для разрыва полстера в его середине и наблюдаем последствия миграции клеток путем отслеживания ядер, помеченных Histone2B-mCherry.
протокол
Все работы с животными были одобрены Этическим комитетом N 59 и Министерством национального образования, высшего образования и исследований под номером APAFIS#15859-2018051710341011v3. Некоторые из шагов, описанных ниже, специфичны для нашего оборудования и программного обеспечения, но могут быть легко адаптированы к различному оборудованию.
1. Инъекционная подготовка
- Готовят 75 мл 1% раствора агарозы в эмбриональной среде (ЭМ).
- Поместите инжекторную форму в чашку Петри толщиной 90 мм и залейте примерно 50 мл агарозы, достаточной для того, чтобы форма всплыла. Дайте агарозе затвердеть и удалите инжекторную форму.
- Приготовьте блюдо, покрытое агарозой, налив 1 мл агарозы в чашку Петри толщиной 30 мм.
- Приготовьте 4 мкл 30 нг/мкл раствора мРНК Histone2B-mCherry, разбавляя исходный раствор в воде, не содержащей РНКазы, и держите на льду.
ПРИМЕЧАНИЕ: Позаботьтесь о том, чтобы носить перчатки при манипулировании мРНК, чтобы избежать деградации, опосредованной RNase. - Вытяните инъекционную иглу из капилляра с помощью съемника микропипетки.
2. Подготовка эмбрионов
- После того, как рыбы отложили яйца, соберите, промойте и соберите урожай в 90-миллиметровой чашке Петри в ЭМ. Поместите эмбрионы в инкубатор при температуре 28,5 °C.
- Подождите 20 минут, пока первая клетка станет видимой.
- Перенесите 30 эмбрионов на инъекционную пластину, заполненную ЭМ. Выдавите эмбрионы в бороздки с помощью слегка тупых щипцов и ориентируйте их с поднятым вверх полюсом животного.
- Используя наконечник микрозагрузчика, заполните инъекционную иглу 2 мкл раствора мРНК. Вставьте иглу в капиллярный держатель, помещенный в микроманипулятор, соединенный с трубкой из политетрафторэтилена (PTFE), с воздушным инжектором.
- Под стереомикроскопом осторожно разбейте кончик иглы.
- Вводят раствор мРНК в эмбрионы 1-клеточной стадии, вставляя иглу в клетку.
ПРИМЕЧАНИЕ: Вводимый объем составляет примерно одну треть объема клетки. - Поместите обратно введенные эмбрионы в инкубатор при температуре 28,5 °C.
3. Подготовка двухфотонного микроскопа
ПРИМЕЧАНИЕ: В этом протоколе используются два лазера. Один из них используется для изображения GFP (при 920 нм) и выполнения абляций (при 820 нм). Он будет называться зеленым / абляционным лазером. Другой используется при 1160 нм для изображения mCherry. Он будет называться красным лазером.
- Установите зеленый/абляционный лазер на 820 нм (длина волны абляции), а красный лазер на 1160 нм (возбуждение мВечерри).
- Используя подвижные зеркала на оптическом пути, выровняйте зеленый/абляционный и красный лазерные лучи как на входе, так и на выходе из сканирующей головки.
ПРИМЕЧАНИЕ: Это увеличивает фокус лазерного луча и минимизирует фокусный объем для возбуждения и абляции. - Измерьте максимальную мощность зеленого/абляционного лазера при 820 нм под объективом. Для этого поместите измеритель мощности под объектив, закройте черную камеру, установите мощность зеленого / абляционного лазера на 100% и откройте жалюзи. Рассчитайте процент мощности лазера, необходимый для достижения 300 мВт.
- Установите зеленый / абляционный лазер до 920 нм (возбуждение GFP) и установите мощность лазера на 7%. Установите мощность красного лазера на 15%.
- Активация детекторов epi-PhotoMultiplier Tubes (PMT) для зеленых и красных линий; установите чувствительность зеленой и красной линии PMT на 65.
- Установите поле зрения на 400 x 400 мкм, разрешение изображения на 512 x 512 пикселей и частоту сканирования на 800 Гц.
- Выберите режим 3D Timelapse Imaging . Затем создайте папку и активируйте автосохранение для данных после каждого сбора.
- Соберите нагревательную камеру и установите ее на 28 °C. Подождите не менее 10 минут, пока камера и объектив согреются.
4. Монтаж эмбриона
- С помощью флуоресцентного стереомикроскопа идентифицируйте эмбрионы на 70% эпиболии, которые экспрессируют GFP.
ПРИМЕЧАНИЕ: Выберите эмбрионы с ярким сигналом в осевой мезодерме и без фоновой флуоресценции для лучшего качества изображения. - Перенесите три-четыре отобранных эмбриона в блюдо, покрытое агарозой (этап 1.3), с помощью пластиковой пипетки Пастера и аккуратно дехорионируйте их с помощью тонких щипцов.
ПРИМЕЧАНИЕ: Дехорионированные эмбрионы очень деликатны и лопаются при контакте с воздухом или пластиком. - Влить 1 мл 0,2% агарозы в 1x пенициллин-стрептомицин ЭМ в небольшой стеклянный флакон. Поместите флакон в предварительно нагретый 42 °C сухой блочный нагреватель.
ПРИМЕЧАНИЕ: Следующие шаги должны быть выполнены быстро, чтобы обеспечить ориентацию эмбриона до наборов агарозы. - Перенесите дехорионированный эмбрион в флакон с 0,2% агарозным стеклом с помощью огнеполированной стеклянной пипетки. Позаботьтесь о том, чтобы не добавлять слишком много ЭМ в агарозу, чтобы избежать ее разбавления. Выбросьте оставшуюся ЭМ из пипетки и аспирируйте эмбрион обратно вместе с достаточным количеством агарозы, чтобы покрыть слайд стеклянной нижней тарелки, прежде чем эмбрион выпадет из пипетки.
- Выдуйте агарозу и эмбрион на стеклянную горку блюда. Позаботьтесь о том, чтобы эмбрион не коснулся воздуха или пластиковой стороны тарелки. Далее заполните камеру вокруг стеклянной горки агарозой.
- Используйте ресницу, чтобы сориентировать эмбрион так, чтобы целевая область находилась вверху (рисунок 1B).
ПРИМЕЧАНИЕ: При ориентации эмбрионов позаботьтесь о том, чтобы коснуться только бластодермы, а не очень хрупкого желтка. Агароз устанавливается примерно через 1 минуту, в зависимости от комнатной температуры. - Подождите ~5 мин, пока агароза полностью сложится, а затем добавьте несколько капель пенициллин-стрептомицина ЭМ.
5. Определение местонахождения эмбриона и предабляционная визуализация
- Поместите стеклянную нижнюю посуду под объектив в нагретую камеру. Погрузите объектив в пенициллин-стрептомицин ЭМ и закройте нагреваемую камеру.
- Переместите ползунок, чтобы задать световой контур на окуляры. Затем, используя окуляры, люминесцентные лампы и сценический контроль, найдите эмбрион и установите фокус на поверхность эмбриона.
- Выключите люминесцентную лампу, установите световой путь к PMT и закройте черную камеру.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы выключить все источники света в черной камере, так как это может повредить PMT. - Запустите визуализацию в реальном времени и найдите осевую мезодерму. Отрегулируйте мощность зеленого / абляционного и красного лазера, чтобы иметь хороший сигнал (т. Е. От 1000 до 20000 фотонов на пиксель для областей экспрессии GFP). Используйте красный канал, чтобы переместить стадию в самый верх эмбриона и установить это положение как Z = 0.
- Выберите временной шаг 1 мин и Z-шаг 2 мкм. Z-курс 110 мкм достаточен для охвата всего полстера и приобретается менее чем за 1 мин с этими настройками. Установите первый срез на 15 мкм выше осевой мезодермы (в более поверхностной эктодерме).
ПРИМЕЧАНИЕ: Полстер движется вдоль изогнутой линии так, что нижний срез Z-стека должен быть установлен на 30 мкм глубже, чем самое глубокое положение полстера, чтобы приспособиться к его движению во время покадровой визуализации (рисунок 1E). - Запись 10-15 минут предварительного абляционного фильма.
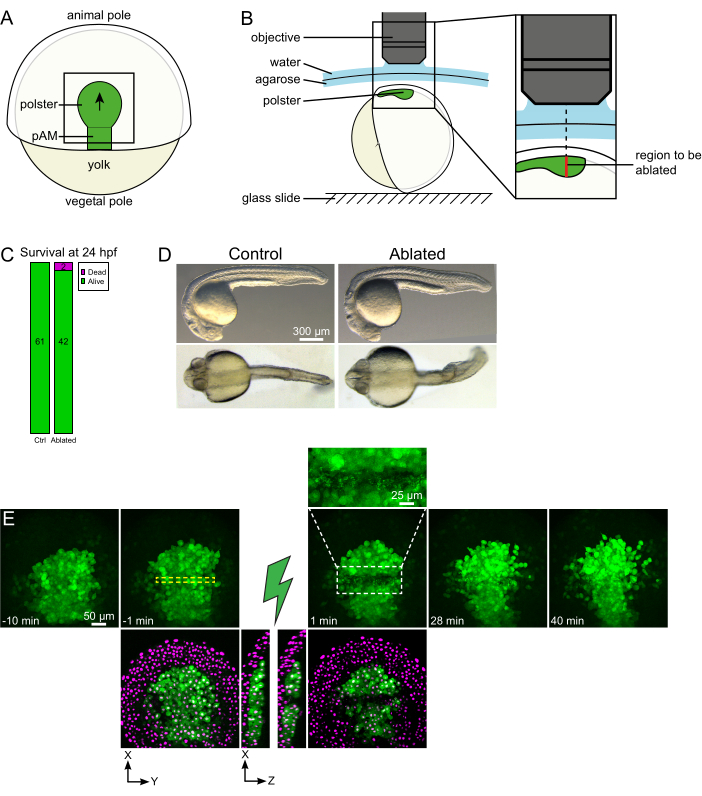
Рисунок 1: Успешный исход лазерной абляции. (А) Схема гаструлирующего эмбриона при 70% эпиболии в дорсальном виде; pAM: задняя осевая мезодерма; черная стрелка отмечает направление миграции полстеров; черный квадрат указывает на типичное поле зрения для абляций в полстере. (B) Схема крепления эмбриона для разрыва полстера. Боковой вид. Эмбрион смонтирован таким образом, что плоскость полстера перпендикулярна оптической оси. (C) выживаемость и (D) морфология контрольных и абляционных эмбрионов через 24 ч после оплодотворения. Шкала бара составляет 300 мкм. (E) Временная последовательность от лазерной абляции в полстере эмбриона Tg(gsc:GFP), экспрессирующего Histone2B-mCherry. Виды только с зеленым каналом являются максимальными проекциями. Крупный план отображает абляционную область, содержащую клеточный мусор. Виды с зеленым и красным (отображается как пурпурный) каналами представляют собой срезы XY и XZ до и после абляции (зеленая молния представляет абляцию). Срезы XZ показывают, что вышележащие ткани (пурпурные ядра без экспрессии GFP) не были затронуты абляцией нижележащих структур. Желтая пунктирная рамка соответствует ROI, выбранному для лазерной абляции. Шкала составляет 50 мкм на больших снимках и 25 мкм на крупном плане. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Определение местоположения цели и лазерная абляция
- Найдите контур полстера на изображениях в реальном времени и с помощью инструмента «Область интереса электрооптического модулятора» (EOM ROI) нарисуйте большой прямоугольник размером 20 пикселей (15 мкм), охватывающий ширину полстера. Поместите этот прямоугольник в середину полстера (рисунок 1E).
- Обратите внимание на осевое положение самой высокой и самой низкой плоскостей, содержащих ячейки полстера. Абляции будут выполняться каждые 10 мкм между этими двумя плоскостями. Позаботьтесь о том, чтобы ROI не перекрывал желтковую ячейку ни на одной из этих плоскостей.
- Поместите сцену в самое низкое положение Z интервала. Абляции должны выполняться снизу вверх, так как мусор поглощает свет.
- Установите длину волны зеленого/абляционного лазера на 820 нм и установите процент мощности , чтобы получить выходную мощность 300 мВт (шаг 3.3).
- Установите частоту изображения на 200 Гц.
- Установите для параметра EOM зеленой/абляционной лазерной визуализации значение 0 и выберите режим ROI-Treatment .
- Включите EOM и настройте процедуру на немедленное начало (после 0 кадров).
- Установите для режима обработки изображений значение Timelapse и отмените активацию автосохранения.
- Установите шаг времени в быстрый режим.
- Установите для параметров Количество кадров обработки и Число кадров значение, соответствующее заданной глубине (таблица 1).
| Глубина (мкм) | Лечебные каркасы |
| -30 | 1 |
| -35 | 1-2 |
| -40 | 1-2 |
| -45 | 2 |
| -50 | 2-3 |
| -55 | 3 |
| -60 | 3-4 |
| -65 | 4 |
| -70 | 4 |
| -75 | 4-5 |
| -80 | 4-5 |
| -85 | 5 |
| -90 | 5 |
| -95 | 5-6 |
| -100 | 6 |
| -105 | 6 |
Таблица 1: Предлагаемое количество рамок лазерной обработки в зависимости от глубины целевой клетки в эмбрионе (0 является поверхностью эмбриона).
- Запустите создание образа. Приобретение черное, так как затвор PMT закрывается во время обработки EOM.
- Поднимитесь по сцене на следующую позицию Z списка (шаг 6.2).
- Повторяйте шаги с 6.10 по 6.12 до тех пор, пока не будет достигнута верхняя часть полстера.
7. Постабляционная верификация и визуализация
- Установите зеленый/ абляционный лазер на 920 нм и мощность 5%. Установите EOM зеленой/абляционной лазерной визуализации на 100 и выберите режим Fullfield .
- Установите для параметра Частота изображения значение 800 Гц. Выключите EOM.
- Пройдите через весь стек в режиме реального времени, чтобы проверить, был ли удален каждый самолет. Если это не так, вернитесь к шагу 6.2.
ПРИМЕЧАНИЕ: Абляция иногда вызывает вертикальное смещение соседних тканей, так что Z-стек, возможно, придется переопределить. - Установите для режима обработки изображений значение 3D Timelapse и повторно активируйте автосохранение. Запись 40-60 минут постабляционного фильма.
- Проверьте, в постабляционном фильме, были ли целевые клетки эффективно абляции. Восстановление флуоресценции или целевые клетки, занимающие пространство и препятствующие прохождению последующих клеток, указывают на то, что целевые клетки были только фотоотбелены, а не абляции (рисунок 1E и рисунок 2A).
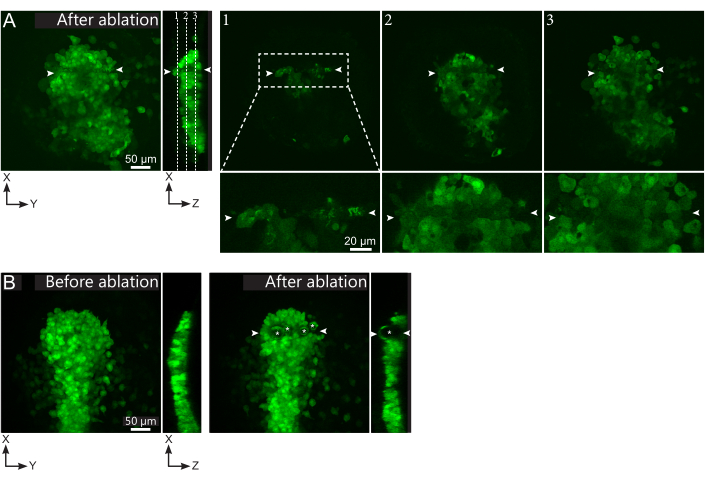
Рисунок 2: Отрицательные результаты лазерной абляции. (А) Типичные примеры потенциальных сбоев в лазерной абляции. Большие XY-виды - это максимальные проекции, вид XZ - реконструированный раздел. Обработанная лазером область расположена между двумя белыми наконечниками стрел. Три фокальные плоскости выделены в реконструированном разделе и отображены справа. Они соответствуют трем различным видам отказов. Плоскость 1 показывает, что клетки над полстером были удалены. Это можно определить по наличию автофлуоресцентного мусора на этой фокальной плоскости (см. крупный план) над полстером (см. положение плоскости 1 на реконструированном участке). Это, вероятно, является результатом неправильного определения региона, подлежащего удалению. Плоскость 2 показывает клетки, которые были отбелены, но не абляции. Они могут быть идентифицированы как сигнал низкой флуоресценции, все еще выявляющий неповрежденные контуры клеток (см. крупный план). Плоскость 3 отображает неповрежденные клетки, которые практически не отбеливались лазерной обработкой. Это может быть результатом неправильного определения региона, подлежащего удалению, или плохого обращения. В ситуациях, изображенных в плоскостях 2 и 3, возможно повторное применение абляционного лечения к неаблированным клеткам-мишеням. Шкала составляет 50 мкм на больших снимках и 20 мкм на крупных планах. (B) Типичный пример пузырьков (отмеченных белыми звездочками), образованных кавитацией из-за слишком интенсивной лазерной обработки. Такие пузырьки не ограничиваются Z-плоскостью, иногда даже охватывая всю высоту полстера, деформируя соседние ткани. Шкала составляет 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
8. Анализ данных
- Откройте покадровую серию с помощью программного обеспечения для анализа изображений и установите правильный размер пикселя.
- В функции Spot установите для параметра Размер объекта значение 10 мкм, так как это средний размер ядра во время гаструляции. Затем запустите функцию Spot для обнаружения и отслеживания ядер.
ПРИМЕЧАНИЕ: Обнаружение может быть немного улучшено, если учесть более низкое осевое разрешение, устанавливающее эллипсоидальную форму длиной 12 мкм вдоль оси Z. - Используйте фильтры для удаления ложных срабатываний. В линии Tg(Gsc:GFP) клетки эмбриональной оси и некоторые энтодермальные клетки помечены зеленым цветом. Следовательно, фильтрация по зеленой интенсивности позволяет быстро выбирать эти ячейки (рисунок 3A).
- Установите максимальное расстояние между последовательными точками на значение, совместимое со скоростью ячеек.
ПРИМЕЧАНИЕ: Будьте осторожны, учитывая временной интервал между двумя кадрами. Клетки Полстера мигрируют со скоростью 2,8 ± 0,8 мкм/мин. Следовательно, разрешение максимального смещения 4 мкм в течение временного шага в 1 мин удаляет большинство артефактных следов. - Разрешение разрывов в одной или двух временных точках обеспечивает более длинные непрерывные треки, но может привести к ошибкам отслеживания. Если ядро не обнаружено правильно в одноразовой момент, рассмотрите возможность повторного запуска точечного обнаружения с другими параметрами / фильтрами.
- Визуально проверяйте треки и при необходимости исправляйте их.
- Экспортируйте результаты в виде файла .xlsx. Обработайте файл с помощью опубликованных процедур электронных таблиц24 (рисунок 3B) и пользовательских процедур в программном обеспечении для анализа данных (доступно по запросу).
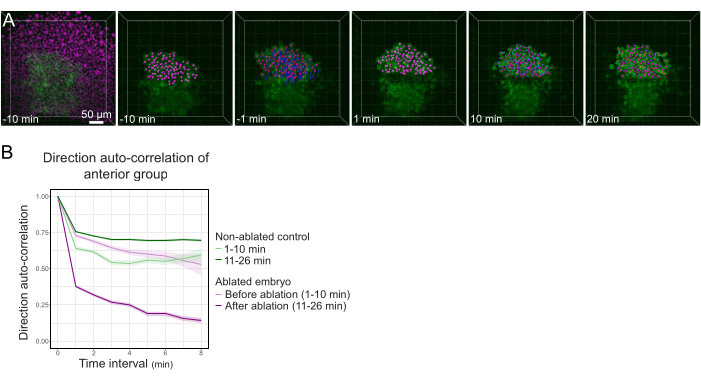
Рисунок 3: Выделение передней половины полстера влияет на направленность клеток. (A) 3D-реконструкция эмбриона Tg(gsc:GFP), экспрессирующего Histone2B-mCherry (отображается в пурпурном цвете), до и после лазерной абляции, разрывающей полстер в его середине. Ядра, принадлежащие передней половине полстера, помечены пурпурной точкой и отслеживаются с течением времени до и после абляции (см. Фильм S1). Шкала шкалы составляет 50 мкм. (B) Как мера стойкости миграции, направление автокорреляции клеток, принадлежащих передней части полстера до и после абляции. Клетки демонстрируют непрерывное движение перед абляцией, которое резко уменьшается после абляции, что указывает на потерю коллективно-ориентированной миграции. Направленная автокорреляция также измерялась на клетках, образующих переднюю половину полстера неабляционного эмбриона, в качестве контроля. Конверты графика указывают на стандартную ошибку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Чтобы разорвать полстер в его середине, эмбрион Tg(gsc: GFP), введенный с мРНК Histone2B-mCherry, был установлен на стадии 70% эпиболии, как описано на этапе 4. Полстер был идентифицирован экспрессией GFP, и эмбрион был смонтирован так, что плоскость полстера перпендикулярна оптической оси (
Обсуждение
Здесь мы описываем протокол, который использует нелинейную оптику для выполнения глубоких и пространственно четко определенных объемных абляций. Наиболее важным шагом протокола является поиск условий лечения, которые обеспечивают достаточную энергию, чтобы позволить абляцию, но не ?...
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы благодарим Эмили Менант за уход за рыбами, Политехнический центр биовизуализации, в частности Пьера Маху, за помощь в создании живой визуализации на их оборудовании, частично поддерживаемом Région Ile-de-France (interDIM) и Национальным агентством исследований (ANR-11-EQPX-0029 Morphoscope2, ANR-10-INBS-04 France BioImaging). Эта работа была поддержана грантами ANR 15-CE13-0016-1, 18-CE13-0024, 20-CE13-0016 и исследовательской и инновационной программой Европейского союза Horizon 2020 в рамках грантового соглашения Марии Склодовской-Кюри No 840201, Министерства высшего и научного образования и Национального центра научных исследований.
Материалы
| Name | Company | Catalog Number | Comments |
| 25x water immersion objective | Olympus | XLPLN25XWMP2 | |
| Agarose | PanReac AppliChem | A8963,0500 | |
| Data analysis software : Matlab | Math Works | ||
| Electro-optic modulator (EOM) | ConOptics | 350-80LA | |
| Embryo Medium (EM) solution | Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio), 5th Edition. University of Oregon Press, Eugene (Book). (2000). | ||
| Environmental chamber chamber | Okolab | H201-T-UNIT-BL | |
| EOM driver | ConOptics | 302RM | |
| Fluorescence source | Lumencor | SOLA | |
| Glass bottom dishes | MatTek | P35G-0-10-C | |
| Glass capillaries | Harvard Apparatus | 300085 | Outside diameter 1.0 mm, inside diameter 0.58 mm |
| Glass pipettes | Volac | D810 | Tip should be fire polished |
| Green/ablation laser | Spectra Physics | Mai Tai HP DeepSee | |
| Histone2B-mCherry mRNA | Synthesized from pCS2-H2B-mCherry plasmid (Dumortier& al. 2012) | ||
| Image analysis software: IMARIS | Bitplane | ||
| ImSpector software | Abberior Instruments Development Team | ||
| Injection mold | Adapative Science Tools | I-34 | |
| Microloader tips | Eppendorf | 5242956003 | |
| Micromanipulator | Narishige | MN-151 | |
| Micropipette puller | Sutter | P-1000 | |
| mMESSAGE mMACHINE SP6 Transcription Kit | Invitrogen | AM1340 | |
| Penicillin-Streptomycin | Thermofisher | 15140-122 | 10 000 units penicillin and 10 mgstreptomycin per ml |
| Photomultiplier tube (PMT) | Hammamatsu | H7422-40 | |
| PicoPump (Air injector) | World Precision Instrument | PV820 | |
| Red laser | Spectra Physics | OPO/Insight DeepSee | |
| RNAse free water for injection | Sigma | W3500 | |
| Spreadsheet software: Excel | Microsoft | ||
| Stereomicroscope | Nikon | SMZ18 | |
| Tg(gsc:GFP) zebrafish line | Doitsidou, M. et al. Guidance of primordial germ cell migration by the chemokine SDF-1. Cell. 111 (5), 647–59, doi: doi.org/10.1016/S0092-8674(02)01135-2 (2002). | ||
| TriM Scope II microscope | La Vision Biotech |
Ссылки
- Slack, J. M. W. Embryonic induction. Mechanisms of Development. 41 (2-3), 91-107 (1993).
- Fernandez-Sanchez, M. -. E., Brunet, T., Röper, J. -. C., Farge, E. Mechanotransduction's impact on animal development, evolution, and tumorigenesis. Annual Review of Cell and Developmental Biology. 31, 373-397 (2015).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Selleck, M. A. J. Culture and microsurgical manipulation of the early avian embryo. Methods in Cell Biology. 51 (51), 1-21 (1996).
- Bulina, M. E., et al. A genetically encoded photosensitizer. Nature Biotechnology. 24 (1), 95-99 (2006).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods in Cell Biology. 107, 177-206 (2012).
- Colombelli, J., Grill, S. W., Stelzer, E. H. K. Ultraviolet diffraction limited nanosurgery of live biological tissues. Review of Scientific Instruments. 75 (2), 472-478 (2004).
- Smutny, M., Behrndt, M., Campinho, P., Ruprecht, V., Heisenberg, C. -. P. UV laser ablation to measure cell and tissue-generated forces in the zebrafish embryo in vivo and ex vivo. Methods in Molecular Biology. 1189, 219-235 (2015).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Volpe, B. A., Fotino, T. H., Steiner, A. B. Confocal microscope-based laser ablation and regeneration assay in zebrafish interneuromast cells. Journal of Visualized Experiments: JoVE. (159), (2020).
- Bonnet, I., et al. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface. 9 (75), 2614-2623 (2012).
- Rauzi, M., Lenne, P. F., Lecuit, T. Planar polarized actomyosin contractile flows control epithelial junction remodelling. Nature. 468 (7327), 1110-1115 (2010).
- Niemz, M. H. . Laser-Tissue Interactions. Encyclopedia of Biomaterials and Biomedical Engineering, Second Edition - Four Volume Set. , (2019).
- Smith, A. M., Mancini, M. C., Nie, S. Bioimaging: second window for in vivo imaging. Nature Nanotechnology. 4 (11), 710-711 (2009).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current Topics in Developmental Biology. 95, 93-144 (2011).
- Theveneau, E., David, N. B. Migrations cellulaires collectives. Medecine/Sciences. 30 (8-9), 751-757 (2014).
- Dumortier, J. G., Martin, S., Meyer, D., Rosa, F. M., David, N. B. Collective mesendoderm migration relies on an intrinsic directionality signal transmitted through cell contacts. Proceedings of the National Academy of Sciences of the United States of America. 109 (42), 16945-16950 (2012).
- Solnica-Krezel, L., Stemple, D. L., Driever, W. Transparent things: cell fates and cell movements during early embryogenesis of zebrafish. BioEssays. 17 (11), 931-939 (1995).
- Montero, J. -. A., Kilian, B., Chan, J., Bayliss, P. E., Heisenberg, C. -. P. Phosphoinositide 3-kinase is required for process outgrowth and cell polarization of gastrulating mesendodermal cells. Current Biology. 13 (15), 1279-1289 (2003).
- Ulrich, F., et al. Slb/Wnt11 controls hypoblast cell migration and morphogenesis at the onset of zebrafish gastrulation. Development. 130 (22), 5375-5384 (2003).
- Kai, M., Heisenberg, C. -. P., Tada, M. Sphingosine-1-phosphate receptors regulate individual cell behaviours underlying the directed migration of prechordal plate progenitor cells during zebrafish gastrulation. Development. 135 (18), 3043-3051 (2008).
- Smutny, M., et al. Friction forces position the neural anlage. Nature Cell Biology. 19 (4), 306-317 (2017).
- Johansson, M., Giger, F. A., Fielding, T., Houart, C. Dkk1 controls cell-cell interaction through regulation of non-nuclear β-Catenin pools. Developmental Cell. 51 (6), 775-786 (2019).
- Gorelik, R., Gautreau, A. Quantitative and unbiased analysis of directional persistence in cell migration. Nature Protocols. 9 (8), 1931-1943 (2014).
- Grill, S. W., Howard, J., Schäffer, E., Stelzer, E. H. K., Hyman, A. A. The distribution of active force generators controls mitotic spindle position. Science. 301 (5632), 518-521 (2003).
- Desprat, N., Supatto, W., Pouille, P. -. A. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental Cell. 15 (3), 470-477 (2008).
- Farhadifar, R., Röper, J. -. C., Aigouy, B., Eaton, S., Jülicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Willier, B. H., Oppenheimer, J. M. . Foundations of Experimental Embryology. , (1964).
- Ashby, W. J., Zijlstra, A. Established and novel methods of interrogating two-dimensional cell migration. Integrative Biology: Quantitative Biosciences from Nano to Macro. 4 (11), 1338-1350 (2012).
- Bosze, B., et al. Pcdh18a regulates endocytosis of E-cadherin during axial mesoderm development in zebrafish. Histochemistry and Cell Biology. 154 (5), 463-480 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены