Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Автоматизированная система культивирования для использования в доклиническом тестировании методов лечения туберкулеза, направленных на хозяина
В этой статье
Резюме
Быстрая и эффективная количественная оценка внутриклеточного роста M. tuberculosis имеет решающее значение для проведения улучшенных методов лечения туберкулеза (ТБ). Этот протокол описывает колориметрический анализ обнаружения на основе бульона с использованием автоматизированной системы жидких культур для количественной оценки роста Mtb в макрофагах, обработанных терапией, направленной на хозяина.
Аннотация
Микобактерия туберкулеза (Mtb), возбудитель туберкулеза (ТБ), была самой значительной причиной смерти от инфекционных заболеваний во всем мире до появления COVID-19. Mtb эволюционировал, чтобы сохраняться во внутриклеточной среде, уклоняться от защиты хозяина и развил устойчивость ко многим противотуберкулезным препаратам. Одним из подходов к решению проблемы резистентности является определение существующих одобренных препаратов, которые будут стимулировать иммунный ответ хозяина на Mtb. Затем эти препараты могут быть перепрофилированы в качестве дополнительных методов лечения, направленных на хозяина (HDT), чтобы сократить время лечения и помочь преодолеть устойчивость к антибиотикам.
Количественная оценка внутриклеточного роста Mtb в макрофагах является важным аспектом оценки потенциального HDT. Золотым стандартом для измерения роста Mtb является подсчет колониеобразующих единиц (КОЕ) на агаровых пластинах. Это медленный, трудоемкий анализ, который не поддается быстрому скринингу лекарств. В этом протоколе автоматизированная система культивирования на основе бульона, которая чаще используется для обнаружения Mtb в клинических образцах, была адаптирована для доклинического скрининга терапии, направленной на хозяина. Оценивалась способность системы анализа жидких культур исследовать внутриклеточный рост Mtb в макрофагах, обработанных HDT. HDT, протестированные на их способность ингибировать рост Mtb, представляли собой полностью транс-ретиноевую кислоту (AtRA), как в растворе, так и инкапсулированную в микрочастицы поли(молочно-ко-гликолевой кислоты) (PLGA) и комбинацию интерферона-гамма и линезолида. Преимущества этого автоматизированного метода на основе жидких культур по сравнению с методом КОЕ включают простоту настройки, менее трудоемкую подготовку и более быстрое время получения результатов (5-12 дней по сравнению с 21 днем или более для агаровых пластин).
Введение
Микобактерия туберкулеза (Mtb), возбудитель туберкулеза, была наиболее значимой причиной смерти от инфекционных заболеваний во всем мире в 2019году 1. Чтобы уклониться от защиты хозяина, Mtb подрывает микобактерицидную активность врожденных иммунных клеток, таких как макрофаги и дендритные клетки (DC), позволяя ему сохраняться внутриклеточным образом иреплицироваться 2. Отсутствие эффективной вакцины для профилактики туберкулеза легких у взрослых и растущее появление лекарственно-устойчивых штаммов подчеркивают настоятельную необходимость в новых методах лечения.
Адъюнктивная терапия, направленная на хозяина (HDT), может сократить время лечения и помочь преодолеть резистентность3. Доклиническая оценка кандидатов HDT in vitro для определения микобактерицидной активности в макрофагах часто опирается на количественную оценку роста Mtb по колониеобразующим единицам (КОЕ) на твердых агаровых пластинах. Это медленный, трудоемкий анализ, который не поддается быстрому скринингу лекарств. Коммерчески доступные автоматизированные системы обнаружения микробов на основе бульона чаще используются в клинических микробиологических лабораториях для обнаружения и тестирования чувствительности к лекарственным средствам Mtb и других видов микобактерий в клинических образцах4. Эти приборы измеряют рост косвенно на основе бактериальной метаболической активности, приводящей к физическим изменениям в культуральной среде (изменение уровней CO2 илиO2 или давления), контролируемых с течением времени5. Считывание - это время до позитивности (TPP), которое, как было ранее показано, коррелирует с Mtb КОЕ в образцах мокроты больных туберкулезом в ответ на лечение 6,7 и в лизатах инфицированных мышных легких и селезенки8. Кроме того, системы обнаружения жидких культур были использованы для измерения влияния традиционной терапии, направленной на патогены, на рост микобактерий в аксенической культуре и культивируемых макрофагах 9,10. Инструмент также использовался для исследования врожденной способности дендритных клеток и альвеолярных макрофагов контролировать внутриклеточный рост Mtb 11,12. Этот экспериментальный протокол демонстрирует, что система диагностики жидких культур может быть адаптирована для выполнения доклинического скрининга HDT на туберкулез в культивируемых макрофагах. По сравнению с перечислением КОЕ, основным преимуществом этого метода является то, что он значительно сокращает экспериментальный труд и время, необходимое для количественной оценки внутриклеточного роста / выживаемости микобактерий. Этот метод опирается на доступ к автоматизированному инструменту культивирования, который может быть использован для оценки внутриклеточной выживаемости микобактерий в иммунных клетках, обработанных широким спектром фармакологических реагентов, нацеленных на клеточные функции для повышения иммунитета хозяина.
Access restricted. Please log in or start a trial to view this content.
протокол
Эксперименты, описанные в этом протоколе, проводились с использованием ослабленного штамма H37Ra Mtb, который может быть обработан в лаборатории containment Level 2. Все манипуляции с живыми микобактериями проводились в шкафу биологической безопасности II класса (БСК). Экспериментальные процедуры были разработаны для минимизации образования аэрозолей. Культуру эукариотических клеток (клетки THP-1) также проводили в классе II BSC. Лаборатория провела оценку рисков и обеспечила, чтобы все процедуры выполнялись в соответствии с институциональными и национальными правилами биологической безопасности. Моноцитарная клеточная линия THP-1 человека использовалась для выполнения метода, как описано (шаг 1). Клетки дифференцируются в макрофаги после стимуляции форболом 12-миристатом 13-ацетатом (ПМА) перед заражением микобактериями.
1. Клеточная культура
- Размножают семенной материал H37Ra до логарифмической фазы в бульоне Middlebrook 7H9 (MB), дополненном обогащением альбумин-декстрозы-каталазы (ADC) (10%) и 0,05% полисорбата 80. Храните H37Ra в 1 мл аликвоты в морозильной камере при температуре -80 °C в течение 1 года.
- Разморозьте флакон Mtb-H37Ra объемом 1 мл и переложите его в колбу T25 с фильтрующим колпачком, содержащим 9 мл добавленного отвара МБ примерно за 1 неделю до запланированного эксперимента. Инкубировать при 37 °C в течение 5-7 дней в статическом инкубаторе.
- Выращивайте клетки THP-1 в RPMI-1640, дополненные нетермояемой убитой 10% сывороткой для телят плода (полной (c)RPMI) в колбе T75в увлажненном инкубатореCO2 при 5% CO 2/37 °C и субкультуре два раза в неделю для поддержания плотности менее 1 х 106 клеток / мл.
- Дифференцируйте клетки THP-1 в макрофаги за 3 дня до заражения, осторожно пипетируя клетки несколько раз, используя серологическую пипетку в колбах T75, чтобы диспергировать любые сгустки и поместить их в коническую трубку объемом 50 мл.
- Центрифужные ячейки при 300 х г в течение 10 мин при комнатной температуре, отфильтровывают супернатант и осторожно повторно суспендируют гранулу в 2 мл RPMI. Выполните подсчет ячеек для оценки ячеек/мл.
- Семена 2 мл макрофагов THP-1 в 12-луночных тканевых культуральных пластинах при плотности 100 000 клеток/мл в cRPMI со 100 нг/мл PMA в течение 72 ч. Удалите PMA-содержащую среду из клеток и пополните свежим cRPMI до заражения Mtb.
- Установите отдельные пластины для каждого требуемого точки времени.
- Семенные клетки той же плотности (100 000 клеток/мл) в 2-луночных стеклянных камерах для определения кратности инфекции (MOI).
- Поместите в 5%CO2 увлажненный инкубатор на 3 дня при 37 °C.
2. Количественная оценка поглощения Mtb
- Определение поглощения Mtb макрофагами (MOI)
- Установите шкаф биологической безопасности класса II (BSC) в день заражения и работайте на двух слоях папиросной бумаги, чтобы поймать любые разливы. Установите контейнеры для выбрасывания отходов в соответствии с местными правилами.
- Удалите 6-8 мл микобактериальной культуры из колбы T25 и переложите ее в полипропиленовую трубку объемом 15 мл.
ПРИМЕЧАНИЕ: Трубки меньшего объема могут быть использованы для небольших экспериментов. - Центрифугирование трубки в настольной центрифуге при комнатной температуре в течение 10 мин при 2890 х г.
- Осторожно извлеките трубку из центрифуги и перенесите ее в шкаф биологической безопасности. Подождите 1 минуту, чтобы бактерии осели.
- Вылейте супернатант в контейнер для выбрасывания дезинфицирующего средства, повторите трубку и повторно суспендируйте бактерии в оставшейся среде, постукивая по боковой стороне трубки. Подождите 1 минуту, чтобы бактерии осели.
- Добавьте 2 мл предварительно разогретого cRPMI, аккуратно перемешайте и переложите в коническую трубку объемом 50 мл.
- Повторно суспендируйте микобактерии очень осторожно, используя иглу 25 г и шприц 5 мл. Чтобы повторно суспендировать, втяните суспензию микобактерий в шприц и очень осторожно выталкивайте вниз по боковой стенке трубки, чтобы свести к минимуму образование аэрозоля. Повторить 6-8 раз.
ПРИМЕЧАНИЕ: Соблюдайте максимальную осторожность, так как это культура микобактерий высокой плотности. Чтобы избежать риска травмы от укола иглой, используйте тупые иглы, где это возможно, и шприцы Luer lock. - Утилизируйте иглу и шприц в контейнер для острых предметов в BSC.
- Переложите суспензию в микрофрагменную трубку объемом 2 мл (с завинчивающимся колпачком) и центрифугу при комнатной температуре в течение 3 мин при 100 х г , чтобы гранулировать любые оставшиеся комочки. Верните трубку в шкаф безопасности и подождите 1 минуту, чтобы бактерии осели.
- Перенесите верхние 1-1,5 мл надосадочного вещества в новую трубку. Выбросьте оригинальную трубку в ведро для отходов, содержащее дезинфицирующее средство. Хорошо перемешайте и добавьте различные количества микобактериальной суспензии (например, 5, 25, 50, 150 мкл) в 2-луночную стеклянную камеру и инкубируйте в течение 3 ч в инкубатореCO2 при 37 °C.
- Окрашивание для кислотных быстрых бактерий (AFB)
ПРИМЕЧАНИЕ: После 3-часовой инкубации макрофаги промывают и фиксируют параформальдегидом для инактивации микобактерий. Затем слайды окрашивают с использованием модифицированного набора Auramine O (см. Таблицу материалов) для оценки микобактерий, фагоцитозированных на клетку. Из-за своей восковой клеточной стенки микобактерии сохраняют краситель аурамин после кислотно-спиртовой промывки. Затем ядра макрофагов контр окрашиваются с помощью Hoechst. Этот метод позволяет подсчитать количество фагоцитозированных бактерий на клетку и используется для определения множественности инфекции (MOI) макрофагов.- Извлеките среду из слайда стеклянной камеры после пипетки вверх и вниз три раза, чтобы вытеснить бактерии, которые не были фагоцитозированы.
- Промыть один раз с 2 мл комнатной температуры PBS.
- Хранить в запасах 4% параформальдегида, растворенного в ПБС в аликвотах при -20 °С в течение 6 месяцев. Разморозьте аликвоту 4% параформальдегида непосредственно перед применением. Разбавить до 2% параформальдегида ПБС и добавить 2 мл на лунку.
- Инкубировать в течение 10 мин при комнатной температуре. Затвор стеклянной камеры может быть удален из шкафа безопасности на этом этапе для окрашивания.
- Промойте горку под нежной струей водопроводной воды.
- Нанесите достаточное количество аурамина на слайд, чтобы покрыть клетки с помощью пластиковой переносной пипетки и инкубируйте в течение 1 мин при комнатной температуре в темноте (накройте алюминиевой фольгой).
- Смойте излишки красителя с горки водопроводной водой и добавьте обесцвечиватель/гаситель на 1 мин в темноте.
- Смойте излишки водопроводной водой и инкубируйте в течение 15 мин при комнатной температуре с помощью Hoechst 33342 (10 мкг/мл в PBS) в темноте.
- Смойте пятно Hoechst водопроводной водой, удалите камеры, слейте лишнюю воду с горки, добавьте каплю антивзрасти и крышки и высушите воздухом.
- Осмотрите слайд под флуоресцентным микроскопом с помощью 100-кратного масляного объектива. Микобактерии будут флуоресцировать зеленым цветом под фильтром FITC. Ядра флуоресцируют синим цветом под фильтром DAPI (рисунок 1С).
- Определить MOI путем подсчета количества фагоцитозированных микобактерий на клетку и процента инфицированных клеток.
- Рассчитать объем микобактериальной суспензии, необходимый для достижения требуемого МВД, исходя из площади поверхности скважины в пластине; например, площадь поверхности слайдов стеклянной камеры, используемых в этом эксперименте, составляет 4см2. Низкий MOI (приблизительно 1-2 бациллы на клетку) желателен для экспериментов, проводимых в течение нескольких дней (например, 5 дней).
- Заражение макрофагами
- Хорошо смешайте суспензию микобактерий и добавьте необходимое количество в клетки на 12-луночных пластинах, как только будет определен объем, необходимый для достижения желаемого MOI.
- Инкубировать при 37 °C в течение 3 ч, чтобы микобактерии могли быть фагоцитозированы.
- Удалите внеклеточные бактерии, промыв колодцы теплым RPMI или HBSS несколько раз.
- Лизируйте макрофаги в одной лунке (образец 3 ч), чтобы определить процентное время до положительности (ТТП) исходного инокулята (образец 3 ч), как описано на этапе 3 ниже.
- Добавьте свежий cRPMI и необходимые дозы препарата или контроль транспортного средства в оставшиеся колодцы, инкубируйте пластины в инкубаторе CO2 при 37 °C в течение необходимого времени (в зависимости от экспериментальной конструкции, но обычно с несколькими интервалами от 1 до 8 дней).
3. Сбор образцов для системы обнаружения жидких культур
ПРИМЕЧАНИЕ: В день заражения внеклеточные микобактерии удаляются путем промывки, а внутриклеточные микобактерии собирают путем лизиса одной лунки макрофагов (образец 3 ч) для определения начального количества фагоцитоза в качестве базового контроля инфекции. В последующее время среда, клеточный лизат и промывки объединяются для измерения общего роста микобактерий. Внеклеточный и внутриклеточный рост также может быть оценен отдельно при желании.
- Сбор 3-часовой пробы для определения ТТП
- Смывайте внеклеточные микобактерии из всех колодцев после первых 3 ч инфекции, как описано в шаге 2.3.3. Добавьте 1 мл свежих сред в контрольный колодец за 3 часа, чтобы выровнять объем лизата с объемами более поздних временных точек.
ПРИМЕЧАНИЕ: См. шаг 3.2.7, если внеклеточные микобактерии должны быть исключены из анализа.
- Смывайте внеклеточные микобактерии из всех колодцев после первых 3 ч инфекции, как описано в шаге 2.3.3. Добавьте 1 мл свежих сред в контрольный колодец за 3 часа, чтобы выровнять объем лизата с объемами более поздних временных точек.
- Сбор образцов
- Прогрейте бульон MB и инструментальные бутылочки для культивирования, чтобы довести их до комнатной температуры.
- Перенесите среду с 12-луночной пластины на соответствующие меченые конические трубы.
- Добавьте 500 мкл стерильного лизисного буфера (0,1% Тритона х-100 в PBS, отфильтрованного через стерильный фильтр 0,2 мкм) в каждую скважину в течение 10 мин.
- Аккуратно соскоблите клетки из лунки стерильным скребком и соедините со средой в соответствующей конической трубке.
- Промыть лунку 0,5 мл стерильного ПБС и переложить в соответствующую трубку.
- Осторожно пропустите каждый образец через иглу и шприц (25 г) 6-8 раз, чтобы разбить комочки. Разбавлять образцы 1:10 в МБ бульона; Образец 100 мкл + средняя емкость 900 мкл.
- В требуемое время/дни (обычно от 1 до 8 дней) соберите оставшиеся образцы, выполнив шаги 3.2.1-3.2.6 выше.
ПРИМЕЧАНИЕ: Исследователи могут предпочесть исключить внеклеточные микобактерии из своего анализа, и в этом случае, на этапе 3.2.2 выше, среда из каждой лунки отбрасывается, а макрофаги промываются несколько раз перед добавлением буфера лизиса.
- Инокуляция и загрузка бутылок для культуры инструментов
ПРИМЕЧАНИЕ: Подробная информация об инструменте для культивирования жидкостей и связанных с ним расходных материалах приведена в Таблице материалов.- Стерилизуйте резиновый колпачок флакона для культивирования инструмента папиросной бумагой, смоченной в 70% спирте, и дайте ему высохнуть на воздухе.
ПРИМЕЧАНИЕ: Этот шаг должен быть выполнен в BSC. - Подготовьте бутылки, перенеся достаточное количество питательных добавок для всех образцов в коническую трубку (0,5 мл / бутылка). Используйте иглу и шприц, чтобы ввести 0,5 мл питательной добавки в бутылку для культуры инструмента.
- Пипетка 500 мкл разбавленного образца (1:10) в 1 мл V-образной трубки.
- Используйте иглу и шприц, чтобы ввести 500 мкл образца в назначенный флакон для культуры инструмента.
- Стерилизуйте резиновый колпачок флакона для культивирования инструмента папиросной бумагой, смоченной в 70% спирте, и дайте ему высохнуть на воздухе. Протрите флаконы папиросной бумагой, пропитанной 70% спиртом, перед удалением из БСК.
- Осторожно транспортируйте бутылки из шкафа биобезопасности к инструменту для погрузки.
- Нажмите кнопку загрузки на автоматизированной системе обнаружения микробов.
- Отсканируйте штрих-коды на бутылках для культуры приборов и поместите их в инкубатор системы обнаружения при 37 °C на срок до 42 дней. Читайте и записывайте время, необходимое для достижения позитивности с экрана прибора.
ПРИМЕЧАНИЕ: Штрих-код позволяет инструменту идентифицировать бутылку и связать показания отражательной способности с конкретной бутылкой. - Рассчитайте процентное время до позитивности (ТТП), сравнив ТТП исходного внутриклеточного инокулята (День 0) с ТТП макрофагов, культивируемых за указанное время. Положительное изменение процента ТТП означает рост микобактерий13.
Например, для 3-го дня:
Процентное изменение времени к позитивности =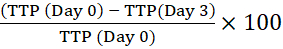
- Стерилизуйте резиновый колпачок флакона для культивирования инструмента папиросной бумагой, смоченной в 70% спирте, и дайте ему высохнуть на воздухе.
Access restricted. Please log in or start a trial to view this content.
Результаты
Автоматизированный прибор для культивирования жидкостей, используемый в этом исследовании, контролирует уровни CO2 каждые 10 минут. Изменение цвета датчика в нижней части бутылки прибора измеряется колориметрически и выражается в виде единиц отражения. Затем программное обеспеч?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Авторы использовали метод жидкой культуры, описанный в этом протоколе, для мониторинга роста Mtb в моноцитарных макрофагах и альвеолярных макрофагах и клетках THP-1, дифференцированных с PMA 11,16,17. Этот метод также может быть модифицирован ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа финансировалась Научным фондом Ирландии (SFI 08/RFP/BMT1689), Советом по исследованиям в области здравоохранения в Ирландии [HRA-POR/2012/4 и HRA-POR-2015-1145] и Королевским городским больничным фондом Дублина.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| IX51 Fluorescent Microscope | Olympus, Japan | N/A | AFB detection and imaging |
| 2 mL microtube, flat bottom, screw cap, sterile | Sarstedt, North Carolina, USA | 72.694.006 | Mtb infection of macropahges |
| 5 mL syringe, Luer lock | BD Biosciences, San Jose, CA, USA | SZR-150-031K | Mtb infection of macropahges/CFU |
| 50 mL tube, sterile | Sarstedt, North Carolina, USA | 62.547.254 | Mtb infection of macropahges |
| all-trans-Retinoic Acid (ATRA) ≥98% (HPLC) | Sigma Aldrich, Missouri, USA | R2625 | Host directed therapy candidate |
| BacT/ALERT 3D Microbial Detection System | Biomerieux ( Hampshire, UK) | 247001 | Broth-based colormetric detection system |
| BACT/ALERT MP BACT/ALERT MP Nutrient Supplement | Biomerieux ( Hampshire, UK) | 414997 | Broth-based colormetric detection assay |
| BACT/ALERT MP culture bottles | Biomerieux ( Hampshire, UK) | 419744 | Broth-based colormetric detection assay |
| BD BBL Middlebrook ADC Enrichment, 20 mL | BD Biosciences, San Jose, CA, USA | M0553 | Mycobacterium liquid culture |
| BD BBL Middlebrook OADC Enrichment, 20mL | BD Biosciences, San Jose, CA, USA | M0678 | Colony Forming Units |
| Cell scraper, 25 cm | Sarstedt, North Carolina, USA | 83.1830 | Harvest of lmacrophage lysates |
| Corning Syringe Filter, 0.2 µm | Corning Incorporated, Germany | 431219 | Sterilization of lysis buffer |
| Cover glass (borosilicate), 24 x 50 mm, #1.5 thickness | VWR International Limited | 631 - 0147 | |
| Cycloheximide, from microbial | Sigma Aldrich, Missouri, USA | C7698 | Colony Forming Units |
| Dako Fluorescent Mounting Medium | Agilent Technologies Ireland Limited | S3023 | Antifade mounting medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich, Missouri, USA | D8537 | Mtb infection of macropahges |
| Fetal Bovine Serum, Gibco | Thermo Fisher, Massachusetts, USA | 10270106 | Macrophage cell culture |
| Glycerol, Difco | BD Biosciences, San Jose, CA, USA | 228220 | Colony Forming Units |
| Hoescht 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma Aldrich, Missouri, USA | B2261 | Nuclear stain |
| IFNγ, recombinant human | R&D Systems Inc, Minnesota, USA | 285-IF | Host directed therapy candidate |
| Labtek 2-well chamber slide, sterile, Nunc | Thermo Fisher, Massachusetts, USA | TKT-210-150R | Mtb infection of macropahges |
| L-Asparagine, anhydrous | Sigma Aldrich, Missouri, USA | A4159 | Colony Forming Units |
| Linezolid | Sigma Aldrich, Missouri, USA | PZ0014 | Antibiotic |
| Microlance Hypodermic Needle 25 G | BD Biosciences, San Jose, CA, USA | 300400 | Mtb infection of macropahges/CFU |
| Middlebrook 7H10 Agar Base | BD Biosciences, San Jose, CA, USA | M0303 | Colony Forming Units |
| Middlebrook 7H9 Broth Base | BD Biosciences, San Jose, CA, USA | M0178 | Mycobacterium liquid culture |
| Modified Auramine O Stain and Decolourizer | Scientific Device Laboratory, IL, USA | 345-250 | AFB stain |
| Paraformaldehyde | Sigma Aldrich, Missouri, USA | 158127 | Mtb infection of macropahges |
| Petri dishes, 92 x 16mm (20/bag) | Sarstedt, North Carolina, USA | 82.1473.001 | Colony Forming Units |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich, Missouri, USA | P8139 | Macrophage cell culture |
| Polysorbate 80, Difco | BD Biosciences, San Jose, CA, USA | 231181 | Mycobacterium liquid culture |
| RPMI-1640, Gibco | Thermo Fisher, Massachusetts, USA | 52400025 | Macrophage cell culture |
| Sterile Cell Spreader, L-Shaped | Fisherbrand, Thermo Fisher, MA, USA | RB-44103 | Colony Forming Units |
| T25 TC flask, angled neck, filter cap, sterile, Nunc | Thermo Fisher, Massachusetts, USA | 156367 | Mycobacterium liquid culture |
| THP-1 cell line | ATCC, Virginia, USA | ATCC TIB-202 | Macrophage cell culture |
Ссылки
- WHO. Global Tuberculosis Report. World Health Organization. , Geneva. (2020).
- Russell, D. G. Mycobacterium tuberculosis and the intimate discourse of a chronic infection. Immunological Reviews. 240 (1), 252-268 (2011).
- Young, C., Walzl, G., Du Plessis, N. Therapeutic host-directed strategies to improve outcome in tuberculosis. Mucosal Immunology. 13 (2), 190-204 (2020).
- Angeby, K. A., et al. Evaluation of the BacT/ALERT 3D system for recovery and drug susceptibility testing of Mycobacterium tuberculosis. Clinical Microbiology and Infection. 9 (11), 1148-1152 (2003).
- Asmar, S., Drancourt, M. Rapid culture-based diagnosis of pulmonary tuberculosis in developed and developing countries. Frontiers in Microbiology. 6, 1184(2015).
- Diacon, A. H., et al. Time to liquid culture positivity can substitute for colony counting on agar plates in early bactericidal activity studies of antituberculosis agents. Clinical Microbiology and Infection. 18 (7), 711-717 (2012).
- Diacon, A. H., et al. Time to positivity in liquid culture predicts colony forming unit counts of Mycobacterium tuberculosis in sputum specimens. Tuberculosis. 94 (2), Edinburgh. 148-151 (2014).
- O'Sullivan, D. M., et al. Evaluation of liquid culture for quantitation of Mycobacterium tuberculosis in murine models. Vaccine. 25 (49), 8203-8205 (2007).
- Heinrichs, M., et al. Mycobacterium tuberculosis Strains H37ra and H37rv have equivalent minimum inhibitory concentrations to most antituberculosis drugs. International Journal of Mycobacteriology. 7 (2), 156-161 (2018).
- Sorrentino, F., et al. Development of an intracellular screen for new compounds able to inhibit mycobacterium tuberculosis growth in human macrophages. Antimicrobial Agents and Chemotherapy. 60 (1), 640-645 (2016).
- O'Leary, S. M., et al. Cigarette smoking impairs human pulmonary immunity to Mycobacterium tuberculosis. American Journal of Respiratory and Critical Care Medicine. 190 (12), 1430-1436 (2014).
- Ryan, R. C., O'Sullivan, M. P., Keane, J. Mycobacterium tuberculosis infection induces non-apoptotic cell death of human dendritic cells. BMC Microbiology. 11, 237(2011).
- Keane, J., Remold, H. G., Kornfeld, H. Virulent mycobacterium tuberculosis strains evade apoptosis of infected alveolar macrophages. The Journal of Immunology. 164 (4), 2016-2020 (2000).
- Gao, X. F., Yang, Z. W., Li, J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis: a systematic review. International Journal of Infectious Diseases. 15 (9), 594-600 (2011).
- Thorpe, T. C., et al. BacT/Alert: an automated colorimetric microbial detection system. Journal of Clinical Microbiology. 28 (7), 1608-1612 (1990).
- Gleeson, L. E., et al. Cutting edge: Mycobacterium tuberculosis induces aerobic glycolysis in human alveolar macrophages that is required for control of intracellular bacillary replication. The Journal of Immunology. 196 (6), 2444-2449 (2016).
- O'Connor, G., et al. Inhalable poly(lactic-co-glycolic acid) (PLGA) microparticles encapsulating all-trans-Retinoic acid (ATRA) as a host-directed, adjunctive treatment for Mycobacterium tuberculosis infection. European Journal of Pharmaceutics and Biopharmaceutics. 134, 153-165 (2019).
- O'Connor, G., et al. Sharpening nature's tools for efficient tuberculosis control: A review of the potential role and development of host-directed therapies and strategies for targeted respiratory delivery. Advanced Drug Delivery Reviews. 102, 33-54 (2016).
- Rodriguez, D. C., Ocampo, M., Salazar, L. M., Patarroyo, M. A. Quantifying intracellular Mycobacterium tuberculosis: An essential issue for in vitro assays. Microbiologyopen. 7 (2), 00588(2018).
- Ortalo-Magne, A., et al. Molecular composition of the outermost capsular material of the tubercle bacillus. Microbiology. 141, Reading. Pt 7 1609-1620 (1995).
- Stokes, R. W., et al. The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages. Infection and Immunity. 72 (10), 5676-5686 (2004).
- O'Sullivan, M. P., O'Leary, S., Kelly, D. M., Keane, J. A caspase-independent pathway mediates macrophage cell death in response to Mycobacterium tuberculosis infection. Infection and Immunity. 75 (4), 1984-1993 (2007).
- Cheon, S. H., et al. Bactericidal activity in whole blood as a potential surrogate marker of immunity after vaccination against tuberculosis. Clinical and Diagnostic Laboratory Immunology. 9 (4), 901-907 (2002).
- Nathan, C., Barry, C. E. TB drug development: immunology at the table. Immunological Reviews. 264 (1), 308-318 (2015).
- Bowness, R., et al. The relationship between Mycobacterium tuberculosis MGIT time to positivity and cfu in sputum samples demonstrates changing bacterial phenotypes potentially reflecting the impact of chemotherapy on critical sub-populations. Journal of Antimicrobial Chemotherapy. 70 (2), 448-455 (2015).
- Basu Roy, R., et al. An auto-luminescent fluorescent BCG whole blood assay to enable evaluation of paediatric mycobacterial responses using minimal blood volumes. Frontiers in Pediatrics. 7, 151(2019).
- Christophe, T., et al. High content screening identifies decaprenyl-phosphoribose 2' epimerase as a target for intracellular antimycobacterial inhibitors. PLoS Pathogens. 5 (10), 1000645(2009).
- Franzblau, S. G., et al. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis. 92 (6), Edinburgh. 453-488 (2012).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены