Method Article
Аналитическое определение митохондриальной функции иссеченных твердых гомогенатов опухоли
В этой статье
Резюме
Мы разработали практический протокол и аналитический подход для оценки митохондриального окислительного фосфорилирования и способности переноса электронов в свежих гомогенатах опухоли. Этот протокол может быть легко адаптирован для изучения различных митохондриальных функций, которые способствуют инициации, прогрессированию рака и ответу на лечение.
Аннотация
Митохондрии необходимы для возникновения и прогрессирования рака посредством производства энергии, регуляции активных форм кислорода и синтеза макромолекул. Генетические и функциональные адаптации митохондрий к опухолевой среде стимулируют пролиферативный и метастатический потенциал. Появление секвенирования ДНК и РНК устранило критические барьеры для оценки генетических медиаторов опухолевого генеза. Однако на сегодняшний день методологические подходы к оценке митохондриальной функции опухоли остаются неуловимыми и требуют технического мастерства, ограничивающего осуществимость, в конечном итоге уменьшая диагностическую и прогностическую ценность как в экспериментальных, так и в клинических условиях. Здесь мы описываем простой и быстрый метод количественной оценки скорости окислительного фосфорилирования (OXPHOS) и переноса электронов (ET) в свежеиссекенных твердых гомогенатах опухоли с использованием респирометрии высокого разрешения. Протокол может быть воспроизводимо применен к видам и типам опухолей, а также адаптирован для оценки разнообразия митохондриальных et-путей. Используя этот протокол, мы демонстрируем, что мыши, перенесшие люминальный рак молочной железы B, демонстрируют дефектное никотинамид-динуклеотид-связанное дыхание и зависимость от сукцината для получения аденозинтрифосфата через OXPHOS.
Введение
Все клетки тесно связаны своей потребностью производить и потреблять аденозинтрифосфат (АТФ), молекулярную энергетическую валюту. Поскольку клеточные мутации приводят к образованию опухолей, митохондрии обеспечивают выживание за счет диверсификации производства энергии, которая часто фенотипически отличается от нераковойткани 1,2,3. Таким образом, существует острая необходимость в быстром и глубоком профилировании дыхательной функции митохондрий, чтобы облегчить классификацию типа опухоли, инициации рака, прогрессирования и ответа на лечение.
Дыхательные функции образцов иссеченной ткани не могут быть оценены неповрежденными, поскольку первичные субстраты для OXPHOS не являются клеточно-проницаемыми. Чтобы преодолеть это ограничение, митохондрии могут быть получены либо путем выделения, химической пермеабилизации, либо механической гомогенизации. Митохондриальная изоляция долгое время считалась золотым стандартом для оценки дыхательной функции. Тем не менее, он требует большого количества ткани, занимает много времени и является низкопродуктивным с возможным смещением отбора для определенных фракций митохондрий4. Пермеабилизация состоит из механического разделения и воздействия на участки тканей или пучки волокон мягкого моющего средства, которое избирательно разлагает плазматическую мембрану5. Пермеабилизация часто используется в поперечно-полосатых тканях, таких как скелетная и сердечная мышцы, поскольку отдельные пучки волокон могут быть разделены. По сравнению с изоляцией, пермеабилизация дает больше митохондрий в их родной клеточной среде и физической форме5. Пермеабилизация успешно применяется в других тканях, таких как опухоль6,7 и плацента8; однако воспроизводимость пермеабилизированных волоконных препаратов может быть затруднена из-за консистенции рассечения и потребностей в кислороде для преодоления диффузионных ограничений9. Кроме того, пермеабилизированные волокна могут быть непригодны для некоторых типов опухолей, которые являются плотно клеточными и высокофиброзными. Тканевые гомогенаты образуются путем механического разрушения плазматической мембраны и аналогичны пермеабилизированным волокнам с точки зрения выхода митохондрий и целостности10. Тканевые гомогенаты также минимизируют ограничения диффузии кислорода и могут быть легко использованы между типами тканей путем оптимизации механической силы11,12.
Здесь мы описываем простой и быстрый метод количественной оценки скорости окислительного фосфорилирования (OXPHOS) и способности переноса электронов (ET) в свежеиссеченных твердых гомогенатах опухоли. Протокол оптимально разработан для оценки свежих тканей с использованием респирометра высокого разрешения Oxygraph-2k (O2k), который требует предварительных знаний инструментальной настройки и калибровки, но может быть аналогичным образом адаптирован с использованием любого электрода типа Кларка, анализатора Seahorse или считывателя пластин. Протокол может быть воспроизводимо применен к видам и типам опухолей, а также адаптирован для оценки разнообразия митохондриальных et-путей.
протокол
Все эксперименты и процедуры с участием животных были одобрены Комитетом по уходу и использованию животных Пеннингтонского биомедицинского исследовательского центра.
1. Подготовка реагентов.
- Готовят среду для роста клеток EO771 с 10 мМ HEPES, 10% фетальной бычьей сыворотки (FBS), 1% пенициллина-стрептомицина (100 Ед/мл) и 0,2% амфотерицина B.
- Приготовьте 1 л раствора для консервации биопсии (BIOPS) в стеклянном стакане объемом 1000 мл.
- Добавить 3,180 гNa2АТФ (конечная концентрация 5,77 мМ).
- Добавить 1,334 г MgCL2·6H2 O (конечная концентрация 6,56 мМ).
- Добавьте 2,502 г таурина (конечная концентрация 20 мМ).
- Добавьте 3,827 гNa2фосфокреатина (конечная концентрация 15 мМ).
- Добавить 1,362 г имидазола (конечная концентрация 20 мМ).
- Добавьте 0,077 г дитиотрейтола (конечная концентрация 0,5 мМ).
- Добавьте 9,76 г гидрата MES (конечная концентрация 50 мММ).
- Добавьте 800 млH2Oи перемешайте компоненты с помощью магнитной мешалки при 30 °C.
- Добавить 72,3 мл 100 мМK2EGTA (конечная концентрация 7,23 мМ).
- Растворить 7,608 г ЭГТА и 2,3 г КОН в 100 млН2О.
- Отрегулируйте pH до 7,0 с 5 М КОН и доведите объем до 200 мл с H2O.
- Добавить 27,7 мл 100 мМ CaK2EGTA (конечная концентрация 2,77 мМ).
- Растворить 7,608 г ЭГТА в 200 млH2Oи нагреть до 80 °C (конечная концентрация 100 мМ).
- Растворить 2,002 г CaCO3 в 200 мл горячего раствора EGTA 100 мМ.
- При непрерывном перемешивании добавьте 2,3 г КОН и отрегулируйте рН до 7,0.
- Отрегулируйте pH до 6,75 при 23 °C (pH 7,1 при 0 °C) с 5 М КОН. Доведите объем до 980 мл с H2Oи перемешайте раствор. Проверьте pH еще раз, отрегулируйте при необходимости и доведите конечный объем до 1000 мл водой.
- Aliquot BIOPS в конические трубки (15 мл или 50 мл) и хранить при -20 °C до использования. Разморозьте только один раз, непосредственно перед использованием.
- Приготовьте 1 л митохондриальной среды дыхания (MiR05) в стеклянном стакане объемом 1000 мл.
- Добавьте 0,190 г EGTA (конечная концентрация 0,5 мМ).
- Добавьте 0,610 г MgCL2·6H2O (конечная концентрация 3 мММ).
- Добавьте 2,502 г таурина (конечная концентрация 20 мМ).
- Добавить 1,361 г KH2PO4 (конечная концентрация 10 мМ).
- Добавить 4,77 г HEPES (конечная концентрация 20 мМ).
- Добавьте 37,65 г D-сахарозы (конечная концентрация 110 мМ).
- Добавьте 800 млH2Oи перемешайте компоненты с помощью магнитной мешалки при 30 °C.
- Добавьте 120 мл 0,5 М лактобионовой кислоты (конечная концентрация 60 мМ).
- Растворить 35,83 г лактобионовой кислоты в 100 млH2O.
- Отрегулируйте pH до 7,0 с 5 М КОН и доведите объем до 200 мл с H2O.
- Перемешайте раствор и отрегулируйте рН до 7,1 с 5 М КОН.
- Взвесьте 1 г BSA, по существу не содержащего жирных кислот (конечная концентрация 1 г/л), в конической пробирке объемом 50 мл. Добавьте 40 мл раствора рН 7,1 со стадии 9 в трубку, осторожно переверните для смешивания и избегайте вспенивания. Переместите растворенный BSA в оставшийся раствор рН 7,1 со стадии 9 и перемешайте осторожно и непрерывно. Проверьте pH еще раз, отрегулируйте при необходимости и доведите конечный объем до 1000 мл с H2O.
- Aliquot среды MiR05 в конические трубки объемом 50 мл и храните при -20 °C до использования. Разморозьте только один раз, непосредственно перед использованием.
- Приготовьте субстраты, разъединители и ингибиторы.
- Приготовить 0,8 М малата: Растворить 536,4 мг L-яблочной кислоты в 4 млH2O. Нейтрализовать с 5 М КОН до рН 7 и довести объем до 5 мл сН2О. Разделить на аликвоты и затем хранить при -20 °C.
- Приготовить 1 М пирувата: Растворить 550 мг натриевой соли пировиноградной кислоты в 4 млН2О. Нейтрализовать с 5 М КОН до рН 7 и довести объем до 5 мл сН2О. Разделить на аликвоты и затем хранить при -20 °С.
- Приготовить 0,5 М АДФ (аденозин 5'-дифосфат): Растворить 1,068 г адф натриевой соли в 4 млН2О. Нейтрализовать с 5 М КОН до рН 7 и довести объем до 5 мл сН2О. Разделить на аликвоты и затем хранить при -20 °С.
- Приготовить 2 М глутамата: Растворить 3,7426 г моногидрата L-глутаминовой кислоты в 8 млН2О. Нейтрализовать с 5 М КОН до рН 7 и довести объем до 10 мл сН2О. Разделить на аликвоты и затем хранить при -20 °С.
- Приготовить 4 мМ цитохрома c:Растворить 50 мг цитохрома c в 1 млH2O. Разделить на аликвоты и затем хранить при -20 °C.
- Приготовить 1 М сукцината: Растворить 2,701 г сукцината динатриевой соли гексагидрата в 8 млH2O.Нейтрализовать с 1 N HCl до рН 7 и довести объем до 10 мл сH2O. Разделить на аликвоты и затем хранить при -20 °C.
- Приготовьте 1 мМ FCCP (карбонильный цианид-4-(трифторметокси)фенилгидразон): Растворите 2,54 мг FCCP в 10 мл чистого этанола. Разделить на аликвоты и затем хранить при -20 °C.
- Приготовить 150 мкМ ротенона: растворить 3,94 мг ротенона в 10 мл чистого этанола, чтобы приготовить 1 мМ запаса, вихрь до полного растворения. Разбавить 225 мкл концентрации ротенона 1 мМ с 1,275 мл чистого этанола, чтобы получить 1,5 мл 150 мкМ ротенона. Защитить от света, разделить на аликвоты, а затем хранить при -20 °C.
- Приготовить 125 мкМ антимицина А: Растворить 11 мг антимицина А в 4 мл чистого этанола, чтобы получить концентрацию антимицина А в 5 мМ. Развести 25 мкл 5 мМ концентрации антимицина А с 975 мкл чистого этанола, чтобы получить 1 мл 0,125 мМ антимицина А. Разделить на аликвоты и затем хранить при -20 °C.
- Приготовить 0,8 М Аскорбата: Растворить 1,584 г аскорбатной натриевой соли в 8 млН2О. Отрегулировать рН аскорбиновой кислотой до рН 6 и довести объем до 10 мл сН2О. Защитить от света, разделить на аликвоты, а затем хранить при -20 °С.
- Приготовьте 0,2 M TMPD (тетраметил-п-фенилендиамин): Растворите 32,85 мг TMPD в 987,5 мкл DMSO. Добавьте 12,5 мкл аскорбата 0,8 М (конечная концентрация аскорбата 10 мМ). Защитить от света, разделить на аликвоты, а затем хранить при -20 °C.
- Приготовить 4 М азида натрия: Растворить 2,6 г азида натрия в 10 млH2O.Разделить на аликвоты и хранить при -20 °C.
2. Рост опухоли
- Выращивайте клетки EO771 в питательной среде RPMI 1640 и поддерживайте клетки в увлажненном инкубаторе с температурой 37 °C с 5% CO2.
- Одноместные четырехнедельные самки мышей C57BL/6J поддерживают их при 21-22 °C при 12-часовом свете: темном цикле. Обеспечьте мышам ad libitum доступ к пище и воде.
- Как только мыши достигнут 10-недельного возраста, подготовьте клетки и мышей к имплантации раковых клеток.
- Трипсинизируют клетки, деактивируют трипсин с ростовыми средами и центрифугируют клетки при 500 х г в течение 5 мин при комнатной температуре. Аспирируйте супернатант и повторно суспендируйте и комбинируйте клеточные гранулы (по мере необходимости) в средах. Подсчитайте жизнеспособные клетки с помощью трипан-синего цвета и приготовьте разбавление клеток 1х 10 6 клеток общим объемом 60 мкл с помощью 1:1:1 среды/фундаментальной мембранной матрицы/PBS раствора. После добавления матрицы базальной мембраны хорошо перемешайте и держите клеточную суспензию на льду. Наполните шприцы 60 мкл клеточной суспензии и поместите их на лед. Работайте эффективно и вводите клетки мышам в течение 1,5 ч после приготовления.
- Обезболивание мышей путем вдыхания изофлурана (3%-5% для индукции и 1%-3% для поддержания). Брейте между правыми4-й и5-й паховыми молочными железами. Ортотопически вводят анестезированным мышам клеточную суспензию EO771.
- Используйте электронные суппорты для мониторинга и измерения роста опухоли два раза в неделю в течение 4 недель. При некропсии, иссечении, взвешивании, а затем поместите опухоль (или минимум 60 мг опухолевого сечения) немедленно в 10 мл ледяного БИОПСА. Держите трубку на мокром льду.
3. Настройка и калибровка приборов
- Нагрейте среду MiR05 на водяной бане с температурой 37 °C.
- Включите систему Oroboros O2k, откройте программное обеспечение DATLAB, введите или выберите Пользователь. Нажмите «Подключиться к O2k». Проверьте конфигурацию O2k и убедитесь, что правильный прибор помечен для Power-O2k и каждая камера соответствует правильному датчику кислорода; Нажмите кнопку ОК. Как только откроется окно управления O2k, на вкладке «Системы» установите температуру блока на 37 °C, скорость мешалки на 750 об/мин для обеих камер, а интервал записи данных — на 2,0 с. Проверьте мощность и освещение мешалки в коробках камеры. На вкладке Кислород, O2 установите коэффициент усиления для датчика на 1 В/мкА (коэффициент усиления, возможно, потребуется отрегулировать для более старых моделей приборов), напряжение поляризации на 800 мВ, а затем нажмите кнопку Подключиться к O2k. Как только откроется новый файл эксперимента, назовите файл и нажмите кнопку Сохранить. Как только эксперимент активен, откроется окно выбора протокола; нажмите кнопку Отмена, чтобы запустить пользовательский SUIT (титрование ингибитора разъединителя субстрата).
- После выбора протокола откроется окно примера для заполнения экспериментального кода, типа образца, когорты, кода образца, номера образца и номера подвыборки, если это применимо. Назначают единицу по мг и вводят в опухоль концентрацию гомогената на мл (количество на камеру будет автоматически заполняться). Убедитесь, что указанная среда MiR05, а объем камеры составляет 2,00 мл. Добавьте комментарии по мере необходимости в нижнем поле и нажмите OK.
- Удалите пробки и аспирируйте 70% этанола из камер. Никогда не аспирируйте близко к мембране, которая обнажается внутри камеры. Промыть четыре раза чистой водой и заполнить камеру 2,25 мл MiR05.
- Тест датчика: нажмите F9, чтобы выключить мешалки на 30 с. Как только мешалка снова включится, убедитесь, что наклон O2 быстро увеличивается моноэкспоненциально в каждой камере. Если камера не проходит тест датчика, проверьте электрические соединения и очистите, не накопились ли соли; повторите тест. Если датчик по-прежнему не проходит тест, снимите разъем полярографического датчика кислорода (POS) для проверки мембраны. Если наблюдается видимое повреждение мембраны, сильное окисление или значительное накопление пузырьков, прекратите экспериментальные процедуры и приступайте к обслуживанию прибора.
- Калибровка кислорода: Выполните калибровку кислорода для получения точных измерений дыхания.
- С помощью скручивающего движения медленно вставьте пробки в их откалиброванное по объему положение. Откачайте лишнюю среду, выброшенную через инъекционный капилляр, который собирается в колодце пробки. Скручивающим движением поднимите пробки ровно настолько, чтобы плотно прилегать к стопорно-распорному инструменту, оставив объем газа над жидкой фазой для окончательного уравновешивания воздуха (30-45 мин.).
- Используйте устойчивое состояние, достигнутое за этот период, для калибровки датчика кислорода для получения точных измерений дыхания. Наклон O2 neg. (отрицательный наклон кислорода) составляет 0 ± 2 пмоль/с·мл. Если значение выше 2 пмоль/с·мл, очистите камеру и пополните ее свежеотмороженным MiR05. Если уклон неустойчив, приступайте к обслуживанию прибора.
- После достижения устойчивого состояния выберите кривую концентрации O2 и выделите устойчивую область кривой, удерживая клавишу shift и щелкнув левой кнопкой мыши. После того, как регион выбран, нажмите на F5,выберите метку для калибровки воздуха с помощью стрелки раскрывающегося списка и нажмите «Откалибровать» и скопируйте в буфер обмена.
- Инструментальная калибровка фона (опционально)
- После калибровки воздуха убедитесь, что над жидкой фазой нет объема газа для выравнивания фона потока (~ 15 мин) и полностью закройте камеры.
ПРИМЕЧАНИЕ: Установившаяся скорость, достигнутая за этот период, представляет собой инструментальную основу и может быть вычтена из полученных данных для повышения аналитической точности. Наклон O2 neg. первоначально немного увеличится и плато между ± 2 до 4 pmol / s·mL. - Если значение высокое (>6 пмоль/с·мл), существует потенциальное биологическое загрязнение. В этом случае очистите камеру и пополните ее свежеразмороженным MiR05. После достижения установившегося состояния выберите кривую наклона O2 и выделите устойчивую область кривой, удерживая клавишу Shift и щелкнув левой кнопкой мыши.
- После выбора области нажмите клавишу F5,выберите поле коррекции базовой линии и отметку для базовой линии со стрелкой раскрывающегося списка и нажмите OK.
- После калибровки воздуха убедитесь, что над жидкой фазой нет объема газа для выравнивания фона потока (~ 15 мин) и полностью закройте камеры.
4. Препарат гомогената опухоли
- Поместите на влажный лед стеклянный гомогенизатор, содержащий 1 мл MiR05 и плотно прилегающий стеклянный пестик.
- Во время исследования поместите ткань в 1 мл BIOPS в ледяную чашку Петри.
- Очистите и рассекните ткань, чтобы максимизировать растворимый материал, избежать некротических областей и удалить краевую опухолевую ткань. Используя расслоительный микроскоп, скальпель и хирургический пинцет, удалите все волосы, некротическую ткань, периферическую соединительную и сосудистую ткань и прилегающий жир, если это применимо. Позаботьтесь о том, чтобы сохранить опухоль в ледяном BIOPS во время рассечения.
- Разрежьте опухоль на небольшие кусочки (~ 5-10 мг каждый) и поместите оставшиеся кусочки опухоли обратно в 10 мл BIOPS, хранящегося на льду. Используйте эту ткань позже для дополнительных препаратов, если это необходимо.
ПРИМЕЧАНИЕ: Выполните следующие действия быстро, чтобы свести к минимуму количество времени, в течение которого образец не погружается полностью в BIOPS. После того, как образец помещен в MiR05, время имеет решающее значение. Осторожно переместите подготовленный гомогенат в калиброванную камеру как можно скорее. - Аккуратно промокните участки ткани на фильтровальной бумаге, поместите их на небольшую пластиковую смоляную весовую лодку и запишите начальный влажный вес. Поместите неиспользованные кусочки обратно в коническую трубку BIOPS объемом 10 мл для дальнейшего сохранения.
- Погрузите участки ткани в ледяной гомогенизатор, содержащий MiR05, и запишите оставшийся вес на весовой лодке, если это применимо.
- Используя стеклянный пестик (диапазон клиренса 0,09-0,16 мм), мягко разрушают опухолевую ткань, выполнив 5-7 ударов вниз и вверх. Для каждого удара поворачивайте пестик по часовой стрелке против часовой стрелки 3 раза, толкая пестик вниз и еще 3 раза, вытягивая пестик обратно вверх. Убедитесь, что ткань оседает на дне гомогенизатора между ударами, но избегайте полностьюго поднятия пестика над объемом жидкости, чтобы предотвратить вспенивание.
ПРИМЕЧАНИЕ: Полученный гомогенат должен казаться мутным с минимальными остатками твердых тканей. - Налейте гомогенат в коническую трубку объемом 15 мл и поместите его на лед.
- Пипетка 1-3 мл свежего MiR05 над пестиком и в гомогенизатор для промывки оставшегося гомогената ткани. Вылейте промывку MiR05 в коническую трубку, содержащую гомогенат. Повторите промывание пестика и гомогенизатора 2-3 раза, чтобы обеспечить полную передачу гомогената. Имейте в виду целевую концентрацию и необходимый объем, чтобы не разбавлять образец во время этапов промывки.
- Чтобы точно рассчитать концентрацию гомогената в тканях, тщательно осмотрите гомогенизатор и гомогенат на наличие оставшегося негомогенизированного материала (т.е. соединительной ткани).
- Чтобы удалить из гомогенизатора неомогенизированный материал, который не может быть достигнут пинцетом, добавьте MiR05 к гомогенизатору, аспирируйте объем (включая ткань) пипеткой и переместите содержимое в чашку Петри.
- Чтобы удалить неомогенизированный материал из гомогената (поселившийся крупными кусками на дне конической трубки), аспирируйте крупные куски пипеткой и поместите их на тканевую крышку конической трубки.
- Удалите ткань из чашки Петри или колпачка конической трубки пинцетом и промойте ее на фильтровальной бумаге. Добавьте оставшийся гомогенат из колпачка конической трубки обратно в коническую трубку, закройте его, а затем переверните для смешивания.
- Повторно проверьте гомогенизаторы и гомогенат на наличие любого дополнительного негомогенизированного материала и повторите этапы 4.10.1-4.10.3 для удаления материала по мере необходимости.
- Взвешивайте и регистрируйте массу неодногенизированного материала, извлеченного из гомогенизатора. Осмотрите гомогенатный препарат на наличие перенесенной грубо неповрежденной ткани. Удалите неомогенизированные куски и взвесьте по мере необходимости.
- Вычтите вес ткани, извлеченный из весовой лодки, гомогенизатора и гомогената (при необходимости) из исходного веса влаги, чтобы рассчитать окончательный вес образца.
- Используя окончательный вес образца, добавьте дополнительный MiR05, чтобы довести гомогенат до желаемой концентрации (см. шаг 5 для получения подробной информации об экспериментах по оптимизации).
- После того, как гомогенат взвешен и приготовлен, приступайте к анализу как можно скорее. Храните образец на влажном льду до тех пор, пока он не будет перенесен на инструмент.
5. Протокол титрования субстрата, разъединителя, ингибитора (SUIT)
- После калибровки прибора и подготовки образца удалите пробки скручивающим движением и аспирируйте MiR05 из камер (избегая мембраны, открытой внутри камеры). Хорошо перемешайте гомогенат и добавьте в камеру 2,25 мл гомогената. При добавлении одного гомогената в несколько камер пипетку по 1 мл за раз в каждую камеру при смешивании гомогената для обеспечения равного распределения тканей. Нажмите F4, чтобы назвать и пометить время события, а затем нажмите OK.
- Наполните шприц объемом 50 мл кислородом из кислородного баллона с регулятором и газовой трубкой с помощью тупой иглы 18 Г. Гипероксигенировать камеры до ~500 мкМ кислорода. Для этого вводят кислород непосредственно в камеры. Свободно вставьте пробки и подождите, пока кислород не достигнет ~480 мкМ. Скручивающим движением медленно закройте камеру и дайте дыханию уравновеситься (~15-20 мин). При необходимости заполните центральный капилляр пробки MiR05.
- Аналитическое определение емкости OXPHOS и ET (состояние переноса электронов) N-связанной и NS-связанной и CIV (комплекс IV): Использование специальных микрошприцев для введения подложек, разъединителей и ингибиторов в полностью закрытые камеры. Нажимайте на F4 с каждой инъекцией, чтобы назвать и отметить время событий для каждой камеры в режиме реального времени. На протяжении всего исследования выбирайте F6 для корректировки концентрации O2 и шкалы наклона O2 по мере необходимости. После каждой инъекции промывайте шприцы 3 раза в воде (для водорастворимых соединений) или 70% этаноле (для соединений, растворенных в этаноле или ДМСО).
ПРИМЕЧАНИЕ: N-связанный: поток O2, поддерживаемый определенными NADH-генерирующими комбинациями подложек, NS-связанный: потокO2, поддерживаемый сходимостью определенных NADH-генерируемых комбинаций подложек и сукцината.- Добавьте 5 мкл 0,8 М малата (конечная концентрация 2 мМ) и немедленно приступайте к следующей инъекции. Промыть шприц для инъекций 3 раза в воде.
- Немедленно добавьте 5 мкл 1 М пирувата (конечная концентрация 2,5 мМ) и дождитесь стабилизации дыхания. Промыть шприц для инъекций 3 раза в воде.
- Добавьте 10 мкл 0,5 М АДФ (конечная концентрация 2,5 мМ) и дождитесь стабилизации реакции АДФ. Промыть шприц для инъекций 3 раза в воде.
ПРИМЕЧАНИЕ: Дополнительный АДФ (2,5-10 мМ) может потребоваться для обеспечения того, чтобы концентрации аденилата не ограничивались дыхательными потоками. - Добавьте 5 мкл 2 М глутамата (конечная концентрация 5 мМ) и дождитесь стабилизации дыхания. Промыть шприц для инъекций 3 раза в воде.
- Добавьте 5 мкл 4 мМ цитохрома c (конечная концентрация 10 мкМ) и дождитесь стабилизации дыхания. Промыть шприц для инъекций 3 раза в воде.
- Добавьте 20 мкл 1 М сукцината (конечная концентрация 10 мМ) и дождитесь стабилизации дыхания. Промыть шприц для инъекций 3 раза в воде.
- Титруйте 0,5-1 мкл с шагом 1 мМ FCCP (конечная концентрация 2-20 мкМ) и дождитесь стабилизации дыхания после каждой инъекции, продолжайте до тех пор, пока не произойдет дополнительного увеличения дыхания. Промыть шприц для инъекций 3 раза в 70% этаноле.
- Добавьте 2 мкл 150 мкМ ротенона (конечная концентрация 150 нМ-2 мкМ) и дождитесь стабилизации дыхания. Добавьте еще 1 мкл ротенона, чтобы убедиться, что нет дальнейшего ингибирования. Если наблюдается снижение дыхания, продолжайте дополнительные инъекции до тех пор, пока не произойдет снижения дыхания. Промыть шприц для инъекций 3 раза в 70% этаноле.
- Добавьте 2 мкл 125 мкМ антимицина А (конечная концентрация 125 нМ-5 мкМ) и дождитесь стабилизации дыхания. Добавьте еще 1 мкл антимицина А, чтобы убедиться, что нет дальнейшего ингибирования. Если наблюдается снижение дыхания, продолжайте дополнительные инъекции до тех пор, пока не произойдет снижения дыхания. Промыть шприц для инъекций 3 раза в 70% этаноле.
- Проверить концентрацию кислорода в камере; если концентрация ниже 125 мкМ, реоксигенировать в комнатный воздух или слегка гипероксигенат, чтобы гарантировать, что кислород не ограничивает дыхательный поток. Добавьте 5 мкл 0,8 М аскорбата (конечная концентрация 2 мМ). Промыть шприц для инъекций 3 раза в 70% этаноле.
- Сразу добавляют 10 мкл 0,2 М TMPD (конечная концентрация 1 мМ), дождитесь медленного увеличения дыхания. Промыть шприц для инъекций 3 раза в 70% этаноле.
- Добавьте 25 мкл 4 М азида натрия (конечная концентрация 50 мМ) сразу же, когда дыхательный поток аскорбата/TMPD плато. Промыть шприц для инъекций 3 раза в 70% этаноле.
- Завершите исследование - нажмите Файл, Сохранить и Отключить. Продолжайте мыть камеру и шприц, следуя шагам 9.2-9.3.
6. Протокол чувствительности ADP
- После того, как прибор откалиброван и образец подготовлен, снимите пробки скручивающим движением и аспирируйте MiR05 из камер (избегая мембраны, открытой на внутренней стороне камеры). Хорошо перемешайте гомогенат и добавьте в камеру 2,25 мл гомогената. Предположим, что мы добавляем один гомогенат в несколько камер, пипетку по 1 мл за раз в каждую камеру при смешивании гомогената для обеспечения равного распределения тканей. Нажмите на F4, чтобы назвать и отметить время события, и нажмите OK.
- Вставьте пробки и скручивающим движением медленно закройте камеру и дайте дыханию уравновеситься (~15-20 мин). При необходимости заполните центральный капилляр пробки MiR05.
- Аналитическое определение чувствительности митохондриального АДФ, связанного с сукцинатом: нажмите F4 с каждой инъекцией, чтобы назвать и отметить время событий для каждой камеры в режиме реального времени. На протяжении всего исследования выбирайте F6 для корректировки концентрации O2 и шкалы наклона O2 по мере необходимости.
- Добавьте 2 мкл 150 мкМ ротенона (конечная концентрация 150 нМ).
- Немедленно добавьте 20 мкл 1 М сукцината (конечная концентрация 10 мМ) и дождитесь стабилизации дыхания.
- Титруйте АДФ путем поэтапного добавления субнасыщенных концентраций до достижения максимальной скорости отклика (VMAX;конечная концентрация 2,5-10 мМ).
ПРИМЕЧАНИЕ: Скорость может стабилизироваться после инъекции из-за небольшого изменения концентрации АДФ, таким образом, увеличивать концентрацию инъекции после каждого плато и продолжать титрование до тех пор, пока не произойдет дальнейшего увеличения дыхания даже при кратном увеличении концентрации АДФ для инъекций.
7. Рекомендуемые эксперименты по оптимизации
- Определить оптимальную концентрацию гомогената и кислорода для протокола.
- Выполнять протокол SUIT (этапы 5.1-5.3) при множественных концентрациях в тканях (например, 30 мг/мл, 20 мг/мл, 10 мг/мл, 5 мг/мл, 2,5 мг/мл, 1 мг/мл и/или 0,5 мг/мл).
- Подбирают концентрацию, максимизирующую дыхательный поток при ограничении частоты резоксигенаций (не более 1-2). Если требуются более частые реоксигенации, уменьшите концентрацию гомогената.
- Определите оптимальное количество ударов с помощью гомогенизатора.
- Выполняйте протокол SUIT (шаги 5.1-5.3) на нескольких уровнях гомогенизации (например, 5 ударов, 10 ударов, 15 ударов, 20 ударов).
- Поскольку в литературе недостаточно данных для определения порога процентного увеличения цитохрома с опухолевым гомогенатным препаратом, выбирайте препарат с ограниченным ответом цитохрома с, но адекватным дыханием, подпитываемым интересующим субстратом (субстратами).
- Определение оптимальных концентраций субстрата, АДФ, разъединителя и ингибитора, необходимых для количественных и воспроизводимых дыхательных потоков.
- Выполнять протокол SUIT (этапы 5.1-5.3.9) при выбранной концентрации в тканях (этап 7.1). Титруйте каждый субстрат, разъединитель, ингибитор и АДФ до тех пор, пока не будет наблюдаться дальнейший ответ. Титруйте ингибирование азидом натрия в отдельных экспериментах.
- Добавьте 5 мкл 0,8 М малата (конечная концентрация 2 мМ) и немедленно приступайте к следующей инъекции.
- Титруйте 1 мкл с шагом 1 М пирувата и дождитесь стабилизации дыхания после каждой инъекции, продолжайте до тех пор, пока не произойдет дополнительного увеличения дыхания.
- Титруйте 2 мкл с шагом 0,5 М АДФ и дождитесь стабилизации дыхания после каждой инъекции, продолжайте до тех пор, пока не произойдет дополнительного увеличения дыхания.
- Титруйте 1 мкл с шагом 2 М глутамата и дождитесь стабилизации дыхания после каждой инъекции, продолжайте до тех пор, пока не произойдет дополнительного увеличения дыхания.
- Добавьте 5 мкл 4 мМ цитохрома c (конечная концентрация 10 мкМ) и дождитесь стабилизации дыхания.
- Титруйте 5 мкл с шагом 1 М сукцината и дождитесь стабилизации дыхания после каждой инъекции, продолжайте до тех пор, пока не произойдет дополнительного увеличения дыхания.
- Титруйте 5 мкл с шагом 0,5 М АДФ и дождитесь стабилизации дыхания после каждой инъекции, продолжайте до тех пор, пока не произойдет дополнительного увеличения дыхания.
- Титруйте с шагом 0,5 мкл 1 мМ FCCP и дождитесь стабилизации дыхания после каждой инъекции, продолжайте до тех пор, пока не произойдет дополнительного увеличения дыхания.
- Титруйте 1 мкл с шагом 150 мкМ ротенона и ждите, пока дыхание стабилизируется после каждой инъекции, продолжайте до тех пор, пока не произойдет уменьшения увеличения дыхания.
- Титруйте 1 мкл с шагом 125 мкМ антимицина А и дождитесь стабилизации дыхания после каждой инъекции, продолжайте до тех пор, пока не произойдет дополнительного снижения дыхания.
- Добавьте 5 мкл 0,8 М аскорбата (конечная концентрация 2 мМ).
- Сразу же добавляют 5 мкл 0,2 М TMPD (конечная концентрация 0,5 мМ), дождитесь медленного увеличения дыхания. В отдельном эксперименте добавляют 10 мкл 0,2 М TMPD (конечная концентрация 1 мМ).
- В отдельных экспериментах добавляют 10 мкл, 25 мкл, 50 мкл и 100 мкл 4 М азида натрия (20 мМ, 50 мМ, 100 мМ, 200 мМ конечной концентрации соответственно) сразу же, когда дыхательный поток Аскорбата/ТМПД плато.
- Выберите концентрации субстрата и ингибиторов, которые насыщаются в течение первой инъекции, чтобы улучшить сроки эксперимента. Используйте ADP в насыщенных или субнасыщенных концентрациях для объединения оценок чувствительности ADP с традиционными протоколами SUIT.
- Используйте субмаксимальные концентрации разъединителя, чтобы продемонстрировать реакцию на дозу без ингибирования потока дыхания.
- Выполнять протокол SUIT (этапы 5.1-5.3.9) при выбранной концентрации в тканях (этап 7.1). Титруйте каждый субстрат, разъединитель, ингибитор и АДФ до тех пор, пока не будет наблюдаться дальнейший ответ. Титруйте ингибирование азидом натрия в отдельных экспериментах.
8. Анализ данных
- Анализ КОСТЮМА
- Выберите стационарные или пиковые ставки для каждого титрования и экспорта для аналитического сокращения.
- Экспрессируют данные в виде пмола О2 в секунду на мг ткани (пмол/с/мг).
- Достижение аналитического снижения ТЧ-L, PM-P, PMG-P, PMGS-P и PMGS-E путем вычитания антимицина A нечувствительной нормы из соответствующей нормы (т.е. стационарной нормы, полученной после добавления АДФ).
ПРИМЕЧАНИЕ: PM: Пируват + Малат; ПМГ: Пируват + Малат + Глутамат; ПМГС: Пируват + Малат + Глутамат + Сукцинат; -L:Состояние утечки; -P: Состояние окислительного фосфорилирования, -E: Состояние переноса электронов. - Достижение аналитического снижения CIV-E путем вычитания нечувствительной к азиду натрия скорости из пиковой скорости аскорбата/TMPD.
- Достижение аналитического снижения PMG-E путем вычитания коэффициента нечувствительности ротенона из скорости PMGS-E.
- Достижение аналитического снижения S-E путем вычитания нечувствительной к антимицину А скорости из нечувствительной к ротенону скорости.
- Достичь аналитического снижения эффективности управления цитохромом c, маркером неповрежденности наружной мембраны, с помощью следующего уравнения:
jc = ((JCHNOc - JCHNO)/JCHNO) x 100
В уравнении jc — % увеличения при добавлении цитохрома c,JCHNOc — поток кислорода после добавления цитохрома c,а JCHNO — поток кислорода до добавления цитохрома c.
- Анализ чувствительности ADP
- Аналитически определить кинетику чувствительности АДФ относительно скорости утечки сукцината + ротенона (а не скорости гомогената ткани).
- Построение потока O2 (ось Y) относительной концентрации АДФ (ось X). Определите максимальную скорость дыхания(Vmax)как пиковую скорость, достигнутую за титрованиеМ АДФ.
- Определите кинетику Михаэлиса-Ментена с помощью программного обеспечения для подгонки кривых (PRISM, версия 10.1), чтобы выявить концентрацию АДФ, при которой достигается 1/2 ВMAX (Apparent KM).
9. Инструментальный контроль качества
- Выполняйте инструментальный фонО2 в пределах требуемого диапазона концентрации кислорода (0-600 мкМ) и нулевую калибровку.
- Выполните шаги 3.1 и 3.2
- Удалите пробки и аспирируйте 70% этанола из камер (избегая мембраны, открытой внутри камеры). Промыть 4 раза двойным дистиллированным H2O и заполнить камеру 2,25 мл MiR05
- Гипероксигенировать камеры до ~600 мкМ кислорода.
- Медленно вставляйте пробки в их полностью закрытое положение. Скачайте избыточную среду, выброшенную через капилляр впрыска и собранную в лунку пробки, и дайте сигналу кислорода стабилизироваться (30-45 мин).
- Чтобы выполнить калибровку кислорода, выберите область, где концентрация кислорода и наклон стабильны, откройте окно калибровки для соответствующей камеры и выберите отметку R1.
- Готовят раствор дитионита, растворяя 20 мг гидросульфита натрия в 0,5 мл воды. Ограничьте воздействие воздуха, так как дитионит окисляется с течением времени под воздействием кислорода.
- Как только сигнал кислорода стабилизируется, вводят 1 мкл и наблюдают снижение концентрации кислорода. Отрегулируйте эффективность раствора дитионита по мере необходимости.
- Вводят достаточное количество раствора дитионита для снижения концентрации кислорода до 450 мкМ, 300 мкМ, 225 мкМ, 150 мкМ, 75 мкМ и 0 мкМ соответственно. При каждой инъекции дайте кислороду стабилизироваться и выберите отметку для устойчивого наклона. Как только концентрация кислорода достигнет ~ 0 мкМ, отметьте концентрацию кислорода.
- Чтобы выполнить инструментальную коррекцию фона O2, выберите окно потока/ наклона для соответствующей камеры, выберите O2 Background Calibrationи нажмите «Калибровка» для интересующих меток.
- Чтобы выполнить нулевую калибровку, откройте окно калибровки для соответствующей камеры и выберите отметку R0, достигнутую после титрования дитионита.
- Чистка приборов
- Быстро промойте каждую камеру чистой водой три раза. Для первой промывки аспирируйте гомогенат, заполните камеру полностью водой, а затем аспирируйте воду. Для второй промывки наполните камеру на 3/4 водой, вставьте пробки, чтобы протолкнуть воду через капилляр инъекции, аспирируйте часть воды через капилляр для инъекций, а затем удалите пробки, чтобы аспират промыть полностью.
- Промывайте камеры 70% этанолом в течение 5 мин.
- Над раковиной или стаканом очистите пробки чистой водой, 70% этанолом и 100% этанолом, проталкивая жидкость через капилляры для инъекций с помощью бутылки для мытья.
- Быстро промойте каждую камеру чистой водой два раза.
- Инкубируйте камеры с 2 мл PBS, содержащим ~ 2 мг замороженных митохондрий, клеточного лизата или живых фибробластов в течение 15 минут.
- Промыть камеры чистой водой в течение 5 мин два раза.
- Промывайте камеры 70% этанолом в течение 5 мин два раза.
- Промывайте камеры 100% этанолом в течение 10 мин.
- Наполните камеры 70% этанолом.
- Если проводится последовательный эксперимент, оставьте камеры в 70% этаноле на 5 мин, а затем перейдите к шагу 3,3.
- Если эксперименты завершены, наденьте крышки на пробки и выключите прибор.
- После каждого использования правильно очищайте шприцы для инъекций и держите шприцы предназначенными для использования в конкретных соединениях, чтобы предотвратить перенос.
- Вставьте шприц в промывочную жидкость и полностью погрузите инъекционную иглу.
- Втяните промывочную жидкость в шприц до максимального объема.
- Извлеките шприц из емкости для стирки, выбросьте жидкость для стирки в стакан, а затем промойте шприц на бумажном полотенце.
- Повторите шаги 9.3.1-9.3.3 три раза как можно скорее после каждого использования.
Результаты
Первоначальные исследования показали, что опухоли EO771 были низкоокислительными и, следовательно, требовали высоких концентраций гомогенатов для адекватной оценки потока O2. Были проведены оптимизационные эксперименты для определения оптимального диапазона концентрации гомогената в тканях для исследования. Гомогенаты опухоли первоначально получали при 40 мг/мл, а затем линейно разбавляли. ПотокO2, нормализованный до массы ткани, был согласован по всем концентрациям(рис. 1A-D). Было отмечено, что 40 мг/мл приводит к быстрому истощению кислорода и не подходит для экспериментов(рисунок 1А). Потребление кислорода существенно замедлилось с 30 мг/мл и 20 мг/мл, но все же быстро снижалось за короткое время в отсутствие субстратов или АДФ(Рисунок 1В,С). Концентрация 10 мг/мл привела к оптимальному расходу кислорода(рисунок 1D),который поддерживал бы более длинный 90-минутный протокол SUIT.
Протокол SUIT использовался для оценки NADH- и сукцинат-связанных OXPHOS и ET, а также активности CIV(рисунок 2A). Пируват и малат добавляли к гомогенату ткани в отсутствие АДФ для утечек (L) через NADH. Затем добавляли насыщенный АДФ для обеспечения максимального NADH-связанного OXPHOS (P), за которым следовало добавление глутамата. Затем добавляли цитохром c для обеспечения целостности наружной мембраны; увеличение частоты дыхания составило менее 20% во всех выборках(рисунок 2В). Учитывая очень низкую реакцию на NADH-связанные субстраты, высвобождение цитохрома c также оценивали в присутствии сукцината и ротенона и наблюдали минимальную стимуляцию цитохрома c (рисунок 2B). Интересно, что NADH-связанный OXPHOS был незначительным в опухолях EO771(рисунок 2C). Затем сукцинат добавляли в присутствии пирувата, малата и глутамата для стимуляции потока электронов через сукцинатдегидрогеназу. Затем FCCP был титрован для управления максимальным потоком электронов (E), что показало, что в опухолях EO771 фосфорилирование, а не окисление ограничивало дыхание(рисунок 2C). Ротенон и антимицин А были впоследствии титрованы для ингибирования комплекса I и комплекса III соответственно. Затем были добавлены аскорбат и TMPD для управления максимальным потоком электронов через CIV, который затем ингибируется азидом натрия. Таблица 1 иллюстрирует аналитические уравнения редукции исходных данных(Таблица 2)для количественного определения параметров дыхания, построенных на рисунке 2C. В целом, гомогенатные респираторные профили опухоли(рисунок 2C)аналогичны профилям неимплантированных проницаемых дигитонином клеток EO771(рисунок 2D),за исключением уменьшенного максимального переноса электронов, поддерживаемого N- и S-сцепленными субстратами в опухоли.
Поскольку NADH-связанное дыхание было незначительным, дыхательная кинетика сукцината дополнительно оценивалась путем поэтапного титрования субнасыщенного АДФ до достижения максимальной скорости (VMAX)(рисунок 3A,3B). Полумаксимальная концентрация (KM)АДФ в присутствии сукцината + ротенона составляла 37,5 мкМ, тогда как VMAX составляла ~10,5 пмоль/с/мг(рисунок 3C). Таким образом, несмотря на относительно низкие скорости окисления, опухоли EO771 были очень чувствительны к АДФ и поддерживали синтез АТФ при относительно низких концентрациях АДФ.
Выбор соответствующих областей необработанных данных для извлечения имеет решающее значение для воспроизводимости экспериментов и точной количественной оценки. Для цитохрома cмаркировка должна быть выбрана в установившемся состоянии непосредственно перед инъекцией(рисунок 4A, отметка1). Часто существует начальный артефакт инъекции, за которым может последовать период времени (около 5-10 минут), когда поток O2 не является устойчивым. Оценка эффективности цитохрома c производится путем дополнительного выбора после стабилизации потока O2 (рисунок 4A,отметка 2). Выбор после добавления субстратов, АДФ или большинства ингибиторов также производится после инъекционного артефакта и после стабилизации потока O2 (рисунок 4B). Отбор, используемый для определения максимального несвязанного дыхания, производится на пиковом увеличении, достигнутом при титровании FCCP, которое часто является не последней произведенной инъекцией(рисунок 4C). Выбор для TMPD производится после добавления аскорбата и TMPD и на пике увеличения дыхания(рисунок 4D,отметка 1). Сразу после этого пика добавляется ингибитор, азид натрия, который быстро уменьшает дыхание, но также часто имеет артефакт инъекции ниже, чем скорость ингибированного дыхания(рисунок 4D). Маркировка ингибитора производится сразу после инъекции артефакта(рисунок 4D,отметка 2). ПотокO2, как правило, не стабилизируется и продолжает уменьшаться.
Таблица 1: Дыхательная нотация и аналитический вывод. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Выборочные и дыхательные характеристики гомогенатов люминальной опухоли молочной железы В. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.

Рисунок 1:Оптимизация концентрации гомогената опухоли. O2 Flux (красный) и O2 Концентрация (синий) в гомогенатах опухоли молочной железы, приготовленных при(A)40 мг/мл,(B)30 мг/мл,(C)20 мг/мл и(D)10 мг/мл. Том: Тканевое гомогенатное дыхание. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
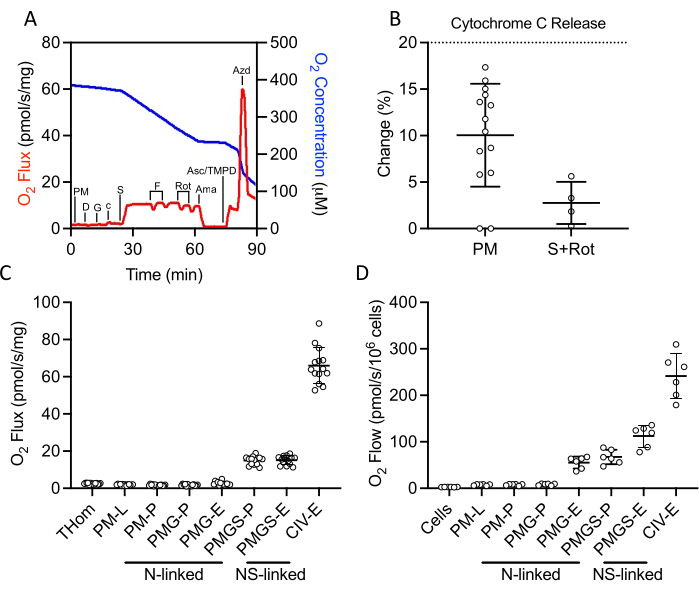
Рисунок 2:Оценка емкости OXPHOS и ET с помощью респирометрии высокого разрешения в свежеиссеченных гомогенатах опухоли. (A)Репрезентативный график потребления кислорода (красный) и концентраций (синий) в течение протокола субстрата, ингибитора, разъединителя. PM: Пируват + Малат, D: ADP, G: Глутамат, c: Цитохром c,S: Сукцинат, F: FCCP, Ротенон, Ama: Антимицин A, Asc / TMPD: Аскорбат / Тетраметил-п-фенилендиамин. (B)Процентное увеличение потокаO2 при добавлении цитохрома c. (C-D) Дыхание поддерживается малатом, пируватом, глутаматом и сукцинатом в присутствии АДФ, FCCP и аскорбата/TMPD в(C)EO771-производных опухолевых гомогенатах и(D)неимплантированных EO771 дигитонин-пермеабилизированных клетках. Том: Тканевое гомогенатное дыхание; ПМ: Пируват + Малат; ПМГ: Пируват + Малат + Глутамат; ПМГС: Пируват + Малат + Глутамат + Сукцинат; CIV: Комплекс IV; -L: Состояние утечки; -P: Состояние окислительного фосфорилирования, -E: Состояние переноса электронов; N-связанный: поток O2, поддерживаемый определенными NADH-генерирующими комбинациями подложек; NS-связанный: поток O2, поддерживаемый сходимостью определенных NADH-генерируемых комбинаций субстратов и сукцината. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
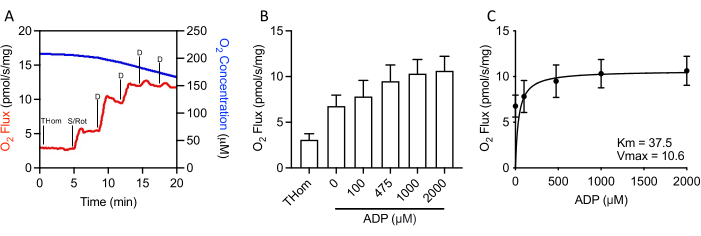
Рисунок 3:Опухоли молочной железы EO771 проявляли высокую чувствительность к АДФ (аденозин-5'-дифосфату). (A)Репрезентативный график потребления кислорода (красный) и концентраций (синий) во всем протоколе титрования АДФ, связанного с S. Том: Тканевое гомогенатное дыхание; S/Rot: Сукцинат/Ротенон; Д: АДП. (B)Дыхание, поддерживаемое сукцинатом в присутствии ротенона и повышение концентраций АДФ (0 мкМ АДФ = S/Rot-L). (C)Максимальная скорость (VMAX)и полумаксимальная концентрация (KM)АДФ в присутствии сукцината + ротенона. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
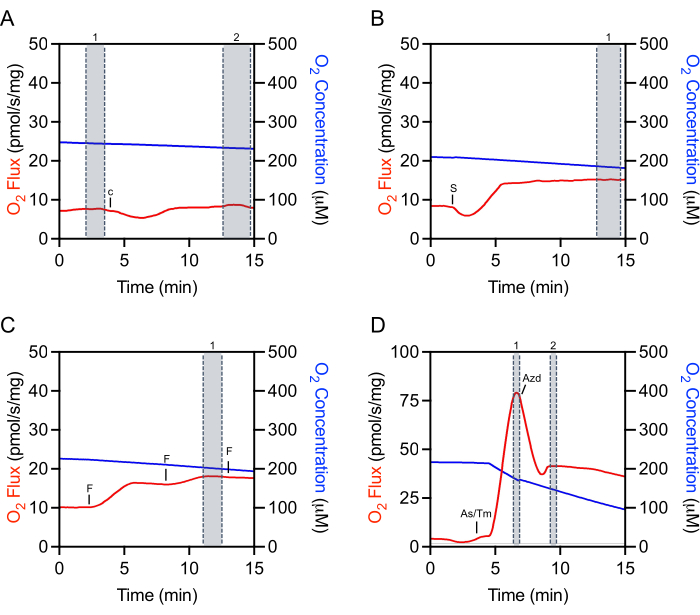
Рисунок 4:Репрезентативная трассировка, иллюстрирующая выбор метки необработанных потоков O2 для извлечения данных. (A) Выбор цитохрома c: выбор No 1 перед инъекцией цитохрома c и выбор No 2 после инъекции, когда поток O2 стабилизировался. c Цитохром c. (B)Выбор субстрата, АДФ и ингибитора: отбор No 1 после инъекции (сукцината на этом репрезентативном участке), где поток O2 стабилизировался. S: Сукцинат. (C) Выбор разъединителя: выбор No 1 на пике увеличения дыхания во время титрования разъединителя. На этом репрезентативном участке титрования FCCP третья инъекция немного снижает дыхание и, таким образом, не используется для отбора. F: ACCP. (D) Выбор TMPD: выбор No 1 на пике увеличения дыхания после инъекций аскорбата и TMPD. Выделение азида натрия: выделение No 2 после острого инъекционного артефакта, когда дыхание первоначально уменьшается. As/Tm: Аскорбат/TMPD; Азд: Азиде. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Подходы к оценке митохондриального дыхания при раке в значительной степени были ограничены моделями in vitro 13,14,15,16. Некоторые успехи были достигнуты в измерении митохондриального дыхания в опухолях с использованием химической пермеабилизации6,7,17,но не существует единого подхода золотого стандарта, который можно было бы универсально применять и сравнивать между типами опухолей. Кроме того, отсутствие последовательного анализа данных и отчетности ограничивает обобщаемость и воспроизводимость данных. Способ, описанный в настоящем описании, обеспечивает простой, относительно быстрый подход к измерению митохондриального дыхания18 в митохондриальных препаратах из свежеиссеченных твердых образцов опухолей. Опухоли были выращены из ортотопически имплантированных мышиных люминальных В, ERα-отрицательных EO771 клеток рака молочной железы19.
Усердие и осторожность при обращении с тканями значительно повысят точность и нормализацию норм потребления кислорода. Ткань и митохондрии могут быть легко повреждены, если образец не остается холодным, не постоянно погружается в консервационные среды или чрезмерно обрабатывается, что приводит к неоптимальной рутине и скорости OXPHOS. Кроме того, точный влажный вес гомогенизированной ткани имеет решающее значение, поскольку это основной метод нормализации. Могут быть рассмотрены другие методы нормализации, такие как общий белок или митохондриальные специфические маркеры, такие как активность цитратсинтазы20. Кроме того, необходимо будет решить проблему неоднородности тканей, при этом решения о опухолевых областях должны быть включены в эксперименты, сделанные априори. Некротическая, фиброзная и соединительная ткань может не гомогенизироваться и / или хорошо дышать, и ее следует избегать, если намеренно не анализировать эти опухолевые области. Примечательно, что опухоль может быть очень липкой в зависимости от типа и области иссечения, что затрудняет точное взвешивание и перенос. Количество ударов, используемых для гомогенизации, должно быть оптимизировано для обеспечения полной подготовки митохондрий при одновременном смягчении повреждения наружных митохондриальных мембран.
Для повышения точности и воспроизводимости мы рекомендуем проводить эксперименты по оптимизации количества штрихов для гомогенатного препарата, концентрации в тканях, а также концентраций субстрата, разъединителя, ингибитора. Исследования могут сравнивать различное количество инсультов и то, как они соответствуют реакции на добавление цитохрома c в рамках исследования, а также максимальную митохондриальную дыхательную способность 21. Хотя существует общее признание того, что меньший ответ цитохрома C лучше, поскольку увеличение потребления кислорода после добавления цитохрома c может указывать на повреждение внешней митохондриальной мембраны, не существует золотого стандарта в отношении того, каков этот порог для каждой ткани, и его следует экспериментально исследовать, чтобы гарантировать, что ткань не перегружена или недостаточно подготовлена. В этой опухолевой ткани было обнаружено, что ответ цитохрома c под ~ 30% не ухудшает дыхательную функцию. Использование цитохрома c становится критически важным для точной количественной оценки дыхательной способности, если тест положительный. В этом случае добавка восполняет эндогенный цитохром с, который при истощении вызовет недооценку дыхательных путей.
Эксперименты по титрованию концентрации в тканях могут быть выполнены в диапазоне возможных концентраций и, в идеале, должны проводиться с помощью SUIT, которые будут исследованы во время исследования. Дыхательная способность будет варьироваться в зависимости от типа и состава опухоли. Таким образом, опухоли плотные с митохондриями или высокой дыхательной способностью потребуют более низких концентраций (0,5-5 мг/мл). Опухоли с небольшим количеством митохондрий или низкой дыхательной способностью потребуют более высоких концентраций (7-12 мг / мл). Кроме того, SUIT, которые являются длинными или имеют высокопотребляемые субстраты, могут нуждаться в меньшем количестве ткани для предотвращения реоксигенации камеры или ограничения АДФ. Некоторые ткани будут иметь линейную зависимость в потреблении кислорода, тогда как другие будут демонстрировать улучшенную чувствительность и максимальное окисление в определенных диапазонах концентраций. Выбранная концентрация в тканях должна быть оптимизирована для максимизации потока кислорода при одновременном ограничении количества событий реоксигенации. Кроме того, часто лучше переоценить необходимость или стремиться к более высокому пределу диапазона концентраций. Ингибиторы, которые необходимы для количественного определения дыхательных потоков, более точны при использовании в больших пулах митохондрий.
Другим важным соображением является концентрация лекарств, которые используются во время протоколов. Изменения концентрации гомогенатов могут изменять концентрации субстратов, разъединителей и ингибиторов, необходимые для максимального ответа. Таким образом, как только оптимальный диапазон концентраций выбран, следует провести эксперимент, проверяющий дозы, необходимые для протокола SUIT. Дополнительный АДФ может быть добавлен для обеспечения того, чтобы концентрации аденилата не ограничивались дыхательными потоками. Химические разъединители, такие как FCCP или CCCP, будут ингибировать дыхание при более высоких концентрациях22. Таким образом, важно титровать в небольших количествах, чтобы выявить максимально достигнутую скорость. Ингибиторы, такие как ротенон и антимицин А, лучше всего использовать при насыщении в течение первой инъекции. В то время как оптимальные концентрации были определены в предварительных экспериментах, мы также наблюдали связанные с лечением различия в реакции на ингибиторы и, таким образом, часто добавляли одну дополнительную инъекцию ингибиторов, чтобы продемонстрировать максимальное ингибирование, поскольку результирующие скорости служат основой для количественной оценки. Химическое ингибирование аскорбата/TPMD имеет важное значение для точного аналитического восстановления, поскольку TMPD подвергается автоокислению23. Мы контролировали автоокисление аскорбата/TMPD/цитохрома c путем добавления азида натрия, установленного ингибитора CIV. Для исследований Km добавление ротенона в присутствии только сукцината предотвращает накопление оксалоацетата, который может ингибировать активность сукцинатдегидрогеназы при низких концентрациях24. Объем и концентрация АДФ сильно зависят от чувствительности митохондрий к преобладающей комбинации субстратов. Митохондриальные препараты, которые очень чувствительны к АДФ, потребуют более низких начальных концентраций. Кроме того, для успешных экспериментов необходимы проверенные химические вещества и надлежащая подготовка лекарств с вниманием к рН, чувствительности к свету, если это применимо, и температуре хранения.
Настройка приборов и рутинный уход имеют решающее значение для успеха этих экспериментов. Адекватная и надлежащая очистка камер имеет важное значение для воспроизводимости и предотвращения биологического, белкового, ингибиторного или разъединяющего загрязнения. Электроды типа Clark и системы O2k используют стеклянные реакционные камеры, что является значительным преимуществом в стоимости для пластинчатых систем, которые полагаются на расходные материалы. Однако стеклянные камеры должны быть тщательно очищены и могут быть источником ингибирующего загрязнения в последующих исследованиях. Инкубация с богатыми митохондриями образцами во время процесса промывания (например, изолированные митохондрии сердца или печени) может снизить риск экспериментального загрязнения и рекомендуется в дополнение к процедурам разбавления и промывки на спиртовой основе. При проведении последовательных исследований очистка этанолом и митохондриями сводит к минимуму возможность заражения ингибиторами. Калибровка датчика кислорода рекомендуется перед каждым экспериментом для получения точных измерений дыхания относительно преобладающего парциального давления кислорода. Если несколько калибровок невозможны, одной калибровки в день может быть достаточно, если концентрация кислорода остается стабильной и постоянной после процедуры стирки.
Процедуры, описанные выше, используют инструмент Oroboros O2k для измерения потребления кислорода в опухолевой ткани в течение 4 часов после иссечения опухоли с использованием ранее разработанного и оптимизированного консервационного раствора и дыхательных сред25,26,27. Несколько параметров в этом протоколе могут быть изменены для последующих применений. Настройка и калибровка прибора, гомогенизаторы, используемые для подготовки тканей, а также оптимальная концентрация гомогената и кислорода в камере могут быть адаптированы для использования на других приборах с потенциалом мониторинга кислорода. Например, камеры были слегка переполнены при добавлении гомогената, и, таким образом, когда камера полностью закрыта, капилляр камеры остается заполненным. Это будет потреблять некоторое количество кислорода в камере, но с оптимизацией концентрации образца мы можем учесть это потребление при определении того, с какого уровня кислорода начать. В качестве альтернативы, образцу можно позволить уравновеситься при окружающем кислороде до закрытия камеры, но это часто увеличивает количество времени до начала эксперимента и задерживает добавление подложек. В то время как гомогенизаторы, используемые в этом протоколе, широко доступны, могут быть использованы другие коммерческие методы гомогенизации, такие как измельчитель тканей или автоматизированный гомогенизатор28.
Кроме того, тканевая подготовка и инструментальные процедуры могут быть использованы с рядом различных SUIT для изучения респираторного контроля с помощью различных состояний связи и контроля путей29. Эти протоколы SUIT были разработаны для измерения функциональной емкости, и, таким образом, вклад потенциальных эндогенных субстратов не влияет на измерение емкости. Мы аналитически учитываем немитохондриальное потребление кислорода и/или остаточное потребление гомогената путем вычитания антимицина А-ротенона или нечувствительных к азиду натрия скоростей, в зависимости от обстоятельств. Митохондрии могут оставаться жизнеспособными в BIOPS или аналогично построенных растворах для сохранения в течение длительных периодов времени (>24 ч) в зависимости от типа ткани и интактности30,31. Исследования могут быть проведены заранее для определения временных пределов хранения, поскольку OXPHOS определенных субстратов может иметь различные ограничения. Это важно, если эксперимент не может быть выполнен в течение нескольких часов после иссечения ткани / биопсии. 37°C является оптимальной и физиологической температурой для оценки дыхательной функции в большинстве систем млекопитающих. Однако, если температура анализа, по-видимому, мешает оценке32,сравнительные исследования могут быть проведены в широком температурном диапазоне (25-40 °C) для обеспечения адекватной реакции. Инструментальные ограничения могут ограничивать способность проводить такие исследования.
Основными ограничениями вышеописанного способа являются: 1) возможность повреждения митохондрий в результате механической гомогенизации, 2) наличие АТФаз или других субклеточных биохимических веществ в гомогенатных препаратах, которые могут мешать одновременному определению АТФ или других интересующих переменных и могут потребовать дополнительных методов коррекции или использования ингибитора33 и 3) оценка многих образцов и/или нескольких SUIT на выборку занимает много времени, поскольку один инструмент может вместить два эксперимента одновременно и требует очистки и установки между последовательными экспериментами. Эксперименты по оптимизации и последовательная подготовка образцов могут свести к минимуму существенное повреждение митохондрий, которое будет способствовать противоречивым данным.
Значение метода по отношению к существующим/альтернативным методам заключается в улучшении осуществимости по сравнению с количеством исходного материала, проблемой выделения митохондрий или технической проблемой в пермеабилизирующей ткани. Приготовление гомогенатов происходит быстрее, кислород не так ограничен и менее подвержен изменчивости между персоналом по сравнению с пермеабилизированной тканью. Важно отметить, что почти все типы образцов подходят для гомогенатной подготовки, что позволяет проводить сравнительный анализ по тканям. Респирометрия высокого разрешения является золотым стандартом измерения митохондриальных OXPHOS и ET. Применение этого метода в доклинических и клинических исследованиях рака позволяет расширить текущие исследования in vitro до исследований ex vivo. Кроме того, он предлагает потенциальное применение в клинических и диагностических условиях.
Раскрытие информации
У авторов нет конфликта интересов, связанного с данной работой.
Благодарности
Мы благодарим сотрудников Pennington Biomedical Research Center Comparative Biology Core за уход за животными. Это исследование было частично поддержано грантами Национального института здравоохранения U54GM104940 (JPK) и KL2TR003097 (LAG). Все эксперименты и процедуры с участием животных были одобрены Комитетом по уходу и использованию животных Пеннингтонского биомедицинского исследовательского центра.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-(N-Morpholino)ethanesulfonic acid hydrate | Sigma-Aldrich | M8250 | |
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Adenosine 5'-triphosphate disodium salt hydrate | Sigma-Aldrich | A2383 | |
| Amphotericin B | Gibco | 15290018 | |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Ascorbate | Sigma-Aldrich | A4544 | |
| Bovine serum albumin, fraction V, heat shock, fatty acid free | Sigma-Aldrich | 3117057001 | Roche |
| BD 50 mL Luer-Lok Syringe | Fisher Scientific | 13-689-8 | |
| BD Vacutainer General Use Syringe Needles | Fisher Scientific | 23-021-020 | |
| Calcium carbonate | Sigma-Aldrich | C4830 | |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920 | |
| Cytochrome c from equine heart | Sigma-Aldrich | C2506 | |
| Datlab 7.4 software | Oroboros Instruments | ||
| Dimethylsulfoxide | Amresco | N182 | |
| Dithiothreitol | Sigma-Aldrich | D0632 | |
| D-Sucrose | Sigma-Aldrich | S7903 | |
| Dumont # 5 Forceps | Fine Science Tools | 11251-30 | Dumoxel, autoclavable |
| Dumont # 7 Forceps | Fine Science Tools | 11271-30 | Dumoxel, autoclavable |
| Digital Calipers 150 mm/6 in | World Precision Instruments | 501601 | |
| EO771 cells | CH3 BioSystems | SKU: 94APV1-vial-prem | Pathogen Tested |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | Sigma-Aldrich | E4378 | |
| Female C57BL/6J mice | Jackson Laboratory | Stock #000664 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Imidazole | Sigma-Aldrich | 56750 | |
| Kimwipes | Fisher Scientific | 34120 | |
| L-(−)-Malic acid | Sigma-Aldrich | G1626 | |
| Lactobionic acid | Sigma-Aldrich | L2398 | |
| Malate | Sigma-Aldrich | M6413 | |
| Matrigel Matrix | Corning | 354248 | |
| MgCl·6H2O | Sigma-Aldrich | M2670 | |
| Microsyringes | Hamilton | 87919, 80383, 80521, 80665, 80765, 80865, 87943 | |
| N,N,N′,N′-Tetramethyl-p-phenylenediamine | Sigma-Aldrich | T7394 | |
| Oxygraph-2k | Oroboros Instruments | 10023-03 | |
| Oxygraph-2k FluoRespirometer | Oroboros Instruments | 10003-01 | |
| PBS | Gibco | 10010023 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Phosphocreatine disodium salt hydrate | Sigma-Aldrich | P7936 | |
| Potassium hydroxide | Sigma-Aldrich | P1767 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| RPMI 1640 | Gibco | 21875034 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Sodium pyruvate | Sigma-Aldrich | P5280 | |
| Succinate (disodium) | Sigma-Aldrich | W327700 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Whatman Filter Paper, grade 5 | Sigma-Aldrich | 1005-090 | |
| Wheaton Tenbroeck Tissue Grinder, 7 mL | Duran Wheaton Kimble | 357424 | |
| Straight Tip Micro Dissecting Scissors | Roboz | RS-5914SC | |
| Non-Safety Scalpel No. 11 | McKesson | 1029065 | |
| BD Precision Glide Needle 27 G x 1/2 | Becton, Dickinson and Company | 305109 | |
| BD Precision Glide Needle 18 G x 1 | Becton, Dickinson and Company | 305195 | |
| BD 1mL Slip Tip Syringe | Becton, Dickinson and Company | 309659 | |
| Pyrex Reusable Petri Dish, 60 mm | Thermo Fisher Scientific | 316060 | |
| Rodent Very High Fat Diet, 60% kcal from fat, 20% kcal from protein, and 20% kcal from carbohydrate | Research Diet | D12492 | |
| Pyrex Watch Glass, 100 mm | Thermo Fisher Scientific | S34819 |
Ссылки
- DeBerardinis, R. J., Chandel, N. S. Fundamentals of cancer metabolism. Science Advances. 2 (5), 1600200(2016).
- Bajzikova, M., et al. Reactivation of dihydroorotate dehydrogenase-driven pyrimidine biosynthesis restores tumor growth of respiration-deficient cancer cells. Cell Metabolism. 29 (2), 399-416 (2019).
- Martínez-Reyes, I., et al. Mitochondrial ubiquinol oxidation is necessary for tumour growth. Nature. 585 (7824), 288-292 (2020).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6 (3), 18317(2011).
- Saks, V. A., et al. Bioenergetics of the Cell: Quantitative Aspects. Saks, V. A., et al. , Springer US. 81-100 (1998).
- Kaambre, T., et al. Metabolic control analysis of cellular respiration in situ in intraoperational samples of human breast cancer. Journal of Bioenergetics and Biomembranes. 44 (5), 539-558 (2012).
- Koit, A., et al. Mitochondrial respiration in human colorectal and breast cancer clinical material is regulated differently. Oxidative Medicine and Cellular Longevity. 2017, 1372640(2017).
- Holland, O. J., et al. Changes in mitochondrial respiration in the human placenta over gestation. Placenta. 57, 102-112 (2017).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Kondrashova, M. N., et al. Preservation of native properties of mitochondria in rat liver homogenate. Mitochondrion. 1 (3), 249-267 (2001).
- Pecinová, A., Drahota, Z., Nůsková, H., Pecina, P., Houštěk, J. Evaluation of basic mitochondrial functions using rat tissue homogenates. Mitochondrion. 11 (5), 722-728 (2011).
- Wu, M., et al. Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. American Journal of Physiology-Cell Physiology. 292 (1), 125-136 (2007).
- Hlozková, K., Starková, J. Assessment of the metabolic profile of primary leukemia cells. Journal of Visualized Experiments: JoVE. (141), e58426(2018).
- Zhang, J., Zhang, Q. Cancer Metabolism: Methods and Protocols. Haznadar, M. , Springer. New York. 353-363 (2019).
- Wigner, P., Zielinski, K., Labieniec-Watala, M., Marczak, A., Szwed, M. Doxorubicin-transferrin conjugate alters mitochondrial homeostasis and energy metabolism in human breast cancer cells. Scientific Reports. 11 (1), 4544(2021).
- Schöpf, B., et al. Oxidative phosphorylation and mitochondrial function differ between human prostate tissue and cultured cells. The FEBS Journal. 283 (11), 2181-2196 (2016).
- Ye, F., Hoppel, C. L. Measuring oxidative phosphorylation in human skin fibroblasts. Analytical Biochemistry. 437 (1), 52-58 (2013).
- Le Naour, A., et al. EO771, the first luminal B mammary cancer cell line from C57BL/6 mice. Cancer Cell International. 20, 328(2020).
- Gnaiger, E., et al. Mitochondrial physiology. Bioenergetics Communications. 1, 44(2020).
- Hughey, C. C., Hittel, D. S., Johnsen, V. L., Shearer, J. Respirometric oxidative phosphorylation assessment in saponin-permeabilized cardiac fibers. Journal of Visualized Experiments: JoVE. (48), e2431(2011).
- Dranka, B. P., et al. Assessing bioenergetic function in response to oxidative stress by metabolic profiling. Free Radical Biology and Medicine. 51 (9), 1621-1635 (2011).
- Munday, R. Generation of superoxide radical, hydrogen peroxide and hydroxyl radical during the autoxidation of N,N,N',N'-tetramethyl-p-phenylenediamine. Chemico-Biological Interactions. 65 (2), 133-143 (1988).
- Moser, M. D., Matsuzaki, S., Humphries, K. M. Inhibition of succinate-linked respiration and complex II activity by hydrogen peroxide. Archives of Biochemistry and Biophysics. 488 (1), 69-75 (2009).
- Veksler, V. I., Kuznetsov, A. V., Sharov, V. G., Kapelko, V. I., Saks, V. A. Mitochondrial respiratory parameters in cardiac tissue: a novel method of assessment by using saponin-skinned fibers. Biochimica et Biophysica Acta. 892 (2), 191-196 (1987).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. Heldmaier, G., Klingenspor, M. , Springer. Berlin, Heidelberg. 431-442 (2000).
- Doerrier, C., et al. High-resolution fluorespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Rohlenova, K., et al. Selective disruption of respiratory supercomplexes as a new strategy to suppress Her2(high) breast cancer. Antioxidants & Redox Signaling. 26 (2), 84-103 (2017).
- Gnaiger, E. Mitochondrial pathways and respiratory control. Bioenergetics Communications. 5th ed. , (2020).
- Barksdale, K. A., et al. Mitochondrial viability in mouse and human postmortem brain. FASEB Journal. 24 (9), 3590-3599 (2010).
- Underwood, E., Redell, J. B., Zhao, J., Moore, A. N., Dash, P. K. A method for assessing tissue respiration in anatomically defined brain regions. Scientific Reportys. 10 (1), 13179(2020).
- Jorgensen, L. B., Overgaard, J., Hunter-Manseau, F., Pichaud, N. Dramatic changes in mitochondrial substrate use at critically high temperatures: a comparative study using Drosophila. Journal of Experimental Biology. 224, Pt 6 (2021).
- Salin, K., et al. Simultaneous measurement of mitochondrial respiration and ATP production in tissue homogenates and calculation of effective P/O ratios. Physiological Reports. 4 (20), 13007(2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены