Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высокопроизводительный, надежный и гибкий по времени метод поверхностной стерилизации семян арабидопсиса
В этой статье
Резюме
Предусмотрен высокопроизводительный протокол поверхностной стерилизации семян Arabidopsisthaliana (Arabidopsis), оптимизирующий этапы обработки жидкости с помощью простого всасывающего устройства, построенного с вакуумным насосом. Сотни образцов семян могут быть стерилизованы поверхностно за один день.
Аннотация
Arabidopsis на сегодняшний день является модельным видом растений, наиболее широко используемым для функциональных исследований. Поверхностная стерилизация семян арабидопсиса является фундаментальным шагом, необходимым для достижения этой цели. Таким образом, крайне важно установить высокопроизводительные методы поверхностной стерилизации семян Arabidopsis для обработки от десятков до сотен образцов (например, трансгенных линий, экотипов или мутантов) одновременно. В данном исследовании представлен метод стерилизации поверхности семян, основанный на эффективном устранении жидкости в трубах с помощью самодельного всасывающего устройства, построенного из общего вакуумного насоса. За счет резкого сокращения трудоемкого практического времени с помощью этого метода обработка нескольких сотен образцов за один день возможна с небольшими усилиями. Последовательные анализы времени также показали весьма гибкий диапазон времени поверхностной стерилизации за счет поддержания высоких показателей всхожести. Этот метод может быть легко адаптирован для поверхностной стерилизации других видов мелких семян с простой настройкой всасывающего устройства в соответствии с размером семян и скоростью, желаемой для устранения жидкости.
Введение
Arabidopsis — вид диплоидных растений, относящийся к семейству Brassicaceae. Его относительно короткий жизненный цикл (два месяца на поколение в условиях долгого дня выращивания), небольшой размер растения и самоопыление с производством сотен семян на растение сделали его первым фундаментальным модельным видом растений1,2. Кроме того, его геном был полностью секвенирован3,обширные инструменты обратной генетики (насыщенные Т-ДНК, транспозоны и химически мутагенизированные популяции) доступны4,5,6, и эффективная Agrobacterium-опосредованная трансформация хорошо установлена для получения достаточных трансгенных линий для дальнейшей последующей работы7 . Таким образом, за последние два десятилетия были достигнуты большие успехи, используя Arabidopsis в качестве модельного вида для препарирования различных аспектов биологии растений на молекулярном уровне, включая естественные, генетические и фенотипические вариации8,9.
Чтобы функционально охарактеризовать гены, представляющие интерес для Arabidopsis, стерилизация поверхности семян для устранения грибковых и бактериальных загрязнителей является предварительным этапом для многих последующих протоколов, требующих аксеновых культур. Генетическая трансформация для сверхэкспрессии10,нокдауна (РНК-I11)или нокаута (редактирование генома12,13)функции гена, субклеточной локализации14,промоторной активности15,16,белка-белка17 и белково-ДНК-взаимодействия18,чтобы привести только наиболее распространенные применения, все это требует стадии стерилизации поверхности семян. Таким образом, несмотря на свою относительную простоту, стерилизация поверхности семян играет фундаментальную роль во многих функциональных анализах.
До настоящего времени были разработаны две основные категории методов поверхностной стерилизации семян, основанные либо на газофазной, либо на жидкофазной стерилизации19. В то время как пропускная способность газофазной поверхностной стерилизации семян является средней или высокой, использование опасного реагента газообразного хлора в качестве поверхностного стерилизующего агента препятствует его широкому применению. Методы, основанные на жидкофазной стерилизации, напротив, полагаются на более мягкие химические вещества, такие как этанол и отбеливающие растворы для поверхностной стерилизации, и они более широко используются, несмотря на то, что они имеют по своей сути более низкую пропускную способность, чем фумигация хлором. В общем, обычно используются два разных метода, в которых используются жидкие реагенты. Один из широко используемых методов основан на промывке этанолом и отбеливателем в разных концентрациях на разную продолжительностьвремени 20,21. Другой метод основан на нанесении отбеливателятолько 21,22. Оба метода в основном применяются для мелкомасштабной поверхностной стерилизации семян. Однако во многих экспериментах необходимо экранировать многие трансгенные линии Arabidopsis, полученные из одного преобразования15,23 или экранировать параллельно множество трансгенных линий, генерируемых из разных преобразований24,25. Насколько нам известно, не было опубликовано ни одного жидкого метода высокопроизводительной поверхностной стерилизации семян, который представляет собой, хотя и малопризнанный, важное узкое место для подходов функциональной геномики. Поэтому разработка безопасных, надежных и высокопроизводительных методов стерилизации поверхности семян является необходимым и критическим шагом на пути к успеху функциональной характеристики многих генов одновременно.
С этой целью в настоящем исследовании представлен усовершенствованный метод поверхностной стерилизации семян арабидопсиса. Этот метод является безопасным, недорогим, высокопрочным и высокопроизводительным, что позволяет обрабатывать 96 независимых линий в течение одного часа от начала стерилизации поверхности семян до конца посева семян в чашках Петри. Продемонстрированный метод опирается на широко доступные, базовые лабораторные приборы, такие как вакуумный насос, расходная стеклянная посуда и пластиковая посуда. Этот улучшенный метод предоставляет научному сообществу безопасный, простой и доступный подход к оптимизации стерилизации поверхности семян с пропускной способностью, адекватной современным подходам функциональной геномики у арабидопсиса и других немодельных видов растений.
протокол
1. Реагенты и подготовка сред
- Приготовьте 70% раствор этанола: Добавьте 737 мл 95% технического этанола в 263 мл дистиллированной воды. Тщательно перемешать.
ПРИМЕЧАНИЕ: Приготовьте 70% раствор этанола на нестерильном рабочем столе.
ВНИМАНИЕ: Этанол легко воспламеняется и может вызвать серьезное раздражение глаз. Хранить вдали от пламени и источников тепла. При попадании в глаза промыть обильной водой. - Приготовьте 5% раствор отбеливателя: Добавьте 5 мл бытового отбеливателя (содержащего ~3,5% гипохлорита натрия, NaClO) в 95 мл стерильной дистиллированной воды. Добавьте несколько капель неионного моющего средства (например, Tween 20) и тщательно перемешайте.
ПРИМЕЧАНИЕ: Приготовьте 5% раствор отбеливателя внутри ламинарной вытяжки.
ВНИМАНИЕ: Гипохлорит натрия, активный компонент отбеливателя, сильно раздражает. Он очень коррозионный и может нанести серьезный ущерб желудочно-кишечному тракту. В случае контакта немедленно промойте обильной водой. В случае проглатывания позвоните в токсикологический центр или к врачу для консультации по лечению. - Готовят полусилу Мурасиге и Скуг (1/2 МС) средние26.
- Добавьте 2,2 г порошка ms medium (включая витамины) и 10 г сахарозы в 800 мл дистиллированной воды. Отрегулируйте рН раствора с помощью 1 М КОН и доведите объем до 1 л с помощью дистиллированной воды. Aliquot 500 мл в бутылку 1 л и добавьте 4 г агара для приготовления твердой среды. Автоклав решения.
- После автоклавирования охладите среду до 50-53 °C на водяной бане и вылейте ее в чашку Петри под ламинарной вытяжкой. Для приготовления селективной среды добавляют 1000 мкл/л 50 мг/мл раствора канамицина (смешивают 500 мг моногидрата канамицина сульфата в 10 мл дистиллированной воды, фильтруют стерилизуют и хранят при -20°С) к среде (50-53 °С). Хорошо перемешайте, закручиваясь, и вылейте в чашку Петри, как упоминалось ранее.
2. Настройка аспиратора
ПРИМЕЧАНИЕ: Настройка приборов обобщена на рисунке 1.
- Подключите входное отверстие вакуумного насоса к одному концу полиэтиленовой (ПЭ) трубки подходящего размера. Подключите другой конец трубки к выходному отверстию двусторонней крышки декантационного флакона. Плотно оберните соединение трубки уплотнительной пленкой(Таблица материалов)для обеспечения герметичного соединения.
- Подключите вторую полиэтиленовую трубку к входному отверстию (отверстие, выступающее внутрь бутылки) завинчивающейся крышки на бутылке для декантации. Поднесите другую сторону трубки к выходу аквариумного клапана. При необходимости оберните уплотнительной пленкой вдоль стыка, чтобы исключить утечку воздуха.
- Непосредственно перед использованием подойдите стерильным наконечником пипетки объемом 200 мкл к входному отверстию аквариумного фильтра под ламинарной вытяжкой.
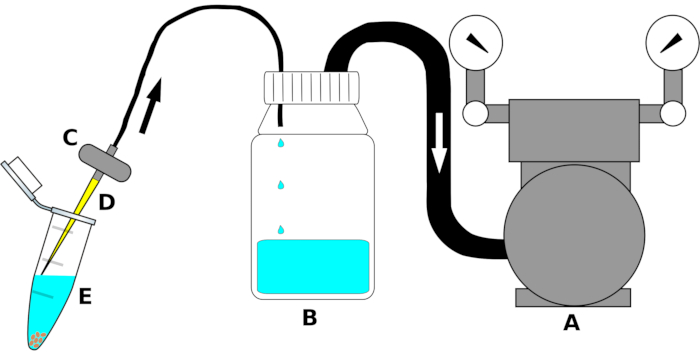
Рисунок 1:Схематический чертеж всасывающего устройства для высокопроизводительного удаления стерилизационных жидкостей. Для ясности отдельные части не рисуются в масштабе. Буква(A)обозначает вакуумный насос,(B)резервуарную бутылку для сбора жидкостей (этанола, отбеливателя или стерильной воды),(C)клапан для предотвращения рефлюкса жидкостей,(D)стерильный наконечник пипетки объемом 200 мкл и(E)микроцентрифужную трубку объемом 1,5 мл, содержащую семена и стерилизационную жидкость. Стрелки указывают направление воздушного потока. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Высокопроизводительная жидкостная поверхностная стерилизация семян
ПРИМЕЧАНИЕ: Общая процедура и минимальное время, необходимое для поверхностной стерилизации семян Arabidopsis thaliana (L.) Heynh wild-type (Col-0) (Arabidopsis) с 96 независимыми образцами, обобщены на рисунке 2.
- Этикетка перманентным маркером двух партий микроцентрифужных трубок 48 х 1,5 мл с прогрессивными номерами.
- Добавьте 100-200 семян арабидопсиса в каждую из 96 стерильных микроцентрифужных трубок объемом 1,5 мл (примерно на 1-2 мм выше нижней части конического конца трубки).
- Aliquot около 1000 мкл 70% этанола в каждую трубку, используя 10 мл стерильной серологической пипетки внутри ламинарной вытяжки (первая партия семян, 48 пробирок) и осторожно закройте крышки.
ПРИМЕЧАНИЕ: Дозирование растворов не должно быть чрезвычайно точным, если дозируемый объем в несколько раз превышает объем семян. Кроме того, выполните этот шаг за пределами ламинарной вытяжки (нестерильное состояние). - Встряхните трубки с частотой колебаний 8,0 Гц в течение не менее 3 мин в шейкере.
- Извлеките адаптеры из шейкера и переложите их в корзину настольной микроцентрифуги.
- Быстро раскрутите семена, используя импульсную функцию (присутствующую в большинстве настольных центрифуг), чтобы достичь 1880 х г (~ 15 с).
ПРИМЕЧАНИЕ: Более длительное время или более высокие силы центрифугирования негативно влияют на прорастание семян. - Переложите 48 трубок с адаптеров в одну стойку и откройте все трубки под ламинарной вытяжкой. Избегайте загрязнений, не касаясь части крышек, врезающихся в трубки. Если крышки находятся слишком близко друг к другу, разделите трубки на две стойки для облегчения обработки.
- Установите стерильный желтый наконечник объемом 200 мкл на входное отверстие аквариумного клапана самодельного аспиратора под ламинарной вытяжкой и включите насос.
- Вставьте желтый кончик чуть выше уровня семян, чтобы не касаться семян при всасывании жидкости. Кроме того, быстро расположите наконечник в нижней части трубки; если семя блокирует всасывание жидкости, удалите желтый наконечник и вставьте новый.
- Aliquot в каждой трубке около 1000 мкл 5% отбеливателя с использованием 10 мл стерильной серологической пипетки внутри ламинарного проточного капюшона.
- Плотно закройте все крышки и поместите все трубки обратно в адаптеры шейкера. Встряхните трубки при частоте колебаний 8,0 Гц в течение не менее 3 мин в шейкере.
- Быстро раскручивайте семена, используя импульсную функцию настольной центрифуги в течение времени, необходимого для достижения 1880 х г (~ 15 с).
- Установите новый стерильный желтый наконечник объемом 200 мкл на клапан аквариума, подключенный к вакуумному насосу под ламинарной вытяжкой, и включите насос.
- Вставьте желтый кончик выше уровня семян, чтобы избежать прикосновения к семенам при высасывании раствора отбеливателя.
- Aliquot в каждую трубку около 1000 мкл стерилизованногоH2Oс использованием 10 мл стерильной серологической пипетки в ламинарной вытяжке.
ПРИМЕЧАНИЕ: Объедините две партии семян, чтобы свести к минимуму время работы. - Установите новый стерильный желтый наконечник объемом 200 мкл на клапан аквариума, подключенный к вакуумному насосу под ламинарной вытяжкой, и включите насос.
- Вставьте желтый кончик чуть выше уровня семян, чтобы избежать прикосновения к семенам при сосании H2O.
- Aliquot в каждую трубку около 500 мкл стерилизованногоH2Oс помощью 10 мл стерильной серологической пипетки и закройте все крышки в ламинарной вытяжке. Семена готовы к посеву. При необходимости держите трубки при комнатной температуре в течение нескольких часов максимум или при 4 °C в течение ночи.
- Наполните резервуар бутылки, используемой для сбора жидкости, достаточным количеством воды и автоклавируйте ее. После этого выбросьте жидкость в обычную раковину.
ПРИМЕЧАНИЕ: Автоклав жидкости, чтобы убить все семена внутри резервуара.
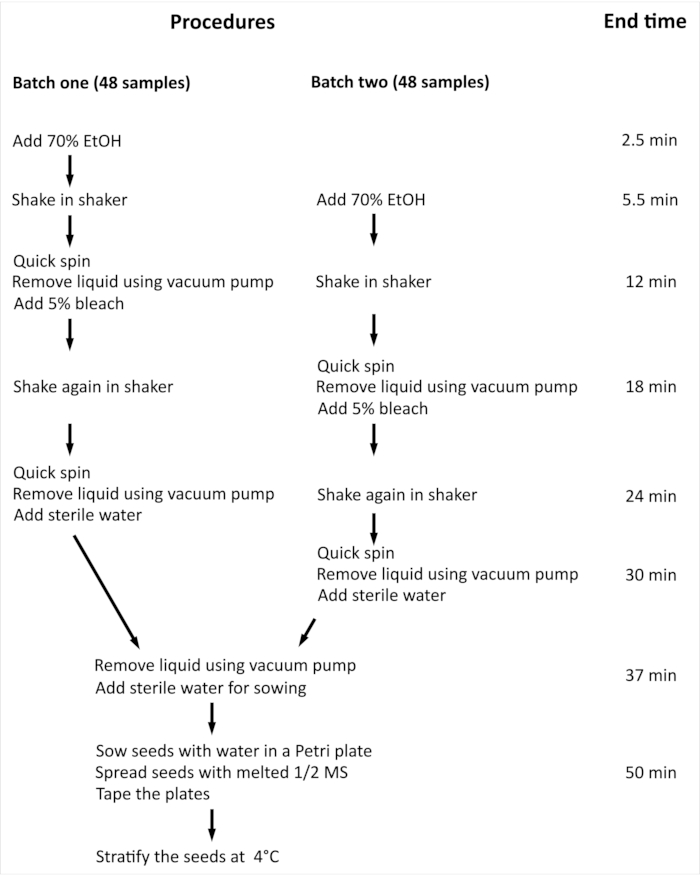
Рисунок 2:Обзор процедуры и минимальное время, необходимое для поверхностной стерилизации семян арабидопсиса с 96 независимыми образцами. В представленном эксперименте 96 независимых образцов обрабатываются двумя партиями одинакового размера. Вся процедура одинакова для обеих партий, и они обрабатываются параллельно, но вторая партия обрабатывается с задержкой в один шаг по сравнению с первой партией. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Нанесение покрытия и оценка Arabidopsis на 1/2 MS пластинах
- Переложите семена и 300-400 мкл стерильногоH2Oв чашку Петри путем бережной пипетки пипеткой 1000 мкл.
- После переноса 10 пробирок влейте в каждую пластину около 1,5-2,0 мл расплавленной 1/2 МС среды без антибиотиков.
ПРИМЕЧАНИЕ: Расплавите заранее, а затем храните расплавленную среду 1/2 МС в термостатической ванне, установленной при 50-53 °C, чтобы избежать затвердевания. Убедитесь, что температура не превышает 58 °C, чтобы избежать снижения всхожести семян. - Быстро закрутите тарелку, чтобы распределить семена внутри нее. Заклейте пластины на противоположные стороны.
- Заверните пластины в пластиковую или алюминиевую фольгу, а затем поместите их в холодильник (4 °C) на 3 дня в темноте для получения равномерного прорастания.
- Переложите пластины в камеру роста, установленную при 23 °C в условиях длительного дня (16 ч света/8 ч темноты) с интенсивностью света 100-120 мкмоль·м-2·с-1 и 60% относительной влажностью.
- Через два дня оценивают растения по наличию радиков. Обнаружение появления радика и образования зеленого семядоли (полное открытие двух семядолий) для оценки всхожести семян.
5. Статистический анализ
ПРИМЕЧАНИЕ: Здесь парный тест Туки использовался для статистического анализа.
- Рассматривать значения P ниже 0,01 как статистически значимые. Проведите все эксперименты по крайней мере с пятью биологическими репликами.
Результаты
Для оценки времени, необходимого для всей процедуры стерилизации семян, были рассчитаны и сопоставлены с традиционными методами пипетирования разницы во времени обработки жидкости 96 проб в текущем протоколе. Результат показывает, что текущий протокол экономит время, сокращая время о?...
Обсуждение
Стерилизация семян является фундаментальным шагом для функциональных исследований при арабидопсисе. Хотя он часто проводится для многих различных целей, доступны ограниченные исследования по высокопроизводительной стерилизации поверхности семян при арабидопсисе.
Д?...
Раскрытие информации
Все авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование финансировалось автономной провинцией Тренто через основное финансирование группы по экономике Fondazione E. Mach.
Материалы
| Name | Company | Catalog Number | Comments |
| Aquarium valve | Amazon | B074CYC5SD | Kit including 2 valves and thin-walled tubings. The valve prevents the liquids to go back to the sterile tip |
| Arabidopsis Col-0 wild-type seeds | Nottingham Arabidopsis Stock Center | N1093 | Wild type seeds (sensitive to kanamycin) |
| Arabidopsis transgenic line AdoIspS-79 seeds | NA | NA | Transgenic line overexpressing an isoprene synthase gene from Arundo donax transformed in the Col-0 background, resistant to kanamycin (Li et al. (2017) Mol. Biol. Evol., 34, 2583–2599). Available on request from the authors |
| Microcentrifuge | Eppendorf | EP022628188 | Benchtop microcentrifuge used for spinning down the seeds |
| Murashige & Skoog medium including vitamins | Duchefa | M0222 | Standard medium for plant sterile culture |
| Pipette controller | Brand | 26300 | Used to operate the serological pipette |
| Polyethylene tube 1 | Roth | 9591.1 | Tube for connection from vacuum pump to decantation bottle (inner diameter: 7 mm; outer diameter: 9 mm) |
| Polyethylene tube 2 | Roth | 9587.1 | Tube for connection from decantation bottle to the aquarium valve (inner diameter: 5 mm; outer diameter: 7 mm) |
| Screw cap with connectors | Roth | PY86.1 | 2-way dispenser screw cap GL45 in polypropylene for decanting bottle |
| Serological pipette | Brand | 27823 | Graduated glass (reusable) serological pipette. Disposable pipettes can be used instead |
| Shakeret al. | Qiagen | 85300 | TissueLyser II bead mill used normally for tissue homogenization. Without the addition of beads to the tubes it works as shaker. |
| Technical ethanol | ITW Reagents (Nova Chimica Srl) | 212800 | Ethanol 96% v/v partially denatured technical grade |
| Tween 20 | Merck Millipore | 655205 | Non-ionic detergent acting as surfactant |
| Universal tubing connectors | Roth | Y523.1 | Can be used to improve/simplify tubing connections |
| Vacuum pump | Merck Millipore | WP6222050 | Used for making the suction device |
Ссылки
- Somerville, C., Koornneef, M. A fortunate choice: The history of Arabidopsis as a model plant. Nature Reviews Genetics. 3 (11), 883-889 (2002).
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. Plant Journal. 61 (6), 909-921 (2010).
- Initiative, T. A. G. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283-2290 (1999).
- Speulman, E., et al. A two-component enhancer-inhibitor transposon mutagenesis system for functional analysis of the arabidopsis genome. Plant Cell. 11 (10), 1853-1866 (1999).
- Jander, G., et al. Ethylmethanesulfonate saturation mutagenesis in Arabidopsis to determine frequency of herbicide resistance. Plant Physiology. 131 (1), 139-146 (2003).
- Zhang, X., Henriques, R., Lin, S. -. S., Niu, Q. -. W., Chua, N. -. H. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method. Nature Protocols. 1 (2), 641-646 (2006).
- Togninalli, M., et al. AraPheno and the AraGWAS catalog 2020: A major database update including RNA-Seq and knock-out mutation data for Arabidopsis thaliana. Nucleic Acids Research. 48 (1), 1063-1068 (2020).
- Lan, Y., et al. AtMAD: Arabidopsis thaliana multi-omics association database. Nucleic Acids Research. 49 (1), 1445-1451 (2021).
- Xu, J., Trainotti, L., Li, M., Varotto, C. Overexpression of isoprene synthase affects ABA-and drought-related gene expression and enhances tolerance to abiotic stress. International Journal of Molecular Sciences. 21 (12), 1-21 (2020).
- Czarnecki, O., et al. Simultaneous knock-down of six non-family genes using a single synthetic RNAi fragment in Arabidopsis thaliana. Plant Methods. 12 (1), 1-11 (2016).
- Yan, L., et al. high-efficiency genome editing in arabidopsis using YAO promoter-driven CRISPR/Cas9 system. Molecular Plant. 8 (12), 1820-1823 (2015).
- Liu, Y., Gao, Y., Gao, Y., Zhang, Q. Targeted deletion of floral development genes in Arabidopsis with CRISPR/Cas9 using the RNA endoribonuclease Csy4 processing system. Horticulture Research. 6 (1), (2019).
- Grefen, C., et al. Subcellular localization and in vivo interactions of the Arabidopsis thaliana ethylene receptor family members. Molecular Plant. 1 (2), 308-320 (2008).
- Gazzani, S., et al. Evolution of MIR168 paralogs in Brassicaceae. BMC Evolutionary Biology. 9 (1), (2009).
- Lee, S., Korban, S. S. Transcriptional regulation of Arabidopsis thaliana phytochelatin synthase (AtPCS1) by cadmium during early stages of plant development. Planta. 215 (4), 689-693 (2002).
- Long, Y., et al. In vivo FRET-FLIM reveals cell-type-specific protein interactions in Arabidopsis roots. Nature. 548 (7665), 97-102 (2017).
- Freire-Rios, A., et al. Architecture of DNA elements mediating ARF transcription factor binding and auxin-responsive gene expression in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24557-24566 (2020).
- Rivero, L., et al. Handling arabidopsis plants: Growth, preservation of seeds, transformation, and genetic crosses. Methods in Molecular Biology. 1062, 3-25 (2014).
- Chen, J. H., et al. Drought and salt stress tolerance of an arabidopsis glutathione S-transferase U17 knock-out mutant are attributed to the combined effect of glutathione and abscisic acid. Plant Physiology. 158 (1), 340-351 (2012).
- Li, D. Z., et al. Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants. Proceedings of the National Academy of Sciences of the United States of America. 108 (49), 19641-19646 (2011).
- Mathur, J., Koncz, C. Establishment and maintenance of cell suspension cultures. Arabidopsis Protocols. Methods in Molecular Biology. 82, 27-30 (1998).
- Li, M., Cappellin, L., Xu, J., Biasioli, F., Varotto, C. High-throughput screening for in planta characterization of VOC biosynthetic genes by PTR-ToF-MS. Journal of Plant Research. 133 (1), 123-131 (2020).
- Li, M., et al. In planta recapitulation of isoprene synthase evolution from ocimene synthases. Molecular Biology and Evolution. 34 (10), 2583-2599 (2017).
- Li, M., et al. Evolution of isoprene emission in Arecaceae (palms). Evolutionary Applications. 14, 902-914 (2020).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods in Molecular Biology. 343, 87-104 (2006).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Tkacz, A., Cheema, J., Chandra, G., Grant, A., Poole, P. S. Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition. ISME Journal. 9 (11), 2349-2359 (2015).
- Singh, N., Gaddam, S. R., Singh, D., Trivedi, P. K. Regulation of arsenic stress response by ethylene biosynthesis and signaling in Arabidopsis thaliana. Environmental and Experimental Botany. 185, 104408 (2021).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized method for high-throughput sterilization of Arabidopsis seeds. Journal of Visualized Experiments: JOVE. (128), e56587 (2017).
- Acemi, A., Özen, F. Optimization of in vitro asymbiotic seed germination protocol for Serapias vomeracea. The EuroBiotech Journal. 3 (3), 143-151 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены