Method Article
В пробирке Многопараметрический клеточный анализ с помощью микроорганических зарядо-модулированных полевых транзисторных матриц
В этой статье
Резюме
Здесь мы представляем протокол изготовления органического устройства на основе полевого транзистора с модуляцией заряда (OCMFET) для клеточного взаимодействия in vitro . Устройство, называемое микро-массивом OCMFET, представляет собой гибкое, недорогое и безреференсное устройство, которое позволит контролировать электрическую и метаболическую активность электроактивных клеточных культур.
Аннотация
Современная электрофизиология постоянно подпитывается параллельным развитием все более сложных инструментов и материалов. В свою очередь, открытия в этой области привели к технологическому прогрессу в процессе взад-вперед, который в конечном итоге определил впечатляющие достижения последних 50 лет. Тем не менее, наиболее используемые устройства, используемые для сотового сопряжения (а именно, микроэлектродные массивы и микроэлектронные устройства на основе транзисторов), по-прежнему имеют несколько ограничений, таких как высокая стоимость, жесткость материалов и наличие внешнего опорного электрода. Чтобы частично преодолеть эти проблемы, были разработаны разработки в новой научной области, называемой органической биоэлектроникой, что привело к таким преимуществам, как более низкая стоимость, более удобные материалы и инновационные методы изготовления.
За последнее десятилетие было предложено несколько интересных новых органических устройств для удобного взаимодействия с клеточными культурами. В данной работе представлен протокол изготовления устройств для клеточного сопряжения на основе органического транзистора с модулированным зарядом полевым эффектом (OCMFET). Эти устройства, называемые микро-массивами OCMFET (MOA), сочетают в себе преимущества органической электроники и специфические особенности OCMFET для подготовки прозрачных, гибких и безреференсных инструментов, с помощью которых можно контролировать как электрическую, так и метаболическую активность кардиомиоцитов и нейронов in vitro, что позволяет проводить многопараметрическую оценку электрогенных моделей клеток.
Введение
Мониторинг in vivo электроактивных клеток, таких как нейроны и кардиомиоциты, представляет собой действительный и мощный подход в фундаментальных исследованиях человеческого мозга, исследованиях функциональной связности, фармакологии и токсикологии. Инструменты, обычно используемые для таких исследований, в основном основаны на микроэлектродных массивах (MEAs)1,2,3,4,5 и все более эффективных и мощных полевых устройствах (FEDs)6,7,8,9,10,11,12 . Эти два семейства устройств позволяют в режиме реального времени контролировать и стимулировать электрическую активность нейронов и кардиомиоцитов и обычно характеризуются прочностью, простотой использования и надежностью. Эти особенности делают MEA и FED золотым стандартом для электрофизиологических приложений, которые в настоящее время используются для взаимодействия со стандартными клеточными культурами, органотипическими срезами мозга и трехмерными органоидами13,14,15,16. Несмотря на их широкое использование и впечатляющие характеристики, MEA и FED имеют некоторые ограничения, такие как высокая стоимость, жесткость материалов и наличие обычно громоздкого эталонного электрода, который должен быть помещен в измерительную жидкую среду и необходим для правильной работы устройств.
Чтобы изучить альтернативные решения для клеточного сопряжения, в последнее десятилетие было вложено много усилий в изучение электронных устройств на основе органических материалов и инновационных методов изготовления17. Среди нескольких органических устройств, изученных для устранения вышеупомянутых ограничений, недавно был предложен своеобразный органический транзистор под названием OCMFET в качестве действительной альтернативы MEA и FEDs18. В дополнение к стандартным функциям, предлагаемым технологией органической электроники, таким как недорогие материалы и методы изготовления, оптимальные механические и химические свойства, оптическая прозрачность и биосовместимость, OCMFET также предлагает сверхвысокую чувствительность заряда (из-за его двойной закрытой структуры) без необходимости внешнего опорного электрода. Кроме того, этот органический датчик обладает замечательной способностью зондировать различные анализируемые / физические параметры в зависимости от конкретной функционализации его зондирующей области, которая отделена от области транзистора19,20. Все эти особенности могут быть удобно использованы для получения различных параметров в клеточной культуре. В частности, в дополнение к способности обнаруживать электрическую активность нейронов / сердца, также можно использовать сверхвысокую чувствительность рН, предлагаемую своеобразной двойной структурой OCMFET, используя простую физическую функционализацию21 для надежного мониторинга незначительных локальных изменений рН, вызванных клеточной метаболической активностью.
При биозондировании клеток in vitro мониторинг клеточной метаболической активности является мощным индикатором состояния культуры и может быть использован для оценки клеточного ответа на различные раздражители, такие как введение лекарств и электростимуляция22,23. Более того, в конкретном случае нейронных приложений мониторинг как электрической, так и метаболической активности представляет большой интерес, особенно в фармакологии и токсикологии24. С целью удобного удовлетворения требований современной электрофизиологии in vitro, в то же время предлагая все преимущества OCMFET, недавно было представлено устройство под названием Micro OCMFET Array (MOA). MOA представляет собой массив на основе OCMFET со специализированными зонами зондирования, специально разработанными для клеточного взаимодействия in vitro, что позволяет проводить многопараметрический анализ культур электрогенных клеток. В частности, два канала MOA имеют большие зоны зон зондирования для максимизации их чувствительности и могут быть избирательно функционализированы для мониторинга конкретных параметров, представляющих интерес, таких как изменения рН питательной среды. Другие OCMFETs в структуре действуют как внеклеточные датчики электрической активности. На рисунке 1 показана структура 16-канального MOA. Эта возможность в сочетании с отсутствием внешнего опорного электрода делает MOA очень интересным инструментом для применения in vitro. В этой работе представлен пошаговый протокол изготовления мультисенсирующего MOA для обнаружения in vitro электрической и метаболической активности нейронов и кардиомиоцитов. На рисунке 2 показаны основные этапы изготовления, используемые материалы и структура устройства.
протокол
Были соблюдены все применимые международные, национальные и/или институциональные руководящие принципы по уходу за животными и их использованию. Были предприняты все усилия, чтобы уменьшить количество животных для проекта и свести к минимуму их страдания.
1. Приготовление развивающего раствора, травильных растворов, органического полупроводникового раствора и фотолитографических масок
- Готовят разрабатываемый раствор путем разбавления гранул NaOH в деионизированной воде в концентрации 175 мМ.
ПРИМЕЧАНИЕ: Это экзотермическая реакция. Если используется пластиковый контейнер, продолжайте перемешивать контейнер до тех пор, пока все гранулы не будут полностью растворены. - Готовят раствор для травления титана путем разбавления фтористоводородной кислоты (HF) в деионизированной воде (1 часть концентрированной 48% HF, 49 частей деионизированной воды).
ВНИМАНИЕ: Фтористоводородная кислота может легко проникать в кожу, вызывая серьезные повреждения глубоких слоев тканей. Быстрая нейтрализация HF необходима для предотвращения разрушения тканей, которое может продолжаться в течение нескольких дней и привести к тяжелой травме или даже смерти. Риски, связанные с HF, зависят от концентрации и продолжительности контакта с кислотой. Используйте только под вытяжным кожухом с помощью лицевого щитка. Двойная перчатка также настоятельно рекомендуется. - Готовят раствор для травления золота, смешивая йод, йодид калия и деионизированную воду (на 250 г раствора используют 200 мл деионизированной воды, 20 г KI, 5 г I2). Размешайте раствор при комнатной температуре в течение 1 ч и оставьте его отдыхать на ночь перед употреблением.
- Готовят полупроводниковый раствор, растворяя 6,13-бис(триизопропилсилиллетинил) пентацен (TIPS Pentacene) в анизоле (1% по массе) и осторожно помешивая в течение 2 ч на конфорке при 80 °C.
ПРИМЕЧАНИЕ: Продолжайте агитировать это решение. Используйте флаконы из янтарного стекла и/или храните их в условиях низкой освещенности. - Подготовьте нужный набор фотолитографических масок с помощью программного обеспечения векторной графики. Подготовьте 5 масок на весь процесс: маску для узора плавающих ворот (FG); маска для вскрытия виа и зоны электрофизиологии; маска для процесса самовыравнивания; маска для выравнивания контакта источника, слива и регулирующего затвора; и маска для плазменной активации рН-каналов.
ПРИМЕЧАНИЕ: В зависимости от необходимого разрешения и конкретной фотолитографической установки могут использоваться различные виды масок. В случае предлагаемых устройств (которые имеют максимальное боковое разрешение 40 мкм) простые пластиковые гибкие маски были куплены в местном фотокопировальном магазине.
2. Подбор и подготовка субстрата
- Вырежьте квадрат 6 x 6 см2 из 250 мкм полиэтилентерефталата (ПЭТ) из нетронутого ПЭТ-листа.
ПРИМЕЧАНИЕ: Начните с немного большей подложки, чем конечное устройство, чтобы иметь достаточно широкие поля, чтобы можно было манипулировать стандартным лабораторным пинцетом, не повреждая его. - Осмотрите подложку оптическим микроскопом, чтобы исключить наличие глубоких канавок и царапин. Тщательно выбирайте менее поцарапанные подложки, так как большие несовершенства могут привести к выходу из строя конечного устройства.
- Промыть ПЭТ-субстраты ацетоном, изопропиловым спиртом и деионизированной водой (в таком порядке) и высушить их струями азота. Храните подложки в чистых пластиковых чашках/контейнерах Петри.
3. FG: осаждение титана
- Предварительно очистите подложки плазменным кислородом (30 с при 100 Вт) и поместите их на держатель подложки внутри вакуумной камеры теплового испарителя.
- Поместите 60 мг титана в тигель, закройте затвор и откачайте испарительную камеру до тех пор, пока она не достигнет уровня вакуума ниже 10-6 Торр. Увеличьте мощность испарителя, пока тигель не загорится красным цветом и подождите 30 с. Откройте затвор, увеличьте мощность до 60% (или пока тигель не засияет ярко-белым), и подождите 60 с. Закройте затвор и выключите питание.
- Снимите подложки с испарителя; очищать их с помощью ацетона, изопропилового спирта и деионизированной воды; и сушить их с помощью потоков азота. Выполните вторую обработку кислородной плазмой (60 с при 200 Вт), чтобы слегка окислить поверхность титана.
4. Моделирование FG
- Поместите по одной подложке за раз на отжимной коатер, помещенный внутрь вытяжного капюшона. Нанесите 4 мл фоторезиста на подложку с помощью одноразовой пластиковой пипетки. Используйте следующие параметры спинового покрытия для получения слоя фоторезиста толщиной 2 мкм: скорость отжима: 3000 об/мин; время вращения: 45 с; время разгона: 0,5 с; время замедления: 0,5 с.
- Мягко выпекайте фоторезист, поместив подложку на конфорку (70 °C в течение 5 мин). Храните подложку внутри пластикового контейнера Петри, обернутого алюминиевой фольгой, чтобы избежать прямого воздействия света.
ПРИМЕЧАНИЕ: Избегайте рекомендуемой температуры выпекания (100 °C в течение 50 с), чтобы предотвратить деформацию субстрата. Однако выпечка при более низкой температуре в течение более длительного времени обеспечивает хорошие результаты. - Поместите прибор в бромограф и поместите на подложку пластиковую фотолитографическую маску с нужным макетом ФГ. Подвергайте воздействию ультрафиолетового (УФ) света сверху в течение 1 мин и осторожно снимите маску, позаботившись о том, чтобы свести к минимуму боковые движения маски по подложке, чтобы избежать ее царапин.
- Погрузите подложку на 5 с в стеклянную емкость, заполненную развивающимся раствором (этап 1.1). Быстро промойте его в деионизированной воде и высушите под азотом. Используйте оптический микроскоп для поиска недоразвитых/переразвитых пятен в подложке. Повторите погружение подложки в разрабатываемый раствор в случае недоразвития.
- Травите открытый титан, погружая его в раствор для травления титана (этап 1.2) на 15 с, промывайте его деионизированной водой и сушите с помощью азота. Оптически осмотрите подложку и удалите фоторезист с помощью ацетона. Смойте субстрат изопропиловым спиртом и деионизированной водой, а также высушите азотом.
5. Затворное диэлектрическое осаждение
- Подготовьте камеру осаждения париленового коатера, распределив 2 мл промотора адгезии (силан - 3-(триметоксисилил)пропилметакрилат) на стенки камеры осаждения с помощью лабораторной салфетки. Поместите 300 мг димера Parylene C (соответствующего конечной толщине 150 нм) на париленовый коатер. Установите более низкое значение давления на 7 мбар, а более высокое значение давления на 10 мбар. После осаждения очистите субстраты ацетоном, изопропиловым спиртом и деионизированной водой и высушите их азотом.
6. Открытие зон измерения OCMFET для регистрации электрической активности и формирования vias для доступа к задней части FG
- Нанесите фоторезист на подложки, используя те же параметры, что и на этапах 4.1 и 4.2.
- Поместите устройство в бромограф и поместите пластиковую фотолитографическую маску на подложку для виа (круглые отверстия диаметром 50 мкм над зондирующими областями и отверстия 100 х 100 мкм2 над FG вдали от зондирования (называемые обратным контактом FG на рисунке 1 и рисунке 2)) под стереоскопическим микроскопом для повышения точности выравнивания. Подвергайте воздействию ультрафиолетового света сверху в течение 1 мин и осторожно снимите маску, позаботившись о том, чтобы свести к минимуму боковые движения маски над подложкой, чтобы избежать ее царапин.
ПРИМЕЧАНИЕ: Виаки на стороне FG вдали от зоны зоны срабатывания (показаны как обратный контакт FG на рисунке 1 и рисунке 2) необходимы для контакта во время характеристики транзистора. Кроме того, электрический доступ к FG может быть очень полезен для различных типов функционализации (например, электроосаждения). - Разработайте фоторезист, как описано ранее в шаге 4.4. Подвергните подложку с узорчатым фоторезистом (который здесь действует как маска) кислородной плазме (180 с при 200 Вт), чтобы удалить парилен С из зондирования.
ПРИМЕЧАНИЕ: Скорость травления парилена С в изотропном плазмоочистителе при 200 Вт составляет приблизительно 90 нм/мин. Для дальнейшей очистки зондирования выполняется небольшое чрезмерное травление. Фоторезист также травится во время процесса. Однако его толщина (2 мкм) значительно выше, чем у парилена С. - Поместите подложки в стеклянный контейнер, наполненный ацетоном, внутри ультразвуковой ванны на 10 с, чтобы полностью удалить фоторезист. Смойте субстраты ацетоном, изопропиловым спиртом, водой и высушите их азотом.
ПРИМЕЧАНИЕ: Использование ультразвуковой обработки вместо простого промывания подложек ацетоном имеет решающее значение для предотвращения нежелательного складывания и повторного осаждения фрагментов парилена С на поверхность зондирующих областей.
7. Самостоятельное выравнивание источника и стока с ФГ
- Нанесите фоторезист на подложки, используя те же параметры, что и на этапах 4.1 и 4.2. Поместите устройство в бромограф и поместите на подложку пластиковую фотолитографическую маску с простыми черными прямоугольниками, которые полностью покрывают области транзистора. Подвергайте воздействию ультрафиолетового света в течение 1 мин как сверху, так и снизу, и осторожно снимите маску, позаботившись о том, чтобы свести к минимуму боковые движения маски над подложкой, чтобы избежать ее царапин.
ПРИМЕЧАНИЕ: При двусторонней экспозиции FG действуют как фотолитографические маски по отношению к нижней экспозиции, в то время как наличие верхней маски гарантирует, что только фоторезист, присутствующий на канале транзисторов, остается неэкспонированным. - Разработайте фоторезист, как описано ранее в шаге 4.4.
8. Осаждение золота, формирование каналов и формирование источников, дренажей и контрольных затворов
- Очистите подложки щадящей плазменной обработкой (30 с при 30 Вт), чтобы способствовать адгезии металла на парилене С, и поместите их на держатель подложки внутри вакуумной камеры термического испарителя.
- Поместите 30 мг золота в тигель, закройте затвор и откачайте испарительную камеру, пока она не достигнет 10-5 торр. Увеличьте мощность испарителя, пока тигель не загорится красным цветом и подождите 30 с. Откройте затвор, увеличьте мощность до 40% (или пока тигель не засияет ярко-белым), подождите 60 с, закройте затвор и выключите питание.
- Поместите подложки в контейнер с ацетоном внутри ультразвуковой ванны на 10 с, чтобы снять фоторезист, тем самым удалив золото из канала транзисторов. Смойте субстраты ацетоном, изопропиловым спиртом, водой и высушите их азотом. Нанесите фоторезист на подложки, используя те же параметры, что и на этапах 4.1 и 4.2.
- Поместите прибор в бромограф и поместите на подложку пластиковую фотолитографическую маску с нужными источниками, дренажами и расположением ворот управления. Подвергайте воздействию ультрафиолетового излучения в течение 1 мин сверху и аккуратно снимите маску, позаботившись о том, чтобы свести к минимуму боковые движения маски над подложкой, чтобы избежать ее царапин.
- Разработайте фоторезист, как описано в шаге 4.4. Травите обнаженное золото, погружая его в раствор для травления золота (этап 1.3) на 10 с, промывайте его деионизированной водой и высушивайте с помощью азота. Оптически осмотрите подложку и удалите фоторезист с помощью ацетона. Промыть изопропиловым спиртом и деионизированной водой и высушить азотом.
9. Осаждение и активация парилена С для измерения рН
- Нанесите фоторезист на подложки, используя те же параметры, что и на этапах 4.1 и 4.2.
- Поместите прибор в бромограф и поместите на подложку пластиковую фотолитографическую маску с отверстиями, соответствующими pH-чувствительным областям OCMFET. Подвергайте воздействию ультрафиолетового излучения в течение 1 мин сверху и аккуратно снимите маску, позаботившись о том, чтобы свести к минимуму боковые движения маски над подложкой, чтобы избежать ее царапин.
- Разработайте фоторезист, как описано в шаге 4.4. Защитите все устройство, за исключением областей, чувствительных к pH, полиимидной изоляционной лентой (см. Таблицу материалов). Нанесите слой 500 нм парилена С (соответствующего 1 г димера парилена С) на подложку, используя те же параметры, которые описаны на этапе 5.1.
ПРИМЕЧАНИЕ: Общая толщина парилена С на pH-чувствительных областях составляет 650 нм. Для этого осаждения не требуется силан. - Аккуратно снимите полиимидную изоляционную ленту. Подвергайте субстрат воздействию кислородной плазмы (5 мин и 30 с при 200 Вт) для активации парилена С на pH-чувствительных областях OCMFETs.
ПРИМЕЧАНИЕ: Полиимидная изоляционная лента необходима здесь для ограничения осаждения парилена С. Фактически, простой взлет с использованием фоторезиста не дает положительных результатов из-за почти бесконтактного характера конформного покрытия, полученного с помощью Parylene C. - Поместите подложки в контейнер с ацетоном внутри ультразвуковой ванны на 10 с, чтобы полностью удалить фоторезист. Промыть субстраты ацетоном и изопропиловым спиртом (без воды) и высушить их азотом.
10. Осаждение полупроводников, размещение камеры культивирования и окончательное вырезание устройства из ПЭТ
- Поместите подложки на конфорку при температуре 50 °C. Налейте каплю (1 мкл) полупроводникового раствора (стадия 1.4) на каждый участок канала, накройте всю подложку крышкой и дайте высохнуть под химическим капюшоном в течение 30 мин.
- Подготовьте камеру культивирования, напечатав акрилонитрилбутадиенстирольное кольцо с внутренним радиусом 15 мм, толщиной 1 мм и высотой 7 мм с помощью 3D-принтера. Приклейте камеру культивирования на центральную часть подложки с помощью полидиметилсилоксана (соотношение отверждающего агента: 15% по массе). Вырежьте устройство из ПЭТ вручную или с помощью лазерного резака.
11. Электрическая характеристика транзисторов
- Охарактеризуйте каждый транзистор с помощью источника 18,19,20,21 (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Как выходные, так и входные характеристики должны быть измерены для экстраполяции параметров транзисторов (главным образом подвижности носителей, порогового напряжения, соотношения ION/IOFF и подпорогового наклона).
Результаты
Потенциал MOA был подтвержден здесь как для записи электрической активности, так и для мониторинга метаболической активности. Точная оценка возможностей устройства для обнаружения внеклеточных потенциалов действия была основана на тщательной характеристике культур кардиомиоцитов крыс (особенно в первичных кардиомиоцитах крыс, измеренных через 8 дней in vitro [DIV])18. На рисунке 3A показан полный MOA с 16 OCMFETs. Верхняя вставка показывает пример сливающейся культуры кардиомиоцитов крыс, прилипшей к поверхности MOA. Чтобы подчеркнуть их здоровье, клетки были иммуноокрашены для саркомерного белка, тропомиозина, после сеанса записи. Нижняя вставка показывает один сигнал кардиомиоцитов, измеренный с помощью OCMFET.
Интересно, что устройство может обнаруживать спонтанную электрическую активность и активность, вызванную введением различных химических веществ, как показано на рисунке 3B. Эта валидация имела решающее значение для демонстрации возможности использования этого подхода для взаимодействия электрогенных клеток. Из-за конфигурации массива MOA также позволил реконструировать скорость распространения сердечного сигнала, тем самым продемонстрировав пригодность системы для изучения сотовых сетей (рисунок 3C). Для дальнейшей валидации для определения фактического предела обнаружения устройства MOA также тестировали со стриатальными нейронами (21 DIV)18, с интересными результатами с точки зрения амплитуды сигнала и надежности записей. Как показано на рисунке 3D, OCMFET может усиливать потенциалы нейронного поля с замечательной стабильностью, показывая отношение сигнал/шум (SNRS) до 3,2 (в том же диапазоне, что и у SNR, полученных со стандартными MEAs25). Настройка записи состояла из пользовательской многоканальной электроники для смещения транзистора и считывания и кондиционирования сигнала. Каждый канал для электрической записи имеет первую ступень, состоящую из I/V преобразователя с резистором обратной связи 1 МОм и полосового фильтра 150 Гц-1,3 кГц с коэффициентом усиления напряжения 110. Для всех представленных измерений транзисторы были смещены с VDS = VGS = -1 В. Преобразование A/D, а также визуализация и хранение данных выполнялись с помощью платы сбора данных (см. Таблицу материалов). Все сеансы измерения проводились внутри клетки Фарадея, чтобы свести к минимуму электрический шум окружающей среды в системе.
Как упоминалось ранее, используя простую физическую функционализацию, представленную в протоколе, можно было подготовить высокочувствительные датчики pH со сверхнернштанским ответом. Из-за представленного подхода к изготовлению эти устройства pH могут быть интегрированы в MOA и использоваться для мониторинга незначительных изменений pH, вызванных метаболической активностью первичных нейронов гиппокампа крыс26. В частности, как показано на рисунке 4, только один из двух OCMFET, предназначенных для низкочастотного зондирования, был выборочно функционализирован, чтобы продемонстрировать осуществимость подхода. Эта селективная функционализация позволила оценить реакцию двух OCMFETs на химически индуцированные метаболические вариации: в частности, высокое метаболическое состояние может быть получено с помощью бикукуллина (BIC), ингибитора рецепторов ГАМК А27, в то время как низкое метаболическое состояние может быть вызвано добавлением тетродотоксина (TTX), что в конечном итоге вызывает клеточную смерть28. . Настройка записи состояла из той же пользовательской многоканальной электроники, которая использовалась для электронных измерений активности.
В отличие от предыдущего случая, два выделенных канала использовались для записи медленных изменений, вызванных клеточной метаболической активностью. Каждый канал состоял из простой схемы, состоящей из двух основных блоков: I/V преобразователя с резистором обратной связи 1 МОм и фильтра нижних частот с частотой среза 10 Гц. Транзисторы были смещены с VDS = VGS = -1 В, и все измерения проводились внутри клетки Фарадея для минимизации влияния внешнего шума на записи (это особенно важный аспект, учитывая флуктуации низкого тока, индуцированные клеточной метаболической активностью). В ходе экспериментов культуры поддерживали в низкобуферной питательной среде, а всю систему помещали в контролируемую среду (37 °C и непрерывный поток CO2/воздух). Как и ожидалось, только ток pH-чувствительного OCMFET может быть модулирован добавлением 25 мкМ BIC. Это было дополнительно подтверждено индункцией изменения тока соответствующим изменением клеточной метаболической активности.
Этот же эксперимент повторяли после добавления 10 мкМ TTX, что приводило к постепенному замедлению клеточного метаболизма. После добавления TTX ни pH-чувствительный OCMFET, ни pH-нечувствительный не показали никакого ответа, тем самым демонстрируя эффективность подхода. Эти результаты демонстрируют эффективность предложенной функционализации и ее относительную стабильность на срок до 2 недель. Важным выводом, который можно сделать из предложенных экспериментов (как электрической активности, так и метаболической активности), является то, что можно подготовить различные виды датчиков путем селективной функционализации различных OCMFETs в пределах одной и той же области культивирования. Этот аспект представляет собой нетривиальное достижение в биозондировании для клеточных приложений, поскольку возможность мониторинга различных параметров в пределах одной и той же клеточной культуры имеет решающее значение для лучшей характеристики сложности этих биологических систем.

Рисунок 1: Вид сверху 16-канального MOA для метаболического и электрического мониторинга электроактивных клеток. Шкала = 1 см. Сокращения: OCMFETs = органические полевые транзисторы с модуляцией заряда; FG = плавающие ворота; S/D = источник/слив; MOA = микро МАССИВ OCMFET. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
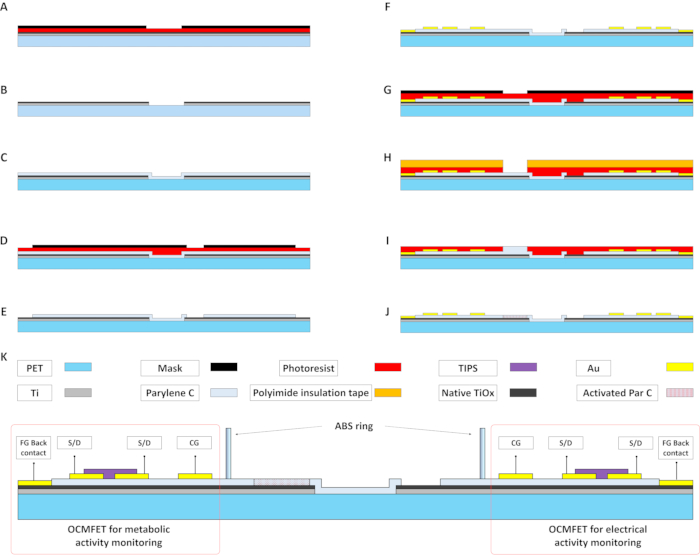
Рисунок 2: Основные этапы изготовления MOA для метаболического и электрического мониторинга электроактивных клеток. (A и B) Испарившаяся ti-пленка моделируется с использованием стандартного фотолитографического процесса для подготовки плавающего затвора OCMFET. с) осаждение 15 нм парилена С. Этот слой вместе с родным оксидом Ti действует как затворный диэлектрик транзисторов. (D и E) Слой парилена C структурирован с использованием плазменной кислородной обработки. Узорчатый слой фоторезиста используется для выборочного обнажения чувствительных областей для электрических записей и задних контактов плавающего затвора. (F) Рисунок верхних контактов Au, а именно источника, слива, регулирующего затвора и заднего контакта плавающего затвора. Метод самоустановления используется для улучшения электрических характеристик устройства. (Г-И) Осаждение второго слоя парилена С на зондирующей области OCMFETs для мониторинга метаболической активности. После воздействия кислородной плазмы этот слой будет действовать как pH-чувствительная мембрана (J). (K) Поперечное сечение полного MOA (с материалами) после осаждения органического полупроводника (TIPS Pentacene) и позиционирования культуральной камеры. Сокращения: OCMFETs = органические полевые транзисторы с модуляцией заряда; FG = плавающие ворота; S/D = источник/слив; MOA = микро МАССИВ OCMFET; CG = контрольный затвор; ПЭТ = полиэтилентерефталат; Пар С = Парилен С; TIPS = 6,13-бис(триизопропилсилиллетинил) пентацен; ABS = акрилонитрилбутадиенстирол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
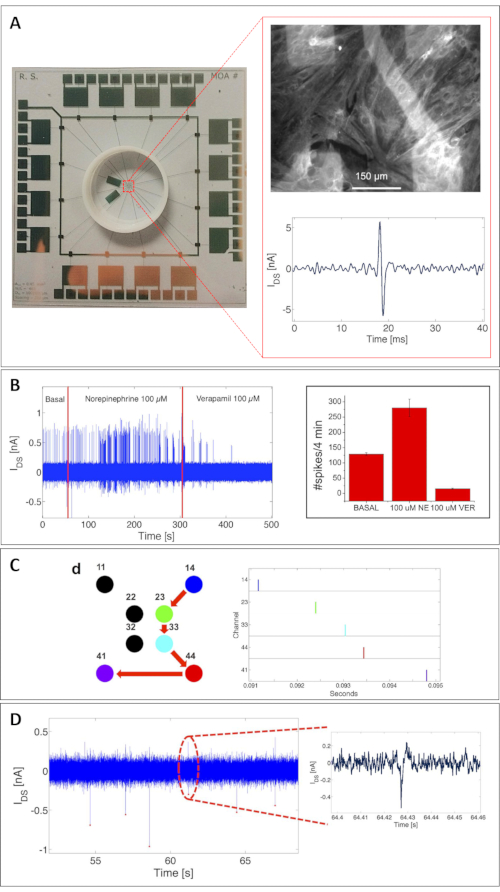
Рисунок 3: Записи клеточной электрической активности с ПОМОЩЬЮ MOA. (A) Сливающаяся культура кардиомиоцитов крыс (8 DIV), прилипающая к поверхности MOA, фиксированная после сеанса записи и иммуноокрашенная для саркомерного белка, тропомиозин (верхняя вставка). Нижняя вставка: пример одного сигнала кардиомиоцита, измеренного с помощью OCMFET. Шкала бара = 150 мкм. (B) Химическая настройка электрической активности культуры кардиомиоцитов. Ускорение активности было вызвано добавлением 100 мМ норадреналина, в то время как подавление было результатом добавления 100 мМ верапамила. Слева: биение частотной модуляции; справа: статистика по 5 OCMFETs-среднему и стандартному отклонению: спайковое количество на 4 мин базальной (129 ± 4,6), норадреналин-опосредованной (280 ± 28,6) и верапамил-опосредованной активности (15 ± 1,9). (C) Реконструкция распространения сердечного сигнала. Справа: растровый график спонтанной активности культуры, указывающий на распространение сигнала с участка 14 на участок 41 (справа). (D) Потенциалы действия стриатальных клеток эмбриона крысы (21 DIV). Эта цифра была изменена с 18. Сокращения: OCMFET = органический полевой транзистор с модуляцией заряда; MOA = микро МАССИВ OCMFET; NE = норадреналин; VER = верапамил; DIV = дни in vitro. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
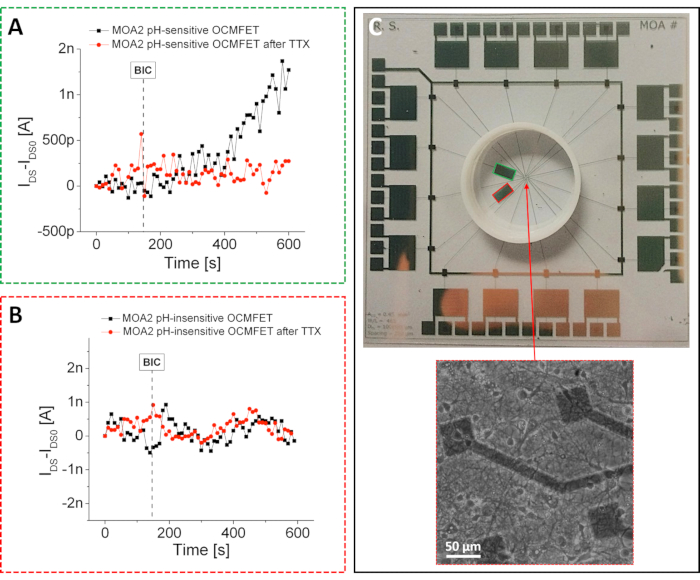
Рисунок 4: Записи метаболической активности с помощью MOA. Реакция (А) рН-чувствительных и (В) рН-нечувствительных каналов МОА на добавление 25 мкМ БИК до и после добавления 10 мкМ ТТХ. После добавления TTX поведение pH-чувствительного канала становится похожим на поведение pH-нечувствительного. В частности, не может наблюдаться изменения тока после добавления BIC из-за клеточной смерти, вызванной TTX. (C) MOA для регистрации метаболической активности. PH-чувствительные и pH-нечувствительные OCMFETs выделены зеленым и красным цветом соответственно. Вставка: здоровые нейроны гиппокампа, культивируемые на устройстве после 15 DIV. Шкала бар = 50 мкм. Эта цифра была изменена с 26. Сокращения: OCMFET = органический полевой транзистор с модуляцией заряда; MOA = микро МАССИВ OCMFET; БИК = бикукультный; TTX = тетродотоксин; DIV = дни in vitro. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В отличие от предыдущих способов изготовления OCMFETs для клеточных применений18,29, предлагаемый способ специально разработан для получения МОА, которые могут одновременно обнаруживать электрическую и метаболическую клеточную активность. Кроме того, этот подход к достижению чувствительности к рН имеет то преимущество, что он совместим со стандартными протоколами изготовления и не включает в себя какую-либо химическую модификацию зоны зоны измерения (этот аспект обеспечивает биосовместимость всего устройства). Чувствительность рН достигается с использованием того же материала, который используется в качестве затворного диэлектрика (т.е. биосовместимого парилена С), что делает этот подход быстрым и воспроизводимым.
Конечным результатом этого подхода является гибкий, прозрачный, недорогой и мультисенсирующий органический инструмент для клеточных приложений in vitro . Тот факт, что это может быть получено с использованием одной транзисторной структуры и простой физической модификации зоны зоны зондирования, добавляет к преимуществам, предлагаемым использованием органических электронных материалов и методов. Более того, поскольку принцип трансдукции OCMFET не зависит строго от конкретного полупроводника или материала FG, весь процесс может быть модифицирован и масштабирован в зависимости от конкретного применения.
Критический аспект предлагаемой методики связан с воспроизводимостью метода плазменной активации. Для получения стабильных результатов необходимо контролировать как толщину парилена С, так и скорость его травления. Частая калибровка процесса осаждения парилена С и плазменного очистителя абсолютно необходима. Другими критическими аспектами, которые также способствуют воспроизводимости процесса, являются бережное обращение с устройством и осаждение органического полупроводника. Здесь использовалась простая техника капельного литья, которая по своей сути создает ограничения воспроизводимости. Чтобы свести к минимуму эти проблемы, как описано в шаге протокола 10.1, каждый раз следует использовать одно и то же количество полупроводникового раствора, а испарение растворителя должно быть максимально стандартизировано. Поддержание постоянной температуры с помощью конфорки и покрытие подложки после каждого капельного осаждения поможет замедлить процесс испарения. Для дальнейшего сведения к минимуму этой проблемы можно было бы переключить метод осаждения (например, с использованием метода струйной печати30.
Ограничение предлагаемого протокола связано с характером функционализации OCMFET для pH-зондирования. Стабильность датчиков pH ограничена несколькими неделями26. Однако окно стабильности предлагаемого подхода достаточно велико, чтобы покрыть стандартное время инкубации, необходимое для роста культуры нейронов (2-3 недели). Другие типы функционализации зон зоны должны рассматриваться для более длительных экспериментов. Протокол изготовления использует выделенный обратный контакт, обеспечивающий электрический доступ к FG. Этот контакт, который остается плавающим во время нормальной работы устройства, может быть использован для электрической характеристики устройства и функционализации зондирования с использованием различных методов (например, электроосаждения).
Эта процедура представляет собой удобный способ подготовки многосенсорного устройства для клеточных применений без необходимости использования обширных материалов или помещений для чистых помещений. Несмотря на ограничения производительности и стабильности из-за использования органического полупроводника и физической (не химической) функционализации зондирования, аналогичные подходы могут быть использованы для подготовки недорогих (и потенциально одноразовых), механически гибких и оптически прозрачных датчиков и биосенсоров, которые могут предоставить исследователям в области клеточной биологии, тканевой инженерии и неврологии новые специализированные инструменты для изучения клеточных систем in vitro.
Раскрытие информации
У авторов нет конфликта интересов, о которых можно было бы заявить.
Благодарности
Авторы признают финансирование из исследовательской и инновационной программы Европейского Союза Horizon 2020 в рамках грантового соглашения No 882897-Search&Rescue project и проекта PON «TEX-STYLE» ARS01_00996, PNR 2015-2020.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-(Trimethoxysilyl)propyl methacrylate | Sigma Aldrich | 440159 | |
| 3D printer Makerbot Replicator 2x | Makerbot | https://www.makerbot.gr/. Estimated price: 2k-3k euros. | |
| ABS filament | |||
| Anisole | Sigma Aldrich | 296295 | |
| Bromograph model Hellas | Bungard | https://www.bungard.de/. Estimated price: 1k-2k euros. | |
| Gold | Local seller | ||
| Hydrofluoric acid | Sigma Aldrich | 695068 | |
| Iodine | Sigma Aldrich | 207772 | |
| Kapton tape | polyimide insulation tape | ||
| Laser cutter VLS2.30 | Universal Laser Systems | https://www.ulsinc.com/it. Estimated price: 20k euros. | |
| Multichannel Systems acquisition board | www.multichannelsystems.com | ||
| NaOH pellets | Sigma Aldrich | 567530 | |
| Parylene C dimer | SCS special coating systems coating | ||
| PDMS Silgard 184 | Sigma Aldrich | 761036 | |
| PDS 2010 LABCOATER 2 Parylene Deposition System | SCS special coating systems | https://scscoatings.com/. Estimated price: 50k euros | |
| PET film biaxially oriented (thickness 0.25 mm) | Goodfellow | ES301450 | |
| Petri dishes | |||
| Plasma cleaner Gambetti "Tucano" | Gambetti | https://www.gambetti.it/. Estimated price: 20k euros. | |
| Positive photoresist AZ1518 | MicroChemicals | ||
| Potassium iodide KI | Sigma Aldrich | 221945 | |
| Source Meter 2636 | Keithley | https://it.farnell.com/. Estimated price: 18k euros | |
| Spin coater unit | Ossila | https://www.ossila.com/. Estimated price: 2.5k euros. | |
| Stereoscopic microscope SMZ745T | Nikon | https://www.microscope.healthcare.nikon. com/. Estimated price: 2k-3k euros. | |
| Thermal evaporator unit | |||
| TIPS pentacene (6,13-Bis(triisopropylsilylethynyl)-pentacene) | Sigma Aldrich | 716006 | |
| Titanium wire | Goodfellow | TI005129 | |
| Ultrasonic bath | Falc Instruments | https://www.falcinstruments.it/. Estimated price: 1k euro. |
Ссылки
- Hubel, D. H. Tungsten microelectrode for recording from single units. Science. 125 (3247), 549-550 (1957).
- Verzeano, M., Negishi, K., Angeles, L. Neuronal activity in cortical and thalamic networks. A study with multiple microelectrodes. Journal of General Physiology. 43 (6), 177-195 (1960).
- Thomas, C. A., Springer, P. A., Loeb, G. E., Berwald-Netter, Y., Okun, L. M. A miniature microelectrode array to monitor the bioelectric activity of cultured cells. Experimental Cell Research. 74 (1), 61-66 (1972).
- Grattarola, M., Martinoia, S. Modeling the neuron-microtransducer junction: from extracellular to patch recording. IEEE Transactions on Biomedical Engineering. 40 (1), 35-41 (1993).
- Wallace, K., Strickland, J. D., Valdivia, P., Mundy, W. R., Shafer, T. J. A multiplexed assay for determination of neurotoxicant effects on spontaneous network activity and viability from microelectrode arrays. NeuroToxicology. 49, 79-85 (2015).
- Bergveld, P. Development, operation, and application of the tool for electrophysiology. IEEE Transactions on Biomedical Engineering. 19 (5), 342-351 (1972).
- Bergveld, P., Wiersma, J., Meertens, H. Extracellular potential recordings by means of a field effect transistor without gate metal, called OSFET. IEEE Transactions on Biomedical Engineering. 23 (2), 136-144 (1976).
- Fromherz, P., Offenhausser, A., Vetter, T., Weis, J. A neuron-silicon junction: a Retzius cell of the leech on an insulated-gate field-effect transistor. Science. 252 (5010), 1290-1293 (1991).
- Martinoia, S., et al. Development of ISFET array-based microsystems for bioelectrochemical measurements of cell populations. Biosensors and Bioelectronics. 16 (9-12), 1043-1050 (2001).
- Heer, F., et al. CMOS microelectrode array for the monitoring of electrogenic cells. Biosensors and Bioelectronics. 20 (2), 358-366 (2004).
- Berdondini, L., et al. Active pixel sensor array for high spatio-temporal resolution electrophysiological recordings from single cell to large scale neuronal networks. Lab on a Chip. 9 (18), 2644-2651 (2009).
- Maccione, A., et al. Multiscale functional connectivity estimation on low-density neuronal cultures recorded by high-density CMOS micro electrode arrays. Journal of Neuroscience Methods. 207 (2), 161-171 (2012).
- Kibler, A. B., Jamieson, B. G., Durand, D. M. A high aspect ratio microelectrode array for mapping neural activity in vitro. Journal of Neuroscience Methods. 204 (2), 296-305 (2012).
- Frega, M., Tedesco, M., Massobrio, P., Pesce, M., Martinoia, S. Network dynamics of 3D engineered neuronal cultures: a new experimental model for in-vitro electrophysiology. Scientific Reports. 4, 5489 (2014).
- Zuo, L., Yu, S., Briggs, C. A., Kantor, S., Pan, J. Y. Design and fabrication of a three-dimensional multi-electrode array for neuron electrophysiology. Journal of Biomechanical Engineering. 139 (12), (2017).
- Spanu, A., et al. A three-dimensional micro-electrode array for in-vitro neuronal interfacing. Journal of Neural Engineering. 17 (3), 036033 (2020).
- Spanu, A., Martines, L., Bonfiglio, A. Interfacing cells with organic transistors: a review of in vitro and in vivo applications. Lab on a Chip. 21 (5), 795-820 (2021).
- Spanu, A., et al. An organic transistor-based system for reference-less electrophysiological monitoring of excitable cells. Scientific Reports. 5, 8807 (2015).
- Viola, F. A., Spanu, A., Ricci, P. C., Bonfiglio, A., Cosseddu, P. Ultrathin, flexible and multimodal tactile sensors based on organic field-effect transistors. Scientific Reports. 8, 8073 (2018).
- Napoli, C., et al. Electronic detection of DNA hybridization by coupling organic field-effect transistor-based sensors and hairpin-shaped probes. Sensors. 18 (4), 990 (2018).
- Spanu, A., et al. A reference-less pH sensor based on an organic field effect transistor with tunable sensitivity. Organic Electronics. 48, 188-193 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807 (2015).
- Zhang, Y. S., et al. Multisensor-integrated organs-on-chips platform for automated and continual in situ monitoring of organoid behaviors. Proceedings of the National Academy of Sciences of the United States of America. 114 (12), 2293-2302 (2017).
- Yu, H., et al. A novel design of multifunctional integrated cell-based biosensors for simultaneously detecting cell acidification and extracellular potential. Biosensors and Bioelectronics. 24 (5), 1462-1468 (2009).
- Maccione, A., et al. A novel algorithm for precise identification of spikes in extracellularly recorded neuronal signals. Journal of Neuroscience Methods. 177 (1), 241-249 (2009).
- Spanu, A., Tedesco, M. T., Martines, L., Martinoia, S., Bonfiglio, A. An organic neurophysiological tool for neuronal metabolic activity monitoring. APL Bioengineering. 2 (4), 046105 (2018).
- Díaz-García, C. M., et al. Neuronal stimulation triggers neuronal glycolysis and not lactate uptake. Cell Metabolism. 26 (2), 361-374 (2017).
- Xie, Y., Dengler, K., Zacharias, E., Wilffert, B., Tegtmeier, F. Effects of the sodium channel blocker tetrodotoxin (TTX) on cellular ion homeostasis in rat brain subjected to complete ischemia. Brain Research. 652 (2), 216-224 (1994).
- Caboni, A., Orgiu, E., Barbaro, M., Bonfiglio, A. Flexible organic thin-film transistors for pH monitoring. IEEE Sensors Journal. 9 (12), 1963-1970 (2009).
- Fraboni, B., Bonfiglio, A., Basiricò, L. Inkjet printing of transparent, flexible, organic transistors. Thin Solid Films. 520, 1291-1294 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены