Method Article
Генерация двигательных единиц человека с функциональными нервно-мышечными соединениями в микрофлюидных устройствах
В этой статье
Резюме
Описан способ генерации двигательных единиц человека в коммерчески доступных микрофлюидных устройствах путем совместного культивирования индуцированных человеком плюрипотентных двигательных нейронов, полученных из стволовых клеток, с первичными миотрубками человека, полученными из мезоангиобластов, что приводит к образованию функционально активных нервно-мышечных соединений.
Аннотация
Нервно-мышечные соединения (NMJ) представляют собой специализированные синапсы между аксоном нижнего двигательного нейрона и мышцей, облегчающими вовлечение мышечного сокращения. При нарушениях двигательных нейронов, таких как боковой амиотрофический склероз (БАС) и спинальная мышечная атрофия (СМА), NMJ дегенерируют, что приводит к мышечной атрофии и прогрессирующему параличу. Основной механизм дегенерации NMJ неизвестен, в основном из-за отсутствия переводимых исследовательских моделей. Это исследование было направлено на создание универсальной и воспроизводимой in vitro модели двигательной единицы человека с функциональными NMJ. Таким образом, моторные нейроны, полученные из индуцированных человеком плюрипотентных стволовых клеток (hiPSC), и миотубы, полученные из первичных мезоангиобластов человека (MAB), были совместно культивированы в коммерчески доступных микрофлюидных устройствах. Использование псевдоизолированных микрокомпараторов позволяет поддерживать клеточную специфическую микросреду, допуская при этом межклеточный контакт через микроплощадки. Путем применения хемотаксического и объемного градиента стимулировали рост двигательных нейронов-нейритов через микрогрузы, способствующие взаимодействию миотруб и образованию NMJ. Эти NMJ были идентифицированы иммуноцитохимически путем совместной локализации пресинаптического маркера двигательных нейронов синаптофизина (SYP) и маркера постсинаптического ацетилхолинового рецептора (AChR) α-бунгаротоксина (Btx) на миотрубках и морфологически охарактеризованы с использованием сканирующей электронной микроскопии (SEM). Функциональность NMJ была подтверждена измерением кальциевых реакций в миотрубах при деполяризации двигательных нейронов. Двигательный блок, созданный с использованием стандартных микрофлюидных устройств и технологии стволовых клеток, может помочь будущим исследованиям, ориентированным на NMJ в области здравоохранения и болезней.
Введение
NMJ облегчают связь между нижними спинальными двигательными нейронами и волокнами скелетных мышц посредством высвобождения нейротрансмиттеров1. При нарушениях двигательных нейронов, таких как БАС и СМА, NMJ дегенерируют, что вызывает нарушение связи с мышцами2,3,4,5,6,7. Это приводит к тому, что пациенты постепенно теряют свою мышечную функцию, что приводит к тому, что они прикованы к инвалидной коляске и в конечном итоге зависят от респираторного жизнеобеспечения из-за прогрессирующей атрофии жизненно важных групп мышц, таких как диафрагма. Точные основные механизмы, ответственные за эту глубокую потерю NMJ при этих расстройствах, неизвестны. Многие исследования были проведены на трансгенных животных моделях, которые дали нам некоторое представление о патогенезе дегенерации NMJ5,6,8,9,10,11. Однако, чтобы полностью понять патологию и противодействовать денервации, важно иметь человеческую систему, которая обеспечивает полную доступность.
Здесь протокол описывает относительно простой способ генерации человеческих NMJ путем совместного культивирования моторных нейронов, полученных из hiPSC, и первичных миотуб человека, полученных из MAB, с использованием коммерчески доступных микрофлюидных устройств. Использование микрофлюидики для поляризации и жидкостной изоляции сом и аксонов нейронов было известно с момента первого описания камер «Кампено»12 в конце 1970-х годов. С тех пор было изготовлено больше микрофлюидных конструкций, включая коммерческие варианты. Устройства, используемые в этом протоколе, содержат два отсека, и каждый отсек состоит из двух колодцев, соединенных каналом13. Два отсека зеркальны и соединены несколькими микрогрузами. Эти микрорезы имеют размер, который облегчает рост нейритов, сохраняя при этом текучую изоляцию между двумя отсеками через капиллярное гидростатическое давление13,14. Используя эту систему, можно культивировать двигательные нейроны в одном компартменте и мышечные клетки в другом, каждый в своей специфической питательной среде, в то же время облегчая физическую связь через нейриты, проходящие через микрорезы и взаимодействующие с мышечными клетками. Эта модель обеспечивает полностью доступную и адаптируемую систему in vitro двигательной единицы человека, которая может быть использована для изучения ранней патологии NMJ при таких заболеваниях, как БАС и СМА.
протокол
Письменное информированное согласие было получено от всех субъектов, которые предоставили свои образцы для генерации iPSC и сбора MAB. Процедура была одобрена комитетом по медицинской этике Университетской клиники Лёвена (n° S5732-ML11268) и главным комитетом по этике исследований Великобритании в рамках проекта StemBANCC. Все реагенты и оборудование, используемые в этом протоколе, перечислены в Таблице материалов и должны использоваться стерильно. Среда должна быть нагрета до комнатной температуры (RT) перед использованием, если не указано иное. Обзор протокола совместного культивирования см. на рисунке 1.
1. Дифференциация предшественников двигательных нейронов от иПСК
- Следуйте протоколу дифференцировки двигательных нейронов15, адаптированному из предыдущего исследования16, до достижения состояния нейронного предшественника (NPC) на 10-й день. Согласно временным рамкам протокола, дифференциация инициируется в понедельник (день 0), что приводит к 10-му дню NPC в четверг.
- Криоконсервировать 10 дней NPC в нокаутирующей сыворотке замещения 10% диметилсульфоксидом (ДМСО) при плотности 2 х 106- 4 х 106 клеток на флакон.
ВНИМАНИЕ: DMSO токсичен: держите в вытяжке средства индивидуальной защиты.
ПРИМЕЧАНИЕ: Ожидается, что примерно 50% дневных 10 NPC будут жизненно важны при оттаивании. Остановите протокол дифференцировки моторных нейронов в этом состоянии NPC «день 10» и криоконсервируйте NPC для генерации большого количества NPC, которые могут быть сохранены и использованы позже, уменьшая длину общей временной шкалы протокола кокультуры с 28 дней до 19 дней в целом.
2. Выведение и поддержание человеческих МАБ
ПРИМЕЧАНИЕ: MABs представляют собой сосудоассоциированные мезенхимальные стволовые клетки, которые в данном случае были собраны из биопсий, полученных от 58-летнего здорового донора. Доступны альтернативные коммерческие источники. Кратко объясняется протокол получения МАБ. Для получения дополнительной информации обратитесь к подробному протоколу17. Все среды MAB должны быть нагреты до 37 °C перед использованием.
- Измельчить биопсийную ткань и инкубировать на коллагене (из телячьей кожи), покрытом 6 см посудой в питательной среде (табл. 1) в течение 2 недель. Меняйте среду каждые 4 дня.
- Для приготовления коллагенового покрытия растворите 100 мг коллагена в 20 мл 0,1 М уксусной кислоты. Коллагену требуется время, чтобы раствориться, поэтому поместите смесь на качающуюся платформу на ночь в RT. На следующий день добавьте 80 мл ddH2O до конечного объема 100 мл.
ВНИМАНИЕ: Уксусная кислота токсична; ручка в вытяжном шкафу со средствами индивидуальной защиты.
ПРИМЕЧАНИЕ: Коллаген из покрытия из телячьей кожи может быть повторно использован до 5x. Хранить при температуре 4 °C. - Покрыть всю поверхность блюда или колбы коллагеном, закрыть и инкубировать в течение 20 мин на РТ внутри ламинарного потока. Через 20 мин восстановите коллаген в свежей емкости, закройте пустую посуду/колбу и оставьте на 10 мин при РТ в ламинарном потоке.
- Переложите блюдо/колбу в инкубатор для ночной (или не менее 6 ч) инкубации (37 °C, 5% CO2). Промыть 5x фосфатно-буферным физиологическим раствором Dulbecco без кальция или магния (DPBS) перед покрытием клеток.
- Для приготовления коллагенового покрытия растворите 100 мг коллагена в 20 мл 0,1 М уксусной кислоты. Коллагену требуется время, чтобы раствориться, поэтому поместите смесь на качающуюся платформу на ночь в RT. На следующий день добавьте 80 мл ddH2O до конечного объема 100 мл.
- Через 14 дней FACS (флуоресцентная активированная сортировка клеток) сортирует MABs для щелочной фосфатазы человека17 с последующим дальнейшим расширением. Поддерживайте MABs на покрытых коллагеном колбах T75 в питательной среде и меняйте питательную среду каждые 2 дня (10 мл на колбу).
- Криоконсервировать, проходить или сеять МАБ в устройствах при достижении 70% слияния.
ПРИМЕЧАНИЕ: MABs теряют свой миогенный потенциал из-за спонтанных слияний при межклеточном контакте. Убедитесь, что при расширении MABs не должно превышать 70% слияния. Одна 70% сливающаяся колба T75 содержит приблизительно 600 000-800 000 клеток, которые могут быть криоконсервированы при 100 000 клеток на флакон. Каждый флакон можно позже разморозить и посеять в колбу T75 для расширения. - Для прохождения МАБ осторожно промыть их один раз с 7 мл DPBS, а затем инкубировать в 7 мл диссоциационного раствора МАБ в течение 3 мин при 37 °C в 5% CO2 для диссоциации клеток.
- Нейтрализуйте диссоциационный раствор МАБ 7 мл питательной среды, аккуратно соскоблите клетки и перенесите клеточную суспензию в трубку центрифуги объемом 50 мл. Аккуратно промыть колбу дополнительными 5 мл питательной среды, чтобы собрать потенциально оставшиеся МАБ.
- Центрифугируют клеточную суспензию в течение 3 мин при 300 х г, затем переходят непосредственно в новую колбу T75 с коллагеновым покрытием для расширения, криоконсервируют в нокаутирующей сыворотке с заменой 10% DMSO или считают для посева в микрофлюидное устройство.
ПРИМЕЧАНИЕ: Пассажи выполняются 1x-2x в неделю для расширения клеток до максимального числа проходов 13. При диссоциации МАБ кажутся сферическими и большими по форме при исследовании под микроскопом.
3. Подготовка предварительно собранных микрофлюидных устройств - День 9
ПРИМЕЧАНИЕ: Протокол адаптирован из протокола нейронного устройства производителя микрофлюидных устройств и был скорректирован для использования как предварительно собранных, так и силиконовых устройств. Здесь предварительно собранные устройства используются для иммуноцитохимии (ICC) и записи переходных процессов кальция в живых клетках, в то время как силиконовые устройства используются для SEM. Временная шкала протокола следует за временной шкалой для протокола дифференцировки двигательных нейронов.
- Подготовьте микрофлюидные устройства за день до посева клеток, так как покрытие нужно инкубировать в течение ночи. Согласно протоколу двигательных нейронов, это будет среда. Добавьте ~10 мл 70%-100% этанола в чашку Петри 10 см. Используйте щипцы для переноса устройства из транспортного контейнера в чашку Петри для стерилизации.
- Погрузите устройство в этанол на 10 с и переложите устройство с щипцами на лист бумаги, чтобы высохнуть на воздухе в ламинарном потоке в течение ~30 мин. Переверните устройство несколько раз, чтобы обе стороны высохли. Когда устройство высохнет, используйте щипцы для перемещения каждого устройства в отдельную чашку Петри 10 см для удобства в обращении
ВНИМАНИЕ: Этанол токсичен; ручка в вытяжном шкафу со средствами индивидуальной защиты - Покрыть устройство поли-L-орнитином (PLO) (100 мкг/мл) в DPBS и инкубировать при 37 °C, 5% CO2 в течение 3 ч.
- Используйте пипетку P200, чтобы добавить 100 мкл PLO в DPBS в верхнюю лунку как можно ближе к отверстию канала и наблюдать за жидкостью, проходящей из верхней скважины через канал в нижнюю скважину. Впоследствии добавьте 100 мкл PLO в DPBS к нижней скважине.
- Повторите на другой стороне микрогрузов и закончите добавлением 100 мкл на одной стороне устройства, чтобы создать градиент объема между двумя зеркальными сторонами устройства для покрытия микрогрузм (например, правая сторона 200 мкл, левая сторона 300 мкл). Через 3 ч промыть прибор 3х в течение 5 мин с помощью DPBS. При необходимости используйте систему всасывания.
ПРИМЕЧАНИЕ: Убедитесь, что вы избегаете образования пузырьков воздуха в каналах в любой момент во время покрытия или культивирования клеток. Даже небольшие пузырьки будут расширяться в течение короткого времени, тем самым препятствуя покрытию, посеву клеток или потоку среды через канал. Если жидкость останавливается в канале во время покрытия, повторно суспендируйте раствор PLO непосредственно в канал с обеих сторон. Если пузырьки все еще присутствуют, используйте 200 мкл DPBS для промывки канала и повторите процесс нанесения покрытия, как указано выше на этапах 3.3.1-3.3.2. Если пузырьки появляются после посева клеток, восстановить устройство невозможно, так как промывка канала повредит клетки.
- Покрыть устройство ламинином (20 мкг/мл) в нейробазальной среде и инкубировать в течение ночи при 37 °C, 5% CO2. Следуйте тем же инструкциям для покрытия PLO, что и на этапах 3.3.1-3.3.2.
- На следующий день используйте пипетку P200 и расположите наконечник в скважине напротив отверстия канала, чтобы удалить ламининовое покрытие из скважин. Добавьте DPBS ко всем колодцам и оставьте устройства с DPBS в ламинарном потоке на RT для посева клеток.
ПРИМЕЧАНИЕ: С этого момента важно не удалять жидкость (ламининовое покрытие, DPBS, среду, фиксирующий раствор и т. Д.) Непосредственно из каналов, так как это может вызвать образование пузырьков воздуха. Всегда осматривайте устройства под микроскопом перед посевом клеток.
4. Приготовление силиконовых микрофлюидных приборов - День 9
- Подготовьте силиконовые микрофлюидные устройства за день до посева клеток, так как покрытие нужно инкубировать в течение ночи. Согласно протоколу двигательных нейронов, это будет среда.
- Добавьте ~10 мл 70%-100% этанола в чашку Петри 10 см. Используйте щипцы для переноса устройства из транспортного контейнера на чашку Петри для стерилизации. Погружают прибор в этанол на 10 с и перекладывают щипцами в скважину в 6-луночную пластину для сушки на воздухе в ламинарном потоке в течение ~30 мин. Расположите устройство на боку, чтобы все стороны высохли.
- Вырежьте листы SEM до размера устройства (оставьте по несколько мм с каждой стороны). Повторите стерилизацию, как указано выше на этапе 4.1.1. Затем переложить щипцами на 10 см чашку Петри для высыхания. Два-три листа SEM уместятся в одном блюде.
- Покрыть устройства и листы SEM PLO (100 мкг/мл) в DPBS и инкубировать при 37 °C, 5% CO2 в течение 3 ч.
- Добавьте 1 мл PLO в DPBS на каждую скважину к каждому устройству в 6-луночной пластине. Убедитесь, что устройство плавает поверх раствора PLO с каналом и стороной микропарата, обращенной вниз к жидкости. Добавьте 10 мл PLO в DPBS на чашку Петри 10 см и используйте щипцы, чтобы протолкнуть листы SEM в жидкость.
ПРИМЕЧАНИЕ: Листы SEM обычно плавают поверх раствора покрытия. Перед сборкой устройства и листа поверните лист SEM так, чтобы поверхность, которая соприкасалась с PLO, контактировала с каналом и микроплоской поверхностью устройства. - Через 3 ч промыть прибор и SEM листы 2x в течение 5 мин с DPBS с последующей еще одной промывкой в течение 5 мин стерильной водой. При необходимости используйте систему всасывания. Переложите каждый лист SEM в отдельную чашку Петри 10 см для удобства обработки.
ПРИМЕЧАНИЕ: Как устройства, так и листы SEM должны быть полностью сухими перед сборкой. Окончательная промывка стерильной водой удаляет потенциальные кристаллы соли из DPBS, которые в противном случае могли бы препятствовать сборке.
- Добавьте 1 мл PLO в DPBS на каждую скважину к каждому устройству в 6-луночной пластине. Убедитесь, что устройство плавает поверх раствора PLO с каналом и стороной микропарата, обращенной вниз к жидкости. Добавьте 10 мл PLO в DPBS на чашку Петри 10 см и используйте щипцы, чтобы протолкнуть листы SEM в жидкость.
- Работа под микроскопом в ламинарном потоке. Используйте щипцы для крепления силиконового устройства с каналом и микрогрузой стороной вниз под углом 90° на лист SEM, гарантируя, что все стороны выровнены. Слегка прижмите к устройству, чтобы убедиться, что вы герметизируете не только внешние края, но и вокруг колодцев, каналов и микрорезов.
ПРИМЕЧАНИЕ: Связанные области будут казаться серыми, в то время как те, которые еще не установлены, будут казаться прозрачными под микроскопом. Убедитесь, что все участки хорошо герметизированы без пузырьков воздуха, чтобы избежать отслоения устройства во время культивирования. В случае мусора или кристаллов соли, блокирующих монтаж, перемойте лист SEM и устройство в стерильной воде и высушите перед повторной попыткой монтажа. Если микроплощадки искажаются из-за слишком сильного нажатия на устройство, полностью извлеките устройство из листа SEM и повторите попытку монтажа. Будьте осторожны при нанесении покрытий и замене среды после установки устройства. - Работа под микроскопом в ламинарном потоке. Покрыть устройство ламинином (20 мкг/мл) в нейробазальной среде и инкубировать в течение ночи при 37 °C, 5% CO2.
ПРИМЕЧАНИЕ: Ночная инкубация затвердевает силиконовое устройство и дополнительно уплотняет его на листе SEM.- Используйте пипетку P200, чтобы добавить 100 мкл раствора ламинина в верхнюю лунку как можно ближе к отверстию канала и наблюдать за жидкостью, проходящей из верхней скважины через канал в нижнюю скважину. Проверьте наличие протечек вокруг колодца и канала.
- Впоследствии добавьте 100 мкл раствора ламинина в нижний колодец и проверьте на герметичность. Повторите на другой стороне микрогруз и закончите с дополнительными 100 мкл на одной стороне устройства, чтобы создать градиент объема между двумя зеркальными сторонами устройства для покрытия микрорезов (например, правая сторона 200 мкл, левая сторона 300 мкл).
ПРИМЕЧАНИЕ: В случае утечки удалите ламининовое покрытие, разберите устройство и листы SEM и промыть их в стерильной воде. Дайте им высохнуть и повторите, начиная с шага 4.3. - На следующий день снимите покрытие со скважин пипеткой P200, расположив наконечник в скважине напротив отверстия канала. Добавьте DPBS ко всем колодцам и оставьте устройства с DPBS в ламинарном потоке на RT для посева клеток.
ПРИМЕЧАНИЕ: С этого момента не удаляйте жидкость (ламининовое покрытие, DPBS, среду, фиксирующий раствор и т. Д.) Непосредственно из каналов, так как это может вызвать образование пузырьков воздуха. Всегда осматривайте устройства под микроскопом перед посевом клеток.
5. Покрытие NPC в микрофлюидных устройствах - День 10
ПРИМЕЧАНИЕ: Согласно протоколу дифференцировки двигательных нейронов15, покрытие NPC 10-го дня происходит в четверг.
- Используют свежедиссоциированные NPC 10 дня 15 или размораживают 1-2 флакона банковских NPC на 10 мл среды двигательных нейронов 10-го дня (таблица 2 и таблица 3) с ингибитором ROCK (10 мкл/мл) раствором и центрифугируют клеточную суспензию при 100 х г в течение 4 мин.
- Повторно суспендируют клеточную гранулу в 500-1000 мкл моторной нейронной среды 10-го дня раствором ингибитора ROCK (10 мкл/мл) и подсчитывают живые клетки любым предпочтительным методом подсчета.
ПРИМЕЧАНИЕ: Как указано ниже, убедитесь, что NPC повторно суспендированы в нужное количество среды, чтобы приспособиться к оптимальному объему посева. - Удалите DPBS из двух лунок с одной стороны микрорезов в устройстве с помощью пипетки P200 и посейте 250 000 NPC на устройство в 60-100 мкл 10-дневной моторной нейронной среды.
- В правом верхнем углу скважины посейте 30-50 мкл клеточной суспензии (125 000 ячеек) близко к отверстию канала под углом 45° и осторожно перетащите оставшуюся жидкость вдоль дна скважины к центру скважины кончиком пипетки.
- Сделайте паузу на несколько секунд, чтобы позволить клеточной суспензии течь через канал, прежде чем повторить это в нижней лунке (125 000 клеток в 30-50 мкл). Используйте ручку, чтобы пометить засеянную сторону «NPC» или эквивалент для удобной ориентации устройства без микроскопа.
- Инкубируют устройство при 37 °C, 5% CO2 в течение 5 мин, чтобы обеспечить прикрепление клеток перед заполнением двухсеменных лунок дополнительной средой двигательных нейронов 10 дней (всего 200 мкл/лунка) и снова инкубируют при 37 °C, 5% CO2.
ПРИМЕЧАНИЕ: Каждая скважина может содержать 200 мкл. Посев клеток как в скважинах, так и в каналах обеспечивает надежную структуру культуры, снижая риск отслоения клеток во время изменений среды. Можно посеять меньше клеток только в канале. Однако это сделает культуру более восприимчивой к объемному току через каналы во время каждого изменения среды.
- Используйте пипетку P200, чтобы удалить DPBS из двух скважин на другой стороне микроплодов напротив свежезасеянных NPC. Добавьте 200 мкл / лунку среды двигательных нейронов 10-го дня и подождите несколько секунд между верхней и нижней скважинами, чтобы позволить среде течь через канал. Затем добавьте 6 мл DPBS на чашку размером 10 см вокруг устройства, чтобы предотвратить испарение среды во время инкубации.
ПРИМЕЧАНИЕ: При необходимости добавьте дополнительные DPBS вокруг устройства в течение периода изучения и региональных параметров. - Выполните полное изменение среды двигательных нейронов в обоих отсеках устройства в день 11 (пятница), день 14 (понедельник) и день 16 (среда) (таблица 2 и таблица 3). Добавляйте свежие добавки в день смены носителя.
ПРИМЕЧАНИЕ: С этого момента выполняйте все изменения среды с помощью пипетки P200. Всегда располагайте наконечник пипетки подальше от канала на краю скважины и не удаляйте жидкость непосредственно из канала. Будьте осторожны, чтобы не отсоединить силиконовые устройства. Удаление и добавление среды следует делать медленно, чтобы предотвратить отслоение клеток.- Осторожно удалите все среды в обеих скважинах с помощью NPC, расположив наконечник пипетки P200 на нижнем краю стенки скважины напротив отверстия канала. Медленно добавьте 50-100 мкл свежей среды двигательных нейронов в верхнюю лунку, расположив наконечник пипетки P200 на верхнем краю стенки колодца напротив отверстия канала.
- Сделайте паузу на несколько секунд, чтобы позволить среде течь через канал, прежде чем добавлять 50-100 мкл среды двигательных нейронов в нижнюю лунку. Повторяйте этот процесс осторожно, пока обе скважины не будут содержать 200 мкл/лунку. Повторите на боку без ячеек.
6. Покрытие МАБ в микрофлюидных устройствах - День 17
- Примерно за 7 дней до посева МАБ в микрофлюидные устройства (10-й день дифференцировки двигательных нейронов) разморозьте МАБ и засейте их в питательную среду (таблица 1) в колбу T75, покрытую коллагеном, чтобы обеспечить достаточное расширение клеток. см. раздел 2.
- На 17-й день дифференцировки двигательных нейронов (четверг) диссоциируют МАБ, как описано на этапе 2.4, повторно суспендируют клеточную гранулу в ~ 500 мкл питательной среды и подсчитывают живые клетки, используя любой предпочтительный метод подсчета.
ПРИМЕЧАНИЕ: Как указано ниже, убедитесь, что MABs повторно снабжены в нужное количество среды, чтобы приспособиться к оптимальному объему посева. - Удалите моторную нейронную среду на несеянной стороне микрогруз в устройстве пипеткой P200, аккуратно промыть DPBS и посеять 200 000 MABs на устройство в 60-100 мкл питательной среды.
- В правом верхнем углу колодца посейте 30-50 мкл клеточной суспензии (100 000 клеток) близко к отверстию канала под углом 45° и осторожно перетащите оставшуюся жидкость вдоль дна скважины к центру скважины кончиком пипетки. Сделайте паузу на несколько секунд, чтобы позволить потоку клеток через канал перед повторением в нижней лунке (100 000 клеток в 30-50 мкл).
- Инкубируйте устройство при 37 °C, 5% CO2 в течение 5 мин, чтобы обеспечить прикрепление клеток перед заполнением двух свежезасеменных скважин MAB дополнительной питательной средой (всего 200 мкл /лунка). Снова инкубировать при 37 °C, 5% CO2.
ПРИМЕЧАНИЕ: На 17-й день на стороне двигательных нейронов устройства не требуется никаких изменений среды. Изменение среды 17-го дня в соответствии с ранее опубликованным методом дифференцировки моторных нейронов15 вместо этого выполняется на 18-й день (пятница).
7. Реализация объемного и хемотаксического градиента для стимулирования роста нейритов двигательных нейронов в сторону отсека МАБ
- На 18-й день выполните полное изменение среды на стороне двигательного нейрона со средой моторных нейронов 18-го дня (200 мкл /хорошо). Следуйте инструкциям для средних изменений, упомянутым в шагах 5.5.1-5.5.2. Инициировать дифференциацию МАБ в отсеке МАБ устройства (таблица 2 и таблица 4).
- Тщательно промывайте отсеки МАБ один раз DPBS перед добавлением предварительно нагретой дифференцировочной среды МАБ (таблица 4), дополненной 0,01 мкг/мл человеческого агрина (200 мкл/лунка).
ПРИМЕЧАНИЕ: MABs будут сливаться и образовывать многоядерные миотрубы в течение одной недели.
- Тщательно промывайте отсеки МАБ один раз DPBS перед добавлением предварительно нагретой дифференцировочной среды МАБ (таблица 4), дополненной 0,01 мкг/мл человеческого агрина (200 мкл/лунка).
- На 21 день, согласно протоколу дифференцировки двигательных нейронов (понедельник), инициируют хемотаксический и объемный градиент (таблица 2 и таблица 3).
- Добавьте 200 мкл/лунку базальной среды двигательных нейронов с 30 нг/мл нейротрофического фактора мозга (BDNF), нейротрофического фактора глиальной клеточной линии (GDNF) и цилиарного нейротрофического фактора (CNTF), человеческого агрина (0,01 мкг/мл) и ламинина (20 мкг/мл) в отсек миотрубок (ранее определенный как отсек MAB). Добавьте базальную среду двигательного нейрона (100 мкл/хорошо) без факторов роста в отсек двигательных нейронов.
- Повторяйте шаг 7.2 каждый второй день до 28 дня дифференцировки двигательных нейронов. В выходные дни смена СМИ не требуется.
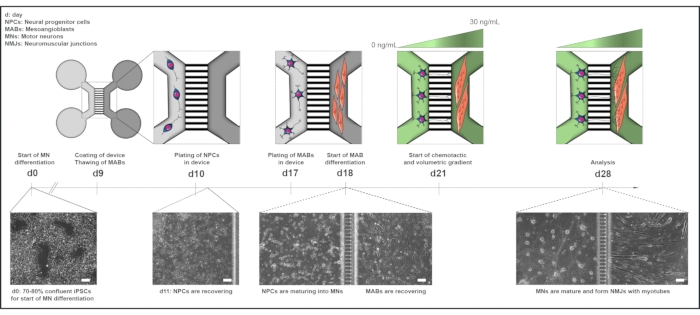
Рисунок 1: Схематический обзор протокола блока двигателя в микрофлюидных устройствах. Хронология дифференциации и кокультурный обзор с 0-го по 28-й день в соответствии с временной шкалой протокола дифференцировки двигательных нейронов22. Дифференциация двигательных нейронов от иПСК инициируется на 0-й день и выполняется, как указано ранее, в течение следующих 10 дней15. На 9 день устройство стерилизуют и покрывают ПЛО-ламинином. MAB размораживают для расширения в колбах T75. На 10 день двигательные нейроны-NPC покрываются как в колодцах, так и в канале одного отсека (светло-серого) устройства, где их дифференцировка в двигательные нейроны продолжается в течение недели. МАБ покрываются как в скважинах, так и в канале противоположного отсека (темно-серый) на 17-й день. На 18 день начинается дифференциация МАБ в миотубы. На 21 день устанавливается объемный и хемотаксический градиент для содействия поляризации двигательных нейронов-нейритов через микрогрузы прибора. Отсек моторных нейронов получил 100 мкл/лунку базальной среды двигательного нейрона без факторов роста (светло-зеленый компартмент), в то время как отсек миотрубы получил 200 мкл/лунку базальной среды моторного нейрона с 30 нг/мл факторов роста (темно-зеленый компартмент) (таблица 2 и таблица 3). Культивирование продолжают с объемным и хемотактическим градиентом в течение дополнительных 7 дней до анализа на 28-й день. Изображения яркого поля показывают морфологию клеток на 0-й день, 11-й день, 18-й день и 28-й день культивируемые в предварительно собранных микрофлюидных устройствах. Шкала, 100 мкм. Эта цифра была изменена по сравнению с Stoklund Dittlau, K. et al.18. Иллюстрации клеток были изменены из Smart Server medical Art22. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
8. Фиксация и ICC
ПРИМЕЧАНИЕ: Все шаги должны быть сделаны осторожно, чтобы предотвратить отслоение нейронных культур. Не удаляйте жидкость из каналов во время следующих шагов.
- Выполните фиксацию в вытяжном шкафу или ламинарном потоке: тщательно промывайте все колодцы в устройстве один раз с DPBS перед фиксацией. Фиксируют с помощью 4% параформальдегида (ПФА) в DPBS в течение 15-20 мин при РТ в ламинарном потоке (100 мкл/лунка).
ВНИМАНИЕ: PFA токсичен: ручка в вытяжном шкафу с помощью средств индивидуальной защиты.- Осторожно добавьте 100 мкл в верхнюю лунку устройства и подождите несколько секунд, чтобы раствор для фиксации протекал через канал, прежде чем добавлять 100 мкл в нижнюю лунку. Повторите с другой стороны. После инкубации удалите раствор PFA и аккуратно промойте 3x в течение 5 мин с DPBS. Оставьте в 200 мкл/лунку DPBS для хранения и запечатайте 10-сантиметровую чашку Петри парапленкой для хранения при 4 °C до эксперимента ICC.
ПРИМЕЧАНИЕ: Убедитесь, что устройства не высыхают во время хранения.
- Осторожно добавьте 100 мкл в верхнюю лунку устройства и подождите несколько секунд, чтобы раствор для фиксации протекал через канал, прежде чем добавлять 100 мкл в нижнюю лунку. Повторите с другой стороны. После инкубации удалите раствор PFA и аккуратно промойте 3x в течение 5 мин с DPBS. Оставьте в 200 мкл/лунку DPBS для хранения и запечатайте 10-сантиметровую чашку Петри парапленкой для хранения при 4 °C до эксперимента ICC.
- Инкубируют клетки пермеабилизирующим раствором (100 мкл/лунка) 0,1% тритона Х-100 в DPBS в течение 20 мин при РТ на 1-й день процедуры ICC. Удалите раствор для пермеабилизации и добавьте 5% обычную ослиную сыворотку в 0,1% раствор Triton X-100/DPBS (100 мкл/лунка) в течение 30 мин при RT.
- Удалите 5% нормальный раствор сыворотки осла и инкубируйте устройства с первичными антителами (Таблица материалов) в 2% нормальной ослиной сыворотке в 0,1% растворе Triton X-100 / DPBS и инкубируйте при 4 °C в течение ночи.
- Реализация градиента объема. Добавьте 100 мкл/лунку раствора антител с одной стороны микрорезов и 150 мкл/лунку с другой (всего 500 мкл на устройство).
ПРИМЕЧАНИЕ: Можно использовать различные антитела по обе стороны от микроплот. В этом случае не реализуйте градиент объема с первичными или вторичными антителами через микрорезы для поддержания жидкостной изоляции между компартментами. Нейриты в микроактивах не будут окрашены без градиента.
- Реализация градиента объема. Добавьте 100 мкл/лунку раствора антител с одной стороны микрорезов и 150 мкл/лунку с другой (всего 500 мкл на устройство).
- На следующий день (день 2 процедуры ICC) удалите первичные антитела и тщательно промыть устройство 3 раза в течение 5 мин 0,1% раствором Triton X-100/DPBS.
ПРИМЕЧАНИЕ: В легко снимаемых культурах промывка 3x в течение 5 минут может быть заменена на 1x в течение 30 минут. - Отныне работают в темноте, так как вторичные антитела (Таблица материалов) светочувствительны. Инкубировать клетки со вторичными антителами в 2% нормальной ослиной сыворотке в 0,1% растворе Triton X-100/DPBS в течение 1 ч при RT. Реализуют градиент объема, как указано в шаге 8.3.1. После инкубации удаляют вторичные антитела и промывают 3 раза в течение 5 мин с DPBS.
- Маркировка ядерной ДНК с помощью DAPI в DPBS (100 мкл/лунка) в течение 20 мин при RT с последующей промывкой 3x-4x 5 мин 0,1% раствором Triton X-100/DPBS. Извлеките 0,1% раствор Triton X-100/DPBS из всех скважин и дайте культуре высохнуть в течение нескольких секунд, прежде чем добавить одну каплю флуоресцентной монтажной среды в каждую скважину для герметизации.
ПРИМЕЧАНИЕ: Держите устройства горизонтально в течение не менее 24 часов, чтобы можно было установить монтажный носитель. Через 24 ч устройства можно хранить в скользящем корпусе при 4 °C. - Изображение в z-стеках с помощью инвертированного микроскопа.
- Чтобы получить изображение NMJ, используйте 40-кратный объектив, чтобы найти миотрубки, отмеченные антителом к миотрубам (Таблица материалов), и выполнить записи z-стека для обеспечения визуализации нейронной и миотрубной тканей. Сделайте несколько изображений в случае, если миотуба слишком велика, чтобы поместиться в одном кадре.
- Для количественной оценки NMJ вручную подсчитайте количество колокализаций между нейрональным пресинаптическим маркером и маркером AChR через каждый z-стек. Нормализуйте количество соклатилизаций до числа миотуб, присутствующих в z-стеке.
9. Фиксация и подготовка прибора к СЭМ
ПРИМЕЧАНИЕ: При замене жидкости всегда держите небольшое количество, чтобы покрыть культуру, чтобы избежать коллапса клеток. В этом протоколе используются высокотоксичные вещества, и требуется работать со средствами индивидуальной защиты и в вытяжном шкафу в течение всего процесса.
- Фиксация и разборка: Приготовьте свежий 2,5% глутаровый альдегид (GA) в буфере какодилата натрия 0,1 М (рН 7,6), фильтр с фильтром 0,2 мкм и нагрейте до 37 °C.
ВНИМАНИЕ: ГА и какодилат натрия токсичны: ручка в вытяжке с помощью средств индивидуальной защиты.- Тщательно промыть устройство один раз с DPBS, чтобы удалить среду и клеточный мусор, а затем прикрепить раствор GA в течение 15 мин при RT.
- Используйте скальпель, чтобы аккуратно вырезать лист SEM по периметру устройства, укрепляя устройство щипцами. Убедитесь, что устройство не отсоединяется во время резки. Переместите устройство и лист SEM с помощью щипцов на чашку Петри 3 см и поместите чашку 3 см в чашку 10 см для удобства обработки.
- После 15 минут префиксации аккуратно извлеките устройство из листа SEM с помощью щипцов. Отсоедините устройство в одном углу и медленно снимите его по диагонали в сторону противоположного угла. Наблюдайте, как клетки отделяются от устройства.
- Добавьте дополнительный раствор GA, чтобы покрыть весь лист SEM в посуде 3 см и продолжайте фиксацию в общей сложности 2 ч при RT или на ночь при 4 °C.
ПРИМЕЧАНИЕ: Осторожно проталкивайте лист SEM под раствор GA щипцами, избегая любых покрытых клетками поверхностей.
- Продолжайте использовать стандартный протокол для SEM. Короче говоря, инкубация в тетроксиде осмия с последующим обезвоживанием с градуированным рядом этанола. Вставьте лист SEM в держатель крышки для сушки в критической точке и установите на опорные заглушки для углеродных наклеек и покрытия. Используйте сканирующий электронный микроскоп для получения изображения при ускоряющем напряжении 5 кВ и рабочем расстоянии 7 мм.
10. Оценка функциональности NMJ с помощью визуализации кальция живыми клетками
- Подготовительные устройства: Обновите отсек миотруб 200 мкл/лунку базальной среды двигательных нейронов 18 дня с 30 нг/мл BDNF, GDNF и CNTF и отсек двигательных нейронов с 200 мкл/лунку базальной среды двигательного нейрона без факторов роста (Таблица 2 и Таблица 3).
- Добавьте краситель Fluo-4 AM, разведенный в растворителе красителя Fluo-4, в отсек миотрубок в конечной концентрации 5 мкМ и инкубируйте устройство в темноте при 37 °C, 5% CO2 в течение 25 мин. Пока устройство находится в инкубации, разводят хлорид калия в базальной среде двигательных нейронов без факторов роста при конечной концентрации 450 мМ.
ПРИМЕЧАНИЕ: Fluo-4 AM является показателем кальция, который демонстрирует увеличение флуоресценции при связывании кальция. Отныне работайте в темноте, так как краситель светочувствительный. - Через 25 мин обновите отсек миотруб 200 мкл/лунку базальной среды моторного нейрона 18-го дня с 30 нг/мл BDNF, GDNF и CNTF и отсек двигательных нейронов со 100 мкл/лунку базальной среды двигательного нейрона без факторов роста для восстановления хемотаксического и объемного градиента.
- Чтобы блокировать NMJ, дополните среду миотрубного компартмента 19 мкМ конкурентного антагониста AChR тубокурарина гидрохлорида пентагидрата.
ВНИМАНИЕ: Пентагидрат тубокурарина гидрохлорида токсичен: ручка в вытяжном шкафу со средствами индивидуальной защиты.
- Добавьте краситель Fluo-4 AM, разведенный в растворителе красителя Fluo-4, в отсек миотрубок в конечной концентрации 5 мкМ и инкубируйте устройство в темноте при 37 °C, 5% CO2 в течение 25 мин. Пока устройство находится в инкубации, разводят хлорид калия в базальной среде двигательных нейронов без факторов роста при конечной концентрации 450 мМ.
- Выполняйте записи с помощью инвертированного конфокального микроскопа, оснащенного инкубатором, настроенным на 37 °C, 5% CO2.
- С 10-кратным объективом используйте яркий полевой канал, чтобы найти миотубы в отсеке миотуб. Отрегулируйте мощность, усиление и смещение лазера для канала 488 до уровня, при котором флуоресценция Fluo-4 отмечает отдельные миотрубы.
ПРИМЕЧАНИЕ: Репрезентативные результаты были получены путем настройки полос прокрутки в настройках A1 программного обеспечения на мощность лазера 5%, коэффициент усиления 60 (HV) и смещение 0.
- С 10-кратным объективом используйте яркий полевой канал, чтобы найти миотубы в отсеке миотуб. Отрегулируйте мощность, усиление и смещение лазера для канала 488 до уровня, при котором флуоресценция Fluo-4 отмечает отдельные миотрубы.
- Установите время записи на 1 мин с интервалом 1 с. Запись в течение 5-10 с должна иметь исходный уровень, с последующим немедленной стимуляцией двигательных нейронов раствором хлористого калия.
- Через 5-10 с в запись медленно добавляют 25 мкл раствора хлористого калия в один колодец отсека двигательных нейронов, чтобы достичь конечной концентрации 50 мМ.
ПРИМЕЧАНИЕ: Избегайте добавления раствора хлористого калия слишком быстро, так как это создаст волну через канал, вызывая артефакты на записи.
- Через 5-10 с в запись медленно добавляют 25 мкл раствора хлористого калия в один колодец отсека двигательных нейронов, чтобы достичь конечной концентрации 50 мМ.
- Запишите отсек миотрубок стимуляцией двигательных нейронов дважды с 2-минутной паузой, за которой следует прямая стимуляция раствором хлорида калия 25 мкл отсека миотрубок для оценки прямой активности миотруб независимо от деполяризации двигательных нейронов.
- Для количественной оценки обведите каждую миотубу вручную с помощью записывающего программного обеспечения и проанализируйте интенсивность флуоресценции Fluo-4 в течение 1-минутного периода времени. Чтобы определить увеличение притока кальция, вычтите среднее исходное значение (т.е. среднее от первых 10 с до стимуляции хлоридом калия) из пикового значения после стимуляции хлоридом калия. Репрезентативные результаты были получены с использованием программного инструмента измерения времени.
Результаты
Генерация NMJ в микрофлюидных устройствах
Для создания двигательной единицы человека с функциональными NMJ в коммерчески доступных микрофлюидных устройствах использовались человеческие моторные нейроны, полученные из iPSC, и человеческие миотрубы, полученные из MAB. Качество исходного клеточного материала имеет важное значение, и особенно способность к слиянию МАБ в миотрубы имеет решающее значение для успешного результата этого протокола. MAB легко сохранить в культуре. Однако важно оценить способность каждой партии к синтезу перед нанесением их на микрофлюидные устройства (дополнительный рисунок 1A, B)18. Любые партии, которые не показывают образования миотубов после 10 дней дифференцировки, использовать не следует. Индекс слияния на дополнительном рисунке 1B определяли путем расчета процента ядер в миотрубах, положительного для каждого маркера миотубок от общего числа ядер на изображение. Мы обнаружили, что индекс слияния примерно в 8% был достаточным для нашей совместной культуры при создании NMJ.
Всегда важно начинать дифференциацию двигательных нейронов с чистой культуры иПСК. Чем чище вход - тем чище результат. Протокол дифференцировки моторных нейронов генерирует культуры моторных нейронов, которые обычно на 85-95% положительны для маркеров двигательных нейронов (дополнительный рисунок 1C, D)18. Остальные клетки обычно будут недифференцированными клетками-предшественниками, которые в некоторых случаях будут подвергаться обширной пролиферации и тем самым оказывать негативное влияние на качество культуры. Чтобы получить наилучший результат этого протокола, эффективность дифференцировки моторных нейронов должна быть оценена перед применением 10 моторных нейронов-NPC в устройство. Кроме того, проверка качества NPC может быть выполнена на 11-й день для оценки выражения маркера NPC Olig2 (дополнительный рисунок 1E,F).
Первоначально двигательные нейроны-NPC и MABs были покрыты в один и тот же момент времени на 10-й день. Здесь дифференциация MAB была начата на 11-й день. Градиент объема и фактора роста, реализованный на 14-й день, позволил оценить формирование NMJ на 21-й день, тем самым сократив протокол на одну неделю. Интересно, что мы могли наблюдать характерное формирование NMJ ICC (дополнительный рисунок 2A). Тем не менее, мы не смогли получить функциональный выход через записи кальция живых клеток на ранней стадии дифференцировки двигательных нейронов (данные не показаны). Мы пришли к выводу, что двигательные нейроны еще недостаточно зрелы, чтобы сформировать функциональные связи NMJ с миотрубами, хотя морфология NMJ выглядела многообещающей. Это согласуется с нашими предыдущими наблюдениями о том, что спонтанные потенциалы действия в двигательных нейронах, зарегистрированные с помощью электрофизиологического анализа, происходят только на 35-й день дифференцировки двигательных нейронов15.
Кроме того, мы попытались продлить созревание двигательных нейронов, а также устойчивость кокультуры, созревая двигательные нейроны в устройстве в течение 2 недель (день 24), прежде чем покрыть MABs. К сожалению, наблюдалось большое количество спонтанного пересечения двигательных нейронов-нейритов через микрогрузы, что привело к ингибированию прикрепления МАБ (дополнительный рисунок 2B). Из-за отсутствия образования миотуба в канале нам не удалось идентифицировать NMJ на 36-й день и поэтому мы применили 28-дневный протокол (рисунок 1).
Идентификация, количественная оценка и морфологическая характеристика NMJ in vitro
После следования 28-дневному протоколу (рисунок 1) можно было получить полнофункциональные NMJ. Как in vivo, так и in vitro NMJ характеризуются иммуногисто- или иммуноцитохимически путем совместной локализации пресинаптического маркера и постсинаптического маркера. В этом исследовании использовалась комбинация тяжелой цепи нейрофиламента (NEFH) и SYP в качестве комбинации пресинаптических маркеров, что позволило проследить за одним нейритом от сомы двигательного нейрона к наиболее дистальному процессу. Что касается мышц, Btx широко используется в качестве постсинаптического маркера для AChR, и также использовался в этом исследовании. Добавление агрина и ламинина способствует кластеризации AChR в сарколемме19,20,21, что облегчает идентификацию AChR in vitro, а также увеличивает количество присутствующих AChR и NMJ18.
Чтобы найти и рассчитать NMJ непредвзятым образом, каждая миотруба идентифицируется с помощью миозиновой тяжелой цепи (MyHC)-позитивности и визуализируется в z-стеках при 40-кратном увеличении с использованием перевернутого конфокального микроскопа. Для очень длинных миотубок было приобретено несколько z-стеков. Для анализа изображений количество совместительств между NEFH/SYP и Btx подсчитывается вручную через каждый z-стек, а число сокультализаций нормализуется до числа миотуб, присутствующих в z-стеке (рисунок 2A-C)18. Не все миотубы будут иметь NMJ, как видно из количественной оценки иннервированных миотуб (рисунок 2D). Следовательно, важно выполнять непредвзятый подход к записи, где все миотубы визуализируются, независимо от присутствия Btx.
В этой системе in vitro можно выделить два типа морфологий. NMJ либо выглядят как nmJ с одной контактной точкой, где нейрит касается кластера AChR в одной точке взаимодействия, либо как несколько nmJ точек контакта, где нейрит будет раздуваться и взаимодействовать с кластером AChR на большей поверхности. Эти две морфологии могут быть идентифицированы как иммуноцитохимически (рисунок 2A)18 , так и с помощью SEM (рисунок 2B)18, и также могут быть количественно определены (рисунок 2C)18. В целом, несколько точек контакта способствуют более широкому соединению через большое мышечное встраивание, что указывает на более зрелое образование NMJ. Напротив, NMJ с одной точкой контакта считаются менее зрелыми из-за раннего состояния развития культуры.
Функциональная оценка NMJ in vitro
Для оценки функциональности NMJ использовали записи переходных процессов кальция в живых клетках (рисунок 3)18. Используя преимущества жидкостно изолированной системы микрофлюидных устройств, сторону сомы двигательных нейронов стимулировали высокой концентрацией (50 мМ) хлорида калия при одновременной регистрации притока кальция в миотрубы, которые были загружены кальциечувствительным красителем Fluo-4 (рисунок 3A). Почти сразу после активации двигательных нейронов мы могли наблюдать приток кальция в миотрубы через характерное волновое образование, что подтверждает функциональную связь через двигательный нейрон-нейрит и миотрубу (рисунок 3A-C)18. Не наблюдалось ни спонтанных волн кальция, ни спонтанных сокращений миотубов, хотя при прямой стимуляции хлоридом калия не наблюдалось сокращения миотубов. Специфичность соединения была дополнительно подтверждена добавлением конкурентного антагониста AChR, пентагидрата тубокурарина гидрохлорида (DTC) в компартмент миотруб (рисунок 3A), что привело к ингибированию притока кальция (рисунок 3C). Этот эффект подтвердил, что связь между моторными нейронами и миотрубами привела к полностью функциональным NMJ. Чтобы оценить количество активных миотубов с помощью стимуляции NMJ, миотрубный компартмент стимулировали непосредственно хлоридом калия для определения общего числа активных миотубов в этом отсеке. Приблизительно 70% миотруб были активны через стимуляцию двигательными нейронами активации хлоридом калия (рисунок 3D)18.
Эти результаты подтверждают оптимальное формирование, количество, морфологию и функциональность NMJ путем совместного культивирования моторных нейронов, полученных из iPSC, и миотуб, полученных из MAB, в течение 28-дневного протокола.
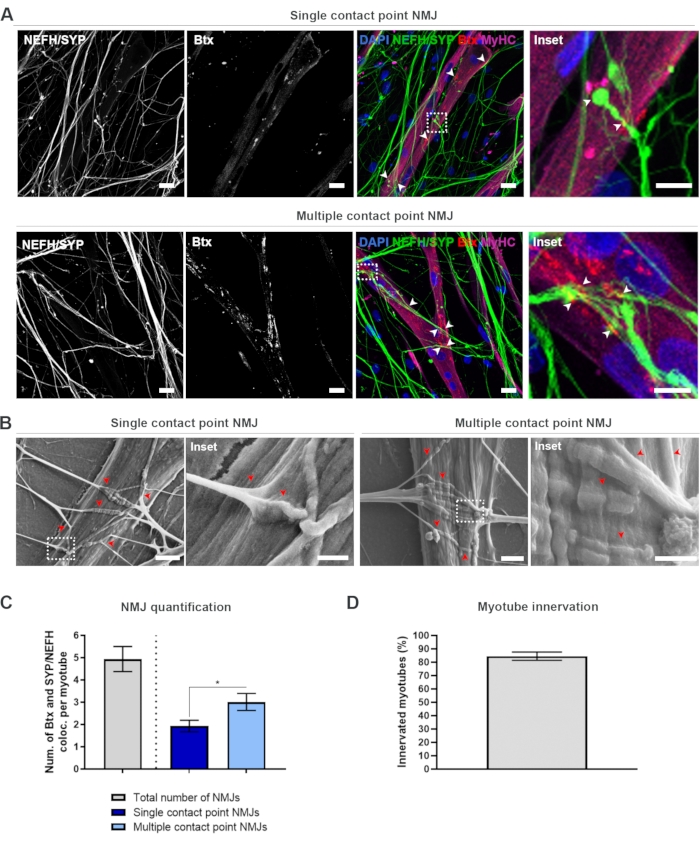
Рисунок 2: Формирование NMJ в микрофлюидных устройствах. (A) Конфокальные микроснимки образования NMJ в предварительно собранных микрофлюидных устройствах на 28 день. NMJ идентифицируются путем совместной локализации (наконечники стрел) пресинаптических маркеров (NEFH и SYP) и постсинаптического маркера AChR (Btx) на миотубах, окрашенных MyHC. NMJ идентифицируются морфологически путем формирования одной или нескольких точек контакта между нейритами и кластерами AChR. Ядра метки DAPI. Шкала, 25 мкм. Вставка показывает увеличение NMJ. Вставка шкалы, 10 мкм. (B) SEM морфологии NMJ в силиконовых микрофлюидных устройствах на 28 день. Наконечники стрел изображают встраивание нейритов в миотрубу. Шкала, 2 мкм. Вставка показывает увеличение NMJ. Шкала вставки, 1 мкм. (C) Количественная оценка общего числа НМЮ на миотрубу, а также числа НМЮ с одной и несколькими контактными точками на миотрубу. График показан как среднее ± стандартной погрешности среднего от четырех биологических реплик. Статистическая значимость определяется с помощью теста Манна-Уитни с * p < 0,05. (D) Количественная оценка процентной доли иннервированных миотубов. График показан как среднее ± стандартной погрешности среднего от четырех биологических реплик. Эта цифра была изменена по сравнению с Stoklund Dittlau, K. et al.18. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
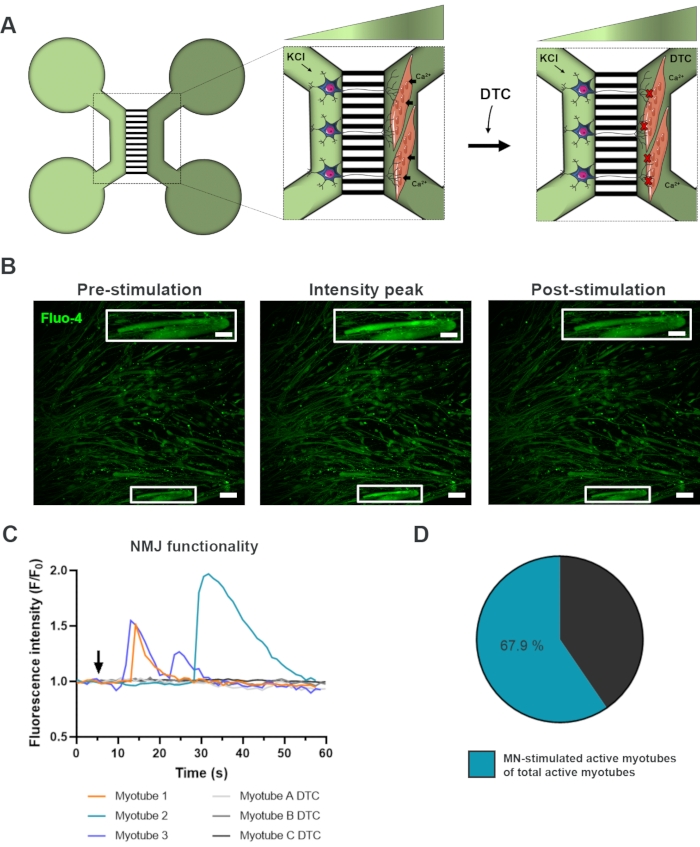
Рисунок 3: Подтверждение функциональности NMJ. (A) Схематическая иллюстрация записей переходного кальция в живых клетках функциональности NMJ в предварительно собранных микрофлюидных устройствах на 28-й день до и после закупорки NMJ тубокурарином (DTC)22. Двигательные нейроны в светло-зеленом отсеке стимулируются 50 мМ хлорида калия (KCl), который вызывает внутриклеточный ответ двигательного нейрона через нейриты. Это вызывает приток кальция (Ca2+) в миотрубы, которые помечены чувствительным к кальцию красителем Fluo-4 (темно-зеленый отсек). (B) Флуоресцентные микроснимки флуоресценции флуо-4 предварительной стимуляции, пика интенсивности и постстимуляции миотрубы, изображающие волну внутриклеточного увеличения кальция при стимуляции двигательных нейронов KCl. Вставка показывает увеличение иннервированной активной миотрубы. Шкала стержней, 100 мкм. Шкала вставки, 200 мкм. (C) Репрезентативные кривые притока кальция в миотрубах после стимуляции двигательных нейронов kCl (стрелкой), подтверждающей функциональность NMJ. Myotube 1-3 показывают характерные кривые кальция через иннервацию двигательных нейронов-миотруб, в то время как миотруба A-C DTC изображает кривые после блокировки NMJ DTC. (D) Отношение активных миотуб, стимулируемых двигательными нейронами, к общему числу активных миотрубок. Эта цифра была изменена по сравнению с Stoklund Dittlau, K. et al.18. Иллюстрации клеток были изменены из Smart Server medical Art22. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Проверка моторных нейронов, индекс слияния MAB и контроль качества NPC. (A) Конфокальные изображения миотуб, полученных из MAB, через 10 дней после начала дифференцировки. Миотубы маркируются маркерами миотубей: десмин, MyHC, миогенин (MyoG) и титин. Ядра окрашиваются DAPI. Шкала бара, 100 мкм. (B) Количественная оценка индекса слияния МАБ через 10 дней после начала дифференцировки. После голодания MABs сливаются в многоядерные миотрубки, которые были количественно определены для положительности маркера миотубов (AB+). График изображает среднее ± стандартной погрешности среднего от трех биологических реплик. (C) Конфокальные изображения моторных нейронов, полученных из iPSC, на 28-й день дифференцировки, которые помечены маркерами моторных нейронов NEFH, холинацетилтрансферазой (ChAT) и островком-1 в дополнение к паннейрональному маркеру βIII-тубулину (Тубулин). Ядра окрашиваются DAPI. Шкала баров, 75 мкм. (D) Количественная оценка количества клеток, которые являются положительными для моторных нейронов и паннейрональных маркеров (AB+). График изображает среднее ± стандартной погрешности среднего от трех биологических реплик. (E) Конфокальные изображения NPC-производных iPSC на 11-й день дифференцировки двигательных нейронов, которые помечены NPC-маркером Olig2 и паннейрональным маркером βIII-тубулином (Тубулин). Ядра окрашиваются DAPI. Шкала баров, 50 мкм. (F) Количественная оценка числа NPC, которые являются положительными для Olig2 и βIII-тубулина (AB+). График изображает среднее ± стандартной погрешности среднего от трех биологических реплик. Эта цифра была изменена по сравнению с Stoklund Dittlau, K. et al.18. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Оптимизация протокола кокультуры (A) Конфокальные изображения формирования NMJ на 21-й день дифференцировки двигательных нейронов, когда MAB засеиваются в тот же момент времени, что и NPC на 10-й день. NMJ идентифицируются путем совместной локализации (наконечники стрел) пресинаптических маркеров (NEFH и SYP) и постсинаптического маркера AChR (Btx) на миотубах, окрашенных MyHC. Шкала (слева), 10 мкм. Шкала (справа), 5 мкм. (B) Ярко-полевое изображение канала миотуба на 24-й день, изображающее спонтанное пересечение моторных нейронов и нейритов, ингибирующее прикрепление MABs. Шкала, 100 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
| Реагент | Концентрация запасов | Конечная концентрация |
| ИМДМ | в 1 раз | 80% |
| Фетальная бычья сыворотка | 15% | |
| Пенициллин/Стрептомицин | 5000 ЕД/мл | 0.5% |
| L-глютамин | в 50 раз | 1% |
| Пируват натрия | 100 мМ | 1% |
| Заменимые аминокислоты | в 100 раз | 1% |
| Инсулин трансферрин селен | в 100 раз | 1% |
| bFGF (добавлен свежий) | 50 мкг/мл | 5 нг/мл |
Таблица 1: Среда роста МАБ. Среда может длиться 2 недели при 4 °C. bFGF добавляют свежим в день использования.
| Реагент | Концентрация запасов | Конечная концентрация |
| ДМЭМ/Ф12 | 50% | |
| Нейробазальная среда | 50% | |
| Пенициллин/Стрептомицин | 5000 ЕД/мл | 1% |
| L-глютамин | в 50 раз | 0.5 % |
| Дополнение N-2 | в 100 раз | 1% |
| B-27 без витамина А | в 50 раз | 2% |
| β-меркаптоэтанол | 50 мМ | 0.1% |
| Аскорбиновая кислота | 200 мкМ | 0.5 мкМ |
Таблица 2: Базальная среда двигательных нейронов. Средний может длиться 4 недели при 4 °C.
| День | Реагент | Концентрация запасов | Конечная концентрация | Отделение |
| День 10/11 | Сглаженный агонист | 10 мМ | 500 нМ | Оба |
| Ретиноевая кислота | 1 мМ | 0,1 мкМ | ||
| ДАПТ | 100 мМ | 10 мкМ | ||
| БДНФ | 0,1 мг/мл | 10 нг/мл | ||
| ГДНФ | 0,1 мг/мл | 10 нг/мл | ||
| День 14 | ДАПТ | 100 мМ | 20 мкМ | Оба |
| БДНФ | 0,1 мг/мл | 10 нг/мл | ||
| ГДНФ | 0,1 мг/мл | 10 нг/мл | ||
| День 16 | ДАПТ | 100 мМ | 20 мкМ | Оба |
| БДНФ | 0,1 мг/мл | 10 нг/мл | ||
| ГДНФ | 0,1 мг/мл | 10 нг/мл | ||
| ЦГТФ | 0,1 мг/мл | 10 нг/мл | ||
| День 18 | БДНФ | 0,1 мг/мл | 10 нг/мл | Двигательный нейрон |
| ГДНФ | 0,1 мг/мл | 10 нг/мл | ||
| ЦГТФ | 0,1 мг/мл | 10 нг/мл | ||
| День 21+ | БДНФ | 0,1 мг/мл | 30 нг/мл | Миотубе |
| ГДНФ | 0,1 мг/мл | 30 нг/мл | ||
| ЦГТФ | 0,1 мг/мл | 30 нг/мл | ||
| Агрин | 50 мкг/мл | 0,01 мкг/мл | ||
| Ламинин | 1 мг/мл | 20 мкг/мл | ||
| День 21+ | Без добавок | Двигательный нейрон |
Таблица 3: Добавки среды моторных нейронов. Добавки добавляются свежими в день использования в базальную среду двигательного нейрона.
| День | Реагент | Концентрация запасов | Конечная концентрация | Отделение |
| День 18 | ДМЭМ/Ф12 | 97% | МАБ | |
| Пируват натрия | 100 мМ | 1% | ||
| Конская сыворотка | 2% | |||
| Агрин | 50 мкг/мл | 0,01 мкг/мл |
Таблица 4: Среда дифференциации МАБ. Средний может длиться 2 недели при 4 °C. Агрин добавляется свежим в день использования.
Обсуждение
Протокол описывает относительно простой в использовании метод, который генерирует двигательные единицы человека с функциональными NMJ в коммерчески доступных микрофлюидных устройствах менее чем за 30 дней. Описано, как NMJ могут быть оценены морфологически с помощью стандартных методов, таких как ICC и SEM, и функционально с помощью записей кальция живых клеток.
Большим преимуществом данного протокола является использование технологии стволовых клеток. Это обеспечивает полную адаптивность, при которой НМЮ могут быть оценены как по здоровью, так и по заболеванию, независимо от профиля донора. Модель уже оказалась успешной и полезной в исследованиях БАС, где мы идентифицировали нарушения в росте нейритов, восстановлении роста и числах NMJ как новых фенотипов из-за мутаций в гене FUS18. С помощью этой модели можно расширить исследования, включив в них спорадические формы БАС, где этиология неизвестна, используя ИПСК у спорадических пациентов с БАС. Это дает преимущество перед традиционными животными моделями, которые полагаются на трансгенную сверхэкспрессию мутированных генов для повторения болезни человека23,24. Кроме того, наша полностью человеческая система позволяет потенциально повторять специфическую для человека физиологию и болезнь. Предыдущие исследования продемонстрировали различия между морфологией NMJ грызунов и человека25, что говорит о том, что необходимо соблюдать осторожность при использовании грызунов для лечения патологии NMJ человека. Хотя эта система представляет собой относительно простую установку in vitro, которой не хватает сложности модели in vivo, можно было продемонстрировать, что морфология NMJ, отображаемая в микрофлюидных устройствах, напоминала NMJ ампутатов человека25. Кроме того, эта модель позволяет оценивать NMJ во время формирования и созревания NMJ, потенциально выявляя ранние фенотипы заболевания, которые отсутствуют, неидентифицируемы или упускаются из виду в посмертных образцах человека.
MABs обеспечивают допустимый вариант генерации миотубов, хотя их ограниченная выживаемость в 10 дней является недостатком системы. Выживание myotube зависит от их прикрепления к поверхности, что, вероятно, скомпрометировано спонтанными сокращениями миофиберов. Через более чем 10 дней большинство миотубов отсоединятся, что сделает культуру NMJ непригодной для использования. В идеале миотубы также должны генерироваться из iPSCs. Однако современные протоколы оказалось трудно воспроизвести26 из-за изменчивости индекса слияния27,28,29,30.
Используя коммерчески доступные микрофлюидные устройства, мы создали стандартизированную систему, которая является полностью доступной. Другие модели NMJ существуют31,32,33,34,35,36,37,38,39,40,41,42. Тем не менее, они обычно полагаются на одиночные отсеки, в которых отсутствует компартментализация и жидкостная изоляция между типами клеток, или на изготовленные на заказ сосуды для культивирования, что снижает доступность и, возможно, также воспроизводимость. Микрофлюидные устройства, используемые для этого протокола, могут быть приобретены с микроплотами различной длины, что позволяет проводить дальнейший анализ, такой как аксональный транспорт43,44 или аксотомия18,45,46 исследований. Жидкостная изоляция между компартментами дополнительно позволяет проводить компартментированную медикаментозную обработку двигательных нейронов или миотрубок, что может быть благоприятным в развитии терапии. Появилось больше компаний, специализирующихся на микрофлюидике, которые открылись для большого выбора дизайна и функций устройств, что еще больше способствовало доступности исследований in vitro.
В заключение, мы разработали протокол, обеспечивающий надежный, универсальный и простой метод культивирования двигательных единиц человека с функциональными NMJ.
Раскрытие информации
L.V.D.B. имеет патент на использование ингибиторов HDAC при болезни Шарко-Мари-Тута (US-2013227717-A1), является научным соучредителем Augustine Therapeutics и членом ее научно-консультативного совета. Другие авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Авторы благодарят Никки Кортхаута и Себастьяна Мунка из LiMoNe, исследовательской группы молекулярной нейробиологии (VIB-KU Leuven) за их советы по записям переходной флуоресценции кальция живыми клетками. Это исследование было поддержано Комиссией Фулбрайта в Бельгии и Люксембурге, KU Leuven (C1 и Фонд «Открывая будущее»), VIB, Агентством по инновациям в области науки и техники (IWT; SBO-iPSCAF), «Фонд научных исследований Фландрии» (FWO-Vlaanderen), Target ALS, ALS Liga België (A Cure for ALS), правительство Бельгии (Межуниверситетская программа привлечения полюсов P7/16, инициированная Бельгийским федеральным управлением по научной политике), Фонд Тьерри Латрана и «Ассоциация belge contre les Maladies neuro-Musculaires» (ABMM). T.V. и J.B. поддерживаются стипендиями Ph.D., присуждаемыми FWO-Vlaanderen.
Материалы
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
Ссылки
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены