Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Репортерный клеточный анализ для мониторинга эффективности сплайсинга
В этой статье
Резюме
Этот протокол описывает минигенный репортерный анализ для мониторинга влияния мутаций 5-образного сайта сращивания на сплайсинг и разрабатывает супрессор U1 snRNA для спасения ингибирования сплайсинга, вызванного мутациями. Конструкции репортера и супрессора U1 snRNA экспрессируются в клетках HeLa, а сплайсинг анализируется путем праймерного расширения или ОТ-ПЦР.
Аннотация
Во время экспрессии генов жизненно важный этап сплайсинга пре-мРНК включает в себя точное распознавание участков сращивания и эффективную сборку сплайсеосомальных комплексов для соединения экзонов и удаления интронов до цитоплазматического экспорта зрелой мРНК. Эффективность сплайсинга может быть изменена наличием мутаций в местах сращивания, влиянием транс-действующих факторов сплайсинга или активностью терапевтических средств. Здесь мы описываем протокол для клеточного анализа, который может быть применен для мониторинга эффективности сплайсинга любого данного экзона. В анализе используется адаптируемый плазмидный закодированный 3-экзон/2-интронный минигенный репортер, который может быть экспрессирован в клетках млекопитающих путем транзиторной трансфекции. После трансфекции выделяют общую клеточную РНК, а эффективность сплайсинга экзонов в репортерной мРНК определяют либо расширением праймера, либо полуколичественной обратной транскриптазно-полимеразной цепной реакцией (ОТ-ПЦР). Мы описываем, как влияние связанных с заболеванием 5' мутаций сращивания может быть определено путем введения их в репортер; и как подавление этих мутаций может быть достигнуто путем совместной трансфекции с конструкцией малой ядерной РНК (snRNA) U1, несущей компенсаторные мутации в ее 5'-области, которая базирует пары с 5'-сращивающимися участками на экзон-интронных переходах в премРНК. Таким образом, репортер может быть использован для проектирования терапевтических частиц U1 для улучшения распознавания мутантных 5' сращивающихся сайтов. Вставка цис-действующих регуляторных сайтов, таких как последовательности усилителя сращивания или глушителя, в репортер также может быть использована для изучения роли U1 snRNP в регулировании, опосредованном конкретным альтернативным фактором сплайсинга. Наконец, репортерные экспрессирующие клетки могут быть инкубированы с небольшими молекулами для определения влияния потенциальных терапевтических средств на конститутивное сплайсинг пре-мРНК или на экзоны, несущие мутантные 5' места сращивания. В целом, репортерный анализ может быть применен для мониторинга эффективности сплайсинга в различных условиях для изучения фундаментальных механизмов сплайсинга и заболеваний, связанных со сплайсингом.
Введение
Сплайсинг пре-мРНК является важным этапом обработки, который удаляет некодирующие интроны и точно кодирует кодирующие экзоны для формирования зрелой мРНК. Распознавание консенсусных последовательностей на экзон-интронных переходах, называемых 5'-сращивающим участком и 3'-сращивающим участком, компонентами сращивающего механизма инициирует процесс сращивания. Малый ядерный рибонуклеопротеин U1 (snRNP) распознает сайт 5'-сращивания путем спаривания основания snRNA U1 с пре-mRNA1. Генетически унаследованные мутации, которые изменяют последовательности 5'-сращивания, связаны со многими заболеваниями2,3. Прогнозируется, что потеря парировки основания snRNA U1 с мутантными 5'-сращивающими сайтами вызывает аберрантное сплайсинг, что может поставить под угрозу трансляцию пораженного транскрипта. Потенциальный терапевтический подход к исправлению дефектов сплайсинга включает подавление мутаций модифицированной U1 snRNA, несущей компенсаторные нуклеотидные изменения в своей 5'-области, которая имеет основания с 5'-сращенным участком. Было обнаружено, что такие модифицированные U1 snRNAs, также называемые экзон-специфическими U1 snRNAs, эффективны в обращении вспять дефектов сплайсинга, что приводит к увеличению экспрессии белка из спасенной мРНК4,5,6,7,8.
Здесь мы описываем анализ комплементации U1 snRNP, основанный на репортерах клеточный сплайсинг, который позволяет оценить влияние мутаций 5'ss на сплайсинг экзона, а также может быть использован для разработки модифицированных U1 snRNAs для спасения включения экзонов. Мы также предоставляем протоколы для мониторинга сращенных репортерных транскриптов с помощью праймерного расширения и ОТ-ПЦР, а также для определения экспрессии модифицированных snRNAs U1 с помощью праймерного расширения и RT-qPCR.
протокол
1. Реагенты и буферы
ПРИМЕЧАНИЕ: Вся стерилизация с использованием вакуумных фильтров должна выполняться с мембраной 0,2 мкм полиэфирсульфона (PES) в шкафу биобезопасности.
- Приготовьте воду без РНКазы, добавив 1,0 мл диэтилпирокарбоната (DEPC) к 1,0 л деионизированной воды, перемешайте в течение не менее 1 часа при комнатной температуре (RT), дважды автоклав, а затем охладите до RT перед использованием.
- Приготовьте модифицированную орлиную среду Dulbecco (DMEM), смешав один пакет порошка DMEM (13,4 г), 3,7 г бикарбоната натрия, 100 мл фетальной бычьей сыворотки (FBS), пенициллин и стрептомицин с ~ 800 мл стерильной деионизированной воды. Конечная концентрация пенициллина и стрептомицина в ДМЭМ должна составлять 50 Ед/мл и 50 мкг/мл соответственно. Отрегулируйте pH до 7,4, а затем восполните объем до 1,0 л стерильной деионизированной водой. Стерилизуют путем фильтрации и хранят при температуре 4 °C.
- Приготовьте 10x фосфатного буферного физиологического раствора (10x PBS), добавив 25,6 г гептагидрата водорода динатрия (Na2HPO4· 7H2O), 2 г дигидрофосфата калия (KH2PO4), 2 г хлористого калия (KCl) и 80 г хлорида натрия (NaCl) до 800 мл деионизированной воды. Перемешать до растворения и восполнить объем до 1,0 л. Стерилизовать фильтрацией и хранить при 4 °C.
- Приготовьте 0,5 М этилендиамина тетра-уксусной кислоты (ЭДТА), растворив 186,1 г Na2•EDTA•2H2O в ~800 мл деионизированной воды. Отрегулируйте pH до 8,0, а затем увеличьте объем до 1,0 л стерильной деионизированной водой. Стерилизуют путем фильтрации и хранят при температуре 4 °C.
- Готовят 1-кратный раствор трипсина-ЭДТА, смешивая 100 мл 10-кратного трипсина (2,5%), 2 мл 0,5 М ЭДТА, и добавляют 1x PBS до 1,0 л. Стерилизуют фильтрацией и аликвотой в конические пробирки по 50 мл. Хранить при температуре 4 °C в течение 1-2 недель или заморозить при -20 °C для длительного использования.
- Получают 2-кратный формамидный краситель для загрузки ДНК/РНК путем смешивания 14,4 мл формамида и 0,6 мл 0,5 М ЭДТА для конечного объема 15 мл. Добавьте бромфеноловый синий и ксилол-цианоловый порошок до конечной концентрации 0,02% и храните при 4 °C.
ПРИМЕЧАНИЕ: Формамид токсичен и коррозионен. Ознакомьтесь с паспортами безопасности материалов для получения дополнительных рекомендаций по безопасности. - Приготовьте 5x буфер Tris/Borate/EDTA (5x TBE), смешивая 54,0 г основания tris, 27,5 г борной кислоты и 20 мл 0,5 M ЭДТА в ~800 мл деионизированной воды. Смешайте до растворения и восполните объем до 1,0 л с деионизированной водой.
- Готовят раствор мочевинно-полиакриламидного геля электрофореза (urea-PAGE), смешивая 200 мл 5x TBE, 250 мл 40% 19:1 бис/акриламид и 450,5 г мочевины. Затем добавляют деионизированную воду до 1,0 л. Смешивают до полного растворения ингредиентов, затем стерилизуют фильтрацией и хранят при 4 °C в янтарной стеклянной бутылке.
ПРИМЕЧАНИЕ: Бис/акриламид токсичен. Ознакомьтесь с паспортами безопасности материала для получения дополнительных процедур безопасности. - Готовят 10% персульфат аммония (АФС), растворяя 1 г АФС в 10 мл деионизированной воды и хранят при 4 °C.
2. Котрансфекция клеток HeLa с репортерными и U1 snRNA плазмидами
ПРИМЕЧАНИЕ: Трансфекция клеток Hela должна выполняться в стерильных условиях в шкафу биологической безопасности. Наружная поверхность всех материалов должна быть опрыскана 70% этанолом перед введением в шкаф биологической безопасности.
- Поддерживайте клетки Hela в DMEM в инкубаторе с температурой 37 °C с 5% CO2 путем пропускания каждые 2-3 дня, когда клетки составляют около 80-90% слива.
- Для пропускания клеток HeLa аспирируют отработанную среду, а затем инкубируют клетки с 3 мл 0,25% трипсина, содержащего 1 мМ ЭДТА при 37 °C в течение 3 мин.
- После инкубации добавить 7 мл свежего ДМЭМ. Переложите клеточную суспензию в пробирку объемом 10 мл, центрифугу при 1000 х г в течение 5 мин.
- Повторно суспендируйте клеточную гранулу в 10 мл свежего DMEM, а затем нанесите клетки на новую чашку для культуры тканей при 20% слиянии.
- Для переходных трансфекций подсчитайте клетки Hela с помощью чистого слайда гемоцитометра и подготовьте суспензию плотностью 2,5 х 105 клеток/мл.
- Посейте 1,0 мл 2,5 х 105 клеток/мл клеточной суспензии Hela в каждую лунку из 12-луночной пластины и инкубируют в течение ночи при 37 °C.
- На следующий день аспирировать отработанную среду и добавить 0,8 мл свежего ДМЭМ с сывороткой.
- Готовят раствор I, добавляя 0,2 мкг репортерной плазмиды Dup51 или Dup51p, 1,8 мкг pcDNA, pNS6U1 или pNS6U1-5a плазмиды и 100 мкл трансфекционной среды в новую микроцентрифужную трубку объемом 1,5 мл.
- Приготовьте главную смесь раствора II для всех образцов, подлежащих трансфекции, добавив 100 мкл трансфекционной среды и 4,0 мкл трансфекционного реагента на образец.
- Приготовьте трансфекционную смесь, добавив 100 мкл раствора II в каждую микроцентрифужную трубку, содержащую раствор I.
- Вихревую трансфекцию смешивают в течение 15 с, центрифугу в настольной микроцентрифуге при 3000 х г в течение 10 с при РТ, а затем инкубируют при РТ в течение 5 мин.
- Добавьте все 200 мкл трансфекционной смеси в одну лунку 12-луночной клеточной пластины HeLa для достижения конечного объема 1,0 мл на лунку и инкубируйте пластину при 37 °C в течение 48 часов.
- После инкубации экстрагируют РНК из трансфектированных клеток HeLa коммерчески доступным раствором гуанидина тиоцианата и фенола.
ПРИМЕЧАНИЕ: Этот реагент содержит фенол, и этот этап должен быть выполнен в вытяжном шкафу. Использование очищенной DEPC воды рекомендуется для повторного суспендирования экстрагированной РНК.- Аспирировать отработанную среду и добавить в каждую лунку по 500 мкл реагента. Инкубировать на RT в течение 5 мин.
- Гомогенизация путем пипетки вверх и вниз. Затем переложите раствор в новую микроцентрифужную трубку объемом 1,5 мл.
- Добавьте 100 мкл хлороформа и вихря в течение 15 с.
- Центрифуга при 12 000 х г в течение 15 мин при RT.
- Перенос 200 мкл РНК, содержащего верхний водный слой, в новую микроцентрифужную трубку объемом 1,5 мл.
- Добавьте 2 мкг гликогена и 200 мкл изопропанола к каждому образцу РНК. Перемешайте, перевернув трубки.
- Собирают осадок РНК путем центрифугирования при 12 000 х г в течение 10 мин при 4 °C.
- Удалите и выбросьте супернатант, не нарушая гранулу РНК.
- Промыть гранулу дважды, добавив 1,0 мл 70% этанола, перевернув трубки и центрифугируя, как описано на этапе 2.13.7.
- Гранулы сушат на воздухе в течение ~10-20 мин при РТ и повторно суспендируют РНК в 10-20 мкл воды, не содержащей РНКазы.
- Определение концентрации РНК путем измерения абсорбции при 260 нм, как описано Desjardins и Conklin9.
- Продолжайте удлинение праймера или храните образцы РНК при -20 °C. Изолированная РНК может храниться при -20 °C в течение 6-12 месяцев.
3. 32P-маркировка олигонуклеотидов
ПРИМЕЧАНИЕ: Этапы, связанные с использованием олигонуклеотидов , меченных 32P-АТФ и 32P, должны выполняться за акриловым щитом подготовленными лицами с разрешения уполномоченных учреждений. Протокол, описанный ниже, может быть использован для маркировки олигонуклеотидов, Dup3r и U17-26-R, а также маркеров для мочевины-PAGE. Использование очищенной DEPC воды рекомендуется для повторного суспензии олигонуклеотидов и исключения размеров шариков.
- К микроцентрифужной трубке объемом 1,5 мл добавляют олигонуклеотид, полинуклеотидкиназу Т4 (Т4 ПНК), буфер Т4 ПНК и 32P-АТФ, как описано в Таблице 1. В последнюю очередь добавить в смесь 32P-АТФ; это важно.
ПРИМЕЧАНИЕ: Для добавления радиоактивных растворов рекомендуется использовать наконечники фильтров. - Инкубировать на водяной бане при 37 °C в течение 30 мин.
- В то время как реакции маркировки инкубируются, повторно суспендируйте шарики исключения размера с молекулярной массой 25 кДа, отрезанными путем осторожного вихря в течение ~ 10 с.
ПРИМЕЧАНИЕ: Шарики для исключения размеров должны быть приготовлены в соответствии с инструкциями завода-изготовителя и храниться в виде 50% суспензии в 25% этаноле при 4°C. - Подготовьте колонны, переместив 600 мкл повторно суспендированных шариков в одноразовый мини-столбец, помещенный в трубку для сбора 1,5 мл, и вернув булатный материал до 4 °C.
- Центрифуга при 2 000 х г в течение 1 мин при РТ и отбрасывает поток насквозь.
- Вымойте шарики, добавив в колонку 300 мкл воды без РНКазы.
- Повторите шаги 3.5. и 3.6. дважды и перенесите мини-колонку в новую центрифужную трубку объемом 1,5 мл.
- Добавляют реакционную смесь киназы в колонку шарика и центрифугу при 5000 х г в течение 1 мин при РТ.
- Соберите и сохраните поток, который имеет 32P-меченый олигонуклеотид, и выбросьте все наконечники и трубки в акриловый ящик для отходов.
- Добавьте 20 мкл войны без РНКазы, чтобы разбавить 32P-меченый олигонуклеотид до конечной концентрации 2,5 мкМ.
ПРИМЕЧАНИЕ: Разбавьте маркированные маркеры по мере необходимости для загрузки на гели мочевины-PAGE. - Храните меченый олигонуклеотид в коробке из акриловых микротрубок при -20 °C или продолжайте анализ растяжения грунтовки.
4. Анализ сращенных репортерских расшифровок по праймерному расширению
ПРИМЕЧАНИЕ: Перед использованием рекомендуется очищать поверхности и оборудование реагентом, инактивирующим РНКазу.
- Добавьте 2,0 мкг РНК, извлеченной из клеток Hela, в отдельные микроцентрифужные трубки объемом 200 мкл и добавьте воду без РНКазы, чтобы составить объем до 6,55 мкл.
- Приготовьте Master Mix I с разбавленными 32P-Dup3r и dNTP, как показано в таблице 2, и добавьте 0,9 мкл смеси в каждую ПЦР-трубку, содержащую образцы РНК.
- Инкубируют пробирки, сначала при 65 °C в течение 5 мин, а затем на льду в течение 1 мин.
- Приготовьте Master Mix II с 5-кратным буфером первой нити, дитиотрейтолом (DTT), ингибитором РНКазы и обратной транскриптазой, как показано в таблице 2.
- Добавьте 2,55 мкл смеси в каждую трубку, содержащую РНК и Master Mix 1; общий объем реакции должен составлять 10 мкл. Держите пробирки при РТ в течение 10 мин.
- Переложите трубки в сухую ванну или термальный циклер и инкубируйте сначала при 50 °C в течение 60 мин, а затем при 70 °C в течение 15 мин.
- После инкубации добавьте 10 мкл 2-кратного формамидного РНК-нагрузочного красителя к каждому образцу и храните в акриловой коробке при -20 °C или приступайте к разделению фрагментов мочевиной-PAGE с использованием геля длиной 14 см и визуализации изображения геля, как описано ниже на этапе 8.
- Выполните денситометрическое сканирование гелевого изображения с помощью программного обеспечения для анализа изображений и используйте интенсивности полос включенных и пропущенных продуктов для расчета процента включения экзона 2, как показано ниже.

5. Анализ сращенных репортерских расшифровок флуоресцентной ОТ-ПЦР
ПРИМЕЧАНИЕ: В анализе ОТ-ПЦР, описанном ниже, используются случайные гексамеры для синтеза кДНК и комбинация немаркированных олигонуклеотидов Dup8f и Cy5-меченых Dup3r для амплификации ПЦР сращенных продуктов.
- Для синтеза кДНК добавьте 2,0 мкг РНК, извлеченной из трансфектированных клеток Hela, в отдельные микроцентрифужные трубки объемом 200 мкл и добавьте воду без РНКазы, чтобы составить объем до 11,0 мкл.
- Приготовьте Master Mix I, содержащий случайные гексамеры и dNTP, как показано в таблице 3 , и добавьте 2,0 мкл смеси к каждому образцу. Инкубировать, сначала при 65 °C в течение 5 мин, затем на льду в течение 1 мин.
- Приготовьте Master Mix II, содержащий буфер первой нити, ингибитор РНКАЗЫ, DTT и обратную транскриптазу, как показано в таблице 3 , и добавьте 7,0 мкл смеси в каждую трубку, содержащую РНК и Master Mix I.
- Держите пробирки при RT в течение 10 мин, а затем инкубируйте при 50 °C в течение 60 мин и 70 °C в течение 15 мин.
ПРИМЕЧАНИЕ: Завершенные реакции кДНК могут храниться при -20 °C. - Для ПЦР перенесите 1,0 мкл (100 нг/мкл) каждого образца кДНК в новые пробирки ПЦР.
- Приготовьте мастер-смесь, состоящую из Dup8f, Cy5-Dup3r, dNTPs, Taq-буфера, Taq-полимеразы и воды, как описано в таблице 4 , и добавьте 11,5 мкл смеси в каждую пробирку, содержащую кДНК.
- Выполняют ПЦР с помощью термоциклера с начальным шагом денатурации при 94 °C в течение 3 мин; затем 20 циклов денатурации (94 °C в течение 30 с), отжига (65 °C в течение 30 с) и удлинения (72 °C в течение 15 с), а также этап окончания при 72 °C в течение 5 мин.
- Добавьте 12,5 мкл 2-кратного формамидного ДНК-нагрузочного красителя в каждую трубку и нагревайте при 95 °C в течение 5 мин.
- Храните реакцию ПЦР при -20 °C или продолжайте с мочевиной-PAGE, как описано ниже на этапе 8.1-8.4.
- После электрофореза извлеките стеклянные пластины из аппарата электрофореза и просканируйте с помощью флуоресцентного тепловизора для визуализации геля.
- Выполните денситометрическое сканирование гелевого изображения и используйте интенсивность полосы входящих и пропущенных продуктов для расчета процента включения экзона 2, как описано в Шаге 4.8.
6. Анализ варианта экспрессии snRNA U1 по праймерному расширению
- Добавьте 2,0 мкг РНК, извлеченной из клеток Hela, в отдельные микроцентрифужные трубки объемом 200 мкл и добавьте воду без РНКазы, чтобы составить объем до 4,325 мкл, а затем добавьте dATP, как показано в таблице 5.
- Добавьте 10 000 CPM олигонуклеотида 32P-U17-26-R в каждую трубку.
ПРИМЕЧАНИЕ: Для приготовления 10 000 cpm/μl раствора 32P-U17-26-R (из этапа 3) разбавляют меченый олигонуклеотид (разбавление 1:20), определяют cpm в 1,0 мкл с помощью сцинтилляционного счетчика и далее разбавляют деионизированной водой для приготовления раствора 10 000 cpm/μL в новой микроцентрифужной трубке объемом 1,5 мл. - Инкубировать при 65 °С в течение 5 мин, а затем на льду в течение 1 мин.
- Приготовьте мастер-микс с 5-кратным буфером первой нити, ингибитором РНКАЗЫ, DTT и обратной транскриптазой, как показано в таблице 5 , и добавьте 1,8 мкл смеси к каждому образцу.
- Инкубировать, сначала при RT в течение 10 мин, а затем при 42 °C в течение 10 мин.
- После инкубации добавьте 10 мкл 2x формамидного РНК-нагрузочного красителя в каждый образец и храните в акриловой коробке при -20 °C или приступайте к разделению фрагментов мочевиной-PAGE с использованием геля длиной 38 см (см. Шаг 8).
7. Анализ экспрессии варианта snRNA U1 методом RT-qPCR
- Разбавить запас кДНК, приготовленный, как описано выше на этапах 5.1 - 5.4, до концентрации 0,2 нг/мкл.
- Пипетка 5,0 мкл разбавленной кДНК в отдельные скважины 96-луночной qPCR пластины в трех экземплярах. Добавьте деионизированную воду вместо кДНК для управления без шаблона (NTC).
- Приготовьте две отдельные грунтовочные смеси, состоящие из прямой и обратной грунтовок для snRNAs U1 и U2 и воды, как показано в таблице 6.
ПРИМЕЧАНИЕ: Последовательности для U1 и U2 snRNA-специфических праймеров приведены в таблице 7. - Добавьте 5,0 мкл грунтовочной смеси snRNA U1 и U2 к образцу и лункам NTC.
- Добавьте 10,0 мкл ПЦР-смеси в режиме реального времени в каждую лунку.
- Запечатайте пластины оптической пленкой, затем центрифугу при 1000 х г в течение 2 мин на РТ для сбора реакций на дно скважин.
- Выполняют qPCR с начальной стадией денатурации при 95 °C в течение 10 мин, за которой следуют 40 циклов 2-ступенчатого протокола, состоящего из денатурации (95 °C в течение 15 с) и отжига/расширения (62 °C в течение 60 с) при сборе значений порогового цикла количественной оценки (Cq) целевых ампликонов.
- Завершите реакцию qPCR, проверив наличие одного пика в кривой диссоциации для реакций snRNA U1 и U2.
- Из значений Cq рассчитайте дельта Cq (ΔCq) для snRNAs U1 и U2 по сравнению с контролем ПХДНК.
- Определите вариант выражения snRNA U1 как относительную величину (RQ) U1 по сравнению с U2, используя значение ΔΔCq, как показано ниже для всех образцов.

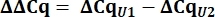
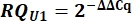
8. Настройка и запуск гелей Urea-PAGE
ПРИМЕЧАНИЕ: Сборка стеклянных пластин и гелевого рабочего аппарата должна производиться в соответствии с инструкциями завода-изготовителя. Литье 10% геля мочевины-PAGE может быть выполнено в соответствии с ранее описанным протоколом Summer et al.10. Этапы, связанные с подготовкой маркеров и образцов, а также запуском и визуализацией гелей, описаны ниже. Необязательно, чтобы предотвратить прилипание геля к стеклянным пластинам, внутренняя поверхность может быть покрыта силиконовым раствором путем добавления 1 мл раствора на поверхность и равномерного распределения по всей поверхности тканью. После высыхания пластины следует промыть деионизированной водой и снова высушить.
ВНИМАНИЕ: Неполимеризованный акриламид является нейротоксичным и должен обрабатываться с защитой, рекомендованной в паспорте безопасности материала.
- Подготовьте образцы и маркеры грунтовки путем нагревания при 95 °C в течение 5 мин, а затем центрифугирования в настольной микроцентрифуге при 3000 х г в течение 5 с при РТ.
- Перед загрузкой маркеров и образцов промывайте скважины 1x буфером TBE, чтобы удалить осевший мочевину.
- Загрузите 10 мкл / образец / скважину и запустите гель при 300-500 В в течение 2-3 часов или до тех пор, пока ксилол цианол не достигнет дна.
ПРИМЕЧАНИЕ: Около 1000 копий в минуту маркера с маркировкой 32P могут быть загружены. - После электрофореза снимите стеклянные пластины с аппарата электрофореза.
- Тщательно разделите две пластины так, чтобы гель лежал ровно на любой стеклянной поверхности, перенесите гель на фильтровальную бумагу и накройте полиэтиленовой пленкой.
- Вакуумная сушка геля на фильтровальной бумаге при 80 °C в течение 30 мин с помощью гелевой сушилки.
- Поместите высушенный гель в люминофорную кассету и храните в RT на ночь.
ПРИМЕЧАНИЕ: Люминофорный экран должен быть стерт с помощью светового короба перед использованием. - Чтобы визуализировать изображение геля, снимите экран и отсканируйте с помощью люминофорного тепловизора.
Результаты
Сплайсинг-репортер Dup51, миниген из трех экзонов-двух интронов, был получен из гена β-глобина человека и был описан ранее (рисунок 1A)11,12. Мы создали мутантный репортер Dup51p, введя мутации сайта 5'-сращивания, связанные с синдромом Ашера, которы?...
Обсуждение
Анализ может быть адаптирован для анализа сплайсинга в клеточных линиях, отличных от HeLa, однако факторы, влияющие на эффективность трансфекции, такие как клеточная конфузия и количество ДНК, возможно, потребуется оптимизировать. Отношение репортера к конструкции U1 является еще одним к...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана фондами S.S. от Национальных институтов здравоохранения (R21CA170786 и R01GM127464) и Американского онкологического общества (грант на институциональные исследования 74-001-34-IRG), а также S.S. и W.M. от Valley Research Partnership Program (P1-4009 и VRP77). Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagent Grade Deionized Water | ThermoFisher Scientific | 23-751628 | |
| Diethyl pyrocarbonate (DEPC) | Sigma-Aldrich | D5758-25ML | |
| Dulbecco's Modified Eagle Medium (DMEM) powder packet | Gibco | 12100-046 | |
| Sodium Bicarbonate | ThermoFisher Scientific | S233-500 | |
| Fetal Bovine Serum (FBS), Australian Source, Heat Inactivated | Omega Scientific | FB-22 | |
| Penicillin-Streptomycin (P/S) | Sigma-Aldrich | P4458-100ML | |
| Sodium Hydroxide, Standard Solution 1.0N | Sigma-Aldrich | S2567-16A | |
| Hydrochloric Acid, Certified ACS Plus, 36.5 to 38.0% | ThermoFisher Scientific | A144-500 | |
| Disposable PES Bottle Top Filters | ThermoFisher Scientific | FB12566510 | |
| EDTA Disodium Salt Dihydrate | Amresco | 0105-2.5KG | |
| 2.5% Trypsin (10x), no phenol red | ThermoFisher Scientific | 15090046 | |
| Sodium Chloride | Fisher Bioreagent | BP358-212 | |
| Potassium Chloride | Fisher Bioreagent | BP366-1 | |
| Disodium Hydrogen Phosphate Heptahydrate | Fisher Bioreagent | BP332-1 | |
| Potassium Dihydrogen Phosphate | Fisher Bioreagent | BP362-1 | |
| Transfection medium - Opti-MEM™ I Reduced Serum Medium, no phenol red | ThermoFisher Scientific | 11058021 | |
| Transfection Reagent - Lipofectamine™ 2000 | ThermoFisher Scientific | 13778150 | |
| TRIzol™ Reagent | ThermoFisher Scientific | 15596018 | |
| Chloroform (Approx. 0.75% Ethanol as Preservative/Molecular Biology) | ThermoFisher Scientific | BP1145-1 | |
| Ethanol, Absolute (200 Proof), Molecular Biology Grade, Fisher BioReagents | ThermoFisher Scientific | BP2818-4 | |
| Isopropanol, Molecular Biology Grade, Fisher BioReagents | ThermoFisher Scientific | BP2618-212 | |
| Glycogen (5 mg/ml) | ThermoFisher Scientific | AM9510 | |
| Direct-zol RNA Miniprep Kit | Zymo Research | R2052 | |
| ATP, [γ-32P]- 6000Ci/mmol 150mCi/ml Lead, 1 mCi | PerkinElmer | NEG035C001MC | |
| T4 Polynucleotide Kinase | New England Biolabs | M0201L | |
| Size exclusion beands - Sephadex® G-25 | Sigma-Aldrich | G2580-10G | |
| Size exclusion mini columns | USA Scientific | 1415-0600 | |
| pBR322 DNA-MspI Digest | New England Biolabs | N3032S | |
| Low Molecular Weight Marker, 10-100 nt | Affymetrix | 76410 100 UL | |
| Rnase inactivating reagents - RNaseZAP™ | Sigma-Aldrich | R2020-250ML | |
| dNTP Mix (10 mM ea) | ThermoFisher Scientific | 18427013 | |
| RNaseOUT™ Recombinant Ribonuclease Inhibitor | ThermoFisher Scientific | 10777019 | |
| Reverse Transcriptase - M-MLV Reverse Transcriptase | ThermoFisher Scientific | 28025013 | used for primer extension |
| Taq DNA Polymerase | ThermoFisher Scientific | 10342020 | |
| Random Hexamers (50 µM) | ThermoFisher Scientific | N8080127 | |
| Real time PCR mix - SYBR™ Select Master Mix | ThermoFisher Scientific | 4472903 | |
| SuperScript™ III Reverse Transcriptase | ThermoFisher Scientific | 18080093 | used for cDNA preparation |
| Dithiothreitol (DTT) | ThermoFisher Scientific | 18080093 | |
| 5X First-Strand Buffer | ThermoFisher Scientific | 18080093 | |
| Formamide (≥99.5%) | ThermoFisher Scientific | BP228-100 | Review Material Safety Data Sheets |
| Bromophenol Blue sodium salt | Sigma-Aldrich | 114405-5G | |
| Xylene Cyanol FF | Sigma-Aldrich | 2650-17-1 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | ThermoFisher Scientific | BP152-5 | |
| Boric Acid (Crystalline/Electrophoresis) | ThermoFisher Scientific | BP168-500 | |
| Acrylamide: Bis-Acrylamide 19:1 (40% Solution/Electrophoresis) | ThermoFisher Scientific | BP1406-1 | Review Material Safety Data Sheets |
| Urea (Colorless-to-White Crystals or Crystalline Powder/Mol. Biol.) | ThermoFisher Scientific | BP169-212 | |
| Ammonium peroxodisulphate (APS) ≥98%, Pro-Pure, Proteomics Grade | VWR | M133-25G | |
| Sigmacote | Sigma-Aldrich | SL2-100ML | |
| N,N,N',N'-Tetramethylethylenediamine (TEMED) ≥99%, Ultrapure | VWR | 0761-25ML | Review Material Safety Data Sheets |
| Adjustable Slab Gel Systems, Expedeon | VWR | ASG-400 | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 14.5cm | VWR | NGP-125NR | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 22.0cm | VWR | NGP-200NR | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 38.7cm | VWR | NGP-400NR | |
| GE Storage Phosphor Screens | Sigma-Aldrich | GE28-9564 | |
| Typhoon™ FLA 7000 Biomolecular Imager | GE Healthcare | 28-9610-73 AB | |
| Beckman Coulter LS6500 Liquid Scintillation Counter | GMI | 8043-30-1194 | |
| C1000 Touch Thermal Cycler | ThermoFisher Scientific | ||
| QuantStudio 6 Flex Real-Time PCR Systems | ThermoFisher Scientific |
Ссылки
- Zhuang, Y., Weiner, A. M. A compensatory base change in U1 snRNA suppresses a 5' splice site mutation. Cell. 46 (6), 827-835 (1986).
- Scotti, M. M., Swanson, M. S. RNA mis-splicing in disease. Nature Review Genetics. 17 (1), 19-32 (2016).
- Ward, A. J., Cooper, T. A. The pathobiology of splicing. Journal of Pathology. 220 (2), 152-163 (2010).
- Scalet, D., et al. Disease-causing variants of the conserved +2T of 5' splice sites can be rescued by engineered U1snRNAs. Human Mutatation. 40 (1), 48-52 (2019).
- Yamazaki, N., et al. Use of modified U1 small nuclear RNA for rescue from exon 7 skipping caused by 5'-splice site mutation of human cathepsin A gene. Gene. 677, 41-48 (2018).
- Yanaizu, M., Sakai, K., Tosaki, Y., Kino, Y., Satoh, J. I. Small nuclear RNA-mediated modulation of splicing reveals a therapeutic strategy for a TREM2 mutation and its post-transcriptional regulation. Science Reports. 8 (1), 6937 (2018).
- Balestra, D., et al. Splicing mutations impairing CDKL5 expression and activity can be efficiently rescued by U1snRNA-based therapy. International Journal of Molecular Sciences. 20 (17), 20174130 (2019).
- Donadon, I., et al. Exon-specific U1 snRNAs improve ELP1 exon 20 definition and rescue ELP1 protein expression in a familial dysautonomia mouse model. Human Molecular Genetics. 27 (14), 2466-2476 (2018).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments. (45), e2565 (2010).
- Summer, H., Gramer, R., Droge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). Journal of Visualized Experiments. (32), e1485 (2009).
- Dominski, Z., Kole, R. Selection of splice sites in pre-mRNAs with short internal exons. Molecular Cell Biology. 11 (12), 6075-6083 (1991).
- Amir-Ahmady, B., Boutz, P. L., Markovtsov, V., Phillips, M. L., Black, D. L. Exon repression by polypyrimidine tract binding protein. RNA. 11 (5), 699-716 (2005).
- Le Guedard-Mereuze, S., et al. Sequence contexts that determine the pathogenicity of base substitutions at position +3 of donor splice-sites. Human Mutation. 30 (9), 1329-1339 (2009).
- Sharma, S., Wongpalee, S. P., Vashisht, A., Wohlschlegel, J. A., Black, D. L. Stem-loop 4 of U1 snRNA is essential for splicing and interacts with the U2 snRNP-specific SF3A1 protein during spliceosome assembly. Genes and Development. 28 (22), 2518-2531 (2014).
- Steitz, J. A., et al. . Functions of the abundant U-snRNPs. Structure and function of major and minor small nuclear ribonucleoprotein particles. , 115-154 (1988).
- Fortes, P., et al. Inhibiting expression of specific genes in mammalian cells with 5' end-mutated U1 small nuclear RNAs targeted to terminal exons of pre-mRNA. Proceedings of the National Academy of Sciences U.S.A. 100 (14), 8264-8269 (2003).
- Roca, X., et al. Widespread recognition of 5' splice sites by noncanonical base-pairing to U1 snRNA involving bulged nucleotides. Genes and Development. 26 (10), 1098-1109 (2012).
- Roca, X., Krainer, A. R. Recognition of atypical 5' splice sites by shifted base-pairing to U1 snRNA. Nature Structural Molecular Biology. 16 (2), 176-182 (2009).
- Taladriz-Sender, A., Campbell, E., Burley, G. A. Splice-switching small molecules: A new therapeutic approach to modulate gene expression. Methods. 167, 134-142 (2019).
- Hamid, F. M., Makeyev, E. V. A mechanism underlying position-specific regulation of alternative splicing. Nucleic Acids Research. 45 (21), 12455-12468 (2017).
- Martelly, W., et al. Synergistic roles for human U1 snRNA stem-loops in pre-mRNA splicing. RNA Biology. , 1-18 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены