Method Article
На месте Визуализация роста аксонов и динамики конуса роста в культурах эмбриональных срезов мозга Ex vivo
В этой статье
Резюме
Этот протокол демонстрирует простой и надежный метод изучения роста аксона in situ и динамики конуса роста. Он описывает, как подготовить ex vivo физиологически значимые острые срезы мозга и предоставляет удобный для пользователя конвейер анализа.
Аннотация
Во время развития нейронов аксоны перемещаются по корковой среде, чтобы достичь своих конечных пунктов назначения и установить синаптические связи. Ростовые конусы - сенсорные структуры, расположенные на дистальных кончиках развивающихся аксонов - выполняют этот процесс. Изучение структуры и динамики конуса роста имеет решающее значение для понимания аксонального развития и взаимодействий с окружающей центральной нервной системой (ЦНС), которые позволяют ей формировать нейронные цепи. Это важно при разработке методов реинтеграции аксонов в нейронные цепи после травмы в фундаментальных исследованиях и доклинических контекстах. До сих пор общее понимание динамики конуса роста в первую очередь основано на исследованиях нейронов, культивируемых в двух измерениях (2D). Хотя 2D-исследования, несомненно, имеют основополагающее значение для современных знаний о структурной динамике конуса роста и реакции на стимулы, они искажают физиологическую трехмерную (3D) среду, с которой сталкиваются конусы роста нейронов в неповрежденной ткани ЦНС. Совсем недавно коллагеновые гели были использованы для преодоления некоторых из этих ограничений, что позволило исследовать развитие нейронов в 3D. Тем не менее, как синтетические 2D, так и 3D-среды не имеют сигнальных сигналов в ткани ЦНС, которые направляют расширение и поиск пути развивающихся аксонов. Этот протокол обеспечивает метод изучения аксонов и колбочек роста с использованием органотипических срезов мозга, где развивающиеся аксоны сталкиваются с физиологически значимыми физическими и химическими сигналами. Сочетая тонко настроенную внутриутробную и внеутробную электропорацию для редкой доставки флуоресцентных репортеров вместе с микроскопией со сверхвысоким разрешением, этот протокол представляет собой методологический конвейер для визуализации динамики аксона и конуса роста in situ. Кроме того, включено подробное описание анализа данных визуализации долгосрочных и живых клеток.
Введение
Нейроны представляют собой сильно поляризованные клетки, которые представляют собой основную вычислительную единицу в нервной системе. Они получают и излучают информацию, которая опирается на разделение входных и выходных участков: дендритов и аксонов, соответственно1. Во время разработки аксоны расширяются, ориентируясь в невероятной сложной среде, чтобы достичь места назначения. Аксонная навигация направляется конусом роста, сенсорной структурой, расположенной на кончике развивающегося аксона. Конус роста отвечает за обнаружение сигналов окружающей среды и перевод их в динамическую пространственную реорганизацию своего цитоскелета 2,3. Полученные морфомеханические реакции инструктируют конус роста расширяться или втягиваться от триггерного сигнала, что приводит к специфическим маневрам аксона.
Современное понимание динамики расширения и роста конуса аксона проистекает из исследований, оценивающих рост аксонов над двумерными (2D) субстратами 2,4,5,6,7. Эти новаторские исследования выявили сложное взаимодействие между колбочками роста и субстратами роста и выявили поразительные различия, зависящие от характеристик субстрата, таких как адгезивность и жесткость 8,9. Во главе с этими выводами были выдвинуты гипотезы о том, что внеклеточные сигналы окружающей среды диктуют рост аксонов, причем цитоскелет конуса роста выполняет этот рост 2,10,11,12. Примечательно, что нейроны могут расширять аксоны в неадгезивных субстратах (например, полилизин, полиорнитин)13. Кроме того, жесткость подложки может влиять на скорость роста аксона независимо от клеточных адгезивных комплексов8. Следовательно, изучение динамики конуса роста в 2D-субстратах само по себе не может точно смоделировать баланс сил, возникающий в результате взаимодействия конусов роста аксонов с физиологически значимыми трехмерными (3D) средами, такими как те, которые обнаружены in vivo.
Для преодоления ограничений 2D-анализов в 3D-матрицах 8,9 были изучены рост аксонов и динамика конуса роста. Эти матрицы представляют собой более физиологический контекст, но позволяют изучать клеточные механизмы роста аксонов. Это позволяет исследовать конус роста одноклеточным способом в различных условиях и фармакологических методах лечения9. В таких 3D-средах аксоны демонстрировали отчетливую динамику цитоскелета и росли быстрее, чем те, которые наблюдались в 2D-культивируемых нейронах9. Эти изящные исследования продемонстрировали влияние дополнительного измерения на реорганизацию цитоскелета ростового конуса и, следовательно, на его поведение.
Несмотря на очевидные преимущества, предоставляемые 3D-матрицами по сравнению с 2D-поверхностями в поддержке развития нейронов и роста аксонов, они остаются упрощенным синтетическим каркасом, который не может отражать сложность динамики, наблюдаемой в ткани центральной нервной системы (ЦНС). Здесь доставка репортерных плазмид ex utero и in utero электропорация сочеталась с органотипической культурой среза мозга и визуализацией in situ с живым сверхвысоким разрешением для анализа динамики конуса роста в физиологическом контексте. Данная методика позволяет визуализировать развивающиеся аксоны при ощущении 3-мерности среды in vivo и сложности ее физико-химического состава. Наконец, описаны удобные для пользователя процедуры измерения роста аксонов и динамики конуса роста с использованием общелицензионного и общедоступного программного обеспечения.
протокол
Эксперименты на животных должны соответствовать соответствующим институциональным и федеральным правилам. Эмбриональный день 15,5 и 12,5 (E15.5 и E12.5) беременных самок мышей C57BL/6JRj был использован в этом протоколе. Эксперименты проводились в соответствии с Законом о благополучии животных Государственного агентства по охране окружающей среды Северной Рейн-Вестфалии (Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV)).
1. Подготовка плазмид к инъекциям
- Изолируйте ДНК с помощью набора Maxiprep без эндотоксинов в соответствии с протоколом производителя (см. Таблицу материалов).
- Смешайте выбранную ДНК в желаемой концентрации (таблица 1) и 10% раствор Fast Green (см. Таблицу материалов) для визуализации доставки смеси ДНК в желудочки мозга.
ПРИМЕЧАНИЕ: Специфические плазмиды использовались для разреженной маркировки корковых нейронов (рисунок 1A), нитевидных актиновых (F-актиновых) структур в конусе роста (рисунок 1B) и двойной маркировки ростовых колбочек в одной коре (рисунок 1C). Все плазмиды (таблица 1), используемые в этом протоколе, были депонированы в Addgene (см. Таблицу материалов). - Подготовьте стеклянные капилляры с помощью набора капиллярного электродного съемника в соответствии со следующей программой: давление: 500, тепло: 800, тяга: 30 и скорость: 40.
- Загрузите 15 мкл смеси ДНК / Fast Green в каждый стеклянный капилляр с помощью наконечников пипетки микрозагрузчика.
ПРИМЕЧАНИЕ: Убедитесь, что пузырьки не образуются. - Храните заполненные ДНК капилляры в 10-сантиметровой посуде с кусочком моделирующей глины по всему диаметру тарелки. Капилляры можно загружать и хранить при 4 °C за день до эксперимента. Запечатайте заднюю часть капилляра гибкой пленкой для предотвращения высыхания.
2. Приготовление растворов
- Приготовьте раствор буферной соли Хэнка, дополненный глюкозой (HBSS-G).
- Добавьте 0,5% от 20% запаса глюкозы во флакон 1x HBSS. Хорошо перемешать и хранить при 4 °C до 2 недель. Для извлечения эмбриона пузырьковый раствор HBSS-G с карбогеном (95% O2 и 5% CO2) используют пузырьковый камень незадолго до сбора эмбрионов.
- Решение для монтажных носителей
- Приготовьте свежие срезы, содержащие нейробазаль 1x, 5% конскую сыворотку, 5% икроножную сыворотку плода, добавку B27 1:50, добавку L-глутамина 1:400, пенициллин-стрептомицин 1:200 и добавку Neuropan-2 1:100 (при рН = 7,3), в стерильных условиях (см. Таблицу материалов).
- Приготовьте 3 см блюдо по 1 мл ломтика в каждой. Поместите в инкубатор при 35 °C с 5% CO2 в течение, по меньшей мере, 1 ч до эксперимента, чтобы уравновесить рН среды посредством газообмена.
ПРИМЕЧАНИЕ: Выравнивание pH среды вызвано подкислением среды CO2 из инкубатора. Срезы могут храниться при температуре 4 °C до 1 недели.
- Раствор агарозы с низкой температурой плавления (3%)
- Взвесьте нужное количество порошка агарозы с низкой температурой плавления и растворите в соответствующем объеме 1x HBSS-G в стеклянной бутылке. Требуется примерно 7 мл раствора агарозы на мозг.
- Поместите флакон в микроволновую печь на 2-3 мин, свободно поставив колпачок, и встряхивайте каждые 10-20 с.
- Как только порошок полностью растворится, поместите бутылку на водяную баню или бисериновую ванну, установленную на 37 °C, по крайней мере, за 1 ч до начала эксперимента, чтобы агароза остыла.
ПРИМЕЧАНИЕ: Рекомендуется нагревать агарозу дважды в течение 15 минут, чтобы убедиться, что порошок агарозы растворен. Это имеет решающее значение для правильной адгезии агарозы к мозговой ткани. Термометр следует использовать для измерения температуры раствора агарозы при встраивании мозга, убедившись, что она находится между 37-40 ° C. Мозг разных возрастных животных имеет разную жесткость. Рекомендуется проверить диапазон концентраций агарозы, чтобы найти однородность между тканью и агарозой. - Приготовьте фосфатный буферизованный физиологический раствор с 0,3% тритона X-100 (PBS-T).
- Приготовьте фосфатный буферизованный физиологический раствор с 0,2% азида натрия (PBS-NaN3).
ПРИМЕЧАНИЕ: Растворы, описанные на этапах 2.4-2.5, предназначены для использования на более поздней стадии иммуногистохимии.
3. Подготовка хирургического отделения
- Очистите операционную станцию 70%-96% этанолом и поместите операционную подложку на поверхность станции.
- Стерилизуйте хирургические инструменты путем промывки 70-96% этанолом, а затем сухой стерилизацией в горячем стерилизаторе.
- Очистите платиновые электроды пинцета (см. Таблицу материалов) с 70%-96% этанолом перед подключением к генератору импульсов.
- Вставьте заполненный ДНК/Fast Green стеклянный капилляр в капиллярный держатель. Непосредственно перед использованием аккуратно отломите кончик капилляра тонкими ножницами и проведите тестовый раствор внутри микроцентрифужной трубки объемом 1,5 мл, заполненной предварительно нагретым физиологическим раствором или водой.
ПРИМЕЧАНИЕ: На рисунке 2A, B показана установка хирургической станции и инструменты, используемые для электропорации ex utero (EUE) и внутриутробной электропорации (IUE). - Для МСЭ разогреть солевой раствор до 37 °C на водяной бане.
4. Извлечение эмбриона
- Поместите беременную мышь в индукторную камеру анестезии с 5% изофлураном до тех пор, пока мышь не будет глубоко обезболена. Подтверждают анестезию отсутствием рефлекса снятия педали.
- Переведите мышь на операционную подложку и выдержите изофлуран на уровне 1,5%-2% через носовой конус.
- Нанесите мазь на оба глаза, чтобы предотвратить пересыхание роговицы.
- Побрейте брюшко мыши, а затем используйте 70-96% пропитанную этанолом марлю для удаления бритых волос. Очистите область бетадином.
- Используя стерильные небольшие хирургические ножницы, сделайте разрез кожи 2 см вдоль средней линии живота, а затем разрез мышцы 1,5 см.
ПРИМЕЧАНИЕ: Размер разреза зависит от размера эмбриона. Действительно, более крупные эмбрионы потребуют большего разреза для размещения их извлечения. - Вырежьте отверстие в середине марли достаточно широко, чтобы поместиться в разрезе кожи (~ 2 см в диаметре), замочите его теплым физиологическим раствором и поместите вокруг брюшного отверстия.
- Вытащите оба рога матки с помощью ватной палочки, смоченной в теплом физиологическом растворе или с помощью щипцов, осторожно захватывая промежутки между эмбрионами, чтобы вытащить их. Поместите эмбрионы на влажную марлю (рисунок 2С).
ПРИМЕЧАНИЕ: Даже небольшое повреждение кровеносных сосудов и капилляров вокруг рогов матки, скорее всего, приведет к обильному кровотечению. Поэтому избегайте прямого обращения с этими васкуляризированными областями в любое время. - Разрежьте маточный мешок и удалите каждый эмбрион (рисунок 2D).
- Усыпляют каждый эмбрион сразу после экстракции с помощью нисходящего диагонального разреза, обеспечивая полную трансекцию спинного мозга (рисунок 2E).
- Поместите эмбрионы в 10-сантиметровую посуду, содержащую HBSS-G на льду.
ПРИМЕЧАНИЕ: Избегается обезглавливание эмбриона, чтобы предотвратить утечку смеси ДНК / Fast Green из мозга и облегчить позиционирование эмбриона в держателе (см. электропорация ex utero , этап 5). - Жертвуют матерью сразу после извлечения эмбрионов, выполняя вывих шейки матки.
ПРИМЕЧАНИЕ: Здесь мать подвергается эвтаназии под наркозом, чтобы избавить ее от любых дальнейших боли или страданий после процедуры в соответствии с протоколом, утвержденным Законом о благополучии животных Государственного агентства по охране окружающей среды Северной Рейн-Вестфалии (LANUV).
5. Внематочная электропорация (EUE)
- Возьмите эмбрион и поместите его в держатель.
ПРИМЕЧАНИЕ: Вырезанный наконечник пипетки объемом 1 мл, прикрепленный к концу клеточного скребка, используется в качестве держателя эмбрионов. Во время процедуры важно держать руки эмбрионов вне кончика, чтобы предотвратить их скольжение в кончик (рисунок 2F-I). Диаметр наконечника пипетки легко регулируется для размещения эмбрионов различных размеров. Вырежьте второй наконечник по длине, где диаметр наконечника соответствует размеру эмбриона, и используйте его в качестве переходной вставки к держателю, упомянутому выше. - Осторожно вставьте ЗАПОЛНЕННЫЙ ДНК/Fast Green стеклянный капилляр через череп эмбриона в боковой желудочек и введите 2-3 мкл плазмидной смеси ДНК (Рисунок 1A,B; Таблица 1) в каждый желудочек (рисунок 2F).
ПРИМЕЧАНИЕ: Используйте лямбдоидальные и сагиттальные швы в качестве руководства по месту инъекции ДНК. Лямбдоидальные и сагиттальные швы представляют собой фиброзные суставы, соединяющие костную пластину черепа. Первый соединяет теменную кость с затылочной костью, а второй соединяет две теменные кости. - Держите голову эмбриона между платиновыми электродами пинцета под соответствующим углом, чтобы нацелиться на желаемую область мозга (угол 60° в данном случае), катодом, обращенным к области, где предназначен перенос ДНК (рисунок 2G-H).
- Примените пять импульсов при 30 мВ с интервалом 1 с и длительностью 50 мс с помощью генератора импульсов квадратной волны.
ПРИМЕЧАНИЕ: Имейте в виду, что мозг в EUE испытывает более эффективное электрическое поле, чем в IUE. Следовательно, при данной концентрации ДНК EUE приводит к более высокой эффективности переноса ДНК, чем IUE, и концентрации ДНК должны быть соответствующим образом скорректированы. - Если требуется двусторонняя электропорация, повторите шаги 5.3-5.4 с катодом и анодом, отражающими предыдущее положение, чтобы нацелиться на контралатеральную кору.
ПРИМЕЧАНИЕ: Поскольку обоим желудочкам вводили ДНК, кора обоих полушарий была нацелена. - Поместите электропорированный эмбрион в 6-сантиметровую посуду, содержащую холодный HBSS-G. Повторите шаги 5.1-5.6 для всех необходимых эмбрионов.
6. Внутриутробная электропорация (МСЭ)
- Вводят беременной мыши анальгетик; 50 мкл бупренорфина (0,1 мг/кг) (см. Таблицу материалов) подкожно, за 20 мин до процедуры.
- Выполните шаги 4.1-4.8 из секции извлечения эмбриона.
ПРИМЕЧАНИЕ: Избегайте оставлять эмбрионы без необходимости, покрывая их стерильной марлей, смоченной в теплом физиологическом растворе. - Кончиками пальцев осторожно поворачивайте эмбрион внутри матки до тех пор, пока не будут расположены лямбдоидальные и сагиттальные швы (рисунок 2J). Осторожно вставьте днк / быстрый зеленый стеклянный капилляр через стенку матки и череп эмбриона в боковой желудочек и введите 2-3 мкл плазмидной смеси ДНК (рисунок 1A, C) в один или оба желудочка по желанию (рисунок 2K-L).
ПРИМЕЧАНИЕ: Чрезмерное давление пальцев на рога матки может привести к коллапсу амниотического мешка. - Держите головку эмбриона между платиновыми электродами пинцета под соответствующим углом, чтобы нацелиться на желаемую область мозга (угол 60 ° в данном случае), катодом, обращенным к области, где предназначен перенос ДНК. Избегайте сдавливания матки, так как это может вызвать коллапс амниотического мешка (рисунок 2M).
- Подайте пять импульсов на 35 мВ с интервалом 600 мс и длительностью 50 мс с помощью генератора импульсов квадратной волны.
- Если были введены оба боковых желудочка, повторите шаги 6,5-6,6 с катодом и анодом, отражающими предыдущее положение, чтобы нацелиться на контралатеральную кору.
- Повторите шаги 6.3-6.6 для всех необходимых эмбрионов.
- После того, как все необходимые эмбрионы будут электропорированы, используйте пропитанную физиологическим раствором ватную палочку, чтобы аккуратно поместить рога матки обратно в брюшную полость.
ПРИМЕЧАНИЕ: Добавление физиологического раствора в брюшинную полость поможет маточным рогам вернуться в исходное положение. - Шовные разрезы мышц и кожи с использованием 5-0 шовного материала. Используйте шовные клипсы для закрепления раны и дезинфекции шовной раны, опрыскивая ее бетадином (рисунок 2N-P).
- Вводят мышам 200 мкл 5% глюкозы подкожно.
- Вводят мышам антибиотик; 50 мкл энрофлоксацина (5 мг/кг) подкожно (см. Таблицу материалов).
- Поместите мышь обратно в восстановительную клетку и поддерживайте тепло с помощью дальнего инфракрасного согревающего света или грелки в течение не менее 20 минут после процедуры (рисунок 2Q).
- Ежедневно контролируйте мышь и вводите мелоксикам после процедуры обезболивания в соответствии с институциональными и федеральными рекомендациями.
- Извлеките эмбрионы через 2 дня после процедуры (т.е. E17.5) после шага 4.
7. Извлечение и встраивание мозга в агарозу
ПРИМЕЧАНИЕ: Рекомендуется выполнять следующие шаги под рассеченным микроскопом для лучшей точности. Предотвращение повреждения мозга имеет решающее значение для успеха процедуры.
- Установите инструменты экстракции в стерильном рабочем пространстве под вытяжкой (рисунок 3A).
- Отделите головку эмбриона от остальной части тела с помощью ножниц для рассечения.
- Зафиксируйте голову, как показано на рисунке 3C, а затем удалите кожу и череп, разрезав вдоль средней линии, начиная от основания головы к носу (рисунок 3D).
- Очистите кожу и череп сбоку, создав достаточно большой зазор (~ 1 см) для иссечения мозга.
- Чтобы удалить мозг, вставьте закрытый наконечник стерильных ножниц для рассечения, начиная с обонятельной луковицы, двигаясь в сторону ствола мозга (рисунок 3E).
- Отрежьте ствол мозга и обрежьте любые свободные куски мозговых оболочек вокруг мозга (рисунок 3F).
ПРИМЕЧАНИЕ: Рыхлые мозговые оболочки часто приводят к тому, что срезы остаются прикрепленными к блоку агарозы после разрезания, что приводит к отделению ткани от агарозы во время сбора срезов. - Повторите шаги 7.1-7.6 для всех эмбрионов и держите мозг на льду (в идеале не дольше 30 минут) до этапа встраивания.
ПРИМЕЧАНИЕ: Следующие шаги 7.7.1-7.7.4 относятся к извлечению мозгом E12.5.- Изолируйте верхнюю часть головы чуть ниже глаза, как показано на рисунке 3G.
- Вырежьте кожу и череп поверх ствола мозга, следуя пунктирной линии, как показано на рисунке 3H, без удаления ствола мозга.
- Сделайте 2 мм разрез кожи-черепа в затылке, как показано на рисунке 3I (см. рисунки для ясности).
ПРИМЕЧАНИЕ: Этот разрез обеспечивает начальные точки захвата для отслаивания слоев кожи и черепа. Как правило, они отрываются в виде одного слоя. Типичный размер разреза составляет 2 мм, что соответствует длине режущей кромки используемых ножниц микропрупил. - Начните отслаивать слои кожи и черепа, закрепляя одну сторону разреза и осторожно вытягивая другую. С такой же осторожностью завершайте, отслаивая основание головы до освобождения мозга (рисунок 3J).
ПРИМЕЧАНИЕ: Это должно быть сделано с большой осторожностью, наблюдая, что мозг не тянется вдоль тканевых слоев. Чередуйте стороны для удаления ткани, покрывающей мозг.
- Теплую агарозу (при 37-40 °С) вылить в посуду 3 см.
- Поднимите мозг с помощью перфорированной ложки и удалите лишнюю жидкость, обмакнув дно ложки в сухую папиросную бумагу. Поместите мозг в блюдо из агарозы.
ПРИМЕЧАНИЕ: Важно удалить как можно больше жидкости со всего мозга, чтобы обеспечить лучшую адгезию агарозы к ткани. - Положите блюдо с жидкой агарозой на лед. Используя меньшую ложку, смешайте агарозу в течение 10 с для равномерного охлаждения. Маневрируйте мозгом до середины тарелки. Поместите мозг горизонтально в чашку спинной стороной вверх, убедившись, что она полностью покрыта агарозой со всех сторон (рисунок 3K).
ПРИМЕЧАНИЕ: Мозг часто опускается на дно блюда после того, как его помещают в агарозу; поднимать мозг с помощью небольшой ложки до тех пор, пока не будет установлена щель в 1-2 мм под мозгом. - Повторите шаги 7.8-7.10 для всех мозгов.
- Как только агароза полимеризуется, добавьте 500 мкл HBSS-G поверх блока агарозы, чтобы предотвратить высыхание. Затем накройте блюдо льдом.
ПРИМЕЧАНИЕ: Держите образец на льду в течение 5 минут перед разделением, чтобы температура мозга достигла 4 ° C.
8. Органотипическая срезовая культура
ПРИМЕЧАНИЕ: Очистите вибратом и окружающие поверхности 70%-96% этанолом, чтобы избежать загрязнения срезов. Настройка рабочей станции вибратома (см. Таблицу материалов) показана на рисунке 3B.
- Наполните буферный лоток вибратома холодным HBSS-G, а внешний лоток льдом, чтобы поддерживать HBSS-G холодным на протяжении всей процедуры.
- Непрерывная подача HBSS-G в буферный лоток с карбогеном с помощью пузырящегося камня.
- Используя свежее лезвие, сделайте большой разрез (~ 2 х 2 см) вокруг мозга и удалите блок агарозы, содержащий мозг, с достаточным количеством окружающей агарозы, чтобы обрезать агарозу в небольшой прямоугольный блок.
ПРИМЕЧАНИЕ: Этот шаг позволяет отрегулировать угол блока таким образом, чтобы сагиттальная ось мозга была перпендикулярна пластине вибратома, а корональная ось выравнивалась параллельно лезвию. Оставьте около 5 мм агарозы на спинной стороне мозга для легкой обработки ломтиков. - Поместите небольшую каплю суперклея без растворителя в середину держателя образца и распределите в область, которая покроет дно блока агарозы.
- Аккуратно поднимите блок агарозы и высушите дно, обмакнув папиросную бумагу. Поместите блок на склеенную область держателя образца, ростральной стороной мозга вверх. Положите держатель образца на лед и дайте клею высохнуть в течение 1 мин.
- Как только клей высохнет, поместите держатель образца в буферный лоток.
- Разрежьте мозг корональными срезами под углом 15°.
ПРИМЕЧАНИЕ: Толщина срезов может варьироваться в зависимости от применения. Здесь мозги были разрезаны на толщину 150 мкм. Установите скорость вибратома на 1,0-1,5 мм/с для обрезки избытка агарозы сверху и обрезки обонятельных луковиц. Уменьшите скорость резания до 0,5 мм/с для сбора кортикальных срезов для анализа. Большинство вибратомов можно приостановить, чтобы собрать каждый кусочек. Если наблюдается снижение качества срезов или отсоединение ткани от агарозы, может помочь снижение скорости резания или замена лезвия вибратома. - Используя чистые шпатели, соберите срезы мозга и поместите их на мембрану политетрафторэтилена (PTFE), иммобилизованную в 35-миллиметровую стеклянную посуду с использованием парафина (до пяти мозговых срезов / мембраны) (рисунок 3L-M).
ПРИМЕЧАНИЕ: Закрепите мембрану из PTFE внутри 35-миллиметровой тарелки со стеклянным дном с использованием воска. Это стабилизирует мембрану при добавлении культуральной среды среза, а также во время визуализации. - Используя пипетку объемом 200 мкл, удалите избыток HBSS-G вокруг ломтиков на мембране из PTFE, оставив ломтики полусухими.
- Добавьте 500 мкл среза (предварительно нагретого до 35 °C) непосредственно в пространство под мембраной из PTFE.
ПРИМЕЧАНИЕ: При добавлении среды под мембраной не должно образовываться пузырьки. Это оставит целые или частичные фрагменты без обмена медиа. Заменяйте 200 мкл носителя каждые 2 дня в культуре или после каждого сеанса визуализации. - Инкубировать ломтики при 35 °C с 5% CO2.
9. Иммуногистохимия
- Зафиксируйте ломтики с 1 мл 4% параформальдегида (PFA) с добавлением 4% сахарозы на блюдо. Инкубировать в RT в течение 30 мин.
ВНИМАНИЕ: При работе с PFA надевайте лабораторный халат и перчатки. Выполните этапы фиксации под химическим капотом и утилизируйте отходы PFA соответствующим образом. - Вымойте ломтики дважды с 300 мкл PBS в течение 5 мин. Переложите ломтики на 24-луночную тарелку.
ПРИМЕЧАНИЕ: На этом этапе эксперимент может быть приостановлен. Добавьте PBS-NaN3 в ломтики и храните при температуре 4 °C. NaN3 является токсичным соединением; при обращении с растворами с ним надевайте лабораторное пальто и перчатки. Шаги 9.3-9.10 должны выполняться в орбитальном шейкере. - Закаляйте ломтики 300 мкл 0,1 М глицина при 4 °C в течение ночи.
- Промыть глицин PBS при RT 3x в течение 10 мин.
- Пермеабилизируйте ломтики 300 мкл PBS-T при RT в течение 2 ч.
- Блокируют с использованием 10% козьей сыворотки в PBS-T при RT в течение 2 ч.
- Добавьте 300 мкл первичного антитела (анти-виментиновое антитело в разведении 1:200; см. Таблицу материалов), разведенного в 10% козьей сыворотке в растворе PBS-T при 4 °C в течение ночи.
ПРИМЕЧАНИЕ: На этапах 9.8-9.12 срезы были защищены светом для предотвращения потери флуоресценции. - Промывайте первичное антитело PBS при RT 3x в течение 20 мин.
ПРИМЕЧАНИЕ: PBS использовался вместо PBS-T для промывки Triton X-100. - Добавьте 300 мкл вторичного антитела (либо Alexa Fluor 488, либо 647 в разведении 1:400; см. Таблицу материалов) в PBS при RT в течение 2 ч.
ПРИМЕЧАНИЕ: DAPI добавляют сразу после удаления вторичного антитела в разведении 1:10 000 в течение 5 мин. - Промыть вторичное антитело PBS при RT 3x в течение 20 мин. Промыть дистиллированной водой 2x в течение 1 мин.
- Переложите ломтики на стеклянную горку мелкой кистью, а затем высушите при 30 °C в течение 20 минут.
- Смонтируйте срезы с помощью водного монтажного носителя. Держите слайды на RT в течение ночи, чтобы монтажный носитель мог быть курирован.
10. Получение изображений
ПРИМЕЧАНИЕ: Независимо от подхода к доставке ДНК (IUE или EUE), срезы анализировались в одном и том же возрастном диапазоне развития (E17.5-E18.5). IUE позволяет нейронным прародителям делиться и развиваться в течение еще двух дней in vivo. EUE, с другой стороны, позволяет отслеживать события раннего развития.
- Включите камерный инкубатор и установите его на 35 °C с 5% CO2 - в идеале за 4 часа до визуализации - чтобы компоненты микроскопа уравновешивались при 35 °C.
- Для глубокой визуализации срезов используйте цели погружения в воду, чтобы уменьшить несоответствие показателя преломления между тканью и объективом.
ПРИМЕЧАНИЕ: Здесь использовался режим изображения со сверхвысоким разрешением. Визуализация через мембрану из PTFE требует объектива с большим рабочим расстоянием (~ 1 мм). Если цель на большом рабочем расстоянии недоступна, ломтики могут быть перенесены в блюдо со стеклянным дном из 8 лунок. Чтобы перенести срезы, добавьте 1 мл среза среды в верхнюю часть мембраны, а затем используйте шпатель, чтобы поднять срез и перенести его в скважину, содержащую 200 мкл среды. Удалите лишнюю среду с помощью наконечника пипетки объемом 1 мл, оставив ломтики полусухими. - Для визуализации роста аксона найдите область коры с низкой и средней плотностью клеток. Для визуализации динамики ростовых конусов найдите конус роста в промежуточной зоне коры или субвентрикулярной зоне.
- Определите размер z-стека в программном обеспечении для обработки изображений (см. Таблицу материалов). Для роста аксона в большом z-стеке установите размер шага 2 мкм. Для ростовых конусов в меньшем z-стеке установите размер шага 1 мкм.
ПРИМЕЧАНИЕ: Всегда учитывайте потенциальное движение конуса роста и аксона через плоскости x, y и z. Аксоны растут гораздо более высокими темпами в оловотипических культурах, чем в культурах in vitro . Здесь z-стек около 80 мкм для изображения роста аксона был достаточным. Для динамики конуса роста z-стек ~6 мкм был достаточным. - Для визуализации роста аксонов нейронов на большей площади определите сканирование плитки.
- Используйте самую низкую возможную мощность лазера, чтобы свести к минимуму вероятность обесцвечивания ростовых колбочек во время приобретения.
- Для визуализации роста аксонов приобретайте таймлапсы в течение 2 ч с интервалом 5 мин. Для визуализации динамики роста конуса приобретают таймлапсы в течение 2-5 мин с интервалом 2,5-3 с.
11. Анализ данных
- Измерение скорости роста аксонов с помощью кимографов
- Откройте файл изображения в Fiji14 через файл > Открыть и выберите изображение.
- Получите проекцию максимальной интенсивности замедленной съемки с помощью стеков > изображения > Z-проекции > проекции максимальной интенсивности.
- Пройдите таймлапс и найдите растущий аксон.
- Оказавшись на месте, проведите линию через растущий аксон. Начните с кончика аксона в первом кадре и следуйте за аксоном на протяжении всего таймлапса.
- Сгенерируйте кимограф с помощью плагина KymoResliceWide.
- Установите масштаб кимографа, перейдя в раздел Свойства > изображения. Установите расстояние в мкм в поле Ширина в пикселях и установите время в s или min в Пиксельной высоте.
- Перейдите в раздел Анализ > меры.
ПРИМЕЧАНИЕ: Будет указан угол относительно оси X. - Рассчитайте скорость роста аксона, подставив угол в следующем уравнении: SIN(RADIANS(θ))/COS(RADIANS(θ)) в электронной таблице.
- Измерьте объем конуса роста с помощью программного обеспечения для анализа изображений (см. Таблицу материалов).
- Откройте файл изображения в программном обеспечении для анализа изображений через файл > Открыть и выберите интересующий файл.
- Выберите мастер добавления новых поверхностей .
ПРИМЕЧАНИЕ: В левом нижнем углу появится раздел с шестью шагами для ручного редактирования. - На шаге 1 в разделе Настройки алгоритма выберите Сегментировать только интересующую область. На шаге 2 обрежьте рамку, чтобы она соответствовала всему конусу роста во всех кадрах.
- На шаге 3 установите пороговое значение абсолютной интенсивности и убедитесь, что на шаге 4 достигнут пороговый уровень всей области конуса роста.
- На шаге 5 выберите Количество вокселей lmg = 1 в разделе Тип фильтра.
ПРИМЕЧАНИЕ: На последнем шаге может быть создано несколько наборов измерений. Здесь было создано только одно измерение для объема. - Нажмите кнопку Выполнить , чтобы выполнить все шаги создания и завершить работу мастера добавления новых поверхностей.
- На вкладке Статистика в верхней части окна мастера выберите Конкретные значения и том на вкладке Подробно .
Результаты
Показаны репрезентативные результаты, полученные с помощью описанного метода рабочего процесса. Мыши E15.5 были использованы в настоящей демонстрации, хотя этот протокол легко адаптируется практически ко всем эмбриональным возрастам, начиная от E11 до позднего E17. В этом протоколе либо ex utero electroporation (EUE; Рисунок 2А, 2С-I) или внутриутробная электропорация (МСЭ; Рисунок 2B, C и 2J-Q) использовались для доставки плазмид в нейроны-предшественники, выстилающие боковые желудочки. Эти предшественники являются источником будущих кортикальных проецирующих нейронов (CPN)15,16. Плазмидные смеси были подготовлены для управления разреженной нейрон-специфической экспрессией либо мембранно-целевого (Lyn)-mNeonGreen (Рисунок 1A), либо LifeAct-enhanced (E)GFP (Рисунок 1B) для оценки общего поведения и динамики актина в колбочках роста, соответственно. Кроме того, была включена плазмидная смесь, предназначенная для маркировки отдельных нейронов либо турбо(t)-RFP, либо зеленым флуоресцентным белком zoanthus sp. (Zs) (ZsGreen) (рисунок 1C). Это облегчает мониторинг поведения конуса роста от независимых соседних нейронов.
Вскрытие мозга из электропорированных эмбрионов является решающим шагом, который необходимо тщательно выполнить, чтобы получить высококачественные срезы, сохраняющие нативную структуру мозга. Инструменты для рассечения и вибратом готовили заранее и тщательно стерилизовали этанолом (рисунок 3А,В). Далее были тщательно рассечены головки электропорированных эмбрионов и извлечен мозг. Здесь показано репрезентативное рассечение мозга эмбрионов, подвергшихся воздействию EUE на E15 (рисунок 3C-F) и E12.5 (рисунок 3G-J). Мозг немедленно заключают в агарозную матрицу, нарезают и помещают на мембранные вставки из PTFE в нижней стеклянной чашке для инкубации (рисунок 3K-M).
Состояние здоровья срезов мозга является важным моментом для контроля для обеспечения надежных результатов. Ежедневно проводился визуальный осмотр на предмет каких-либо загрязнений. Кроме того, как только культура была завершена, срезы мозга фиксируются и подвергаются иммуногистохимии. Здесь,4',6-диамидино-2-фенилиндол (DAPI) использовался для контроля общей клеточной организации и окрашивания виментина для выявления глиальной организации; в частности, радиальные глиевые (RG) каркасы. Как правило, успешно культивируемые срезы мозга, полученные из IUE или EUE, показывают нормальное клеточное распределение, выявленное DAPI и несколько организованным массивом RG с апикально ориентированными пиально-контактными процессами17 (рисунок 4A, B соответственно). Иногда наблюдаются заметные нарушения в строительных лесах RG в культивируемых срезах мозга, особенно в тех, которые получены в результате электропорации EUE (рисунок 4C). Срезы мозга с крайне дезорганизованным каркасом RG показывают нарушение миграции нейронов и дефектный рост аксонов (не показаны). Следовательно, управление каркасом RG является простым посткультурным методом сортировки данных, полученных из надежных срезов мозга.
Срезы мозга, полученные из IUE или EUE с Lyn-mNeonGreen-экспрессирующей плазмидной смесью, приводят к аналогичной разреженной маркировке нейронов. В качестве примера показана репрезентативная пирамидальная КПН, выражающая Lyn-mNeonGreen и динамическое поведение ее конуса роста (рисунок 5A и дополнительное видео 1, вверху слева). Кроме того, нейроны были помечены с помощью плазмиды, экспрессирующей актиновый зонд, для анализа динамики актина аксональных колбочек роста in situ (рисунок 5B и дополнительное видео 1, внизу слева). Эксперименты in situ также проводились с двойным Cre/Dre флуорофор-экспрессирующим дизайном плазмиды (рисунок 1C и дополнительное видео 1, справа). Флуорофоры tRFP или ZsGreen в этой плазмиде могут быть специфически и индивидуально активированы рекомбиназами Dre или Cre соответственно в соседних нейронах (рисунок 5C). Эта экспериментальная линейка позволяет параллельно анализировать колбочки роста от контрольных нейронов с соседними модифицированными нейронами (любая данная потеря или усиление функции). Это позволяет обойти изменчивость, возникающую в результате использования различных срезов для тестирования контрольных и экспериментальных условий.
Были проанализированы кимографы, полученные из записанного фильма, из которых можно легко получить динамические параметры роста, такие как протрузивная активность с течением времени и длина роста (рисунок 6А). Обратите внимание, что простая регулировка временного разрешения замедленной съемки позволяет измерять скорость удлинения аксона в течение 2 ч (рисунок 6А). Кроме того, изменение объема конуса роста с течением времени - мера общей динамической активности конуса роста - может быть легко получено, в данном случае с помощью лицензионного программного обеспечения (рисунок 6B и рисунок 6E, F). Это может быть использовано для оценки скорости беговой дорожки актина и баланса филоподий / ламеллиподий во время активности исследования конуса роста.
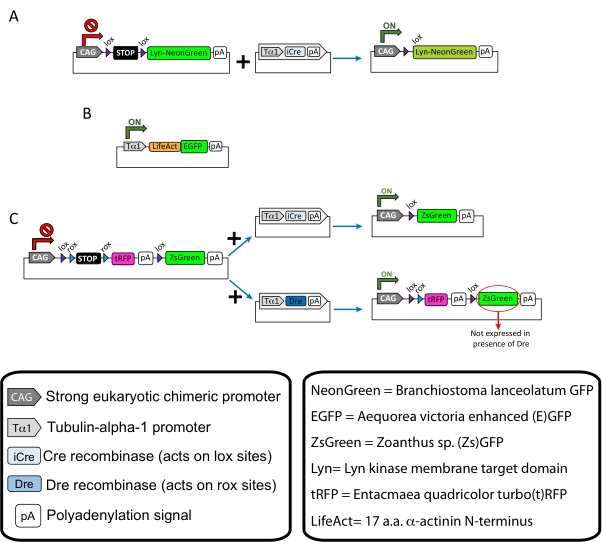
Рисунок 1: Схемы плазмид, используемых в протоколе. (A) pCAG-lox-STOP-lox-Lyn-mNeonGreen. (B) p-Tub-alpha-1-LifeAct-GFP. (C) pCAG-lox-rox-STOP-rox-tRFP-pA-lox-ZsGreen-pA. Соответствующая информация о плазмидных компонентах и происхождении флуорофора находится в коробках. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
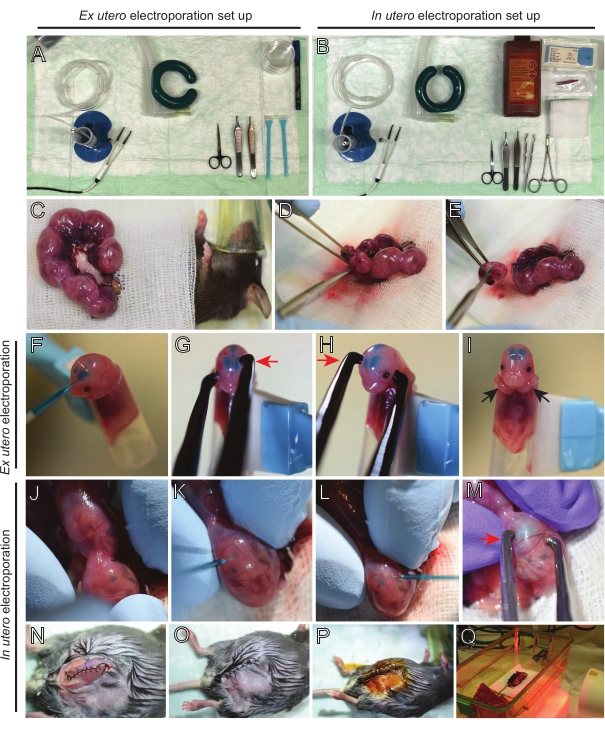
Рисунок 2: Рабочий процесс внеутробной и внутриутробной электропорации мышей E15.5. (A) Создание хирургической станции для внеутробной электропорации. (B) Создание хирургической станции для внутриутробной электропорации. (C) Рога матки, вытянутые за пределы брюшной полости анестезированной мыши. (D) Извлечение эмбриона из маточного мешка. e) жертвоприношение эмбриона путем полной трансекции спинного мозга с помощью диагонального разреза; обратите внимание, что обезглавливания удалось избежать. (F) Помещение эмбриона в держатель и введение смеси ДНК/Fast Green в левый боковой желудочек. (Г,Ч) Расположите головку эмбриона между платиновыми электродами пинцета катодом (красная стрелка) над корой под углом 60°. (I) Размещение рук эмбриона (черные стрелки) вне держателя для предотвращения скольжения эмбриона во время процедуры. (J) Вращение эмбриона внутри маточного мешка для обнажения головы. (К,Л) Инъекция смеси ДНК/Fast Green в боковые желудочки эмбриона через стенку матки. (M) Расположите головку эмбриона между платиновыми электродами пинцета катодом (красная стрелка) над корой под углом 60°. (N) Ушной разрез мышц с помощью скользящего стопорного шва. (O) Ушной разрез кожи прерванным швом. (P) Закрепление раны с помощью хирургических раневых зажимов и дезинфекция с использованием бетадина. (Q) Помещение мыши в восстановительную клетку с дальним инфракрасным теплым светом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Экстракция мозга Е15.5 и Е12.5 и процедура культуры органотипического среза. (A) Инструменты, используемые для процедуры извлечения мозга. (B) Создание станции органотипической культуры. (С-Ф) Экстракция мозга Е15.5. (Г-Дж) Извлечение мозга Е12.5. Пунктирные линии выделяют расположение разрезов. Красные стрелки указывают направление вытягивания щипцами. (K) Встраивание мозга в 3-сантиметровую чашку, содержащую 3% агарозы с низким содержанием расплава, оставляя разрыв между агарозами 1-2 мм под мозгом. (L) Коллекция 150 мкм мозгового среза. (M) Размещение срезов мозга на мембранных вставках из PTFE, обездвиженных в 35-миллиметровой чашке с использованием парафиновой пленки (синяя стрелка). Красная звездная маркировка указывает на данный набор срезов мозга из вибратома (L) и его перенос на мембрану PTFE (M). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
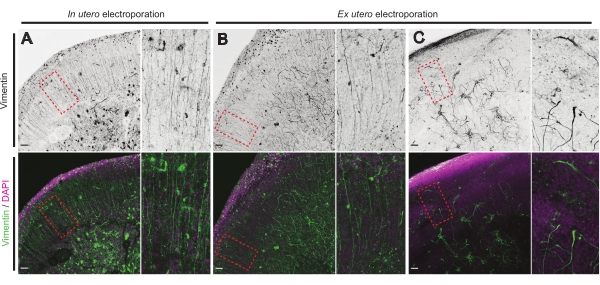
Рисунок 4: Сохраненная радиальная глиальная клеточная структура в здоровых органотипических срезах. Конфокальные изображения срезов мозга E17.5, показывающие массив RG (виментин; зеленый) и общую организацию клеток (DAPI; пурпурный) после IUE (A) и EUE (B, C). Обратите внимание на сильные возмущения в массиве RG, которые могут иногда возникать в результате EUE (C). Увеличения соответствуют красным пунктирным рамкам на главном рисунке: шкала, 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
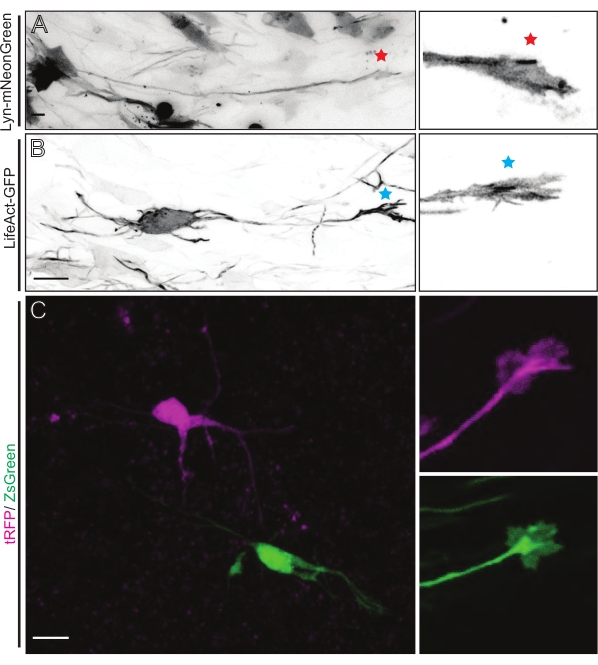
Рисунок 5: Визуализация in situ динамики конуса роста в острых оловоорганических срезах. (А,Б) Нейроны и соответствующие им конусы роста помечены Lyn-mNeonGreen и LifeAct-GFP соответственно. Красная звезда отмечает рост конуса экспрессирующего нейрона Lyn-mNeonGreen. Синяя звездочка, отмечающая рост конуса экспрессирующего нейрона LifeAct-GFP. (C) Соседние нейроны, помеченные двойной плазмидной системой, содержащей tRFP (пурпурный) и ZsGreen (зеленый) и соответствующие им колбочки роста. Изображенные на снимке конусы роста (справа) находились за пределами захваченного кадра (слева), полученного вскоре после приобретения такого времени конуса роста; шкала, 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
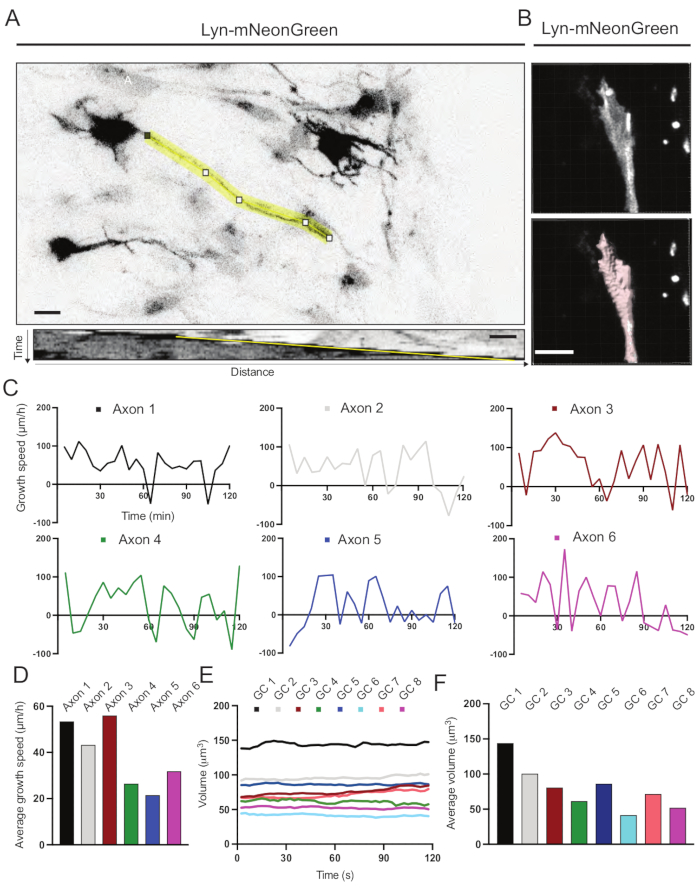
Рисунок 6: Анализ скорости роста аксона и объема конуса роста. (A) Трассировка аксона на нейроне, экспрессирующем Lyn-mNeonGreen (вверху) и соответствующем ему кимографе (внизу), сгенерированном с помощью ImageJ. (B) Реконструкция z-стекового видео конуса роста с использованием программного обеспечения для анализа изображений (вверху) и того же конуса роста, выделенного с помощью инструмента измерения поверхностей (ниже). (C) Графики, показывающие изменения скорости роста с течением времени для нескольких аксонов. (D) Средняя скорость роста аксонов измеряется в (C). E) График, показывающий изменения объема конуса роста с течением времени. F) средний объем ростовых конусов количественно оценивается в пункте (E); шкала, 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
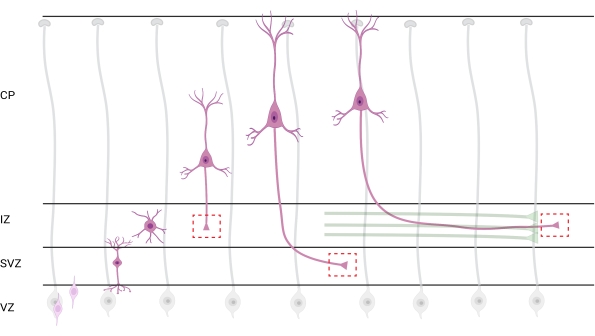
Рисунок 7: Радиальная миграция и поляризация нейронов пирамидных корковых нейронов. Диаграмма, иллюстрирующая развивающиеся пирамидальные корковые нейроны (розовый), мигрирующие радиально из зародышевой желудочковой зоны (VZ) к поверхности пиа. Руководствуясь радиальными глиальными процессами (серыми), мигрирующие поляризованные нейроны устанавливают ведущий процесс, будущий дендррит, и замыкающий процесс, будущий аксон, которые продолжают простираться вниз к промежуточной зоне (IZ). Пунктирные красные поля представляют собой кортикальные области, где были изображены конусы роста. В частности, в ИЗ, субвентрикулярной зоне (SVZ) или присоединяющихся пучках аксонов (зеленый). Иллюстрация была создана с помощью веб-инструмента BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Плазмидные | Концентрация (мкг/мкл) | Целевое использование |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | 0.25 | Маркировка мембранно-целевого белка (Lyn) |
| + | + | |
| p-Tub-альфа-1-iCre | 0.08 | |
| p-Tub-альфа-1-LifeAct-GFP | 0.125 | Маркировка филаментозного актина (F-актина) в колбочках роста |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | 1 | Независимая маркировка двух популяций соседних нейронов |
| + | + | |
| p-Tub-альфа-1-iCre | 0.004 | |
| + | + | |
| p-Tub-alpha-1-Dre | 0.2 |
Таблица 1: Перечень плазмид, используемых в Протоколе. Название, концентрация и предполагаемое использование каждой используемой плазмиды.
Дополнительное видео 1: Визуализация in situ динамики конуса роста в острых оловоорганических срезах. Динамика роста конусов обозначена Lyn-mNeonGreen (вверху слева) и LifeAct-GFP (внизу слева). Соседние колбочки роста дифференциально помечены двойной плазмидной системой, содержащей tRFP (пурпурный; вверху справа) и ZsGreen (зеленый; внизу справа). Интервал визуализации, 2,5 с. Шкала, 5 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Как растущие конусы чувствуют и реагируют на окружающую их среду, чтобы координировать одновременное расширение аксона и руководство, все еще является предметом споров 3,18. Новаторские исследования в области 2D-субстратов дали представление о фундаментальных молекулярных механизмах, генерирующих силы, которые управляют динамикой конуса роста во время формирования аксонов, роста и навигации 2,10,11,12,19. Совсем недавно исследования в 3D-матрицах показали, какое влияние третье измерение оказывает на поведение конуса роста и, следовательно, на рост аксона 8,9. Тем не менее, сложные механизмы, инструктирующие динамику конуса роста in vivo, еще предстоит тщательно изучить.
Получение оловоорганических культур срезов из мозга IUE или EUE широко используется и хорошо документировано. Он стал золотым стандартом, позволяющим ученым получить представление о развитии и поведении нейронов в живой мозговой ткани20,21. Действительно, этот метод был успешно использован в сочетании с различными методами визуализации с высоким разрешением для визуализации конкретных молекулярных процессов и морфологических событий in situ. Такие исследования включают, но не ограничиваются ими, образование и расширение аксонов19,22, миграцию корковых нейронов 19,22,23,24, динамику центросом 25,26, динамику микротрубочек27, а также функциональную динамику пре- и постсинаптических компартментов28,29.
Этот протокол устраняет пробел в экспериментальной нейробиологии, визуализируя динамику конуса роста развития корковых нейронов in situ, in ex vivo острых культур среза мозга и инструменты для анализа полученных данных.
Для создания этого протокола использовались культуры острых срезов мозга, потому что они (1) с некоторой практикой легко генерируются; (2) представлять доступную систему для изучения колбочек роста, встроенных в квази-полностью физиологическую среду, но достаточно прозрачную, чтобы обеспечить визуализацию живых клеток с высоким разрешением; (3) может быть расширен для его использования с помощью множества трансгенных линий мыши; (4) в сочетании с IUE или EUE обеспечивают практически неограниченный потенциал для предоставления молекулярных инструментов для оценки производительности ростовых конусов и аксонов in vivo при потере/усилении функциональных режимов, наряду с флуоресцентными репортерами и зондами цитоскелета.
Эта методология была описана в контексте как EUE, так и IUE. Несмотря на то, что EUE по-прежнему является высоконадежным методом, он привел к увеличению частоты срезов мозга, показывающих дезорганизованную сеть RG по сравнению с теми, которые были получены с помощью IUE в качестве метода доставки (рисунок 4C). Нарушения в массиве RG сильно влияют на миграцию нейронов и характер удлинения аксона30,31. Это ключевые параметры, которые предсказывают, где найти аксоны для анализа в данный момент времени и тип среды, в которой они ориентируются. Срезы мозга со значительно нарушенной сетью RG обычно имеют нарушенную стратификацию корковых нейронов. Это, в свою очередь, производит аксоны с хаотичными траекториями. Поэтому настоятельно рекомендуется контролировать структурную целостность сети RG. Интересно, что плохая структурная целостность коррелирует с увеличением возраста эмбрионального мозга. Действительно, такие эффекты у молодых эмбрионов E12.5-E13.5 обычно не наблюдались19.
Настоящий протокол является тщательным и простым. Тем не менее, есть несколько критических шагов, где необходимо проявлять особую осторожность и внимание для получения оптимальных результатов. Они были четко отмечены в протоколе и включают (1) настройку количества ДНК, используемой в электропорации, для получения разреженной маркировки; (2) предотвращение повреждений во время извлечения мозга; (3) контроль температуры агарозы во время оболочки мозга; (4) устранение идеального процента агарозы для мозга данного возраста; и 5) отбор флуорофоров, опыт которых следует. Во время оптимизации протокола была проверена производительность нескольких флуорофоров в визуализации живых клеток in situ. Для этого протокола были выбраны мономерные варианты GFP EGFP и NeonGreen для получения плазмид, помеченных LifeAct и Lyn (рисунок 5A,B). Кроме того, был протестирован вариант RFP mScarlet, который был признан очень подходящим для этой установки (данные не показаны). Также были протестированы многомерные tRFP (димер) и ZsGreen (тетрамер) (рисунок 5C и дополнительное видео 1, справа). Эти быстро складывающиеся сверхяркие флуорофоры рекомендуются, когда метод требует быстрой генерации флуоресцентного сигнала после доставки ДНК.
Обычной практикой в использовании культур срезов является использование срезов из разных мозгов для тестирования контрольных и экспериментальных условий. Это представляет собой неотъемлемый источник нежелательной изменчивости. Здесь была использована система экспрессии, позволяющая независимо модифицировать соседние нейроны и экспрессию репортеров для идентификации. Обратите внимание, что в этой демонстрации (рисунок 5C) не было различий между нейронами, экспрессирующими любой из флуорофоров. Однако, например, такая плазмидная смесь в сочетании с трансгенной линией мыши, содержащей Cre-чувствительный ген, будет маркироваться нейронами tRFP (Dre-sensitive), которые остались диким типом. Напротив, ZsGreen (также Cre-чувствительный) будет маркировать рекомбинированные нейроны. Следовательно, ростовые колбочки двух разных генотипов и, вероятно, также фенотипов могут быть изучены бок о бок одновременно в одном и том же срезе мозга.
Локализация аксонов и конусов роста для анализа является важным соображением. Корковые нейроны поляризуются, радиально мигрируя из желудочковой зоны (VZ) к кортикальной пластине (CP). Во время этого процесса нейроны образуют ведущий процесс (будущий дендррит) и замыкающий процесс, который станет аксоном, в конечном итоге присоединяясь к новаторским аксонам в промежуточной зоне (IZ), создавая аксонные тракты32. Поэтому для захвата аксональных конусов роста проводилась визуализация аксональных волокон в ИЗ, включая аксоны, выходящие из CP, и рано сгенерированные аксоны, уже связанные с аксональными пучками; или, в конце концов, в волокнах, которые пересекают ИЗ и простираются под ним (рисунок 7).
Этот протокол позволяет выполнять визуализацию нейронов сверхвысокого разрешения в органотипических срезах. Исторически сложилось так, что рассеяние света было значительной проблемой, с которой сталкивались при визуализации толстых образцов. За последние два десятилетия обширные достижения в области оптических технологий сделали возможным получение изображений толстых образцов. Здесь цель на большом рабочем расстоянии использовалась для лучшей визуализации небольших структур, таких как конусы роста. Неизбежно, этот протокол не фиксирует более подробные события, такие как ретроградный поток актина или динамика микротрубочек. Объектив большого рабочего расстояния, который требует более низкой числовой апертуры (NA), сохраняет информацию из толстых срезов. Однако этот протокол также можно было адаптировать для использования с целью сокращения рабочего расстояния. Для этого требовалась плавная переноска ломтиков в блюдо со стеклянным дном для сохранения структурной целостности. Однако использование этого метода привело к более короткой выживаемости - ~ 15 ч - из-за потери газообмена (данные не показаны). В отличие от 2D-культур, ростовые конусы в 3D занимают больший объем и требуют компенсации движения-артефакта по оси Z. Чтобы повысить способность к детальному изображению событий, необходимо использовать современные конфокальные технологии. Поэтому рекомендуется использовать быстро сканирующий z-стековый двигатель, такой как z-Galvo, доступный на высокочувствительных конфокальных микроскопах33.
Следует отметить, что этот протокол представляет собой три основных ограничения. Во-первых, часто бывает сложно контролировать уровни экспрессии / количество экспрессирующих клеток любой данной плазмиды in vivo. Это приводит к изменчивости между всеми срезами даже при поддержании одинаковой концентрации плазмид. Поэтому выбор регуляторных элементов в используемых векторах выражений должен быть предопределен с осторожностью. Во-вторых, визуализация подробных событий с помощью мембранных вставок в настоящее время невозможна. Это второе ограничение может быть преодолено с помощью методологических обновлений, предложенных в предыдущем пункте. Наконец, ростовые конусы очень светочувствительны и могут быстро стать фотоотбеленными. Поэтому частая визуализация колбочек роста в течение всего 5 минут с помощью лазерных сканирующих микроскопов часто может разрушить колбочки роста. В связи с этим новые достижения в устройствах, генерируемых световой микроскопией, могут быть адаптированы для долгосрочной визуализации срезов мозга34.
Подобные протоколы предназначены для открытия новых исследовательских направлений, позволяя лучше понять, что требуется для того, чтобы конус роста считывал и реагировал на сложную среду in vivo , и, что более важно, разгадывал механику этого сложного взаимодействия.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Марию Евгению Бернис за фотографирование процедур. Мы также благодарим Эмили Бернсайд, Эмили Хэндли, Торбена Пьетраллу, Макса Шелски и Сину Стерн за чтение и обсуждение рукописи. Мы благодарны нашим выдающимся техническим помощникам Джессике Гоньер, Бланке Рэндел и Ань-Туан Фаму. Мы признаем ценную поддержку установки светового микроскопа DZNE и установки для животных. Эта работа была поддержана Deutsche Forschungsgesellschaft (DFG), Международным фондом исследований параплегии (IRP) и Wings for Life (до F.B). Ф.B. является членом кластера передового опыта ImmunoSensation2, SFBs 1089 и 1158, и является лауреатом премии Роджера Де Споэльберха.
Материалы
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11006-12 | |
| Alexa Fluor 488 | Invitrogen | A21202 | Goat Anti-Mouse |
| Alexa Fluor 647 | Invitrogen | A21236 | Goat Anti-Mouse |
| Anti-Vimentin antibody | sigma-Aldrich | V2258-.2ML | Monoclonal mouse, clone LN-6, ascites fluid |
| B27 supplement | ThermoFisher Scientific | 17504044 | |
| Betadine | B. Braun | 3864154 | |
| Biozym Sieve GP Agarose | Biozyme | 850080 | |
| Braunol, Sprühflasche | B. Braun | 3864073 | |
| Buprenorphine (Temgesic) | GEHE Pharma | 345928 | |
| DAPI | sigma-Aldrich | D9542 | |
| DMZ unevirsal electrode puller | Zeitz | NA | |
| Electric razor | Andes | NA | ProClip UltraEdge Super 2-Speed model |
| Enrofloxacin (Baytril) | Bayer | 3543238 | 2,5% (wt/vol) |
| Eppendorf microloader pipette tips | FischerScientific | 10289651 | |
| Fast Green FCF | Sigma-Aldrich | F7252-5G | Dye content ≥ 85 % |
| Fetal Bovine Serum | ThermoFisher Scientific | 10500064 | |
| Fiji 2.1.0 | NIH | NA | https://imagej.net/software/fiji/downloads |
| Fine Scissors | Fine Science Tools | 14058-09 | ToughCut/Straight/9cm |
| FluoroDish Cell Culture Dish | World Precision Instruments | FD5040-100 | |
| Fluoromount Aqueous Mounting Medium | sigma-Aldrich | F4680-25ML | |
| Glucose | MedPex | 3705391 | 5% |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HBSS | Life Technologies | 14025092 | calcium, magnesium, no phenol red |
| Horse serum | Pan-Biotech | P30-0711 | |
| Imaris 9.7.2 | Bitplane | NA | https://imaris.oxinst.com/products/imaris-for-neuroscientists |
| Isoflurane | Virbac | NA | |
| Isotonic saline solution | B. Braun | 8609261 | 0.90% |
| Leica VT1200 S vibratome | Leica | 14048142066 | |
| LSM 880 with Airyscan | Zeiss | NA | |
| Metacam | Venusberg Apotheke | 8890217 | 5 mg/ml |
| Mice | Janvier Labs | NA | C57BL/6JRj |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Micropipette Storage Jar | World Precision Instruments | E210 | 16.16.27 |
| Microsoft Excel | Microsoft | NA | https://www.microsoft.com/en-us/microsoft-365/p/excel/cfq7ttc0k7dx?activetab=pivot:overviewtab |
| Millicell Cell Culture Insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm |
| Moria Perforated Spoons | Fine Science Tools | 10370-18 | |
| Moria Spoon | Fine Science Tools | 10321-08 | |
| Neurobasal Medium, minus phenol red | ThermoFisher Scientific | 12348017 | |
| Neuropan-2 supplement | Pan-Biotech | P07-11010 | |
| Normal goat serum | Abcam | ab138478 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| p-Tub-alpha-1-Dre | Addgene | 133925 | |
| p-Tub-alpha-1-iCre | Addgene | 133924 | |
| p-Tub-alpha-1-LifeAct-GFP | Addgene | 175437 | |
| Parafilm | VWR | 52858-000 | |
| Paraformaldehyde | sigma-Aldrich | P6148 | |
| PBS | Sigma-Aldrich | P3813-10PAK | |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | Addgene | 175438 | |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | Addgene | 175257 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| PicoNozzle Kit v2 | World Precision Instruments | 5430-ALL | |
| Platinum Tweezertrodes | Harvard Apparatus | 45-0487 | 1 mm / 3 mm |
| QIAGEN Maxi kit | QIAGEN | 12162 | |
| Reflex wound closure Clip | World Precision Instruments | 500344-10 | 7 mm |
| Sekundenkleber Pattex Mini Trio | Lyreco | 4722659 | |
| Square wave electroporation system ECM830 | Harvard Apparatus | W3 45-0052 | |
| Sterile gauze | Braun Askina | 9031216 | |
| Sterile lubricant eye ointment | Bayer Vital | PZN1578675 | |
| Sterile surgical gloves | Sempermed | 14C0451 | |
| Sucrose | Roth | 4621.2 | |
| Supramid 5-0 surgical silk sutures | B. Braun | NA | |
| Thin-wall glass capillaries | World Precision Instruments | TW100-4 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| µ-Slide 8 Well Glass Bottom | Ibidi | 80827 |
Ссылки
- Schelski, M., Bradke, F. Neuronal polarization: From spatiotemporal signaling to cytoskeletal dynamics. Molecular and Cellular Neurosciences. 84, 11-28 (2017).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews: Molecular Cell Biology. 10 (5), 332-343 (2009).
- Stoeckli, E. T. Understanding axon guidance: are we nearly there yet. Development. 145 (10), (2018).
- Bradke, F., Dotti, C. G. The role of local actin instability in axon formation. Science. 283 (5409), 1931-1934 (1999).
- Neukirchen, D., Bradke, F. Cytoplasmic linker proteins regulate neuronal polarization through microtubule and growth cone dynamics. Journal of Neuroscience. 31 (4), 1528-1538 (2011).
- Witte, H., Bradke, F. The role of the cytoskeleton during neuronal polarization. Current Opinion in Neurobiology. 18 (5), 479-487 (2008).
- Witte, H., Neukirchen, D., Bradke, F. Microtubule stabilization specifies initial neuronal polarization. Journal of Cell Biology. 180 (3), 619-632 (2008).
- Nichol, R. H., Catlett, T. S., Onesto, M. M., Hollender, D., Gomez, T. M. Environmental elasticity regulates cell-type specific RHOA signaling and neuritogenesis of human neurons. Stem Cell Reports. 13 (6), 1006-1021 (2019).
- Santos, T. E., et al. Axon growth of CNS neurons in three dimensions is amoeboid and independent of adhesions. Cell Reports. 32 (3), 107907 (2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1 (9), 761-772 (1988).
- Lin, C. H., Thompson, C. A., Forscher, P. Cytoskeletal reorganization underlying growth cone motility. Current Opinion in Neurobiology. 4 (5), 640-647 (1994).
- Myers, J. P., Gomez, T. M. Focal adhesion kinase promotes integrin adhesion dynamics necessary for chemotropic turning of nerve growth cones. Journal of Neuroscience. 31 (38), 13585-13595 (2011).
- Turney, S. G., et al. Nerve growth factor stimulates axon outgrowth through negative regulation of growth cone actomyosin restraint of microtubule advance. Molecular Biology of the Cell. 27 (3), 500-517 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature Neuroscience. 7 (2), 136-144 (2004).
- Ferent, J., Zaidi, D., Francis, F. Extracellular control of radial glia proliferation and scaffolding during cortical development and pathology. Frontiers in Cell and Developmental Biology. 8, 578341 (2020).
- Dent, E. W., Gupton, S. L., Gertler, F. B. The growth cone cytoskeleton in axon outgrowth and guidance. Cold Spring Harbor Perspectives in Biology. 3 (3), (2011).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29 (22), 3874-3886 (2019).
- Azzarelli, R., Oleari, R., Lettieri, A., Andre, V., Cariboni, A. In vitro, ex vivo and in vivo techniques to study neuronal migration in the developing cerebral cortex. Brain Sciences. 7 (5), (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Namba, T., et al. Pioneering axons regulate neuronal polarization in the developing cerebral cortex. Neuron. 81 (4), 814-829 (2014).
- Shah, B., et al. Rap1 GTPases are master regulators of neural cell polarity in the developing neocortex. Cerebral Cortex. 27 (2), 1253-1269 (2017).
- Wiegreffe, C., Feldmann, S., Gaessler, S., Britsch, S. Time-lapse confocal imaging of migrating neurons in organotypic slice culture of embryonic mouse brain using in utero electroporation. Journal of Visualized Experiments: JoVE. (125), (2017).
- de Anda, F. C., Meletis, K., Ge, X., Rei, D., Tsai, L. H. Centrosome motility is essential for initial axon formation in the neocortex. Journal of Neuroscience. 30 (31), 10391-10406 (2010).
- Sakakibara, A., et al. Dynamics of centrosome translocation and microtubule organization in neocortical neurons during distinct modes of polarization. Cerebral Cortex. 24 (5), 1301-1310 (2014).
- Schatzle, P., Kapitein, L. C., Hoogenraad, C. C. Live imaging of microtubule dynamics in organotypic hippocampal slice cultures. Methods in Cell Biology. 131, 107-126 (2016).
- Qu, X., Kumar, A., Bartolini, F. Live imaging of microtubule dynamics at excitatory presynaptic boutons in primary hippocampal neurons and acute hippocampal slices. STAR Protocols. 2 (1), 100342 (2021).
- Tonnesen, J., Katona, G., Rozsa, B., Nagerl, U. V. Spine neck plasticity regulates compartmentalization of synapses. Nature Neuroscience. 17 (5), 678-685 (2014).
- Buchsbaum, I. Y., Cappello, S. Neuronal migration in the CNS during development and disease: insights from in vivo and in vitro models. Development. 146 (1), (2019).
- Rigby, M. J., Gomez, T. M., Puglielli, L. Glial cell-axonal growth cone interactions in neurodevelopment and regeneration. Frontiers in Neuroscience. 14, 203 (2020).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annual Review of Neuroscience. 32, 347-381 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены