Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение первичных клеток гладкой мускулатуры аорты, специфичных для пациента, и полуколичественные измерения сокращения в режиме реального времени in vitro
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной работе описывается метод выделения и культивирования первичных, специфичных для пациента гладкомышечных клеток аорты человека и дермальных фибробластов. Кроме того, представлен новый метод измерения сокращения клеток и последующего анализа, который может быть использован для изучения специфических для пациента различий в этих клетках.
Аннотация
Гладкомышечные клетки (SMC) являются преобладающим типом клеток в аортальных средах. Их сократительный механизм важен для передачи силы в аорте и регулирует сужение сосудов и расширение сосудов. Мутации в генах, кодирующих белки сократительного аппарата SMC, связаны с заболеваниями аорты, такими как аневризмы грудной аорты. Измерение сокращения SMC in vitro является сложной задачей, особенно с высокой пропускной способностью, которая необходима для скрининга материала пациента. Доступные в настоящее время методы не подходят для этой цели. В данной работе представлен новый метод, основанный на электрическом датчике импеданса ячейки-подложки (ECIS). Во-первых, описан протокол эксплантата для выделения специфических для пациента первичных SMC человека из биопсии аорты и специфических для пациента первичных дермальных фибробластов человека для изучения аневризм аорты. Далее дается подробное описание нового метода сокращения для измерения сократительного ответа этих клеток, включая последующий анализ и предложение для сравнения различных групп. Этот метод может быть использован для изучения сокращения адгезивных клеток в контексте трансляционных (сердечно-сосудистых) исследований и исследований скрининга пациентов и лекарств.
Введение
Гладкомышечные клетки (SMC) являются преобладающим типом клеток в медиальном слое аорты, самом толстом слое аорты. Внутри стенки они радиально ориентированы и участвуют, среди прочих функций, в сужении сосудов и вазодилатации1. Сократительный механизм SMC участвует в передаче силы в аорте через функциональную связь с внеклеточным матриксом2. Мутации в генах, кодирующих белки сократительного аппарата SMC, такие как тяжелая цепь гладкого миозина (MYH11) и актин гладких мышц (ACTA2), были связаны со случаями семейных аневризм грудной аорты, подчеркивая актуальность сокращения SMC в поддержании структурной и функциональной целостности аорты 1,2 . Кроме того, мутации в сигнальном пути TGFβ также связаны с аневризмами аорты, и их влияние в патофизиологии аневризмы аорты также может быть изучено в фибробластах кожи3.
Высокопроизводительное измерение сокращения SMC in vitro является сложной задачей. Поскольку сократимость SMC не может быть измерена in vivo у людей, анализы in vitro на клетках человека представляют собой возможную альтернативу. Более того, развитие аневризмы брюшной аорты (ААА) на животных моделях либо химически индуцируется, например, перфузией эластазы, либо вызвано специфической мутацией. Таким образом, данные животных не сопоставимы с развитием ААА у людей, которое в основном имеет многофакторную причину, такую как курение, возраст и / или атеросклероз. In vitro Сократимость SMC до сих пор в основном измерялась с помощью микроскопии силы тяги 4,5, количественной оценки флуоресцентных внутриклеточных потоков кальцияFura-2 6 и анализов сморщивания коллагена7. В то время как тракционная микроскопия дает бесценное числовое представление о силах, генерируемых одной клеткой, она не подходит для высокопроизводительного скрининга из-за сложной математической обработки данных и анализа одной клетки за раз, что означает, что измерение репрезентативного количества клеток на одного донора занимает очень много времени. Анализы красителя Fura-2 и сморщивания коллагена позволяют поверхностно определять сокращение и не дают точного численного результата, что делает их менее подходящими для распознавания специфических для пациента различий. Нарушение сокращения SMC в клетках, полученных из аорты пациентов с аневризмой брюшной аорты, было впервые продемонстрировано путем оптимизации нового метода измерения сокращения SMC in vitro8. Это было сделано путем перепрофилирования метода измерения импеданса электрической ячейки-подложки (ECIS). ECIS - это анализ средней пропускной способности в режиме реального времени для количественной оценки поведения и сокращения клеток адгезивныхклеток 9,10,11, таких как рост и поведение SMC в анализах заживления ран и миграции 12,13,14. Точный метод описан в разделе протокола. Таким оптимизированным способом ECIS также может быть использован для изучения сокращения фибробластов из-за их одинакового размера и морфологии.
Целью данной работы является пошаговое описание метода измерения сокращения SMC in vitro с использованием ECIS8 и сравнение сокращения между контролем и SMC пациента. Во-первых, объясняется выделение и культивирование первичных SMC от контрольных и пациентских биопсий аорты, которые могут быть использованы для измерения сокращения. Во-вторых, описаны измерения и анализ сокращения, наряду с проверкой экспрессии маркера SMC. Кроме того, в данной работе описан метод выделения специфических для пациента дермальных фибробластов, сокращение которых может быть измерено с использованием той же методологии. Эти клетки могут быть использованы для специфических для пациента исследований, ориентированных на аневризму аорты или другие сердечно-сосудистые патологии15 или прогностических исследований с использованием протокола трансдифференциации, который позволяет измерять сокращение до операции аневризмы16.
протокол
ПРИМЕЧАНИЕ: Биопсия аорты была получена во время открытого восстановления аневризмы в медицинских центрах Амстердамского университета, Университетском медицинском центре VU, Амстердаме, Zaans Medisch Centrum, больнице Zaandam and Dijklander, Хорн, Нидерланды. Контрольная ткань аорты была получена из куска аорты, прикрепленного к почечной артерии, собранной для трансплантации почки. Были включены только пациенты старше 18 лет, и все пациенты дали свое информированное согласие на участие в исследовании. Все материалы были собраны в соответствии с правилами Хельсинкской декларации WMA и институциональными руководящими принципами Медицинского этического комитета Медицинского центра VU. Все эксперименты и экспериментальные протоколы были выполнены в соответствии с институциональными руководящими принципами и одобрены Медико-этическим комитетом Медицинского центра ВУ. Для получения полной информации об используемых контрольных и используемых клеточных линиях пациента обратитесь к пункту 8.
1. Выделение первичных SMC человека из биопсии аорты
ПРИМЕЧАНИЕ: Выполните следующие действия под стерильной культурой тканей ламинарной проточной вытяжкой. Надевайте перчатки и используйте стандартные асептические методы при обращении с образцами человеческой крови и тканей человека. SMC культивируются в 231 базальной среде гладкомышечных клеток гладкой мускулатуры человека, дополненной 100 ЕД / мл пенициллина, 100 мкг / мл стрептомицина и добавки для роста гладких мышц, называемой средой SMC.
- Стерилизуйте две пары хирургических щипцов и скальпель, погружая их в 70% этанол и впоследствии вытирая их насухо.
- Пипетка 2 мл среды SMC в чашке Петри, в которой будет выполнено рассечение тканей.
- Пипетка 2,5 мл среды SMC в две колбы T25. Закрутите колбы вокруг так, чтобы небольшой объем среды покрывал всю поверхность.
- Транспортировать собранную биопсию стенки аорты человека из операционной в лабораторию на льду в стерильной пластиковой трубке с холодным, стерильным раствором для переноса тканей (см. Таблицу материалов) или 0,9% NaCl.
- Откройте трубку с тканью внутри вытяжки культуры тканей. Возьмите биопсию из пробирки с помощью стерилизованных щипцов и поместите ее в чашку Петри (рисунок 1А).
- Визуально осмотрите биопсию, чтобы идентифицировать три слоя аорты: оболочку интима (внутренняя), среда (средняя) и адвентиция (внешний слой). Ищите наличие атеросклеротических бляшек на стороне интимы и слизистой соединительной ткани на адвентициальной стороне (рисунок 1B), чтобы различать слои.
- Чтобы изолировать SMC от носителя, удалите два других слоя. Сначала поместите ткань с бляшкой интимы вверх (рисунок 1B). Удалите твердую бляшку, вытащив ее из ткани щипцами, одновременно толкая ткань вниз другой парой щипцов. Удалите последующие слои налета до тех пор, пока не будет виден розовый, однородный медиальный слой.
- Переверните ткань (рисунок 1С). Повторите ту же процедуру, что и на шаге 1.7, сняв адвентивный слой (рисунок 1D). Обязательно удаляйте все видимые части за столько попыток, сколько необходимо, так как этот слой не будет легко отсоединяться от носителя.
ПРИМЕЧАНИЕ: Важно, чтобы интимальный и адвентиционный слои были удалены должным образом, чтобы получить как можно более чистую популяцию SMC. - Как только медиальный слой выделен, разрежьте ткань на кубики размером примерно 1 мм х 1 мм х 1 мм. Прижмите среду щипцами и разрежьте ткань в одном направлении с помощью скальпеля. Не режьте взад и вперед; делайте чистые, однонаправленные разрезы, чтобы свести к минимуму ущерб. Постарайтесь сделать как можно больше кубиков, учитывая размер биопсии (рисунок 1Е).
- Поместите кусочки ткани в верхнюю четверть колбы T25 с помощью щипцов. Поместите 10-20 кубиков на колбу, если количество материала позволяет это (рисунок 1F).
ПРИМЕЧАНИЕ: Используйте гладкие щипцы, чтобы свести к минимуму адгезию ткани к ребрам щипцов и легко отделить ткань в колбу. - Инкубируйте кубики тканей в колбах T25 в течение приблизительно 10 дней при 5% CO2 при 37 °C в инкубаторе.
ПРИМЕЧАНИЕ: Первый рост клеток ожидается примерно в это же время. Первоначально мигрирующие клетки могут выглядеть меньше, чем обычные SMC. - Как только рост клеток будет наблюдаться, добавьте 2,5 мл среды в колбу, следя за тем, чтобы она не попала на кусочки ткани, чтобы предотвратить их отсоединение.
- Еще примерно через 5 дней, когда вокруг кусочков ткани наблюдаются скопления клеток, меняют культуральную среду. Если кусочки ткани отделяются, удалите их, так как они не будут снова прикрепляться.
- Как только клетки сольются на 80-90%, перенесите их в колбу Т75 и продолжайте культивирование в этом формате.
ПРИМЕЧАНИЕ: Рекомендуется соотношение разделения 1:2 или 1:3. Заморозьте резервную копию клеток при раннем прохождении. Клетки обычно сохраняют свои свойства до прохождения 10; более поздние отрывки не должны использоваться для экспериментов.
2. Выделение первичных дермальных фибробластов из биопсии кожи
ПРИМЕЧАНИЕ: Выполните следующие действия под стерильной культурой тканей ламинарной проточной вытяжкой. Надевайте перчатки и используйте стандартные асептические методы при обращении с образцами человеческой крови и тканей человека. Фибробласты культивируют в базальной среде, дополненной 10% фетальной бычьей сывороткой, 100 ЕД / мл пенициллина и 100 мкг / мл стрептомицина, называемого фибробластной средой.
- Стерилизуйте две пары хирургических щипцов и скальпель, обмакнув их в 70% этанол и впоследствии вытирая их насухо.
- Пипетка 2 мл фибробластной среды в чашке Петри, в которой будет выполнено рассечение ткани.
- Пипетка 2,5 мл фибробластной среды в две колбы T25. Закрутите колбы вокруг так, чтобы небольшой объем среды покрывал всю поверхность.
- Транспортируйте собранную биопсию кожи из операционной в лабораторию на льду в холодном, стерильном растворе для переноса тканей (см. Таблицу материалов) или 0,9% NaCl в стерильной пластиковой трубке.
- Откройте трубку с тканью внутри вытяжки культуры тканей. Возьмите биопсию из пробирки с помощью стерилизованных щипцов и поместите ее в чашку Петри (рисунок 2А).
- Визуально осмотрите биопсию, чтобы определить три слоя кожи, эпидермис, дерму и подкожный жир. Ищите узнаваемую поверхность кожи, иногда с видимыми волосами, чтобы идентифицировать эпидермис. На противоположной стороне ищите подкожно-жировую клетчатку, которая часто бывает желтой и слизистой. Определите слой между эпидермисом и подкожным жиром как дерму - источник жизнеспособных фибробластов (рисунок 2B).
- Чтобы изолировать фибробласты из дермы, удалите два других слоя и поместите ткань на бок так, чтобы все три слоя были видны.
ПРИМЕЧАНИЕ: В отличие от ткани аорты, слои кожи не могут быть отделены друг от друга; следовательно, они должны быть разрезаны. Ткань также более резиновая, что затрудняет ее разрезание. Используйте острый скальпель. - Удерживайте ткань щипцами. Разрезают параллельно границе между эпидермисом и дермой. Отрежьте весь эпидермис. Старайтесь разрезать на одну чистую линию и не двигайтесь вперед и назад, чтобы избежать повреждения тканей.
- Переверните ткань. Повторите ту же процедуру, что и на шаге 2.8; на этот раз разрезают внутри дермы параллельно границе с подкожно-жировой клетчаткой.
- Как только дерма будет выделена, разрежьте ткань на кубики примерно 1 х 1 х 1 мм3. Прижмите ткань щипцами и разрежьте ткань в одном направлении с помощью скальпеля. Не режьте взад и вперед; делайте чистые, однонаправленные разрезы, чтобы свести к минимуму ущерб. Постарайтесь сделать как можно больше кубиков, учитывая размер биопсии (рисунок 2С).
- Поместите кусочки ткани в верхнюю четверть колбы T25 с помощью щипцов. Поместите по 10-20 кубиков на колбу, если количество материала позволяет это (рисунок 2D).
ПРИМЕЧАНИЕ: Используйте гладкие щипцы, чтобы свести к минимуму адгезию ткани к ребрам щипцов и легко отделить ткань в колбу. - Инкубируйте кубики тканей в колбах T25 в течение приблизительно 10 дней при 5% CO2 при 37 °C в инкубаторе.
ПРИМЕЧАНИЕ: Первый рост клеток ожидается примерно тогда. Клетки, которые первоначально мигрируют, могут выглядеть меньше, чем нормальные фибробласты. - Как только рост клеток будет наблюдаться, добавьте 2,5 мл среды в колбу, следя за тем, чтобы она не попала на кусочки ткани, чтобы предотвратить их отсоединение.
- Еще примерно через 5 дней, когда скопления клеток можно наблюдать вокруг кусочков ткани, меняют культуральную среду. Если кусочки ткани отделяются, удалите их, так как они не будут снова прикрепляться.
- Как только клетки сольются на 80-90%, перенесите их в колбу Т75 и продолжайте культивирование в этом формате.
ПРИМЕЧАНИЕ: Рекомендуется соотношение разделения 1:2 или 1:3. Заморозьте резервную копию клеток при раннем прохождении. Клетки обычно сохраняют свои свойства до прохождения 10; более поздние отрывки не должны использоваться для экспериментов.
3. Измерение сокращения (пример SMC)
- Подготовьте массив ECIS 96w10e (см. рисунок 3A для репрезентативного изображения массива с увеличенными электродами и ячейками, засеянными на электродах).
ПРИМЕЧАНИЕ: Выполните следующие действия под стерильной культурой тканей ламинарной проточной вытяжкой.- Покрыть стерильный массив 96w10e 200 мкл 10 мМ L-цистеина на скважину в течение 30 мин при комнатной температуре.
- Дважды вымойте тарелку стерильной водой. Дайте пластине высохнуть в течение ночи в вытяжке для культивирования тканей со слегка приоткрытой крышкой.
ПРИМЕЧАНИЕ: Покрытие пластины L-цистеином необходимо только при первом использовании пластины. - На следующий день УФ-стерилизуют пластину и крышку на 30 мин. Поверните крышку вверх так, чтобы внутренняя часть была стерилизована. После того, как пластина будет стерилизована, не открывайте пластину снаружи вытяжки.
- Посевные ячейки в массиве ECIS
- Предваренный 1% стерильный желатиновый раствор на водяной бане в течение 30 мин.
ПРИМЕЧАНИЕ: Раствор хранится в холодильнике и может затвердеть, что затрудняет пипетку. - Затем покрывают лунки 100 мкл 1 % раствора желатина на лунку и инкубируют пластину при 37 °C в течение не менее 1 ч.
- Аспирировать желатин из лунок.
- Подсчитайте ячейки с помощью автоматизированного счетчика клеток и засейте SMC в трипликате при плотности посева 30 000 клеток на лунку в 200 мкл среды SMC.
- Поместите пластину с SMC в держатель ECIS 96-лунки в инкубаторе клеточных культур. Дважды щелкните программное обеспечение ECIS Applied Biophysics , чтобы открыть программу, и нажмите кнопку Setup .
- Проверьте, имеют ли все электроды контакт с держателем (зеленый; красный, если нет соединения) на левой нижней панели с надписью «Конфигурация скважины». Если электроды не подключены должным образом, отрегулируйте пластину в держателе перед началом измерения.
- Выберите тип пластины (массив из 96 скважин) на той же панели, щелкнув Тип массива.
- В правой верхней панели Data Collection Setup нажмите на одну частоту и измените значение импеданса на 4000 Гц и интервал на 8 с.
- Нажмите кнопку Пуск , чтобы начать измерения. Дождитесь открытия новой панели, где можно сохранить ECIS-файл.
- Дайте ячейкам прикрепиться и установите монослой в течение 48 ч.
ПРИМЕЧАНИЕ: Прикрепление и распространение ячеек на электродах создает базовое значение сопротивления (рисунок 3B).
- Предваренный 1% стерильный желатиновый раствор на водяной бане в течение 30 мин.
- Стимуляция клеток, чтобы вызвать сокращение
- Индуцируют сокращение SMC путем стимуляции клеток 10 мкг/мл ионофора кальция, иономицина.
ПРИМЕЧАНИЕ: Иономицин будет индуцировать приток внеклеточного Ca2+, активируя сократительный каскад; См. Рисунок 4А для репрезентативных изображений нестимулированных и стимулированных сократительных клеток. - Развести 1 мг порошка иономицина в 100 мкл диметилсульфоксида, чтобы получить запасной раствор 10 мг/мл, и хранить 10 мкл аликвот при -20 °C. Перед применением разводят раствор иономицина 1:10 в среде SMC для приготовления рабочего раствора для добавления в клетки.
- Выполняйте стимуляцию клеток, пока массив все еще находится в держателе массива внутри инкубатора клеточной культуры, и электроды прикреплены к системе.
- Чтобы стимулировать клетки, снимите крышку и поместите ее на стерильную поверхность внутри инкубатора. Подготовьте две пипетки, установленные по 2 мкл и 150 мкл.
- Перед началом стимуляции нажмите Mark в программном обеспечении и поместите комментарий.
ПРИМЕЧАНИЕ: Это облегчит поиск точных сроков стимуляции при анализе данных. - Пипетка 2 мкл рабочего раствора иономицина в каждую лунку как можно быстрее. После того, как все клетки будут стимулированы, смешайте среду в лунках, используя вторую пипетку.
ПРИМЕЧАНИЕ: Из-за быстрого воздействия нет необходимости менять наконечники между различными клеточными линиями и условиями. Работайте быстро, стимулируя и смешивая, потому что иономицин оказывает острое действие. При стимуляции полноценной тарелки стимулируйте максимум 3 колонки сразу. После каждой стимуляции подождите не менее 30 минут до следующей стимуляции, чтобы позволить клеткам восстановиться после изменения температуры и CO2 , вызванного открытием дверцы инкубатора. - Сразу после того, как стимуляция сделана, нажмите Mark еще раз, чтобы добавить комментарий о том, что стимуляция выполнена.
- Завершение эксперимента по стимуляции
- Записывайте значения импеданса в течение примерно 5 мин после стимуляции иономицином. Завершите запись, нажав клавишу Finish.
- Повторно используйте массивы ECIS до трех раз: дважды промывайте колодцы стерильной водой и инкубируйте пластину при 37 °C в течение 2-3 ч трипсином или аналогичным реагентом. Повторите шаги 3.1.2 и 3.1.3.
- Индуцируют сокращение SMC путем стимуляции клеток 10 мкг/мл ионофора кальция, иономицина.
- Экспорт данных
- Чтобы экспортировать данные, щелкните Файл | Экспорт данных | В Excel (выбрано). Выберите папку для сохранения файла.
- Нажмите кнопку Разделить , когда программа попросит объединить или разделить листы.
- Анализ сократительного выхода
- Чтобы рассчитать сократительную реакцию, используйте следующее уравнение (1), где C указывает на сокращение (выраженное в % от изменения по сравнению с исходным уровнем), престимуляция (PrS) указывает на значение сопротивления (выраженное в Ω) непосредственно перед стимуляцией иономицина, а постстимуляция (PoS) указывает на сопротивление (выраженное в Ω) через 2 мин после окончания стимуляции.
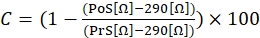 (1)
(1)
ПРИМЕЧАНИЕ: Как показано в уравнении (1), значение импеданса скважины, заполненной питательной средой без каких-либо прикрепленных ячеек (значение 290 Ω), вычитается из всех результатов в окончательном расчете. Рекомендуется измерять сократительные реакции в трех экземплярах в каждом эксперименте и выполнять три независимых эксперимента с одной и той же клеточной линией для учета любых меж- и внутриэкспериментальных вариаций. - После того, как три независимых эксперимента были выполнены, сгруппируйте данные вместе, вычислив среднее значение трех измерений, включая стандартное отклонение (SD).
- Чтобы рассчитать сократительную реакцию, используйте следующее уравнение (1), где C указывает на сокращение (выраженное в % от изменения по сравнению с исходным уровнем), престимуляция (PrS) указывает на значение сопротивления (выраженное в Ω) непосредственно перед стимуляцией иономицина, а постстимуляция (PoS) указывает на сопротивление (выраженное в Ω) через 2 мин после окончания стимуляции.
- Сравнение различных групп
- Чтобы определить диапазон нормального сокращения и исследовать последующие конкретные исследовательские вопросы, используйте контрольную группу для определения «нормального сокращения» и сравните его с сократительной реакцией пациентов или групп лечения.
- Вычислите среднее и SD всей контрольной группы, т.е. конечные значения для всех клеточных линий, как описано в шаге 3.5.2.
- Используйте диапазон среднего ± 2SD для идентификации клеток в другой группе, которые выходят за пределы этого диапазона, указывая, что они имеют измененный сократительный ответ.
ПРИМЕЧАНИЕ: Механизм, лежащий в основе измененного сократительного ответа, подлежит конкретным исследовательским вопросам и зависит от клеток и состояний и не будет обсуждаться в настоящем протоколе.
4. Обнаружение наличия специфических маркеров SMC
- Выделение РНК
- Посейте те же специфические для пациента клеточные линии, которые используются для измерений сокращения, в 6-луночных пластинах, по одной лунке на клеточную линию. Подсчитайте клетки с помощью автоматизированного счетчика клеток и засейте клетки с плотностью посева 200 000 клеток / скважина в среде SMC и позвольте им присоединиться в течение ночи.
- Вымойте клетки один раз стерильным PBS.
- Разрисуйте клетки и изолируйте клетки в соответствии с инструкциями производителя.
- Синтез кДНК
- Осуществляют синтез кДНК в 20 мкл реакционной смеси обратной транскрипции. Разбавляют концентрации общей изолированной РНК в соответствии с инструкциями, предоставленными производителем.
- qPCR
- Измерьте экспрессию генов маркеров SMC, например, ACTA2, CNN1, SMTN и TAGLN , чтобы подтвердить, что изолированные клетки действительно являются SMC, и обнаружить маркеры SMC. Проверьте корреляцию результатов с сократительным выходом.
- Используйте по крайней мере два гена домашнего хозяйства для нормализации данных, например, YWHAZ и TBP.
ПРИМЕЧАНИЕ: Запуск и анализ qPCR могут быть выполнены с использованием различных ПЦР-машин и совместимого программного обеспечения, в зависимости от того, что доступно и оптимизировано в лаборатории. Последовательности праймеров см. в дополнительной таблице S1 .
Результаты
Чтобы проверить воспроизводимость этого метода, метод был сначала проверен с использованием только контрольных SMC. Для определения воспроизводимости межэкспериментальных измерений два независимых измерения всех включенных контрольных и пациентских клеточных линий были построены в...
Обсуждение
В данной работе представлен метод измерения сокращения SMC in vitro, основанный на изменениях импеданса и занятия поверхности. Во-первых, описывается выделение, культивирование и расширение специфических для пациента первичных человеческих SMC и фибробластов кожи, а затем то, как испол?...
Раскрытие информации
У авторов нет конфликта интересов, о которых можно было бы заявить.
Благодарности
Мы хотели бы с благодарностью поблагодарить Тару ван Мерриенбоер, Альберта ван Вейка, Йоланду ван дер Фельден, Яна Д. Бланкенштейна, Лана Трана, Питера Л. Хордейка, команду PAREL-AAA и всех сосудистых хирургов Амстердамского UMC, Zaans Medisch Centrum и больницы Dijklander за предоставление материалов и поддержку для этого исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| 96-well Array | Applied Biophysics | 96W10idf PET | Array used to measure contraction in the ECIS setup |
| Custodiol | Dr. Franz Höhler Chemie GmbH | RVG 12801 | Solution used to transfer tissue in from surgery room to laboratorium |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | Solution used to dilute ionomycin |
| Fetal Bovine Serum | Gibco | 26140079 | Addition to cell culture medium |
| Ham's F-10 Nutrient Mix | Gibco | 11550043 | Medium used to culture skin fibroblasts |
| Human Vascular Smooth Muscle Cell Basal Medium (formerly ''Medium 231'') | Gibco | M231500 | Medium used to culture smooth muscle cells |
| Invitrogen countess II | Thermo Fisher Scientific | AMQAX1000 | Automated cell counter |
| Ionomycin calcium salt from Streptomyces conglobatus | Sigma-Aldrich | I0634-1MG | Compound used for contraction stimulation |
| NaCl 0.9% | Fresenius Kabi | B230561 | Solution used to transfer tissue in from surgery room to laboratorium |
| Penicillin-Streptomycin | Gibco | 15140122 | Antibiotics used for cell culture medium |
| Phospathe buffered saline | Gibco | 10010023 | Used to wash cells |
| Quick-RNA Miniprep Kit | Zymo Research | R1055 | Kit used for RNA isolation |
| Smooth Muscle Growth Supplement (SMGS) | Gibco | S00725 | Supplement which is added to smooth muscle cell culture medium |
| SuperScript VILO cDNA Synthesis Kit | Thermo Fisher Scientific | 11754250 | Kit used for cDNA synthesis |
| SYBR Green PCR Master Mix | Thermo Fisher Scientific | 4309155 | Reagent for qPCR |
| Trypsin-EDTA | Gibco | 15400-054 | Used to trypsinize cells |
| ZTheta | Applied Biophysics | ZTheta | ECIS instrument used for contraction measurements |
Ссылки
- Milewicz, D. M., et al. Genetic basis of thoracic aortic aneurysms and dissections: focus on smooth muscle cell contractile dysfunction. Annual Review of Genomics and Human Genetics. 9, 283-302 (2008).
- Milewicz, D. M., et al. Altered smooth muscle cell force generation as a driver of thoracic aortic aneurysms and dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (1), 26-34 (2017).
- Groeneveld, M. E., et al. Betaglycan (TGFBR3) up-regulation correlates with increased TGF-β signaling in Marfan patient fibroblasts in vitro. Cardiovascular Pathology. 32, 44-49 (2018).
- Chen, J., Li, H., SundarRaj, N., Wang, J. H. C. Alpha-smooth muscle actin expression enhances cell traction force. Cell Motility and the Cytoskeleton. 64 (4), 248-257 (2007).
- Peyton, S. R., Putnam, A. J. Extracellular matrix rigidity governs smooth muscle cell motility in a biphasic fashion. Journal of Cellular Physiology. 204 (1), 198-209 (2005).
- Williams, D. A., Fogarty, K. E., Tsien, R. Y., Fay, F. S. Calcium gradients in single smooth muscle cells revealed by the digital imaging microscope using Fura-2. Nature. 318 (6046), 558-561 (1985).
- Wu, D., et al. NLRP3 (nucleotide oligomerization domain-like receptor family, pyrin domain containing 3)-caspase-1 inflammasome degrades contractile proteins: implications for aortic biomechanical dysfunction and aneurysm and dissection formation. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (4), 694-706 (2017).
- Bogunovic, N., et al. Impaired smooth muscle cell contractility as a novel concept of abdominal aortic aneurysm pathophysiology. Scientific Reports. 9 (1), 1-14 (2019).
- Hurst, V., Goldberg, P. L., Minnear, F. L., Heimark, R. L., Vincent, P. A. Rearrangement of adherens junctions by transforming growth factor-β1: role of contraction. American Journal of Physiology-Lung Cellular and Molecular Physiology. 276 (4), 582-595 (1999).
- Hu, N., et al. Comparison between ECIS and LAPS for establishing a cardiomyocyte-based biosensor. Sensors and Actuators B: Chemical. 185, 238-244 (2013).
- Peters, M. F., Lamore, S. D., Guo, L., Scott, C. W., Kolaja, K. L. Human stem cell-derived cardiomyocytes in cellular impedance assays: bringing cardiotoxicity screening to the front line. Cardiovascular Toxicology. 15 (2), 127-139 (2015).
- Zhang, S., Yang, Y., Kone, B. C., Allen, J. C., Kahn, A. M. Insulin-stimulated cyclic guanosine monophosphate inhibits vascular smooth muscle cell migration by inhibiting Ca/calmodulin-dependent protein kinase II. Circulation. 107 (11), 1539-1544 (2003).
- Halterman, J. A., Kwon, H. M., Zargham, R., Bortz, P. D. S., Wamhoff, B. R. Nuclear factor of activated T cells 5 regulates vascular smooth muscle cell phenotypic modulation. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (10), 2287-2296 (2011).
- Bass, H. M., Beard, R. S., Cha, B. J., Yuan, S. Y., Nelson, P. R. Thrombomodulin induces a quiescent phenotype and inhibits migration in vascular smooth muscle cells in vitro. Annals of Vascular Surgery. 30, 149-156 (2016).
- Burger, J., et al. Molecular phenotyping and functional assessment of smooth muscle like-cells with pathogenic variants in aneurysm genes ACTA2, MYH11, SMAD3 and FBN1. Human Molecular Genetics. , (2021).
- Yeung, K. K., et al. Transdifferentiation of human dermal fibroblasts to smooth muscle-like cells to study the effect of MYH11 and ACTA2 mutations in aortic aneurysms. Human Mutation. 38 (4), 439-450 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены