Method Article
Эффективное и масштабируемое производство полноразмерных вариантов гентингтина человека в клетках млекопитающих с использованием переходной системы экспрессии
В этой статье
Резюме
Мы предоставляем масштабируемые протоколы, охватывающие конструкцию конструкции, транзиторную трансфекцию, а также экспрессию и очистку полноразмерных вариантов белка гентингтина человека в клетках HEK293.
Аннотация
Полноразмерный гентингтин (FL HTT) представляет собой крупный (aa 1-3,144), везде выраженный, полиглутамин (polyQ)-содержащий белок массой примерно 350 кДа. Хотя клеточная функция FL HTT не совсем понятна, мутантное расширение тракта polyQ выше ~ 36 повторов связано с болезнью Гентингтона (HD), причем длина polyQ коррелирует примерно с возрастом начала. Чтобы лучше понять влияние структуры на функцию мутантного HTT (mHTT), требуется большое количество белка. Субмиллиграммная продукция FL HTT в клетках млекопитающих была достигнута с использованием доксициклин-индуцируемой стабильной экспрессии клеточной линии. Тем не менее, производство белка из стабильных клеточных линий имеет ограничения, которые могут быть преодолены с помощью методов транзиторной трансфекции.
В данной работе представлен надежный метод получения низкомиллиграммового количества FL HTT и его вариантов из кодон-оптимизированных плазмид путем транзиторной трансфекции с использованием полиэтиленимина (PEI). Метод является масштабируемым (>10 мг) и последовательно дает 1-2 мг/л клеточной культуры высокоочищенного FL HTT. В соответствии с предыдущими докладами было установлено, что состояние очищенного раствора FL HTT является высокодинамичным; белок имеет склонность к образованию димеров и олигомеров высокого порядка. Ключом к замедлению образования олигомеров является быстрая работа по выделению мономерных фракций из димерных и олигомерных фракций высокого порядка во время эксклюзионной хроматографии размеров.
Эксклюзионная хроматография с многоугольным рассеянием света (SEC-MALS) использовалась для анализа димерного и олигомерного содержания более высокого порядка очищенного HTT. Корреляции между длиной полиQ FL HTT (Q23, Q48 и Q73) и содержанием олигомера не наблюдалось. Конструкция exon1-deleted (aa 91-3,144) показала сопоставимую склонность к олигомеризации к FL HTT (aa 1-3,144). В настоящем описаны способы производства, очистки и характеризации по SEC/MALS-рефракционному индексу (RI), электрофорезу додецилсульфат-полиакриламидного геля натрия (SDS-PAGE), вестерн-блоттингу, native PAGE и Blue Native PAGE.
Введение
Болезнь Гентингтона (БГ) является редким нейродегенеративным заболеванием, в первую очередь характеризующимся неустойчивым и непроизвольным двигательным движением, а также когнитивными и психиатрическими изменениями, такими как изменения личности и апатия 1,2. БГ связана с расширением CAG-речевого тракта, расположенного в экзоне 1 гена гентингтина (HTT), до более чем 35 повторов, причем большее количество ЦАГ-повторов коррелирует с более ранним началом заболевания 3,4. Поступательный продукт HTT, белок гентингтина (HTT), участвует в жизнеспособности нейронов и развитии мозга 5,6,7,8,9.
HTT представляет собой каркасный белок, который, как сообщается, участвует в широком спектре клеточных процессов, транспорте пузырьков, делении клеток, цилиогенезе и аутофагии10,11. Однако молекулярный патогенез БГ не совсем ясен, а идентификация ключевых белковых интеракторов, опосредующих патологическое воздействие полиQ-вспененного мНТТ, отсутствует. Некоторые исследования показывают усиление токсической функции от mHTT, обусловленное склонностью к олигомеризации расширенного белка HTT, поскольку агрегаты HTT были идентифицированы в нейронах и глии у пациентов с БГ и животных моделей заболевания 12,13,14,15,16,17 . Чтобы стимулировать исследование функции и структуры вариантов FL HTT и mHTT и снабжать исследователей высококачественными стандартами белка для разработки анализов, необходим надежный и масштабируемый запас однородного рекомбинантного белка.
Из-за своего размера (aa 1-3,144, нумерация основана на длине polyQ Q23), протеолитической нестабильности и склонности к агрегации, FL HTT оказалось трудно экспрессировать и изолировать как растворимый белок. Ранее область экзона 1 (aa 2-90) HTT была экспрессирована и очищена в больших масштабах с использованием различных меток, которые могут увеличить растворимость белка в Escherichia coli 18,19,20. FL HTT был впервые экспрессирован и очищен в системе экспрессии клеток насекомых с использованием бакуловируса21,22, а структуры электронной микроскопии с низким разрешением 30 Å (EM) химически сшитых FL Q23-HTT и Q78-HTT были зарегистрированы23. Исследование структуры HTT получило дальнейшее развитие, когда производство FL Q17, Q46 и Q128-HTT с нативными посттрансляционными модификациями (PTM) было достигнуто в клетках человека с использованием стабильных клеточных линий или систем экспрессии аденовируса24. Эти исследования показывают, что, хотя очищенный HTT в основном существует в мономерном состоянии, он также имеет тенденцию образовывать олигомеры и агрегаты высокого порядка.
Аналитическое ультрацентрифугирование FL Q128-HTT с высокорасширенной областью polyQ дало больше олигомерных и агрегатных фракций, чем белок с нерасширенной областьюpolyQ 24. Используя стабильную клеточную линию, стратегия была успешно адаптирована для стабилизации FL HTT путем совместной экспрессии с партнером по взаимодействию HAP40. Крио-ЭМ-структура комплекса FL HTT и HAP40 была решена со средним разрешением 4 Å с использованием очищенного белкового комплекса (PDB:6EZ8)25. Эта стратегия совместной экспрессии была успешно адаптирована к системе бакуловируса, и ряд высококачественных вариантов HTT с различной длиной polyQ были экспрессированы и очищены от клеток насекомых26. С тех пор в Базу данных белка27,28 (PDB: 7DXK, 7DXH, 6X9O) было решено и депонировано больше крио-ЭМ структур комплекса HTT с переменными длинами polyQ и структурами HAP40 и более высокого разрешения.
Мы оптимизировали метод трансфекции и экспрессии в клетках HEK293, используя полиэтиленимин (PEI), для быстрой транзиторной экспрессии FL HTT. В качестве доказательства принципа варианты FL HTT, содержащие 23 глутамина (FL Q23-HTT), были сначала очищены и охарактеризованы с использованием модификации способа очистки, описанного ранее24. Этот метод транзиторной трансфекции удобен, высокоэффективный и масштабируемый; он может продуцировать очищенный HTT с выходом 1-2 мг/л, сопоставимый со стабильным методом клеточной линии, о котором сообщается24. Поскольку белок продуцируется в клеточной линии человека, продуцируемый HTT с большей вероятностью будет иметь нативные ПТМ человека при проведении масс-спектрометрического протеомического анализа 11,29,30,31. Были получены миллиграммовые количества вариантов FL Q48-HTT, FL Q73-HTT и exon1-deleted (ΔExon1-HTT), демонстрирующие, что метод переходной экспрессии особенно полезен для быстрого получения альтернативных вариантов HTT без зависимости от трудоемких усилий, необходимых для создания стабильных клеточных линий для производства.
Следующий протокол иллюстрирует стандартный метод, используемый в лаборатории этих авторов для клеточной культуры, трансфекции, очистки белка и характеристики белка после очистки для получения FL Q23-HTT из культуры клеток 2 L. Протокол может быть расширен до более крупных культур или адаптирован для очистки других вариантов HTT. До 10 L клеточных культур FL HTT и различные мутации сайта или усечения гомологов HTT и HTT были успешно выполнены в лаборатории с использованием того же протокола. Очищенный FL HTT содержит высокий процент мономеров наряду с димерами и олигомерами более высокого порядка. Такой же совокупный профиль наблюдается среди выпускаемых вариантов (Q23, Q48, Q73 и исключенный Exon1). Поскольку агрегация может произойти, когда не принимается надлежащий уход, было проведено исследование стабильности состава и замораживания-оттаивания для определения наилучших условий для обработки белка. Также описаны такие методы, как Blue Native PAGE и SEC/MALS-RI, для анализа содержания олигомеров HTT в рамках процесса контроля качества. Чтобы принести пользу исследовательскому сообществу БГ, плазмиды и белки HTT, описанные в этом исследовании, также депонируются в репозитории сообщества БГ в Институте Кориелла (www.coriell.org/1/CHDI).
протокол
1. Проектирование и изготовление конструкций для выражения млекопитающих HTT с тегом FLAG
- Получите полноразмерную последовательность белка HTT человека (P42858) из Национального центра биотехнологической информации (https://www.ncbi.nlm.nih.gov/).
ПРИМЕЧАНИЕ: Исследователи должны быть знакомы с доменными организациями HTT и поддерживать основную 3D-структуру HTT при проектировании конструкций для мутантов HTT. - Запросите службу синтеза генов для выполнения оптимизации кодонов для экспрессии клеток человека на основе последовательности P42858. Измените число polyQ с Q16 на желаемую длину Q (Q23 был выбран в качестве первой конструкции здесь) и синтезируйте полноразмерный ген HTT .
ПРИМЕЧАНИЕ: Синтезированная кодон-оптимизированная полноразмерная конструкция Q23-HTT была доставлена в качестве вставки в плазмиду pUC18 в этом исследовании. - Необязательно: Добавлены функции для облегчения клонирования различных длин Q и очистки в конструкциях.
ПРИМЕЧАНИЕ: Участок расщепления вируса травления табака (TEV) и метка очистки FLAG (AAAENLYFQGDYKDDDDK) были добавлены в C-конце конструкций. Два сайта HindIII были спроектированы в конструкциях, чтобы охватить область polyQ (переведенная белковая последовательность не изменяется путем введения сайтов HindIII). Это позволяет исследователю изменять длину Q HTT путем переваривания фермента рестрикции и лигирования без ресинтезации полного гена HTT .
2. Клонирование синтезированных конструкций HTT в pcDNA3.1.
- Переваривает 5 мкг pUC18-Q23-HTT и 5 мкг pcDNA3.1, используя по 2 мкл NheI и PmeI каждый при 37 °C в течение 2 ч.
- Запустите 0,5% мас./об.агарозного геля и очистите фрагмент Q23-HTT и переваренный вектор pcDNA3.1 с помощью набора для экстракции агарозного геля. Количественно оцените концентрации очищенной ДНК OD280 с помощью УФ-спектрометра, который может измерять микролитры образцов.
ПРИМЕЧАНИЕ: Обычно наблюдается OD260/280 в диапазоне от 1,8 до 2,0. Синтезированный FL HTT поставляется в виде вставки с NheI и PmeI на обоих концах в плазмиде pUC18. Используйте другие ферменты рестрикции, если HTT синтезируется по-другому. - Используйте 10 нг переваренной пхДНК3.1 вектора в реакции. Лигировать очищенные ДНК при молярном соотношении 1:1 (HTT:pcDNA3.1) в реакции 10 мкл при комнатной температуре в течение 5 мин с использованием ДНК-лигазы Т4.
- Преобразовать лигированный продукт в компетентные клетки E. coli (см. Таблицу материалов) с использованием протокола, указанного производителем лигазы.
- Соберите 6 одиночных колоний и сделайте ночные культуры в 4-6 мл LB с добавлением 100 мкг/мл карбенициллина при 37 °C.
- Выделите 1 мл с каждой ночной культуры. Добавьте глицерин до 25% v/v и сохраните запас глицерина при -80 °C. Очистите оставшуюся культуру на ночь с помощью мини-комплекта для подготовки в соответствии с шагами, указанными в руководстве пользователя.
- Секвенировать все плазмиды с помощью секвенирующих праймеров, охватывающих область транскрипции плазмиды. Выберите один запас глицерина, который имеет правильную последовательность в качестве основного запаса глицерина, и отбросьте остальные.
- Необязательно: Запросите службу синтеза генов для синтеза ДНК с различными длинами Q (Q48, Q73 и Exon1), которые охватывают два сайта HindIII в плазмиде pcDNA3.1-Q23-HTT. Переваривайте pcDNA3.1-Q23-HTT и вновь синтезированные ДНК с использованием HindIII и религитируйте их с T4 лигазой, как на этапах 2.2-2.7, чтобы получить FL HTT с различной длиной polyQ в плазмиде pcDNA3.1.
ПРИМЕЧАНИЕ: Плазмидные конструкции, используемые в этом исследовании, также доступны непосредственно из репозитория сообщества HD в Институте Кориелла (www.coriell.org/1/CHDI); см. Таблицу материалов.
3. ГИГА преп без эндотоксинов плазмидная ДНК для крупномасштабной трансфекции
- Проведите полосу бактериальных глицериновых запасов pcDNA3.1-Q23-HTT-TEV-FLAG на агаровой пластине LB с карбенициллином (100 мкг/мл). Инкубируют пластину при 37 °C в течение 16-24 ч до появления одиночных колоний.
- Возьмите одну колонию, привите 5 мл закваски в богатой среде, предназначенной для плазмидного амплификации карбенициллином (100 мкг/мл), и выращивайте при 37 °C в течение 8 ч.
- Выберите комплект для очистки плазмид GIGA без эндотоксинов. Выполните действия, описанные в руководстве по набору плазмиды GIGA для очистки плазмиды pcDNA3.1-Q23-HTT-TEV-FLAG.
- Измерьте уровни плазмидного эндотоксина с помощью набора для количественной оценки эндотоксинов на основе лизата лизута (LAL). Следуйте процедуре, указанной в руководстве производителя.
ПРИМЕЧАНИЕ: Высококачественная плазмидная очистка с низким уровнем эндотоксина необходима для получения хорошей эффективности трансфекции. Используя этот протокол, можно получить 20-40 мг плазмиды (сверхспиративная форма >80%) на л бактериальной культуры при концентрациях плазмиды > 4 мг/мл. Правильно очищенная плазмида должна иметь уровень эндотоксина < 30 ЕС / мг. Обычно наблюдается OD260/280 в диапазоне от 1,8 до 2,0.
4. Крупномасштабная трансфекция 2 л элементов HEK293 полиэтиленимином (PEI)
- Добавьте 1 г PEI 25K к 1 л воды без эндотоксинов при перемешивании. Отрегулируйте pH до 2,0, используя 100 мМ HCl, и перемешивайте до тех пор, пока весь PEI 25K не растворится. Отрегулируйте pH до 7,0 с помощью раствора NaOH 100 мМ и фильтруйте через фильтр 0,2 мкм. Aliquot и хранить при -20 °C до года.
ПРИМЕЧАНИЕ: Аликвоты PEI можно хранить при температуре 4 °C до двух недель, но никогда не следует повторно замораживать после оттаивания. - Размножают клетки HEK293 в питательной среде (см. Таблицу материалов), дополненной пенициллин-стрептомицином (конечная концентрация в 5 ЕД/мл для пенициллина и 5 мкг/мл для стрептомицина) в увлажненном шейкерном инкубаторе при 37 °C, 90 об/мин, 5% CO2 в течение 18-24 ч. Разбавляют клетки до 2 л при плотности ~1,2 × 106 клеток/мл с использованием питательной среды в колбах Эрленмейера по 5 л за один день до трансфекции.
- Продолжают расти клетки при 37 °C, 90 об/мин, 5% CO2 в течение 18-24 ч. Измерьте параметры ячейки с помощью автоматического счетчика ячеек, способного измерять плотность и жизнеспособность ячеек в соответствии с руководством пользователя.
ПРИМЕЧАНИЕ: Плотность клеток должна удвоиться, а жизнеспособность должна составлять >95%. Плотность клеток до трансфекции должна составлять приблизительно 2,0 × 10 6-2,4 × 10 6 клеток/мл. Разбавьте клетки до нужной плотности перед трансфекцией, когда это необходимо. - Рассчитать количество плазмиды и ПЭИ, необходимых для трансфекции; использовать 1 мг плазмиды и 3 мг ПЭИ для трансфекции каждого литра клеточной культуры. Выделяют 2 мг плазмиды и 6 мг PEI, необходимых для 2-литровой трансфекции.
- Разводят плазмиду и ПЭИ по отдельности в объем фосфатно-буферного физиологического раствора, равный 1/20от общего объема клеточной культуры (по 100 мл на трансфекцию 2 л) и инкубируют при комнатной температуре в течение 5 мин. Смешайте разбавленную плазмиду и PEI путем осторожного закручивания и инкубируйте смесь при комнатной температуре в течение 30 мин.
ПРИМЕЧАНИЕ: Смесь будет казаться слегка мутной после инкубации. - Добавьте смесь в культуру клеток и осторожно закрутите, чтобы перемешать их.
- Выращивайте клетки при 37 °C, 5% CO2, 90 об/мин в течение 24 ч.
- Добавьте 2 М раствора бутирата натрия до конечной концентрации 2 мМ. Добавьте в культуру антикомпонент 1:1000 (v/v) и антипену 1:1000 (v/v).
- Переместите колбу в увлажненный шейкер-инкубатор при 32 °C, 90 об/мин, 5% CO2 и продолжайте расти в течение 48 ч.
- Измерьте параметры ячейки, включая плотность и жизнеспособность ячеек, с помощью счетчика автоматических ячеек в соответствии с руководством пользователя.
- Перенос 2,0 × 106 ячеек (Vol = 2,0 × 106/плотность клеток) в микроцентрифужную трубку. Гранулируйте ячейки по 2000 × г в течение 1 мин в центрифуге для западного блоттинга в секции 5.
- Соберите клетки путем центрифугирования при 2000 × г в течение 30 мин и храните гранулу ячейки при -80 °C перед очисткой.
5. SDS-PAGE и вестерн-блот лизата клеток HEK293 для оценки уровня экспрессии HTT
- Возьмем аликвоту в 2,0 × 10 6 клеток, предварительно замороженных (шаг 4.11) из крупномасштабной трансфекции клеточной культуры HEK293. Добавьте 250 мкл трис-буферного физиологического раствора (TBS), дополненного 50 мкг/мл дигитонина, 5 мМ ЭДТА и коктейля ингибитора протеазы 1x, и повторно суспендируйте клеточную гранулу, аспирируя несколько раз с помощью пипетки.
- Осторожно поверните трубки в течение 30 мин при 4 °C, используя миниротатор для лизирования клеток. Гранулируйте нерастворимый материал центрифугированием при 17 000 × г в течение 5 мин.
- Добавьте 1/3объема 4-кратного восстановительного буфера нагрузки додецилсульфата лития (LDS) к надосадочному веществу и нагревайте при 70 °C в течение 10 мин.
- Загрузите 5-20 мкл клеточного лизата на сборный 3-8% трис-ацетатный гель PAGE. Используя гель-совместимый 1x Tris-ацетатный SDS рабочий буфер, запустите гель в режиме постоянного напряжения при 150 В в течение 60 минут.
ПРИМЕЧАНИЕ: Трисацетат SDS-PAGE был использован для анализа FL HTT, поскольку он генерирует более высокое разрешение, чем другие типы SDS-PAGE для белков с молекулярной массой выше 300 кДа. Белки, используемые в этом исследовании, также доступны непосредственно из репозитория сообщества HD в Институте Кориелла (www.coriell.org/1/CHDI); см. Таблицу материалов. - Для выполнения вестерн-блоттинга соберите трансферный сэндвич с использованием переносной буферной плотной трансферной бумаги, мембраны, активированной метанолом поливинилиденфторида (PVDF) и геля SDS-PAGE. Перенесите белки на мембрану PVDF с помощью полусухого западного блоттера в соответствии с руководством пользователя производителя.
ПРИМЕЧАНИЕ: Как правило, 20-30 мин при 135 мА достаточно для мембраны размером 10 см х 10 см. - Разберите сэндвич-перенос и блокируйте мембрану в TBST (20 мМ Tris pH 7,4, 150 мМ NaCl и 0,1% v/v Tween-20), дополненном 5% мас./об. обезжиренного молока.
- Инкубировать мембрану на коромысле в течение 1 ч при комнатной температуре с 15 мл первичного антитела (разведение 1:2 500 для моноклонального антитела антифрагмента антифлага и 1:2 000 для всех остальных первичных антител).
ПРИМЕЧАНИЕ: Первичными антителами, используемыми в этом исследовании, являются анти-FLAG M2, MAB5492, MAB5490, MAB2166, MAB3E10, MAB4E10, MAB2168, MAB8A4 (см. Таблицу материалов). - Промыть мембрану 3 х 5 мин, используя 30-50 мл TBST.
- Инкубируют мембрану на коромысле с флуоресцентным красителем-конъюгированным козьим антимышевым вторичным антителом IgG при 1:15 000 комнатной температуры, в 15 мл TBST, содержащего 5% мас./об.сухого молока.
- Визуализируйте полосы западного пятна на флуоресцентном тепловизоре, используя длину волны, специфичную для вторичного антитела. Количественно оцените сигнал полосы с помощью программного обеспечения, сопровождающего тепловизор в соответствии с руководством пользователя.
ПРИМЕЧАНИЕ: Количественное вестерн-блоттинг может быть выполнено с использованием очищенного HTT в качестве стандарта. Линейный стандартный диапазон HTT является инструментальным и был установлен в этой лаборатории от 25 нг до 250 нг HTT на полосу с использованием антитела против ФЛАГА. Западное пятно HTT должно быть свободным от деградации; обычно наблюдается общий уровень экспрессии HTT 2-4 пг/клетка. Обратитесь к ранее опубликованномупротоколу 32 для получения подробной информации о том, как выполнить количественное вестерн-блоттинг.
6. Быстрая белковая жидкостная хроматография (FPLC) очистка HTT с использованием анти-FLAG колонки и SEC
- Анти-FLAG очистка
- Оцените количество смолы FLAG, необходимое для очистки (как правило, 12 мл анти-FLAG M2 аффинной смолы для очистки 2-4 л трансфектированной клеточной культуры). Упакуйте 12-25 мл анти-FLAG смолы в пустую колонку (см. Таблицу материалов) с использованием FPLC со скоростью потока 4 мл/мин с использованием буфера A (таблица 1). Отрегулируйте высоту плунжера, чтобы не было зазора между концом плунжера и слоем смолы.
- Используя соотношение 10 мл лизисного буфера на 1 г ячейки гранулы, размораживают и суспендируют ячейку гранулы в холодном буфере лизиса (таблица 1).
- Пропустите клеточную суспензию один раз через гомогенизатор с высоким сдвигом при 10 000 фунтов на квадратный дюйм. Осветление лизата центрифугированием при 20 000 × g в течение 1 ч в центрифуге, оснащенной совместимым ротором с фиксированным углом.
- Запрограммируйте FPLC (см. Таблицу материалов для программного обеспечения, используемого в исследовании) и выполните следующие последовательности.
- Загрузите осветленный лизат через насос для отбора проб.
- Промывка с 4 колонными томами (CV) буфера А (таблица 1).
- Промывка с 4 CV буфера B (таблица 1).
- Промывка с 8 РЕЗЮМ буфера C (таблица 1).
- Промывайте 3 резюме буфера D (таблица 1).
- Промывайте 3 резюме элюционного буфера (табл. 1).
- Анализируйте 10 мкл пиковых фракций с помощью SDS-PAGE. Соберите и комбинируйте пиковые фракции с желаемой чистотой. Сохраните ~50 мкл комбинированных элюатов для анализа SDS-PAGE.
ПРИМЕЧАНИЕ: Обычно появляется один пик, и все фракции, элюированные в пике, содержат ~ 90% чистого HTT. - Повторно создайте столбец anti-FLAG с помощью 5 резюме буфера регенерации (таблица 1) и повторно уравновешивайте столбец с помощью 5 резюме буфера A.
ПРИМЕЧАНИЕ: Смолу Anti-FLAG можно повторно использовать до пяти раз или до тех пор, пока относительный выход на литр не упадет до 50% от первой очистки.
- Очистка столбца исключения размера (SEC) с помощью столбца SEC
- Предварительно уравновешивайте столбец SEC, который позволяет разделять белки с молекулярной массой (MW) > 500 кДа (см. Таблицу материалов для используемого столбца), используя 2 × CV буфера SEC (таблица 1).
- Напрямую загрузите элюат anti-FLAG (начиная с шага 6.1.5) через суперпетлю объемом 50 мл. Запустите 1.2 × CV буфера SEC за инъекцию. Запустите разделение SEC ночью при 4 °C.
ПРИМЕЧАНИЕ: Максимум 5 мл или 15 мл образца белка могут быть загружены на столбцы SEC, выбранные в этом исследовании. Запрограммируйте FPLC таким образом, чтобы несколько инъекций могли выполняться автоматически. Примеры сценариев метода также включены в качестве дополнительного файла 1 и дополнительного файла 2. - Сравните профиль элюирования со стандартным профилем элюирования HTT, чтобы различить мономерные, димерные и олигомерные пики более высокого порядка. Объединение мономерных фракций HTT на основе профиля элюирования колонны SEC. При желании объединяйте олигомерные и димерные фракции HTT более высокого порядка по отдельности.
- Сконцентрируйте объединенный белок HTT с помощью центробежного концентратора 100 кДа при 4 °C. Рассчитайте концентрации белков, разделив их значения OD280 на соответствующие коэффициенты вымирания (теоретические коэффициенты вымирания Q23-HTT, Q48-HTT, Q73-HTT и ΔExon1-HTT составляют 0,776, 0,769, 0,762 и 0,798 (мг/мл)-1 см-1, соответственно, для расчета). Поддерживать концентрацию HTT ≤ 1,0 мг/мл.
ПРИМЕЧАНИЕ: Важно контролировать процесс концентрации, так как чрезмерная концентрация приведет к агрегации. - Aliquot очищенный белок HTT в криобезопасных микроцентрифужных трубках в объеме < 100 мкл. Мгновенно заморозьте аликвоты с помощью жидкого азота и храните их при -80 °C.
7. Аналитический ВЭЖХ SEC-MALS-dRI для анализа полидисперсности HTT
- Выполняйте все аналитические ФУНКЦИИ SEC-MALS при 4 °C на высокопроизводительной системе жидкостной хроматографии (ВЭЖХ) в сочетании с УФ-детектором, многоугольным детектором рассеяния света и детектором дифференциального показателя преломления (dRI).
- Перед подключением колонны UHPLC к системе продувайте насос и детекторы фильтрованной (0,1 мкм) водой класса ВЭЖХ.
- Подключите столбец UHPLC (используемый столбец см. в Таблице материалов ) к системе. Уравновесьте колонну отфильтрованной (0,1 мкм) водой, а затем буфером SEC-MALS (таблица 1) до тех пор, пока все сигналы детектора не достигнут исходного уровня.
- Вводят 2 мкл 6 мг/мл бычьего сывороточного альбумина (BSA) со скоростью потока 0,3 мл/мин в течение 15 мин на инъекцию и проверяют качество данных. Выполните нормализацию, выравнивание пиков и коррекцию расширения диапазона на основе профиля BSA и создайте шаблон для следующих запусков образцов HTT.
- Быстро разморозьте флакон образца FL Q23-HTT на водяной бане комнатной температуры с помощью поплавка. Отфильтруйте HTT с помощью спинового фильтра 0,1 мкм. Вводят 2-4 мкл образца HTT и работают в течение 15 мин при 4 °C при скорости потока 0,3 мл/мин.
- Анализ хроматографических и светорассеивающих данных с помощью сопутствующего программного обеспечения (см. Таблицу материалов). Используйте детектор dRI в качестве детектора концентрации и используйте 0,185 в качестве приращения показателя преломления (dn/dc) для HTT. Сгенерируйте график Зимма для определения усредненной по весу молекулярной массы для каждого пика33,34.
ПРИМЕЧАНИЕ: Приращение показателя преломления HTT рассчитывается как 0,185 с использованием программного обеспечения SEDFIT35 и первичной аминокислотной последовательности HTT в качестве входных данных.
ПРИМЕЧАНИЕ: Мономер HTT MW определяется SEC-MALS при ~370 кДа ± 30 кДа. Очищенный HTT обычно имеет содержание мономера от 60 до 75% (в этой лаборатории). Низкое содержание мономеров может указывать на то, что необходимо проявлять большую осторожность при обращении с ними для предотвращения агрегации.
8. Синяя нативная страница для анализа полидисперсности HTT
- Подготовьте 1 л анодного буфера, перемешав 50 мл 20x синего нативного буфера PAGE (см. Таблицу материалов) с 950 млH2O. Подготовьте 2 л темно-синего катодного буфера, смешивая 100 мл 20x blue Native PAGE и 100 мл катодной добавки Blue Native PAGE (20x) с 1 800 мл H2O. Охладите буферы до 4 °C перед использованием.
- Быстро разморозьте флакон с образцом FL Q23-HTT на водяной бане комнатной температуры с помощью поплавка. Храните размороженный белок на льду перед употреблением.
- Смешайте 5 мкг FL Q23-HTT (~1 мг/мл), 1 мкл 0,5% добавки G250, 2,5 мкл 4x буфера образцов Blue Native PAGE и воду, чтобы довести конечный объем до 10 мкл.
- Загрузите смешанный образец FL Q23-HTT на 3-12% сборный гель Bis-Tris. Загрузка 7,5 мкл неокрашенного стандарта белка в том же геле, что и стандарт.
- Заполните переднюю часть бака темно-синим катодным буфером, а заднюю часть бака анодным буфером.
ПРИМЕЧАНИЕ: Заполняйте буферы после загрузки образца, чтобы упростить визуализацию при загрузке образцов. - Запустите гель при 150 В в течение 120 мин в холодном помещении.
- Очищайте гель раствором (таблица 1) до тех пор, пока не будут соблюдены полосы; переложить гель в воду. Визуализируйте и документируйте гель на станции визуализации.
ПРИМЕЧАНИЕ: Blue Native PAGE был первоначально разработан для анализа мембранных белков. Он был адаптирован в этой лаборатории в качестве альтернативного метода оценки мономерного содержания HTT. Он связывается с гидрофобными областями HTT и предотвращает образование агрегатов в буферных условиях, в которых отсутствует моющее средство. Традиционный native PAGE без использования Coomassie blue G250 заставляет HTT образовывать растворимые олигомеры и агрегаты, вероятно, из-за множества гидрофобных карманов, существующих в HTT.
9. SDS PAGE с последующим окрашиванием Coomassie или серебром для анализа чистоты HTT
- Добавьте 4x буфер образцов LDS и 10x восстанавливающий реагент к очищенному FL Q23-HTT, чтобы конечная концентрация нагрузочного буфера и восстановительного реагента была 1x.
- Нагревайте образец на сухом нагревательном блоке при 70 °C в течение 10 мин.
- Загрузите максимум 1 мкг белка на лунку на 3-8% геля Tris acetate и запускайте при 150 В в течение 1 ч, используя буфер работы Tris-acetate SDS.
ПРИМЕЧАНИЕ: Белки, используемые в этом исследовании, также доступны непосредственно из репозитория сообщества HD в Институте Кориелла (www.coriell.org/1/CHDI); см. Таблицу материалов. - Пятно Кумасси
- Промыть гель сH2Oв течение 5 мин.
- Окрашивают гель в окрашивающий раствор Кумасси (таблица 1) раскачивая гель в 30 мл окрашивающего раствора в течение 15 мин.
- Обезжиривание путем раскачивания геля в 50 млH2Oв течение 5 мин. Повторите дважды. Визуализируйте и документируйте гель, окрашенный Кумасси, на станции визуализации.
- Серебряное пятно с использованием коммерческого набора серебряных пятен.
- После SDS-PAGE зафиксируйте гель с помощью фиксирующего раствора (таблица 1) в течение 1 ч до ночи при комнатной температуре.
- Выполняйте окрашивание, стирайте и развивайте в соответствии с инструкциями комплекта.
- Немедленно остановите развивающийся этап, как только полосы достигнут желаемой интенсивности.
- Задокументируйте гель в системе документирования геля, оснащенной источником видимого света.
ПРИМЕЧАНИЕ: HTT, очищенный при >95%, может быть обнаружен Coomassie и серебряным окрашиванием с помощью этого протокола. Обратитесь к ранее опубликованномупротоколу 32 для получения подробной информации о том, как выполнять количественный анализ белка.
Результаты
Вектор переходной экспрессии (pcDNA3.1-Q23-HTT-TEV-FLAG, рисунок 1A) разработан для быстрого производства в клетках млекопитающих FL Q23-HTT (aa 1-3,144, на основе нумерации Q23). Эта конструкция имеет особенности, предназначенные для быстрого генерирования различных структур мутации HTT путем кассетного клонирования, облегчения очистки белка HTT до высокого качества и однородности с минимальными хроматографическими шагами и имеют возможность производить непомеченный FL HTT. Список функций включает в себя 1. Сайты рестрикции пищеварения HindIII, окружающие ЦАГ-повтор в экзоне HTT 1, могут быть использованы для генерации мутантов FL HTT с растяжением polyQ различной длины путем переваривания фермента рестрикции и лигирования; 2. C-концевой конец FL HTT помечен эпитопом FLAG с сайтом распознавания протеазы TEV для одноступенчатой аффинной очистки FL HTT с высокой чистотой и дополнительной генерации белка FL HTT без метки с использованием расщепления протеазы TEV; 3. Кодон-оптимизированная последовательность FL HTT для использования кодона клеток человека для высокоуровневой экспрессии в клетках HEK293. Вектор pcDNA 3.1 (+) используется в качестве основы конструкции для использования высокой транскрипционной активационной активности промотора ЦМВ в клеточных линиях млекопитающих.
Используя pcDNA3.1-Q23-HTT-TEV-FLAG в качестве начального шаблона, конструкции Q48 и Q73 FL HTT были получены путем синтеза фрагментов ДНК с правильной длиной Q, охватывающих два сайта фермента рестрикции HindIII, и замены одной и той же области в шаблоне. Мутант ΔExon1 FL HTT (aa 91-3,144) (рисунок 1B) был получен с использованием праймеров, направленных на удаленные остатки, охватывающие область экзона 1 в шаблоне. Клетки HEK293, трансфектированные pcDNA3.1-Q23-HTT-TEV-FLAG с использованием PEI, выращивали в колбах шейкера объемом 5 л под 5% CO2. Типичная крупномасштабная очистка использует гранулу 2-10 л-клеток, содержащую 6,0 × 10 9-3,0 × 1010 клеток. Прежде чем приступить к очищению, уровень экспрессии HTT от каждой трансфекции оценивали путем количественного западного блоттинга с использованием очищенного рекомбинантного HTT, помеченного FLAG, в качестве стандартного и анти-FLAG антитела в качестве первого антитела. Для очистки использовали гранулы с расчетным уровнем экспрессии HTT на уровне ≥2 пг HTT/клетка.
Очистка FL HTT состоит из 2-ступенчатого колонного процесса, сначала с анти-FLAG аффинной очисткой, а затем с SEC на гелевой фильтрационной колонне с подходящим диапазоном разделения для HTT (рисунок 2A; см. Таблицу материалов для примеров). После обеих стадий HTT получали при чистоте образца >95%, определяемой SDS-PAGE с содержанием мономера Coomassie blue и >65% на основе аналитического SEC-MALS. Поскольку как длительное время очистки, так и температура оказывают негативное влияние на конечное содержание мономера HTT, FPLC использовался на обеих стадиях очистки для минимизации обработки и получения стабильного качества образца. Основным загрязнителем во время анти-FLAG очистки был шаперон Hsp70, определенный масс-спектрометрией (рисунок 2B, полоса 2). Это согласуется с выводом о том, что Hsp70 очищается совместно с FL HTT, стабильно экспрессируемым в клеточных линиях24 человека, предполагая, что Hsp70 может быть общим стабилизатором для FL HTT in vivo.
Загрязнение Hsp70 может быть устранено путем тщательной промывки хлоридом магния и АТФ на стадии антиффинной очистки (рисунок 2B, полоса 1). После удаления Hsp70 FL HTT склонен к образованию олигомеров более высокого порядка24 и должен поддерживаться в концентрации ≤ 1 мг/мл. Стадия концентрации перед SEC часто может привести к значительной агрегации. Поэтому лучше всего напрямую загружать пиковые фракции из антифланговой очистки на колонну исключения размера без концентрирования. После SEC образец концентрировали до ≤1 мг/мл для максимального восстановления мономерного FL HTT. Количество HTT, извлеченного на каждой стадии очистки, оценивали либо синим Coomassie, либо количественным западным блоттингом с использованием очищенного FL HTT в качестве стандарта количественной оценки (таблица 2). Типичный выход очищенных белков FL HTT, полученных описанным способом, составляет приблизительно 1 мг/л клеточной культуры, но может быть значительно ниже этого (таблица 3) из-за вариабельности от партии к партии или если анти-FLAG очищающая смола повторно используется несколько раз.
Сверхэкспрессия FL HTT может привести к фрагментации белка22. FL Q23-HTT, полученный описанным здесь способом, разрешается как единая полоса с правильным МВт 350 кДа SDS PAGE, окрашенная либо Coomassie G250, либо серебряным окрашиванием (рисунок 2C). При вестерн-блоттинге FL Q23-HTT реагировал с антителами, поднятыми против эпитопов в N-концевых, С-концевых и нескольких промежуточных доменах, без каких-либо дополнительных полос, связанных с фрагментами, что указывает на то, что белок был выделен без значительных обнаруживаемых усечений (рисунок 3A). Варианты длины FL HTT polyQ Q23, Q48 и Q73 реагировали, как и ожидалось, в западном блотте, показывая все более сильный сигнал для polyQ-направленного mAb MW1, коррелирующий с увеличением длины Q: Q23-HTT < Q48-HTT < Q73-HTT (рисунок 3B). Не наблюдалось сигнала для ΔExon1-HTT (aa 91-3,144) при исследовании антител MW1 и MAB549, которые нацелены на N-концевой экзон 1 (рисунок 3B).
SEC-MALS был использован для анализа состояния агрегации и молекулярной массы очищенного белка HTT. Образцы анализировались аналитическим SEC, контролируемым детекторами UV, MALS и dRI. Абсолютная молярная масса, полученная из SEC-MALS, не зависит от формы молекул33,34; поэтому SEC-MALS обеспечивает объективную оценку МВт для мономерных и олигомерных фракций, когда они хорошо разделены. Среди протестированных колонок ВЭЖХ колонка SEC (см. Таблицу материалов) показала достаточное разрешение между мономером HTT и димером, чтобы можно было различить молярные массы (рисунок 4). Концентрацию белка определяли методом обнаружения dRI. Приращение показателя преломления (dn/dc) FL HTT составляет 0,1853 мл/г, рассчитанное программным обеспечением SEDFIT35. Аналогичные аналитические модели элюирования SEC наблюдались для ΔExon1 HTT (91-3,144), FL Q23, Q48 и Q73 HTT (1-3,144), каждый из которых состоял из крупного мономерного пика с незначительными димерными и олигомерными пиками (таблица 4). Расчетная МВт для мономерной формы больше теоретической МВт. Вероятно, это вызвано перекрывающимися видами из олигомерных пиков более высокого порядка и ошибками, возникающими в результате слабых сигналов dRI, поскольку белки HTT поддерживаются в низкой концентрации, чтобы избежать образования олигомеров более высокого порядка. При интеграции УФ-пиков нескольких партий очищенных вариантов FL HTT не наблюдалось четкой корреляции между длиной polyQ и профилем агрегата (таблица 4).
В дополнение к аналитическому SEC, традиционный нативный PAGE был выполнен, чтобы определить, может ли он быть использован в качестве дополнительного метода для характеристики олигомерного состояния FL HTT. Олигомеры более высокого порядка разрешали с помощью 3-8% трисацетатных гелей с использованием нативного буфера без моющего средства. Очищенный FL HTT от SEC показал несколько полос, соответствующих состояниям олигомеризации (рисунок 5A). Самая низкая полоса была расположена между нативным маркером 480 кДа и 720 кДа, аналогично предыдущим результатам, сообщенным для FL HTT, очищенного от клеток насекомых22. Однако мономер HTT не был самым распространенным диапазоном при использовании традиционного нативного PAGE, и результаты не коррелируют с совокупным профилем, определенным аналитическим SEC-MALS. Несколько гидрофобных пятен, присутствующих в FL HTT 36,37,38, особенно гидрофобный интерфейс между HAP40 и FL HTT 25, вероятно, будут способствовать образованию олигомеров более высокого порядка во время миграции внутри геля. Это связано с тем, что гидрофобные области, как известно, взаимодействуют друг с другом в отсутствие моющих или стабилизирующих белково-белковых взаимодействий. В соответствии с гидрофобными свойствами HTT, FL HTT образует все большее количество олигомерных фракций более высокого порядка в отсутствие CHAPS на стадии очистки SEC.
Blue Native PAGE, который широко используется для исследования мембранных белков и крупных белковых комплексов, содержащих гидрофобные пластыри39, сравнивали с традиционным нативным PAGE. Очищенный HTT показал три основные полосы на Blue Native PAGE с расчетным MW 643, 927 и 1070 кДа (рисунок 5B), которые, вероятно, представляют мономерные, димерные и тримерные виды HTT соответственно. Мономерная полоса оставалась самой распространенной полосой в Blue Native PAGE, хорошо соответствующей аналитическому профилю SEC тех же образцов. Переоценка MW мономера HTT Blue Native PAGE может быть результатом уникальной полой сферической структуры или гидрофобных областей HTT, которые вызывают более медленную миграцию относительно соответствующих маркеров молекулярной массы 11,23,25. В целом, FL Q23-HTT, FL Q48-HTT, FL Q73-HTT и ΔExon1-HTT имеют сходные профили Blue Native PAGE с небольшими различиями в миграции белковых полос из-за их различий в молекулярной массе.
В качестве дополнительной проверки качества очищенных белков C-концевая метка FLAG может быть удалена из FL HTT путем лечения протеазой TEV. После протеолитического расщепления образцы были проанализированы методом западного пятна с использованием четырех антител для подтверждения удаления метки FLAG и обнаружения деградации HTT. Иммунореактивность к анти-FLAG M2 и трем гентингтин-специфическим антителам с эпитопами к N-концу, промежуточным доменам и C-концу HTT показала успешное удаление метки FLAG и отсутствие HTT-специфических продуктов деградации (дополнительный рисунок S1).
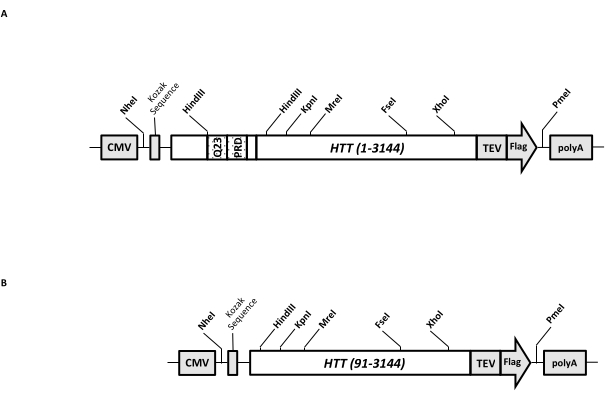
Рисунок 1: Конструкция для полноразмерного выражения HTT. (A) Полноразмерный HTT Q23 был оптимизирован для кодона и клонирован в плазмиду pcDNA3.1 (+). 3'-дюймовый конец HTT был помечен сайтом расщепления эпитопа Флага и протеазы TEV для производства белка HTT без меток. Полиглутаминовая растяжка и богатый пролином домен были спроектированы с боковыми эндонуклеазными сайтами рестрикции HindIII для вставки дополнительных ЦАГ-повторов с использованием кассетного клонирования , то есть Q48 и Q73, для получения вариантов HTT с различной длиной polyQ. (B) Конструкция ΔExon1 была сделана ПЦР-мутагенезом с использованием pcDNA3.1-Q23-HTT в качестве шаблона. Остатки 91-3,144 HTT остались в конструкции ΔExon1 для выражения. Сокращения: HTT = гентингтин; ЦМВ = цитомегаловирус; Q23 = растяжение полиглутамина; PRD = домен, богатый пролинами; TEV = место расщепления вируса травления табака. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
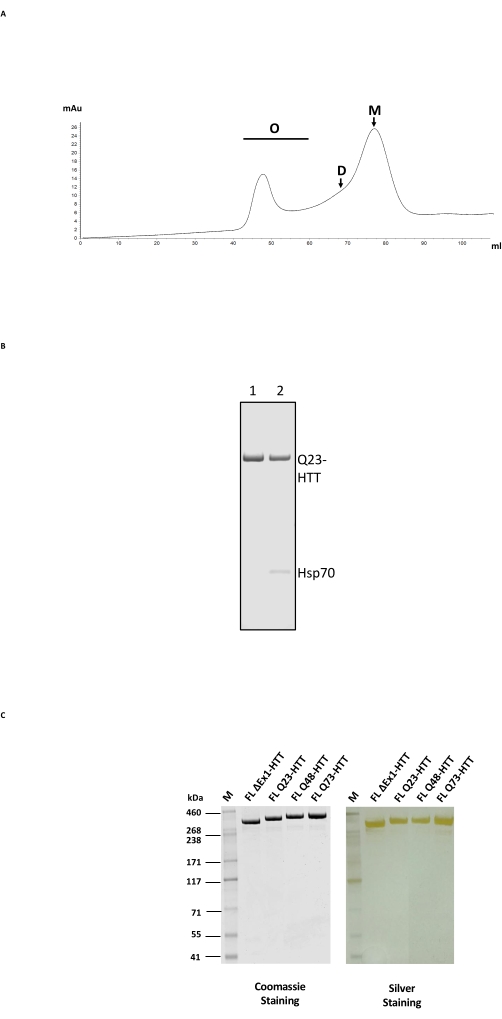
Рисунок 2: Крупномасштабная очистка профиля HTT. (A) SEC антифлагрового очищенного полноразмерного Q23-HTT на колонке FPLC. Высокоупорядоченные олигомеры, димеры и мономерные пики Q23-HTT маркируются. Фракции, содержащие мономер, собирали в качестве окончательного образца HTT. (B) SDS-PAGE очищенного Q23-HTT со ступенью промывки АТФ/магния (полоса 1) или без промывки АТФ/магнием приводит к совместному элюированию Hsp70 (полоса 2). (C) Окончательные очищенные полноразмерные варианты HTT на SDS-PAGE, окрашенные синим пятном Coomassie G-250 или серебристым пятном. Сокращения: FL = полная длина; HTT = гентингтин; SEC = размерная эксклюзионная хроматография; FPLC = быстрая белковая жидкостная хроматография; O = олигомер; D = димер; M = мономер; SDS-PAGE = электрофорез полиакриламидного геля додецилсульфата натрия; Hsp70 = белок теплового шока 70. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
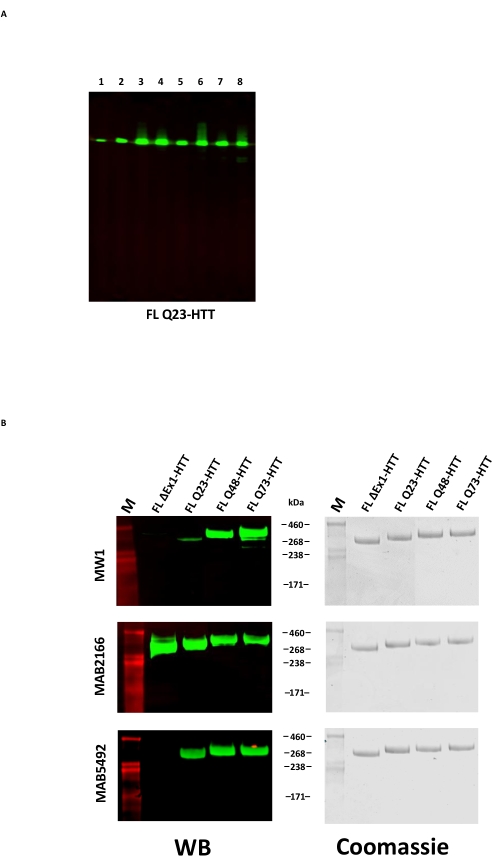
Рисунок 3: Вестерн-блотт-анализ очищенных вариантов HTT. (A) Очищенный FL Q23-HTT был выполнен на SDS-PAGE и перенесен на мембрану PVDF. Первичными антителами и взаимодействующими эпитопами являются Lane 1, α-FLAG M2, FLAG tag; Переулок 2, MAB5492, HTT aa. 1-82; Переулок 3, MAB5490, HTT aa 115-129; Переулок 4, MAB2166, HTT aa 181-810; Переулок 5, MAB3E10, HTT aa 1,171-1,177; Переулок 6, MAB4E10, HTT aa 1,844-2,131; Переулок 7, MAB2168, HTT aa 2,146-2,541; Переулок 8, MAB8A4, HTT aa 2,703-2,911. (B) 1 мкг очищенных вариантов FL HTT были запущены на SDS-PAGE и перенесены в PVDF (слева), а дубликат Геля SDS был запущен и окрашен Coomassie Blue (справа). Первичными антителами и взаимодействующими эпитопами являются ряд 1, MW1, расширенные повторы PolyQ; Ряд 2, MAB2166, HTT aa 181-810; Ряд 3, MAB5492, HTT aa 1-82. Сокращения: FLL Q23-HTT = полноразмерный белок гентингтина, содержащий 23 остатка глутамина; SDS-PAGE = электрофорез полиакриламидного геля додецилсульфата натрия; WB = вестерн блот; M = маркер; PVDF = поливинилиденфторид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
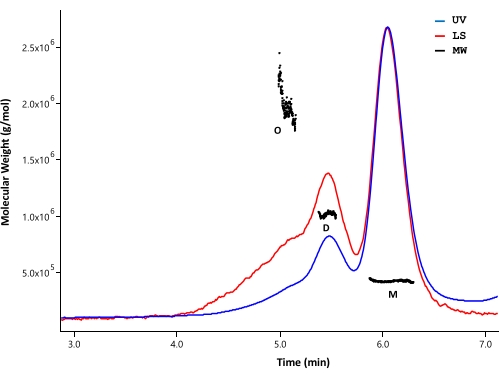
Рисунок 4: Sec-MALS анализ полноразмерного HTT. Очищенный полноразмерный Q23-HTT был элюирован на колонне UPLC. Указаны пиковые положения предсказанного мономера, димера и олигомера. Молекулярные массы были рассчитаны для мономерных, димерных и тримерных пиков и перечислены в таблице 5. Аналогичные профили элюирования наблюдаются для Q48, Q73 и ΔExon1 HTT с переменным содержанием мономера, димера и олигомера в каждой очистке. Сокращения: SEC-MALS = Размерная исключающая хроматография с многоугольным рассеянием света; УФ = ультрафиолетовый; LS = рассеяние света; MW = молекулярная масса; Q23-HTT = белок гентингтина, содержащий 23 остатка глутамина; M = мономер; D = димер; O = олигомер. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
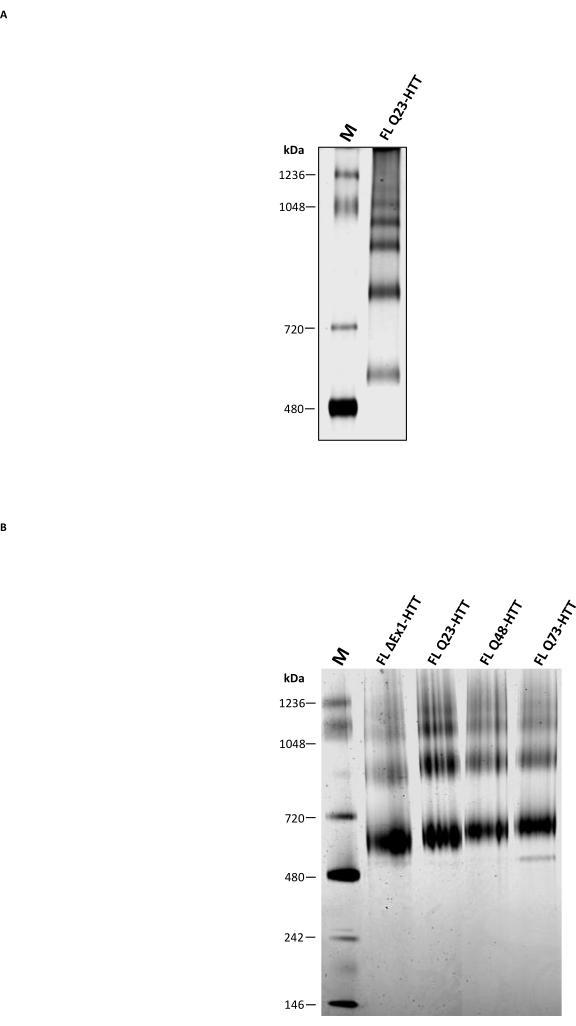
Рисунок 5: Характеристика очищенного HTT с использованием прозрачного геля Native PAGE или Blue Native PAGE. Нативный маркер и кажущийся мономерный Q23-HTT от SEC были разрешены на 3-8% трисацетатных гелях в неденатурирующей системе PAGE (A) и системе Blue Native PAGE (B). Сокращения: FL = полнометражный; Q23-HTT = белок гентингтина, содержащий 23 остатка глутамина; PAGE = электрофорез полиакриламидного геля; M = маркер. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Шаг | Имя | Состав | ||
| 6.1.1 | Буфер A | 50 мМ Tris, 500 мМ NaCl, 5% в/в глицерин, 5 мМ ЭДТА, 0,01% в/об Tween-20, рН 8,0. | ||
| 6.1.2 | Буфер лизиса | 50 мМ Tris, 500 мМ NaCl, 5% v/v глицерина, 5 мМ ЭДТА и коктейль ингибиторов протеазы 1x | ||
| 6.1.4.2 | Буфер A | 50 мМ Tris, 500 мМ NaCl, 5% в/в глицерин, 5 мМ ЭДТА, 0,01% в/об Tween-20, рН 8,0. | ||
| 6.1.4.3 | Буфер B | 50 мМ Трис; 500 мМ KCl; 5 мМ MgCl2; 5% v/v глицерина; 0,01% об/об Анимация движения-20, рН 8,0 | ||
| 6.1.4.4 | Буфер C | 20 мМ Трис; 200 мМ KCl; 5 мМ MgCl2; 5 мМ АТФ; 0,01% v/v Tween-20; 5% v/v глицерина, рН 8,0 | ||
| 6.1.4.5 | Буфер D | 50 мМ Трис; 500 мМ NaCl; 5% v/v глицерина; 5 мМ ЭДТА; 0,5% мас./об CHAPS, pH 8,0 | ||
| 6.1.4.6 | Буфер элюирования | 50 мМ Трис; 500 мМ NaCl; 5% v/v глицерина; 0,5% масс./об CHAPS; 0,2 мг/мл пептида DYKDDDDK, рН 8,0 | ||
| 6.1.6 | Буфер регенерации | 0,1 М глицина HCl, рН 3,5; 0,01% v/v Анимация движения-20 | ||
| 6.2.1 | Буфер SEC | 50 мМ Tris, 500 мМ NaCl, 5% в/в глицерин, 0,5% мас./об CHAPS, 1 мМ TCEP | ||
| 7.3 | Буфер SEC-MALS | 50 мМ HEPES, pH 7,2, 500 мМ NaCl, 5% в/в глицерин, 0,5% мас./об CHAPS | ||
| 8.7 | Решение для обесцвечивания | 40% v/v метанола и 7% v/v уксусной кислоты | ||
| 9.4.2 | Решение для окрашивания Coomassie | 0,01% мас./об.кумасси g250, 50% об/об/об/метанол, 10% в/об уксусной кислоты | ||
| 9.5.1 | Решение для исправления | 50% v/v метанола, 10% v/v уксусной кислоты, 50 мкл формальдегида/100 мл раствора | ||
Таблица 1: Состав буферов и растворов
| Стремянка | Концентрация HTT (мг/мл) | Общий объем (мл) | Содержание HTT (мг) | Выход HTT на ячейку (pg/ячейка) | % Доходность |
| Всплывающий | 0.1792 | 220 | 39.4 | 4.4 | 100 |
| Анти-Флаг | 1.524 | 8.6 | 13.1 | 1.47 | 33.4 |
| СЕК | 0.91 | 3.9 | 3.54 | 0.4 | 9.1 |
Таблица 2: Выход HTT из гранул HEK293 объемом 2 л, трансфектированных pcDNA3.1-Q23-HTT-TEV-Flag. Сокращения: FL Q23-HTT = полноразмерный белок гентингтина, содержащий 23 остатка глутамина; TEV = место расщепления вируса травления табака; SEC = размерная исключающая хроматография.
| Образец HTT | Выход HTT (мг/л) | Средняя чистота (%) | ||
| БЦА | А280 | |||
| 1 | FL DEx1-HTT (N=3) | 0.67-1.30 | 0.69-1.18 | 99.3 |
| 2 | FL Q23-HTT (N=3) | 0.25-0.92 | 0.28-0.98 | 96.9 |
| 3 | FL Q48-HTT (N=3) | 0.28-1.15 | 0.38-1.16 | 97.4 |
| 4 | FL Q73-HTT (N=3) | 0.58-1.05 | 0.57-0.97 | 98.8 |
Таблица 3: Сводка выхода белка четырех вариантов очистки FL HTT и их окончательной чистоты. Аббревиатура: FLL HTT = полноразмерный белок гентингтина.
| Образец HTT | A | D | M |
| FL Q23-HTT | 4.2-6.9% | 18.7-29.3% | 66.5-76.0% |
| FL Q48-HTT | 4.0-9.4% | 10.6-17.8% | 73.6-85.4% |
| FL Q73-HTT | 2.0-14.0% | 16.9-24.6% | 65.1-81.1% |
Таблица 4: Сводка репрезентативного содержания агрегата, димера и мономера в вариантах FL HTT от очистки. Сокращения: FL HTT = полноразмерный белок гентингтина; A = совокупность; D = димер; M = мономер; SEC = размерная исключающая хроматография.
Дополнительный рисунок S1: Вестерн-блот-анализ после переваривания протеазы TEV. Очищенные FL Q23-HTT и FL Q48-HTT были запущены на SDS-PAGE, перенесены на мембраны PVDF и проанализированы методом западного блоттинга после переваривания TEV. Первичными антителами были анти-Flag M2 (тег Flag), MAB5492 (HTT aa 1-82), MAB3E10 (HTT aa 997-1,276) и MAB2168 (HTT aa 2,146-2,541). Lane 1, Стандарт белка; Полоса 2, Q23-HTT-TEV-Флаг; Полоса 3, Q48-HTT-TEV-Флаг; Полоса 4, Q23-HTT-TEV-Flag обрабатывают протеазой TEV при 1:5, ночью при 4 °C; Полоса 5, Q48-HTT-TEV-Flag обрабатывают протеазой TEV при 1:5, ночью при 4 °C. Сокращения: FL HTT = полноразмерный белок гентингтина; SDS-PAGE = электрофорез полиакриламидного геля додецилсульфата натрия; TEV = вирус травления табака; PVDF = поливинилиденфторид. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2: Sec-MALS анализ вариантов FL HTT, подвергшихся циклам замораживания-оттаивания. Очищенные Q23-HTT (A) и Q48-HTT (B) замораживали при -80 °C и размораживали при комнатной температуре до 6 раз. Q23-HTT и Q48-HTT после первого цикла замораживания-оттаивания и шестого циклов замораживания-оттаивания были затем проанализированы SEC-MALS. Незначительное снижение фракции мономера и увеличение димерных и олигомерных фракций высокого порядка наблюдались путем рассеяния света после повторных циклов замораживания-оттаивания. Указаны пиковые положения предсказанного мономера, димера и олигомера высокого порядка. Сокращения: FL HTT = полноразмерный белок гентингтина; O = олигомер; D = димер; M = мономер; SEC-MALS = Размерная экспозиционная хроматография с многоугольным рассеянием света. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S3: SDS PAGE вариантов FL HTT, подвергшихся циклам замораживания-оттаивания. Очищенные Q23-HTT (полосы 2-7) и Q48-HTT (полосы 9-14) замерзали при -80 °C и размораживали при комнатной температуре до 6 раз. Аликвоты Q23-HTT и Q48-HTT хранились после каждого цикла замораживания-оттаивания, а затем анализировались SDS PAGE. Не наблюдалось увеличения совокупных или деградационных продуктов; образцы считались стабильными и >95% чистыми с помощью ленточной денситометрии. Сокращения: FL HTT = полноразмерный белок гентингтина; SDS-PAGE = электрофорез полиакриламидного геля додецилсульфата натрия. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: FPLC 15 мл анти-FLAG HTT скрипт. Аббревиатуры = FPLC = быстрая белковая жидкостная хроматография; HTT = белок гентингтина. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: FPLC SEC_MALS сценарий HTT. Сокращения: SEC-MALS = Размерная исключающая хроматография с многоугольным рассеянием света; FPLC = быстрая белковая жидкостная хроматография; HTT = белок гентингтина. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Здесь мы описываем метод транзиторной трансфекции, экспрессии и очистки для генерации нескольких белков FL HTT с подходящей чистотой и однородностью для использования в качестве стандартов для иммуноанализа и разработки анализа РС, контроля для анализа вестерн-блот и для исследований структурно-функциональных исследований. Этот метод переходной экспрессии является масштабируемым и универсальным и позволяет пользователю генерировать низкомиллиграммовые количества вариантов FL HTT более эффективно, чем использование стабильных клеточных линий или методов на основе вирусов, описанных ранее 21,22,23,24. Как правило, 2-5 мг высокоочищенного FL HTT могут быть получены из 2-литрового продуцирования белка менее чем за неделю с использованием метода переходной экспрессии после построения плазмиды с типичным выходом 1-2,5 мг FL HTT на литр клеточной культуры.
Метод переходной экспрессии, описанный здесь, преодолевает многие препятствия в экспрессии стабильных клеточных линий, такие как длительное время, необходимое для установления клеточных линий, и трудности в хранении и поддержании стабильных клеточных линий. PEI также относительно недорог по сравнению с другими трансфекционными реагентами на рынке, что делает крупномасштабную трансфекцию экономически жизнеспособной. Существуют также ограничения в протоколе: эффективность трансфекции во многом зависит от качества плазмид, оптимального роста клеток и того, насколько хорошо хранится и готовится PEI. Операторы должны проявлять особую осторожность и выполнять контроль качества на этих критических этапах, чтобы избежать резкого падения выходов белка. Смола Anti-FLAG, используемая в протоколе, также относительно дорога и показывает уменьшенный захват FL HTT после нескольких чисток и регенераций. Некоторые исследователи могут счесть более практичным переключиться на другую метку, чтобы обеспечить более надежную регенерацию аффинной смолы.
Различные клеточные линии и условия экспрессии были протестированы для оптимизации уровней экспрессии FL HTT. Клетки HEK293 были выбраны для экспрессии FL HTT из-за высокой экспрессии белка и простоты обработки в формате культуры суспензии, что делает метод пригодным для крупномасштабной экспрессии в шейкерах или биореакторах. Более высокий уровень экспрессии белка FL HTT может быть достигнут при более низких температурах культивирования, таких как 32 ° C, а не при обычной температуре 37 ° C. Возможно, что более низкая температура может замедлить синтез белка и способствовать правильному сворачиванию FL HTT40. Однако это явление не является специфическим для FL HTT или тестируемых клеточных линий. Пониженная температура послетрансфекции широко используется в фармацевтической экспрессии белка в клетках CHO. Хотя механизм не полностью понят, считается, что низкие температуры останавливают клеточный цикл в фазе G1 и отвлекают клеточную энергию на выработку белка41.
Полноразмерный HTT, очищенный от клеток млекопитающих, со-элюируется с шапероном Hsp7024, а этапы промывки Mg-ATP могут удалить белок Hsp70. Интересно, что коэлюированный Hsp70 не наблюдается в FL HTT, очищенном от системы экспрессии клеток насекомых 21,22,23. Это может отражать разницу в PTM FL HTT или реакции белка теплового шока на сверхэкспрессию FL HTT в клетках млекопитающих и насекомых. После того, как рекомбинантный белок был лишен Hsp70, для стабилизации мономерной формы FL HTT требуются неионные моющие средства, такие как CHAPS или DDM.
Состояния олигомеризации вариантов FL HTT были проанализированы с использованием Blue Native PAGE и SEC-MALS. Небольшая доля димерного и олигомерного HTT более высокого порядка присутствовала при анализе либо Blue Native PAGE, либо SEC-MALS. Следует отметить, что олигомеры более высокого порядка, образованные FL HTT, по-видимому, не коррелируют с длиной polyQ, и даже мутант делеции Exon1 демонстрирует аналогичное соотношение олигомер-димер-мономер. Фактические различия в содержании олигомеров среди этих конструкций, вероятно, обусловлены незначительными различиями в производстве и обработке каждой партии. В отличие от агрегатов и фибрилл, образованных HTT Exon1 40,41, олигомеры более высокого порядка FL HTT оставались растворимыми и могли быть проанализированы SEC и Native PAGE.
Очищенный мономерный FL HTT только относительно стабилен. Длительное хранение при 4 °C, короткие инкубации при комнатной температуре или концентрации > 1 мг/мл преобразуют мономерный FL HTT в димерные и более высокоупорядоченные олигомерные формы, даже если в этих условиях не наблюдается видимых осадков. Очищенный мономерный FL HTT, поддерживаемый при ≤1 мг/мл, оставался относительно стабильным при -80 °C в буфере хранения (50 мМ Tris, pH 8,0, 500 мМ NaCl, 5% v/v глицерина, 0,5% мас./об CHAPS и 5 мМ DTT), как описано ранее24. До 6 циклов замораживания-оттаивания FL HTT, приготовленных и хранимых таким образом, не вызывали видимого осаждения белка, хотя небольшой сдвиг в более высокое олигомерное состояние наблюдался SEC-MALS (дополнительный рисунок S2). Образцы также были проанализированы SDS PAGE после повторных циклов замораживания-оттаивания. Видимых осадков не наблюдалось; SDS-PAGE не видел агрегатов или дополнительных продуктов деградации (дополнительный рисунок S3). Долгосрочная стабильность очищенного FL HTT все еще находится в стадии изучения. При отсутствии убедительных долгосрочных данных мы рекомендуем хранить очищенный FL HTT при -80 °C не более 6 месяцев.
Высококачественные, рекомбинантные варианты белка FL HTT и методы их получения пользуются большим спросом у исследовательского сообщества HD. Эти белки используются в качестве иммуноанализа и аналитических стандартов MS, в структурных исследованиях и для разработки новых FL HTT-специфических анализов. Крупномасштабные методы экспрессии переходных процессов, описанные здесь, последовательно производили миллиграммовые количества вариантов FL HTT с чистотой >95%, обеспечивая необходимые инструменты для исследований HTT. Производство десятков миллиграммов высокоочищенных вариантов FL HTT polyQ и других мутантов в поддержку исследований HD стало рутиной.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов с содержанием данной статьи.
Благодарности
Мы благодарим Департамент фармацевтических наук Государственного университета Нью-Йорка в Буффало за проведение анализа РС HTT. Эта работа была результатом совместных усилий с Фондом CHDI. Мы особенно благодарим Элизабет М. Доэрти; Игнасио Муньос-Санхуан; Дуглас Макдональд, Фонд CHDI; и Рори Кертис, Курия, за их неоценимый вклад в подготовку этой рукописи. Мы также благодарны Мишель Луче, Митре Махмуди и Стефани Фокс за поддержку этих исследований.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 kDa concentrator-Amicon | Millipore | UFC910096 | Protocol Section Number-6.2.4 |
| 20x blue native PAGE running buffer | Invitrogen | BN2001 | Protocol Section Number-8.1 |
| 20x TBS | Thermo Fisher | PI28358 | Protocol Section Number-5.1 |
| 4x blue native PAGE sample buffer | Invitrogen | BN2003 | Protocol Section Number-8.3 |
| 4x LDS loading buffer | Invitrogen | NP0007 | Protocol Section Number-5.3 |
| 5 L Erlenmeyer flasks | Corning | 431685 | Protocol Section Number-4.2 |
| Agarose gel extraction kit | Qiagen | 28704 | Protocol Section Number-2.2 |
| Anti-clumping agent | Thermo Fisher | 0010057AE | Protocol Section Number-4.8 |
| anti-FLAG M2 affinity gel | Sigma | A2220 | Protocol Section Number-6.1.1 |
| anti-FLAG M2 | Sigma | F3165 | Protocol Section Number-5.7 |
| Anti foam-Excell anti foam | Sigma | 59920C-1B | Protocol Section Number-4.8 |
| ATP | Sigma | A6419 | Protocol Section Number-6.1.4.4 |
| BEH 450 SEC | Waters | 186006851 | 2.5 µm x 4.6 mm x 150 mm Protocol Section Number-7.3 |
| blue native PAGE 5% G-250 sample additive | Invitrogen | BN2004 | Protocol Section Number-8.3 |
| carbenicillin | Thermo Fisher | 10177012 | Protocol Section Number-2.5 |
| centrifuge - Sorvall Lynx 6000 | Thermo Fisher | 75006590 | Protocol Section Number-6.1.3 |
| Cell Counter - ViCELL | BECKMAN COULTER | Protocol Section Number-4.3 | |
| CHAPS | Anatrace | C316S | Protocol Section Number-6.1.4.6 |
| Competent E. coli cells-TOP10 | Invitrogen | C404010 | Protocol Section Number-2.4 |
| digitonin | Sigma | D141 | Protocol Section Number-5.1 |
| differential refractive index detector | Wyatt | Protocol Section Number-7.1 | |
| DYKDDDDK peptide | Genscript | Peptide synthesis service Protocol Section Number-6.1.4.6 | |
| EDTA | Sigma | EDS | Protocol Section Number-5.1 |
| EndoFree Plasmid Giga Kit | Qiagen | 12391 | Protocol Section Number-3.3 |
| Endotoxin free water | Cytiva | SH30529.03 | Protocol Section Number-4.1 |
| endotoxin quantification kit-CRL Endosafe Nexgen-PTS detection system | Charles River | PTS150K | Protocol Section Number-3.4 |
| fixed angle rotor A23-6x100 rotor | Thermo Fisher | 75003006 | Protocol Section Number-6.1.3 |
| FPLC software- Unicorn 6.2 | Cytiva | Protocol Section Number-6.1.4 | |
| Gene synthesis | Genscript | Gene synthesis service Protocol Section Number-1.2 | |
| Glycerol | Fisher Scientific Glycerol (Certified ACS) | G33-4 | Protocol Section Number-5.6 |
| Growth Medium-Expi293 expression medium | Thermo Fisher | A1435102 | Protocol Section Number-4.2 |
| HEK293 cells | Thermo Fisher | R79007 | Protocol Section Number-4 |
| high shear homogenizer-Microfluidizer | MicroFluidics | LM10 | Protocol Section Number-6.1.3 |
| HPLC - 1260 infinity II Bio-Insert HPLC | Agilent | Protocol Section Number-7.1 | |
| Image Studio | LiCor | Image analysis software Protocol Section Number-5.1 | |
| MAB2166 | Sigma | MAB2166 | Protocol Section Number-5.7 |
| MAB2168 | EMD | MAB2168 | Protocol Section Number-5.7 |
| MAB3E10 | Santa Cruz | SC-47757 | Protocol Section Number-5.7 |
| MAB4E10 | Santa Cruz | SC-7757 | Protocol Section Number-5.7 |
| MAB5490 | Sigma | MAB5490 | Protocol Section Number-5.7 |
| MAB5492 | Sigma | MAB5492 | Protocol Section Number-5.7 |
| MAB8A4 | Santa Cruz | SC-47759 | Protocol Section Number-5.7 |
| multi-angle light scattering detector | Wyatt | Protocol Section Number-7.1 | |
| NativeMark Unstained Protein Standard | Invitrogen | LC0725 | Protocol Section Number-8.4 |
| NaCl | Sigma | S9888 | Protocol Section Number-5.6 |
| NheI | New England Biolab | R0131S | Hi-Fi version available Protocol Section Number-2.2 |
| NuPAGE 3–8% Tris acetate gels | Invitrogen | EA0375PK2 | Protocol Section Number-5.4 |
| NuPAGE Tris-Acetate SDS Running buffer | Invitrogen | LA0041 | Protocol Section Number-5.4 |
| PEI 25K | Polysciences | 23966-1 | Protocol Section Number-4.1 |
| Penicillin-Streptomycin | Thermo Fisher | 15070063 | Protocol Section Number-4.2 |
| Phosphate Buffered Saline (PBS) | Cytiva | SH30256.02 | Protocol Section Number-4.5 |
| plasmid miniprep kit | Qiagen | 27104 | Protocol Section Number-2.6 |
| PmeI | New England Biolab | R0560S | Protocol Section Number-2.2 |
| precast Bis-tris gel- 3-12% NativePAGE Novex Bis-Tris Gel | Invitrogen | BN1003BOX | Protocol Section Number-8.4 |
| protease inhibitor cocktail | GoldBio | GB-331-1 | Protocol Section Number-5.1 |
| SEC-MALS analysis software - Astra 7 | Wyatt Technology | Protocol Section Number-7.6 | |
| secondary antibody -IRdye 800 CW goat anti-mouse IgG | LiCor | 926-32210 | Protocol Section Number-5.9 |
| Superose 6 pg XK 16/70 | Cytiva | 90100042 | Protocol Section Number-6.2 |
| Tris base | Fisher | BP152 | Protocol Section Number-5.6 |
| Tween-20 | Thermo Fisher | AAJ20605AP | Protocol Section Number-6.1.1 |
| UV spectrometer - Nanodrop 8000 | Thermo Fisher | ND-8000-GL | Protocol Section Number-2.2 |
| XK26/100 | Cytiva | 28988951 | Protocol Section Number-6.1.1 |
Ссылки
- Walker, F. O. Huntington's disease. Lancet. 369 (9557), 218-228 (2007).
- McColgan, P., Tabrizi, S. J. Huntington's disease: a clinical review. European Journal of Neurology. 25 (1), 24-34 (2018).
- Duyao, M., et al. Trinucleotide repeat length instability and age of onset in Huntington's disease. Nature Genetics. 4 (4), 387-392 (1993).
- MacDonald, M. E., et al. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Nasir, J., et al. Targeted disruption of the Huntington's disease gene results in embryonic lethality and behavioral and morphological changes in heterozygotes. Cell. 81 (5), 811-823 (1995).
- Dragatsis, I., Levine, M. S., Zeitlin, S. Inactivation of Hdh in the brain and testis results in progressive neurodegeneration and sterility in mice. Nature Genetics. 26 (3), 300-306 (2000).
- Anne, S. L., Saudou, F., Humbert, S. Phosphorylation of huntingtin by cyclin-dependent kinase 5 is induced by DNA damage and regulates wild-type and mutant huntingtin toxicity in neurons. Journal of Neuroscience. 27 (27), 7318-7328 (2007).
- Dietrich, P., Johnson, I. M., Alli, S., Dragatsis, I. Elimination of huntingtin in the adult mouse leads to progressive behavioral deficits, bilateral thalamic calcification, and altered brain iron homeostasis. PLoS Genetics. 13 (7), 1006846(2017).
- Dragatsis, I., et al. Effect of early embryonic deletion of huntingtin from pyramidal neurons on the development and long-term survival of neurons in cerebral cortex and striatum. Neurobiology of Disease. 111, 102-117 (2018).
- Benn, C. L., et al. Huntingtin modulates transcription, occupies gene promoters in vivo, and binds directly to DNA in a polyglutamine-dependent manner. Journal of Neuroscience. 28 (42), 10720-10733 (2008).
- Saudou, F., Humbert, S. The biology of huntingtin. Neuron. 89 (5), 910-926 (2016).
- Davies, S. W., et al. Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell. 90 (3), 537-548 (1997).
- DiFiglia, M., et al. Aggregation of huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain. Science. 277 (5334), 1990-1993 (1997).
- Gutekunst, C. A., et al. Nuclear and neuropil aggregates in Huntington's disease: Relationship to neuropathology. Journal of Neuroscience. 19 (7), 2522-2534 (1999).
- Hodgson, J. G., et al. A YAC mouse model for Huntington's disease with full-length mutant huntingtin, cytoplasmic toxicity, and selective striatal neurodegeneration. Neuron. 23 (1), 181-192 (1999).
- Hoffner, G., Djian, P. Polyglutamine aggregation in Huntington disease: does structure determine toxicity. Molecular Neurobiology. 52 (3), 1297-1314 (2015).
- Waldvogel, H. J., Kim, E. H., Tippett, L. J., Vonsattel, J. P. G., Faull, R. L. M. The neuropathology of Huntington's disease. Current Topics in Behavioral Neurosciences. 22, 33-80 (2014).
- Kim, M. Beta conformation of polyglutamine track revealed by a crystal structure of huntingtin N-terminal region with insertion of three histidine residues. Prion. 7 (3), 221-228 (2013).
- Hoop, C. L., et al. Huntingtin exon 1 fibrils feature an interdigitated β-hairpin-based polyglutamine core. Proceedings of the National Academy of Sciences of the United States of America. 113 (6), 1546-1551 (2016).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An intein-based strategy for the production of tag-free huntingtin exon 1 proteins enables new insights into the polyglutamine dependence of Httex1 aggregation and fibril formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Seong, I. S., et al. Huntingtin facilitates polycomb repressive complex 2. Human Molecular Genetics. 19 (4), 573-583 (2009).
- Li, W., Serpell, L. C., Carter, W. J., Rubinsztein, D. C., Huntington, J. A. Expression and characterization of full-length human huntingtin, an elongated HEAT repeat protein. Journal of Biological Chemistry. 281 (23), 15916-15922 (2006).
- Vijayvargia, R., et al. Huntingtin's spherical solenoid structure enables polyglutamine tract-dependent modulation of its structure and function. eLife. 5, 11184(2016).
- Huang, B., et al. Scalable production in human cells and biochemical characterization of full-length normal and mutant huntingtin. PLoS ONE. 10 (3), 0121055(2015).
- Guo, Q., et al. The cryo-electron microscopy structure of huntingtin. Nature. 555 (7694), 117-120 (2018).
- Harding, R. J., et al. Design and characterization of mutant and wildtype huntingtin proteins produced from a toolkit of scalable eukaryotic expression systems. Journal of Biological Chemistry. 294 (17), 6986-7001 (2019).
- Harding, R. J., et al. HAP40 orchestrates huntingtin structure for 1 differential interaction with polyglutamine 2 expanded exon 1. bioRxiv. , (2021).
- Huang, B., et al. Pathological polyQ expansion does not alter the conformation of the Huntingtin-HAP40 complex. Structure. 29 (8), 804-809 (2021).
- Colin, E., et al. Huntingtin phosphorylation acts as a molecular switch for anterograde/retrograde transport in neurons. EMBO Journal. 27 (15), 2124-2134 (2008).
- Thompson, L. M., et al. IKK phosphorylates Huntingtin and targets it for degradation by the proteasome and lysosome. Journal of Cell Biology. 187 (7), 1083-1099 (2009).
- Ratovitski, T., et al. Post-translational modifications (PTMs), identified on endogenous Huntingtin, cluster within proteolytic domains between HEAT repeats. Journal of Proteome Research. 16 (8), 2692-2708 (2017).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Molecular Biotechnology. 55 (3), 217-226 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1-3), 95-116 (2003).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, Clifton, N.J. 97-112 (2006).
- McMeekin, T. L., Wilensky, M., Groves, M. L. Refractive indices of proteins in relation to amino acid composition and specific volume. Biochemical and Biophysical Research Communications. 7 (2), 151-156 (1962).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Kegel-Gleason, K. B. Huntingtin interactions with membrane phospholipids: Strategic targets for therapeutic intervention. Journal of Huntington's Disease. 2 (3), 239-250 (2013).
- Michalek, M., Salnikov, E. S., Werten, S., Bechinger, B. Membrane interactions of the amphipathic amino terminus of huntingtin. Biochemistry. 52 (5), 847-858 (2013).
- Wittig, I., Braun, H. P., Schägger, H. Blue native PAGE. Nature Protocols. 1 (1), 418-428 (2006).
- Nissley, D. A., O'Brien, E. P. Altered co-translational processing plays a role in huntington's pathogenesis-A hypothesis. Frontiers in Molecular Neuroscience. 9, 54(2016).
- Kumar, N., Gammell, P., Clynes, M. Proliferation control strategies to improve productivity and survival during CHO based production culture: A summary of recent methods employed and the effects of proliferation control in product secreting CHO cell lines. Cytotechnology. 53 (1-3), 33-46 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены