Method Article
Упрощенный высокопроизводительный анализ сократимости одноклеточных клеток с использованием микроструктурированных эластомеров
В этой статье
Резюме
В этой работе представлен гибкий протокол для использования флуоресцентно меченых эластомерных сжимающих поверхностей (FLECS) в формате микровелл для упрощенной, непринужденной количественной оценки одноклеточных сократительных сил на основе визуализированных перемещений микропаттернов флуоресцентного белка.
Аннотация
Генерация клеточной сократительной силы является фундаментальной чертой, общей практически для всех клеток. Эти сократительные силы имеют решающее значение для правильного развития, функционируют как на клеточном, так и на тканевом уровнях и регулируют механические системы в организме. Многочисленные биологические процессы зависят от силы, включая подвижность, адгезию и деление одиночных клеток, а также сокращение и расслабление таких органов, как сердце, мочевой пузырь, легкие, кишечник и матка. Учитывая его важность в поддержании правильной физиологической функции, клеточная сократимость также может управлять болезненными процессами, когда они преувеличены или нарушены. Астма, гипертония, преждевременные роды, фиброзные рубцы и недостаточная активность мочевого пузыря являются примерами механически управляемых болезненных процессов, которые потенциально могут быть облегчены при надлежащем контроле клеточной сократительной силы. Здесь мы представляем комплексный протокол для использования новой технологии анализа сократимости на основе микропластин, известной как флуоресцентно меченые эластомерные сжимаемые поверхности (FLECS), которая обеспечивает упрощенный и интуитивно понятный анализ сократимости одиночных клеток в массовом масштабе. Здесь мы предоставляем пошаговый протокол для получения двух шеститочечных кривых дозы-ответа, описывающих влияние двух сократительных ингибиторов на сокращение первичных гладкомышечных клеток мочевого пузыря человека в простой процедуре с использованием только одной микропластины анализа FLECS, чтобы продемонстрировать надлежащую технику пользователям метода. Используя технологию FLECS, все исследователи с базовыми биологическими лабораториями и системами флуоресцентной микроскопии получают доступ к изучению этого фундаментального, но трудно поддающегося количественной оценке функционального фенотипа клеток, эффективно снижая входной барьер в область силовой биологии и фенотипического скрининга сократительной клеточной силы.
Введение
Механические силы, генерируемые клетками, необходимы для правильного функционирования в различных органах по всему телу, таких как кишечник, мочевой пузырь, сердце и другие. Эти органы должны генерировать стабильные паттерны сокращения и расслабления клеток для поддержания внутреннего гомеостатического состояния. Аномальное сокращение гладкомышечных клеток (СМК) может привести к возникновению различных расстройств, включая, например, дисмоторику кишечника, характеризующуюся аномальными паттернами сокращения гладкой мускулатуры кишечника1, а также урологические состояния гиперактивного2 или недостаточного мочевого пузыря3. В дыхательных путях SMC, которые демонстрируют нерегулярные паттерны сокращения, могут вызвать астматическую гиперчувствительность4, потенциально затягивая дыхательные пути и уменьшая воздушный поток кислорода в легкие. Другое широко распространенное физическое состояние, гипертония, вызвано колебаниями сокращения гладких мышц в кровеносных сосудах5. Очевидно, что сократительные механизмы в клетках и тканях могут привести к заболеваниям, которые требуют вариантов лечения. Поскольку эти условия безошибочно проистекают из дисфункционального сократительного поведения клеток, становится логичным и необходимым измерить саму сократительную функцию клетки при скрининге потенциальных кандидатов на лекарства.
Признавая необходимость инструментов для изучения клеточной сократительной силы, академическими исследователями было разработано несколько количественных методов анализа сокращения, включая микроскопию силы тяги (TFM)6, микроструктурированный TFM7, плавающие гелевые анализы8 и эластомерные микропостовые анализы9. Эти технологии использовались в формате одной тарелки, а также в формате нескольких скважин в многочисленных исследованиях и даже были предложены для трехмерных измерений силы10,11,12,13,14. Хотя эти технологии позволили провести новаторские исследования в обширной области биологии клеточных сил, все они были в значительной степени ограничены лабораториями, обладающими конкретными возможностями и ресурсами, в частности: способностью изготавливать субстраты TFM, способностью правильно применять сложные и неинтуитивные алгоритмы для решения карт смещения TFM и относительно точными системами микроскопии, которые могут регистрировать изображения, сделанные до и после удаления образца со стадии (для диссоциации клеток). Таким образом, для неподготовленного исследователя входной барьер для использования этих методов может быть достаточно высоким, учитывая обширный набор требований к применению этих технологий. Кроме того, разрешение изображения, требуемое для многих существующих технологий (40-кратные цели или более), может значительно ограничить экспериментальную пропускную способность, в то время как технологии массовых измерений могут маскировать вклад от выделяющихся клеток и предотвращать обнаружение более мягких сократительных различий. Следует отметить, что, насколько известно авторам, только низкопроизводительный и полуколичественный подход к анализу плавающего геля достаточно созрел, чтобы стать доступным для исследователей (см. Рисунок 1).

Рисунок 1: Общая схема метода технологии FLECS. (A) Клетки прилипают к микрошарам адгезивного белка, которые ковалентно встроены в тонкий эластомерный слой, поддерживаемый стеклом. (B) Вид сверху различных возможных микрошаблонных форм и взрыв ячейки, сжимающей микрошарику в форме "X". (C) Наложение флуоресцентных микрошариков и фазовых контрастных изображений сжимающейся ячейки. D) изображения с течением времени одной договаривающейся ячейки. Шкала стержней = 25 мкм. Эта цифра была адаптирована с разрешения Пушкарского и др.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Следуя недавним достижениям в области микротехнологий, авторы разработали технологию на основе микропластин, позволяющую проводить количественные измерения сокращения одиночных клеток в сотнях тысяч клеток, называемых FLECS (флуоресцентно меченые эластомерные сжимаемые поверхности)15,16,17,18,19,20 , в качестве альтернативы TFM. В этом подходе флуоресцентные белковые микрошарики встроены в мягкие пленки, которые деформируются и сжимаются, когда клетки прикладывают к ним силы тяги, интуитивно понятным и измеримым образом. Важно отметить, что белковые микрошарики ограничивают положение, форму и область распространения клеток, что приводит к однородным условиям тестирования. Они позволяют проводить простые измерения, основанные только на их размерных изменениях, которые высоко разрешаются пространственно даже на изображениях с 4-кратным увеличением. Метод включает в себя модуль анализа изображений на основе браузера и позволяет проводить простой анализ сократительной клеточной силы, не требуя деликатных процедур обработки или регистрации фидуциарных маркеров, так что он должен быть оперируем любым исследователем с базовой установкой клеточной культуры и простым флуоресцентным микроскопом с низким увеличением (рисунок 2). ). Эта технология, которая готова к полке и коммерчески доступна, была разработана с учетом конечного пользователя и направлена на снижение барьера входа для любого лабораторного ученого для изучения биологии клеточной силы.

Рисунок 2: Схема формата пластины с 24 лунками для анализа сократимости одной ячейки. Этот формат был использован в экспериментах, описанных здесь и изображенных в видеочасти статьи. Шкала = 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В этой работе мы представляем протокол для применения формата пластины 24 лунок платформы FLECS Technology для количественной оценки влияния силовых модулирующих препаратов на клеточную сократимость в первичных гладкомышечных клетках мочевого пузыря. Этот протокол общего назначения может быть адаптирован и модифицирован по мере необходимости для учета различных других временных шкал, типов клеток и условий лечения, представляющих интерес, и масштабирован для ответа на другие вопросы в области биологии.
протокол
1. День 1: Подготовка плиты из 24 скважин
- Начните процедуру с добавления 20 мл клеточной культуральной среды в коническую трубку объемом 50 мл. В этом эксперименте используется среда на основе F12 Ham, дополненная 10% фетальной бычьей сывороткой (FBS).
- Получите пластину из 24 лунок, предназначенную для анализа сократимости клеток. Установите пипетку на 500 мкл и получите клеточный ситечко для прохождения клеток.
ПРИМЕЧАНИЕ: Пластина предоставляется авторами по запросу. - Поднимите и подержите тарелку в одной руке и приступайте к аккуратному отклеиванию пластиковой пленки от верхней части тарелки. Затем аккуратно установите пластину обратно вниз.
- Включите вакуумный аспиратор и аспирируйте верхний слой фосфатно-буферного соляного раствора (PBS) из скважин, чтобы предотвратить разлив. Удаляйте PBS по одной строке за раз. Как только скважины больше не будут полностью заполнены, держите пластину в одной руке и осторожно извлеките остальную часть PBS из скважин. Быстро залейте 500 мкл клеточной питательной среды. Следите за тем, чтобы избежать контакта между аспиратором и дном колодца.
- Аккуратно встряхните тарелку и постучите по стороне, чтобы все дно колодца было покрыто раствором. После того, как все колодцы заполнены средой, отложите плиту в сторону.
2. День 1: Посев клеток
- Извлеките колбу для культивирования с проходом 7 или ниже первичных клеток гладкой мускулатуры мочевого пузыря человека (BSM) из инкубатора с температурой 37 °C. Под микроскопом проверьте морфологию клеток и убедитесь, что клетки выросли по крайней мере до 90% слияния, но менее 100% слияния.
- Проведите протокол диссоциации клеток. В стерильном шкафу биобезопасности трипсинизируют клетки в течение 2,5 мин, пока клетки не будут отделены, прежде чем закалять их сывороточной средой (10% FBS).
- Как только клетки диссоциируются, используйте гемоцитометр для подсчета клеток и разбавляйте клеточную суспензию примерно до 50 000 клеток / мл в среде, дополненной сывороткой. Важно отметить, что клеткам требуется не менее 2% сыворотки для прикрепления к микрошарам.
- Перед посевом быстро процедите клеточную суспензию через клеточный сетчатый фильтр 40 или 100 мкм в коническую трубку объемом 50 мл с серологической пипеткой, чтобы разбить скопления клеток на отдельные клетки.
- Осторожно добавьте 500 мкл из 50 000 ячеек/мл клеточной суспензии в каждую из 24 лунок на пластине, используя пипетку P1000, дозируя раствор по каплям в разных положениях в скважинах.
- После посева клеток дайте пластине постоять при комнатной температуре в течение 1 часа, чтобы ячейки осели непосредственно на микроструктуры, не подвергаясь влиянию микротоков, генерируемых испарением. Через 1 ч поместите пластину в инкубатор при температуре 37 °C на ночь. Клетки будут самособираться и распространяться по адгезивным микроструктурам в течение этого времени и начнут оказывать уровни базального сокращения.
3. День 2: Добавление тестового препарата
ПРИМЕЧАНИЕ: Конечная концентрация диметилсульфоксида (ДМСО) в скважинах, содержащих прилипшие клетки, не может превышать 1%, и лекарственное средство/ДМСО не может быть добавлено непосредственно в клетки, а сначала должно быть разбавлено и смешано с промежуточным раствором клеточной среды.
- Создайте шестиступенчатый восьмикратный ряд разведения лекарственного средства путем переноса 30 мкл исходного лекарственного средства в последовательные объемы ДМСО объемом 210 мкл и тщательного смешивания между каждой стадией переноса. В этой работе в ДМСО готовится шестиступенчатая восьмиступенчатая серия разведения блеббистатина в дозах от 40 мкМ до 1 нМ.
- Для каждого исходного лекарственного раствора (из Стадии 3.1) смешайте 30 мкл лекарственного средства в 470 мкл клеточной культуральной среды. Промежуточный раствор дает 16,7-кратное разбавление ДМСО.
- Перенесите 200 мкл каждого промежуточного раствора в соответствующую скважину на плите 24 скважины (которая уже содержит 100 мкл среды в каждой скважине). Это приводит к дополнительному шестикратному разбавлению ДМСО.
- Этапы 3.2 и 3.3 в совокупности дают 1% конечную концентрацию ДМСО в скважинах.
- Поместите обработанную пластину в инкубатор при температуре 37 °C на соответствующую продолжительность. Для этого эксперимента используется 30-минутная инкубация.
- Непосредственно перед визуализацией добавьте раствор живого ядерного пятна Hoechst 33342 в каждую лунку (окончательное разбавление 1:10 000). Дайте ему инкубироваться в течение дополнительных 15 минут, чтобы пометить ядра клеток.
4. День 2: Визуализация плиты скважины
- Доступ к микроскопу, оборудованному для изображения каналов как клеточных ядер (DAPI), так и микрошариков (TRITC).
- Сначала создайте изображение ячеек только с DMSO.
- Затем сосредоточьтесь и изобразите как микрошарики, так и меченые ядра клеток, чтобы идентифицировать отдельные клетки и обеспечить идеальное выравнивание обоих каналов для обеспечения автоматизированного анализа изображений.
- Повторите в нескольких положениях в каждой из 24 скважин на плите. Изображения могут быть сделаны с 4-кратным объективом (или опционально выше, чтобы ускорить визуализацию и получить максимальные точки данных на изображение).
- Экспортируйте изображения в виде файлов TIF и откройте их на компьютере, подключенном к Интернету, с помощью ImageJ для анализа данных.
5. Постэксперимент: Анализ изображений
ПРИМЕЧАНИЕ: Анализ изображений проводился с использованием Biodock.ai портального и графического программного обеспечения.
- Загрузите полученные изображения на компьютер.
- Убедитесь, что соответствующие пары микроструктурных и ядерных изображений названы правильно.
- Убедитесь, что все имена изображений микрошарики имеют вид "sharedCoreName_pt.tif".
- Убедитесь, что все имена образов ядер имеют вид "sharedCoreName_dapi.tif".
- Конвертируйте изображения из TIF в PNG с помощью ImageJ.
- После открытия ImageJ загружайте его по одному каналу за раз. Для этого эксперимента сначала загрузите микрошаблонные изображения в виде стека в ImageJ.
- С помощью image > Adjust > Brightness/Contrast, отрегулируйте яркость изображения, чтобы подчеркнуть микрошарики и уменьшить фон до черного. В дополнение к этому, сгладьте изображения.
- С помощью Image > Type > 8-бит, преобразуйте изображения в 8-битные.
- Затем экспортируйте изображение в формат PNG и установите флажок уровень фрагмента в качестве имени файла. Теперь создайте новую папку PNG и сохраните там PNG-файлы с тем же именем.
- Повторите этот процесс для изображений ядер.
- Загрузите пары изображений PNG в программное обеспечение для обработки изображений для анализа.
- Создайте и подтвердите учетную запись. У авторов есть учетная запись для обеспечения открытого доступа для академических пользователей.
- Подтвердите учетную запись, связавшись с авторами.
- Войдите в программное обеспечение.
- На вкладке Данные слева нажмите кнопку Загрузить пакет.
- Импортируйте изображения, перетаскивая пары изображений в всплывающее окно и назовите пакет. Нажмите кнопку ОК.
- Установите флажок рядом с именем пакета и нажмите кнопку Анализировать.
- На следующем экране прокрутите вниз и установите флажок Анализ сократимости и нажмите кнопку Выбрать. Внизу страницы выберите 10x в качестве увеличения, которое использовалось для изображения в раскрывающемся меню.
- Нажмите кнопку Отправить. Как только анализ данных прочитает Завершено, нажмите на имя пакета. На следующем экране щелкните Загрузить данные в правой части страницы.
ПРИМЕЧАНИЕ: Загруженные файлы будут содержать изображения, которые были проанализированы, сводные результаты, сообщающие о среднем сокращении в каждом изображении, и подробный анализ каждого микрошаблона, который был обнаружен на любом изображении, сообщая об их размерах, положениях, количестве приклеенных ячеек и сокращении. - Построение значений сокращения по отношению к концентрациям лекарственного средства для создания кривой концентрация-реакция и определения относительных потенций различных методов лечения.
- Нажмите кнопку Отправить. Как только анализ данных прочитает Завершено, нажмите на имя пакета. На следующем экране щелкните Загрузить данные в правой части страницы.
Результаты
Области изображений, полученных из скважин, которые были обработаны только ДМСО, и те, которые были обработаны блеббистатином 40 мкМ, показаны бок о бок на рисунке 3. Можно четко заметить, что клетки, обработанные только DMSO, демонстрируют значительный уровень сокращения, основанный на очень заметных деформациях микроструктур, прилипших к гладкомышечным клеткам мочевого пузыря (BSMC) в этой скважине. И наоборот, на изображении хорошо обработанного 40 мкМ блеббистатина наблюдается значительная клеточная релаксация7, поскольку микрошарики, к которым прилипают БСМК, почти неотличимы по размеру от микрошариков, к которым не прилипают клетки, что указывает на минимальное сокращение. Эти изображения демонстрируют интуитивное и четкое визуальное представление сократимости одной клетки, предлагаемое методом флуоресцентного микроструктурирования. В отличие от методов на основе TFM, где всенаправленное движение многочисленных флуоресцентных частиц, случайным образом распределенных под плотным монослоем ячейки, предназначено для передачи относительной сократительной силы, здесь однородная и выраженная сжатая геометрия микрошариков обеспечивает немедленную и легко интерпретируемую качественную информацию о сокращении отдельных клеток. Они могут быть непосредственно количественно определены путем применения стандартных операций с двоичными объектами к изображениям.
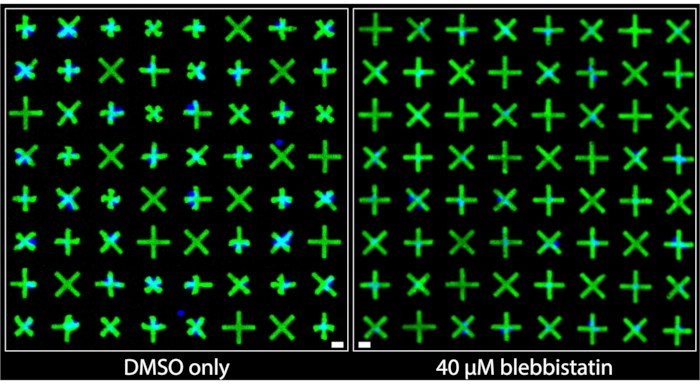
Рисунок 3: Параллельные сравнения изображений, сделанных из скважин, содержащих либо только 1% лечения ДМСО (слева), либо содержащих 40 мкМ блеббистатина (справа). Можно четко заметить, что лечение блеббистатином значительно снижает сократимость одиночных клеток, о чем свидетельствуют более крупные, неконцентрированные микроструктуры. Синие ядра указывают, какие микрошарики связаны клетками. Шкала = 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Применяя модуль анализа на основе браузера для анализа полученных пар изображений микрошаблонов и клеточных ядер, для каждой популяции получаются распределения сократимости одиночных клеток, как показано на рисунке 4. Подробно описанный в предыдущем отчете по методологии FLECS15, анализ работает путем определения положения и ориентации каждого микрошаблона в форме «X», подсчета количества ядер, прикрепленных непосредственно к центру каждой микрошаблоны, вычисления средней длины каждого микрошаблона и вычисления пиксельного расстояния сжатия каждой микрошаблоны по отношению к средней длине пустых микрошаблонов (ссылка на нулевое сокращение). Поэтому пустые микрошарики служат важной цели для нормализации данных о сокращении. Важно отметить, что клетки, которые не связываются с микроструктурами, будут накапливаться на границах скважин из-за микротоков, где они не будут влиять на анализ изображений. Как видно на этих графиках, невозмутимая сократимость клеточной популяции, обработанной только с помощью элементов управления DMSO, охватывает большой диапазон до 20 пикселей, причем центр находится на уровне около 10 пикселей. Между тем, клетки, обработанные блеббистатином, сокращаются значительно меньше, и их распределение опускается до центра чуть более 6 пикселей. Важно отметить, что каждый микрошаблон, найденный на изображении, который связывается точно на клетке, представлен в этих распределениях. Это демонстрирует способность метода передавать дифференциальные клеточные реакции на медикаментозное лечение.
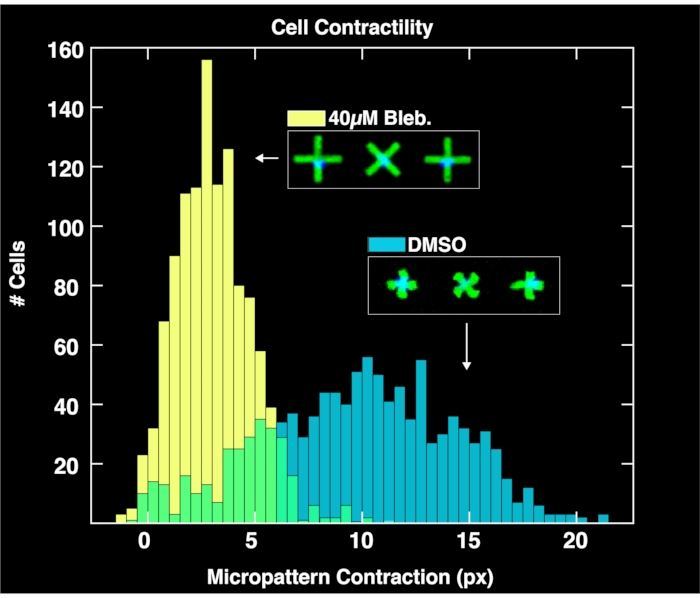
Рисунок 4: Гистограммы, изображающие данные о сократимости одноклеточных клеток, полученные в результате анализа изображений, полученных из скважин, содержащих только 1% ДМСО (синий) или 40 мкМ блеббистатина. Распределение клеток, обработанных ДМСО, является широким и сосредоточено на гораздо большем значении сокращения (~ 10 пикселей), чем распределение, обработанное блеббистатином, демонстрируя количественные эффекты лечения клеток блеббистатином. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
При использовании всех скважин на одной 24-луночной пластине и визуализации по меньшей мере 3 участков на скважину одновременно генерируются шеститочечные кривые «доза-реакция» для двух лекарственных соединений. На рисунке 5 показаны данные о концентрации-ответе для БСМК, получавших одинаковый диапазон доз блеббистатина или цитохалазина D (оба известных ингибитора сократимости). Как видно из профилей концентрации-ответа, цитохалазин D является более мощным ингибитором тонического сокращения в этих клетках. Подгоняя сигмоидальную кривую к точкам данных, значения IC50 могут быть рассчитаны для каждого препарата. Наши эксперименты показывают, что IC50 составляет 7,9 мкМ и 100 нМ для блеббистатина и цитохалазина D, соответственно, после ~ 30 мин воздействия лекарств. Важно отметить, что в целом эти значения согласуются с предыдущими отчетами, подтверждающими количественную точность метода определения эффективности ингибиторов сокращения7,21.
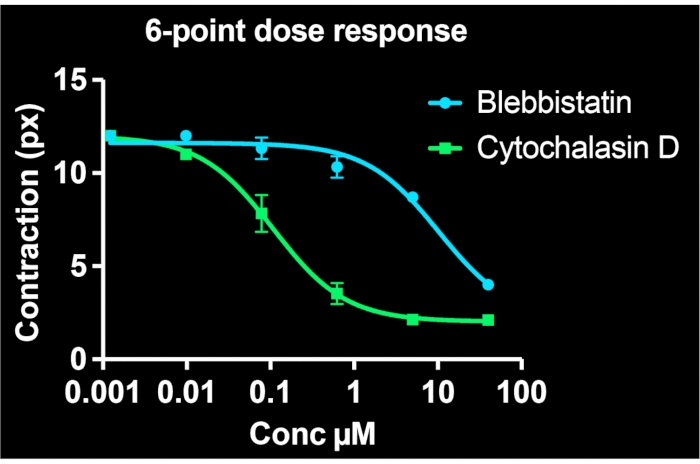
Рисунок 5: Кривые концентрация-реакция, изображающие влияние блеббистатина и цитохалазина D на клеточную сократимость в одиночных клетках. Каждая точка данных содержит три изображения для этого условия. Сигмоидальная кривая соответствовала каждому набору данных. Результаты показывают, что цитохалазин D является более мощным, имея более низкое значение IC50 . Эти данные собираются с одной 24-луночной пластины FLECS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот упрощенный метод количественного измерения сокращения в сотнях тысяч клеток одновременно при различных условиях лечения и использовании только стандартных инструментов микроскопии обеспечивает доступную альтернативу традиционному TFM для исследователей для изучения клеточной силовой биологии. Поскольку представленная технология обеспечивает визуальное отображение сокращения клеток путем анализа изменений в регулярно сформированных флуоресцентных микроструктурах, величина сокращения, производимого любой данной клеткой, интуитивно понятна - чем меньше микрошаблон, тем больше сократительная сила, оказываемая клеткой.
Примечательно, что, предлагая контроль над такими факторами, как форма, область распространения и молекула адгезии, содержащая микрошарики (все факторы, которые, как известно, регулируют сократимость клеток22,23,24), представленная технология систематически устраняет дополнительные переменные, которые могут сбить с толку интерпретации исследований сокращения клеток.
В этом эксперименте в геле использовалась жесткость 10 кПа, а микрошагонная матрица 70 мкм (диагональная длина) состояла из коллагена IV типа. Помимо этих параметров, адгезивная молекула может быть заменена различными коллагенами, фибронектином, желатином и другим внеклеточным матриксом (ECM). Жесткость геля может быть настроена до 0,1 кПа и до диапазона МПа. Геометрия микрошаблона может быть спроектирована de novo так, чтобы иметь любую форму с минимальным размером объекта ~ 5 мкм. Эти параметры разъединены и могут быть независимо оптимизированы для конкретного биологического контекста.
Эта технология была широко проверена на совместимость с высокоадгезионными и сократительными типами клеток мезенхимального фенотипа, включая различные типы гладкомышечных клеток человека (первичный мочевой пузырь человека, кишечник, трахея, бронхиальный, маточный, аортальный и артериальный), мезенхимальные стволовые клетки и их дифференцированное потомство, различные фибробласты (легочные, дермальные и сердечные), миофибробласты и эндотелиальные клетки. Кроме того, макрофаги, полученные из моноцитов, также будут производить большую измеримую фагоцитарную силу на микрошаблонах, особенно если микроструктура состоит из известного опсонина. Различные линии рака также могут быть проанализированы с использованием метода.
Метод может создавать некоторые проблемы для использования с клетками, которые либо относительно малы, такими как Т-клетки и нейтрофилы, либо с типами клеток с преимущественно эпителиальным фенотипом. Основная причина этого заключается в том, что метод опирается на сильную адгезию и полное распространение клеток по микрошаблону с целью генерации измеримого сократительного сигнала. Клетки, которые слабо связываются, связываются друг с другом или не распространяются полностью, не будут производить измеримые сократительные сигналы. Это поведение, которое относительно редко, может быть смягчено путем корректировки размера микрошаблона, чтобы он был меньше, или путем использования альтернативных адгезивных молекул в микрошаблонах, которые будут лучше способствовать адгезии и распространению в этих клетках.
Пользователи технологии должны тщательно оценивать различные возможные составы клеточной культуральной среды для их конкретного типа клеток, поскольку различные компоненты, факторы роста, уровни сыворотки и чувствительность к рН могут управлять переменным поведением в разных клетках. Оптимизация протокола должна предшествовать масштабированию любых экспериментальных рабочих процессов, а компоненты носителей всегда должны быть свежими, стерильными и соответствовать предыдущим партиям.
В конечном счете, если разрешение одной ячейки не является необходимым для целей пользователя, или если целевой тип ячейки имеет минимальную способность к распространению, то традиционный TFM может быть в равной степени или более подходящим для таких экспериментов. Цель и надежда авторов заключается в том, что этот инструмент предоставляет клеточным биологам дополнительный путь для изучения клеточного сокращения, особенно в контексте автоматизированных высокопроизводительных фенотипических скринингов лекарств.
В зависимости от будущего использования в скринингах лекарств могут использоваться пластины с более высокой пропускной способностью, такие как пластина FLECS с 384 скважинами. В таких пластинах 4-кратные цели на многих микроскопах могут захватывать целую единственную скважину в поле зрения, гарантируя, что все клеточные сократительные реакции будут захвачены. Используя высокопроизводительную систему визуализации, вся пластина из 384 скважин может быть получена примерно за 5 минут, что делает эту систему значительно быстрее, чем другие варианты, и, следовательно, подходит для открытия высокопроизводительных фенотипических лекарств. Действительно, авторы регулярно проводят еженедельные скрининги лекарств на ~ 50 384 скважинах (в общей сложности более 19 000 скважин) с использованием автоматизации.
Раскрытие информации
И.П. является изобретателем по выданному семейству патентов, защищающих методы и системы технологии FLECS. I.P., Y.W., J.Z., E.C. и R.H. являются сотрудниками Forcyte Biotechnologies, Inc. R.D. является профессором UCLA и соучредителем Forcyte Biotechnologies, Inc. I.P., Y.W., J.Z. и R.D. имеют финансовые интересы в Forcyte Biotechnologies, Inc., которая является эксклюзивным лицензиатом вышеуказанных патентов и коммерциализирует технологию FLECS.
Благодарности
Лабораторные работы проводились при поддержке UCLA Molecular Shared Screening Resource (MSSR), где Forcyte спонсирует исследовательскую деятельность, и Инкубатора Magnify в Калифорнийском институте наносистем (CNSI), где Forcyte Biotechnologies, Inc. является компанией-резидентом. Авторы предоставят доступ к Biodock.ai аналитическому модулю FLECS всем академическим исследователям по запросу. Л.Х. и И.П. внесли равный вклад в эту работу.
Материалы
| Name | Company | Catalog Number | Comments |
| Bladder smooth muscle cell culture | Sciencell | #4310 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Cell culture media | Thermofisher | 11765054 | Ham's F12 medium supplemented with 10% FBS and 1% p/s |
| Cell strainer | Fisher Scientific | 7201432 | |
| Conical Tube | Fisher Scientific | 05-539-13 | |
| Culture flask | Fisher Scientific | FB012941 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| DMSO (Dimethyl sulfoxide) | Fisher Scientific | D1284 | |
| Eppendorf tubes | Fisher Scientific | 05-402-31 | |
| Fluorescent microscope | Molecular Devices | ImageXpress Confocal | |
| Forcyte-manufactured 24-well plate | Forcyte Biotechnologies | 24-HC4R-X1-QB12 | |
| Hoescht 3342 Live Nuclear Stain | Thermofisher | 62249 | |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP39920 |
Ссылки
- Ohama, T., Hori, M., Ozaki, H. Mechanism of abnormal intestinal motility in inflammatory bowel disease: How smooth muscle contraction is reduced. Journal of Smooth Muscle Research. 43 (2), 43-54 (2007).
- Peyronnet, B., et al. A comprehensive review of overactive bladder pathophysiology: On the way to tailored treatment. European Urology. 75 (6), 988-1000 (2019).
- Aldamanhori, R., Osman, N. I., Chapple, C. R. Underactive bladder: Pathophysiology and clinical significance. Asian Journal of Urology. 5 (1), 17-21 (2018).
- Sanderson, M. J., Delmotte, P., Bai, Y., Perez-Zogbhi, J. F. Regulation of airway smooth muscle cell contractility by Ca2+ signaling and sensitivity. Proceedings of the American Thoracic Society. 5 (1), 23-31 (2008).
- Brozovich, F. V., et al. Mechanisms of vascular smooth muscle contraction and the basis for pharmacologic treatment of smooth muscle disorders. Pharmacological Reviews. 68 (2), 476-532 (2016).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Bell, E., Ivarsson, B., Merrill, C. Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro. Proceedings of the National Academy of Sciences. 76 (3), 1274-1278 (1979).
- Tan, J. L., et al. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proceedings of the National Academy of Sciences. 100 (4), 1484-1489 (2003).
- Rokhzan, R., et al. high-throughput measurements of cell contraction and endothelial barrier function. Laboratory Investigation. 99 (1), 138-145 (2019).
- Park, C. Y., et al. High-throughput screening for modulators of cellular contractile force. Integrative Biology. 7 (10), 1318-1324 (2015).
- Kaylan, K. B., Kourouklis, A. P., Underhill, G. H. A high-throughput cell microarray platform for correlative analysis of cell differentiation and traction forces. Journal of Visualized Experiments. (121), e55362 (2017).
- Huang, Y., et al. Traction force microscopy with optimized regularization and automated Bayesian parameter selection for comparing cells. Scientific Reports. 9, 539 (2019).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: A new tool for quantifying cell-matrix interactions. PLOS ONE. 6, 17833 (2011).
- Pushkarsky, I., et al. Elastomeric sensor surfaces for high-throughput single-cell force cytometry. Nature Biomedical Engineering. 2 (2), 124-137 (2018).
- Pushkarsky, I. FLECS technology for high-throughput single-cell force biology and screening. ASSAY and Drug Development Technologies. 16 (1), 7-11 (2017).
- Koziol-White, C. J., et al. Inhibition of PI3K promotes dilation of human small airways in a rho kinase-dependent manner. British Journal of Pharmacology. 173 (18), 2726-2738 (2016).
- Orfanos, S., et al. Obesity increases airway smooth muscle responses to contractile agonists. American Journal of Physiology-Lung Cellular and Molecular Physiology. 315 (5), 673-681 (2018).
- Tseng, P., Pushkarsky, I., Carlo, D. D. Metallization and biopatterning on ultra-flexible substrates via dextran sacrificial layers. PLOS ONE. 9, 106091 (2014).
- Yoo, E. J., et al. Gα12 facilitates shortening in human airway smooth muscle by modulating phosphoinositide 3-kinase-mediated activation in a RhoA-dependent manner. British Journal of Pharmacology. 174 (4), 4383-4395 (2017).
- MacGlashan, D., Vilariño, N. Polymerization of actin does not regulate desensitization in human basophils. Journal of Leukocyte Biology. 85 (4), 627-637 (2009).
- Hocking, D. C., Sottile, J., Langenbach, K. J. Stimulation of integrin-mediated cell contractility by fibronectin polymerization. Journal of Biological Chemistry. 275 (14), 10673-10682 (2000).
- Tolić-Nørrelykke, I. M., Wang, N. Traction in smooth muscle cells varies with cell spreading. Journal of Biomechanics. 38 (7), 1405-1412 (2005).
- Ye, G. J. C., et al. The contractile strength of vascular smooth muscle myocytes is shape dependent. Integrative Biology. 6 (2), 152-163 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены