Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуализация и количественная оценка фармацевтических соединений в коже с помощью когерентной рамановской рассеянной визуализации
В этой статье
Резюме
Описана когерентная методология визуализации рамановского рассеяния для визуализации и количественной оценки фармацевтических соединений в коже. В данной работе описывается подготовка тканей кожи (человека и мыши) и местное применение состава, получение изображений для количественной оценки профилей пространственно-временной концентрации и предварительный фармакокинетический анализ для оценки местной доставки лекарств.
Аннотация
Кожная фармакокинетика (cPK) после местного применения состава была областью исследований, представляющей особый интерес для ученых в области регулирования и разработки лекарств для механистического понимания местной биодоступности (BA). Полуинвазивные методы, такие как ленточное удаление, дермальный микродиализ или кожная микроперфузия с открытым потоком, количественно определяют макромасштаб cPK. Хотя эти методы предоставили обширные знания cPK, сообществу не хватает механистического понимания проникновения и проникновения активных фармацевтических ингредиентов (API) на клеточном уровне.
Одним из неинвазивных подходов к решению микромасштабных cPK является когерентная рамановская рассеянная визуализация (CRI), которая избирательно нацелена на внутренние молекулярные колебания без необходимости внешних меток или химической модификации. CRI имеет два основных метода - когерентное анти-Стоксовское рамановское рассеяние (CARS) и стимулированное рамановское рассеяние (SRS), которые позволяют чувствительную и селективную количественную оценку API или неактивных ингредиентов. CARS обычно используется для получения структурной информации о коже или визуализации химического контраста. Напротив, сигнал SRS, который является линейным с молекулярной концентрацией, используется для количественной оценки API или неактивных ингредиентов в стратификациях кожи.
Хотя ткань мыши обычно используется для cPK с CRI, местный BA и биоэквивалентность (BE) в конечном итоге должны быть оценены в тканях человека до одобрения регулирующих органов. В данной статье представлена методология подготовки и изображения кожи ex vivo для использования в количественных фармакокинетических исследованиях CRI при оценке актуальных БА и БЭ. Эта методология обеспечивает надежную и воспроизводимую количественную оценку API в коже человека и мыши с течением времени. Количественно оцениваются концентрации в богатых липидами и бедных липидами компартментах, а также общая концентрация АФИ с течением времени; они используются для оценки микро- и макромасштабных БА и, возможно, БЭ.
Введение
Методологии оценки cPK после местного применения лекарственного средства расширились от классических исследований проникновения in vitro (IVPT) 1,2,3,4,5 и ленточного удаления 6,7,8 до дополнительных методологий, таких как микроперфузия с открытым потоком или дермальный микродиализ 9,10,11, 12,13,14. Существуют потенциально различные локальные участки терапевтического действия в зависимости от интересующего заболевания. Следовательно, может существовать соответствующее количество методологий для оценки скорости и степени, в которой API попадает на предполагаемый локальный сайт действий. Хотя каждая из вышеупомянутых методологий имеет свои преимущества, основным недостатком является отсутствие микромасштабной информации cPK (то есть невозможность визуализировать, куда идет API и как он пронизывает).
Одной из неинвазивных методологий, представляющих интерес для оценки актуальных БА и БЭ, является CRI, который можно разбить на два метода визуализации: CARS и микроскопию SRS. Эти когерентные рамановские методы позволяют химически специфическую визуализацию молекул с помощью нелинейных рамановских эффектов. В CRI две лазерные импульсные цепи фокусируются и сканируются внутри образца; разница в энергии между частотами лазера устанавливается для нацеливания на колебательные моды, специфичные для химических структур, представляющих интерес. Поскольку процессы CRI нелинейны, сигнал генерируется только в фокусе микроскопа, что позволяет проводить трехмерную фармакокинетическую томографическую визуализацию ткани. В контексте cPK CARS был использован для получения тканевой структурной информации, такой как расположение богатых липидами структур кожи15. Напротив, SRS был использован для количественной оценки молекулярной концентрации, поскольку ее сигнал является линейным с концентрацией. Для образцов кожи ex vivo предпочтительно проводить CARS в эпи-направлении16 и SRS в режиме передачи17. Таким образом, тонкие образцы тканей позволят обнаруживать и количественно определять сигнал SRS.
Как модельная ткань, ухо обнаженной мыши представляет несколько преимуществ с незначительными недостатками. Одним из преимуществ является то, что ткань уже имеет толщину ~200-300 мкм и не требует дальнейшей пробоподготовки. Кроме того, несколько стратификаций кожи наблюдаются путем осевой фокусировки через одно поле зрения (например, роговой слой, сальные железы (SGs), адипоциты и подкожный жир)16,18. Это позволяет проводить предварительную доклиническую оценку путей кожного проникновения и актуальные оценки БА перед переходом к образцам кожи человека. Однако модель обнаженной мыши имеет такие ограничения, как сложность экстраполяции на сценарии in vivo из-за различий в структуре кожи19. В то время как обнаженное ухо мыши является отличной моделью для получения предварительных результатов, модель кожи человека является золотым стандартом. Хотя были различные комментарии о пригодности и применимости замороженной кожи человека для точного повторения кинетики проникновения in vivo 20,21,22, использование замороженной кожи человека является общепринятым методом оценки кинетики проникновения API in vitro 23,24,25 . Этот протокол визуализирует различные слои кожи мыши и человека, количественно оценивая концентрации API в богатых липидами и бедных липидами структурах.
В то время как CRI использовался во многих областях для конкретной визуализации соединений в тканях, были предприняты ограниченные усилия по исследованию cPK местно применяемых лекарственных средств. Чтобы оценить актуальный BA / BE актуальных продуктов с использованием CRI, необходимо сначала иметь стандартизированный протокол для проведения точных сравнений. Предыдущие усилия по использованию CRI для доставки лекарств на кожу продемонстрировали изменчивость данных. Поскольку это относительно новое применение CRI, создание протокола имеет решающее значение для получения надежных результатов 18,26,27. Этот подход нацелен только на одно конкретное волновое число в биологической тихой области рамановского спектра. Однако большинство API и неактивных ингредиентов имеют рамановские сдвиги в области отпечатков пальцев. Ранее это создавало проблемы из-за внутреннего сигнала, возникающего из ткани в области отпечатков пальцев. Последние лазерные и вычислительные достижения устранили этот барьер, который также может быть использован в сочетании с подходом, представленным здесь28. Этот подход, представленный здесь, позволяет количественно оценить API, который имеет рамановский сдвиг в тихой области (2000-2 300 см-1). Это не ограничивается физико-химическими свойствами препарата, что может иметь место для некоторых ранее упомянутых методологий мониторинга cPK29.
Протокол должен уменьшать вариабельность толщины кожи от образца к образцу для различных препаратов, поскольку образцы толстой кожи человека будут производить минимальный сигнал после применения лекарственного препарата из-за рассеяния света толстым образцом. Целью этой рукописи является представление методологии подготовки тканей, которая обеспечивает воспроизводимые стандарты визуализации. Кроме того, система CRI настроена так, как описано, чтобы уменьшить потенциальные источники ошибок, а также минимизировать сигнал-шум. Однако в этом документе не будут обсуждаться руководящие принципы и технические достоинства микроскопа CRI, поскольку это было ранее рассмотрено30. Наконец, исследуется обширная процедура анализа данных, позволяющая интерпретировать результаты для определения успеха или неудачи эксперимента.
Access restricted. Please log in or start a trial to view this content.
протокол
Использование ткани уха обнаженной мыши было одобрено Комитетом по уходу и использованию животных Массачусетской больницы общего профиля (IACUC), в то время как использование тканей кожи человека было одобрено Советом по институциональному обзору Массачусетской больницы общего профиля (IRB). Согласно протоколам IACUC, свежеусыпленные мыши были получены от коллаборационистов с колониями обнаженных мышей. Ткани человека были приобретены в результате плановой абдоминопластики в Массачусетской больнице общего профиля по утвержденному протоколу. Кроме того, определенные типы тканей, отличные от кожи живота, были приобретены через орган донорства тела, также через протокол, одобренный IRB.
1. Подготовка тканей
- Приготовление ткани кожи уха обнаженной мыши
- После приобретения свежесобранных обнаженных тел мышей удаляют уши с помощью щипцов и микрохирургических ножниц. Поместите одно ухо в небольшую чашку Петри (т.е. 35 мм х 10 мм). Поместите тело обнаженной мыши в мешок биологической опасности, который необходимо утилизировать в соответствии с местными протоколами IACUC.
- Промойте каждое ухо мыши фосфатно-буферным физиологическим раствором (PBS) и осторожно вытрите его насухо с помощью стеклоочистителя. Повторите дважды, чтобы удалить остаточную грязь или мусор на ухе, которые могут повлиять на качество изображения (см. Рисунок 1).
- Если ухо должно использоваться в течение 24 ч, поместите его в небольшую чашку Петри (т.е . 35 мм х 10 мм) со свежим PBS в холодильнике (2-8 °C). Если колос будет использоваться после 24 ч сбора урожая, поместите его в чашку Петри (35 мм х 10 мм) без PBS, накройте тарелку парапленкой и поместите в морозильную камеру при температуре -20 °C.
- Подготовка тканей кожи человека
- После заготовки человеческой ткани поместите ее в большую чашку Петри (т.е. 60 мм х 15 мм) в биологическую вытяжку, чтобы обеспечить достаточно места для подготовки образца.
- Поместите роговой слой лицом вниз так, чтобы подкожно-жировая клетчатка была доступна.
- Используя щипцы и микрохирургические ножницы, начните осторожно удалять подкожно-жировую клетчатку. После того, как подкожный жир больше не может быть удален ножницами, переключитесь на одноразовый скальпель с 10 лезвиями (или эквивалент), чтобы удалить оставшийся подкожный жир. Используйте скальпель под углом 45° к коже, удерживая кожу неподвижно щипцами (см. Рисунок 1).
ПРИМЕЧАНИЕ: Чтобы иметь высококачественную передачу изображений SRS, образцы должны быть как можно более тонкими без проколов.
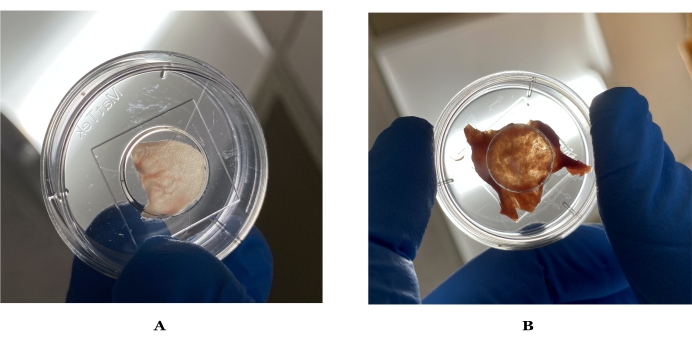
Рисунок 1: Изображения идеальной толщины для визуализации кожи мыши и человека. (А) Кожа уха мыши удерживается до света, который может заметно пропускать свет. (B) Идеальная кожа человека, выдерживаемая до света после подготовки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Разделите кожу человека на кусочки размером 1 см х 1 см.
ПРИМЕЧАНИЕ: Свежая кожа, может быть использована в течение 24 ч без использования агарозного гелевого слоя, как описано ранее31. Тем не менее, свежая кожа может использоваться дольше, если ее держать на агарозном гелевом ложе. Если кожа будет использована позже, кожу помещают в мешок для транспортировки образцов, а затем помещают в морозильную камеру с температурой -20 °C. Замороженную кожу необходимо разморозить с помощью процедуры, приведенной ниже, для достижения оптимальных результатов (см. шаг 3.1.2).
2. Настройка лазера и микроскопа
- Примерно за 30 минут до получения изображения включите широко настраиваемый сверхбыстрый лазер (далее именуемый лазером) и дайте ему прогреться. Включите систему лазерного предупреждающего знака/замка, чтобы уведомлять персонал за пределами потенциальной опасности при входе.
ПРИМЕЧАНИЕ: При работе с лазерами IV класса необходимо всегда носить соответствующие очки. Для конкретного лазера, используемого здесь, рекомендуемыми надлежащими очками являются OD ≥ 6 для рабочего диапазона лазера 800-1 300 нм. - Пока лазер нагревается, включите оставшееся оборудование для управления микроскопом, обнаружения CARS и обнаружения SRS.
- Правильно выровняйте микроскоп, чтобы обеспечить оптимальную визуализацию. В окне Image Acquisition Control (Управление получением изображений ) в программном обеспечении управления микроскопом (далее — программное обеспечение MC) нажмите на лампу пропускания , чтобы свет поступал от трансиллюминационной лампы микроскопа.
- Обеспечьте правильное освещение Köhler, чтобы выровнять микроскоп вдоль вертикальной оси: закройте радужную оболочку, чтобы через окуляр32 было видно минимальное количество света.
- Глядя через окуляр, откройте радужную оболочку, чтобы увидеть, касается ли многоугольник всех сторон одновременно. Отрегулируйте высоту конденсатора, если перед открытием диафрагмы не видна многоугольная форма.
- Если многоугольная фигура не затрагивает все стороны одновременно, отрегулируйте положение выравнивания диафрагмы с помощью ручек регулировки.
ПРИМЕЧАНИЕ: Смотрите Sanderson et al.33 для углубленной настройки микроскопа. - Поместите на держатель ступени микроскопа предметное стекло с крышкой и двусторонней клеевой прокладкой, содержащей образец масла (например, оливковое масло, так как в маслах много связей -CH2-).
- В окне Настройки сбора данных программного обеспечения MC найдите раскрывающееся меню микроскопа и установите для объектива микроскопа значение 20x.
- Убедитесь, что фильтр обнаружения CARS (645 нм/50 нм) в состоянии визуализировать и измерять сигнал epiCARS вдоль трубки фотоумножителя бокового порта микроскопа.
ПРИМЕЧАНИЕ: Этот специфический фильтр выбран для визуализации липидов в качестве анти-Stokes CARS сигнала, генерируемого при 652 нм для длины волны насоса 803 нм и длины волны Стокса 1040 нм (см. Экв. (1)).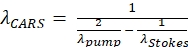 (1)
(1)
Где переменные λ имеют единицы нм; λнасос - длина волны пучка насоса; и λСтокс — длина волны пучка Стокса. - Посмотрите через окуляр, чтобы найти край образца масла, который будет использоваться для проверки выравнивания системы.
- Убедитесь, что край находится в Z-фокусе с помощью ручек фокусировки на микроскопе, и отрегулируйте контроллер сцены для получения фокуса XY.
- После того, как лазер прогрелся, установите луч накачки на 803 нм , а тонкая настройка двигателя установлена на 50,0 в графическом пользовательском интерфейсе лазера. Точная точная тонкая настройка двигателя может отличаться от настройки к настройке.
ПРИМЕЧАНИЕ: Пучок накачки является единственным лучом с регулируемой длиной волны на этом лазере, поскольку длина волны луча Стокса зафиксирована на уровне 1040 нм. Эта конфигурация нацелена на вибрацию CH на уровне 2850 см-1 (см. Экв. (2) для расчета длины волны насоса для нацеливания на волновое число).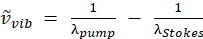 (2)
(2)
Где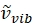 имеет единицы относительного волнового числа (см−1), а переменные λ имеют единицы в см.
имеет единицы относительного волнового числа (см−1), а переменные λ имеют единицы в см. - Проверьте выравнивание лазера в микроскоп перед визуализацией; См. рисунок 2 для изображения лазерного пути. Во время первоначальной настройки микроскопа установите две радужные оболочки в траектории луча в качестве направляющих для правильного выравнивания в микроскопе. Поскольку оптический путь лазера может дрейфовать с течением времени, убедитесь, что траектории лазерного луча пересекают центр радужных оболочек, чтобы они правильно входили в микроскоп.
- Используя ИК-вьюер, полностью закройте все радужные оболочки и убедитесь, что луч центрирован на обоих: сначала на радужной оболочке, ближайшей к лазеру, и, наконец, на входном отверстии микроскопа.
- Во-первых, проверьте пучок насоса, чтобы убедиться, что луч идет в микроскоп прямо. Как только насос выровнен, убедитесь, что луч Стокса также правильно попадает в микроскоп.
- Если лучи не выровнены через радужные оболочки, итеративно проведите лучи через радужные оболочки с помощью регуляторных ручек x и y двух зеркальных креплений для насоса и лучевых дорожек Стокса.
- После того, как точки луча перекрываются перед входом в микроскоп, проверьте, правильно ли они проходят через микроскоп.
- В окне Image Acquisition Control программного обеспечения MC щелкните канал TD для передачи, ALG1 (аналоговый канал 1) для когерентного анти-Стоксовского рамановского канала и ALG2 (аналоговый канал 2) для стимулированного канала рамановского рассеяния. Используйте следующие настройки (как в этом протоколе): усиление 1 и смещение -1 для ALG1, усиление 1,25 и смещение -2 для ALG2.
ПРИМЕЧАНИЕ: В зависимости от конфигурации системы аналоговые каналы могут иметь различную нумерацию для отдельных каналов обработки изображений. Если детектор SRS установлен, сигнал передачи не будет, так как свет не может пройти (т. Е. Нельзя визуализировать изображения с TD и ALG2 одновременно в этой установке).
- В окне Image Acquisition Control программного обеспечения MC щелкните канал TD для передачи, ALG1 (аналоговый канал 1) для когерентного анти-Стоксовского рамановского канала и ALG2 (аналоговый канал 2) для стимулированного канала рамановского рассеяния. Используйте следующие настройки (как в этом протоколе): усиление 1 и смещение -1 для ALG1, усиление 1,25 и смещение -2 для ALG2.
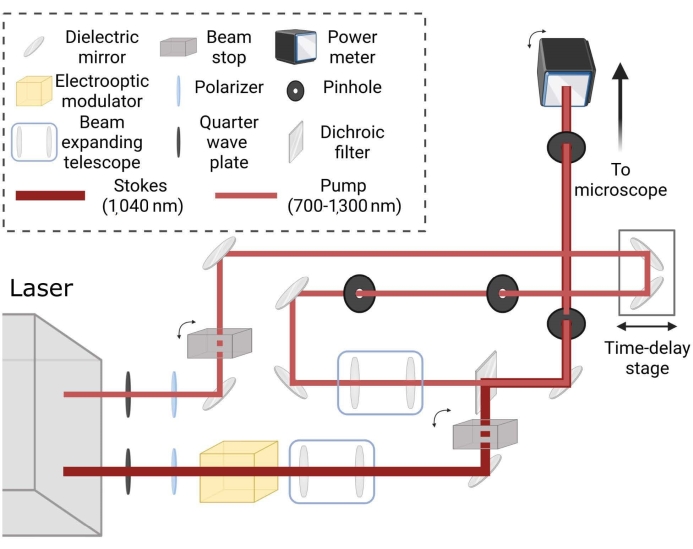
Рисунок 2: Схематическая компоновка для когерентного пути рамановской лазерной визуализации. Лучи независимо кондиционируются для размера пятна и сопоставляются с помощью стадии временной задержки для создания когерентного комбинационного рассеяния в образцах для желаемой частоты настройки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Включите измеритель мощности и, используя датчик тепловой мощности высокой мощности, измерьте мощность насоса и лучей Стокса индивидуально для эксперимента.
ПРИМЕЧАНИЕ: В этом конкретном примере мощность пучка насоса составляла 80 мВт, в то время как мощность пучка Стокса составляла 180 мВт до входа в микроскоп. - В окне Image Acquisition Control (Управление получением изображений ) нажмите кнопку Focus x2 (Фокус x2 ), чтобы просмотреть изображение в программном обеспечении MC.
- В окне Параметры получения убедитесь, что для соотношения пикселей и времени ожидания установлены нужные параметры для эксперимента.
ПРИМЕЧАНИЕ: В этом протоколе использовалось соотношение пикселей 1,024 x 1,024 и время ожидания 2 мкс/пиксель. - Подтвердите лазерное выравнивание по отношению к микроскопу, разблокировав луч накачки и посмотрев на канал TD .
ПРИМЕЧАНИЕ: Лазер выравнивается правильно, если луч виден в центре изображения с правильными настройками детектора. - В противном случае используйте ручки регулировки X и Y на перископе, чтобы переместить луч в центр изображения.
- Подтвердите выравнивание лазера и микроскопа, увидев одно и то же изображение в каналах CARS и SRS.
- Чтобы получить изображение выравнивания, нажмите кнопку сканирования XY в окне «Управление получением изображения » с соответствующим набором режимов фильтрации (например, Kalman Line 3).
- Сохраните этот набор изображений с описательным именем файла, чтобы сравнить его с течением времени и подтвердить производительность/выравнивание системы.
3. Липидная визуализация
- Мышиное ухо и ткани человека
- При использовании свежих тканей пропустите шаг 3.1.2.
- Снимите кожу уха мыши из морозильной камеры с температурой -20 °C и поместите ее в инкубационную камеру (32 °C) на 10 минут. Извлеките ухо мыши из инкубационной камеры.
ПРИМЕЧАНИЕ: См. шаг 1.1.2. для подготовки кожи уха мыши. Грубое обращение или соскоб ткани может привести к механической деградации, разрушению или разрушению ткани, особенно рогового слоя. - Если вы используете ухо для обнаженной мыши, поместите переднюю часть уха лицом к стеклянному дну тарелки No 0 диаметром 35 мм. Если используется человеческая кожа, поместите ее роговым слоем лицом вниз, так как это позволит количественно оценить препарат от поверхностных слоев до более глубоких слоев (рисунок 1).
ПРИМЕЧАНИЕ: Задняя часть обнаженного мышиного уха более склонна к несовершенствам от корпуса. Если человеческая кожа не помещена со стороной рогового слоя, обращенной вниз на перевернутом микроскопе, человек не сможет видеть за пределами дермы, так как рассеяно изрядное количество света, и препарат, проникающий в роговой слой, не может быть виден. - После того, как ткань была центрирована на стеклянном дне, используйте аппликатор с хлопковым наконечником, чтобы убедиться, что кожа плоская и имеет полный контакт с поверхностью крышки стеклянного дна.
ПРИМЕЧАНИЕ: Это шаг, который может вызвать трудности при визуализации кожи, если она не полностью плоская. - Поместите шайбу поверх кожи, чтобы предотвратить любое движение во время визуализации. Убедитесь, что ткань видна через центральное отверстие шайбы для обнаружения передачи SRS.
- Снимите вставку слайд-стадии и замените ее инкубационной камерой, которая имеет одну вставку для посуды.
- Поместите стеклянную нижнюю посуду с кожной тканью в одну тарелку, прикрепленную к инкубационной камере.
ПРИМЕЧАНИЕ: В качестве альтернативы, используйте 6-луночную пластину для изображения нескольких образцов кожи и составов одновременно. - Уменьшите соотношение пикселей в окне «Настройки сбора» программного обеспечения MC (например, с 1 024 x 1024 до 512 x 512) для более высокой скорости сканирования galvo, в то время как Z-глубина изменяется для поиска рогового слоя (см. Рисунок 3A для мыши или Рисунок 3E для человека).
- После того, как роговой слой будет найден, зарегистрируйте это осевое положение как нулевую позицию в окне «Параметры сбора» и измените соотношение пикселей для каждого конкретного эксперимента (например, 1 024 x 1024).
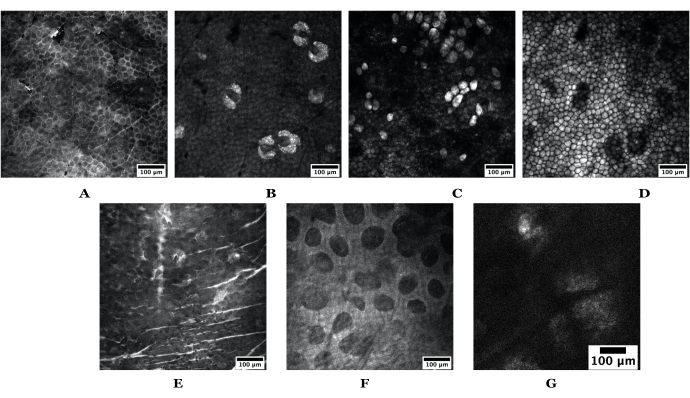
Рисунок 3: Пример глубины кожи, полученный с помощью SRS. Верхний набор изображений взят из кожи уха обнаженной мыши, изображающей следующее: (A) роговой слой, (B) сальные железы, (C) адипоциты, (D) подкожный жир. Нижний набор изображений получен из кожи человека, изображая следующее: (E) роговой слой, (F) сосочковая дерма и (G) сальная железа. Шкала стержней = 100 мкм. Изображения как мыши, так и кожи человека были получены с использованием 20-кратного объектива с разрешением 1024 x 1024 пикселей; человеческий SG был снят при разрешении 512 x 512 пикселей. Сокращения: SRS = стимулированное рамановское рассеяние; SG = сальная железа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Применение актуальной формулировки
- Пипетка с заданной дозой препарата наносится на кожу (например, 10 мкл/см2).
ПРИМЕЧАНИЕ: Вязкость состава будет играть определенную роль в выборе пипетки. Рекомендуется использовать пипетку с положительным смещением для вязких составов, таких как кремы или гели, и пипетку воздушного вытеснения для растворов. В этом эксперименте руксолитиниб был модельным соединением в простом растворе пропиленгликоля (пропан-1,2-диол). - Используя наконечник плунжера от шприца или пальца в перчатке, втирайте состав по часовой стрелке в течение 30 с. Обратите внимание на время, когда формула применяется для последующего анализа cPK (см. шаги 6.15-6.17 ниже).
ПРИМЕЧАНИЕ: Продолжительность применения зависит от эксперимента; каждый из них может быть разным. - По истечении времени, отведенного для пронизывания состава, удалите излишки состава и поместите кожу со стороны состава лицом к блюду со стеклянным дном.
ПРИМЕЧАНИЕ: Состав удаляется с помощью тонкого стеклоочистителя или небольшого (~1 дюйм) 3D-печатного скребка в одном направлении (например, с севера на юг).
5. Экспериментальная установка для количественной оценки лекарственных средств
- Установите пучок насоса на 803 нм. Проверьте мощность насоса и пучка Стокса с помощью фотодиода, чтобы убедиться, что они являются желаемыми мощностями для эксперимента. Разблокируйте каждый луч отдельно, чтобы измерить мощность и повторно заблокировать лучи.
ПРИМЕЧАНИЕ: В этом конкретном примере мощность пучка насоса составляла 100 мВт, в то время как мощность луча Стокса составляла 180 мВт. - Поместите стеклянную посуду в инкубационную камеру со вставкой для одной посуды со стеклянным дном. Закрепите тарелку зажимами, чтобы предотвратить движение во время съемки.
- Включите лампу передачи в программном обеспечении MC. Глядя через окуляр, отрегулируйте осевой фокус с помощью регуляторной ручки, чтобы убедиться, что ткань находится в фокусе.
- Разблокируйте насос и балки Стокса. Убедитесь, что каналы ALG1 и ALG2 включены, а затем нажмите кнопку Focus x2 на программном обеспечении MC, чтобы визуализировать обложку в каналах CARS и SRS. Убедитесь, что фотодиод SRS находится над конденсатором.
- В раскрывающемся меню Устройство выберите многозонный интервал времени (MATL). Найдите предупреждение XY Stage, чтобы появиться; когда этап перемещается, чтобы найти свое механическое происхождение, нажмите кнопку ОК.
- В модуле MATL перейдите в раздел Вид и щелкните Список зарегистрированных точек в программном обеспечении MC. Начните добавлять либо 1) определенные глубины в коже (т. Е. Роговой слой, SGs, адипоциты, подкожный жир, определенные во время живой визуализации с липидным контрастом), либо 2) позиции XY, если необходимо взять целые стеки глубины. Примеры см. на рисунке 3 .
- Как только роговой слой идентифицирован, прокрутите осевой фокус (или z-фокус), чтобы определить конкретные стратификации тканей, упомянутые выше. См. рисунок 3 для примеров на коже человека и мыши.
- В случае визуализации определенной глубины, а не полных стеков Z-глубины, для каждой стратификации скина щелкните Точка регистрации , чтобы добавить ее в очередь MATL. Для стеков полной глубины щелкните Зарегистрировать точку для каждой позиции XY с выделением глубины в окне параметров сбора .
- После того, как все желаемые позиции XY (полные стеки Z-глубины) или XYZ (конкретные стратификации кожи) будут зарегистрированы в программном обеспечении MATL, измените каталог и имя файла таким образом, чтобы они были согласованы во всех экспериментах для анализа изображений и cPK (см. шаги 6.15- 6.17).
- Установите для параметра модуль MATL число повторов равное 1 и нажмите кнопку Готово. Подождите, пока Play изменится с серой на черную стрелку, указывающую, что программное обеспечение готово. Нажмите кнопку Воспроизведения , чтобы начать визуализацию предварительного стека липидов (далее Липидные изображения).
ПРИМЕЧАНИЕ: Это будет использоваться для разделения богатых липидами и бедных липидами областей отдельных стратификаций тканей во время анализа. Цикл и общее время указаны в правом нижнем углу списка зарегистрированных точек. - После завершения цикла заблокируйте насос и балки Стокса. Измените длину волны на лазерном графическом интерфейсе пользователя на желаемую длину волны на основе целевого волнового числа или комбинационной вибрации.
ПРИМЕЧАНИЕ: Например, 843 нм для пучка насоса используется для нацеливания на 2 250 см-1 с использованием экв. (2), а тонкая настройка двигателя изменяется на 50,1. Пример препарата, представленный здесь, руксолитиниб, содержит нитрил, который может быть нацелен на 2,250 см-1. Волновое число, нацеленное на структуру кожи, всегда будет одинаковым (2 850 см-1); однако волновое число для API может быть любым волновым числом, но должно быть известно или вычислено априори. - Отрегулируйте ручную стадию задержки времени (рисунок 2), чтобы обеспечить перекрытие во времени для новой длины волны и мощности пучка насоса. Убедитесь, что одни и те же способности используются как для липидной, так и для API-визуализации, которые установлены априори.
- Используйте продолжительность цикла для расчета общего количества повторов, необходимых для эксперимента. Просто разделите общее желаемое время эксперимента на продолжительность цикла.
ПРИМЕЧАНИЕ: Длительность цикла является функцией размера изображения, времени ожидания пикселя, усреднения Калмана и количества изображений за цикл. Оптимизация этих параметров позволит сократить время цикла, тем самым увеличивая временное разрешение. - После того, как общее количество повторов цикла было выбрано, разблокируйте пучок насоса, проверьте мощность с помощью фотодиода и убедитесь, что она соответствует мощности желаемой. Наконец, разблокируйте луч Стокса, чтобы обеспечить визуализацию.
- Нажмите кнопку Воспроизведения , чтобы начать автоматическую визуализацию заданных точек.
- После завершения визуализации MATL переключите пучок насоса обратно на 803 нм и отрегулируйте мощность обратно к исходной мощности липидной визуализации, используемой на шаге 5.1.
- Как и на предыдущих шагах, измените имя файла, чтобы оно соответствовало изображениям после эксперимента на протяжении всего исследования.
- Установите для числа повторов значение 1.
- Нажмите Готово | Кнопка воспроизведения , чтобы получить стек липидов после временного хода и убедиться, что во время визуализации не было движения тканей (рисунок 4).

Рисунок 4: Движение тканей в обнаженной коже уха мыши, продемонстрированное визуализацией сальных желез. Пример ограниченного движения тканей изображен в A и B, в то время как существенное движение тканей изображено в C и D. (A) показывает сальные железы в момент применения препарата и (B) ту же глубину через 120 мин после применения. (C) мышиные сальные железы в момент применения препарата и (D) через 120 мин после применения препарата; сальные железы едва заметны, что свидетельствует о том, что этот эксперимент не измерял поглощение сальных желез в течение всей экспериментальной продолжительности. Шкала стержней = 100 мкм. Размеры изображений 1024 x 1024. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Анализ данных
- Получение изображений как . OIB (или . OIR в зависимости от микроскопа и программного обеспечения MC) типы файлов с каждой позицией XYZ, имеющей отдельную подпапку.
- Компилируйте липидные изображения с изображениями каналов API, переименовывая липидные изображения со следующим окончанием _lipid.oib.
- Выполните следующие шаги с каждой стратификацией кожи (показано здесь с использованием стратификации SG только для простоты; см. Рисунок 3B).
- Импортируйте липидное изображение SG в ImageJ (или Fiji)34 и установите флажок Разделенные каналы, чтобы разделить файл на каналы CARS и SRS.
ПРИМЕЧАНИЕ: Фиджи разделит файл на количество изображений, полученных в ходе эксперимента, по количеству каналов. - Откройте менеджер интересующей области (ROI ), щелкнув Анализировать | Инструменты | Менеджер по окупаемости инвестиций.
- Используя канал SRS (например, C = 1), разграничить SG на изображении.
ПРИМЕЧАНИЕ: SG - это яркие места из-за целевой вибрации -CH2-. - Добавьте это в менеджер ROI, щелкнув Добавить [t] в менеджере ROI или нажав t на клавиатуре. Повторите этот процесс для каждого SG в изображении.
- Чтобы замаскировать богатые липидами регионы, выберите каждую рентабельность инвестиций и перейдите на вкладку Дополнительно | OR (Комбайн) | Добавить в менеджер ROI.
- Чтобы замаскировать области с низким содержанием липидов, используйте инструмент «Прямоугольник » в меню FIJI и нарисуйте квадрат вокруг всего изображения. Добавьте это в менеджер ROI.
- Нажмите на недавно добавленную квадратную рентабельность инвестиций в дополнение к ROI, которая выбирает все богатые липидами регионы в менеджере ROI. В разделе Дополнительно выберите XOR , чтобы создать маску областей с низким содержанием липидов и добавить ее в менеджер ROI.
- Импортируйте липидное изображение SG в ImageJ (или Fiji)34 и установите флажок Разделенные каналы, чтобы разделить файл на каналы CARS и SRS.
- Загрузите образы API на Фиджи.
- Объедините изображения в числовом порядке (например, Image0001, Image0002, Image0003 и т. д.), используя следующую последовательность меню: Image | Стеки | Инструменты | Сцепление.
- Кроме того, можно импортировать эти изображения, загрузив одно из изображений на Фиджи, а затем выбрав параметр Групповые файлы с похожими именами на странице установки .
ПРИМЕЧАНИЕ: Это дает возможность импортировать все изображения с похожим именем файла и объединять их автоматически.
- Кроме того, можно импортировать эти изображения, загрузив одно из изображений на Фиджи, а затем выбрав параметр Групповые файлы с похожими именами на странице установки .
- Активизируя сцепленное изображение, перейдите к менеджеру ROI, выберите богатые липидами области (например, SG), нажмите кнопку Дополнительно и выберите Многомерность. Дождитесь появления окна Результаты .
- В настройках измерения по умолчанию найдите Параметры «Площадь», «Среднее», «Минимальное», «Максимальное» и «Медиана». Если для анализа требуются другие метрики, включите эти параметры, установив соответствующий флажок в окне Задание измерений (Анализ | Установить измерения...).
- Экспортируйте данные из окна Результаты в электронную таблицу и добавьте столбец с названием Регион.
- Добавьте богатые липидами данные к каждой строке данных для областей, богатых липидами. Добавьте бедные липидами области, которые были вне липидов.
- Добавьте слой с заголовком столбца и добавьте соответствующий анализируемый слой (дополнительная таблица S1).
- Повторите шаги 6.5 - 6.7 для регионов с низким содержанием липидов, пока выбрана соответствующая рентабельность инвестиций.
- Чтобы визуализировать данные, сохраните электронную таблицу и импортируйте ее в JupyterLab (пакет matplotlib)35 или в R (пакет ggplot2)36. Построение данных в зависимости от числа изображения по отношению к средней интенсивности для оценки данных о времени концентрации. (Рисунок 5).
- Импортируйте электронную таблицу в RStudio для выполнения вневедомственного анализа (NCA) для фармакокинетического анализа данных CRI.
- Добавьте столбец с названием время.
- Для Image0001 рассчитайте длительность между применением формулировки и первым изображением.
ПРИМЕЧАНИЕ: Это первая временная точка. Продолжительность цикла используется для расчета оставшихся изображений (и, следовательно, временных точек), которые увеличиваются с течением времени. Например, если время с момента применения составляет 30 минут, Image0001 будет иметь точку времени 30 минут, а с продолжительностью цикла 8 минут, Image0002 будет иметь точку времени 38 минут, Image0003 будет иметь точку времени 46 минут и так далее. - Запустите NCA в RStudio (с помощью пакета NonCompart)37 для данных о времени интенсивности, импортированных из электронной таблицы, со следующим вызовом для одного слоя/региона:
sNCA(x = время, y = среднее, доза = 1, timeUnit = "s", doseUnit = "mg")
Там, где x относится к временным точкам, y относится к интенсивности, и дозу можно оставить как единицу, рассчитанную как доза мМ лекарственного средства в рецептуре или доза продукта.
ПРИМЕЧАНИЕ: Выходные данные NCA будут предоставлять такие параметры, как Cmax и AUCall. Однако, поскольку это ex vivo skin, эти параметры являются, по сути, Jmax и AUCflux-all. - Визуально сравните показатели Jmax и AUCflux-all , построив их на график (рисунок 6) в дополнение к статистическим сравнениям в экспериментальных условиях. См. рисунок 6 для примера анализа исследований ex vivo CRI.
ПРИМЕЧАНИЕ: Соответствующий статистический тест (тесты) зависит от каждого конкретного набора данных. Также важно отметить, что все фармакокинетические параметры логарифмически распределены, и любые сравнения должны использовать логарифмически преобразованные (натуральный log или log10) данные.
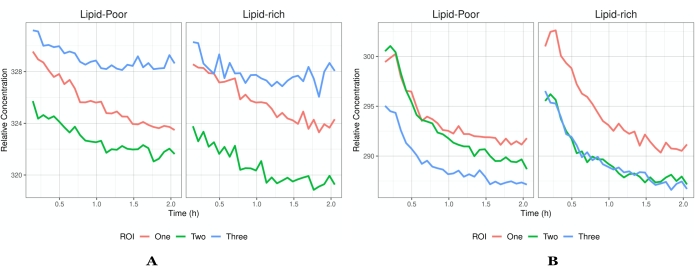
Рисунок 5: Профили интенсивности и времени. (A) Пример профилей потоков, которые достигли насыщения и, таким образом, только снижение интенсивности. Каждый ROI имеет свой профиль потока, чтобы продемонстрировать неоднородность данных, которые можно получить. (B) Пример концентраций, которые увеличиваются после начала визуализации. Каждый ROI представляет собой различное поле зрения (обозначенное различными цветовыми следами) в одной и той же ткани одного и того же эксперимента. В дополнение к глобальным концентрациям существует возможность прояснить, какую местную среду предпочитает АФИ/состав, о чем свидетельствуют богатые липидами и бедные липидами регионы. Профили, представленные в A , указывают на то, что нет абсорбции препарата в ткани, поскольку API уже проник и начал покидать ткань после начала визуализации. Однако при В ткань не достигла насыщения, и все еще происходит всасывание АФИ с последующей элиминацией. Сегментация изображений на богатые липидами и бедные липидами поможет в выяснении локализации API (или неактивных) и путей проникновения в кожу (т.е. рогового слоя). Более высокая концентрация в богатых липидами областях указывает на то, что API локализуется в липидной структуре исследуемого слоя, что помогает в целевой информации о доставке лекарств. Сокращения: ROI = интересующий регион; API = активный фармацевтический ингредиент. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Визуализация считается успешной, если ткань не двигалась значительно в осевом (<10 мкм) или боковом направлении по завершении эксперимента (рисунок 4). Это является непосредственным показателем, если измерение SRS для интересующего API не является репрезентативным для нача?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Оценка актуального BA/BE является областью исследований, требующей многогранного подхода, поскольку ни один метод не может полностью охарактеризовать in vivo cPK. В этом протоколе представлена методология оценки BA/BE местного лекарственного препарата на основе когерентной рамановской ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
CLE является изобретателем патентов на микроскопию CARS, которые были лицензированы несколькими производителями микроскопов. Все остальные авторы не имеют конфликта интересов для раскрытия.
Благодарности
Авторы хотели бы поблагодарить д-ра Фотиса Илиопулоса и Дэниела Гринфилда из Группы Эванса за обсуждение и корректуру этой рукописи. Кроме того, авторы хотели бы отметить поддержку со стороны LEO Pharma. Рисунок 2 был создан с помощью BioRender.com.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Tissue Preparation | |||
| Autoclavable Biohazard Bags | FisherBrand | 22-044562 | As refered to in text: biohazard bags https://www.fishersci.com/shop/products/fisherbrand-polyethylene-biohazard-autoclave-bags-without-sterilization-indicator-8/22044562?searchHijack=true&searchTerm= 22044562&searchType=RAPID& matchedCatNo=22044562 |
| Cell Culture Buffers: Dulbecco's Phosphate-Buffered Salt Solution 1x | Corning | MT21030CV | As refered to in text: PBS https://www.fishersci.com/shop/products/corning-cellgro-cell-culture-buffers-dulbecco-s-phosphate-buffered-salt-solution-1x-8/MT21030CV?searchHijack=true&searchTerm= 21-030-cv&searchType= RAPID&matchedCatNo=21-030-cv |
| Disposable Scalpels | Exel International | 14-840-00 | As refered to in text: scalpel https://www.fishersci.com/shop/products/exel-international-disposable-scalpels-3/1484000?keyword=true |
| High Precision 45° Angle Broad Point Tweezers/Forceps | Fisherbrand | 12-000-132 | As refered to in text: forceps https://www.fishersci.com/shop/products/high-precision-45-angle-broad-point-tweezers-forceps/12000132#?keyword= |
| Kimwipes Delicate Task Wipers, 1-Ply | Kimberly-Clark Professional Kimtech Science | 06-666 | As refered to in text: task wiper https://www.fishersci.com/shop/products/kimberly-clark-kimtech-science-kimwipes-delicate-task-wipers-7/06666 |
| Parafilm M Laboratory Wrapping Film | Bemis | 13-374-12 | As refered to in text: parafilm https://www.fishersci.com/shop/products/curwood-parafilm-m-laboratory-wrapping-film-4/1337412 |
| Petri Dish (35 mm x 10 mm) | Fisherbrand | FB0875711YZ | As refered to in text: small petri dish https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-specialty-6/FB0875711YZ?keyword=true |
| Petri Dish (60 mm x 15 mm) | Fisherbrand | FB0875713A | As refered to in text: large petri dish https://www.fishersci.com/shop/products/fisherbrand-petri-dishes-clear-lid-12/FB0875713A?keyword=true |
| Surgical Scissors | Roboz | NC9411473 | As refered to in text: scissors https://www.fishersci.com/shop/products/scissors-327/NC9411473?searchHijack=true&searchTerm= RS-5915SC&searchType=RAPID& matchedCatNo=RS-5915SC |
| Laser/microscope | |||
| 650/60 nm BrightLine single-band bandpass filter | Semrock | As refered to in text: CARS filter - CH2 vibrations (645nm/60nm filter) | |
| Control box IX2-UCB | Olympus | As refered to in text: Control Box | |
| D700/30m | Chroma | As refered to in text: CARS filter - deuterated band https://www.chroma.com/products/parts/d700-30m | |
| DeepSee Insight | Spectra-Physics | As refered to in text: Laser https://www.spectra-physics.com/f/insight-x3-tunable-laser | |
| Digital Handheld Optical Power and Energy Meter Console | ThorLabs | PM100D | As refered to in text: power meter https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=3341 |
| Fluoview Software | Olympus | As refered to in text: Microscope Control software | |
| Frosted Microscope Slides | FisherBrand | As refered to in text: microscope slides https://www.fishersci.com/shop/products/fisherbrand-frosted-microscope-slides-4/22265446 | |
| FV1000 | Olympus | As refered to in text: Microscope | |
| Incubation Chamber | Tokai Hit | GM-800 | As refered to in text: incubation chamber |
| Integrating Sphere Photodiode Power Sensor | ThorLabs | S142C | As refered to in text: photodiode https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=3341 |
| Power supply FV31-PSU | Olympus | As refered to in text: Power Supply | |
| Precision 4063, 80MHz Dual Channel Function Generator | BK Precision | As refered to in text: function generator | |
| ProScan – Precision Microscope Automation | Prior Scientific Instruments | As refered to in text: stage controller https://www.prior.com/microscope-automation/inverted-microscope-systems/proscan-linear-stage-highest-precision-microscope-automation | |
| SecureSeal Imaging Spacers | Grace Biolabs | 654004 | As refered to in text: spacer https://gracebio.com/product/secureseal-imaging-spacers-654004/ |
| SRS Detection Kit | APE | As refered to in text: SRS detector | |
| UPLSAPO 20X NA:0.75 | Olympus | As refered to in text: 20X Objective https://www.olympus-lifescience.com/en/objectives/uplsapo/ | |
| Lipid/Drug Imaging | |||
| 35 mm Dish, No. 0 Uncoated Coverslip, 14 mm Glass Diameter | MatTek Corporation | NC9711297 | As refered to in text: Glass bottom dish https://www.fishersci.com/shop/products/glass-bottom-mircrowell-dish/nc9711297 |
| Cotton-tipped applicators | FisherBrand | As refered to in text: Cotton-tipped applicator | |
| Distriman Postive Displacement Pipette | Gilson | As refered to in text: Postive Displacement Pipette https://www.fishersci.com/shop/products/gilson-distriman-positive-displacement-repetitive-pipette/F164001G#?keyword= | |
| Distriman Postive Displacement Pipette Tips | Gilson | As refered to in text: Tips for pipette https://www.fishersci.com/shop/products/gilson-distritip-syringes-6/f164100g?keyword=true | |
| Data Analysis | |||
| FIJI | Open-source | As refered to in text: FIJI/ImageJ https://imagej.net/software/fiji/ | |
| Jupyter-Lab | open-source | As refered to in text: JupyterLab https://jupyter.org/ | |
| Rstudio | Open-source | As refered to in text: Rstudio https://www.rstudio.com/ |
Ссылки
- Finnin, B., Walters, K. A., Franz, T. J. In vitro skin permeation methodology. In Transdermal and topical drug delivery: principles and methodology. Transdermal and topical drug delivery: principles and practice. Benson, H. E., Watkinson, A. C. , John Wiley & Sons. Hoboken NJ USA. 85-108 (2012).
- Shin, S. H., et al. On the road to development of an in vitro permeation test (IVPT) model to compare heat effects on transdermal delivery systems: exploratory studies with nicotine and fentanyl. Pharmaceutical Research. 34 (9), 1817-1830 (2017).
- Hossain, A., et al. Preparation, characterisation, and topical delivery of terbinafine. Pharmaceutics. 11 (10), 548(2019).
- Santos, L. L., Swofford, N. J., Santiago, B. G. In vitro permeation test (IVPT) for pharmacokinetic assessment of topical dermatological formulations. Current Protocols in Pharmacology. 91 (1), 79(2020).
- Iliopoulos, F., Caspers, P. J., Puppels, G. J., Lane, M. E. Franz cell diffusion testing andquantitative confocal Raman spectroscopy: In vitro-in vivo correlation. Pharmaceutics. 12 (9), 887(2020).
- Cordery, S., et al. Topical bioavailability of diclofenac from locally-acting, dermatological formulations. International Journal of Pharmaceutics. 529 (1-2), 55-64 (2017).
- Pensado, A., et al. Stratum corneum sampling to assess bioequivalence between topicalacyclovir products. Pharmaceutical Research. 36 (12), 1-16 (2019).
- Zhang, Y., et al. Dermal delivery of niacinamide-in vivo studies. Pharmaceutics. 13 (5), 726(2021).
- Bodenlenz, M., et al. Open flow microperfusion as a dermal pharmacokinetic approach to evaluate topical bioequivalence. Clinical Pharmacokinetics. 56 (1), 91-98 (2017).
- Eirefelt, S., et al. Evaluating dermal pharmacokinetics and pharmacodymanic effect of soft topical PDE4 inhibitors:Open flow microperfusion and skin biopsies. Pharmaceutical Research. 37 (12), 1-12 (2020).
- Stagni, G., O'Donnell, D., Liu, Y. J., Kellogg, J. D. L., Shepherd, A. M. Iontophoretic current and intradermal microdialysis recovery in humans. Journal of Pharmacological and Toxicological Methods. 41 (1), 49-54 (1999).
- Garcia Ortiz, P., Hansen, S. H., Shah, V. P., Menne, T., Benfeldt, E. Impact of adultatopic dermatitis on topical drug penetration: assessment by cutaneous microdialysis and tape stripping. Acta Dermato-Venereologica. 89 (1), 33-38 (2009).
- Joshi, A., Patel, H., Joshi, A., Stagni, G. Pharmacokinetic applications of cutaneous microdialysis: Continuous+intermittent vs continuous-only sampling. Journal of Pharmacological and Toxicological Methods. 83, 16-20 (2017).
- Kuzma, B. A., et al. Evaluation of local bioavailability of metronidazole from topical formulations using dermal microdialysis: Preliminary study in a Yucatan mini-pig model. European Journal of Pharmaceutical Sciences. 159, 105741(2021).
- Begley, R., Harvey, A., Byer, R. L.Coherent anti-Stokes Raman spectroscopy. Applied Physics Letters. 25 (7), 387-390 (1974).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807-16812 (2005).
- Hill, A. H., Manifold, B., Fu, D. Tissue imaging depth limit of stimulated Raman scattering microscopy. Biomedical Optics Express. 11 (2), 762-774 (2020).
- Feizpour, A., Marstrand, T., Bastholm, L., Eirefelt, S., Evans, C. L. Label-free quantification of pharmacokinetics in skin with stimulated Raman scattering microscopy and deep learning. Journal of Investigative Dermatology. 141 (2), 395-403 (2021).
- Ghosh, B., Reddy, L. H., Kulkarni, R. V., Khanam, J. Comparison of skin permeability of drugs in mice and human cadaver skin. Indian Journal of Experimental Biology. 38 (1), 42-45 (2000).
- Nielsen, J. B., Plasencia, I., Sørensen, J. A., Bagatolli, L. Storage conditions of skin affect tissue structure and subsequent in vitro percutaneous penetration. Skin Pharmacology and Physiology. 24 (2), 93-102 (2011).
- Barbero, A. M., Frasch, H. F. Effect of frozen human epidermis storage duration and cryoprotectant on barrier function using two model compounds. Skin Pharmacology and Physiology. 29 (1), 31-40 (2016).
- Babu, R., et al. The influence of various methods of cold storage of skin on the permeation of melatonin and nimesulide. Journal of Controlled Release. 86 (1), 49-57 (2003).
- Skelly, J. P., et al. FDA and AAPS report of the workshop on principles and practices of in vitro percutaneous penetration studies: relevance to bioavailability and bioequivalence. Pharmaceutical Research. 4 (3), 265-267 (1987).
- OECD. Guidance document for the conduct of skin absorption studies. OECD. , (2004).
- OECD. Test no. 428: Skin absorption: In vitro method. OECD. , (2004).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 330 (6009), 1368-1370 (2010).
- Saar, B. G., Contreras-Rojas, L. R., Xie, X. S., Guy, R. H. Imaging drug delivery to skin with stimulated Raman scattering microscopy. Molecular Pharmaceutics. 8 (3), 969-975 (2011).
- Pence, I. J., Kuzma, B. A., Brinkmann, M., Hellwig, T., Evans, C. L. Multi-windowsparse spectral sampling stimulated Raman scattering microscopy. Biomedical Optics Express. 12 (10), 6095-6114 (2021).
- Herkenne, C., et al. In vivo methods for the assessment of topical drug bioavailability. Pharmaceutical Research. 25 (1), 87-103 (2008).
- Alfonso-Garcıa, A., Mittal, R., Lee, E. S., Potma, E. O. Biological imaging with coherent Raman scattering microscopy: a tutorial. Journal of Biomedical Optics. 19 (7), 071407(2014).
- Osseiran, S., et al. Longitudinal monitoring of cancer cell subpopulations in monolayers, 3D spheroids, and xenografts using the photoconvertible dye DiR. Scientific Reports. 9 (1), 1-10 (2019).
- Evennett, P. Kohler illumination: a simple interpretation. Proceedings of the Royal Microscopical Society. 28 (4), 189-192 (1983).
- Sanderson, J. Fundamentals of microscopy. Current Protocols in Mouse Biology. 10 (2), 76(2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hunter, J. D. Matplotlib: A 2D graphics environment. Computing in Science & Engineering. 9 (3), 90-95 (2007).
- Wickham, H. ggplot2: Elegant Graphics for Data Analysis. , Springer-Verlag. New York. (2016).
- Kim, H., Han, S., Cho, Y. S., Yoon, S. K., Bae, K. Development of R packages:'Non-Compart' and 'ncar' for noncompartmental analysis (NCA). Translational and Clinical Pharmacology. 26 (1), 10-15 (2018).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены