Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Устройства на стеклянной основе для генерации капель и эмульсий
В этой статье
Резюме
Здесь представлен протокол изготовления микрофлюидных устройств на основе стекла, используемых для генерации высокомонодисперсных эмульсий с контролируемым размером капли.
Аннотация
В этой рукописи описаны три различных пошаговых протокола для получения высокомонодисперсных эмульсионных капель с использованием микрофлюидики на основе стекла. Первое устройство построено для генерации простых капель, приводимых в движение силой тяжести. Второе устройство предназначено для генерации эмульсионных капель в котопливной схеме. Третье устройство представляет собой расширение соточного устройства с добавлением третьей жидкости, которая действует как электрическое заземление, позволяя образовывать электрифицированные капли, которые впоследствии разряжаются. В этой установке две из трех жидкостей имеют заметную электропроводность. Третья жидкость опосредует между этими двумя и является диэлектриком. Разность напряжений, приложенная между двумя проводящими жидкостями, создает электрическое поле, которое соединяется с гидродинамическими напряжениями котопливных жидкостей, влияя на процесс струйного и капельного образования. Добавление электрического поля обеспечивает путь для генерации меньших капель, чем в простых котопливных устройствах, и для генерации частиц и волокон с широким диапазоном размеров.
Введение
Контролируемая генерация капель в микронном и наноразмерном масштабе с узким распределением размеров является сложной задачей. Эти капли представляют интерес для разработки мягких материалов со многими применениями в науке и технике 1,2,3,4,5,6.
Наиболее распространенными устройствами для высокой скорости образования капель являются смесители7 и ультразвуковые эмульгаторы8. Эти методы просты и недороги, но они обычно приводят к полидисперсным каплям с широким диапазоном размеров. Следовательно, для производства монодисперсных образцов требуются дополнительные этапы. Микрофлюидные устройства могут быть спроектированы по-разному, чтобы обеспечить эффективный способ падения образования. Кроме того, обычно низкие скорости потока (т. Е. Низкое число Рейнольдса) обеспечивают большой контроль над потоком жидкости.
В то время как микрофлюидные устройства обычно изготавливаются с использованием литографических методов с поли(диметил)силоксаном (PDMS), эта рукопись фокусируется на капиллярных устройствах на основе стекла. Устройства PDMS обычно выбираются из-за их способности проектировать сложные шаблоны каналов и из-за их масштабируемости. Стеклянные устройства, напротив, являются жесткими и имеют большую стойкость к растворителям, чем их аналоги PDMS. Дополнительно стекло можно модифицировать для изменения его смачиваемости, что позволяет контролировать генерацию сложных эмульсий. Возможность самостоятельной обработки сопла и стенок канала позволяет формировать капли контролируемым и воспроизводимым образом, обеспечивая при этом стабильность полученных эмульсий, если капли соприкасаются со стенками9; в противном случае капли могут слиться и скапливаться у стенки. Еще одно различие между этими двумя типами устройств заключается в том, что в устройствах на стеклянной основе поток трехмерный, в то время как в обычных устройствах PDMS он плоский. Этот факт минимизирует контакт капли со стенками канала, так что влиянием контактных линий можно пренебречь10, тем самым защищая стабильность множественных капель эмульсии.
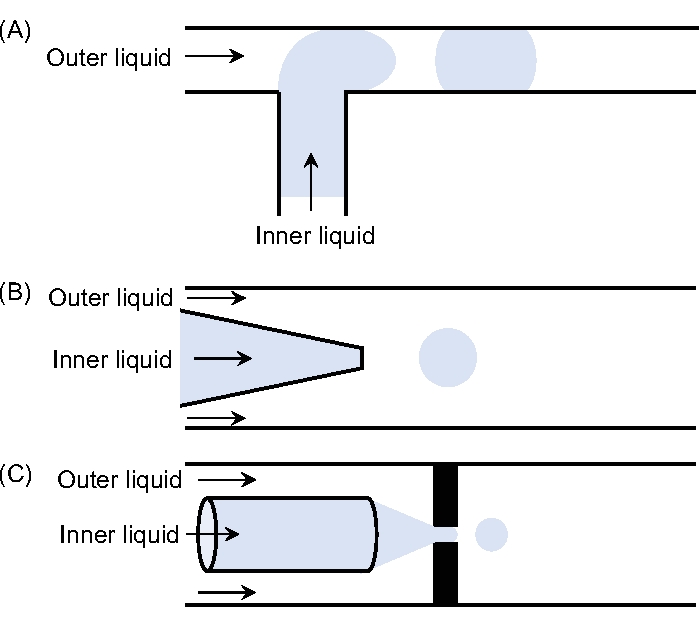
Рисунок 1: Различные конфигурации микрофлюидных устройств. Эскизы (A) Т-перехода, (B) котопливного устройства и (C) устройства фокусировки потока. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Используются три основные геометрии, а именно Т-образный переход11, фокусировка потока12,13 и копоток14. В геометрии Т-перехода дисперсная фаза, содержащаяся в канале, перпендикулярно пересекает основной канал, в котором находится непрерывная фаза. Напряжение сдвига, оказываемое непрерывной фазой, разрушает поступающую дисперсную жидкость, что приводит к падениям. Генерируемые капли ограничены в меньших размерах размерами основного канала11. В геометрии фокусировки потока две жидкости проталкиваются через небольшое отверстие, расположенное перед инъекционной трубкой. В результате образуется струя, которая значительно меньше, чем инъекционная трубка12,13. Наконец, геометрия копота имеет конфигурацию, характеризующуюся коаксиальным потоком двух несмешивающихся жидкостей14. В целом, капание и струйная обработка могут наблюдаться в зависимости от условий эксплуатации. Капающий режим происходит при низких скоростях потока, а образующиеся капли очень монодисперсны и имеют диаметр, пропорциональный размеру наконечника. Недостатком является его низкая частота производства. Режим струйной обработки происходит при более высоких скоростях потока по сравнению с режимом капания. В этом случае диаметр капли прямо пропорционален диаметру струи, который при правильных условиях может быть намного меньше диаметра наконечника.
Альтернатива этим гидродинамическим подходам опирается на дополнительное использование электрических сил. Электрораспыление является хорошо известным и широко используемым методом генерации капель. Он основан на принципе, что жидкость с конечной электропроводностью будет деформироваться в присутствии сильного электрического поля. Жидкость в конечном итоге примет коническую форму, полученную в результате баланса между электрическими и поверхностными напряжениями15. Процесс начинается с электрического поля, индуцирующего электрический ток в жидкости, который заставляет заряды накапливаться на поверхности. Наличие электрического поля приводит к электрической силе на этих зарядах, которая увлекает жидкость за собой, удлиняя мениск в направлении поля. В разных условиях мениск может либо сбрасывать заряженные капли, либо испускать одну или несколько струй, которые затем распадаются на капли15. Хотя эти микрофлюидные методы с электрической поддержкой, естественно, позволяют генерировать небольшие капли, они страдают от отсутствия стационарной работы, которая ставит под угрозу монодисперсность эмульсии. Результирующие заряженные капли имеют тенденцию разряжаться на ограничивающих стенках и/или в любом месте устройства, где электрический потенциал ниже наложенного внешнего напряжения. Таким образом, электрифицированный мениск становится нестабильным, в конечном итоге выделяя капли хаотичным образом и вызывая их неконтролируемое производство и потерю монодисперсности.
В электрокопоте электрические и гидродинамические напряжения соединены в котопном микрофлюидном устройстве16 , аналогичном тому, которое используется для генерации двойных эмульсий12. Две основные особенности позволяют электрокопулу успешно достигать стационарного режима излучения: (i) дисперсная фаза выбрасывается в другую кофоклетующую вязкую жидкость и (ii) использование жидкого контрэлектрода или земли. Доказано, что наличие протекающей наружной жидкости изменяет геометрические свойства процессавыброса капель 17. Жидкостный контрэлектрод позволяет разряжать и извлекать полученные капли, обеспечивая стационарную генерацию капель. Кроме того, используя баланс электрических и гидродинамических сил, результирующие размеры падения могут потенциально варьироваться в более широком диапазоне, чем размеры, которые могут быть покрыты любым из ранее упомянутых методов.
Этот подробный видеопротокол предназначен для того, чтобы помочь новым практикам в использовании и изготовлении микрофлюидики на основе стекла.
протокол
1. Создание простых капель
- Для изготовления простых капель используйте стеклянную основу, изготовленную с помощью слайда микроскопа (76,2 мм х 25,4 мм), чтобы построить устройство. Это позволяет легко транспортировать и визуализировать жидкости через стекло.
- Используйте круглый стеклянный капилляр для наконечника. Для этого протокола используйте круглые капилляры диаметром 1 мм (легко доступные в широком диапазоне размеров).
- Чтобы сделать наконечник с нужным диаметром, потяните капилляр с помощью машины для вытягивания микропипетки до тех пор, пока не будут получены два полукапилляра с очень маленьким наконечником (~ 1 мкм).
- С помощью микрокрапии вырежьте наконечник до нужного диаметра (2-80 мкм). Для больших диаметров (> 80 мкм) используйте керамическую плитку, если микрокрапса не режет эти размеры.
ПРИМЕЧАНИЕ: В зависимости от желаемой жидкости, стекло нужно будет обработать, чтобы жидкость не залезла по внешней стороне наконечника.
- Для жидкостей на водной основе сделайте внешний вид наконечника гидрофобным. Для жидкостей на масляной основе, когда внешняя часть наконечника находится в контакте с водой, сделайте внешний вид наконечника гидрофильным. См. шаг 2.3 для обработки стекла.
- Используйте шприцевую иглу (20 г) для облегчения введения жидкости в капилляр. Вырежьте отверстие – размером с наружный диаметр капилляра – у основания иглы с помощью лезвия бритвы или скальпеля.
- Промойте иглу водой, чтобы удалить пыль и волокна от резки. Высушите их на воздухе.
- Для сборки приклейте круглый капилляр к слайду микроскопа с помощью быстросохнущей эпоксидной смолы. Поместите кончик капилляра на 1-2 см за пределы торца микроскопа. Используйте только мазок эпоксидной смолы в центре капилляра. Таким образом, он не будет мешать полю зрения или шприцевой игле.
- Приклейте шприцевую иглу таким образом, чтобы конец капилляра располагался в центре иглы. Во-первых, поместите небольшое количество почти затвердевшей эпоксидной смолы вокруг обода в нижней части иглы. Поместите иглу так, чтобы конец капилляра находился в центре его основания.
- Через несколько минут нанесите второй слой свежей эпоксидной смолы, покрыв основание иглы, избегая отверстия. Наконец, закройте отверстие почти затвердевшей эпоксидной смолой, чтобы предотвратить попадание эпоксидной смолы внутрь игл. Следуйте рекомендациям производителя эпоксидной смолы по времени затвердевания и отверждения.
- Прикрепите к игле кусок трубки (I.D. x O.D. 0,86 мм x 1,32 мм). Очистите трубку, прежде чем прикрепить ее. Промывайте деионизированную воду вручную с помощью шприца, чтобы удалить любые остатки, образующиеся при разрезании трубки.
ПРИМЕЧАНИЕ: Материал трубки должен быть совместим с жидкостью, используемой в экспериментах. Трубка должна быть достаточно длинной, чтобы иметь возможность соединить устройство и насосную систему. - Для тестирования устройства прокачайте деионизированную воду через иглу и посмотрите, нет ли утечек. Используйте шприц и соответствующую ему иглу для ручной перекачки воды. В случае обнаружения утечки тщательно высушите устройство. Нанесите эпоксидную смолу и подождите не менее 1 ч, прежде чем снова тестировать.
- Для генерации капель, используя зажим, поместите устройство в вертикальное положение, чтобы наконечник был обращен вниз, как в кухонном кране. Используйте шприцевой насос или напорную установку для перекачки жидкости в устройство.
- Соберите капли, поместив наконечник внутрь стакана или флакона с жидкостью с соответствующим количеством поверхностно-активного вещества. Например, для силиконового масла 10cSt в качестве внутренней жидкости используйте непрерывную фазу 16 мМ додецилсульфата натрия (SDS) в воде.
- Для капель масла в воде, чтобы повысить стабильность капель, добавьте слой вязкого масла поверх коллекционной ванны перед приготовлением эмульсии. Для капель воды в масле используйте неионное поверхностно-активное вещество в масле для стабилизации капель.

Рисунок 2: Резная игла. Игла с отверстием, вырезанным в ее основании, чтобы соответствовать круглому капилляру. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Устройство для генерации простых капель. Схема устройства для генерации простых капель. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Сбор простых капель. (A) Набросок того, как собирать капли в стакане. (B) Вид сверху стакана, где 10cSt силиконовые масляные капли были собраны в 16 мМ SDS в водном растворе, полученном с наконечником 580 мкм. Размер капли составляет (3,29 ± 0,08) мм. (C) Вид сверху стакана, где капли силиконового масла 10cSt были собраны в 16 мМ SDS в водном растворе, полученном с наконечником 86 мкм. Размер капли (1,75 ± 0,04) мм Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Изготовление эмульсионных капель по схеме сотокоса
ПРИМЕЧАНИЕ: Устройство построено аналогично устройству, описанному в шаге 1.
- Постройте устройство на стеклянной основе, выполненной с помощью слайда микроскопа (76,2 мм х 25,4 мм). Это позволяет легко транспортировать и визуализировать жидкости через стекло.
- Используют капилляр с квадратным сечением (квадратный капилляр) для наружной жидкости (непрерывная фаза эмульсии) длиной около 5 см. Для этого протокола используйте круглые капилляры диаметром 1 мм (легко доступные в широком диапазоне размеров).
- Для обработки стекла, в зависимости от выбранной внутренней жидкости (дисперсной фазы), делают внутреннюю сторону квадратного капилляра гидрофобной или гидрофильной. Лечение поможет избежать попадания капель в стакан и вмешательства в образование новых капель.
- Для приготовления стекла гидрофобным очистите капилляры, поместив их во флакон с ацетоном в ультразвуковой ванне на 10-15 мин. Промойте их ацетоном или этанолом (никогда не водой). Высушите их.
- Приготовьте чистый и сухой (сухой кость) флакон, содержащий 10 мл толуола (или гексана) + 20 мкл раствора триметокси(октил)силана. Держите капилляры в растворе в течение 2 ч. Промыть капилляры тем же растворителем, который используется для раствора.
- Снова смойте ацетоном. Высушите воздухом. Выпекайте их в духовке в течение 30 мин при температуре около 70 °C.
ПРИМЕЧАНИЕ: Этот процесс трудно реализовать для устройств наконечников, не нарушая их. - Для обработки наконечников приборов окуните их в раствор толуола и раствор триметокси(октил)силана на несколько секунд. Удалите лишний раствор. Дайте высохнуть на воздухе.
- Для придания стеклу гидрофильного повторяют те же этапы (2.3.1-2.3.4), что и в гидрофобном случае, но с раствором 10 мл ацетона + 20 мкл 2-[метокси(полиэтиленокси)6-9пропил]триметоксисилана.
- Используйте круглый стеклянный капилляр для наконечника. Сопоставьте наружный диаметр капилляра с внутренним размером квадратного капилляра. Это гарантирует, что оба капилляра коаксиально выровнены. Убедитесь, что длина круглого капилляра на несколько сантиметров длиннее квадратного капилляра.
- В зависимости от дисперсной жидкости обрабатывайте стекло, чтобы жидкость не залезла по внешней стороне наконечника.
- Соберите, приклеив квадратный капилляр к слайду микроскопа с помощью быстросохнущей эпоксидной смолы. Поместите кончик капилляра на 1-2 см за пределы торца микроскопа (см. Рисунок 6А).
- Используйте мазок эпоксидной смолы в центре капилляра, чтобы он не мешал в поле зрения или в шприцевую иглу. Подождите, пока он полностью вылечится. Отметим, что даже для быстрого высыхания эпоксидной смолы производитель рекомендует 24 ч для полного отверждения материала.
- Введите круглый капилляр в квадратный так, чтобы конец оставался на несколько сантиметров за пределами конца квадратного капилляра.
- Поместите другой конец (снаружи слайда микроскопа) внутрь квадратного капилляра на расстоянии, которое приблизительно совпадает с концом квадратного капилляра (см. Рисунок 6B).
- Приклейте капилляр с помощью эпоксидной смолы на среднем расстоянии между концом капилляра и началом квадратного. Подождите, пока он полностью вылечится.
- Внесите следующие изменения в две иглы, необходимые для введения жидкости.
- Чтобы разместить капилляр в основании иглы, вырежьте отверстие в основании круглого колпачка, которое имеет размер наружного диаметра капилляра (см. Рисунок 2). Чтобы подогнать другую иглу на конце квадратного капилляра, вырежьте круглые и квадратные отверстия у основания иглы, чтобы разместить сустав.
- Убедитесь, что оба отверстия выровнены таким образом, чтобы круглые и квадратные капилляры могли быть установлены внутри иглы. Промойте иглы водой, чтобы удалить пыль и волокна от резки. Высушите их на воздухе. Приклейте иглы и следуйте протоколу, уже описанному в 1.5.2 (см. Рисунок 6С).
- Подключите трубку (контрольный диаметр и совместимый материал) к каждой из игл. Промойте трубки после их разрезания, чтобы удалить мусор и волокна. Вручную используйте шприц и иглу для перекачки воды. Проверьте устройство на наличие утечек, как описано ниже.
- Закройте одну из игл, согнув кусок трубки и используя связующий зажим, чтобы эффективно закрыть его от потока жидкости. Прокачайте деионизированную воду через другую иглу. Если никаких утечек не наблюдается, прокачивайте другую иглу.
- Если обнаружена утечка, тщательно высушите устройство, нанесите эпоксидную смолу и подождите не менее 1 часа, прежде чем снова тестировать.
- Для генерации капель, как описано на этапе 1.8, используют один из двух способов привода жидкостей: фиксацию их расхода с помощью шприцевых насосов или фиксацию их давления с помощью канистр под давлением.

Рисунок 5: Эффекты гидрофобной обработки. (А) и (С) Капилляр без какой-либо жидкости внутри. Красная линия указывает на конец капилляра. (B) Необработанный капилляр. Жидкость смачивает капилляр, когда он поднялся выше красной линии. (D) Обработан капилляр водой. Вода в этом случае не мочит капилляр. Жидкость остается ниже красной линии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
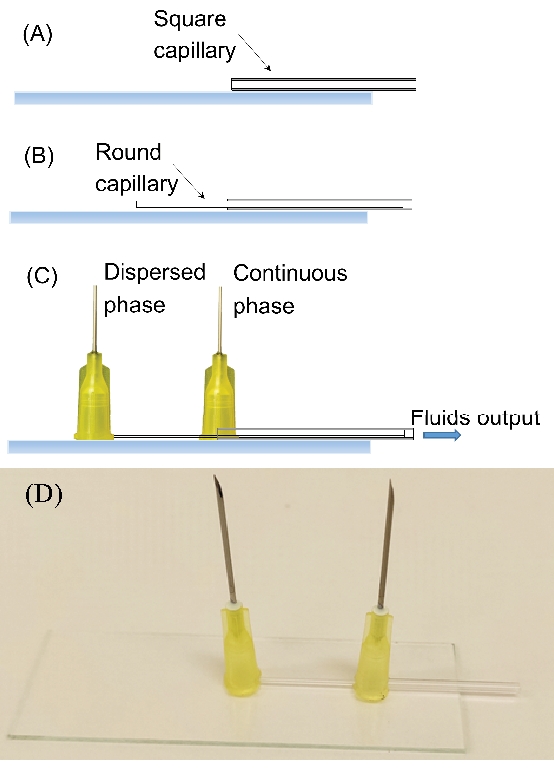
Рисунок 6: Кофокаторное устройство. (А) Расположите квадратный капилляр на предметном стекле микроскопа. (B) Расположите круглый капилляр внутри квадратного. (C) Комплектное устройство с иглами шприца. (D) Фотография полного устройства. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Изготовление электрокотопного устройства
- Для построения микрофлюидного устройства используют стеклянную основу, выполненную с помощью слайдов микроскопа (76,2 мм х 25,4 мм). Из-за их длины, слишком длинной, чтобы поместиться на одном стандартном слайде микроскопа, используйте 1 1/2 или два предметных стекла микроскопа.
- Вырежьте два небольших кусочка слайда (около 1 см), чтобы сохранить слайды вместе, как показано на рисунке 7A. Используйте эпоксидную смолу для склеивания стекла. Подождите, пока он вылечится.
- Выровняйте два капилляра коаксиально. Чтобы избежать лишних затрат на выравнивание двух круглых капилляров разного диаметра, используйте квадратный капилляр с внутренней стороной, которая соответствует внешнему диаметру круглого капилляра. Для электрокотопных экспериментов используйте боковой капилляр толщиной 2 мм.
ПРИМЕЧАНИЕ: Боковой капилляр толщиной 2 мм заставляет эксперименты с электрокопулятором работать лучше, так как расстояние между наконечником и стенкой квадратного капилляра меньше (или аналогично), чем расстояние между наконечником и стенкой квадратного капилляра. При использовании бокового капилляра толщиной 1 мм стенка капилляра находится ближе, чем земля, и жидкость часто имеет тенденцию выделяться туда, что приводит к невоспроизводимым результатам.- Используйте алмазный писец или другой доступный инструмент, чтобы разрезать квадратный капилляр длиной около 4 см. Промойте его водой, чтобы удалить частицы стекла. Дайте высохнуть на воздухе. Сделайте его гидрофобным, если дисперсная фаза представляет собой жидкость на водной основе, в противном случае — гидрофильную.
- Вытягивайте круглый капилляр с помощью машины для вытягивания пипетки, пока не получите два полукапилляра с небольшим наконечником.
- С помощью микрокрапии разрезать кончик одного из полукапилляров до нужного диаметра (20-80 мкм). Для больших диаметров можно использовать керамическую плитку. Для воды в масляных эмульсиях сделайте внешнюю сторону наконечника гидрофобной.
- Используйте другую половину капилляра в качестве коллекторного капилляра. Для этого отрежьте вытянутый наконечник, чтобы оригинальные плоские концы были восстановлены.
- Разрежьте два круглых капилляра длиной около 4-5 см (держите их короче, чем горка). Очистите их, чтобы удалить остатки, образующиеся в процессе резки. Промыть их деионизированной водой с помощью шприца. Высушите их на воздухе.
- Приклейте квадратный капилляр к слайдам (см. рисунок 7B). Не центрируйте его относительно слайдов; стык слайдов не должен находиться в области просмотра. Нанесите на концы мазок (для предотвращения растекания) почти отвержденной эпоксидной смолы.
- Поместите наконечник и коллекторные капилляры внутрь квадратного капилляра. Поместите оба конца - наконечник и один конец коллектора - на одну и ту же горку, чтобы избежать соединения между слайдами (см. Рисунок 7C). Расстояние между наконечником и коллектором составляет около 2 мм. Используйте микроскоп, чтобы измерить это расстояние.
ПРИМЕЧАНИЕ: Это расстояние будет зависеть от техники, которую вы используете для перекачки жидкостей. Конечная цель состоит в том, чтобы иметь расстояние около 1 мм между наконечником и жидким контрэлектродом. - Как только капилляры окажутся на нужном расстоянии, приклейте их к слайду, используя мазок эпоксидной смолы. Будьте осторожны, чтобы не покрыть интересующую область эпоксидной смолой, так как это затруднит визуализацию в микроскопе.
- Чтобы изготовить соединения с открытыми концами капилляров, позиционируйте иглы, покрывающие эти концы. Требуется четыре иглы на устройство.
- Используйте лезвие бритвы или скальпель, чтобы разрезать основание игл так, чтобы они помещались над капиллярами. Сделайте круглое отверстие у основания иглы, чтобы поместить иглу на конце круглых капилляров.
- Чтобы уместить его на конце квадратного капилляра, сделайте круглые и квадратные отверстия у основания иглы для размещения этого сустава. Убедитесь, что оба отверстия выровнены таким образом, чтобы круглые и квадратные капилляры могли быть установлены внутри иглы.
- Промойте иглы водой, чтобы удалить пыль и волокна от резки. Высушите их на воздухе.
- Склейте иглы. Выполните действия, описанные в разделе 1.5.2. Дайте эпоксидной смоле отверждаться в течение ночи, прежде чем тестировать устройство на наличие утечек.
- Чтобы проверить устройство на наличие утечек, выполните действия, описанные ниже.
- Закройте две иглы, используя изогнутый кусок трубки, удерживаемый связующим зажимом. Прокачайте деионизированную воду через одну из игл и используйте последнюю в качестве выхода. Используйте шприц и соответствующую ему иглу, чтобы вручную закачать воду в устройство.
- Если никаких утечек не наблюдается, прокачайте следующую иглу. Повторяйте процесс до тех пор, пока вода не пройдет через все четыре иглы. В случае обнаружения утечки тщательно высушите устройство, нанесите эпоксидную смолу и подождите не менее 1 часа, прежде чем снова тестировать.
- Заполните устройство, как описано ниже, и удалите пузырьки воздуха, так как они могут привести к нежелательным колебаниям в системе. Для удаления пузырьков используйте два наполовину заполненных шприца с деионизированной водой. Нажмите и потяните шприцы, чтобы направить воздух, захваченный внутри игл и капилляров, из устройства.
- Подготовьте шприцы с жидкостями для использования в эксперименте. Удалите все пузырьки из шприцев, как описано выше. Соедините кусок трубки с иглой шприца и заполните его жидкостью, удаляя весь воздух.
- Чтобы подключить трубку к устройству, снимите трубку, используемую для тестирования, с одной из игл устройства и перекачайте воду с помощью одного из соединенных водяных шприцев, чтобы на иглу капала вода.
- В то же время сделайте трубку капельной с нужной жидкостью. Поскольку оба конца капают, при соединении воздух не вводится. Повторите этот процесс с двумя другими шприцами, чтобы единственной свободной иглой в устройстве был выход.
- Соедините шприц внутренней жидкости (дисперсная фаза) с иглой 1, внешнюю жидкость (непрерывная фаза) с иглой 2, а коллекторную жидкость (контрэлектрод) с иглой 4. Игла 3 является выходом (см. рисунок 8).
- Подключите блок питания к иглам, питающим внутреннюю и коллекторную жидкости (иглы 1 и 4 на рисунке 8), чтобы установить разность потенциалов между наконечником и коллекторной жидкостью.
ПРИМЕЧАНИЕ: Поскольку игла металлическая и в контакте с этими проводящими жидкостями, они действуют как жидкие провода, устанавливающие разность потенциалов между наконечником и коллекторным мениском. Для указанных размеров устройства разность потенциалов будет составлять от 0 до 2,5 кВ. - Перекачивайте жидкости одним из двух возможных способов, в зависимости от лабораторного оборудования: используйте шприцевые насосы высокого давления, которые будут фиксировать скорость потока жидкостей, или используйте канистры под давлением, которые будут фиксировать давление жидкостей.
- Как только один из этих методов выбран, зафиксируйте внешнюю и внутреннюю скорость потока до желаемых значений и отрегулируйте скорость потока (или давление) жидкостного коллектора, чтобы сохранить расстояние, L, постоянным (см. Рисунок 9).
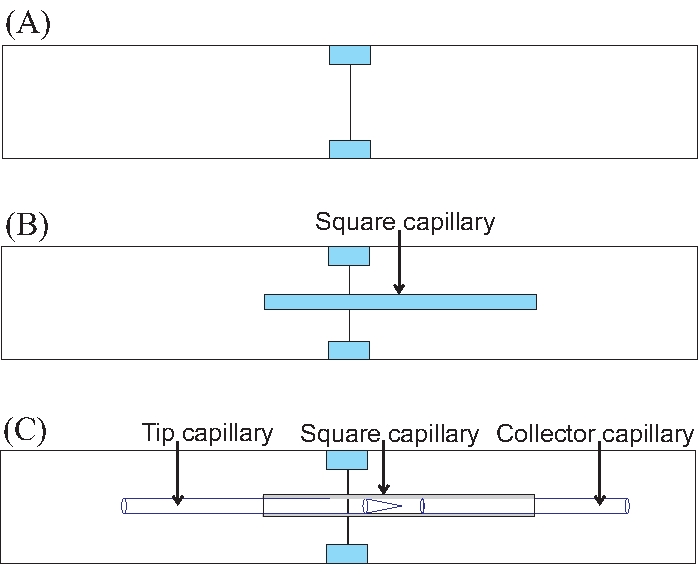
Рисунок 7: Как расположить капилляры на электрокоторном устройстве шаг за шагом. (А) Построение стеклянной основы для устройства, соединяющего два предметных стекла микроскопа. Цветные части представляют собой вырезанные куски стекла, которые после склеивания удерживают вместе два предметных стекла микроскопа. (B) Оптимальное положение квадратного капилляра на двух собранных предметных стеклах микроскопа. (C) Позиционирование круглых капилляров для экспериментов с электрокотоплением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
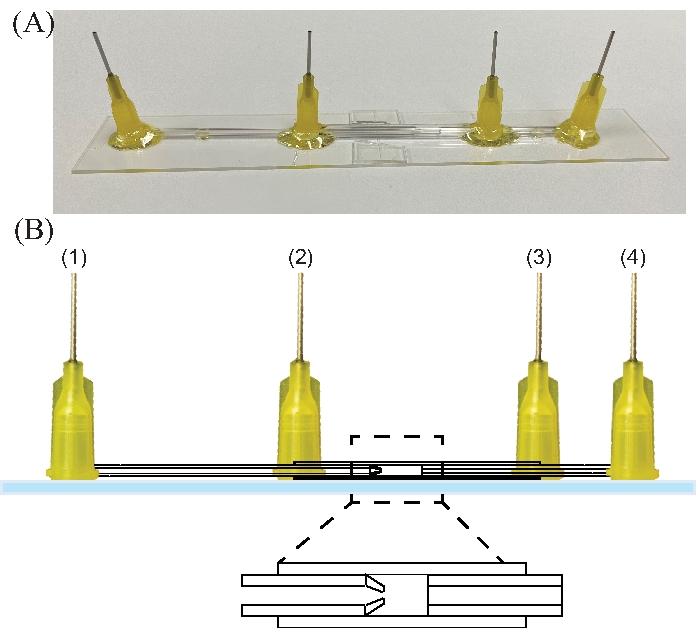
Рисунок 8: Электрокотопное устройство. (А) Фотография электрокотопного устройства. (B) Эскиз электрокотопливного устройства. Цифры обозначают вход для (1) внутренней жидкости, (2) наружной жидкости, (3) выхода устройства и (4) жидкостного коллектора/земли. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
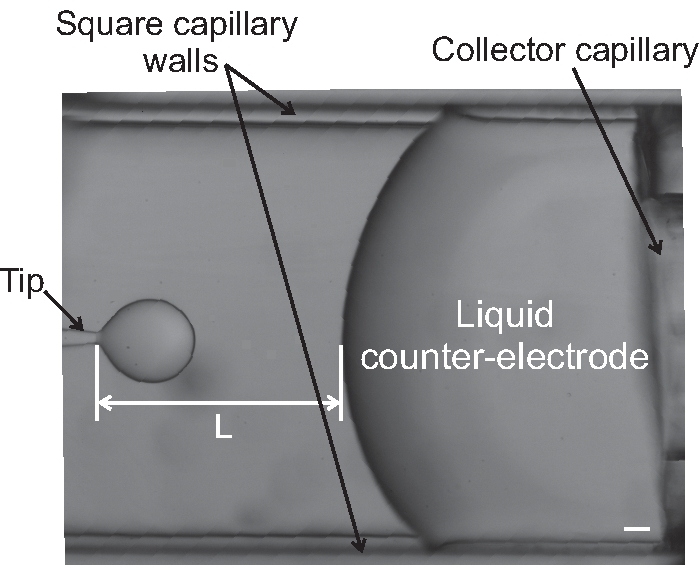
Рисунок 9: Изображение наконечника и жидкого контрэлектрода во время эксперимента с электрокотоплением. Обозначено расстояние между наконечником коллектора, L. Шкала соответствует 100 мкм. Увеличение микроскопа 4x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Очистительные процедуры
- Держите капилляры и предметные стекла микроскопа в ацетоне, чтобы удалить всю пыль и масло. Любая частица масла или пыль могут засорить наконечники микронного размера. Проверяйте наконечники на наличие засоров после каждого этапа изготовления с помощью микроскопа с увеличением от 4 до 20 раз для размеров наконечников от 10 до 100 мкм.
- Перед использованием пропустите деионизированную воду через трубку. Используйте шприц и иглу и вручную накачайте воду, чтобы предотвратить попадание нежелательных частиц изнутри трубки в устройство и засорение наконечника.
Результаты
В этой рукописи три различных устройства были разработаны для генерации капель. Мы сгенерировали капли размером (3,29 ± 0,08) мм (рисунок 4B) и (1,75 ± 0,04) мм (рисунок 4C) с использованием устройства, описанного в шаге 1. Эмульсионные капли могут быть получены с испо?...
Обсуждение
Протокол изготовления трех различных устройств на основе стекла был описан выше. В случае устройства для генерации простых капель скорость потока и свойства жидкости имеют решающее значение для создания капель контролируемым образом. Капли будут образовываться на кончике в режиме ка...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарны ACS PRF (грант 60302-UR9), Agrobio S.L. (контракт No 311325) и MCIN/AEI/10.13039/501100011033/FEDER, UE (грант No. PID2021-122369NB-I00).
Материалы
| Name | Company | Catalog Number | Comments |
| 2-[methoxy(polyethyleneoxy)6-9propyl] trimethoxysilane. | Gelest | SIM6492.7 | |
| Ceramic tile | Sutter | CTS | |
| Ethylene glycol | Fisher | BP230 | These can be found at other companies like Sigma-Aldrich |
| Hexane | Sigma- Aldrich | 34859 | Available in other vendors |
| ITW Polymers Adhesives Devcon 5 Minute Epoxy Adhesive 25 mL Dev-Tube | Ellsworth adhesives | 470740 | |
| Microforge | Narishige | MF 830 | |
| Micropipette puller | Sutter | P97 | |
| Microscope slides | Fisher | 12-544-1 | Available in other vendors |
| Needle 20 Gauge, .0255" ID, .0355" OD, 1/2" Long | McMaster | 75165A677 | |
| SDS | Sigma-aldrich | 428015 | Surfactant |
| Silicone oil | Clearco | PSF-10cSt | The catalog number correspond to the 10cSt viscosity oil. Different viscosity oils can be found at this company |
| Span 80 | Fisher | S0060500G | non-ionic surfactant |
| Square glass capillary 2mm ID (borosillicate 300 or 600 mm long) | VitroCom | S 102 | |
| Standard Glass Capillaries, 6 in., 2 / 1.12 OD/ID | World Precision instruments | 1B200-6 | These can be found at other companies like Sutter or Vitrocom |
| Syringe pump | Chemyx | FUSION 100-X | This model has a good quality/price ratio |
| Syringes (it will depend on the compatibility with the liquids) | Fisher | Catalog number will depend on the size | |
| Trimethoxy(octyl)silane | Sigma- Aldrich | 376221 | Available in other vendors |
| Tubing ( it will depend on the compatibility with the liquids) | Scientific commodities | BB3165-PE/5 | This reference is for polyethylene micro tubing. The size fits the needle size listed here |
Ссылки
- Basaran, O. A. Small-scale free surface flows with break-up: drop formation and emerging applications. American Institute of Chemical Engineers. 48 (9), 1842-1848 (2004).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Reviews of Modern Physics. 77 (3), 977-1026 (2005).
- Stone, H. A., Stroock, A. D., Adjari, A. Engineering Flows in Small Devices: Microfluidics Toward a Lab-on-a-Chip. Annual Review of Fluid Mechanics. 36 (1), 381-411 (2004).
- Gunther, A., Jensen, K. F. Multiphase microfluidics: from flow characteristics to chemical and materials synthesis. Lab on a Chip. 6, 1487-1503 (2006).
- Barrero, A., Loscertales, I. G. Micro- and Nanoparticles via Capillary Flows. Annual Review of Fluid Mechanics. 39, 89-106 (2007).
- Clift, R., Grace, J. R., Weber, M. E. . Bubbles, Drops, and Particles. , (2005).
- Othmer, K. . Encyclopedia of Chemical Technology. 4th edition. 9, (1994).
- Kentish, S., et al. The use of ultrasonics for nanoemulsion preparation. Innovative Food Science & Emerging Technologies. 9 (2), 170-175 (2008).
- Kumar, A., Li, S., Cheng, C. M., Lee, D. Flow-induced phase inversion of emulsions in tapered microchannels. Lab on a Chip. 16 (21), 4173-4180 (2016).
- Atencia, J., Beebe, D. J. Controlled microfluidic interfaces. Nature. 437, 648-655 (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junctions scaling and mechanism of break-up. Lab on a Chip. 6 (3), 437-446 (2006).
- Utada, A. S., et al. Monodisperse Double Emulsions Generated from a Microcapillary Device. Science. 308 (5721), 537-541 (2005).
- Gañan-Calvo, A. M. Generation of Steady Liquid Microthreads and Micron-Sized Monodisperse Sprays in Gas Streams. Physical Review Letters. 80 (2), 285-288 (1998).
- Shah, R. K., et al. Designer emulsions using microfluidics. Materials Today. 11 (4), 18-27 (2008).
- Taylor, G. I. Disintegration of water drops in an electric field. Proceedings of the Royal Society A, Mathematical, Physical and Engineering Sciences. 280 (1382), (1964).
- Gundabala, V. R., Vilanova, N., Fernández-Nieves, A. Current-voltage characteristic of electrospray processes in microfluidics. Physical Review Letters. 105 (15), 154503 (2010).
- Guerrero, J., Rivero, J., Gundabala, V. R., Perez-Saborid, M., Fernández-Nieves, A. Whipping of electrified liquid jets. Proceedings of the National Academy of Sciences of the United States of America. 111 (38), 13763-13767 (2014).
- Vilanova, N., Gundabala, V. R., Fernandez-Nieves, A. Drop size control in electro-coflow. Applied Physics Letters. 99 (2), 021910 (2011).
- Cloupeau, M., Prunet-Foch, B. Electrostatic spraying of liquids: Main functioning modes. Journal of Electrostatics. 25 (2), 165-184 (1990).
- Jaworek, A., Krupa, A. Main modes of electrohydrodynamic spraying of liquids. Third International Conference on Multiphase Flow ICMF. , (1998).
- Juraschek, R., Röllgen, F. W. Pulsation phenomena during electrospray ionization. International Journal of Mass Spectrometry. 177 (1), 1-15 (1998).
- Guerrero, J., et al. Emission modes in electro co-flow. Physics of Fluids. 31 (8), 082009 (2019).
- Utada, A. S., Fernández-Nieves, A., Stone, H. A., Weitz, D. A. Dripping to jetting transitions in coflowing liquid streams. Physical Review Letters. 99 (9), 094502 (2007).
- Castro-Hernández, E., Gundabala, V., Fernández-Nieves, A., Gordillo, J. M. Scaling the drop size in coflow experiments. New Journal of Physics. 11, 075021 (2009).
- Godfray, H. C. J., et al. Food Security: the challenge of feeding 9 billion people. Science. 327 (5967), 812-818 (2010).
- Labbé, R., Gagnier, D., Kostic, A., Shipp, L. The function of supplemental foods for improved crop establishment of generalist predators Orius insidiosus and Dicyphus hesperus. Scientific Reports. 8 (1), 17790 (2018).
- Pilkington, L. J., Messelink, G., van Lenteren, J. C., Le Mottee, K. 34;Protected Biological Control" - Biological pest management in the greenhouse industry. Biological Control. 52 (3), 216-220 (2010).
- Benson, C. M., Labbe, R. M. Exploring the Role of Supplemental Foods for Improved Greenhouse Biological Control. Annals of the Entomological Society of America. 114 (3), 302-321 (2021).
- Temiz, U., Öztürk, E. Encapsulation methods and use in animal nutrition. Selcuk Journal of Agricultural and Food Sciences. 32 (3), 624-631 (2018).
- Messelink, G. J., et al. Approaches to conserving natural enemy populations in greenhouse crops: current methods and future prospects. BioControl. 59, 377-393 (2014).
- Muñoz-Cárdenas, K., et al. Generalist red velvet mite predator (Balaustium sp.) performs better on a mixed diet. Experimental & Applied Acarology. 62 (1), 19-32 (2014).
- van Lenteren, J. C., Bolckmans, K., Köhl, J., Ravensberg, W. J., Urbaneja, A. Biological control using invertebrates and microorganisms: plenty of new opportunities. BioControl. 63, 39-59 (2018).
- Urbaneja-Bernat, P., Alonso, M., Tena, A., Bolckmans, K., Urbaneja, A. Sugar as nutritional supplement for the zoophytophagous predator Nesidiocoris tenuis. BioControl. 58 (1), 57-64 (2013).
- Vila, E., Cabello, T., Guevara-Gonzalez, R., Torres-Pacheco, I. Biosystems Engineering Applied to Greenhouse Pest Control. Biosystems Engineering: Biofactories for Food Production in the Century XXI. , (2014).
- Riudavets, J., Moerman, E., Vila, E., LodovicaGullino, M., Albajes, R. C., Nicot, P. Implementation of Integrated Pest and Disease Management in Greenhouses: From Research to the Consumer. Integrated Pest and Disease Management in Greenhouse Crops. Plant Pathology in the 21st Century. , (2020).
- Cohen, A. C. . Insect diets: Science and technology. Second edition. , (2015).
- Sullivan, M. T., Stone, H. A. The role of feedback in microfluidic flow-focusing devices. Philosophical Transactions of the Royal Society A: Mathematical, Physical, and Engineering Sciences. 366 (1873), 2131-2143 (2008).
- Shang, L., Cheng, Y., Zhao, Y. Emerging droplet microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- Christopher, G. F., Anna, S. L. Microfluidic methods for generating continuous droplet streams. Journal of Physics D: Applied Physics. 40 (19), 319 (2007).
- Nunes, J. K., Tsai, S. S., Wan, J., Stone, H. A. Dripping and jetting in microfluidic multiphase flows applied to particle and fiber synthesis. Journal of Physics D: Applied Physics. 46 (11), 114002 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены