Method Article
Расширение инструментария для визуализации аксонального транспорта in vivo
В этой статье
Резюме
С использованием трансгенных флуоресцентных мышей описаны подробные протоколы для оценки in vivo аксонального транспорта сигнальных эндосом и митохондрий в моторных и сенсорных аксонах интактного седалищного нерва у живых животных.
Аннотация
Аксональный транспорт поддерживает нейрональный гомеостаз, обеспечивая двунаправленный трафик различных органелл и грузов. Нарушения в аксональном транспорте имеют разрушительные последствия для отдельных нейронов и их сетей и способствуют множеству неврологических расстройств. Поскольку многие из этих состояний включают как автономные, так и неавтономные механизмы клеток и часто демонстрируют спектр патологии по подтипам нейронов, методы точной идентификации и анализа нейронных подмножеств являются обязательными.
В этой статье подробно описываются протоколы оценки in vivo аксонального транспорта сигнальных эндосом и митохондрий в седалищных нервах анестезируемых мышей. Пошаговые инструкции приведены для 1) отличить двигательные нейроны от сенсорных in vivo, in situ и ex vivo с помощью мышей, которые избирательно экспрессируют флуоресцентные белки в холинергических двигательных нейронах; и 2) отдельно или одновременно оценивать in vivo аксональный транспорт сигнальных эндосом и митохондрий. Эти дополнительные прижизненные подходы облегчают одновременную визуализацию различных грузов в различных аксонах периферических нервов для количественного мониторинга аксонального транспорта в области здоровья и заболеваний.
Введение
Периферическая нервная система (ПНС) соединяет центральную нервную систему (ЦНС) со своими дистальными мишенями, позволяя реле эфферентных сигналов осуществлять двигательный контроль и афферентных сигналов для обеспечения сенсорной обратной связи. Используя множество достижений в генетике мышей, ученые разработали различные мышиные модели для исследования многих заболеваний / синдромов, поражающих PNS 1,2,3. Поскольку большинство нейродегенеративных патологий являются многофакторными с автономным и неавтономным вкладом клеток 4,5, распутывание клеточных / нейрон-специфических патологий может дать решающее, новое понимание механизмов заболевания.
С этой целью развитие бактериальной искусственной хромосомы (BAC)-трансгенных мышей6 позволило селективной эндогенной экспрессии флуоресцентных белков в целевых подмножествах нейронов. Например, доступны BAC-трансгенные мыши, которые экспрессируют зеленый флуоресцентный белок (GFP) в холинергических7 или глицинергических нейронах8, или вариант красного флуоресцентного белка (tdTomato) в парвальбумин-положительных нейронах9. Альтернативно, селективная нейронная экспрессия флуоресцентных белков может быть достигнута с помощью технологии Cre-loxP 10. Например, мышиные штаммы, экспрессирующие cre-рекомбиназу в подмножествах нейронов (например, холинацетилтрансфераза (ChAT)-Cre), могут быть выведены с мышами, которые экспрессируют флуоресцентный белок (например, tdTomato или GFP) из конститутивного локуса (например, Gt(ROSA)26Sor) под контролем транскрипционного репрессора, окруженного участками loxP11 (например, генерируя мышей, которые экспрессируют tdTomato только в холинергических нейронах). Действительно, используя рекомбинацию Cre-loxP, были получены трансгенные мыши, которые экспрессируют желтый флуоресцентный белок в аксонах нисходящего кортикоспинального тракта12.
Кроме того, последние достижения в редактировании генов CRISPR/Cas9, такие как ORANGE, позволяют флуоресцентно маркировать несколько эндогенных нейронных белков с экспрессией, достижимой при наноразмерном разрешении13. Кроме того, в сочетании с Cre-экспрессирующими штаммами мыши, ORANGE-CAKE может быть использован для маркировки нескольких эндогенных белков в отдельных нейронах13. Альтернативно, вирусно-опосредованное трассировка нейронов также позволяет маркировать подмножества нейронов и может быть достигнута с помощью целевых комбинаций вирусных серотипов и/или клеточно-специфических промоторов 14,15,16,17.
В дополнение к методам маркировки нейронов мышиные линии также были разработаны для экспрессии репортерных белков, нацеленных на конкретные органеллы, такие как митохондрии, экспрессирующие голубой флуоресцентный белок (Mito.CFP)18 или аутофагосомы, экспрессирующие GFP (LC3.GFP)19. Кроме того, мышиные линии были разработаны для оценки динамики кальция конкретно в нейронах (например, Thy1.GCaMP)20,21. В целом, с развитием таких моделей новые экспериментальные приложения позволяют ученым задавать более точные биологические и патологические вопросы о ЦНС и ПНС.
Основная роль периферических двигательных нервов заключается в передаче электрических сигналов скелетным мышцам, чтобы вызвать движение. Кроме того, и происходящие в более длительных временных масштабах, нейрохимические и физиологические сообщения в виде различных органелл (например, митохондрий, эндолизосом, сигнальных эндосом) пересекают цитоскелетную сеть одно- или двунаправленным образом, чтобы помочь поддерживать нейронный гомеостаз 22,23,24. Нарушения в аксональном транспорте имеют катастрофические последствия для здоровья нейронов и связаны со многими заболеваниями нервного развития и нейродегенеративными заболеваниями25. На молекулярном уровне нарушения аксонального транспорта могут нарушить физиологические события, регулирующие синаптическую передачу сигналов и пластичность, транскрипцию генов и локальную трансляцию по всему аксону26,27. Хотя существует множество инструментов для изучения этих событий в культивируемых клетках / нейронах28,29, оценка динамики аксонального транспорта и аксонально-связанных биологических событий in vivo необходима для подтверждения ключевых идей физиологических и патологических процессов30.
На протяжении многих лет лаборатория Schiavo оптимизировала протоколы, чтобы задавать различные вопросы об аксональном транспорте 31,32,33,34,35,36. Эти эксперименты расширились после открытия того, что флуоресцентно меченый атоксин столбнячного нейротоксина (HCT) усваивается в терминалы аксонов в скелетных мышцах посредством взаимодействия с нидогенами и полизиалоганглиозидами37. После интернализации HCT ретроградно транспортируется в Rab7-положительных, нейротрофинсодержащих сигнальных эндосомах, которые предназначены для клеточных тел двигательных и сенсорных нейронов 38,39,40,41. Параллельно с этим достижения в технологии визуализации позволили в режиме реального времени анализировать пучки периферических нервов и отдельные аксоны у живых, обезболенных мышей30. Первый набег на оценку динамики аксонального транспорта in vivo при патологии выявил предсимптомные нарушения в транспорте сигнальных эндосом и митохондрий в мышиной модели бокового амиотрофического склероза (БАС)35 SOD1G93A. Важно отметить, что эти дефекты вряд ли будут представлять собой вторичные последствия нейродегенерации, учитывая, что потеря двигательных нейронов может произойти при отсутствии возмущений аксонального транспорта в мышиной модели болезни Кеннеди42 и гетерозиготной мутантной модели FUS ALS43. Такие аксональные транспортные дефициты могут быть устранены у мышей с БАС с использованием ингибиторов специфическихкиназ 33 или рецепторов фактора роста34. Кроме того, обработка нейронов специфическим блокатором гистондеацетилазы изменяет митохондриальный транспорт in vivo36. Совсем недавно мы сообщали, что BDNF-зависимая модуляция аксонального транспорта дисрегулируется в различных подтипах двигательных нейронов у мышей ALS44.
Используя постоянно расширяющийся инструментарий для оценки динамики аксонального транспорта28,29, этот видеопротокол описывает несколько приложений, которые позволят получить дальнейшее понимание различных биологических и патологических сценариев. Во-первых, трансгенные мыши, которые избирательно экспрессируют флуоресцентные белки в холинергических нейронах (то есть двигательных нейронах), используются для различения моторных и сенсорных аксонов как in vivo, так и ex vivo. Флуоресцентно меченый HCT затем загружается в сигнальные эндосомы в трех трансгенных линиях для дифференциации динамики аксонального транспорта в различных периферических нейронах. Следующий экспериментальный протокол детализирует мультиплексный флуоресцентный подход для оценки митохондриального транспорта, особенно в двигательных нейронах, путем разведения мышей ChAT.tdTomato с мышами Mito-CFP. Наконец, приведены инструкции о том, как одновременно изображать митохондрии и сигнальные эндосомы в пределах одного аксона in vivo.
протокол
Все манипуляции с мышами и эксперименты проводились в соответствии с Законом о животных (научные процедуры) (1986) и были одобрены Комитетом по этике Института неврологии Университетского колледжа Лондона - Института неврологии Квин-Сквер.
1. Животные
- Размещайте всех животных в индивидуально вентилируемых клетках в среде с контролируемой температурой и влажностью и поддерживайте их в 12-часовом светло-темном цикле с доступом ad libitum к пище и воде.
- Используйте как самцов, так и самок мышей следующих трансгенных штаммов: 1) гетерозиготные мыши Tg(Chat-EGFP) GH293Gsat/Mmucd, называемые мышами ChAT.eGFP; 2) гетерозиготные B6.Cg-Tg(Hlxb9-GFP)1Tmj/J, называемые HB9. мыши GFP; и 3) гетерозиготные B6.Cg-Tg(Thy1-CFP/COX8A)S2Lich/J, называемые мышами Mito.CFP.
- Генерация мышей ChAT.tdTomato путем скрещивания гомозиготных мышей B6;129S6-Chat tm2(cre)Lowl/J, называемых мышами ChAT.Cre, с гомозиготными B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J, называемыми мышами Rosa26.tdTomato.
- Генерация мышей ChAT.tdTomato::Mito.CFP путем скрещивания гетерозиготных мышей ChAT.tdTomato с гетерозиготными мышами Mito.CFP.
2. Внутримышечные инъекции флуоресцентного HCT
- Предоперационная подготовка
- Экспресс HCT (HCT441, остатки 875-1315) слился с улучшенной цистеиновой меткой у бактерий в виде белка слияния глутатион-S-трансферазы согласно 45. Маркировка HCT с AlexaFlour555 C2 малеимидом31, диализируйте его в ледяном диализном буфере (10 мМ HEPES-NaOH, 100 мМ NaCl, рН 7,4), заморозьте его в жидком азоте и храните при -80 °C. Прежде чем выполнять эксперименты in vivo , сначала протестируйте HCT in vitro для успешного поглощения и транспорта в первичных нейронах.
- Разбавляйте флуоресцентный HCT (например, HCT-555) до конечной и экспериментально согласованной концентрации в диапазоне от 2,5 до 10 мкг/мкл в стерильном фосфат-буферном физиологическом растворе (PBS) в пробирке 0,2 мл. На этом этапе добавляют больше соединений/факторов в раствор HCT, если это необходимо (например, нейротрофический фактор мозга).
ПРИМЕЧАНИЕ: Конечный объем должен соответствовать размеру интересующей мышцы (мышц). Например, приготовьте инъекционный объем 3-4 мкл для передней (ТА) мышцы большеберцовой кости и ~1 мкл для меньшей камбаловидной мышцы. Поддерживайте рабочую концентрацию HCT между 2,5 и 10 мкг/мкл независимо от конечного объема. - Смешайте раствор HCT с помощью пипетки или вихря и кратковременно вращайте вниз на низкой скорости, используя настольную центрифугу, чтобы собрать жидкость и удалить большие пузырьки. Защитите HCT от света и транспортировки по льду.
- Используйте вытянутую стеклянную микропипетку для оптимальных внутримышечных инъекций в более мелкие мышцы (например, камбалу) или для инъекций интрашиатического нерва. Вытягивайте градуированные стеклянные микропипетты (согласно 46) перед операцией.
ПРИМЕЧАНИЕ: Чтобы включить пипетку и ограничить поток вверх и наружу задней части микропипетки, осторожно отколите небольшой кусочек от острого наконечника с помощью тонких щипцов под рассекающим микроскопом. Позаботьтесь о том, чтобы утилизировать сломанный конец в соответствующем бункере. - Стерилизуйте и очистите все хирургические инструменты перед использованием.
- Хирургическо-внутримышечные инъекции
- Подготовьтесь к операции, закрепив стерильную хирургическую драпировку на тепловом коврике, установленном на 37°C. Позиционируйте и фокусируйте работающий микроскоп. Чтобы начать операцию, распакуйте на хирургическую драпировку предварительно стерилизованные хирургические инструменты, хирургическую ленту, стерильные ватные палочки, 70% (v / v) этанол в воде, стерильный физиологический раствор, швы и иглу Гамильтона или вытянутые стеклянные микропипетты.
- Убедитесь, что анестезирующий аппарат имеет достаточное количество кислорода и изофлурана на время хирургической процедуры. Направьте поток анестезии в индукционную камеру и включите анестетик.
- Для начала используют расход кислорода 1-2 л/мин и 5% изофлурана. Поместите мышь в индукционную камеру, чтобы начать анестезию. При отсутствии корректирующего рефлекса уменьшают анестезию до 2-3% изофлурана, направляют поток анестезии к мундштуку, переносят мышь на мундштук, расположенный в отдельной области хирургического пространства.
- Убедитесь, что рефлексы снятия роговицы и педали отсутствуют, прежде чем брить область меха, покрывающую мышцу (мышцы), подлежащую инъекции. По завершении удалите как можно больше бритого меха у мыши, используя липкую сторону хирургической ленты, и поместите мышь на весы, чтобы записать ее предоперационный вес.
- Осторожно нанесите смазку для глаз с помощью ватного тампона и перенесите мышь и мундштук в хирургическую область.
ПРИМЕЧАНИЕ: Постарайтесь ограничить количество бритого меха, который также переносится в хирургическую область. Используйте хирургическую ленту, чтобы закрепить голову на мундштуке, чтобы предотвратить выскальзывание мыши. Используя отдельный ватный тампон, нанесите этанол на бритую область для стерилизации и уменьшения загрязнения меха. - Расположите тело в соответствии с мышцей, подлежащей инъекции. Например, для TA поместите мышь на спину и вытяните заднюю конечность на ~ 10 ° от средней линии. Альтернативно, для инъекций камбалы поместите животное на бок и вытяните заднюю конечность на ~45° от средней линии. Когда задняя конечность находится в правильном положении, используйте хирургическую ленту по всей стопе, чтобы предотвратить нежелательные движения во время операции.
ПРИМЕЧАНИЕ: Процедуры инъекций для ТА, икроножных и камбаловидных мышц были ранее подробно описаны32. - Прежде чем сделать разрез, подтвердите, что анестезия достаточна, проверив рефлекс снятия педали. Постоянно контролируйте анестезию и поддерживайте ее на протяжении всей хирургической процедуры с регулярной оценкой дыхания и рефлекса отмены.
- На этом этапе втяните рабочий раствор HCT в шприц Гамильтона или вытащенную стеклянную микропипетку.
- Сделайте небольшой разрез над интересующей мышцей в области (областях), которая соответствует (областям) области концевой пластиныдвигателя 46,47,48. Проткните внешнюю фасцию на мышце и медленно введите HCT в соответствии с 32. Оставьте шприц/микропипетку в положении на 5-10 с, прежде чем медленно отойти.
- Закройте разрезы 1-2 швами и переведите мышь в изолированную восстановительную клетку. Следите за мышью после операции в течение минимум 30 минут, прежде чем вернуть ее в домашнюю клетку. Когда мышь успешно выздоровела и послеоперационное наблюдение завершено, верните клетку в нормальные жилищные условия.
3. In vivo аксональный транспорт
- Обнажение седалищного нерва
- Установите камеру окружающей среды микроскопа на 37 °C по крайней мере за 1 ч до получения изображения.
- Подготовьтесь к обнажению седалищного нерва, расположив хирургическую драпировку, инструменты, ленту, стерильные ватные тампоны, 70% этанол и стерильный физиологический раствор вокруг хирургической области. Убедитесь, что анестезирующая машина имеет достаточные запасы кислорода и изофлурана в течение 2 ч на мышь. Создайте клин из парапленки или невидимой ленты, разрезав его на узкий прямоугольник (например, шириной ~ 1 см для более крупных мышей) с угловым наконечником и поместите его под открытый седалищный нерв, чтобы помочь процессу визуализации. Поместите индукционную камеру поверх теплового коврика и установите температуру тела.
ПРИМЕЧАНИЕ: Четыре часа - это достаточно времени для того, чтобы HCT был взят и ретроградно перенесен из места инъекции в седалищный нерв; следовательно, одна мышь может быть подготовлена к повторной анестезии после этого времени. - Направьте поток анестезии в индукционную камеру, включите анестезирующую машину со скоростью потока кислорода 1-2 л/мин и 3-4% изофлурана и поместите мышь в индукционную камеру для начала анестезии.
ПРИМЕЧАНИЕ: Поскольку эксперимент in vivo с аксональным транспортом является терминальной процедурой, нет необходимости смазывать глаза. - При отсутствии корректирующего рефлекса уменьшают анестезию до 2-3% изофлурана, направляют поток анестезии к мундштуку, переносят мышь на мундштук. Используйте хирургическую ленту для крепления головы к мундштуку, вытяните целевой задний зажим на ~ 45 ° от средней линии и используйте хирургическую ленту над ногой для поддержания этого положения.
ПРИМЕЧАНИЕ: Снижение анестезии является преимуществом на этом этапе, поскольку оно может ограничить воздействие дыхательных артефактов во время процесса визуализации. - Убедитесь, что рефлексы отмены роговицы и педали отсутствуют, а затем используйте ножницы, чтобы отрезать кожу, покрывающую седалищный нерв32 (то есть большую область, простирающуюся от центрального спинного мозга до средней нижней части задней конечности). Удаляют вышележащую двуглавую мышцу бедра, а также любую другую мускулатуру и соединительную ткань, которая находится рядом с седалищным нервом. Избегайте повреждения седалищного нерва и окружающих кровеносных сосудов, особенно тех, которые расположены вблизи бокового аспекта надколенника / проксимального аспекта боковой головки икроножной мышцы.
- Когда неповрежденный седалищный нерв достаточно обнажен, нанесите предваренный стерильный физиологический раствор в область вокруг седалищного нерва, чтобы предотвратить высыхание. Используйте изогнутые щипцы, чтобы разрушить глубоко лежащую соединительную ткань и поместить предварительно подготовленный парапленочный «клин» под нерв. По завершении поместите пропитанную физиологическим раствором вату на открытую область и переместите мышь в индукционную камеру, расположенную поверх теплового коврика (установленного на 37 °C), которая все еще должна быть заполнена изофлураном в O2.
- In vivo аксональная визуализация
- Поместите защитное стекло размером 22 x 64 мм на специальную ступень микроскопа и закрепите его положение с помощью ленты. Выберите и нанесите иммерсионное масло на объектив, а затем подключите ступень микроскопа к инвертированному микроскопу. Медленно поднимите погруженный в масло объектив до тех пор, пока не будет установлен контакт между маслом и покровным стеклом.
ПРИМЕЧАНИЕ: Либо 40x, 1,3 числовой апертурой (NA) DIC Plan-Apochromat, либо 63x, 1.4 NA DIC Plan-Apochromat масляные иммерсионные цели могут быть использованы для изображения переноса in vivo в седалищном нерве. - Переместите мундштук анестезии на ступень микроскопа и закрепите шланги анестезии скотчем, чтобы предотвратить нарушение анестезии. Извлеките вату из седалищного нерва и перенесите мышь из индукционной камеры в мундштук, при этом открытый нерв обращен к покровному стеклу. Используйте хирургическую ленту, чтобы убедиться, что голова мыши закреплена на мундштуке и поддерживать самый низкий, эффективный уровень анестезии. Осторожно поднимите мышь за хвост и добавьте стерильный физиологический раствор в крышку возле открытого седалищного нерва, чтобы ограничить высыхание и помочь визуализации.
ПРИМЕЧАНИЕ: Закройте все двери экологической камеры, чтобы убедиться, что площадь остается при температуре тела. - Используя глаз, определите местоположение седалищного нерва, определите оптимальную фокусную точку и выберите интересующую область, содержащую подвижные аксональные органеллы.
ПРИМЕЧАНИЕ: Подробное объяснение этого процесса было ранее описано32. - Переключитесь на программное обеспечение компьютера, нажав кнопку «Приобретение» (или эквивалентную), и выберите интересующую область. Используйте цифровой зум для получения в общей сложности увеличения >80x и поворачивайте выбранную область для горизонтальной визуализации аксонов (например, движущийся ретроградный груз справа налево и движущийся слева направо антероградный груз).
ПРИМЕЧАНИЕ: Параметры направленности зависят от пользователя, но должны оставаться согласованными на протяжении всего эксперимента. - Оптимизируйте интенсивность сигнала, регулируя такие параметры, как интенсивность лазера (0,2 - 1%), диафрагма точечного отверстия (1 а. е. - макс.), усиление (Master) (700 - 1000), цифровое смещение (-50 - 0) и цифровое усиление (1,0 - 4,0). Чтобы уменьшить потенциальное влияние фототоксичности, поддерживайте интенсивность лазера на уровне ≤ 1%, где это возможно, с максимальной интенсивностью лазера 2%. Измените все остальные параметры перед регулировкой интенсивности лазера для оптимального обнаружения сигнала.
- Щелкните поле Области (или эквивалент), выберите интересующую прямоугольную область, затем в режиме получения (или эквивалентном) установите размер кадра не менее 1024 x 1024 пикселей и начните покадровое получение 100–1000 кадров.
ПРИМЕЧАНИЕ: Желаемая скорость сбора кадров зависит от пользователя (например, транспорт может быть оценен с частотой кадров между 0,1 и 6 с) и может быть скорректирована с помощью программных параметров, таких как область интереса, время сканирования, усреднение захвата и направление лазера. Например, чтобы получить более медленную частоту кадров, увеличьте высоту/ширину интересующей области, получите более медленную скорость сканирования, увеличьте усреднение захвата и используйте направление одного лазера и наоборот для более высокой частоты кадров. Скорость сбора кадров должна оставаться согласованной для сопоставимых наборов данных, поскольку обработка изображений на разных частотах может привести к несоответствиям. Быстрые грузы, такие как сигнальные эндосомы, требуют более высокой частоты кадров (например, 0,1-3 с) по сравнению с более медленными органеллами, такими как митохондрии, которые могут быть проанализированы с использованием более медленной скорости (например, 2,5-6 с). - Стремитесь захватить не менее 10 подвижных грузов с минимум трех аксонов на мышь.
ПРИМЕЧАНИЕ: На основе двух выборочных, двусторонних расчетов мощности (со стандартной мощностью 0,8 (1−β) и частотой ошибок типа I 5% (α)), размеры выборки 6-8 являются достаточными для выявления различий в аксональном переносе между моделями дикого типа иболезнями 35,43. - Как только визуализация будет завершена, немедленно усыпите мышь под наркозом (например, вывих шейки матки). Посмертная ткань, такая как мышцы и седалищные нервы, также может быть собрана для дальнейшего анализа.
- Поместите защитное стекло размером 22 x 64 мм на специальную ступень микроскопа и закрепите его положение с помощью ленты. Выберите и нанесите иммерсионное масло на объектив, а затем подключите ступень микроскопа к инвертированному микроскопу. Медленно поднимите погруженный в масло объектив до тех пор, пока не будет установлен контакт между маслом и покровным стеклом.
Результаты
В этой статье подробно описывается универсальный протокол, который расширяет инструментарий аксонального транспорта in vivo в моделях грызунов. Рисунок 1 демонстрирует, что аксоны моторных нейронов могут быть дифференцированы как от аксонов сенсорных нейронов, так и от шванновских клеток с помощью трансгенных мышей. На рисунке 1A показана экспрессия eGFP в холинергических моторных аксонах живой, обезболенной мыши ChAT.eGFP. На рисунке 1B используется альтернативный метод для достижения экспрессии tdTomato в свежеиссекшем нерве (т.е. без дополнительной обработки тканей) у мыши ChAT.tdTomato. Следовательно, использование трансгенных штаммов, таких как ChAT.eGFP, ChAT.tdTomato или Hb9.GFP, позволяет маркировать моторные аксоны in vivo.
Альтернативно, аксоны также могут быть идентифицированы путем введения индикаторов/маркеров (например, HCT31,32 или вирусов, кодирующих eGFP15) в скелетные мышцы. На рисунке 2 показано такое приложение, изображающее восемь надежно экспрессирующих ChAT.eGFP-положительных аксонов, которые содержат HCT-555-положительные сигнальные эндосомы (белые стрелки), ~ 4 ч после инъекции зонда в мышцу ТА. Используя этот экспериментальный дизайн, мы смогли идентифицировать TA-иннервирующие α-моторные нейроны, которые преимущественно быстроутомляются 44. Еще пять аксонов ChAT.eGFP с менее надежной экспрессией eGFP (рисунок 2A, оранжевые звездочки) были частично не в фокусе и, вероятно, располагались немного глубже в седалищном нерве.
Кроме того, мы идентифицировали HCT-555-положительные сигнальные эндосомы в eGFP-отрицательных сенсорных аксонах (желтые стрелки). Таким образом, используя эту экспериментальную парадигму, можно специально оценить и сравнить аксональный транспорт сигнальных эндосом в моторных и сенсорных нейронах in vivo. Действительно, используя этот трансгенный репортерный штамм, мы обнаружили, что транспорт сигнальных эндосом в ChAT.eGFP-положительных моторных аксонах быстрее, чем в ChAT.eGFP-отрицательных сенсорных аксонах, которые могут быть надежно дифференцированы с помощью ширины аксона43.
Ранее мы идентифицировали аксоны моторных нейронов с помощью мыши ChAT.eGFP in vivo43. Теперь мы сообщаем, что HB9. Мыши GFP также могут быть использованы для достижения идентификации аксона двигательных нейронов in vivo. Действительно, на рисунке 3 представлена серия покадровых изображений HB9. Аксоны GFP, содержащие ретроградно движущиеся HCT-555-положительные сигнальные эндосомы. Обратите внимание, что, в отличие от выражения, управляемого ChAT, GFP имеет более пунктуальный / гранулированный шаблон в HB9. Аксоны GFP; причина этого неясна.
Ранее мы описывали, как контролировать динамику митохондрий in vivo в седалищных нервах с помощью инъекций интрасциатического нерва митохондриально-целевого красителя, тетраметилродамина, этилового эфира, перхлората (TMRE)32,36. Чтобы надежно дифференцировать моторные и сенсорные митохондрии, мышь Mito.CFP, которая экспрессирует CFP под промотором Thy1 18, может быть скрещена с трансгенными мышами, которые экспрессируют флуоресцентный репортерный ген в определенных типах нейронов. Действительно, разводя мышей Mito.CFP с мышами ChAT.tdTomato (называемыми ChAT.tdTomato::Mito.CFP), мы могли бы визуализировать митохондрии конкретно в моторных аксонах, как показано на рисунке 4. В этом живом мультиплексном примере можно визуализировать пять аксонов ChAT.tdTomato, четыре из которых содержат CFP-положительные митохондрии. Кроме того, узел Ранвье (белая стрелка на панели III) также может быть идентифицирован. Кроме того, узлы Ранвье четко обнаруживаются в ChAT.eGFP, HB9. Мыши GFP и Mito.CFP (не показаны). Эти двойные трансгенные штаммы позволяют покадровую прижизненную визуализацию живых, обезболенных мышей для мониторинга специфического содержания митохондрий двигательных нейронов и динамики аксонального транспорта.
Наконец, сигнальные эндосомы и митохондрии могут быть одновременно визуализированы в пределах одних и тех же аксонов in vivo путем введения HCT в мышцы мышей Mito.CFP (Рисунок 5). Внутримышечные инъекции HCT-555 выполняли в мышцу ТА у мыши Mito.CFP ~ за 4 ч до визуализации. Как митохондрии (i панели), так и сигнальные эндосомы (ii панели) были одновременно визуализированы в мышечно-специфических аксонах (т.е. аксонах, иннервирующих ТА). Действительно, можно наблюдать антероградно (желтые треугольники) и ретроградно (зеленые треугольники и круги) движущиеся органеллы, а также застывшие органеллы (оранжевые треугольники и круги). Используя эту экспериментальную парадигму, можно оценить сложные функциональные взаимодействия между аксональными митохондриями и сигнальными эндосомами in vivo. В целом, мы демонстрируем несколько различных экспериментальных подходов к оценке аксонального транспорта сигнальных эндосом и / или митохондрий, особенно в холинергических двигательных нейронах in vivo.
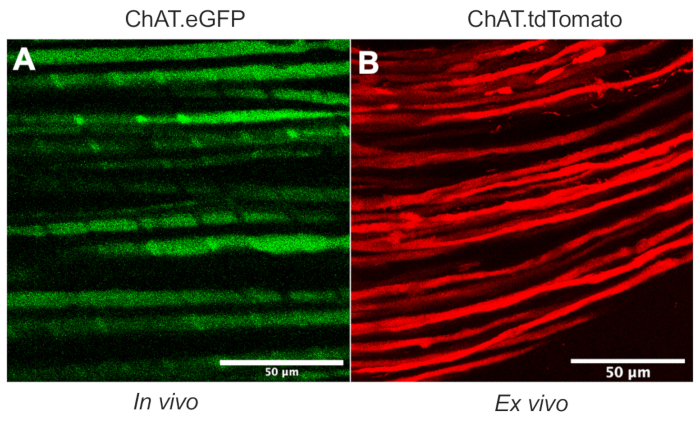
Рисунок 1: Моторные аксоны седалищного нерва. (A) Репрезентативное одноплоскостное изображение eGFP-положительных моторных аксонов, полученное in vivo от мыши ChAT.eGFP. (B) Репрезентативное одноплоскостное изображение tdTomato-положительных моторных аксонов в иссеченном седалищном нерве у мыши ChAT.tdTomato. Различия в калибре аксона обусловлены различиями в возрасте и размере мыши. Шкала стержней = 50 мкм. Сокращения: eGFP = усиленный зеленый флуоресцентный белок; ChAT = холин ацетилтрансфераза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: In vivo аксональный транспорт сигнальных эндосом в живых двигательных и сенсорных нейронах седалищного нерва мыши ChAT.eGFP. (A-C) Репрезентативные изображения холинергических аксонов, экспрессирующих eGFP (A) и содержащих HCT-555-положительные сигнальные эндосомы (B), и слияние (C). Белые стрелки выделяют eGFP-положительный моторный аксон, содержащий HCT-555-положительные сигнальные эндосомы, голубые стрелки идентифицируют моторный аксон, в котором отсутствуют HCT-555-положительные сигнальные эндосомы, а желтые стрелки выделяют eGFP-отрицательный сенсорный аксон, транспортирующий HCT-555-положительные сигнальные эндосомы. Оранжевые звездочки идентифицируют моторные аксоны с более слабой экспрессией eGFP. Шкала шкалы = 25 мкм. Сокращения: eGFP = усиленный зеленый флуоресцентный белок; ChAT = холин ацетилтрансфераза; HCT-555 = столбнячный токсин-связывающий домен. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
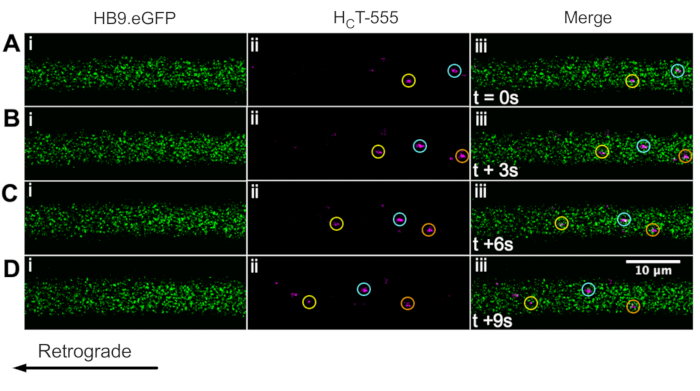
Рисунок 3: Покадровый ряд изображений, представляющий in vivo аксональный транспорт сигнальных эндосом в живых двигательных нейронах HB9. Мышь GFP. (А-Д) Покадровые снимки, сделанные каждые 3 с, изображают аксоны моторных нейронов, экспрессирующие зеленый флуоресцентный белок (i) и содержащие HCT-555-положительные сигнальные эндосомы (ii), и слияние (iii). Каждый круг одного цвета идентифицирует одну и ту же движущуюся эндосому в разных кадрах. Ретроградное движение справа налево. Шкала шкалы = 10 мкм. Сокращения: GFP = зеленый флуоресцентный белок; HCT-555 = столбнячный токсин-связывающий домен. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
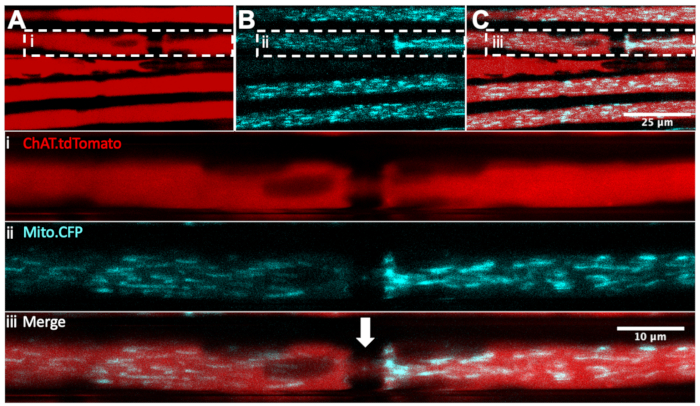
Рисунок 4: In vivo аксональный транспорт митохондрий в живых двигательных нейронах седалищного нерва ChAT.tdTomato:: Mito.CFP: mouse. (A-C) Репрезентативные изображения tdTomato-положительных моторных аксонов (A), содержащих CFP-положительные митохондрии (B), и слияние (C). Вставные изображения i-iii содержат более высокое увеличение от каждой панели. Белая стрелка представляет подозреваемый узел Ранвье. Шкала стержней = 25 (A-C) и 10 мкм (i-iii). Сокращения: ChAT = холин ацетилтрансфераза; CFP = голубой флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
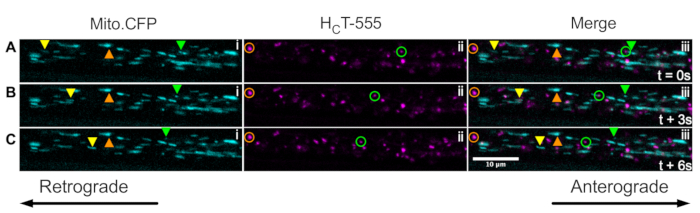
Рисунок 5: Покадровые серии изображений, представляющие параллельный in vivo аксональный транспорт митохондрий и сигнальные эндосомы в живых двигательных нейронах седалищного нерва мыши Mito.CFP. (А-С) Покадровые снимки, сделанные каждые 3 с, изображающие аксональный транспорт как митохондрий (i), так и сигнальных эндосом (ii) в пределах одного аксона седалищного нерва (iii). Желтые треугольники идентифицируют антероградно движущиеся грузы, зеленые круги / треугольники идентифицируют ретроградно движущиеся грузы, а оранжевые круги / треугольники идентифицируют неподвижные грузы. Антероградное движение происходит слева направо, тогда как ретроградное движение находится в противоположном направлении. Шкала бар = 10 мкм. Сокращения: HCT-555 = столбнячный токсин-связывающий домен; CFP = голубой флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этом протоколе подробно описываются шаги по оценке in vivo аксонального транспорта сигнальных эндосом и митохондрий в интактных аксонах мышиного седалищного нерва. Действительно, предусмотрена экспериментальная установка, которая позволяет пользователям 1) отличать моторные нейроны от сенсорных in vivo, in situ и ex vivo с помощью мышей, экспрессирующих флуоресцентные репортерные белки, селективно экспрессируемые в моторных нейронах; 2) оценить in vivo аксональный транспорт сигнальных эндосом конкретно в аксонах двигательных нейронов с использованием трех различных трансгенных мышей; 3) исследовать in vivo аксональный транспорт митохондрий конкретно в аксонах двигательных нейронов; и 4) одновременно оценивать динамику переноса in vivo сигнальных эндосом и митохондрий в пределах одного аксона. Этот подход имеет огромный потенциал для исследования аксонального транспорта в базальных условиях и может быть использован для оценки патологических возмущений при различных заболеваниях, затрагивающих периферические двигательные и сенсорные нервы.
Используя предыдущие экспериментальные парадигмы в качестве основы31,32, здесь мы получили подробные новые, надежные способы дифференциации аксонального транспорта, происходящего в моторных и сенсорных нейронах с использованием трансгенных репортерных мышей. Используя мышь Mito.CFP, этот подход был дополнительно разработан для оценки митохондриального транспорта in vivo путем избегания инъекций интрасциаазного нерва TMRE36. Это позволяет обойти возможные нейронные повреждения и возмущения в аксональном транспорте, вызванные внутринервной инъекцией зонда. Кроме того, этот протокол позволяет визуализировать аксональный транспорт нескольких органелл в двигательных аксонах, иннервирующих мышцы с различными физиологическими свойствами (например, быстро дергающиеся утомляемые мышцы против медленно дергающихся мышц, устойчивых к усталости). Таким образом, сигнальная эндосома и/или динамика митохондриального аксонального транспорта могут быть оценены в различных подмножествах α-моторных нейронов44. Кроме того, аксональный транспорт этих органелл в патологических условиях также может быть оценен путем скрещивания с мышиными моделями различных нейродегенеративных заболеваний 1,2,3.
Инструментарий аксонального транспорта постоянно расширяетсяна 28,29, и были разработаны протоколы ex vivo для оценки динамики транспорта с использованием культивируемых эксплантов вентрального рога мыши49 или иссеченных нервно-мышечных препаратовмыши 50. Кроме того, разработка протоколов оценки аксонального транспорта в индуцированных человеческих плюрипотентных стволовых клетках (hiPSC), полученных из кортикальных51 нейронов или hiPSC-производных спинальных двигательных нейронов52, позволила исследовать нейроны человека с болезнетворными мутациями. Такие передовые протоколы в ткани мыши и клетках человека могут обеспечить критическое понимание функции нейронов, облегчить новые патомеханистические открытия в моделях нейродегенеративных заболеваний и использоваться для тестирования терапевтических молекул и стратегий.
Для успешного внедрения этих методов необходимо предпринять ряд важнейших шагов, и в разделе протокола были представлены некоторые важные замечания. Основными требованиями для прижизненной визуализации являются инвертированный конфокальный микроскоп с индивидуальной сценической вставкой и оборудование для поддержания анестезии и оптимальной температуры. Действительно, специализированная мобильная анестезиологическая система необходима для 1) индукции анестезии, 2) вскрытия / обработки тканей (то есть обнажения седалищного нерва) и 3) поддержания анестезии во время прижизненной визуализации (как ранее подробно описано в 31,32). Особенно при использовании объективов с более высоким увеличением (например, 40x или 63x), глубина анестезии может повлиять на качество изображения, так как более глубокая анестезия вызывает большие «загазованные» вдохи, которые приводят к частым смещениям фокуса. Такие большие движения, несомненно, повлияют на анализ транспортировки после визуализации (например, отслеживание грузов с использованием фиджийских плагинов TrackMate53 или KymoAnalyzer54), поскольку дыхательные движения производят артефакты в покадровых видео, которые могут сделать их непригодными для автоматического отслеживания или потребовать более трудоемкой оценки. Кроме того, мы также наблюдали артефакты визуализации, вызванные пульсирующими артериями внутри седалищного нерва, которые могут быть решены только путем выбора другой области визуализации. Микроскоп должен быть оснащен камерой окружающей среды, способной поддерживать постоянную температуру тела, так как температура и рН влияют на аксональный транспорт55. Кроме того, следует избегать применения анальгетиков после операции, так как они могут изменить транспортную динамику56. Если экспериментальная конструкция является продольной и требует повторной визуализации (например, 57), протоколы вскрытия должны быть соответствующим образом скорректированы, чтобы быть минимально инвазивными и могут потребовать дополнительного этического/лицензионного одобрения.
Необходимо иметь в виду некоторые экспериментальные соображения . Во-первых, большинство протоколов, подробно описанных в настоящем описании, включают использование трансгенных мышей, которые обладают флуоресцентными репортерными белками в митохондриях или аксонах моторных нейронов. Каждая из этих линий мыши должна быть выведена и изображена как геми-/гетерозигота. Исключениями, однако, являются мышиные линии ChAT.Cre и Rosa26.tdTomato, которые могут отдельно поддерживаться в качестве гомозигот, при этом полученное потомство гемизиготы обеспечивает экспрессию tdTomato в холинергических нейронах после рекомбинации Cre-loxP . При скрещивании трансгенных геми-/гетерозиготных мышей (например, Mito.CFP) с другими трансгенными геми-/гетерозиготными мышами (например, ChAT.eGFP) необходимо тщательно рассмотреть стратегию размножения, так как получение желаемого количества двухмутантного потомства может занять много времени. Более того, при разведении F1 поколения мышей ChAT.Cre и Rosa26.tdTomato (т.е. ChAT.tdTomato) с дополнительными трансгенными штаммами (например, Mito.CFP) следует ожидать еще меньшего количества мышей, несущих желаемые тройные трансгены. Кроме того, необходимо также учитывать потенциальное перекрытие флуорофоров при разведении двухрепортерных мышей с близкими свойствами длины волны (например, Mito-CFP-возбуждение: 435 нм, излучение: 485 нм, выведенное с ChAT.eGFP-возбуждение: 488 нм, излучение: 510 нм), хотя эту проблему можно преодолеть при спектральном размешивании58.
Этот метод имеет некоторые ограничения, которые следует учитывать. В этой работе и наших предыдущих протоколах31,32 мы показали, как несколько генетически закодированных маркеров и различные методы окрашивания могут быть использованы для маркировки и отслеживания различных органелл in vivo. Однако не все зонды подходят для такого экспериментального подхода. Мы оценили инъекции в ТА или камбаловидную мышцу бета-субъединицы холерного токсина (CTB)-488 (0,5-1,5 мкг / мкл ~ 4 ч до визуализации), зонд, обычно используемый для маркировки тел клеток двигательных нейронов в экспериментах с ретроградными индикаторами in vivo 59,60. Однако при инъекции в одиночку или совместной инъекции с HCT-555 маркировка CTB-488 была плохой, несмотря на использование концентраций, аналогичных тем, которые использовались для успешного отслеживания ретроградных двигательных нейронов. Таким образом, мы приходим к выводу, что, несмотря на то, что CTB является отличным маркером in vitro сигнальных эндосом в нейронных культурах61, HCT остается зондом золотого стандарта для идентификации сигнальных эндосом in vivo в аксонах седалищного нерва.
Используя различные маршруты, мы также протестировали зонды, обычно используемые для маркировки лизосом, таких как LysoTracker зеленый DND-26, и маркеры активных лизосомальных гидролаз, таких как BODIPY-FL-пепстатин A для катепсина D62 и Magic Red для катепсина B, но без успеха. Мы попробовали внутримышечную доставку BODIPY-FL-пепстатина А (2,5 мкг в ТА ~ 4 ч до визуализации), а также инъекцию интрашиационного нерва 2 мкл LysoTracker (10 мкМ), BODIPY-FL-пепстатина A (10 мкМ) или Magic Red (1/10) за 30-60 минут до визуализации. Несмотря на эти зонды, выделяющие нерв, мы не смогли найти четко обозначенные органеллы. Зонды накапливались вокруг аксонов, вероятно, удерживаясь шванновскими клетками. Следовательно, неудачная маркировка лизосом может быть вызвана недостаточной доставкой зонда в нейроны, хотя существование более подходящих концентраций нельзя исключать. Учитывая, что маркировка TMRE работает в аналогичных условиях (т.е. инъекции внутрисиатикального нерва), интенсивность маркировки может зависеть от красителя и должна быть проверена для каждого маркера независимо. Однако мы приходим к выводу, что нацеливание лизосом in vivo с помощью этих зондов невозможно при указанных выше концентрациях.
Методы анестезии могут изменять различные физиологические показания (например, функция улитки63 и кортикальная электрофизиология64); однако влияет ли анестезия in vivo на аксональный транспорт в седалищном нерве, в настоящее время неизвестно. Учитывая снижение нервно-мышечной активности при изофлуран-индуцированной анестезии, возможно, что кинетика транспорта отличается по сравнению с бодрствующим состоянием. Тем не менее, единственное исследование in vivo, которое непосредственно исследовало это, показало, что транспорт плотных пузырьков ядра в таламокортикальных проекциях не отличается между анестезированными и бодрствующими мышами65. Кроме того, поскольку различия в переносе между мышами дикого типа и моделью заболевания обнаруживаются под анестезией 35,43, ясно, что воздействие изофлурана не препятствует выявлению возмущений при передаче сигналов эндосом или митохондриальном трафике.
Этот протокол имеет и другие потенциальные применения, которые были описаны ниже. Разведение трансгенных мышей, описанных в этом протоколе (например, Mito.CFP, ChAT.eGFP) с нейродегенеративными моделями заболеваний мышей 1,2,3, позволит проводить исследования подтипов нейронов и/или грузов. Кроме того, недавно разработанные мышиные линии Cre66 также позволят визуализировать флуоресцентные репортерные белки в различных популяциях сенсорных аксонов. Например, мышей Rosa26.tdTomato можно скрестить с нейропептидом Y-рецептор-2-экспрессирующим (Npy2r). Cre mouse для обеспечения флуоресценции tdTomato в миелинизированных ноцицепторахА-волокна 67. Кроме того, временное управление также может быть достигнуто путем использования индуцируемых систем Cre (например, тамоксифена)68. Другое потенциальное применение зависит от наличия трансгенных мышей, экспрессирующих флуоресцентные репортерные белки в шванновских клетках. Действительно, мыши S100-GFP69 и PLP-GFP70 позволяют проводить визуализацию клеток Шванна in vivo и / или in situ и находятся на переднем крае исследований, связанных с миграцией шванновских клеток во время регенерации периферических нервов.
В дополнение к этим применениям и дополнению мыши Mito.CFP является наличие нескольких трансгенных линий мыши, которые экспрессируют флуоресцентные белки в различных органеллах, таких как митохондрии и аутофагосомы. Например, исследование in vivo митохондриального транспорта может быть возможно с помощью мыши mito::mKate271 или фотоконвертируемой мыши mitoDendra57. Кроме того, перенос митофагосом in vivo может быть возможен с использованием pH-чувствительной мыши мито-Кейма72 и мыши73 мито-КК для анализа митофагии. Кроме того, трудности лизосомальной маркировки, с которыми мы столкнулись, могут быть преодолены с помощью мышей, экспрессирующих LAMP1-GFP, с оговоркой, что LAMP1 также присутствует в эндоцитарных органеллах, отличных от лизосом74.
Таким образом, мы предоставили новые способы оценки in vivo аксонального транспорта нескольких органелл в специфических аксонах периферических нервов у различных трансгенных мышей. Одновременная визуализация различных органелл будет особенно важна, учитывая недавние результаты аксональных взаимодействий и совместного оборота органелл, таких как митохондрии и эндосомы75,76. Мы считаем, что представленные методы будут полезны для улучшения понимания базальной физиологии аксонов in vivo и распутывания важных патомеханизмов, приводящих к нейродегенерации периферических нервов.
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Мы хотели бы поблагодарить Роберта М. Браунстоуна (Институт неврологии Queen Square, Университетский колледж Лондона) за то, что он поделился мышами ChAT-eGFP, ChAT.Cre и Rosa26.tdTomato, а также Пьетро Фратта (Институт неврологии Queen Square, Университетский колледж Лондона) за распространение HB9. Мышь GFP. Мы хотели бы поблагодарить Елену Р. Раймс, Шарлотту Дж.. Кремерс и Цюхан Ланг (Институт неврологии Queen Square, Университетский колледж Лондона) за критическое прочтение рукописи. Эта работа была поддержана младшей доклинической стипендией от Ассоциации заболеваний двигательных нейронов (Великобритания) (Tosolini/Oct20/973-799) (APT), наградой Wellcome Trust Senior Investigator Awards (107116/Z/15/Z и 223022/Z/21/Z) (GS), премией Фонда Научно-исследовательского института деменции Великобритании (GS); и премия Совета по медицинским исследованиям за развитие карьеры (MR/S006990/1) (JNS).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR tube | |||
| 70% (v/v) ethanol in distilled water | |||
| AlexaFlour555 C2 maleimide | ThermoFisher Scientific | A-20346 | Can also use AlexaFlour-488 or -647 Maleimide |
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J | Jackson Laboratory | 7909 | Rosa26.tdTomato mice |
| B6.Cg-Tg(Hlxb9-GFP)1Tmj/J mice | Jackson Laboratory | 5029 | HB9.GFP mice |
| B6.Cg-Tg(Thy1-CFP/COX8A)S2Lich/J mice | Jackson Laboratory | 7967 | Mito.CFP mice |
| B6;129S6-Chattm2(cre)Lowl/J mice | Jackson Laboratory | 6410 | ChAT.Cre mice |
| Computer with microscope control and image acquisition software | Zeiss | Zen | |
| Cotton swab | |||
| Desktop centrifuge | |||
| Dissecting microscope | |||
| Eye lubricant | |||
| Fine curved forceps | Dumont | ||
| Fine straight forceps | Dumont | ||
| Glass coverslip (22 x 64 mm, thickness no. 1) | |||
| Graduated, glass micropipette with microliter markings and plunger | Drummond Scientific | 5-000-1001-X10 | |
| Hair clippers | |||
| Hamilton microliter syringe (701 N, volume 10 μL, needle size 26 s G, bevel tip, needle L 51 mm) | Merck | 20779 | |
| HcT-441 | N/A | N/A | See Restani et al., 2012 for more details |
| Heating pad | |||
| Immersion oil for fluorescent imaging at 37 °C | |||
| Inverted confocal microscope with environmental chamber | Zeiss | LSM 780 | Most inverted confocals should be adaptable |
| Isoflurane | |||
| Isoflurane vaporizer/anesthesia machine with induction cham-ber and mask stabilizer | |||
| Magic tape | invisible tape | ||
| Micropipette puller | |||
| Parafilm | Parafilm | ||
| Phosphate-buffered saline (PBS): 137 mM NaCl, 10 mM Na2HPO4, 2.7 mM KCl, 1.8 mM KH2PO4–HCl, pH 7.4 | |||
| Recombinant human brain-derived neurotrophic factor (BDNF) | Peprotech | 450-02 | BDNF that can be co-injected with HcT-555 |
| Saline | |||
| Scalpel blade | Dumont | ||
| Small spring scissors | Dumont | ||
| Surgery/operating microscope | |||
| Surgical drape | |||
| Surgical suture | |||
| Surgical tape | |||
| Tg(Chat-EGFP) GH293Gsat/Mmucd mice | MMRRC | 000296-UCD | ChAT.eGFP |
| Vortex mixer |
Ссылки
- Webster, R. G. Animal models of the neuromuscular junction, vitally informative for understanding function and the molecular mechanisms of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (5), 1326 (2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models & Mechanisms. 4 (4), 457-467 (2011).
- De Giorgio, F., Maduro, C., Fisher, E. M. C., Acevedo-Arozena, A. Transgenic and physiological mouse models give insights into different aspects of amyotrophic lateral sclerosis. Disease Models & Mechanisms. 12 (1), 037424 (2019).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. The Journal of Cell Biology. 187 (6), 761-772 (2009).
- Brown, R. H., Al-Chalabi, A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 377 (2), 162-172 (2017).
- Gong, S., et al. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425 (6961), 917-925 (2003).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiological Genomics. 27 (3), 391-397 (2006).
- Zeilhofer, H. U., et al. Glycinergic neurons expressing enhanced green fluorescent protein in bacterial artificial chromosome transgenic mice. The Journal of Comparative Neurology. 482 (2), 123-141 (2005).
- Kaiser, T., Ting, J. T., Monteiro, P., Feng, G. Transgenic labeling of parvalbumin-expressing neurons with tdTomato. Neuroscience. 321, 236-245 (2016).
- Zheng, B., Sage, M., Sheppeard, E. A., Jurecic, V., Bradley, A. Engineering mouse chromosomes with Cre-loxP: range, efficiency, and somatic applications. Molecular and Cellular Biology. 20 (2), 648-655 (2000).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Bareyre, F. M., Kerschensteiner, M., Misgeld, T., Sanes, J. R. Transgenic labeling of the corticospinal tract for monitoring axonal responses to spinal cord injury. Nature Medicine. 11 (12), 1355-1360 (2005).
- Willems, J., et al. A CRISPR/Cas9-based genome editing toolbox for epitope tagging of endogenous proteins in neurons. PLoS Biology. 18 (4), 3000665 (2020).
- Huh, Y., Oh, M. S., Leblanc, P., Kim, K. -. S. Gene transfer in the nervous system and implications for transsynaptic neuronal tracing. Expert Opinion on Biological Therapy. 10 (5), 763-772 (2010).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: an approach to maximize uptake and transduction of spinal cord motor neurons. Scientific Reports. 6, 33058 (2016).
- Andrews, M. R. Gene therapy in the CNS-one size does not fit all. Gene Therapy. 28 (7-8), 393-395 (2021).
- Kügler, S. Tissue-specific promoters in the CNS. Methods in Molecular Biology. 1382, 81-91 (2016).
- Misgeld, T., Kerschensteiner, M., Bareyre, F. M., Burgess, R. W., Lichtman, J. W. Imaging axonal transport of mitochondria in vivo. Nature Methods. 4 (7), 559-561 (2007).
- Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., Ohsumi, Y. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker. Molecular Biology of the Cell. 15 (3), 1101-1111 (2004).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), 108697 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Maday, S., Twelvetrees, A. E., Moughamian, A. J., Holzbaur, E. L. F. Axonal transport: cargo-specific mechanisms of motility and regulation. Neuron. 84 (2), 292-309 (2014).
- Terenzio, M., Schiavo, G., Fainzilber, M. Compartmentalized signaling in neurons: from cell biology to neuroscience. Neuron. 96 (3), 667-679 (2017).
- Abouward, R., Schiavo, G. Walking the line: mechanisms underlying directional mRNA transport and localisation in neurons and beyond. Cellular and Molecular Life Sciences. 78 (6), 2665-2681 (2021).
- Sleigh, J. N., Rossor, A. M., Fellows, A. D., Tosolini, A. P., Schiavo, G. Axonal transport and neurological disease. Nature Reviews. Neurology. 15 (12), 691-703 (2019).
- Bronfman, F. C., Moya-Alvarado, G. BDNF/TrkB signaling endosomes mediate long-distance dendritic growth by activating CREB/PI3K-mTOR-dependent translation in neuronal cell bodies. BioRxiv. , (2020).
- Nagano, S., Araki, T. Axonal Transport and Local Translation of mRNA in Neurodegenerative Diseases. Frontiers in Molecular Neuroscience. 14, 697973 (2021).
- Boecker, C. A., Olenick, M. A., Gallagher, E. R., Ward, M. E., Holzbaur, E. L. F. ToolBox: Live Imaging of intracellular organelle transport in induced pluripotent stem cell-derived neurons. Traffic. 21 (1), 138-155 (2020).
- Surana, S., et al. The evolution of the axonal transport toolkit. Traffic. 21 (1), 13-33 (2020).
- Sleigh, J. N., Vagnoni, A., Twelvetrees, A. E., Schiavo, G. Methodological advances in imaging intravital axonal transport. F1000Research. 6, 200 (2017).
- Gibbs, K. L., Kalmar, B., Sleigh, J. N., Greensmith, L., Schiavo, G. In vivo imaging of axonal transport in murine motor and sensory neurons. Journal of Neuroscience Methods. 257, 26-33 (2016).
- Sleigh, J. N., Tosolini, A. P., Schiavo, G. In vivo imaging of anterograde and retrograde axonal transport in rodent peripheral nerves. Methods in Molecular Biology. 2143, 271-292 (2020).
- Gibbs, K. L., et al. Inhibiting p38 MAPK alpha rescues axonal retrograde transport defects in a mouse model of ALS. Cell Death & Disease. 9 (6), 596 (2018).
- Fellows, A. D., Rhymes, E. R., Gibbs, K. L., Greensmith, L., Schiavo, G. IGF1R regulates retrograde axonal transport of signalling endosomes in motor neurons. EMBO Reports. 21 (3), 49129 (2020).
- Bilsland, L. G., Sahai, E., Kelly, G., Golding, M., Greensmith, L., Schiavo, G. Deficits in axonal transport precede ALS symptoms in vivo. Proceedings of the National Academy of Sciences of the United States of America. 107 (47), 20523-20528 (2010).
- Kalinski, A. L., et al. Deacetylation of Miro1 by HDAC6 blocks mitochondrial transport and mediates axon growth inhibition. The Journal of Cell Biology. 218 (6), 1871-1890 (2019).
- Bercsenyi, K., et al. Tetanus toxin entry. Nidogens are therapeutic targets for the prevention of tetanus. Science. 346 (6213), 1118-1123 (2014).
- Deinhardt, K., et al. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron. 52 (2), 293-305 (2006).
- Debaisieux, S., Encheva, V., Chakravarty, P., Snijders, A. P., Schiavo, G. Analysis of signaling endosome composition and dynamics using SILAC in embryonic stem cell-derived neurons. Molecular & Cellular Proteomics. 15 (2), 542-557 (2016).
- Surana, S., et al. The travel diaries of tetanus and botulinum neurotoxins. Toxicon. 147, 58-67 (2018).
- Villarroel-Campos, D., Schiavo, G., Lazo, O. M. The many disguises of the signalling endosome. FEBS Letters. 592 (21), 3615-3632 (2018).
- Malik, B., et al. Absence of disturbed axonal transport in spinal and bulbar muscular atrophy. Human Molecular Genetics. 20 (9), 1776-1786 (2011).
- Sleigh, J. N., et al. Mice carrying ALS mutant TDP-43, but not mutant FUS, display in vivo defects in axonal transport of signaling endosomes. Cell Reports. 30 (11), 3655-3662 (2020).
- Tosolini, A. P., Sleigh, J. N., Surana, S., Rhymes, E. R., Cahalan, S. D., Schiavo, G. modulation of axonal transport is selectively impaired in ALS. BioRxiv. , (2021).
- Restani, L., et al. Botulinum neurotoxins A and E undergo retrograde axonal transport in primary motor neurons. PLoS Pathogens. 8 (12), 1003087 (2012).
- Mohan, R., Tosolini, A. P., Morris, R. Intramuscular injections along the motor end plates: a minimally invasive approach to shuttle tracers directly into motor neurons. Journal of Visualized Experiments: JoVE. (101), e52846 (2015).
- Tosolini, A. P., Mohan, R., Morris, R. Targeting the full length of the motor end plate regions in the mouse forelimb increases the uptake of fluoro-gold into corresponding spinal cord motor neurons. Frontiers in Neurology. 4, 58 (2013).
- Mohan, R., Tosolini, A. P., Morris, R. Targeting the motor end plates in the mouse hindlimb gives access to a greater number of spinal cord motor neurons: an approach to maximize retrograde transport. Neuroscience. 274, 318-330 (2014).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments: JoVE. (159), e60993 (2020).
- Boyer, N. P., Azcorra, M., Jung, P., Brown, A. Imaging and analysis of neurofilament transport in excised mouse tibial nerve. Journal of Visualized Experiments: JoVE. (162), e61264 (2020).
- Mou, Y., Mukte, S., Chai, E., Dein, J., Li, X. -. J. Analyzing mitochondrial transport and morphology in human induced pluripotent stem cell-derived neurons in hereditary spastic paraplegia. Journal of Visualized Experiments: JoVE. (156), e60548 (2020).
- Stoklund Dittlau, K., et al. Generation of human motor units with functional neuromuscular junctions in microfluidic devices. Journal of Visualized Experiments: JoVE. (175), e62959 (2021).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Bohnert, S., Schiavo, G. Tetanus toxin is transported in a novel neuronal compartment characterized by a specialized pH regulation. The Journal of Biological Chemistry. 280 (51), 42336-42344 (2005).
- Kanai, A., et al. Low-concentration lidocaine rapidly inhibits axonal transport in cultured mouse dorsal root ganglion neurons. Anesthesiology. 95 (3), 675-680 (2001).
- Bolea, I., Gan, W. -. B., Manfedi, G., Magrané, J. Imaging of mitochondrial dynamics in motor and sensory axons of living mice. Methods in Enzymology. , 97-110 (2014).
- Cohen, S., Valm, A. M., Lippincott-Schwartz, J. Multispectral live-cell imaging. Current Protocols in Cell Biology. 79 (1), 46 (2018).
- Blum, J. A., et al. Single-cell transcriptomic analysis of the adult mouse spinal cord reveals molecular diversity of autonomic and skeletal motor neurons. Nature Neuroscience. 24 (4), 572-583 (2021).
- Xu, J., et al. An approach to maximize retrograde transport based on the spatial distribution of motor endplates in mouse hindlimb muscles. Frontiers in Cellular Neuroscience. 15, 707982 (2021).
- Wang, T., et al. Flux of signalling endosomes undergoing axonal retrograde transport is encoded by presynaptic activity and TrkB. Nature Communications. 7, 12976 (2016).
- Chen, C. S., Chen, W. N., Zhou, M., Arttamangkul, S., Haugland, R. P. Probing the cathepsin D using a BODIPY FL-pepstatin A: applications in fluorescence polarization and microscopy. Journal of Biochemical and Biophysical Methods. 42 (3), 137-151 (2000).
- Cederholm, J. M. E., et al. Differential actions of isoflurane and ketamine-based anaesthetics on cochlear function in the mouse. Hearing Research. 292 (1-2), 71-79 (2012).
- Michelson, N. J., Kozai, T. D. Y. Isoflurane and ketamine differentially influence spontaneous and evoked laminar electrophysiology in mouse V1. Journal of Neurophysiology. 120 (5), 2232-2245 (2018).
- Knabbe, J., Nassal, J. P., Verhage, M., Kuner, T. Secretory vesicle trafficking in awake and anaesthetized mice: differential speeds in axons versus synapses. The Journal of Physiology. 596 (16), 3759-3773 (2018).
- Gong, S., et al. Targeting Cre recombinase to specific neuron populations with bacterial artificial chromosome constructs. The Journal of Neuroscience. 27 (37), 9817-9823 (2007).
- Arcourt, A., et al. Touch receptor-derived sensory information alleviates acute pain signaling and fine-tunes nociceptive reflex coordination. Neuron. 93 (1), 179-193 (2017).
- Valny, M., Honsa, P., Kirdajova, D., Kamenik, Z., Anderova, M. Tamoxifen in the mouse brain: implications for fate-mapping studies using the tamoxifen-inducible Cre-loxP system. Frontiers in Cellular Neuroscience. 10, 243 (2016).
- Hayashi, A., et al. A double-transgenic mouse used to track migrating Schwann cells and regenerating axons following engraftment of injured nerves. Experimental Neurology. 207 (1), 128-138 (2007).
- Chen, B., Chen, Q., Parkinson, D. B., Dun, X. -. P. Analysis of schwann cell migration and axon regeneration following nerve injury in the sciatic nerve bridge. Frontiers in Molecular Neuroscience. 12, 308 (2019).
- Barrasso, A. P., Tong, X., Poché, R. A. The mito::mKate2 mouse: A far-red fluorescent reporter mouse line for tracking mitochondrial dynamics in vivo. Genesis. 56 (2), (2018).
- Sun, N., et al. A fluorescence-based imaging method to measure in vitro and in vivo mitophagy using mt-Keima. Nature Protocols. 12 (8), 1576-1587 (2017).
- McWilliams, T. G., et al. mito-QC illuminates mitophagy and mitochondrial architecture in vivo. The Journal of Cell Biology. 214 (3), 333-345 (2016).
- Cheng, X. -. T., et al. Characterization of LAMP1-labeled nondegradative lysosomal and endocytic compartments in neurons. The Journal of Cell Biology. 217 (9), 3127-3139 (2018).
- Cioni, J. -. M., Lin, J. Q., et al. Late Endosomes Act as mRNA Translation Platforms and Sustain Mitochondria in Axons. Cell. 176 (12), 56 (2019).
- Liao, Y. -. C., Fernandopulle, M. S., et al. RNA Granules Hitchhike on Lysosomes for Long-Distance Transport, Using Annexin A11 as a Molecular Tether. Cell. 179 (1), (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены