Method Article
Гибкие органические электронные устройства для импульсной терапии глиобластомы электрическим полем
В этой статье
Резюме
В данной работе описывается разработка гибких межпальцевых электродов для реализации в 3D-моделях опухолей головного мозга, а именно, в культуре in vitro, в модели ovo и в мышиной модели in vivo. Предложенный метод может быть использован для оценки воздействия импульсных электрических полей на опухоли разного уровня сложности.
Аннотация
Глиобластому трудно искоренить с помощью стандартных методов лечения онкологии из-за ее высокой степени инвазивности. Биоэлектрические процедуры на основе импульсных электрических полей (ПЭФ) являются перспективными для повышения эффективности лечения. Однако они полагаются на жесткие электроды, которые вызывают острые и хронические повреждения, особенно в мягких тканях, таких как мозг. В этой работе гибкая электроника использовалась для доставки PEF к опухолям, а биологический ответ оценивался с помощью флуоресцентной микроскопии. Оцифрованные золотые электроды на тонкой прозрачной подложке с париленом-С были покрыты проводящим полимером PEDOT:PSS, в результате чего получилось соответствующее и биосовместимое устройство. Влияние ПЭФ на опухоли и их микроокружение было изучено с использованием различных биологических моделей. Во-первых, монослои клеток глиобластомы культивировали поверх электродов для исследования явлений in vitro. В качестве промежуточного этапа была разработана модель in ovo , в которой сконструированные опухолевые сфероиды были пересажены в эмбриональную оболочку перепела. Из-за отсутствия иммунной системы это приводило к сильно васкуляризированным опухолям. На этой ранней стадии развития эмбрионы не имеют иммунной системы, и опухоли не распознаются как инородные тела. Таким образом, они могут быстро развиваться, развивая свои собственные сосуды из существующей сосудистой системы эмбриона, которая представляет собой ценную 3D-модель рака. Наконец, гибкая электродная доставка PEF была оценена в полном организме с функциональной иммунной системой с использованием сингенной ортотрансплантатной (внутричерепной) мышиной модели. Опухолевые сфероиды были пересажены в мозг трансгенных мультифлуоресцентных мышей до имплантации гибких органических электродных устройств. Герметичное черепное окно позволило получить многофотонную визуализацию опухоли и ее микроокружения во время лечения PEF в течение нескольких недель.
Введение
Мультиформная глиобластома (GBM) является высокоинвазивной опухолью, поэтому ее трудно искоренить с помощью стандартных методов лечения, таких как резекция, лучевая терапия и химиотерапия. Несмотря на мультимодальное лечение, прогноз остается очень плохим, и у большинства пациентов наблюдается прогрессирование заболевания в течение 1 года после постановкидиагноза 1,2. В последнее время развитие биоэлектрических методов лечения показало большой потенциал для улучшения существующих методов лечения. Эти методы лечения используют доставку импульсных электрических полей (PEF), как правило, за один сеанс лечения, чтобы нарушить целостность клеточной мембраны и микроокружение опухолей. Это разрушение клеточной мембраны, также известное как электропорация, может быть обратимым или необратимым в зависимости от напряженности электрического поля и количества импульсов. Необратимая электропорация (IRE) применяется как метод нетермической абляции тканей, при котором электрические импульсы вызывают фатальное повреждение клеточных мембран, что приводит к гибели клеток3. Обратимая электропорация применяется в электрохимиотерапии (ЭСТ), установленном методе, который состоит из доставки PEF в сочетании с химиотерапевтическими препаратами для усиления поглощения лекарств раковыми клетками4. Более того, недавние исследования продемонстрировали электропорацию кальция как альтернативу ЭСТ с высокой эффективностью для лечения рака, которая также является недорогой и вызывает меньше побочных эффектов5. Несмотря на эти многообещающие достижения, PEF обычно применяются с использованием жестких металлических электродов, которые, как известно, вызывают повреждение мягких тканей6. Мозг особенно чувствителен к таким инвазивным устройствам, где механическое несоответствие вызывает воспаление и рубцевание астроглии7.
В этом контексте представлена гибкая система доставки PEF в сочетании с 3D-моделями опухолей глиобластомы, от микрофабрикации до мышиной модели. Конформные электроды изготавливаются с использованием стандартных процессов тонкопленочного микропроизводства, включая использование мягких и биосовместимых материалов, таких как парилен-С, золото и PEDOT: PSS 8,9. Конструкция электрода с промежуточным оцифрованием используется для покрытия большой площади поверхности, сохраняя при этом достаточную прозрачность для визуализации между пальцамиэлектрода 10. Для модели опухоли 3D-сфероиды клеток глиобластомы, экспрессирующие генетически кодируемый флуоресцентный репортер, получают с использованием вариации метода 96-луночной пластины с наложением жидкости11. Сфероиды прививаются к хориоаллантоисной мембране эмбриона перепела, в результате чего получается модель in ovo, которая широко используется для изучения ангиогенеза или лекарственной токсикологии12,13. Опухоли могут быть пересажены и васкуляризированы сосудистой сетью эмбриона при отсутствии иммунной системы на этой стадии эмбрионального развития12. Затем гибкие электроды помещаются поверх васкуляризированной опухоли для изучения влияния доставки PEF на сфероид и его сосудистую сеть. Наконец, эти эффекты исследуются на полном живом организме, включая микроокружение опухоли и иммунную систему, путем имплантации сконструированных сфероидов в паренхиму мозга мышиных моделей14. Гибкие электроды помещаются поверх места введения, а трепанация черепа герметизируется стеклянным окном, что позволяет повторять двухфотонную визуализацию в течение нескольких недель.
Эти методы будут полезны для людей, интересующихся различными областями, начиная от микроэлектроники и заканчивая приложениями в онкологии. Протокол микрофабрикации может быть использован и адаптирован для любого применения, требующего тонкопленочных металлических электродов, покрытых PEDOT:PSS. Кроме того, биологические модели, разработанные для оценки противоопухолевого электрического лечения, будут представлять общий интерес для исследования дифференциации клеточного, сосудистого и иммунного ответа на имплантированные материалы.
протокол
Все экспериментальные процедуры были выполнены в соответствии с французским законодательством и в соответствии с Директивой Совета Европейского сообщества от 24 ноября 1986 года (86/609/EEC) по уходу за лабораторными животными и их использованию. Исследование на животных было санкционировано Департаментом ветеринарных услуг Буш-дю-Рон и одобрено этическим комитетом Прованса Лазурного берега (Apafis # 22689-2019100414103054).
1. Гибкое микропроизводство устройств (рис. 1)
- Очистка предметных стекол
- Ультразвуковое стекло помещают в 2% мыльный раствор в течение 15 мин. Промойте их водой.
- Снова обработайте ультразвуком в смеси 80% чистого ацетона и 20% чистого изопропанола в течение 15 мин.
ВНИМАНИЕ: Эти растворители вредны и легко воспламеняются. Надевайте средства индивидуальной защиты (СИЗ) и обращайтесь с ними под вытяжным шкафом. - Промойте предметные стекла изопропанолом и высушите воздушным пистолетом.
ПРИМЕЧАНИЕ: Следите за тем, чтобы ацетон не высыхал на подложках в течение всего процесса.
- Рисунок золотого электрода (Рисунок 1А)
- Нанесите слой парилена-C (PaC) размером 3 мкм с помощью системы париленового осаждения (рис. 1Aa).
- Поместите очищенные предметные стекла в камеру осаждения. Распылите мыло на чиллер, дайте ему высохнуть и вставьте его в назначенную холодную ловушку системы осаждения. Этот антиадгезивный материал облегчает удаление PaC из чиллера после осаждения.
ВНИМАНИЕ: PaC является раздражителем и представляет опасность для здоровья. При работе с ним надевайте перчатки. - Взвесьте 6 г PaC в алюминиевую лодку и поместите ее в печь. Откачайте машину (P = 10 мТорр) и начните осаждение со следующими параметрами: Tчиллер = -100 °C, Tпечь = 690 °C,T испаритель = 175 °C и Tкамера = 135 °C.
- Когда осаждение будет завершено и температура испарителя станет ниже 40 °C, выключите чиллер, испаритель и печь. Проветрите машину и соберите образцы.
- Поместите очищенные предметные стекла в камеру осаждения. Распылите мыло на чиллер, дайте ему высохнуть и вставьте его в назначенную холодную ловушку системы осаждения. Этот антиадгезивный материал облегчает удаление PaC из чиллера после осаждения.
- Активируйте поверхность образцов кислородно-плазменной обработкой в течение 30 с (100 Вт, 50 sccm).
- Нанесите спин-покрытие на обработанные плазмой образцы негативным фоторезистом при 1,000 x g в течение 40 с. Поместите образцы на горячую плиту при температуре 110 °C на 2 минуты (рис. 1Ab).
ВНИМАНИЕ: Раствор фоторезиста легко воспламеняется и вызывает раздражение; носить СИЗ и обращаться с ними под вытяжным шкафом. - Поместите i-линейный фильтр в линию луча широкополосного УФ-контактного выравнивателя и экспонируйте фоторезист через маску с межпальцевым электродом (рис. 1Ac).
ПРИМЕЧАНИЕ: Межпальцевые электроды с зазором 50 или 250 мкм были разработаны с использованием редактора макета, а фотошаблоны были заказаны у компании, которая производит полиэфирные фотошаблоны методом лазерного фотоплотирования. - Выпекайте вышеуказанные образцы при температуре 110 °C на горячей плите в течение 3 минут и дайте им остыть до комнатной температуры в течение 5 минут. Погрузите образцы в проявитель, не содержащий ионов металлов, на 3 минуты, чтобы удалить неэкспонированный фоторезист. Промойте образцы водой и высушите их с помощью пневматического пистолета (рис. 1Ad).
ВНИМАНИЕ: Решение разработчика является раздражителем; носить СИЗ и ручку под вытяжным шкафом. - Активируйте поверхность образцов кислородно-плазменной обработкой в течение 60 с (100 Вт, 50 sccm).
- Нанесите слой адгезии 20 нм хрома и слой золота 300 нм с помощью термического испарителя следующим образом (рис. 1Ae).
- Выпустите воздух из испарителя и закрепите образцы (лицевой стороной вниз) на верхней круглой пластине металлическими винтами. Наполните выделенные тигли, соответственно, хромом и золотом. Запечатайте и откачайте машину, чтобы достичь давления ниже 5·10-6 торр. Начните вращение держателя образца.
- Выберите тигель, содержащий хром, и медленно увеличивайте ток, проходящий через него, пока не будет достигнута скорость осаждения 0,2 Å·s-1 . Откройте затвор и подождите, пока не отложится 20 нм хрома. Закройте затвор и медленно убавьте ток до 0 мА.
- Выберите тигель, содержащий золото, и медленно увеличивайте ток, проходящий через него, пока не будет достигнута скорость осаждения 0,2 Å·s-1 . Откройте заслонку, чтобы испарить золото, подождите, пока не будет осаждено 10 нм золота, а затем увеличьте скорость осаждения до 1,5 Å·s-1 , пока не будет осаждено примерно 300 нм. Закройте затвор и медленно уменьшите ток до 0 мА.
- Дайте образцам остыть до комнатной температуры в течение 15 минут после осаждения. Остановите вращение держателя образца, проветрите машину и соберите образцы.
- Погрузите образцы в стакан с ацетоном. Поместите стакан на встряхивающую пластину, установленную при 110 об/мин, на 15 минут, чтобы снять фоторезист. Промойте образцы изопропанолом и высушите их с помощью пневматического пистолета (рис. 1Af).
- Активируйте поверхность образцов кислородно-плазменной обработкой в течение 30 с (100 Вт, 50 sccm).
- Наносят изоляционный слой PaC толщиной 3 мкм с помощью системы париленового осаждения (см. этап 1.2.1) (рис. 1Ag).
- Нанесите слой парилена-C (PaC) размером 3 мкм с помощью системы париленового осаждения (рис. 1Aa).
- Контурное отверстие (рис. 1B)
- Нанесите на образцы положительное фоторезист при 600 x g в течение 35 с. Поместите его на горячую плиту при температуре 110 °C на 2 минуты (рис. 1Ba).
ВНИМАНИЕ: Раствор фоторезиста легко воспламеняется и вызывает раздражение; носить СИЗ и ручку под вытяжным шкафом. - Убедитесь, что в линии луча широкополосного УФ-контактного выравнивателя нет фильтра i-line, и экспонируйте фоторезист через маску, которая очертает контур устройства с помощью широкополосного УФ-контактного выравнивателя (рис. 1Bb).
- Погрузите образцы в проявитель, не содержащий ионов металлов, на 4 минуты, чтобы удалить экспонированный фоторезист. Промойте образцы водой и высушите их с помощью пневматического пистолета (рис. 1Bc).
- Вытравите контур через два слоя PaC с помощью реакционноспособного ионного травителя (160 Вт, 22 мин, O2: 50 sccm, CF4: 10 sccm) (рис. 1Bd).
- Удалите остатки фоторезиста ацетоном, промойте изопропанолом и высушите образцы пневматическим пистолетом.
- Нанесите на образцы положительное фоторезист при 600 x g в течение 35 с. Поместите его на горячую плиту при температуре 110 °C на 2 минуты (рис. 1Ba).
- PEDOT: покрытие PSS (рис. 1C)
- Нанесите 2% раствор мыла в дозе 70 x g в течение 35 с (рис. 1Ca).
- Осаждают жертвенный слой PaC размером 3 мкм с помощью системы париленного осаждения (см. этап 1.2.1) (рис. 1Cb).
- Положительный фоторезист с спиновым покрытием при 600 x g в течение 35 с. Поместите образцы на горячую плиту при температуре 110 °C на 2 минуты (рис. 1Cc).
- Убедитесь, что в линии луча широкополосного УФ-выравнивателя контактов нет фильтра i-line, и обнажайте фоторезист через маску, которая имеет активную поверхность электродов (рис. 1Cd).
- Погрузите образцы в проявитель, не содержащий ионов металлов, на 4 минуты, чтобы удалить экспонированный фоторезист. Промойте образцы водой и высушите их с помощью пневматического пистолета (рис. 1Ce).
- Протравите PaC реактивным ионным травителем, чтобы открыть активную поверхность электродов (160 Вт, 24 мин, Ø2:50 sccm, CF4:10 sccm). Проверьте с помощью микроскопа, что на активной поверхности нет остаточного PaC (рис. 1Cf).
- Удалите остатки фоторезиста ацетоном, промойте изопропанолом и высушите образцы с помощью пневматического пистолета.
- Активируйте поверхность образцов с помощью кислородно-плазменной обработки в течение 90 с (100 Вт, 50 sccm).
- Смешайте коммерческую дисперсию химически полимеризованного PEDOT:PSS с 5 об.% этиленгликоля (EG) и 0,1 об.% додецилбензолсульфоновой кислоты (DBSA). Обработка ультразвуком в течение 15 мин. Добавьте 1 мас.% (3-глицидилоксипропил) триметилсилоксана (GOPS) и ультразвук в течение 5 минут. Отфильтруйте раствор через фильтр 1,2 мкм.
ВНИМАНИЕ: ЭГ является раздражителем и представляет опасность для здоровья. DBSA является раздражающим и коррозионным средством. GOPS вызывает коррозию. Наденьте соответствующие СИЗ и обрабатывайте эти химикаты под вытяжным шкафом.
ПРИМЕЧАНИЕ: Общий объем зависит от количества образцов. Для 10 стандартных предметных стекол приготовьте не менее 20 мл, что соответствует следующим количествам: 18,78 мл PEDOT:PSS, 1 мл EG, 20 мкл DBSA и 200 мкл GOPS. - Нанесите четыре слоя раствора PEDOT:PSS при 150 x g в течение 35 с. После осаждения каждого слоя выпекайте образцы при 110 °C в течение 60 с на горячей плите и охлаждайте их до комнатной температуры в течение 5 минут перед прядением следующего слоя (рис. 1Cg).
- Удалите жертвенный слой PaC, погрузив образцы в воду (рис. 1Ch).
- Выпекайте образцы при 140 °C в течение 1 часа.
- Погрузите образцы в деионизированную воду на 30 минут, чтобы удалить остатки мыла и низкомолекулярных соединений в пленке PEDOT:PSS и отделить образцы от стеклянной подложки (рис. 1Ci).
- Соединения и упаковка (рис. 1D)
- Нанесите тонкий слой акриловой краски на полиимидную пленку, покрытую медью (рис. 1Da). Используйте аэрозоль для получения однородного слоя краски (рис. 1Db).
- Нанесите акриловую краску лазером (75 кГц, 7 Вт, 1 проход лазера, 400 мм·с-1), чтобы получить две прямоугольные контактные площадки (5 мм x 15 мм; зазор 1,5 мм) (рис. 1Dc).
- Влажное травление меди насыщенным 30% (мас./об.) хлоридом железа (FeCl3) в воде в течение 15 мин при 40 °C (рис. 1Dd).
ВНИМАНИЕ: FeCl3 является раздражающим и коррозионным средством; Обрабатывайте его в перчатках под вытяжным шкафом. - Снимите акриловую краску с ацетоном, слегка потерев ее тряпочкой (рис. 1De).
- Разрежьте полиимидную пленку с рисунком на прямоугольные формы (15 мм x 30 мм) с помощью лазера (15 кГц, 10 Вт, 30 лазерных проходов, 130 мм·с-1) (рис. 1Df).
- Дозируйте серебряную пасту с помощью трехосевой дозирующей машины под давлением три бар с помощью иглы диаметром 330 мкм (5 м·мин-1) (рис. 1Dg).
ВНИМАНИЕ: Серебряная паста является раздражителем; Обращаться в перчатках. - Совместите и прикрепите зонд PaC к полиимидной пленке под бинокулярным микроскопом с помощью пинцета (рис. 1Dh).
ПРИМЕЧАНИЕ: Метки выравнивания могут быть нанесены на шаге 1.5.2 для облегчения позиционирования датчика на контактных площадках. - Выпекать при температуре 140 °C 2 часа в духовке.
- Поместите полиимидную защитную ленту толщиной 1 см2 на контактные площадки (рис. 1Di).
- Погрузите интерфейс, к которому подключены датчик PaC и полиимидная пленка, в PDMS (рис. 1Dj).
- Выпекать 2 часа при температуре 50 °C.
- Снимите защитную ленту, чтобы открыть контактные площадки (рис. 1Dk).
ПРИМЕЧАНИЕ: Микропроизводство устройств in vitro аналогично, но шаги 1.2.1, 1.3 и 1.5 должны быть пропущены.
2. Генерация стабильной клеточной линии глиобластомы GCaMP6f
- Производство лентивирусов
- В колбе размером 75 см² культивируйте клеточную линию, полученную из HEK 293T, оптимизированную для производства лентивируса, в 10 мл модифицированной орлиной среды (DMEM) Dulbecco, содержащей 4,5 г· L-1 глюкозы, L-глютамина, пирувата натрия и бикарбоната натрия и дополненный 10% фетальной бычьей сывороткой без тетрациклина (FBS), 100 единиц · мл-1 пенициллина и 100 мкг · мл-1 стрептомицина в течение как минимум 3 дней до 80% слияния.
- Извлеките средство из колбы. Аккуратно промойте клетки 10 мл фосфатно-буферного физиологического раствора (PBS).
- Добавьте 1 мл 0,25% раствора трипсина/ЭДТА и инкубируйте колбу в течение 5 минут при 37 ° C.
ВНИМАНИЕ: Раствор трипсина / ЭДТА представляет опасность для здоровья; носить СИЗ и ручку под вытяжным шкафом. - Добавьте 8 мл питательной среды. Аккуратно промойте клеточную суспензию.
- Подсчитайте клетки и планшет 4 х 106 клеток в чашке Петри в 8 мл питательной среды.
- На следующий день разбавьте 25 мкг плазмиды, содержащей ген GCaMP6f и маркер отбора, придающий устойчивость к пуромицину, в общем объеме 600 мкл воды. Добавьте его в тюбик с трансфекционным реагентом. Встряхните в течение 10 с при 3000 об/мин и инкубируйте трубку при комнатной температуре в течение 10 мин, чтобы обеспечить образование наночастиц.
- Добавьте содержимое пробирки по каплям на культуру Т-клеток HEK 293 и осторожно измельчите вручную. Инкубировать клетки при 37 °C не менее 4 ч.
- Замените среду, содержащую комплексы наночастиц, свежей средой и верните ячейки при 37 ° C.
- Через три дня соберите надосадочную жидкость и центрифугу в дозе 500 x g в течение 10 мин, чтобы удалить клеточный мусор. Соберите жидкую фазу, содержащую вирусные частицы.
ПРИМЕЧАНИЕ: Продукция вируса в надосадочной жидкости может быть подтверждена с помощью количественного теста на лентивирусный титр и может храниться при -80 ° C не менее 2 лет.
- Трансдукция клеток глиобластомы
- В колбе объемом 75 см² культивируют клетки глиобластомы в 10 мл DMEM, содержащего 1 г· L-1 глюкозы, L-глютамина, пирувата натрия и бикарбоната натрия с добавлением 10% FBS без тетрациклина, 100 единиц · мл-1 пенициллина и 100 мкг · мл-1 стрептомицина в течение не менее 4 дней.
- Откажитесь от среды и добавьте надосадочную жидкость, полученную на шаге 2.1.9, на клетки-мишени.
- Добавьте 5 мкг·мл-1 бромида гексадиметрина в среду для улучшения трансдукции. Выдерживать 6 ч при 37 °C. Замените среду 10 мл свежей среды.
ВНИМАНИЕ: Гексадиметрин бромид является раздражителем. Обращайтесь с ним в перчатках.
- Генерация стабильной клеточной линии
- Через два-три дня после трансдукции добавьте 10 мл ДМЭМ, содержащего 1 г· L-1 глюкозы, L-глютамина, пирувата натрия и бикарбоната натрия, 10% FBS, 100 единиц · мл-1 пенициллина, 100 мкг · мл-1 стрептомицина и дополненный пуромицином для уничтожения нетрансдуцированных клеток. Культивируют клетки в этой среде не менее 3 дней.
ВНИМАНИЕ: Пуромицин является раздражителем; Обращайтесь с ним в перчатках.
ПРИМЕЧАНИЕ: Чувствительность клеток к пуромицину должна быть проверена перед трансдукцией путем культивирования клеток в их рекомендуемой среде, содержащей различные концентрации пуромицина. Через день проверьте клетки под микроскопом. Выберите адекватную концентрацию, при которой большинство клеток мертвы, но лишь немногие еще живы, чтобы гарантировать, что антибиотик не слишком токсичен и может убить трансфицированные клетки. - Удалите среду и промойте клетки 10 мл PBS.
- Добавьте 1 мл 0,25% раствора трипсина/ЭДТА и инкубируйте колбу в течение 5 минут при 37 ° C.
- Добавьте 8 мл питательной среды. Аккуратно промойте клеточную суспензию.
- Соберите 100 мкл клеточной суспензии и измерьте концентрацию клеток с помощью счетчика клеток. Аспирируйте 50 мкл клеточной суспензии в портативном автоматизированном счетчике ячеек с датчиком 60 мкм.
- Засейте 1 ячейку/лунку в тарелку на 96 лунок. Например, для концентрации 1 х 10 3 клеток на мл добавляют 1/(1 х 103), т. е. 0,001 мл клеточной суспензии на лунку. Сейте каждую лунку, чтобы увеличить шансы на успех. В комплекте с питательной средой для достижения общего объема 200 мкл на лунку.
- Через день найдите каждую лунку, содержащую одну клетку, и проверьте ее флуоресценцию (λexc = 490 нм и λem = 530 нм). Отметьте лунки, содержащие только одну трансфицированную ячейку. Продолжайте рост в течение нескольких дней, пока колодец не станет почти сливающимся.
- Выбросьте средство и промойте клетки 200 мкл PBS. Добавьте 100 мкл 0,25% раствора трипсина/ЭДТА и инкубируйте 96-луночную пластину в течение 5 мин при 37 ° C.
- Добавьте 100 мкл среды и аккуратно промойте клеточную суспензию. Перенесите клеточную суспензию в чашку Петри. Добавьте 5 мл среды и дайте клеткам расти в течение нескольких дней, пока чашка Петри не станет почти сливающейся.
- Выбросьте средство и промойте клетки 5 мл PBS. Добавьте 1 мл 0,25% раствора трипсина/ЭДТА и инкубируйте чашку Петри в течение 5 минут при 37 ° C.
- Добавьте 6 мл среды и аккуратно промойте клеточную суспензию. Переложите клеточную суспензию в колбу Т25. Продолжайте рост в течение нескольких дней, пока колба не станет почти сливающейся.
- Выбросьте средство и промойте клетки 5 мл PBS. Добавьте 1 мл 0,25% раствора трипсина/ЭДТА и инкубируйте колбу T25 в течение 5 мин при 37 °C. Добавьте 7 мл ДМЭМ, содержащего 1 г· L-1 глюкозы, L-глютамина, пирувата натрия и бикарбоната натрия с добавлением 10% FBS, 100 единиц · мл-1 пенициллина и 100 мкг · мл-1 стрептомицина. Аккуратно промойте клеточную суспензию.
- Разделите клеточную суспензию на четыре колбы T25 (2 мл на колбу) и добавьте 5 мл среды в каждую колбу. Дайте клеткам расти в течение нескольких дней, пока колбы почти не сольются.
- Повторите шаг 2.3.12 для трех колб и оставьте последнюю колбу для шага 3.1.3. Переведите клеточную суспензию в коническую пробирку объемом 15 мл и центрифугу при 150 x g в течение 5 мин. Выбросьте надосадочную жидкость и ресуспендируйте клеточную гранулу в 900 мкл. Аккуратно перемешайте клетки, чтобы сохранить однородную клеточную суспензию.
- Переведите клеточную суспензию во флаконы для криогенного хранения. Добавьте 100 мкл диметилсульфоксида. Поместите криовиалы на ночь при температуре -80 °C. Перенесите замороженные клетки на жидкий азот для дальнейших экспериментов.
ПРИМЕЧАНИЕ: Эффективность трансфекции можно оценить, добавив 5 мкМ иономицина кальциевой соли в среду и проверив индуцированное увеличение флуоресценции под флуоресцентным микроскопом (λexc = 490 нм и λem = 530 нм).
- Через два-три дня после трансдукции добавьте 10 мл ДМЭМ, содержащего 1 г· L-1 глюкозы, L-глютамина, пирувата натрия и бикарбоната натрия, 10% FBS, 100 единиц · мл-1 пенициллина, 100 мкг · мл-1 стрептомицина и дополненный пуромицином для уничтожения нетрансдуцированных клеток. Культивируют клетки в этой среде не менее 3 дней.
3.3D модели
- Сфероидная культура
- Приготовьте раствор 1% (мас./об.) агарозы в деионизированной (DI) воде.
- Добавьте 100 г порошка агарозы в 100 мл деионизированной воды и нагрейте раствор в микроволновой печи до полного растворения порошка. Регулярно помешивайте раствор, чтобы не было комков. Автоклавируют раствор в течение 20 мин при 120 °С.
- После извлечения из автоклава осторожно добавьте 75 мкл раствора агарозы на лунку в 96-луночную пластину. Отложите его сбоку от лунки, чтобы образовался мениск, в результате чего получится неприлипшее круглое дно. Дайте ему застыть в течение 15 минут при комнатной температуре.
- Отсоедините ячейки (этап 2.3.12) от колбы, полученной на шаге 2.3.14.
- Добавьте 10 000 клеток в лунку клеток глиобластомы и завершите до достижения общего объема 150 мкл на лунку с DMEM, содержащим 1 г· L-1 глюкозы, L-глютамина, пирувата натрия и бикарбоната натрия с добавлением 10% фетальной бычьей сыворотки (FBS), 100 единиц · мл-1 пенициллина и 100 мкг · мл-1 стрептомицина.
- Инкубируйте клетки при 37 °C, не перемещая пластину, в течение 3 дней. Затем заменяйте половину среды свежей средой каждые 2 дня с помощью многоканальной пипетки до дальнейших экспериментов. Держите наконечник пипетки в верхней части лунки, чтобы избежать повреждения агарозы или самого сфероида.
ПРИМЕЧАНИЕ: Размер сфероидов зависит от количества засеянных клеток и клеточной линии, поэтому его необходимо адаптировать в зависимости от экспериментов.
- Приготовьте раствор 1% (мас./об.) агарозы в деионизированной (DI) воде.
- Модель in ovo
- Оплодотворенные яйца японских перепелов (C. japonica) помещают в инкубатор (37 °C и влажность 57%) на лотки с автоматическим ротатором, который переворачивает яйца каждые 2 часа. Этот день считается эмбриональным днем (ЭД) 0.
- Вымойте пластиковые лодки для взвешивания, поместив их в 70% (мас./об.) этанола. Выньте лодки для взвешивания и высушите их под вытяжным шкафом.
ПРИМЕЧАНИЕ: С этого момента эксперименты не проводятся в стерильных условиях. Тем не менее, чистые условия необходимы, чтобы избежать развития плесени на эмбрионах. - На ED3 аккуратно откройте яйца с помощью пинцета с тонкими кончиками, предварительно промытого 70% (мас./об.) этанола. Вылейте эмбрион в пластиковую лодку для взвешивания, накройте ее другой лодкой для взвешивания и поместите в стандартный увлажненный инкубатор при температуре 37 °C на 3 дня.
- На ED6 сделайте небольшой разрез в хориоаллантоисной мембране (CAM) иглой 23 G.
- С помощью пипетки поместите 7-дневный сфероид на разрез и верните эмбрион в инкубатор на 3 дня до дальнейших экспериментов.
ПРИМЕЧАНИЕ: Флуоресцентный краситель может быть введен в глаз эмбриона для визуализации кровеносных сосудов. - В день эксперимента поместите гибкий зонд поверх васкуляризированной опухоли с помощью микроманипулятора.
- Тем in vivo модель
ПРИМЕЧАНИЕ: Эта часть протокола адаптирована из ранее опубликованной в ссылке14. Использовались взрослые многоцветные флуоресцентные мыши AMU-Neuroinflam (B6.Cg-Tg(Thy1-CFP)23Jrs(Ly6a-EGFP)G5Dzk(Itgax-EYFP)1Mnz/FD); эти мыши представляют собой маркировку субпопуляции Thy1+ нейроны трансгенной экспрессией ECFP, мечением периферических LyzM+ воспалительные клетки путем трансгенной экспрессии EGFP и мечения подтипа микроглии, экспрессирующей EYFP под контролем Cd11c+. Короче говоря, животных слегка успокаивают 1,5% изофлураном в течение 2 минут перед любым лечением или инъекцией. Перед операцией животным делают анестезию кетамином (120 мг/кг; IP) и ксилазин (12 мг/кг; ИП). Затем 3% гель Лидокаина наносится локально, чтобы облегчить любую боль в ушах, связанную с фиксацией стереотаксической опоры. Затем 0,25% раствор бупивакаина вводят в место операции, чтобы облегчить боль из-за трепанации черепа. После того, как мышь была подготовлена к операции, была выполнена трепанация черепа диаметром 4 мм в соответствии с референсом14. С помощью иглы 26 G было сделано отверстие в твердой мозговой оболочке в середине трепанации черепа, и в сфероид опухоли вводили инъекционную систему, описанную в ссылке14. Кроме того, как описано здесь, гибкий электрод был помещен на GCamp6 или DsRed, экспрессирующий опухолевый сфероид, перед герметизацией трепанации черепа стеклянным окном.- Поместите каплю фосфатно-буферного физиологического раствора Дульбекко (DPBS) так, чтобы он покрывал трепанацию черепа. Поместите гибкий электрод на каплю DPBS и аккуратно поместите заднюю часть зонда с контактными площадками на спину мыши (рис. 4B).
ПРИМЕЧАНИЕ: Используйте стерильные перчатки и технику «только наконечник». Смените перчатки при контакте с нестерильной поверхностью. Обеспечьте тепловую поддержку во время этой процедуры. - Прикоснитесь к капле DPBS небольшим листом бумаги, чтобы поглотить DPBS, пока зонд не сможет лечь плашмя на твердую мозговую оболочку и следить за кривизной мозга. Убедитесь, что небольшой слой DPBS остается под электродами, не выходя со стороны электрода. Это обеспечивает барьер от утечки клея на следующих этапах.
ПРИМЕЧАНИЕ: Стерилизуйте все оборудование перед использованием. - Нанесите небольшую каплю силиконового клея на зонд и накройте его круглым покровным стеклом диаметром 5 мм. Надавите на покровное стекло до тех пор, пока силикон не распределится равномерно, а расстояние между покровным стеклом и зондом не станет минимальным. Надавите на покровное стекло еще на 30 секунд, чтобы силикон затвердел.
- Чтобы закрепить покровное стекло, быстро нанесите суперклей на его бока и надавите на него, пока клей не затвердеет.
- Используя зубочистку, нанесите суперклей на горловину зонда, следя за тем, чтобы суперклей попал под шею, чтобы обеспечить ему стабильную поддержку.
- Покройте череп зубным цементом, чтобы создать хронический колпачок. Будьте особенно осторожны, чтобы закрыть только края покровного стекла.
- Поднимите заднюю часть зонда и нанесите цемент под горловину зонда. Положите зонд на цемент до того, как он затвердеет. Аккуратно надавите на горловину зонда тупыми щипцами так, чтобы его поверхность находилась на том же уровне, что и у покровного стекла, и не мешала объективу микроскопа во время эксперимента.
- Покройте верхнюю часть горловины зонда не более чем 1,5 мм слоем стоматологического цемента, чтобы обеспечить надежную фиксацию зонда. Постройте цементный колодец, представляющий собой гребень диаметром 1,5 мм на расстоянии 1-2 мм вокруг покровного стекла, чтобы создать бассейн для погружной жидкости для двухфотонной визуализации (рис. 4C).
- После того, как цемент затвердеет, применяют бупренорфин послеоперационные анальгетики (0,05 мг / кг, 0,1 мл на 10 г массы тела подкожно) и поддерживайте животное в теплой атмосфере, пока оно не проснется. Это включает в себя близость к инфракрасной лампочке, а также заворачивание животного в бумажное полотенце.
ПРИМЕЧАНИЕ: Поместите термометр на уровень мыши, чтобы следить за температурой. - Охарактеризуйте импеданс в диапазоне 1-10 кГц с помощью потенциостата.
- Дайте животному восстановиться после операции не менее 10 дней. Вводите противовоспалительные препараты сразу после операции и продолжайте следить за состоянием животного, чтобы обеспечить соответствующую послеоперационную анальгезию.
- Поместите каплю фосфатно-буферного физиологического раствора Дульбекко (DPBS) так, чтобы он покрывал трепанацию черепа. Поместите гибкий электрод на каплю DPBS и аккуратно поместите заднюю часть зонда с контактными площадками на спину мыши (рис. 4B).
4. Доставка и визуализация импульсного электрического поля (PEF)
- Поместите образцы под флуоресцентный микроскоп. В случае 3D-моделей опухоли можно наблюдать только сверху.
ПРИМЕЧАНИЕ: Для модели in ovo эксперименты проводились под эпифлуоресцентным микроскопом (но также возможно с двухфотонным микроскопом), тогда как эксперименты с моделью in vivo проводились под двухфотонным микроскопом (рис. 6). - Подключите генератор импульсов к контактным площадкам устройств, используя пого-контактные разъемы (in vitro) или зажимы типа «крокодил» (in ovo и in vivo) (рис. 4A). Установите желаемые параметры (количество импульсов, напряжение, длительность импульса, частоту) и примените PEF, запустив генератор (рис. 4А). Измеряйте флуоресценцию одновременно, чтобы наблюдать за эффектами PEF в режиме реального времени.
Результаты
Этот протокол позволяет применять его к двум моделям глиобластомы, в которые интегрирована гибкая система доставки PEF. После этапов микроизготовления и упаковки гибкие электроды характеризуются в солевом растворе с помощью электрохимической импедансной спектроскопии (EIS) для оценки и проверки их характеристик. Электроды с покрытием PEDOT: PSS показывают типичные емкостные и резистивные области, разделенные частотой среза, тогда как электроды без покрытия демонстрируют только емкостное поведение (рис. 2).
Разновидность метода 96-луночной пластины с жидкостным наложением используется для выращивания 3D-опухолей из трансфицированных клеток глиобластомы, стабильно экспрессирующих флуоресцентный внутриклеточный репортер кальция. Рост сфероидов можно наблюдать с помощью светлопольного микроскопа (рис. 3; ЭД 0). Для получения сферических и плотных сфероидов необходимо не менее 2 или 3 дней, в зависимости от клеточной линии и количества засеянных клеток.
В модели in ovo сфероиды прививаются в хориоаллантоисную оболочку зародыша перепела (рис. 3; ЭД 6). Успех трансплантата можно оценить с помощью флуоресцентной микроскопии через несколько дней, так как живые клетки имеют внутриклеточный кальций и, таким образом, флуоресцентны (рис. 3; ЭД 9). Васкуляризацию опухоли можно наблюдать под флуоресцентным микроскопом путем введения флуоресцентного красителя в кровеносные сосуды (рис. 3; ED9). Тем не менее, не всегда возможно визуализировать кровеносные сосуды внутри опухоли, так как сфероид очень плотный. Гибкие межпальцевые электроды помещаются поверх васкуляризированной опухоли (рис. 3; ED 9) и подключен к генератору импульсов. Зонд должен быть аккуратно помещен, чтобы избежать кровотечения эмбриона; В противном случае флуоресцентный краситель может распространиться, что затруднит любое наблюдение путем визуализации. Правильность доставки импульса в биологическую среду можно проверить, измерив ток, проходящий через цепь. Визуализация их в моделях яйцеклеток позволяет в режиме реального времени отслеживать влияние PEF на внутриклеточный кальций в 3D-опухоли глиобластомы, а также вазоконстрикцию, индуцированную на сосудистую сеть опухоли, избегая любого влияния других типов клеток, включая иммунную систему15.
Изучение влияния PEF на глиобластому также может быть выполнено в более полной и прогностической модели. Действительно, модель in vivo , описанная выше14 , состоит из пересадки 3D-опухоли глиобластомы в паренхиму головного мозга мыши (рис. 4). Место инъекции опухоли закупоривается сшитой гелевой гранулой декстрана, чтобы повторить физиологические биофизические ограничения во время роста опухоли. Несмотря на то, что это описано в ссылке14, стоит еще раз подчеркнуть, что критически важно, чтобы полушарик декстрана был точно приклеен к твердой мозговой оболочке; В противном случае опухоль может выйти через открытую твердую мозговую оболочку и полностью покрыть мозг, что делает визуализацию невозможной. Для любой хронической визуализации врастание тканей, которое происходит по мере заживления черепного окна, представляет собой серьезный барьер, поскольку новая ткань непрозрачна и делает изображения затуманенными или непригодными для использования. Поэтому после вставки и приклеивания полушарика боковые стенки открытого черепного окна необходимо запечатать тонким слоем суперклея, тщательно уложенным по всей стенке полости, не позволяя суперклею соскальзывать или течь на твердую мозговую оболочку. Когда гибкий зонд помещается поверх места инъекции опухоли, пузырьки не могут оставаться под зондом по двум причинам. Во-первых, визуализация не может продолжаться при наличии пузырьков. Во-вторых, пузырьки служат изоляторами, изменяя тем самым свойства электростимуляции. После принятия мер предосторожности, описанных выше, трепанация черепа запечатывается стеклянным окном, зацементированным к черепу, чтобы обеспечить хроническую визуализацию в течение нескольких недель. Поскольку опухоль состоит из клеток, экспрессирующих GCaMP или DsRed, инъекция может быть подтверждена флуоресцентным микроскопом. Электрохимический импеданс электродов должен быть измерен для проверки работоспособности после имплантации. По сравнению с импедансом в физиологическом растворе ожидается увеличение импеданса in vivo на частотах выше 100 Гц из-за присутствия биологической среды (рис. 5). Васкуляризированную нервную паренхиму и опухолевую инфильтрацию можно наблюдать и характеризовать через прозрачный субстрат в течение нескольких недель с помощью двухфотонной микроскопии (рис. 6). Использование трансгенных животных, экспрессирующих флуоресцентные белки в интересующих клетках (иммунных клетках и нейронах), может, например, продемонстрировать минимальный воспалительный процесс, вызванный только имплантацией электродов (рис. 6А), или показать наличие микроглии и моноцитов через 26 дней после имплантации электрода, стимулированного PEF, имплантированного поверх растущей опухоли GBM (рис. 6B1 ). В последнем случае вокруг и внутри опухоли были обнаружены как периферические моноцитарные клетки, так и резидентные клетки микроглии головного мозга (рис. 6B2). В день поставки ПЭФ контактные площадки гибких электродов могут быть подключены к генератору импульсов непосредственно под двухфотонным микроскопом. В целом, эта модель может быть использована для исследования эффекта биоэлектрических методов лечения с течением времени с использованием различных типов клеток, участвующих в развитии опухоли головного мозга, на глубине около 500 мкм.
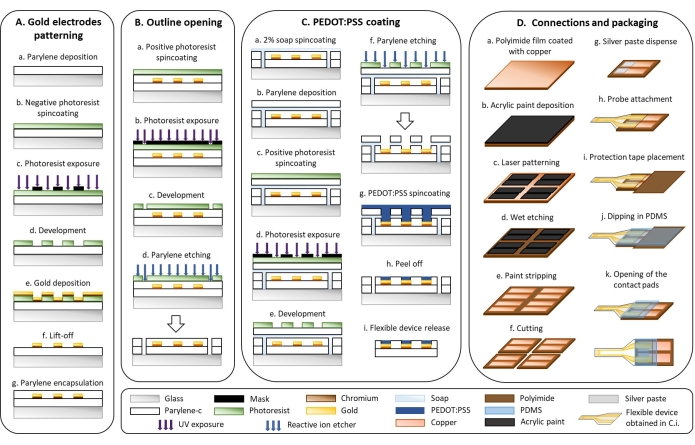
Рисунок 1: Микроизготовление гибких электродов . (A) Рисунок золотого электрода и подложка Parylene C. (B) Наброски открытия. (C) PEDOT: покрытие PSS. d) соединения и упаковка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
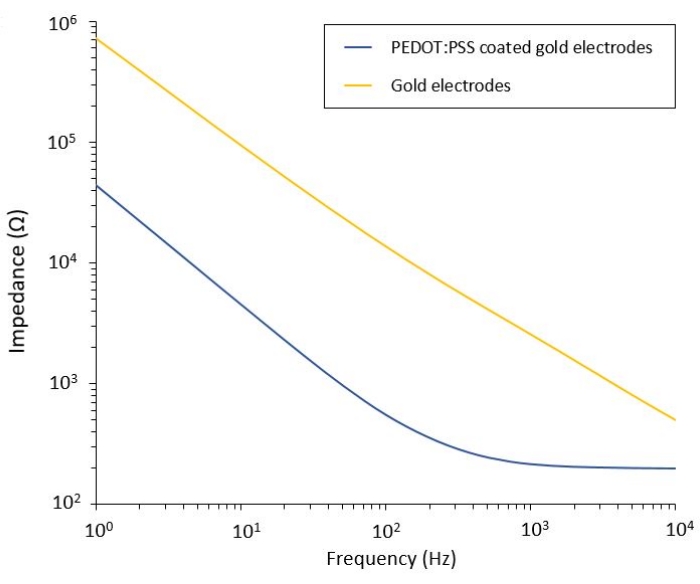
Рисунок 2: Электрохимическая импедансная спектроскопия гибких золотых электродов и холодных электродов с покрытием PEDOT:PSS в физиологическом растворе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
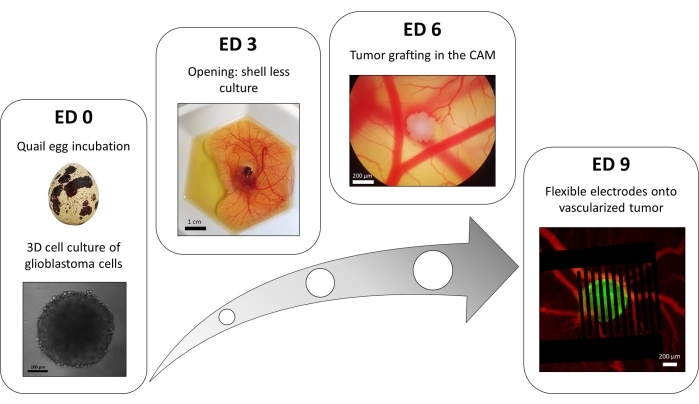
Рисунок 3: Модель глиобластомы in ovo. ED 0: Сфероид, наблюдаемый с помощью светлопольного микроскопа. ED 3: Культура зародыша перепела без скорлупы через 3 дня после вскрытия. ED 6: Опухоль, имплантированная в CAM, наблюдаемая с помощью светлопольного микроскопа. ED 9: Гибкое устройство, размещенное на васкуляризированной опухоли (опухоль зеленого цвета и кровеносные сосуды красного цвета). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
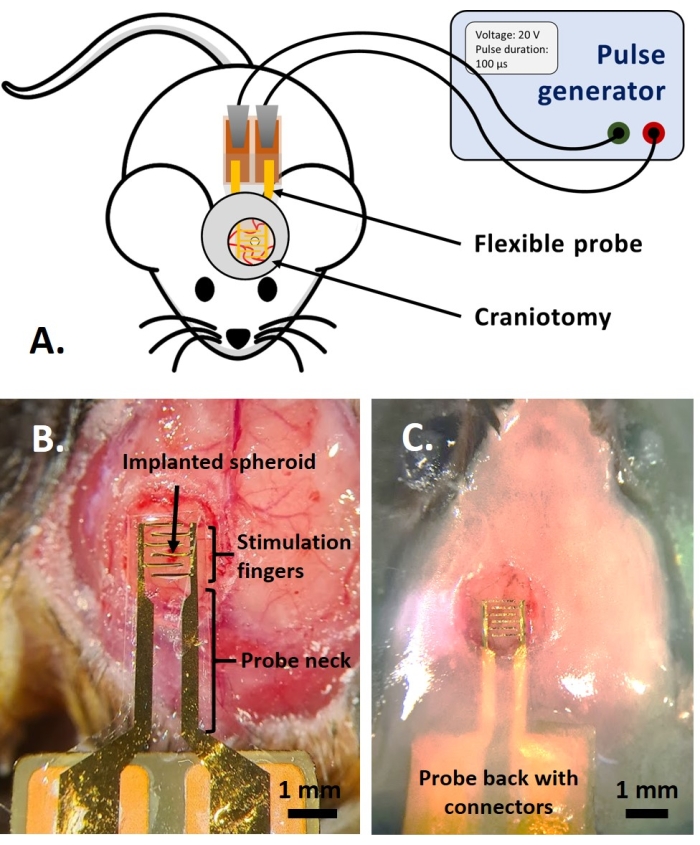
Рисунок 4: Применение in vivo. (A) Схема экспериментов in vivo. (B) Размещение зонда перед нанесением покровного стекла и акриловой смолы. (C) Завершенная имплантация зонда. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
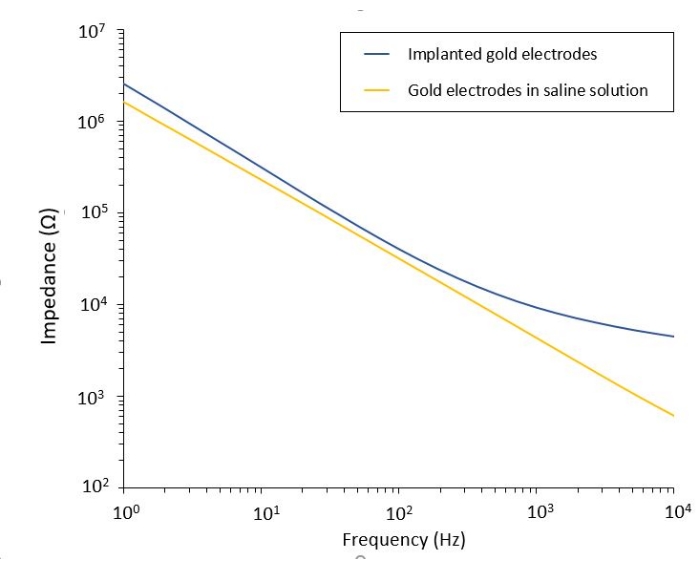
Рисунок 5: Электрохимическая импедансная спектроскопия гибких золотых электродов в физиологическом растворе по сравнению с имплантированным зондом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
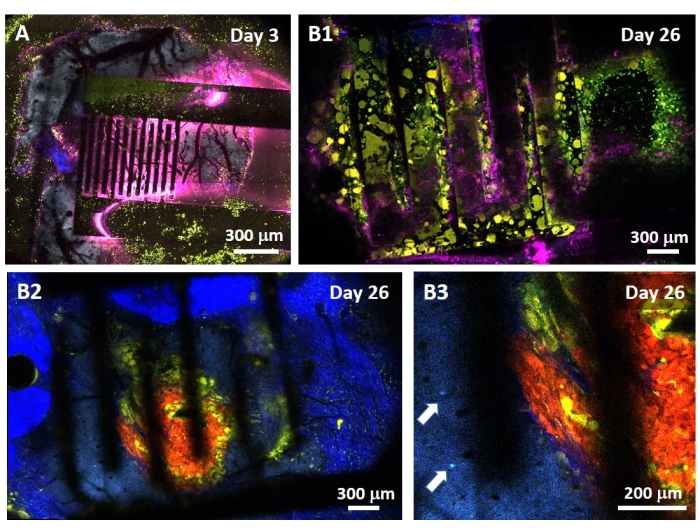
Рисунок 6: Прижизненная мультиспектральная двухфотонная визуализация через электроды . (A) Мозаичное изображение здоровой поверхности мозга у контрольной мультифлуоресцентной мыши AMU-Neuroinflam через 3 дня после имплантации электрода. Голубой показывает дендритную арборизацию пирамидных нейронов слоя 5, зеленый показывает рекрутированные гранулоциты и моноциты, а желтый показывает активированную микроглию и дендритные клетки. Розовый показывает инфракрасную диффузию из-за накопления тепла. (В1) Аналогичное изображение, как и в А , но через 26 дней после имплантации опухолевого сфероида на глубину 200 мкм внутрь коры сразу после имплантации электрода. Обратите внимание на накопление зеленых и желтых иммунных клеток. (В2) Изображение, аналогичное B1 , но на 100 мкм ниже поверхности электродов. Обратите внимание на наличие синей дендритной арборизации нейронов на периферии самой красной опухолевой массы, инфильтрированной желтой микроглией и дендритными клетками. Темно-синий цвет показывает второй гармонический сигнал от перитуморального коллагена. (В3) Увеличенный вид B2 , показывающий наличие интернейронных сом (обозначенных стрелками) в непосредственной близости от опухоли. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Подход, описанный в этой работе, позволяет моделям опухолей головного мозга с интегрированной системой доставки PEF изучать влияние PEF на разных уровнях биологической организации. Протокол микропроизводства состоит из стандартных тонкопленочных процессов, которые обеспечивают большую степень свободы в конструкции электродов, которые могут быть адаптированы к конкретному применению. Иногда дополнительный этап термического отжига может быть полезен в конце изготовления, чтобы уменьшить изгиб электродов, который произошел во время производства.
Использование стабильной клеточной линии глиобластомы, экспрессирующей флуоресцентный индикатор кальция, позволяет избежать всех осложнений, связанных с доставкой и удержанием красителя, особенно в 3D-опухолях, которые очень плотные16. Действительно, высокий уровень экспрессии наблюдается в течение длительного периода по сравнению со стандартными химическими флуоресцентными индикаторами кальция17. Этот протокол может быть применен к различным клеточным линиям, так как он обычно используется для визуализации нейронной активности11. Здесь использовались клеточные линии человека и мыши (U87 и Gl261 для имплантации иммунодефицитным или иммунокомпетентным мышам соответственно). Действительно, недавние исследования показали, что клеточная линия U87 отличается от исходных клеток, поскольку многие мутации были приобретены за годы культивирования клеток, что повлияло на экспериментальную воспроизводимость18. Метод, используемый для получения 3D-опухолей, является высокопроизводительным, воспроизводимым и позволяет генерировать сфероиды определенного размера в зависимости от клеточной линии, количества клеток при посеве и времени роста19. Однако эти сфероиды плотные, что является недостатком при визуализации в ядре опухоли.
Модель in ovo полезна в качестве первого подхода к изучению влияния PEF на 3D-опухоли и их сосудистую сеть без взаимодействия с другими типами клеток, присутствующими в головном мозге. Эта модель недорогая, быстрая, высокопроизводительная и вызывает меньше этических проблем, чем модели на животных. Важно поддерживать целостность эмбриона на протяжении всего эксперимента, так как это может повлиять на его выживаемость и качество изображения. Особую осторожность необходимо соблюдать при вскрытии перепелиного яйца, чтобы избежать повреждения эмбриональной оболочки. Трансплантат и размещение гибких электродов также должны выполняться осторожно, чтобы избежать кровотечения, которое может убить эмбрион. Введение флуоресцентного красителя в кровеносные сосуды позволяет одновременно визуализировать опухолевые клетки и васкуляризацию с помощью флуоресцентной микроскопии. Внутриглазная инъекция должна выполняться осторожно, чтобы избежать утечки красителя в эмбриональную жидкость, что может вызвать остаточную флуоресценцию на заднем плане, что ухудшает качество изображения. Эта модель также может быть использована для отслеживания поглощения лекарств, поскольку она обеспечивает доступ к системе кровообращения. Однако эксперименты ограничены 12-дневным временем выживания эмбриона, что позволяет наблюдать 7 дней, что значительно короче, чем у модели in vivo 21.
Модель опухоли головного мозга in vivo можно контролировать в течение 4-5 недель, прежде чем животные достигнут этической экспериментальной конечной точки, определяемой внезапной потерей веса на 20%. Он хорошо переносится и остается на месте, если соединительный хвост электрода не слишком длинный. В противном случае животные, как правило, царапают переворачивающийся разъем, который в конечном итоге может быть разорван, что препятствует последующему подключению к стимулятору. Этот 4-недельный период, тем не менее, ценен для охвата различных стадий развития глиобластомы. При сравнении плотностей опухолевых клеток в одном и том же интересующем объеме через разные промежутки времени можно наблюдать эволюцию кинетики роста опухоли. В частности, усиленный рост опухоли наблюдался во время иммунного переключателя22. Аналогичное исследование в присутствии стимулирующего электрода проинформирует о влиянии PEF на скорость пролиферации опухоли и чувствительность опухоли к иммунной элиминации. По сравнению с моделью in ovo , модель in vivo может рассматриваться как ценная доклиническая модель для изучения влияния иммунных клеток на прогрессирование опухоли и их вклада в терапевтический эффект PEF. Этот протокол адаптирован из предыдущей статьи с добавлением гибкого электродного устройства на опухоль перед размещением черепного окна14. Как острые, так и хронические биоэлектрические методы лечения опухолей могут быть охарактеризованы прямыми и последующими наблюдениями с помощью двухфотонной микроскопии, учитывая, что первоначальная стимуляция, как ожидается, вызовет гибель клеток и вызовет длительную дисрегуляцию иммунного ответа.
Соединения гибкого зонда легко доступны под двухфотонным микроскопом. Таким образом, параметры электрической стимуляции могут быть скорректированы в режиме реального времени на основе наблюдаемого воздействия на нервную ткань и/или клетки-мишени, подобно тому, как врач выполняет интервенционные процедуры при наблюдении за изображениями МРТ или КТ своего пациента. Последним соображением является важность тщательной герметизации электрода на мозге суперклеем и силиконовым клеем, чтобы предотвратить повторный рост тканей.
В заключение, описанный здесь протокол представляет собой инновационную модель для изучения эффекта PEF-терапии гибкими электродами из органических полимеров для моделей опухолей глиобластомы. Эти две модели демонстрируют разные уровни сложности, так что клеточные, сосудистые или иммунные эффекты могут быть разделены для лучшего понимания механизмов действия. Конформные поверхностные электроды уменьшают ятрогенное повреждение, позволяя нарушить микроокружение опухоли, вызывая вазоконстрикцию или нарушение регуляции внутриклеточного кальция15.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Работа, представленная здесь, была поддержана Французским национальным исследовательским агентством (ANR-18-CE19-0029). Авторы выражают искреннюю благодарность С.М. Барде за вклад в создание стабильной клеточной линии GCaMP6f и Д. О'Коннор за помощь в создании модели in ovo .
Материалы
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
Ссылки
- Koshy, M., et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries. Journal of Neuro-Oncology. 107 (1), 207-212 (2012).
- Davis, M. E. Glioblastoma: Overview of disease and treatment. Clinical Journal of Oncology Nursing. 20, 2-8 (2016).
- Edd, J. F., Horowitz, L., Davalos, R. V., Mir, L. M., Rubinsky, B. In vivo results of a new focal tissue ablation technique: irreversible electroporation. IEEE transactions on Bio-Medical Engineering. 53 (7), 1409-1415 (2006).
- Breton, M., Mir, L. M. Microsecond and nanosecond electric pulses in cancer treatments. Bioelectromagnetics. 33 (2), 106-123 (2012).
- Frandsen, S. K., et al. Direct therapeutic applications of calcium electroporation to effectively induce tumor necrosis. Cancer Research. 72 (6), 1336-1341 (2012).
- Lee, J. H., Kim, H., Kim, J. H., Lee, S. -. H. Soft implantable microelectrodes for future medicine: prosthetics, neural signal recording and neuromodulation. Lab on a Chip. 16 (6), 959-976 (2016).
- Lee, H., Bellamkonda, R. V., Sun, W., Levenston, M. E. Biomechanical analysis of silicon microelectrode-induced strain in the brain. Journal of Neural Engineering. 2 (4), 81-89 (2005).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A review of organic and inorganic biomaterials for neural interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Lecomte, A., Degache, A., Descamps, E., Dahan, L., Bergaud, C. In vitro and in vivo biostability assessment of chronically-implanted Parylene C neural sensors. Sensors and Actuators B: Chemical. 251, 1001-1008 (2017).
- Dijk, G., Ruigrok, H. J., O'Connor, R. P. PEDOT:PSS-coated stimulation electrodes attenuate irreversible electrochemical events and reduce cell electropermeabilization. Advanced Materials Interfaces. 8 (19), 2100214 (2021).
- Chen, T. -. W., et al. Ultra-sensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ribatti, D. Chapter 5 Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Valdes, T. I., Kreutzer, D., Moussy, F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. Journal of Biomedical Materials Research. 62 (2), 273-282 (2002).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments: JoVE. (86), e51108 (2014).
- Lefevre, M. C. Integrating flexible electronics for pulsed electric field delivery in a vascularized 3D glioblastoma model. npj Flexible Electronics. 5, 19 (2021).
- Perry, J. L., Ramachandran, N. K., Utama, B., Hyser, J. M. Use of genetically-encoded calcium indicators for live cell calcium imaging and localization in virus-infected cells. Methods. 90, 28-38 (2015).
- Blömer, U., et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. Journal of Virology. 71 (9), 6641-6649 (1997).
- Lenting, K., Verhaak, R., ter Laan, M., Wesseling, P., Leenders, W. Glioma: experimental models and reality. Acta Neuropathologica. 133 (2), 263-282 (2017).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Tay, S. L. M., Heng, P. W. S., Chan, L. W. The CAM-LDPI method: a novel platform for the assessment of drug absorption. Journal of Pharmacy and Pharmacology. 64 (4), 517-529 (2012).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic Membrane Models of Various Avian Species: Differences and Applications. Biology. 10 (4), 301 (2021).
- Ricard, C., et al. Phenotypic dynamics of microglial and monocyte-derived cells in glioblastoma-bearing mice. Scientific Reports. 6 (1), 26381 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены