Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Гидрогелевые матрицы обеспечивают повышенную пропускную способность для скрининговых эффектов компонентов матрицы и терапии в 3D-моделях опухолей
В этой статье
Резюме
Настоящий протокол описывает экспериментальную платформу для оценки влияния механических и биохимических сигналов на химиотерапевтические реакции клеток глиобластомы, полученных от пациента, в 3D матриксно-миметических культурах с использованием специального устройства УФ-освещения, способствующего высокопроизводительному фотосшиванию гидрогелей с настраиваемыми механическими характеристиками.
Аннотация
Клеточно-матричные взаимодействия опосредуют сложные физиологические процессы через биохимические, механические и геометрические сигналы, влияя на патологические изменения и терапевтические реакции. Ожидается, что учет матричных эффектов на ранних этапах разработки лекарств увеличит вероятность клинического успеха новых терапевтических средств. Стратегии на основе биоматериалов, повторяющие конкретные микросреды тканей в 3D-культуре клеток, существуют, но интеграция их с методами 2D-культуры, в основном используемыми для скрининга лекарств, была сложной задачей. Таким образом, представленный здесь протокол детализирует разработку методов для 3D-культуры в миниатюрных матрицах биоматериала в формате пластины с несколькими скважинами для облегчения интеграции с существующими трубопроводами скрининга лекарств и обычными анализами жизнеспособности клеток. Поскольку ожидается, что характеристики матрицы, критически важные для сохранения клинически значимых фенотипов в культивируемых клетках, будут высоко ткане- и болезнетворно-специфическими, для выявления соответствующих условий для конкретных применений потребуется комбинаторный скрининг параметров матрицы. Методы, описанные здесь, используют миниатюрный формат культуры для оценки реакций раковых клеток на ортогональную вариацию матричной механики и представления лиганда. В частности, это исследование демонстрирует использование этой платформы для изучения влияния параметров матрицы на реакцию клеток глиобластомы (GBM), полученных от пациента, на химиотерапию.
Введение
Ожидаемая стоимость разработки нового препарата неуклонно росла в течение последнего десятилетия, и по текущим оценкам 1 млрд. Частью этих расходов является высокий уровень отказов лекарств, поступающих в клинические испытания. Примерно 12% кандидатов на лекарства в конечном итоге получают одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 2019 году. Многие препараты терпят неудачу в фазе I из-за непредвиденной токсичности2, в то время как другие, которые проходят испытания на безопасность, могут потерпеть неудачу из-за отсутствия эффективности3. Это истощение из-за неэффективности может быть частично объяснено тем фактом, что модели рака, используемые во время разработки лекарств, как известно, не предсказывают клиническую эффективность4.
Функциональные различия между моделями in vitro и in vivo могут быть связаны с удалением раковых клеток из их собственной микросреды, включая неопухолевые клетки и физический ECM 5,6. Как правило, исследовательские группы используют коммерчески доступные матрицы культур, такие как Matrigel (белковая базальная мембранная матрица, полученная из сарком мышей), чтобы обеспечить культивируемые опухолевые клетки микроокружением 3D-матрицы. По сравнению с 2D культурой, 3D культура в мембранной матрице улучшила клиническую значимость результатов in vitro 7,8. Однако культивируемые биоматериалы из децеллюляризованных тканей, включая мембранный матрикс, обычно проявляют вариабельность от партии к партии, что может поставить под угрозу воспроизводимость9. Кроме того, матрицы, полученные из опухолей с различным тканевым происхождением от изученных, могут не обеспечивать соответствующих физиологических сигналов10. Наконец, раковые заболевания с высокой степенью внутриопухолевой гетерогенности имеют микроокружательные особенности, которые варьируются в субмикронной шкале и которые мембранная матрица не может быть настроена на повторение11.
Глиобластома (GBM), равномерно летальная опухоль головного мозга со средним временем выживания около 15 месяцев, является раком, для которого разработка лечения была особенно трудной12,13. Текущий стандарт лечения GBM состоит из первичной резекции опухоли, за которой следует лучевая терапия, а затем химиотерапия с использованием темозоломида (TMZ)14. Тем не менее, более половины клинических опухолей GBM проявляют устойчивость к лечению через различные механизмы 15,16,17. Предсказать эффективность схемы лечения для отдельного пациента крайне сложно. Стандартные доклинические модели, используемые для прогнозирования индивидуальных исходов, состоят из полученных пациентом опухолевых клеток, ксенотрансплантированных ортотопически в мышей с ослабленным иммунитетом. В то время как ксенотрансплантаты, полученные от пациента, могут повторять многие аспекты клинических опухолей GBM и ценны для доклинических моделей18, они по своей сути дороги, имеют низкую пропускную способность, отнимают много времени и связаны с этическими проблемами19. Культуры клеток, полученных от пациента, на 2D-пластиковых поверхностях или в виде сфероидов, в основном избегают этих проблем. В то время как клетки, полученные от пациента, сохраняют генетические аберрации, их культуры в 2D или в виде взвешенных сфероидов были в значительной степени плохими представлениями о ксенотрансплантатах, полученных от пациента, у грызунов и оригинальных опухолей пациента20. Ранее мы и другие показали, что клетки GBM, культивируемые в 3D ECM, который имитирует механические и биохимические свойства ткани мозга, могут сохранять фенотипы лекарственной устойчивости 10,21,22,23.
Взаимодействия между гиалуроновой кислотой (ГК), полисахаридом, распространенным в ECM мозга и чрезмерно экспрессируемым в опухолях GBM, и ее рецептором CD44 модулируют приобретение лекарственной устойчивости in vitro 21,24,25,26,27. Например, включение ГК в мягкие 3D-культуры увеличило способность клеток GBM, полученных от пациента, приобретать терапевтическую резистентность. Эта механочувствительность зависела от связывания ГК с рецепторами CD44 на клетках GBM21. Кроме того, связывание интегрина с RGD-несущими пептидами, включенными в матрицы 3D-культур, усиливало CD44-опосредованное хеморезистентность в зависимости от жесткости21. Помимо ГК, экспрессия нескольких белков ECM, многие из которых содержат области RGD, варьируется между нормальным мозгом и опухолями GBM28. Например, в одном исследовании сообщалось, что 28 различных белков ECM были повышены в опухолях GBM29. В этом сложном микроокружении опухолевой матрицы раковые клетки интегрируют механические и биохимические сигналы, чтобы получить определенный фенотип резистентности, который зависит от относительно небольших различий (например, менее порядка величины) в модуле Юнга или плотности интегрин-связывающих пептидов 28,29,30.
Настоящий протокол характеризует, как опухолевые клетки интерпретируют уникальные комбинации матричных сигналов и идентифицируют сложные, специфические для пациента матричные микросреды, которые способствуют резистентности к лечению (рисунок 1A). Фотохимический метод генерации миниатюрных, точно настроенных матриц для 3D-культуры обеспечивает большое ортогональное переменное пространство. Специально изготовленный массив светодиодов, управляемый микроконтроллером, был включен в гидрогели фотосшивания в формате пластины с 384 лунками для повышения автоматизации и воспроизводимости. Интенсивность воздействия варьировалась в зависимости от скважины, чтобы изменить микромеханические свойства полученных гидрогелей, как оценивалось с помощью атомно-силовой микроскопии (AFM). Хотя эта рукопись не фокусируется на построении самого массива освещения, принципиальная схема (рисунок 1B) и список деталей (таблица материалов) предоставляются в качестве вспомогательных средств для воспроизведения устройства.
Этот отчет демонстрирует быструю генерацию массива клеток GBM, культивируемых в уникальных 3D-микросредах, в которых модуль Юнга (четыре уровня на одном порядке) и содержание интегрин-связывающих пептидов (полученных из четырех различных белков ECM) варьировались ортогонально. Затем этот подход был использован для исследования относительного вклада механики гидрогеля и взаимодействия интегрина с ECM-специфической для жизнеспособности и пролиферации клеток GBM, полученных от пациента, когда они приобретают устойчивость к химиотерапии темозоломидом (TMZ).
протокол
Клеточные линии GBM, полученные от пациентов (GS122 и GS304), были предоставлены профессором Дэвидом Натансоном (нашим сотрудником), который разработал эти линии в соответствии с протоколом, одобренным Советом по институциональному обзору UCLA (IRB # 10-000655). Клетки были предоставлены деидентифицированными, так что клеточные линии не могли быть связаны обратно с отдельными пациентами.
1. Приготовление раствора гидрогеля
- Приготовьте HEPES-буферный раствор, растворив порошок HEPES при 20 мМ в сбалансированном солевом растворе Хэнка (HBSS). Отрегулируйте pH до 7 после полной сольватации.
- В HEPES-буферном растворе растворяют тиолированную ГК (номинальная молекулярная масса 700 кДа, см. Таблицу материалов), приготовленную по предыдущему отчету31, таким образом, чтобы 6%-8% остатков карбоновой кислоты на каждой глюкуроновой кислоте модифицировали тиолом, в концентрации 10 мг/мл в буферном растворе.
ПРИМЕЧАНИЕ: Янтарный флакон рекомендуется для предотвращения окисления тиола окружающим светом.- Перемешивайте с помощью магнитной пластины перемешивания (<1000 об/мин) при комнатной температуре до полного растворения, обычно около 45 мин.
- Во время растворения ГК готовят отдельные растворы (1) 100 мг/мл 8-арм-ПЭГ-Норборнена (20 кДа), (2) 100 мг/мл 4-арм-ПЭГ-Тиола (20 кДа), (3) 4 мМ цистеина или цистеинсодержащего пептида (например, GCGYGRGDSPG) и (4) 4 мг/мл LAP в микроцентрифужных пробирках (см. Таблицу материалов).
- Подготовьте каждый из этих четырех растворов в HEPES-буферном растворе, приготовленном на этапе 1.1. Вихрь растворов, чтобы обеспечить полное растворение каждого реагента перед выполнением шага 4.
ПРИМЕЧАНИЕ: При тестировании нескольких различных пептидов каждый из них должен содержать цистеин или другой источник тиольного фрагмента для этой химии конъюгации. - Подготовьте растворы (4 мМ доступного тиола) всех пептидов, которые будут привязаны к одному гидрогелю в этот момент.
ПРИМЕЧАНИЕ: Пептидные последовательности и белки ECM, из которых они были получены и использованы в данном исследовании, перечислены в таблице 1. N-ацетилцистеин (см. Таблицу материалов), с которым клетки не связываются, может быть заменен биологически активным, тиолсодержащим пептидом для титрования концентрации адгезивного пептида или действовать как отрицательный контроль31.
- Подготовьте каждый из этих четырех растворов в HEPES-буферном растворе, приготовленном на этапе 1.1. Вихрь растворов, чтобы обеспечить полное растворение каждого реагента перед выполнением шага 4.
- Смешайте отдельные растворы ГК, ПЭГ-Норборнена, ПЭГ-тиола и цистеин/тиолсодержащих пептидов (см. Таблицу материалов) для достижения конечных концентраций для конечных гидрогелевых матриц, перечисленных в Таблице 2. Перемешивайте (<1000 об/мин) на магнитной пластине перемешивания в течение не менее 30 минут, чтобы полностью перемешать.
ПРИМЕЧАНИЕ: Растворы ГК обладают высокой вязкостью и лучше всего обрабатываются с использованием пипетки с положительным смещением (см. Таблицу материалов). Если пипетка с положительным смещением недоступна, вязкие растворы также можно обойтись стандартной микропипеткой путем медленной пипетки с использованием широкодисперсных наконечников.
2. Освещение и фотосшивка гидрогелей с помощью светодиодной решетки
ВНИМАНИЕ: Носите УФ-защитные очки и покрывайте поле освещения УФ-поглощающим материалом.
ПРИМЕЧАНИЕ: Массив светодиодов, описанный в этом протоколе, состоит из шести наборов из восьми светодиодов, размещенных последовательно, как показано на представленной принципиальной схеме (рисунок 1A). Каждый набор светодиодов может питаться независимо, что позволяет использовать до шести различных излучений за прогон. Дополнительный файл 1 содержит скриншоты, соответствующие следующим указаниям для дальнейших указаний.
- Загрузите файл устройства освещения.zip из дополнительных файлов кодирования. Этот каталог содержит следующие файлы: Arduino.zip (Файл дополнительного кодирования 1), Драйверы.zip (Файл дополнительного кодирования 2), Графический интерфейс пользователя.zip (Файл дополнительного кодирования 3) и Holder.zip (Файл дополнительного кодирования 4).
ПРИМЕЧАНИЕ: 3D-печать верхней и нижней частей для удержания печатной платы на месте (см. Дополнительные файлы кодирования для получения подробной информации). - Загрузите и установите программное обеспечение микроконтроллера (см. Таблицу материалов).
- Загрузите и установите программное обеспечение с графическим интерфейсом (см. Таблицу материалов). Инструкции по эксплуатации программного обеспечения см. в дополнительном файле 1 .
- Откройте Обработка и установите библиотеку controlIP5 , щелкнув Sketch > Импорт библиотеки > Добавить библиотеку. Затем найдите controlIP5 в библиотеках и нажмите кнопку Установить. Выполните это в первый раз.
- Включите устройство освещения (см. Таблицу материалов) с помощью блока питания напряжением 36 В и подключите его к ПК с помощью кабеля micro-USB.
ПРИМЕЧАНИЕ: Некоторые устройства не устанавливают драйверы автоматически для различных наноплат Arduino. Один набор драйверов предоставляется в zip-файле устройства. - Откройте файл Arduino.ino, расположенный в папке Adruino.zip, с помощью IDE Arduino.
- Скомпилируйте файл Arduino.ino, нажав на кнопку Checkmark . Загрузите скомпилированный код, нажав на кнопку Стрелка .
- Откройте файл GUI.pde, расположенный в папке GUI.zip, с помощью команды Обработка.
- Нажмите кнопку Выполнить в программе обработки, чтобы запустить графический пользовательский интерфейс для управления устройством освещения.
- В окне графического интерфейса пользователя щелкните Интенсивность для столбца, содержащего раствор предшественника гидрогеля, который должен быть сшит, и введите желаемую интенсивность. Нажмите на поле Время и введите желаемое время. Для решения, представленного в таблице 2, это будет 15 с.
ПРИМЕЧАНИЕ: Конечным пользователям необходимо калибровать цифровые значения интенсивности в соответствии с интенсивностью излучения с помощью радиометра. Примеры типичных интенсивностей приведены на рисунке 2А. - Выровняйте образцы с устройством освещения (рисунок 2B) с любым другим светодиодом в одной колонке силиконовых форм (см. Таблицу материалов) или 384-луночной пластине. Нажмите «Готово», чтобы начать освещение. Повторите этот процесс по мере необходимости для освещения нескольких горок или других скважин плиты из 384 скважин.
ПРИМЕЧАНИЕ: Держатель сконструирован таким образом, что пластина с 384 лунками находится вровень с одним углом внутренней камеры во время освещения.- После освещения, при размещении в одном углу, переместите плиту колодца в следующий угол и повторите. Чтобы осветить колодцы на другой половине пластины, поднимите пластину из держателя и поверните на 180°.
- Создавайте гидрогели с различной механикой для механической характеристики, следуя приведенным ниже шагам.
- Очистите стеклянные слайды и силиконовые формы с помощью ленты для удаления мусора. Прикрепите силиконовые формы к стеклянному слайду, прижмите вниз, чтобы обеспечить хорошее уплотнение, и вытесните любые пузырьки воздуха.
- Пипетка 80 мкл раствора предшественника гидрогеля, приготовленного на стадии 1.4, в каждую силиконовую форму на стеклянном слайде.
- Поместите стеклянный слайд на устройство освещения, выровненное с любым другим светодиодом в одной колонке. Подвергайте предшественников гидрогеля воздействию ультрафиолетового света в течение 15 с, как описано на этапе 2, для фотоскрытия.
- Как только освещение прекратится, извлеките слайды и ослабьте гели из форм, проследив внутреннюю окружность формы тонким наконечником (наконечник пипетки 10 мкл, игла 30 г и т. Д.). Удалите силиконовые формы пинцетом/щипцами.
- Перемещайте сшитые гидрогели в отдельные колодцы из 12-луночной плиты, смачивая шпатель и осторожно отталкивая их от стеклянной горки. Заполните каждую лунку 2 мл DPBS (см. Таблицу материалов) перед добавлением гидрогеля. Разбавляйте гели в растворе DPBS в течение не менее 12 ч (обычно на ночь) при комнатной температуре (для механической характеристики на следующий день).
3. Измерения атомно-силовой микроскопии (AFM)
- Включите атомно-силовой микроскоп (АСМ) в соответствии с инструкциями производителя (см. Таблицу материалов). Этот протокол содержит краткие инструкции по использованию прибора и соответствующего программного обеспечения.
- Установите датчик AFM (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Для настоящего исследования треугольный консоль нитрида кремния с номинальной постоянной пружины 0,01 Н/м модифицировали сферической частицей диоксида кремния размером 2,5 мкм. - После установки выровняйте лазер по вершине треугольного зонда, а затем отрегулируйте отклонение зеркала и лазера, чтобы максимизировать сумму сигнала (обычно между 1,5-2,2 вольтами).
- Погрузите зонд в DPBS и подождите до 15 минут, чтобы получить тепловое равновесие. Нажмите кнопку Калибровка и выберите Контактно-зависимая калибровка. Нажмите кнопку «Собрать тепловую настройку» и после сбора данных выберите пик около 3 кГц для калибровки.
ПРИМЕЧАНИЕ: Небольшая регулировка зеркала и лазерных дефлекторов может потребоваться после погружения в жидкость из-за изменения показателя преломления. - Подойдите к поверхности чашки Петри (пластика), установив для параметров приближения постоянную скорость, высоту цели 7,5 мкм и скорость приближения 15 мкм/с. Включите базовое измерение за прогон для подхода , чтобы подход выполнялся непрерывно и не останавливался рано из-за дрейфа в дефлекторе.
- При приближении задайте параметры захвата для отображения силы на обороты 4 нН, расстояние отступа 2 мкм, скорость 1 мкм/с и время контакта 0 с. Нажмите кнопку Start , чтобы начать собирать кривую силы на пластиковой поверхности (например, на пластине колодца).
- Вернитесь в окно калибровки и выберите участок кривой силы, соответствующий контакту и углублению пластика. Примите рассчитанные значения чувствительности и жесткости для зонда для полной калибровки.
- После калибровки поднимите зонд AFM и поместите образец гидрогеля для опроса. Подходите к гидрогелю в соответствии с настройками, указанными в шаге 5.
ПРИМЕЧАНИЕ: Во время процедуры приближения к поверхности гидрогеля устройство может ошибочно вызвать приближенное состояние. Чтобы проверить фактический подход, получите кривую силы, как показано на шаге 4.6. Повторите процедуру подхода, если результирующая кривая не показывает контакта и результирующего отступа. - Когда поверхностный подход будет успешным, переключитесь в режим Force Mapping и задайте параметры сбора карты размером 8 x 8 с длиной 40 мкм на ось. Получение силовых карт в различных регионах для оценки однородности измерений жесткости.
- Интерпретируйте силовые кривые с помощью программной программы JPK SPM Data Processing через модель Герца/Снеддона (уравнения 1 и 2, см. таблицу 3 для определения всех переменных) с выбранной сферической геометрией 32,33,3 4.
 Уравнение 132
Уравнение 132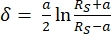 Уравнение 232
Уравнение 232
- Интерпретируйте силовые кривые с помощью программной программы JPK SPM Data Processing через модель Герца/Снеддона (уравнения 1 и 2, см. таблицу 3 для определения всех переменных) с выбранной сферической геометрией 32,33,3 4.
4. Настройка и медикаментозное лечение 3D, матричных культур
- Подготовьте нужные клетки в виде одноклеточного раствора.
ПРИМЕЧАНИЕ: Для различных типов ячеек могут потребоваться разные методы пропускания. Типичный протокол для прохождения культуры суспензии сфероидов GBM из колбы Т-75 описан в ссылке31. - Соберите сфероиды GBM (диаметром около 150 мкм) из культуры суспензии колбы Т-75 в коническую трубку объемом 15 мл. Промойте колбу для культивирования 5 мл DPBS, чтобы удалить любые остаточные клетки и среды, и добавьте этот объем в коническую трубку.
- Центрифугируют коническую трубку, содержащую ячейки при 200 х г , в течение 5 мин при комнатной температуре. После центрифугирования удалите супернатант серологической пипеткой объемом 5 мл, следя за тем, чтобы не потревожить клеточную гранулу, и повторно суспендируйте в 5 мл DPBS.
- Центрифуга при 200 х г в течение 5 мин при комнатной температуре для промывки клеток. Аспирировать супернатант серологической пипеткой 5 мл, следя за тем, чтобы не нарушить работу клеточной гранулы, а затем повторно суспендировать клетки в 2 мл реагента диссоциации клеток (см. Таблицу материалов).
- Инкубировать при комнатной температуре в течение 10-15 мин. Добавьте 3 мл полной среды (см. Таблицу материалов) и аккуратно пипетку 3-5 раз, чтобы разбить сфероиды на одноклеточную суспензию31.
- Центрифугировать одноэлементную суспензию при 400 х г (одноэлементные суспензии могут вращаться быстрее для образования гранул) в течение 5 мин в гранулярные ячейки при комнатной температуре. Аспирируйте супернатант серологической пипеткой 5 мл, заботясь о том, чтобы не потревожить клеточную гранулу. Повторное суспендирование клеток в 1 мл полной среды.
ПРИМЕЧАНИЕ: Если клетки остаются в сгустках, а не в виде одиночных клеток во взвешенной суспензии, после прохождения клетки могут быть пропущены через клеточный сетчатый фильтр 40 мкм для получения одноклеточной суспензии. - Удалите часть клеток для подсчета с помощью гемоцитометра. Разбавьте эту порцию в два раза трипан-синим, который пронизывает клетки с нарушенной жизнеспособностью. Подсчитывайте только живые, бесцветные клетки. Как правило, Т-75, посеянный по 800 000 клеток на колбу, дает 2-3 миллиона клеток через неделю в культуре.
- Определите количество клеток, необходимое для инкапсуляции. Перенесите объем среды, содержащей общее количество необходимых клеток, в стерильную микроцентрифужную трубку объемом 1,7 мл. Открутите при 400 х г в течение 5 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Например, минимум 2,5 миллиона клеток, повторно суспендированных в 1 мл объема геля, необходимы для инкапсуляции клеток при 2,5 миллионах клеток / мл. Гель объемом 1 мл позволяет пользователям дозировать 100 гелевых капель, где каждая капля геля имеет объем 10 мкл. Для учета потерь при переносе пипетки рекомендуется приготовить дополнительный ~20% объем клеток, суспендированных в растворе гидрогеля. Таким образом, в этом примере можно было бы получить 3 миллиона клеток и 1,2 мл раствора предшественника гидрогеля. Рекомендуется минимальная плотность 500 тыс. клеток/мл. - Аспирируйте супернатант с помощью микропипетки, заботясь о том, чтобы не потревожить клеточную гранулу. Повторно суспендируют клеточную гранулу в растворе предшественника гидрогеля, приготовленном на стадии 1.4, хорошо перемешивают путем пипетки вверх и вниз микропипеткой 1000 мкл 4-5 раз.
- Загрузите ячейки в повторный пипетку (см. Таблицу материалов), рассчитанную на дозирование 10 мкл. Чтобы избежать пузырьков и неравномерного дозирования, загрунтуйте повторный пипетку, дозируя дополнительно 1-2 раза в контейнер для отходов.
- В каждую скважину из 384-луночной пластины дозируют 10 мкл клеток, взвешенных в растворе гидрогеля, из повторного пипетки. Используя светодиодную решетку, освещают каждую скважину, содержащую ячейки (этап 2) в течение 15 с с интенсивностью (пример результатов на фиг.2А используется интенсивности 1,14, 1,55, 2,15, 2,74 мВт/см2) для достижения желаемых механических свойств.
ПРИМЕЧАНИЕ: Предлагается начинать с пяти реплик на каждое экспериментальное условие и масштабировать вверх или вниз в зависимости от желаемой пропускной способности и дисперсии анализа конечной точки. - Добавьте 40 мкл полной среды в каждую лунку, содержащую ячейки. Добавьте 50 мкл DPBS в неэкспериментальные, сухие скважины, окружающие гели, чтобы свести к минимуму потери из-за испарения.
- Для клеток GBM добавляют 40 мкл средосодержащего лекарственного средства (например, TMZ, см. Таблицу материалов) для достижения конечной желаемой концентрации (10 мкМ-100 мкМ в диметилсульфоксиде (DMSO) или транспортном средстве (DMSO), соответственно, начиная с 3 дней после инкапсуляции.
5. Анализ пролиферации CCK8
- Добавьте 10 мкл реагента CCK8 (см. Таблицу материалов) в каждую лунку, содержащую клетки.
ПРИМЕЧАНИЕ: Если вы выполняете этот анализ в первый раз, включите отрицательные контрольные скважины, такие как только среда или бесклеточный гидрогель в средах. - Инкубировать в течение 1-4 ч согласно инструкции производителя.
ПРИМЕЧАНИЕ: Это время может изменяться в зависимости от типа и плотности клеток, и, таким образом, время инкубации должно быть проверено для каждого применения, чтобы значения поглощения попадали в линейный диапазон, что является требованием для применения закона35 бира. - Считывание поглощений при 450 нм для всех скважин после инкубации.
- Рассчитайте среднее поглощение при 450 нм, полученное на шаге 3 для состояния транспортного средства для каждой группы. Разделите каждый хорошо обработанный препаратом на среднее значение контроля транспортного средства на группу.
- Вычисление доверительных интервалов путем генерации распределений начальной загрузки (N = 10 000) с помощью процентильного метода36.
ПРИМЕЧАНИЕ: Как правило, можно использовать 95% доверительные интервалы и интерпретировать условия, доверительные интервалы которых не пересекают 1, чтобы быть значительными и требующими дальнейшего изучения. Установка доверительных интервалов на 95% согласуется с установкой отсечения значимости p = 0,05. Для данных, показанных в результатах, полезно различать условия, которые либо способствуют, либо ингибируют матричную опосредованную лекарственную устойчивость, требующую двустороннего анализа.
Результаты
Измерения AFM подтвердили точное управление механикой гидрогеля в зависимости от ультрафиолетового излучения (мВт/см2) во время фотосшивания с использованием специально изготовленного светодиодного массива с управлением Arduino (рисунок 2A). Состав гидрогеля, использ...
Обсуждение
В текущей работе представлены методы генерации 3D,миниатюрных культур на основе ГК, одновременно изменяя жесткость матрицы и пептиды, доступные для взаимодействия с интегрином. Этот метод позволяет систематически изучать, как параметры матрицы влияют на клеточные фенотипы (например, ж...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы особо поблагодарить Кэролин Ким, Амелию Лао, Райана Стаутамора и Итая Соломона за их вклад в более ранние итерации схемы фотогелирования. Сотовые линии GS122 и GS304 были щедро предоставлены Дэвидом Натансоном. Все фигуры были созданы с BioRender.com. Основные объекты UCLA, общие ресурсы молекулярного скрининга и лаборатория характеристик nano и pico сыграли важную роль в работе. Чэнь Чиа-Чун был поддержан Ucla Eli and Edythe Broad Center of Regenerative Medicine and Stem Cell Research Training Program. Григора Варужаняна поддержал грант NIH По программе обучения биологии опухолевых клеток (T32 CA 009056).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.1 kOhm resistors, 6 W | Digikey | 35601k1ft | |
| 1.7 mL microcentrifuge tube | Genesse Scientific | 21-108 | |
| 15 mL conical tube | Fisher Scientific | 14-959-70C | |
| 365 nm LED | Digikey | ltpl-c034uvh365 | |
| 384 well plate | Bio Greiner One | 781090 | |
| 40 µm cell strainer | MTC bio | C4040 | |
| 4-Armed thiol terminated polyethlene glycol (20 kDa) | Laysan Bio | 4arm-PEG-SH-20K-1g | |
| 6 NPN BJTs | Digikey | 2n5550ta | |
| 80 Ohm resistors, 0.125 W | Digikey | erjj-6enf80r6v | |
| 8-Armed norbornene terminated polyethylene glycol (20 kDa) | Jenkem Technology | A7025-1 | |
| Accutase | Innovative Cell Technologies | AT104500 | cell dissociation reagent |
| AFM Probes | Novascan | 0.01 N/m Nominal spring constant, 2.5 µm SiO2 particle | |
| Arduino IDE | Arduino | 1.8.19 | |
| Arduino Nano | Makerfire | Mini Nano V3.0 ATmega328P Microcontroller Board | |
| bFGF | Peprotech | 100-18B | 20 ng/mL |
| CCK8 | Abcam | ab228554 | |
| Centrifuge | Thermoscientific | sorvall legend xtr | |
| CP100ST | Gilson | F148415 | Pipette tips for positive displacement pipette |
| Cubis Semi-Micro Balance | Sartorius | MSA225S100DI | |
| DMEM - F12 (50-50) | Life Technologies | 11330057 | 1x |
| DMSO | Fisher Scientific | BP231-100 | |
| DPBS Ca (-) Mg (-) | Genesse Scientific | 25-508 | |
| EGF | Peprotech | AF100-15 | 50 ng/mL |
| Ethanol, Anhydrous | Fisher Scientific | A405P | Add DI water to dilute to 70% |
| Fisherbrand Class B Amber Glass threaded vials | Fisher Scientific | 03-339-23C | |
| Fisherbrand Weighing Paper | Fisher Scientific | 09-898-12B | |
| G21 Supplement | Gemini Bio | 400-160 | 50x |
| Hanks Balanced Salt Solution | Thermo Fisher Scientific | 14175095 | |
| HCl, ACS, 12M | Sigma Aldrich | S25838A | Add DI water to dilute to 1 M |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H3149-100Ku | 25 µg/mL |
| HEPES | Sigma Aldrich | H7006-100G | |
| Hot Air Gun | Wagner | HT1000 | |
| Integrin-binding sialoprotein (IBSP) peptide | Genscript | Custom Order | GCGYGGGGNGEPRGDTYRAY |
| Lithium phenyl-2,4,6 trimethylbenzoylphosphinate (LAP) , >95% | Sigma Aldrich | 900889-1G | |
| Magnetic stir plate | Thermo Scientific | SP194715 | |
| Microcentrifuge | Thermo Scientific | Sorvall legend micro 21R | |
| Microman E single Channel Pipettor | Gilson | FD10004 | Positive displacement pipette |
| Micropipette Tips | Various Manufacturs | Various sizes | |
| mLine micropipette | Sartorious | ||
| N-acetyl Cysteine | Sigma Aldrich | A7250-10G | |
| Nanowizard 4 | Bruker | AFM microscope | |
| NaOH | Fisher Scientific | ss255-1 | Add DI water to dilute to 1 M |
| Normoicin | Invivogen | ant-nr-1 | 500x |
| Osteopontin Peptide | Genscript | Custom Order | GCGYGTVDVPDGRGDSLAYG |
| Pipet Aid | Drummond | 4000102 | |
| Plain Microscope Slides | Globe Scientific | 1301 | |
| Press-To-Seal silicone Isolator, 12-4.5mm diam x 2mm deep | Grace Bio Labs | 664201-A | Cut so that 8 individual molds are made from a single sheet |
| Processing | Processing | 3.5.4 | |
| Repeater M4 | Eppendorf | 4982000322 | |
| Repeater Pipette Tips | Sartorious | 30089430 | 1 mL sizes |
| RGD Peptide | Genscript | GCGYGRGDSPG | |
| Scoth Tape | |||
| Serological Pipettes | Genesse Scientific | 12-102,12-104 | 5,10 mL Pipettes |
| Solder Paste | Digikey | 315-NC191LT15T5-ND | |
| Solder Wire | |||
| Straight dissecting forceps | VWR Scientific | 82027-408 | |
| Synergy H1 Plate Reader | Biotek | ||
| T-75 Cell Culture Treated Flask | Genesee Scientific | 25-209 | |
| Temozolomide | Sigma Aldrich | T2577 | Typically used from 10 µM to 100 µM |
| Tenascin-C Peptide | Genscript | GCGYGRSTDLPGLKAATHYTITIR GV | |
| Thiolated Hyaluronic Acid (700 kDa), 6-8% modified | Lifecore Biomedical | HA700K5 | |
| VWR Spinbar, Flea Micro | VWR | 58948-375 |
Ссылки
- Scannell, J. W., Blanckley, A., Boldon, H., Warrington, B. Diagnosing the decline in pharmaceutical R&D efficiency. Nature Reviews Drug Discovery. 11 (3), 191-200 (2012).
- Waring, M. J., et al. An analysis of the attrition of drug candidates from four major pharmaceutical companies. Nature Reviews Drug Discovery. 14 (7), 475-486 (2015).
- Khozin, S., Liu, K., Jarow, J. P., Pazdur, R. Why do oncology drugs fail to gain US regulatory approval. Nature Reviews Drug Discovery. 14 (7), 450-451 (2015).
- Booth, B., Ma, P., Glassman, R. Oncology's trials. Market indicators. Nature Reviews Drug Discovery. 2 (8), 609-610 (2003).
- Da Ros, M., et al. Glioblastoma chemoresistance: The double play by microenvironment and blood-brain barrier. International Journal of Molecular Sciences. 19 (10), 2879 (2018).
- Broekman, M. L., et al. Multidimensional communication in the microenvirons of glioblastoma. Nature Reviews Neurology. 14 (8), 482-495 (2018).
- Grundy, T. J., et al. Differential response of patient-derived primary glioblastoma cells to environmental stiffness. Scientific Reports. 6 (1), 1-10 (2016).
- Gomez-Roman, N., Stevenson, K., Gilmour, L., Hamilton, G., Chalmers, A. J. A novel 3D human glioblastoma cell culture system for modeling drug and radiation responses. Neuro-Oncology. 19 (2), 229-241 (2017).
- Simoni, R. D., et al. Basement membrane complexes with biological activity. Biochemistry. 25 (2), 312-318 (2002).
- Xiao, W., et al. Brain-mimetic 3D culture platforms allow investigation of cooperative effects of extracellular matrix features on therapeutic resistance in glioblastoma. Cancer Research. 78 (5), 1358-1370 (2018).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Spinelli, C., et al. Molecular subtypes and differentiation programmes of glioma stem cells as determinants of extracellular vesicle profiles and endothelial cell-stimulating activities. Journal of Extracellular Vesicles. 7 (1), 1490144 (2018).
- Ostrom, Q. T., Cioffi, G., Waite, K., Kruchko, C., Barnholtz-Sloan, J. S. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2014-2018. Neuro-Oncology. 23, (2021).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New England Journal of Medicine. 352 (10), 987-996 (2005).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Tomczak, K., Czerwińska, P., Wiznerowicz, M. The Cancer Genome Atlas (TCGA): An immeasurable source of knowledge. Contemporary oncology. 19, 68-77 (2015).
- Lee, S. Y. Temozolomide resistance in glioblastoma multiforme. Genes and Diseases. 3 (3), 198-210 (2016).
- Joo, K. M., et al. Patient-specific orthotopic glioblastoma xenograft models recapitulate the histopathology and biology of human glioblastomas in situ. Cell Reports. 3 (1), 260-273 (2013).
- Levy, N. The use of animal as models: Ethical considerations. International Journal of Stroke. 7 (5), 440-442 (2012).
- Phon, B. W. S., Kamarudin, M. N. A., Bhuvanendran, S., Radhakrishnan, A. K. Transitioning preclinical glioblastoma models to clinical settings with biomarkers identified in 3D cell-based models: A systematic scoping review. Biomedicine & Pharmacotherapy. 145, 112396 (2022).
- Xiao, W., et al. Bioengineered scaffolds for 3D culture demonstrate extracellular matrix-mediated mechanisms of chemotherapy resistance in glioblastoma. Matrix Biology. 85-86, 128-146 (2020).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Xu, X., Farach-Carson, M. C., Jia, X. Three-dimensional in vitro tumor models for cancer research and drug evaluation. Biotechnology Advances. 32 (7), 1256-1268 (2014).
- Xiao, W., Ehsanipour, A., Sohrabi, A., Seidlits, S. K. Hyaluronic-acid based hydrogels for 3-dimensional culture of patient-derived Glioblastoma Cells. Journal of Visualized Experiments: JoVE. (138), e58176 (2018).
- Preston, M. Digestion products of the PH20 hyaluronidase inhibit remyelination. Annals of Neurology. 73 (2), 266-280 (2013).
- Kim, Y., Kumar, S. CD44-mediated adhesion to hyaluronic acid contributes to mechanosensing and invasive motility. Molecular Cancer Research. 12 (10), 1416-1429 (2014).
- Pibuel, M. A., Poodts, D., Díaz, M., Hajos, S. E., Lompardía, S. L. The scrambled story between hyaluronan and glioblastoma. The Journal of Biological Chemistry. 296, 100549 (2021).
- Xiao, W., Sohrabi, A., Seidlits, S. K. Integrating the glioblastoma microenvironment into engineered experimental models. Future Science OA. 3 (3), (2017).
- Trombetta-Lima, M., et al. Extracellular matrix proteome remodeling in human glioblastoma and medulloblastoma. Journal of Proteome Research. 20 (10), 4693-4707 (2021).
- Schregel, K., et al. Characterization of glioblastoma in an orthotopic mouse model with magnetic resonance elastography. NMR in Biomedicine. 31 (10), 3840 (2018).
- Xiao, W., Ehsanipour, A., Sohrabi, A., Seidlits, S. K. Hyaluronic-acid based hydrogels for 3-dimensional culture of patient-derived glioblastoma cells. Journal of Visualized Experiments: JoVE. (138), e58176 (2018).
- Guz, N., Dokukin, M., Kalaparthi, V., Sokolov, I. If cell mechanics can be described by elastic modulus: Study of different models and probes used in indentation experiments. Biophysical Journal. 107 (3), 564-575 (2014).
- Sneddon, I. N. The relation between load and penetration in the axisymmetric boussinesq problem for a punch of arbitrary profile. International Journal of Engineering Science. 3 (1), 47-57 (1965).
- Soofi, S. S., Last, J. A., Liliensiek, S. J., Nealey, P. F., Murphy, C. J. The elastic modulus of MatrigelTM as determined by atomic force microscopy. Journal of Structural Biology. 167 (3), 216-219 (2009).
- Mayerhöfer, T. G., Popp, J. Beer's law - Why absorbance depends (almost) linearly on concentration. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 20 (4), 511-515 (2019).
- Puth, M. T., Neuhäuser, M., Ruxton, G. D. On the variety of methods for calculating confidence intervals by bootstrapping. Journal of Animal Ecology. 84 (4), 892-897 (2015).
- Lavrentieva, A. Gradient hydrogels. Advances in Biochemical Engineering/Biotechnology. 178, 227-251 (2020).
- Zhu, D., Trinh, P., Li, J., Grant, G. A., Yang, F. Gradient hydrogels for screening stiffness effects on patient-derived glioblastoma xenograft cellfates in 3D. Journal of Biomedical Materials Research. Part A. 109 (6), 1027-1035 (2021).
- da Hora, C. C., Schweiger, M. W., Wurdinger, T., Tannous, B. A. Patient-derived glioma models: From patients to dish to animals. Cells. 8 (10), 1177 (2019).
- Li, W., et al. Characterization and transplantation of enteric neural crest cells from human induced pluripotent stem cells. Molecular Psychiatry. 23 (3), 499-508 (2018).
- Scaringi, C., Minniti, G., Caporello, P., Enrici, R. M. Integrin inhibitor cilengitide for the treatment of glioblastoma: A brief overview of current clinical results. Anticancer Research. 32 (10), 4213-4224 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены