Method Article
Экспериментальная модель для оценки разрешения пневмонии
В этой статье
Erratum Notice
Резюме
В данной рукописи описывается создание инфекционной модели пневмонии у мышей и соответствующая характеристика разрешения травмы, а также методы выращивания бактерий и интратрахеального закапывания. Также описан новый подход с использованием многомерной проточной цитометрии для оценки иммунного ландшафта.
Аннотация
Острый респираторный дистресс-синдром (ОРДС) вызывает острое повреждение легких, характеризующееся быстрым повреждением альвеол и выраженной гипоксемией. Это, в свою очередь, приводит к высокой заболеваемости и смертности. В настоящее время не существует доклинических моделей, которые бы резюмировали сложность ОРДС человека. Тем не менее, инфекционные модели пневмонии (ПНК) могут воспроизводить основные патофизиологические особенности ОРДС. В данной работе мы описываем модель ПНК, индуцированной интратрахеальным инстилляцией живых Streptococcus pneumoniae и Klebsiella pneumoniae у мышей C57BL6. Для того, чтобы оценить и охарактеризовать модель, после индуцирования травмы, мы провели серийные измерения массы тела и бронхоальвеолярного лаважа (БАЛ) для измерения маркеров повреждения легких. Кроме того, мы собрали легкие для определения количества клеток и дифференциалов, количественного определения белка БАЛ, цитоспина, количества колониеобразующих единиц бактерий и гистологии. Наконец, была проведена проточная цитометрия с высокой размерностью. Мы предлагаем эту модель в качестве инструмента для понимания иммунного ландшафта на ранних и поздних стадиях разрешения повреждения легких.
Введение
Острый респираторный дистресс-синдром (ОРДС) остается распространенным летальным и инвалидизирующим синдромом, который поражает примерно 10% пациентов отделений интенсивной терапии (ОИТ) и до 23% лиц, находящихся на искусственной вентиляции легких, что приводит к уровню госпитальной смертности 35–46%1. Более того, недавняя пандемия COVID-19 еще раз подчеркнула важность изучения ОРДС. Положительные случаи COVID-19 привели к увеличению смертности от ОРДС, что подчеркивает ограниченность фармакологической терапии2.
У человека ОРДС характеризуется быстрым возникновением гипоксемии (PaO2/FiO2 < 300) и признаками негидростатического двустороннего отека легких вследствие чрезмерной альвеолярно-капиллярной проницаемости и альвеолита3. Несмотря на то, что ОРДС традиционно описывается как проявление острого повреждения легких (ОПЛ) на фоне различных поражений, бактериальная и вирусная пневмония (ПНК) остается одной из наиболее распространенных причин. Были описаны три основные патофизиологические стадии, а именно экссудативная, пролиферативная и фиброзная стадии, в то время как двумя основными основными признаками ОРДС являются нерегулируемое воспаление и альвеолокапиллярное нарушение4. Во время этих процессов альвеолярное повреждение продуцируется высвобождением воспалительных цитокинов (например, фактора некроза опухоли [TNF-α], интерлейкина [IL-1β, IL-6, IL-8 и др.]), притоком нейтрофилов и воспалительных макрофагов, а также затоплением богатой белком жидкости. В конечном счете, эти события приводят к очаговому и двустороннему повреждению альвеол 5,6,7,8.
Несмотря на значительный прогресс в понимании раннего повреждения легких и воспаления, механизмы, лежащие в основе разрешения ПНК, менее известны и должны быть в центре внимания будущих механистических исследований. Основная цель данной методической работы заключается в том, чтобы предоставить исследователям модель инфекционной пневмонии, разрешающую травмы, которая может воспроизводить основные патофизиологические особенности ОРДС. Мы предполагаем, что эта модель поможет лучше понять биологические механизмы, лежащие в основе разрешения воспаления легких и восстановления, тем самым послужив платформой для спасательной терапии.
Основные стадии физиопатологии, протекающие во время ОРДС, могут быть воспроизведены на доклинических животных моделях ОПЛ, которые должны включать гистологическое свидетельство воспалительной реакции, повреждения тканей, физиологической дисфункции, альвеолита и изменения альвеолярно-капиллярного барьера. Модель мыши, которая индуцирует PNA и ALI, является преимуществом благодаря своей высокой воспроизводимости, быстрому разведению и наличию нескольких инструментов для проведения механистических и молекулярных исследований. Не существует единой модели, которая бы полностью повторяла все особенности человеческого ОРДС9.
Модели ПНК у мышей позволяют воспроизвести ключевые патофизиологические механизмы, продуцируемые инфекционным ОРДС у людей, такие как быстрое начало, признаки повреждения тканей в гистологии, нарушение альвеоло-капиллярного барьера, признаки воспалительной реакции и физиологической дисфункции при одновременной умеренной смертности. Инфекционные модели могут быть индуцированы местной или системной доставкой патогена, при этом интраназальное, интратрахеальное и внутривенное введение являются наиболее частыми путями введения. Интратрахеальный путь позволяет напрямую вводить инфекционного агента в легкие, уменьшая аэрозолизацию и оптимизируя доставку11,12.
Здесь описана методология доклинической мышиной модели ПНК путем интратрахеальной инстилляции либо живого Streptococcus pneumoniae (Spn), либо Klebsiella pneumoniae (Kp). Эти модели представляют собой хороший суррогат ОРДС, продуцируемого бактериальной ПНК, обладающий рядом преимуществ, в том числе: распространенные причины ПНК-ОРДС человека (внебольничные и внутрибольничные); высокая воспроизводимость; Смертность и травмы можно легко титровать (моделируя различные степени воспаления легких) для проявления сильной воспалительной реакции, приводящей к альвеолиту и альвеолокапиллярной дисфункции; оценка ранних и поздних фаз повреждения легких и их устранение; и оценка терапевтических стратегий на разных стадиях ПНК-ОРДС.
протокол
Все протоколы содержания животных, описанные в этом исследовании, были одобрены Комитетом по институциональному уходу за животными и их использованию (ACUC) в Школе медицины Университета Джона Хопкинса для протокола MO21M160 животных. Кроме того, эксперименты проводились в соответствии с институциональными, государственными и федеральными правилами исследований на животных.
ВНИМАНИЕ: Воспроизведение всех описанных ниже протоколов должно быть выполнено в шкафу уровня биобезопасности 2 (BSL-2) в соответствии со всеми институциональными рекомендациями BSL-2 в кабинете биобезопасности.
1. Осаждение бактериальных запасов из коммерческих контуров
ПРИМЕЧАНИЕ: Этот протокол может быть использован для выращивания бактериальных запасов для Spn (ATCC 49619) и Kpn (ATCC 43816), начиная с культовых петель, полученных от поставщика (подробнее см. Таблицу материалов ).
- Нагрейте тарелку с 5% овечьей кровью в течение 15 минут при температуре 37 °C в инкубаторе. Для этой цели можно использовать клеточный инкубатор.
- Под капюшоном снимите оболочку с петли для бактериальной инокуляции и аккуратно распределите ее, пронизывая агаровую пластину, по зигзагообразной схеме. Повторите этот шаг, используя отдельную пластину в качестве дубликата. Одной петлей можно прорезать до пяти пластин.
- Инкубируйте планшеты в течение ночи при температуре 37 °C для оптимального роста бактерий. Выводите бактерии ежедневно в течение 3 дней. Нагрейте кровяные агаровые пластины в течение 15 минут при 37 °C, возьмите от 15 до 20 колоний из первой агаровой пластины с помощью одноразовой инокуляционной петли и распределите их в новую, предварительно нагретую агаровую пластину. Нанесите соответствующую маркировку на табличку.
2. Размножение бактерий и их хранение впрок
- Через 3 дня соберите до 30 колоний из кровяного агарового планшета с помощью петли полосы и поместите его непосредственно в колбу объемом 250 мл с бульоном Тодда Хьюитта (бульон TH). Инкубировать при 37 °C, встряхивая при 250 об/мин, с 5%CO2 в течение примерно 4 ч.
- Принимайте аликвоты каждые 15 минут, чтобы измерить наружный диаметр620 нм, пока он не достигнет 0,3, что эквивалентно примерно 3 x 108 колониеобразующим единицам (КОЕ) на мл.
- Выделите 1 мл нового бактериального запаса сразу в криогенные флаконы объемом 2 мл. Свежеаликотированные флаконы мгновенной заморозки в жидком азоте на 5 минут. Храните аликвоты бактерий в морозильной камере при температуре -80 °C (флаконы можно использовать до 6-8 месяцев, прежде чем они потеряют эффективность).
- После 7 дней заморозки аликвоты можно использовать для исследований на животных. Поэтому определите новую концентрацию бактерий.
3. Размораживание бактерий для интратрахеального закапывания
- Нагрейте тарелку с кровяным агаром в течение 10 минут при температуре 37 °C в шейкере. Достаньте один из новых флаконов из морозильной камеры и разморозьте его путем осторожного перемешивания на водяной бане при температуре 37 °C в течение примерно 2 минут. Не прикасайтесь к уплотнительному кольцу или колпачку теплой водой.
- Пластина на кровяной агаровой пластине для ручного подсчета колоний бактерий. Проведите разведение 1 x 10-6 и налейте 200 мкл от последнего разведения в предварительно подогретую кровяную агаровую пластину. Делайте это в двух экземплярах.
- Инкубируйте планшеты в течение ночи при температуре 37 °C для оптимального роста бактерий. На следующий день примените следующую формулу для определения новой концентрации бактерий: КОЕ/мл = (количество колоний х коэффициент разбавления) / объем посуды
4. Интратрахеальное закапывание живых бактерий
ПРИМЕЧАНИЕ: Этот протокол был оптимизирован для закапывания объема 50 мкл внутритрахеально. Бактериальные запасы могут храниться до 6-9 месяцев. Чтобы обеспечить наличие бактериальных КОЕ в каждом флаконе, обязательно наносите его на тарелку перед каждым экспериментом, рассчитывайте бактериальный запас КОЕ, как описано выше, и используйте бульон TH для последующих разведений.
ВНИМАНИЕ: Под шкафом биобезопасности проведите процедуру выживания грызунов с использованием стерильных хирургических инструментов.
- Обезболите мышь путем внутрибрюшинного введения 100 мг/кг кетамина и 2,5 мг/кг ацетилпромазина. Повторите то же самое для количества мышей, которым вводится инъекция за один раз.
ПРИМЕЧАНИЕ: Мыши могут подвергаться воздействию изофлурана для облегчения работы с животными. Тем не менее, опытный дрессировщик, способный вводить внутрибрюшинные анестетики, не вызывая значительного стресса у животного, может избежать воздействия изофлурана. Количество мышей для инъекции зависит от опыта хирурга. - После того, как все мыши находятся под соответствующей анестезией, подтвердите анестезию щипцом хвоста. Поместите мышь, находящуюся под наркозом, на чистую и стерилизованную поверхность, подвесьте животное за резцы и аккуратно обмотайте передние конечности скотчем (рисунок 1А).
ПРИМЕЧАНИЕ: Чтобы обеспечить хорошее самочувствие животных, обеспечьте смазку роговицы всем животным, находящимся под наркозом. Можно использовать глазные капли с карбоксиметилцеллюлозой, нанося по одной капле на глаз. - Побрейте область шеи и продезинфицируйте область хлоргексидином и 70% спиртом. С помощью хирургических ножниц сделайте поверхностный разрез по средней линии шеи на 1 см, чтобы визуализировать трахею (рисунок 1B). Одного небольшого разреза должно быть достаточно, но если видно обилие жировой ткани, тщательно рассеките жировую ткань вертикально, чтобы визуализировать трахею.
ПРИМЕЧАНИЕ: Используйте стерильные перчатки и стерильные инструменты с помощью техники «только наконечники». Риск инфицирования минимален, если процедура проводится в стерильных условиях. - С помощью щипцов интубируйте каждую мышь. Осторожно вытяните язык наружу и введите через рот ангиокатетер 20 G, продвигая катетер в трахею. Слегка надавите на трахею, чтобы облегчить интубацию.
ПРИМЕЧАНИЕ: Поскольку трахея находится спереди от тела мыши, слегка согните кончик катетера, так как это поможет получить угол для успешной интубации мыши. Разрез на шее выполняется в основном в целях визуализации; В качестве альтернативы оператор может интубировать трахею вслепую. - После интубации подключите мышь к респиратору для подтверждения интубации. Стандартные параметры аппарата ИВЛ, используемые при этой процедуре, составляют 200 мкл объема при работе и 200 ходов в минуту. Кратковременно увеличьте и/или уменьшите мощность вентилятора для быстрого и легкого подтверждения.
- После подтверждения интубации отсоедините мышь от респиратора и осторожно введите 50 мкл бактериального агента через ангиокатетер с помощью насадочного наконечника для дозатора 200 мкл пипетки. Контрольным мышам вводят 50 μл стерильного бульона TH.
- После закапывания бактериального агента снова подключите мышь к респиратору, чтобы помочь возобновить дыхание. Оставьте мышь на респираторе на 30-60 с. После инъекции всем мышам следите за их дыханием. Если дыхание замедлилось, снова подключите мышей к респиратору.
- Закройте разрез, добавив одну небольшую каплю клея на кожу. Сведите вместе кожные складки и слегка надавите, пока клей не высохнет.
- Поместите мышей на грелку для восстановления и внимательно наблюдайте за ними, пока они не придут в сознание. Перенесите мышей обратно в клетку после полного выздоровления. Для послеоперационного купирования боли/дистресса мышей можно лечить бупренорфином в дозе 0,05-0,1 мг/кг подкожно (ПК).
ПРИМЕЧАНИЕ: Животные с потерей веса более чем на 20% или испытывающие значительные дистрессы после процедуры, такие как вялость, неспособность дотянуться до воды или пищи, затрудненное дыхание, нарушение реакции на внешние раздражители или снижение умственной активности, должны быть усыплены.
5. Бронхоальвеолярный лаваж и забор легких
- Усыпите мышь, поместив ее в закрытый контейнер, содержащий 5% изофлурана. Продолжайте воздействие изофлурана в течение 1 минуты после того, как мышь перестанет дышать. Провести торакотомию для подтверждения эвтаназии.
ПРИМЕЧАНИЕ: Подтвердите эвтаназию с помощью визуального и физического осмотра. Должно быть, сердце перестало биться, а мыши не дышали. Слизистые оболочки должны быть белыми или бледными. - Положите мышь в лежачем положении на чистую хирургическую доску и подвесьте ее за резцы. Сбрызните кожу мыши 70% этанолом. С помощью хирургических ножниц сделайте небольшой поверхностный разрез по средней линии шеи, чтобы визуализировать трахею мыши.
- Канюляция трахеи с помощью катетера 20 G. Осторожно добавьте 1 мл безкальциевого фосфатно-солевого буфера (PBS) внутритрахеально с помощью шприца объемом 1 мл. Дайте волю полному расширению легких, а затем аспирируйте жидкость с помощью того же шприца. Повторите этот шаг в общей сложности на 2 мл.
- Переложите BAL в аликвоту объемом 2 мл. Выполните этот шаг дважды, чтобы конечный объем составил 2 мл. Не промывайте легкие более чем 1 мл за один раз из-за высокого риска нарушения альвеолярного пространства.
- Откройте грудную полость и обнажите легкое, сердце и трахею с помощью ножниц и щипцов. Аккуратно рассеките диафрагму и удалите грудную клеть. Следите за тем, чтобы не защемить легочную ткань.
- Пересеките брюшную аорту, чтобы обеспечить обескровливание. Перфузируйте легочную ткань, сделав небольшой разрез примерно 2 мм в правом желудочке с помощью ножниц, и введите 5 мл холодного PBS с помощью катетера 20 G. PBS должен перфузировать легкое. Если будет проведена адекватная перфузия, легочная ткань станет белой, бледной, и PBS покинет внутрисосудистый компартмент через брюшную аорту.
- Осторожно извлеките легкие и рассеките их из трахеи для выполнения либо гистологии, либо дальнейшей обработки до суспензии одиночных клеток.
- При обработке на гистологию осторожно введите катетер 20 G, чтобы надуть легкие до 25 см H2O раствором формалина (нейтральный буферный 10%). После того, как легкие будут инсуффляированы, проденьте шовный нить длиной около 5 см под трахеей и дважды крепко завяжите его, чтобы формалин оставался в легочной ткани. Аккуратно отделите легкое от остальных тканей и поместите его в коническую пробирку объемом 15 мл, содержащую 10 мл раствора формалина.
6. Обработка бронхоальвеолярного лаважа
- Центрифугируйте BAL при 500 x g при 4 °C в течение 5 минут. Извлеките надосадочную жидкость без клеток в отдельную пробирку и храните при температуре -80 °C.
ПРИМЕЧАНИЕ: Дальнейший анализ может быть выполнен в надосадочной жидкости BAL, включая количественное определение белка (например, анализ BCA13) или измерение специфических биомаркеров или цитокинов (анализы ELISA и множественные анализы с использованием таких платформ, как MSD и Luminex). - Лизируйте эритроциты, добавив 100 мкл лизирующего буфера на 1 мин. Нейтрализуйте реакцию лизинга, добавив 1 мл PBS. Центрифугируйте BAL при давлении 500 x g при 4 °C в течение 5 минут и удалите надосадочную жидкость.
- Ресуспендируйте клетки в PBS (100-300 μл; в зависимости от размера гранул клетки). Выполните подсчет клеток с помощью 0,4% трипанового синего цвета с помощью ручного или автоматического подсчета клеток. Оставшуюся гранулу используют для окрашивания проточной цитометрией и/или криоконсервации (путем суспендирования в криоконсервирующем растворе) в жидкий азот для дальнейшего тестирования.
7. Обработка легких на суспензию одиночных клеток
- Аккуратно отделите легкое от остальных тканей и поместите его в коническую пробирку объемом 15 мл, содержащую 5 мл холодного PBS. Извлеките легкое из PBS и высушите его бумажным полотенцем.
- Приготовьте коктейль для пищеварения, добавив 1 мг ДНКазы и 5 мг коллагеназы в 1 мл модифицированной среды Дульбекко (DMEM) с низким содержанием глюкозы. Перенесите легкое в С-образную трубку, содержащую 1 мл коктейля для пищеварения.
- Перенесите С-образную трубку в тканевый диссоциатор и следуйте стандартизированному протоколу обработки легочной ткани14.
- Добавьте 10 мл холодного PBS в С-образную трубку и тщательно перемешайте. Отфильтруйте одноклеточную суспензию с помощью клеточного фильтра 70 мкм на конической пробирке объемом 50 мл. Выполните фильтрацию дважды.
- Центрифугируйте суспензию при 500 x g при 4 °C в течение 5 мин. Осторожно сцедите надосадочную жидкость и добавьте 1 мл лизирующего буфера на 1 мин при комнатной температуре. Добавьте 10 мл холодного PBS, чтобы остановить реакцию лизирования и удалить надосадочную жидкость.
- Центрифугируйте суспензию при 500 x g при 4 °C в течение 5 мин. Осторожно сцедите надосадочную жидкость и добавьте 10 мл холодной PBS.
- Выполните подсчет клеток с помощью трипанового синего окрашивания вручную или автоматически. Используйте клеточную гранулу для окрашивания проточной цитометрией и/или криоконсервации в жидком азоте для дальнейшего тестирования.
Результаты
Описанные выше процедуры позволили смоделировать патофизиологические механизмы, лежащие в основе бактериального поражения легких, вызванного бактериальной пневмонией, у мышей. Для начала моделирования мыши C57BL/6 дикого типа (WT) были получены из лаборатории Джексона и выведены на животноводческом предприятии института. Самцам мышей WT C57BL/6, в возрасте 8 недель, была проведена внутритрахеальная инокуляция либо бульона TH (контроль), либо 3 x 106 КОЕ живого Spn, либо 200 КОЕ живого Kpn. После заражения мыши находились под наблюдением в течение 6 и 10 дней на предмет Spn и Kpn соответственно. Несмотря на то, что инфицированные группы демонстрировали меньшую массу тела по сравнению с неинфицированной контрольной группой, группа Spn восстановила свою массу тела по сравнению с исходным уровнем, в то время как мыши, инфицированные Kpn, демонстрировали медленное восстановление после 6 дней инфекции (рис. 2A). В течение всего исследования ни одному мышонку не потребовалось подвергаться эвтаназии из-за массы тела более 20%, и не было никаких доказательств боли и стресса.
Мы измеряли повреждение легких через разные интервалы. Концентрация белка BAL и общее количество клеток как для БАЛ, так и для легких были значительно выше в инфицированных группах (рис. 2). Репрезентативные гистологические срезы, показывающие воспалительный процесс в обеих моделях, были получены на 2, 4 и 6 день после инокуляции (рис. 3), что свидетельствует о стойком альвеолярном воспалении у мышей, инфицированных Kpn (рис. 4), даже на 10-й день. У мышей, инфицированных Kpn, травма продолжалась к 10-му дню (Рисунок 2 и Рисунок 4), в то время как у мышей, инфицированных Spn, воспаление легких исчезло к 6-му дню (Рисунок 2 и Рисунок 3).
Суспензии одиночных клеток легких использовались для различения иммунного ландшафта с помощью проточной цитометрии в высокомерной проточной цитометрии на 6-й день после инфекции в модели Spn с использованием 18-цветной панели при сортировке флуоресцентных активированных клеток (FACS). С помощью t-распределенного стохастического встраивания соседей (t-SNE) можно визуализировать общие различия в составе иммунных клеток, примечательные повышенным количеством гранулоцитов (CD45+, CD11b+, CD24+, MHC-II-), интерстициальных макрофагов (CD45+, CD11b+, MHC-II-, CD24-), моноцитов (CD45+, CD11b+, MHC-II-, CD24-, CD64-), В-клеток (CD45+, CD19+) и Т-клеток (CD45+, CD3+), в том числе естественных киллеров (CD45+, CD3+, NK1.1+), как показано на рисунке 5. Стратегии стробирования показаны на рисунке 6.
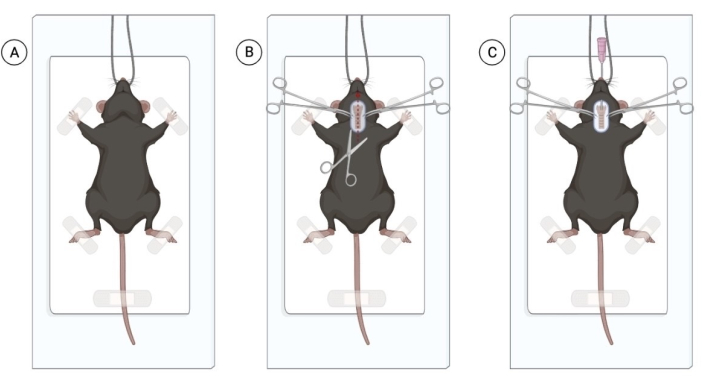
Рисунок 1: Хирургическая процедура интратрахеального закапывания живых бактерий. (A) Положение мыши в стерильной операционной зоне, подвешенной за резцы. (B) Область разреза и обнажение трахеи. (C) Процесс интубации: введение катетера 20 G. Рисунок создан с помощью Biorender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
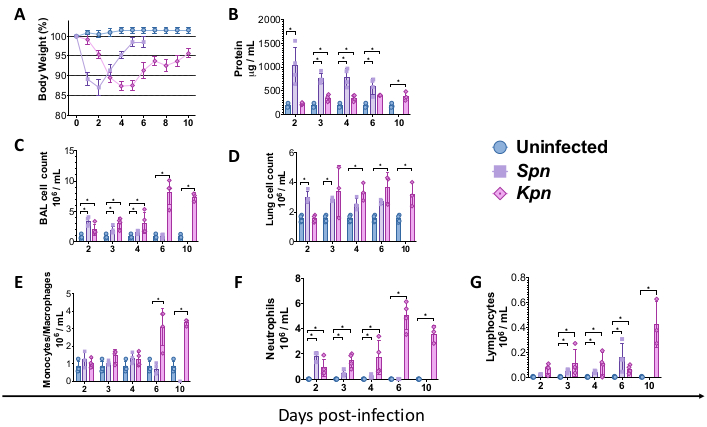
Рисунок 2: Профили острого повреждения легких (ОПЛ) после моделей пневмонии. (A) Масса тела с течением времени относительно исходного уровня, контроль в сравнении с Kpn и Spn (n = 4, в группе). (B) Количественное определение общего белка BAL с помощью анализа BCA (n = 4, на группу). (C) Общее количество клеток BAL в контроле (n = 3), Kpn (n = 4) и Spn (n = 3). (D) Общее количество клеток в легких в контроле (n = 3), Kpn (n = 4) и Spn (n = 3). (Э-Г) Дифференциация клеток BAL по ручному гистологическому подсчету цитоспина BAL в контроле (n = 3), Kpn (n = 4) и Spn (n = 3). Статистические тесты проводились с помощью индивидуального t-критерия, в котором сравнивались неинфицированные контрольные группы с инфицированными. *p < 0,05. Данные отображаются с использованием стандартной ошибки (SE) для каждого графика. Ось Y — это дни после заражения для всех панелей. Сокращения: BAL = бронхоальвеолярный лаваж; Spn = Streptococcus pneumoniae; Kpn = Klebsiella pneumoniae. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
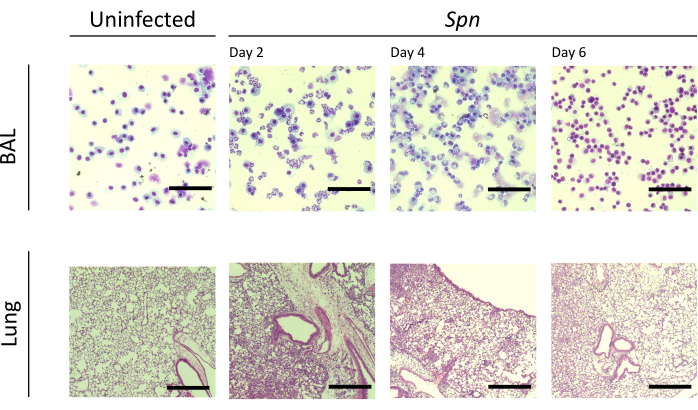
Рисунок 3: Гистопатологические данные легких во время инфекции Spn . Окрашивание гематоксилином и эозином (H&E) гистологических срезов репрезентативного БАЛ и легочного среза после внутритрахеальной инфекции Spn и на 2, 4 и 6 сутки. Увеличение BAL = 100x; увеличение легких = 10x. Сокращения: BAL = бронхоальвеолярный лаваж; Spn = Streptococcus pneumoniae. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
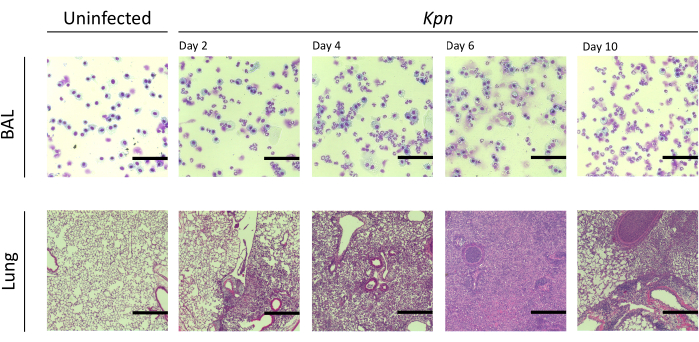
Рисунок 4: Гистопатологические данные легких во время инфекции KpN . Окрашивание гематоксилином и эозином (H&E) гистологических срезов репрезентативного БАЛ и легочного среза после внутритрахеальной инфекции Kpn на 2, 4, 6 и 10 сутки. Изображения показывают большое увеличение (масштабная линейка = 50 мкм). Сокращения: BAL = бронхоальвеолярный лаваж; Kpn = Klebsiella pneumoniae. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
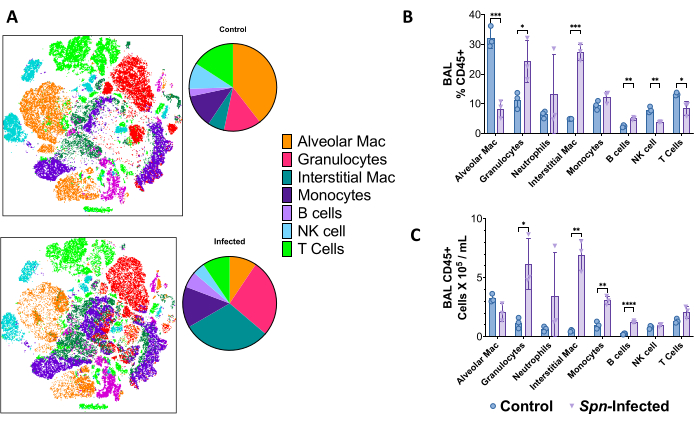
Рисунок 5: Иммунный клеточный ландшафт с помощью многоцветной проточной цитометрии через 6 дней после инфекции Spn . (A) Для визуализации популяций иммунных клеток (CD45+) легкого использовали Т-распределенное стохастическое встраивание соседей (t-SNE) при сравнении неинфицированных контрольных и инфицированных групп. (B) Сводка частот иммунных клеток из общего числа CD45+ клеток в легких. (C) Общее количество клеток в каждой отдельной популяции. Статистические сравнения проводились с помощью t-тестов между контрольной группой и инфицированными. *p < 0,05, **p < 0,01, ***p < 0,001. Данные отображаются с использованием стандартной ошибки (SE) для каждого графика. Сокращения: BAL = бронхоальвеолярный лаваж; Spn = Streptococcus pneumoniae. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Стратегии гейтинга для идентификации субпопуляции иммунных клеток в легких на исходном уровне и после пневмонии. БАЛ и суспензия клеток легких подвергались окрашиванию для многоцветной проточной цитометрии. Сначала мусор был закрыт с помощью SSC-A и FSC-A, а отдельные ячейки были закрыты с помощью двух стратегий (SSC-W против SSC-H и FSC-W против FSC-H). Живые клетки идентифицировали с помощью дискриминатора живого/мертвого в сравнении с SSC-A. Последующие клеточные популяции были идентифицированы по ранее идентифицированным маркерам 15. Сокращение: BAL = бронхоальвеолярный лаваж. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Экспериментальные мышиные модели ПНК предлагают платформу для оценки клеточных и молекулярных механизмов, лежащих в основе повреждения и разрешения ОРДС. Патофизиологические компоненты, которые могут быть оценены, включают ранние воспалительные пути, бактериальный клиренс, динамические изменения иммунного ландшафта, разрешение воспаления, фибропролиферацию, а также восстановление эпителия и сосудов16. Тем не менее, при планировании репликации этой модели поражения легких, вызванного пневмонией, необходимо учитывать несколько аспектов, включая возраст, пол, штамм мыши, внутренние факторы хозяина (например, иммунокомпрометированное состояние), используемый специфический патоген и бактериальную нагрузку, а также опыт персонала, выполняющего процедуру.
ПНА является одной из основных причин ОРДС. Мы решили использовать Spn и Kpn в прямом эфире, которые являются распространенными причинами внебольничной ПНК у людей, соответственно17. Мы предлагаем оптимизировать бактериальные модели ПНК путем титрования доз живых бактерий для достижения желаемого профиля смертности и разрешения травм, который наилучшим образом соответствует гипотезе исследователя. Мы оптимизировали внутритрахеальную инокуляцию бактерий в количестве 3 x 106 КОЕ для Spn и 200 КОЕ для Kpn у мышей, что вызывало альвеолярное воспаление, нарушение альвеолокапиллярного барьера и органную дисфункцию (рис. 2). Тем не менее, партии бактерий из разных источников или даже в пределах повторяющихся контуров могут демонстрировать разную степень воспаления и повреждения, даже при использовании одного и того же штамма и КОЕ.
Поэтому, чтобы воспроизвести результаты, представленные в этой рукописи, исследователям следует начать с описанной здесь концентрации бактерий; Однако для получения аналогичного модельного профиля может потребоваться увеличение или уменьшение дозы. Следовательно, каждая новая партия используемых бактерий должна быть оптимизирована с учетом их потенциального эффекта разрешения травм. Мы представляем надежную модель ПНК с двумя различными исходами разрешения, один саморазрешающийся (Spn) и другой медленно/неразрешающийся (Kpn), которые могут служить платформой для исследователей для оценки иммунологических механизмов и тестирования терапевтических вмешательств, особенно на пике инфекции или после нее (например, через 2 дня после инфекции).
Возраст, пол, деформация и генетические факторы влияют на кинетику паттернов разрешения травм16. Например, секс обеспечивает ускоренное разрешение у женщин по сравнению с мужчинами18; Таким образом, увеличение бактериальной нагрузки приводит к увеличению смертности и задержке разрешения у самцов по сравнению с самками. Старение является еще одним фактором, который следует учитывать при титровании КОЕ используемых бактерий. У стареющих мышей наблюдалась 100% смертность при использовании указанной дозы Spn (не показано здесь). Молодые мыши чаще всего используются в моделях пневмококковой ПНК (в возрасте от 6 до 14 недель), в то время как старые мыши (в возрасте 19-26 месяцев) демонстрируют измененный иммунный ответ и используются для исследования роли старения в ПНК11. Нам пришлось снизить КОЕ до 300%, чтобы добиться выживаемости у стареющих животных (здесь не показано). В этом исследовании использовались самцы мышей C57BL/6 (в возрасте 8-12 недель), за которыми наблюдали в течение 6-10 дней после заражения. Значительные различия в восприимчивости также могут быть обнаружены между штаммами; инбредные штаммы, такие как BALB/C и C57BL6/J, по-разному реагируют на инфекцию11,19.
Прямая инокуляция бактерий внутритрахеально позволяет более точно доставлять инокулюм (до 99%) в легкие12, представляя собой альтернативу менее вирулентным серотипам и уменьшая аэрозолизацию бактерий11. Однако можно утверждать, что это инвазивная процедура. Интубация может быть сложной задачей, требует системной анестезии и может привести к травме трахеи с последующим отеком дыхательных путей и стридором. У мышей может развиться вазовагальный рефлекс, который приводит к апноэ, для чего требуется небольшой мышиный аппарат искусственной вентиляции легких, чтобы обеспечить дополнительную поддержку вентилятора при необходимости. Опыт хирурга, выполняющего процедуру, является критически важным компонентом для обеспечения успешной интубации11. В нашем исследовании ни одна мышь не нуждалась в эвтаназии из-за соответствующего обезболивания и потери массы тела не более чем на 20%. Не было замечено никаких признаков боли и расстройства, таких как вялость, неспособность дотянуться до воды или пищи, затрудненное дыхание или снижение умственной активности. Альтернативным методом прямой доставки бактерий в легкие является орофарингеальная аспирация, хотя разрешение повреждения легких, по-видимому, происходит быстрее, и некоторые бактерии могут заканчиваться в желудке и желудочно-кишечном тракте.
Доклинические модели ПНК позволяют исследователям оценить иммунный ландшафт. Бронхоальвеолярные и интерстициальные компартменты могут быть оценены на предмет динамических изменений в иммунных клетках16. Кроме того, клетки могут быть культивированы и стимулированы ex vivo для определения их специфической продукции цитокинов и хемокинов. Здесь мы сосредоточимся на изучении ландшафта иммунных клеток в легких и BAL с помощью многоцветной проточной цитометрии. Секвенирование РНК отдельных клеток также может быть выполнено для понимания специфических для клеток транскриптомных сигнатур на разных стадиях разрешения травмы.
Модели PNA-ARDS генерируют системные эффекты, которые могут быть обнаружены на ранней стадии путем измерения массы тела втечение заболевания. Несмотря на то, что мы не измеряем системные эффекты ОРДС напрямую, органную дисфункцию также можно оценить с помощью измерения биохимических профилей крови и забора различных тканей, таких как селезенка, почки и печень, для гистологии. Системные эффекты пневмококковой ПНК-ОРДС ранее были описаны другими группами с использованием того же штамма бактерий21.
Здесь описывается модель экспериментальной ПНК, которая напоминает некоторые из ключевых патофизиологических открытий, лежащих в основе ОРДС человека. Несмотря нато, что не существует идеальных моделей, которые полностью повторяют сложность и гетерогенность ОРДС человека, эти модели актуальны и воспроизводимы для изучения механизмов повреждения и восстановления легких, а также служат платформой для идентификации новых потенциальных фармакологических мишеней, которые сосредоточены на ускорении разрешения воспаления легких и содействии восстановлению легких.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано грантом NIH R01 HL131812 и R01HL163881.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-200 µL Round 0.5 mm Thick Gel-Loading Pipet Tips | Corning | 4853 | |
| 2 mL Cryogenic vials | Corning Incorporated | 431420 | 2 mL self standing, round bottom, red cap, polypropylene |
| 2 mL Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Fisherscientific | 05-402-24C | Shape: Round, Length (Metric): 38mm, Diameter (Metric) Outer: 10mm, Capacity (Metric): 2mL |
| 70 µm Cell Strainer | Falcon | 352350 | White, Sterile, Individually Packaged |
| 96-well Clear Round Bottom | Falcon | 353077 | TC-treated Cell Culture Microplate, with Lid, Individually Wrapped, Sterile |
| Acepromizine Maleate Injection, USP 500 mg/50 mL (10mg/mL) | Phoenix | NDC 57319-604-04 | EACH mL CONTAINS: acepromazine maleate 10 mg, sodium citrate 0.36%, Citric acid 0.075%, benzyl alcohol 1% and water for injection. |
| Ammonium-Chloride-Potassium (ACK) Lysing Buffer | Quality Biological | 118-156-721 | 4 x 100mL |
| Anti-mouse I-A/I-E | Biolegend | 107628 | APC/Cyanine7 anti-mouse I-A/I-E [M5/114.15.2]; Isotype: Rat IgG2b |
| BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| BD Trypticase Soy Agar | BD-Biosciences | 90001-276 | 5% Sheep Blood Prepared Media Stacker Plates, BD Diagnostics |
| Biotix Disposable Reagent Reservoirs | Biotix | 89511-194 | |
| Bovine Serum Albumin | Sigma-Aldrih | A4503 | |
| CD103 | Invitrogen | 509723 | Integrin alpha E) Armenian Hamster anti-Mouse, FITC, Clone: 2E7 |
| CD11b | Invitrogen | RM2817 | PE-Texas Red, Clone: M1/70.15, Invitrogen |
| CD11c | BD Biosciences | 565872 | Hamster anti-Mouse, APC-R700, Clone: N418, BD Horizon |
| CD19 | Biolegend | 152410 | APC anti-mouse CD19 [1D3/CD19]; Isotype: Rat IgG2a, κ |
| CD24 | BD Biosciences | 563450 | Rat anti-Mouse, Brilliant Violet 711, Clone: M1/69 |
| CD4 | BD Biosciences | 563790 | BUV395; Clone: GK1.5 |
| CD45 | Biolegend | 103157 | Brilliant Violet 750 anti-mouse CD45 [30-F11]; Isotype: Rat IgG2b, κ; |
| CD8a | BD Biosciences | 612759 | Rat anti-Murine, Brilliant Ultraviolet 737, Clone: 53-6.7 |
| Cell Counting Slides | Bio-rad | 1450017 | For TC20 Cell Counter |
| Cell strainer 70 µL Nylon | Falcon | 198718 | REF 352350 |
| Collagenase Type1 | Worthington Biochemical Corporation | LS004197 | |
| Culti-Loop Streptococcus pneumoniae | Thermo Scientific | R4609015 | ATCC 4961 |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrih | DN25 | |
| Disposable inoculation loops/needles | Fisherbrand | 22-363-603 | Color blue; Volume 1 µL |
| DMEM (Dulbecco’s Modified Eagle’s Medium) | Corning | 10-014-CV | |
| Fc Block | BD Biosciences | 553142 | CD16/CD32 Rat anti-Mouse, Unlabeled, Clone: 2.4G2 |
| Formalin solution | Sigma-Aldrih | HT501640 | Formalin solution, neutral buffered, 10% |
| Gauze Sponges, Covidien | Curity | 2146- | |
| gentleMACS C Tubes | MACS Miltenyi Biotec | 130-093-237 | |
| gentleMACS Dissociator | MACS Miltenyi Biotec | 130-093-235 | SN: 4715 |
| Hema 3 Manual Staining System and Stat Pack | Thermo Scientific | 23123869 | |
| Isoflurane Liquid Inhalation | Henry Schein | 1182097 | |
| IV CATHETER JELCO 20GX1.25" | Hanna Pharmaceutical Supply Co., Inc | 405611 | |
| Ketamine HCl Injection | Henry Schein | 1049007 | Ketamine HCl Injection MDV 100mg/mL 10mL 10/Box |
| Klebsiella pneumoniae | ATCC | 43816 | subsp. pneumoniae (Schroeter) Trevisan |
| Loctite 409 | Electron Microscopy Sciences | 7257009 | |
| Ly-6C | Biolegend | 128036 | Brilliant Violet 605 anti-mouse Ly-6C [HK1.4]; Isotype: Rat IgG2c |
| Ly-6G | BD Biosciences | 740157 | Rat anti-Mouse, Brilliant Violet 510, Clone: 1A8, BD Optibuild |
| MiniVent Type 845 | Hugo Sachs Elektronik- Harvard Apparatus | 4694 | D-79232 March (Germany) |
| NK-1.1 | BD Biosciences | 553165 | Mouse anti-Mouse, PE, Clone: PK136, BD |
| Phase Hemacytometer | Hausser Scientific | 1475 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | 1X without calcium and magnesium, |
| Round Bottom | Sarstedt | 55.476.305 | |
| Round-Bottom Polystyrene Test Tubes | Falcon | 352235 | With Cell Strainer Snap Cap, 5mL |
| SealRite 1.5 mL Natural Microcentrifuge Tube | USA Scientific | 1615-5500 | Free of detectable Rnase, DNase, DNA and pyrogens. |
| Shandon EZ Single Cytofunnel | Epredia | A78710003 | |
| Siglec-F | BD Biosciences | 562681 | Anti-Mouse, Brilliant Violet 421, Clone: E50-2440 |
| Silk Black Braided 30"(75 cm) Sterile, nonabsorbable surgical suture U.S.P. | Ethicon | K-834 | 0 (3.5 metric) |
| Stainless-Steel Slide Clip | Epredia | 59910052 | |
| Sterile Single Use Vacuum Filter Units | Thermo Scientific | 1660045 | |
| Syringe sterile, single use, 1 mL | BD-Biosciences | 309628 | |
| TC20 Automatic Cell Counter | Bio-Rad | 508BR05740 | |
| TipOne 200 ul yellow pipet tip refill | USA Scientific | 1111-0706 | |
| TODD HEWITT BROTH | RPI | T47500 | |
| TPX Sample Chamber | Epredia | A78710018 | |
| TPX Single Sample Chamber, Caps and Filter Cards | Epredia | 5991022 | |
| Trypan Blue | Bio-rad | 1450022 | |
| U-100 Insulin Syringes | BD-Biosciences | 329461 | |
| Wet-Proof Multi-Heat Electric Heat Pad | Cullus | Model PR7791AB | 120 volst AC; 45 watts; Listed 562B/E26869 |
Ссылки
- Bellani, G., et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 315 (8), 788-800 (2016).
- Hariri, L., Hardin, C. C. Covid-19, angiogenesis, and ARDS endotypes. The New England Journal of Medicine. 383 (2), 182-183 (2020).
- Ferguson, N. D., et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Medicine. 38 (10), 1573-1582 (2012).
- Tomashefski Jr, J. F. Pulmonary pathology of the adult respiratory distress syndrome. Clinics in Chest Medicine. 11 (4), 593-619 (1990).
- Martin, T. R. Lung cytokines and ARDS: Roger S. Mitchell lecture. Chest. 116 (1 Suppl), 2S-8S (1999).
- Colletti, L. M., et al. Role of tumor necrosis factor-alpha in the pathophysiologic alterations after hepatic ischemia/reperfusion injury in the rat. The Journal of Clinical Investigation. 85 (6), 1936-1943 (1990).
- Donnelly, S. C., et al. The association between mortality rates and decreased concentrations of interleukin-10 and interleukin-1 receptor antagonist in the lung fluids of patients with the adult respiratory distress syndrome. Annals of Internal Medicine. 125 (3), 191-196 (1996).
- Miller, E. J., Cohen, A. B., Matthay, M. A. Increased interleukin-8 concentrations in the pulmonary edema fluid of patients with acute respiratory distress syndrome from sepsis. Critical Care Medicine. 24 (9), 1448-1454 (1996).
- Matute-Bello, G., et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals. American Journal of Respiratory Cell and Molecular Biology. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 66 (2), e1-e14 (2022).
- Borsa, N., Pasquale, M. D., Restrepo, M. I. Animal models of pneumococcal pneumonia. International Journal of Molecular Sciences. 20 (17), 4220(2019).
- Rubins, J. B., et al. Dual function of pneumolysin in the early pathogenesis of murine pneumococcal pneumonia. The Journal of Clinical Investigation. 95 (1), 142-150 (1995).
- Thermo Scientific, Pierce BCA Protein Assay Kit. , https://www.thermofisher.com/order/catalog/product/23225 Forthcoming.
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. Journal of Visualized Experiments. (29), e1266(2009).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 61 (2), 150-161 (2019).
- Aeffner, F., Bolon, B., Davis, I. C. Mouse models of acute respiratory distress syndrome: a review of analytical approaches, pathologic features, and common measurements. Toxicologic Pathology. 43 (8), 1074-1092 (2015).
- Torres, A., et al. Pneumonia. Nature Reviews Disease Primers. 7 (1), 25(2021).
- Xiong, Y., et al. Estradiol resolves pneumonia via ERβ in regulatory T cells. JCI Insight. 6 (3), e133251(2021).
- D'Alessio, F. R., et al. Enhanced resolution of experimental ARDS through IL-4-mediated lung macrophage reprogramming. American Journal of Physiology. Lung Cellular and Molecular Physiology. 310 (8), L733-L746 (2016).
- D'Alessio, F. R. Mouse models of acute lung injury and ARDS. Methods in Molecular Biology. 1809, 341-350 (2018).
- Gotts, J. E., et al. Clinically relevant model of pneumococcal pneumonia, ARDS, and nonpulmonary organ dysfunction in mice. American Journal of Physiology. Lung Cellular and Molecular Physiology. 317 (5), L717-L736 (2019).
Erratum
Formal Correction: Erratum: Experimental Model to Evaluate Resolution of Pneumonia
Posted by JoVE Editors on 6/13/2023. Citeable Link.
An erratum was issued for: Experimental Model to Evaluate Resolution of Pneumonia. A figure was updated.
Figure 2 was updated from:

to:

Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены