Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Многопоточный перфузионный биореактор, интегрированный с фракционированием на выходе для динамической клеточной культуры
В этой статье
Резюме
В данной работе представлен метод построения и эксплуатации недорогой многоканальной перфузионной системы клеточных культур для измерения динамики секреции и скорости всасывания растворенных веществ в клеточных процессах. Система также может подвергать клетки динамическим профилям стимулов.
Аннотация
Некоторые клеточные и тканевые функции работают в динамической шкале времени от минут до часов, которые плохо разрешаются обычными системами культивирования. В рамках этой работы была разработана недорогая система перфузионного биореактора, которая позволяет непрерывно перфузить культуральную среду в модуль клеточной культуры и фракционировать в последующем модуле для измерения динамики в этом масштабе. Система построена почти полностью из коммерчески доступных частей и может быть распараллелена для проведения независимых экспериментов в обычных многоскважинных пластинах клеточной культуры одновременно. В этой видеостатье показано, как собрать базовую установку, для параллельной обработки до шести культур требуется только один многоканальный шприцевой насос и модифицированный дробовой коллектор. Также представлены полезные варианты модульной конструкции, которые позволяют контролировать динамику стимуляции, такую как импульсы растворенного вещества или фармакокинетические профили. Важно отметить, что, поскольку сигналы растворенного вещества проходят через систему, они искажаются из-за дисперсии растворенного вещества. Кроме того, описан метод измерения распределения времени пребывания (RTD) компонентов перфузионной установки с помощью индикатора с использованием MATLAB. RTD полезны для расчета того, как сигналы растворенного вещества искажаются потоком в многокамерной системе. Эта система очень надежна и воспроизводима, поэтому фундаментальные исследователи могут легко принять ее без необходимости в специализированных производственных мощностях.
Введение
Многие важные биологические процессы происходят в клеточных и тканевых культурах во временной шкале от минут до часов 1,2,3. Хотя некоторые из этих явлений могут наблюдаться и регистрироваться автоматизированным способом с использованием покадровой микроскопии4, биолюминесценции1 или других методов, эксперименты, включающие сбор образцов супернатантов культуры для химического анализа, часто выполняются вручную в статических клеточных культурах. Ручной отбор проб ограничивает осуществимость некоторых исследований из-за неудобств, связанных с частыми или нерабочими периодами отбора проб. Другие недостатки методов статического культивирования включают эксперименты, включающие контролируемое, преходящее воздействие химических стимулов. В статических культурах стимулы должны добавляться и удаляться вручную, а профили стимулов ограничены ступенчатыми изменениями с течением времени, в то время как изменения среды также добавляют и удаляют другие компоненты среды, которые могут влиять на клетки неконтролируемым образом5. Жидкостные системы могут преодолеть эти проблемы, но существующие устройства создают другие проблемы. Микрофлюидные устройства сопряжены с непомерно высокими затратами на специализированное оборудование и обучение для производства и использования, требуют микроаналитических методов для обработки образцов, а клетки трудно восстановить из устройств после перфузии6. Несколько макрофлюидных систем были созданы для типов экспериментов, описанных здесь 7,8,9,10, и они построены из нескольких пользовательских деталей, изготовленных собственными силами, и требуют нескольких насосов или дробных коллекторов. Кроме того, авторам не известно о каких-либо коммерчески доступных макрофлюидных перфузионных клеточных культурах, кроме перемешиваемых резервуарных биореакторов для культуры суспензии, которые полезны для биопроизводства, хотя и не предназначены для моделирования и изучения физиологии.
Авторы ранее сообщали о конструкции недорогой перфузионной биореакторной системы, состоящей почти полностью из коммерчески доступных частей11. Базовая версия системы позволяет хранить несколько культур в пластине скважины в инкубаторе CO2 и непрерывно перфузить средой из шприцевого насоса, в то время как потоки сточных вод из культур автоматически фракционируются в образцы с течением времени с использованием дробного коллектора с пользовательской модификацией. Таким образом, эта система позволяет осуществлять автоматизированный отбор проб супернатанта питательной среды и непрерывный ввод растворенного вещества в культуры с течением времени. Система является макрофлюидной и модульной и может быть легко модифицирована для удовлетворения потребностей новых экспериментальных конструкций.
Общая цель метода, представленного здесь, состоит в том, чтобы построить, охарактеризовать и использовать систему перфузионных клеточных культур, которая позволяет проводить эксперименты, в которых измеряются скорости секреции или поглощения веществ клетками с течением времени и/или клетки подвергаются воздействию точных, переходных сигналов растворенного вещества. В этой видеостатье объясняется, как собрать базовую установку, которая способна перфузить до шести клеточных культур одновременно с помощью одного шприцевого насоса и модифицированного дробового коллектора. Два полезных варианта базовой системы, которые используют дополнительные насосы и детали для проведения экспериментов, которые подвергают клетки переходным сигналам концентрации растворенного вещества, включая короткие импульсы и фармакокинетические профили12, также представлены на фиг.1.
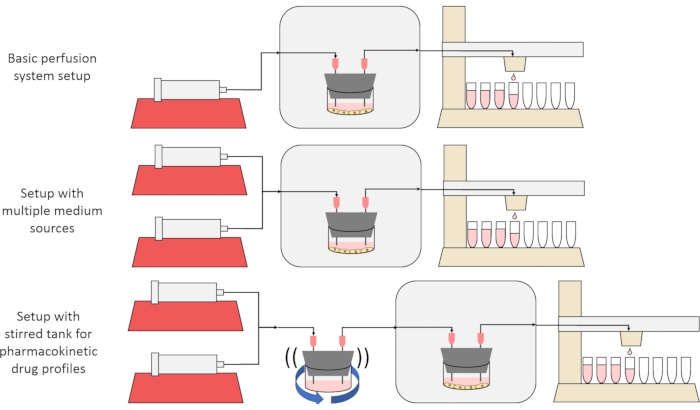
Рисунок 1: Три варианта конструкции перфузионной системы. (Вверху) Базовая перфузионная система. (Средний) Перфузионная система с запорным краном для нескольких средних источников. (Внизу) Перфузионная система с перемешиваемым резервуаром для имитации хорошо смешанного объема распределения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Из-за дисперсии и диффузии внутри потока сигналы растворенного вещества искажаются или «размазываются» по мере их прохождения через систему потока. Это искажение может быть количественно определено с помощью распределений времени пребывания (RTD)13. В этой статье объясняется, как проводить трассирующие эксперименты на компонентах перфузионной системы (рисунок 2), и приводятся сценарии MATLAB для генерации RTD из измеренных данных. Подробное объяснение этого анализа можно найти в предыдущей статье авторов11. Дополнительные скрипты MATLAB подгоняют соответствующие функции к RTD и извлекают физические параметры, а также выполняют свертку сигнала с использованием RTD для прогнозирования того, как ввод сигнала растворенного вещества пользователем будет распространяться и искажаться через перфузионную систему14.
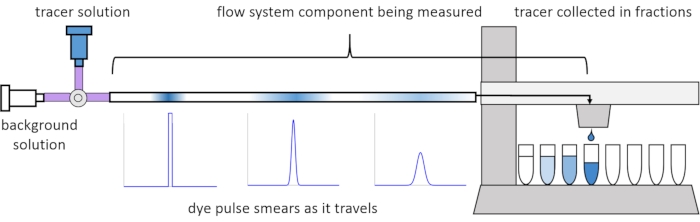
Рисунок 2: Распределение времени проживания. RTD компонентов проточной системы, такие как эта длина трубки, измеряются путем ввода импульса индикатора в систему и измерения того, как он «размазывается» к тому времени, когда он выходит в собранные фракции. Эта цифра была изменена по сравнению с Erickson et al.11. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовьте детали для перфузии плиты скважины
- Подготовка трубок
- Нарежьте две длины силиконовых трубок (внутренний диаметр 1,6 мм) для каждой культуры клеток, подлежащей перфузии. Убедитесь, что кусок, используемый в качестве трубки для восходящей трубы, достаточно длинный, чтобы достичь от шприцевого насоса до клеточной культуры внутри инкубатора, и что нисходящий кусок может достигать от клеточной культуры до самого дальнего расширенного положения коллектора фракций.
- Присвойте каждому куску трубки уникальную этикетку на обоих концах с помощью маркированной ленты.
- Подготовьте пробки для плиты скважины
- Получите одну силиконовую пробку для каждой скважины пластины скважины, которая должна быть перфузирована, с соответствующим диаметром, чтобы плотно прилегать к скважинам с герметичным уплотнением.
- Отрежьте лишние материалы со дна пробки, чтобы они поместились в колодцы, оставляя внутри пространство для воздуха выше предполагаемого уровня жидкости.
- Протолкните две тупые иглы 18 G через каждую пробку, в верхнюю часть и наружу снизу, чтобы служить входом и выходом для потока через скважину, диаметрально противоположные друг другу, чтобы максимизировать расстояние между их кончиками внутри скважины.
- Отрегулируйте высоту игл внутри закупоренного колодца, так как высота выходной иглы будет определять стабильную высоту уровня жидкости в скважине во время перфузии.
ПРИМЕЧАНИЕ: Если перфузию начать с выпускной иглы выше уровня жидкости, то жидкость будет накапливаться в колодце до тех пор, пока уровень не достигнет иглы. Если перфузия начинается с выпускной иглы ниже уровня жидкости, уровень жидкости будет оставаться стабильным, если пузырьки воздуха не потекут в скважину, что приведет к снижению высоты жидкости до тех пор, пока она не достигнет той же высоты, что и выпускная игла.
- Соберите дополнительные детали
- Получите один стерильный шприц для каждой культуры клеток, который должен быть перфузирован, который достаточно велик, чтобы содержать достаточное количество среды для всей перфузии, плюс дополнительное количество среды для первоначального заполнения трубки.
- Для каждой культуры, подлежащей перфузии, приобретите один соединитель Luer от самки к барбусу и два разъема Luer от самца к барбу, а также два женских и два мужских колпачка Luer.
- Очистка и стерилизация деталей
- Если детали использовались ранее, очистите их, перфузировав их 0,1 N NaOH, а затем промойте деионизированной водой.
- Путем автоклавирования или иным образом обеспечьте стерильность всех деталей, перечисленных выше.
2. Лазерная резка многоголовочного дозатора и прикрепление его к коллектору фракций
- Воссоздайте модель многоголовочного диспенсера из рисунка 3 в программе автоматизированного проектирования или загрузите предоставленный файл модели DXF (Дополнительный файл 1).
- Используйте лазерный резак, чтобы вырезать конструкцию из 1/8 акрилового листа.
- Снимите три винта, прикрепляющие дозирующую головку к движущемуся основанию коллектора фракций.
- Совместите три самых маленьких отверстия в многоголовочном дозаторе с отверстиями для винтов в движущемся основании и вкрутите винты обратно через отверстия для крепления.
- Отрегулируйте герметичность трех винтов, чтобы угол многоголовочного дозатора вверх и вниз до тех пор, пока ряд дозирующих отверстий не будет выровнен с трубками для сбора под ним.
- Осторожно поместите наконечники пипетки объемом 300 мкл через нужные отверстия, чтобы они служили в качестве дозирующих наконечников.
ПРИМЕЧАНИЕ: Дробный коллектор можно использовать без многоголовочного дозатора для перфузии одной клеточной культуры.
3. Измерьте компонентные RTD и выполните свертку сигнала
- Настройте насосы и шприцы для индикаторного импульса, как показано на рисунке 2.
- Получите два одноканальных или многоканальных шприцевых насоса.
- Выберите фоновое решение для представления среды, которая будет использоваться в системе потока во время экспериментов с клеточными культурами. Убедитесь, что фоновое решение обладает свойствами массопереноса, аналогичными свойствам среды. Во многих случаях деионизированная вода является подходящим выбором.
- Выберите индикаторное вещество для представления растворенного вещества, которое будет представлять интерес во время экспериментов с клеточными культурами. Убедитесь, что индикатор обладает свойствами массопереноса, аналогичными интересующему растворенному веществу, и его концентрация должна быть измерена. Во многих случаях пищевой краситель является подходящим выбором.
- Растворите индикаторное вещество в фоновом растворе, чтобы получился индикаторный раствор.
- Наполните один шприц фоновым раствором и загрузите его в один шприцевой насос. Наполните другой шприц трассирующим раствором и загрузите его во второй шприцевой насос.
- Подключите оба шприца к двум из трех портов четырехходового запорного крана с помощью разъемов Luer.
- Закройте запорный кран к фоновому раствору и закачивайте трассирующий раствор в запорный кран до тех пор, пока он не начнет капать из открытого порта. Остановите насос и не регулируйте шприц дальше.
ПРИМЕЧАНИЕ: Важно, чтобы движущийся стержень шприцевого насоса прижимался к плунжерам шприцев до начала синхронизированных частей эксперимента. Это позволит потоку начаться сразу после запуска насоса. В противном случае насос может быть запущен, но поток фактически не начнется, пока движущаяся штанга не догонит положение плунжера. - Закройте запорный кран к трассирующему раствору и перекачивайте фоновый раствор в запорный кран до тех пор, пока весь остаточный раствор индикатора не будет смыт из открытого порта. Остановите насос и не регулируйте шприц дальше.
- Настройка интересующего компонента системы потока и дробного коллектора
- Настройте компонент системы потока, необходимый для анализа RTD. Убедитесь, что измеряемый компонент заканчивается куском трубки подходящей длины и гибкости для достижения коллектора фракций во время работы.
- Вставьте конец трубки ниже по потоку в дозатор с наконечником пипетки в многоголовочном дозаторе таким образом, чтобы он был плотно подключен.
- Прикрепите открытый порт четырехходового запорного крана к входному отверстию измеряемого компонента. Прокачивайте фоновый раствор через компонент до тех пор, пока он не будет полностью заполнен, как это было бы во время эксперимента с клеточной культурой, и он начнет капать из дозирующего наконечника коллектора фракций. Остановите насос.
- Впрыскивание индикаторного импульса, сбор фракций и измерение индикатора
- Установите насос для трассирующего раствора на желаемую скорость потока. Закройте запорный кран к фоновому раствору и запустите поток трассирующего раствора. Одновременно запускаем дробный коллектор.
- Продолжайте поток индикаторного раствора в течение короткого периода времени, чтобы приблизить импульсный вход индикатора. Было обнаружено, что длительность импульса 10 мин хорошо работает для RTD при скорости потока 1 мл / ч.
ПРИМЕЧАНИЕ: Если пульс индикатора слишком короткий, в поток войдет недостаточно трассировщика, чтобы его можно было измерить. Если импульс слишком длинный, он больше не будет приближаться к импульсу и изменит форму RTD. - В конце импульсного периода индикаторного раствора остановите насос индикаторного раствора. Быстро закройте запорный кран к трассирующему раствору и запустите поток фонового раствора с той же скоростью потока.
- Позвольте фоновому раствору течь и фракциям собираться до тех пор, пока весь индикатор не пройдет через систему и не попадет в собранные фракции.
- Остановите систему и измерьте концентрацию индикатора во фракциях. Включают только те фракции, которые были дозированы полностью. Если сбор остановлен частично через сбор дроби, не включайте эту дробь.
- Вычисление распределения времени пребывания (RTD) на основе измеренных данных в MATLAB
ПРИМЕЧАНИЕ: Письменное объяснение анализа, выполненного с помощью этого сценария MATLAB, можно найти в предыдущей публикации авторов11, а обсуждение теории широко доступно в литературе13.- Создайте файл .xlsx, содержащий данные о концентрации в формате электронной таблицы example_tracer_data.xlsx, представленной в дополнительном файле 2. Введите значения концентрации индикатора в дробях (любых единицах) в хронологическом порядке слева направо в строке 2. Введите время, прошедшее от начала импульса до конца последней фракции в ячейке A5, и введите длину индикаторного импульса в минутах в ячейке A8.
- Сохраните файл .xlsx в каталоге MATLAB.
- Откройте сценарий RTD_From_Data.m из дополнительного файла 3 в редакторе MATLAB.
- Замените имя файла .xlsx в скобках в первой строке раздела Load Data скрипта именем нового файла данных .xlsx, следуя инструкциям, написанным в файле скрипта. Запустите сценарий.
- Убедитесь, что сценарий успешно выполняет RTD-анализ13, создавая график RTD и возвращая значение числового интеграла над RTD, равное 1. Найдите вектор времени (t) и связанный с ним вектор значений RTD (Et), сохраненный скриптом в каталог MATLAB.
- Подгонка функции модели к RTD в MATLAB
- Откройте сценарий Fit_RTD_Function.m в редакторе MATLAB из дополнительного файла 4.
- Выберите одну из трех закомментированных функций модели, чтобы соответствовать RTD: осевая дисперсионная модель13, которая подходит для RTD для ламинарного потока в цилиндрических трубках; модель CSTR13, которая подходит для хорошо перемешиваемых резервуаров; и модель n-CSTR15, которая примерно подходит для более крупных плит скважин. Чтобы соответствовать другой модели, не включенной здесь, добавьте ее в скрипт в том же формате.
- Удалите комментарии в разделе скрипта, содержащем модель, выбранную для подгонки.
- Измените значения начальных догадок для параметров на те, которые соответствуют RTD.
- Запустите сценарий, чтобы создать график функции fit, наложенной на данные RTD, и распечатать значения параметров fit для функции. Если подгонка очень плохая или возникают ошибки, измените параметр начальных догадок и запустите скрипт заново.
- Выполнение свертки сигнала в MATLAB
- Выберите один сигнал и один RTD или два RTD для свертки.
- Откройте сценарий Signal_Convolution.m из дополнительного файла 5 в редакторе MATLAB.
- Для каждого из двух свернувшихся сигналов (т.е. одного сигнала и одного RTD, или двух RTD), определите один вектор равномерно расположенных временных точек в нужных единицах и соответствующий вектор значений сигнала в эти моменты времени.
ПРИМЕЧАНИЕ: Векторы двух сигналов должны иметь одинаковое количество элементов и одинаковый размер временных шагов. Вот почему полезно иметь RTD в качестве непрерывной функции, которая может быть сэмплирована для произвольного числа точек на любом временном интервале. - Введите два сигнала в MATLAB и запустите скрипт для получения времени и векторов сигнала выходного сигнала.
4. Настройте базовую перфузионную систему с ячейками в пластине скважины
- Подготовьте плиту колодца
- Убедитесь, что культура плит скважин имеет подходящую среднюю глубину для эксперимента по перфузии. Выполните любые окончательные изменения среды, стимуляции или другие шаги по желанию до начала перфузии. Если суспензионные ячейки перфузируются, центрифугируйте пластину, чтобы убедиться, что они находятся на дне.
- В стерильных условиях вводят пробки с иглами в колодец пластинчатых культур с подтянутыми вверх иглами. После того, как пробка будет на месте, опустите иглы на нужную высоту для перфузии, так как высота выходной иглы определяет стабильный уровень жидкости.
- Закройте иглы мужскими колпачками Luer и держите всю пластину колодца в инкубаторе до использования.
- Подготовьте шприцы и трубки для верхней части
- В стерильных условиях заполните один шприц для каждой культуры, чтобы она была перфузирована, достаточным количеством среды для желаемой продолжительности перфузии, а также достаточным количеством дополнительной среды для заполнения трубки вверх по течению.
- Прикрепите трубку вверх по течению к шприцу с помощью разъема Luer. На другом конце трубки вставьте разъем Luer между мужчинами и барбами.
- Дозируйте среду из шприца до тех пор, пока трубка вверх по течению не будет полностью заполнена средой.
- Закройте открытый конец трубки женским колпачком Luer.
ПРИМЕЧАНИЕ: На данный момент все реплицируемые шприцы должны иметь точно такой же объем. Если их объемы не равны, их плунжеры будут находиться в разных положениях, и не все они хорошо впишутся в единый многоканальный шприцевой насос.
- В стерильных условиях вставьте разъем Luer между мужчинами и барбами в один конец трубки, расположенной ниже по течению, и закройте его женским колпачком Luer.
- Аккуратно поднесите все подготовленные трубки, шприцы и плиту колодца в инкубатор, который будет использоваться для перфузии.
- Поместите шприцевой насос и дробной коллектор в нужных местах рядом с инкубатором. Поместите шприцевой насос поверх инкубатора или рядом с ним, а коллектор фракций поместите рядом с инкубатором, рядом с портом.
- Соедините вместе закрытые концы всех труб вверх и вниз по течению и протолкните их с внешней стороны инкубатора внутрь через порт.
- Загрузите шприцы в шприцевой насос и вставьте открытые концы последующих трубок в наконечники дозирующих пипеток многоголовочного дозатора коллектора фракций.
- Внутри инкубатора вытяните как можно больше трубок вверх по течению в инкубатор, чтобы максимизировать длину трубки, через которую текущая среда может получать тепло и CO2 из воздуха инкубатора. Удерживая их на месте, вытащите трубки вниз по течению из инкубатора, ровно настолько, чтобы они могли достичь самой дальней расширенной точки на коллекторе фракций, сохраняя при этом закрытые концы внутри инкубатора.
- Для каждого закупоренного колодца быстро снимите крышку иглы и трубки вверх и вниз по течению для этой скважины и прикрепите их вместе с разъемами Luer.
- После того, как все части соединены, кратковременно запустите шприцевой насос на относительно высокой скорости, чтобы убедиться, что все потоки текут должным образом.
- На этом этапе, если есть желание начать эксперимент с нижестоящими трубками, полными среды, продолжайте работу насоса до тех пор, пока все не будут заполнены. В противном случае остановите насос.
- Установите расход шприцевого насоса и частоту сбора фракций и запустите обе машины одновременно, чтобы начать эксперимент. Собирайте дроби на нужную продолжительность эксперимента.
5. Настройка перфузионной системы с запорным краном для нескольких источников среды
- Выполните все подшаги шага 4.1 выше.
- Подготовьте два носителя для использования в перфузии, пометив среду, которая будет дозироваться сначала как 1, а другую как среду 2.
- Чтобы каждая культура была перфузирована, заполните один шприц достаточным количеством среды 1 на время его дозирования, плюс достаточный объем, чтобы первоначально заполнить перфузионную систему. Наполните второй шприц достаточным количеством среды 2 на время его дозирования.
- Подключите оба шприца к двум из трех портов четырехходового запорного крана.
ПРИМЕЧАНИЕ: Может потребоваться длина трубки для подключения шприцев к запорным кранам. - Подготовьте запорный кран и шприцы аналогично шагам 3.1.7-3.1.8 выше, закрыв запорный кран до среды 1 и распределив среду 2 в запорный кран до тех пор, пока он не начнет капать из открытого порта.
- Закройте запорный кран до среды 2 и поместите среду 1 в запорный кран до тех пор, пока вся остаточная среда 2 не будет смыта из открытого порта.
- Прикрепите трубку вверх по течению к открытому отверстию запорного крана с помощью разъема Luer от гнезда к барбу. На другом конце трубки вставьте разъем Luer между мужчинами и барбами.
- Дозируйте среду 1 из шприца до тех пор, пока трубка вверх по течению не будет полностью заполнена средой.
- Перейдите к этапам 4.3-4.11 выше, загрузив оба шприца в отдельные шприцевые насосы и только дозирующую среду 1.
- Установите расход шприцевого насоса для среды 1 и частоту сбора фракций, и запустите обе машины одновременно, чтобы начать эксперимент.
- Когда источник среды должен быть заменен, быстро остановите шприцевой насос для среды 1, поверните закрытый запорный кран на среду 1 и запустите шприцевой насос для среды 2. При желании позже аналогичным образом переключите источник обратно на средний 1.
- Собирайте дроби на нужную продолжительность эксперимента.
6. Настройте перфузионную систему с перемешиваемым резервуаром для имитации фармакокинетики
- Получить фармакокинетические данные для интересующего препарата и убедиться, что он состоит из пика концентрации, за которым следует экспоненциальный распад.
- После установки пика на время 0 и удаления точек данных до пика используйте сценарий Stirred_Tank_Fit.m (дополнительный файл 6), чтобы подогнать уравнение RTD перемешиваемого резервуара к данным. Ввод v (желаемый расход перфузии) и данные, которые должны быть помещены в виде пары векторов непосредственно в скрипт, наряду с t и C для значений времени и концентрации соответственно. Запустите скрипт для печати параметра V, который является требуемым объемом перемешиваемого резервуара.
- Спланируйте компоновку перфузионной системы, чтобы включить два шприцевых насоса и пластинчатый шейкер перед инкубатором.
- Измерьте RTD компонентов перфузионной системы за пределами запорного крана и выполните свертку сигналов RTD с различной длительностью и концентрациями пульса лекарственного средства, чтобы найти соответствующий фармакокинетический профиль. В этом расчете используйте уравнение RTD с перемешиваемым резервуаром.
- Перейдите к шагам 5.1-5.8 выше.
- Используйте дополнительную пластину скважины соответствующего размера в качестве перемешиваемого резервуара для установки. Каждая скважина может служить перемешиваемым резервуаром для одной перфузированной культуры. Наполните лунку необходимым объемом среды, V, и заткните лунку иглами, сначала подтянутыми вверх, затем вытолкнутыми на дно колодца, и заколочите иглы.
- Загрузите шприцы в шприцевые насосы и быстро подключите трубку от шприцев к закрытым входным иглам перемешиваемых резервуаров. Затем соедините клеточную культуру перед входными отверстиями трубки с выходными иглами перемешиваемых резервуаров.
- Выполните шаги 5.9-5.10.
- В желаемое время переключают на дозирующую среду 2, содержащую лекарственное средство, как описано на этапе 5.11. Переключитесь обратно на среду 1, когда инфузия препарата будет завершена.
- Перейдите к шагу 5.12.
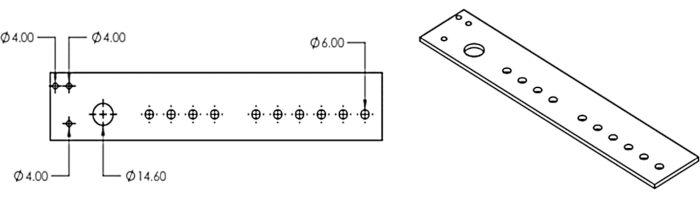
Рисунок 3: Многоголовочный дозатор. Конструкция для многоголовочного дозатора лазерной резки. Эта цифра была изменена по сравнению с Erickson et al.11. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Перфузионная система с несколькими источниками среды из раздела 5 протокола использовалась для измерения динамики экспрессии репортерного гена, управляемого ядерным фактором каппа-лёгкой цепью-энхансером активированных В-клеток (NF-κB) транскрипционного фактора в клетках эмбриональн...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В данной работе описывается сборка и функционирование системы перфузионной клеточной культуры с несколькими источниками среды, продемонстрированной на конкретном примере, в котором измерялась динамика экспрессии генов, управляемых NF-κB, в ответ на переходный импульс TNF-α. RtD компонент...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Это исследование было проведено при поддержке гранта Nos. R01EB012521, R01EB028782 и T32 GM008339 от Национальных институтов здравоохранения.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
Ссылки
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153(2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305(2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673(2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213(2021).
- Saltzman, W. M. Drug Delivery: Engineering Principles for Drug Therapy. , Oxford University Press. (2001).
- Fogler, H. S. Elements of Chemical Reaction Engineering. 4th edn. , Prentice Hall PTR. Boston. (2006).
- Conesa, J. A. Chemical Reactor Design: Mathematical Modeling and Applications. , Wiley. (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615(2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены