Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Керамическая всенаправленная биопечать в клеточных суспензиях для генерации костных аналогов
В этой статье
Резюме
Этот протокол описывает технику 3D-печати для изготовления костеподобных структур путем осаждения чернил фосфата кальция в гранулированную опору на основе желатина. Печатные костные аналоги наносятся в свободной форме, с гибкостью для прямого сбора отпечатка или сшивания внутри матрицы живых клеток для многофазных конструкций.
Аннотация
Структурно костная ткань представляет собой неорганически-органический композит, содержащий метаболически активные клетки, встроенные в иерархическую, высокоминерализованную матрицу. Эту организацию сложно воспроизвести из-за гетерогенной среды кости. Керамическая всенаправленная биопечать в клеточных суспензиях (COBICS) - это метод биопечати на основе микрогелей, который уникально воспроизводит минеральную и клеточную структуру кости. COBICS печатает сложные, биологически значимые конструкции без необходимости в жертвенных вспомогательных материалах или жестких этапах постобработки (например, радиация и высокотемпературное спекание), которые являются двумя из самых больших проблем в аддитивном производстве костных миметических конструкций. Этот метод обеспечивается путем экструзии свободной формы новых чернил на основе фосфата кальция в микрогелевой суспензии на основе желатина. Свойства суспензии при пределе текучести позволяют накладываться и поддерживать печатную костную структуру. УФ-сшивание и нанопреципитация затем «блокируют» его на месте. Способность печатать наноструктурированную костно-миметическую керамику в клеточных биоматериалах обеспечивает пространственно-временный контроль над макро- и микроархитектурой и облегчает изготовление в режиме реального времени сложных костных конструкций в клинических условиях.
Введение
Кость обладает замечательными способностями к регенерации как одна из немногих структур в организме, которая может исцеляться, воссоздавая свой нормальный клеточный состав, ориентацию и механическую прочность вплоть до критического размера дефекта, когда эндогенная способность заживления скомпрометирована1. Кость, вместе с хрящом и связкой, поддерживает и облегчает движение тела, а также хранит минералы и жиры и производит клетки крови. Как твердая, плотная соединительная ткань, кость в основном состоит из неорганической фазы, воды и органического материала, состоящего в основном из коллагеновых волокон2. Клетки встроены в эту высокоминерализованную матрицу из коллагеновых волокон I и кристаллов гидроксиапатита (ГК), образуя иерархическую структуру3.
Сложная организация этой ткани делает изготовление синтетических альтернатив для репликации гетерогенных костных микро- и наносред исключительно сложным3. Для этой цели в качестве решений для создания костных матриц были предложены различные материалы, включая биокерамику, насыщенные клетками гидрогели и синтетические материалы. Среди методов изготовления строительных лесов недавно появились методы на основе 3D-печати, которые получили большое внимание со стороны сообщества тканевой инженерии благодаря их замечательной способности позволять изготавливать очень сложные и точные структуры с большими перспективами лечения для конкретного пациента 4,5,6 . Гидрогели были самым популярным выбором матричной имитации и биочернил, поскольку они могут быть напечатаны вместе с клетками и биологически активными молекулами, генерируя функциональные конструкции6. Однако гидрогелям не хватает функциональных свойств кости, таких как механическая прочность и сильно кальцинированная, неорганическая фаза, содержащая метаболически активные клетки.
3D-печатные керамические каркасы обычно требуют этапов постобработки, включая спекание, высокотемпературную обработку или использование агрессивных химических веществ, которые должны быть тщательно вымыты перед применением in vitro или in vivo 5. Чтобы устранить эти ограничения, Lode et al.7 недавно разработали пасту на основе α-трикальцийфосфата, образованную гидроксиапатитом, которая может быть напечатана и установлена в физиологических условиях. Однако этот материал все еще не может быть напечатан вместе с живыми клетками, поскольку он требует постобработки во влажной среде и последующего погружения водного раствора в течение длительного периода.
В качестве альтернативы в качестве замены 3D-костной матрицы 8,9 были предложены нагруженные клетками гидрогели с включенными неорганическими частицами. Несмотря на их большую способность поддерживать жизнеспособность клеток, они не способны рекапитулировать плотно минерализованную среду костной ткани. Thrivikarman et al.10 приняли биомиметический подход, в котором перенасыщенная кальциевая и фосфатная среда использовалась с аналогом неколлагенового белка, чтобы лучше имитировать наноразмерное осаждение апатита. Однако их конструкции все еще не могут генерировать жесткие 3D-конструкции с микро- и макромасштабной архитектурой, напоминающей кость.
Настоящее исследование устраняет эти недостатки путем разработки стратегии печати для изготовления имитирующих кости конструкций в неорганической и органической фазах, которые способны интегрировать как клетки, так и факторы роста11. COBICS уникально резюмирует минеральную и клеточную структуру кости с использованием метода биопечати на основе микрогелей. Протокол в настоящем описании процесса синтеза керамических микрогелей на основе костных чернил и желатина и последующего объединения клеток, которые обеспечивают COBICS. Процесс начинается с синтеза основного материала-предшественника костных чернил. Затем сшиваемый гидрогель синтезируется и формируется в микрогели. Наконец, костные чернила осаждаются всенаправленно в поддерживающей ванне микрогелей, нагруженных клетками (рисунок 1).
Костные чернила могут быть напечатаны в любой суспензии микрогелей, которые имеют соответствующие характеристики пределов текучести, то есть способность текучесть с определенной скоростью сдвига и впоследствии поддерживать осажденную структуру. Были продемонстрированы два гибких подхода: суспензия, состоящая из желатиновых микрогелей, и суспензия, состоящая из микрогелей желатина метакрилата (GelMA). Первая суспензия растворяется при повышении температуры до 37 °C, обратимое встраивание свободной формы взвешенных гидрогелей (FRESH) по методу12, в то время как последнее может быть сшито после печати, эффективно «сшивая» микрогели вместе и фиксируя напечатанные костные чернила на месте. Настоящее исследование фокусируется на использовании GelMA в качестве матрицы, поскольку оно обеспечивает уникальное преимущество, заключающееся в способности поддерживать рост клеток с помощью печати in situ сложных костных миметических структур. В конечном счете, этот подход позволяет генерировать сложные тканевые модели с высоким уровнем биомимикрии и широкими последствиями для моделирования заболеваний, открытия лекарств и регенеративной инженерии.
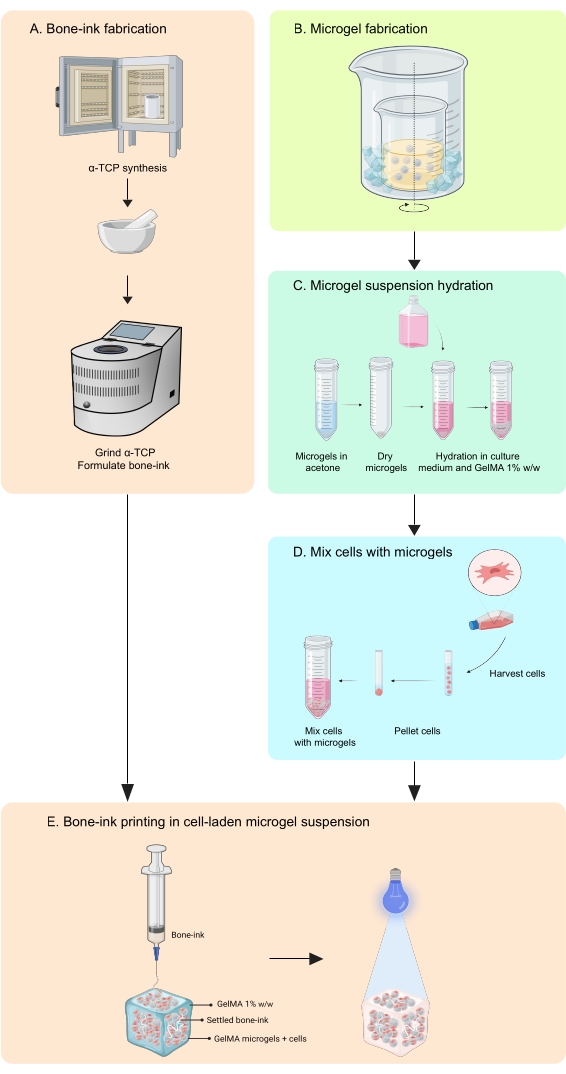
Рисунок 1: Схема рабочего процесса. (А) Костно-чернила синтезируют, начиная с синтеза α-трикальцийфосфата и его последующей комбинации с глицерином, полисорбатом 80 и диосновным фосфатом аммония. (B) Микрогели GelMA изготавливаются методом эмульсии «вода в масле». Полученные микрогели затем (С) гидратируют и (D) объединяют с клетками. Клеточно-микрогелевые композиты затем используются в качестве гранулированной ванны, в которой откладываются костные чернила. (E) Затем вся конструкция сшивается УФ-излучением и переносится в инкубатор для культивирования. Сокращения: α-TCP = α-трикальцийфосфат; GelMA = желатин метакрилат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Изготовление костяных чернил
- Синтез α-трикальцийфосфата
- Взвешивайте порошки гидрофосфата кальция (CaHPO4) и карбоната кальция (CaCO3) в молярном соотношении 3:2 Ca:P. С помощью шпателя тщательно гомогенизируйте два порошка.
- Добавьте смесь порошка гидрофосфата кальция и кальция карбоната в тигель циркония таким образом, чтобы он был заполнен не более чем на 75%.
ПРИМЕЧАНИЕ: Чтобы избежать загрязнения, используйте новый тигель или тигель, ранее использовавшийся для изготовления того же материала. Для очистки промойте 100% этанолом и высушите на воздухе в вытяжке до полного высыхания перед добавлением порошков. - Переложите тигель в печь. Нагревать до 1 400 °C со скоростью 5 °C/мин и удерживать в течение 3 ч.
- Погасите реакцию, вынув тигель из печи и оставив его на огнеупорном блоке. Дайте ему полностью остыть перед обработкой.
ПРИМЕЧАНИЕ: Используйте тигельные щипцы соответствующей длины и обеспечьте надлежащую тепловую защиту. - Используйте ступку и пестик, чтобы разбить и измельчить жмых α-TCP таким образом, чтобы полученные гранулы имели максимальный размер 200 мкм.
ПРИМЕЧАНИЕ: Используйте стандартное сито из нержавеющей стали для обеспечения правильного размера частиц. - Далее гранулы измельчают с помощью планетарной мельницы в два этапа. Сначала добавляют 3 мм биттрий-стабилизированные циркониевые шарики в массовом соотношении 8:1 шарики:порошок, затем 100% этанол в массовом соотношении 3:1 этанол:порошок. Закрепите крышку и измельчите в течение 2 ч при 180 об/мин.
- Соберите суспензию и отделите шарики, используя 100% этанол для промывки.
- Высушите суспензию в духовке при 120 °C в течение 24 ч.
- Добавьте высушенный порошок в помоловые банки с 1 мм циркониевыми шариками и 100% этанолом в тех же весовых соотношениях, что и на первом этапе. Измельчение в течение 2 ч при 180 об/мин, раздельное и сухое.
ПРИМЕЧАНИЕ: Вся процедура синтеза представлена на рисунке 1А.
- Рецептура костно-чернил
- Чтобы сделать костяные чернила, добавьте 2 г порошка α-TCP в банку шариковой мельницы, которая содержит 630 мкл глицерина и 130 мкл полисорбата 80, непрерывно перемешивая шпателем.
- Добавьте 100 мг двухосновного фосфата аммония ((NH4)2HPO4, APD) и перемешайте, чтобы соединить.
ПРИМЕЧАНИЕ: Чрезмерный остаток жидких фаз, оставшихся на шпателе, приведет к дисбалансу соотношения компонентов чернил и, следовательно, кинетики схватывания. - Добавьте 25-миллиметровый циркониевый шарик, закрепите крышку и поместите его внутрь планетарной мельницы на 60 минут при 180 оборотах в минуту, сделав паузу на полпути, чтобы соскрести стороны банки шпателем.
- С помощью шпателя загрузите чернила в шприц объемом 1 мл. Обертывайте адекватно, чтобы избежать контакта с влагой. Хранить при температуре −20 °C, если не использовать немедленно.
- Характеристика микроструктуры костно-чернил
- Распечатайте костяные чернила в деионизированной воде и дайте схватить в течение 5 мин.
- Промыть образец 3 раза 100% этанолом и дать ему полностью высохнуть.
- Покрытие тонким слоем (толщина 15 нм) золота.
- Делайте микроснимки с помощью полевого эмиссионного сканирующего электронного микроскопа при напряжении ускорения 5 кВ.
2. Изготовление микрогелевых суспензий для печати
- Синтез ГелМА
ПРИМЕЧАНИЕ: Данная процедура была опробована для партий, состоящих из 10 г и 20 г желатина. Этот метод детализирует измерения для партии с использованием 10 г.- Сделайте 10% мас./мас. раствора желатина типа А (свинина, прочность Блюма 300) в 1x фосфат-буферном физиологическом растворе (PBS), взвесив 10 г желатина и добавив его в коническую колбу с 90 мл PBS. Нагревать до 50 °C при перемешивании до полного растворения желатина.
- Добавить 5,796 мл метакрилового ангидрида. Поместите резиновый колпачок на коническую колбу и продолжайте помешивать в темноте при 50 °C в течение 90 мин.
ВНИМАНИЕ: Метакриловый ангидрид токсичен при вдыхании или проглатывании и является раздражителем кожи и глаз. Работайте только внутри вытяжного шкафа и используйте соответствующие СИЗ. - Погасите реакцию, разбавляя содержимое конической колбы в два раза PBS.
- Декантировать в пробирки по 50 мл и центрифугу при 3000 × г при комнатной температуре в течение 3 мин для удаления непрореагировавшего метакрилового ангидрида.
- Диализуйте супернатант внутри 14 кДа отсечных целлюлозных диализных трубок против деионизированной воды при 40 °C в течение 5 дней, осторожно перемешивая. Заменяйте деионизированную воду каждый день.
- Подготовьтесь к хранению, декантируя в трубки по 50 мл, закрепляя колпачок и помещая в холодильник на 12 ч. Хранить в холодильнике до 7 дней.
- Заморозить с использованием жидкого азота и сразу же лиофилизировать в течение 5 дней при −54 °C и 0,4 мбар.
ПРИМЕЧАНИЕ: Убедитесь, что при замораживании в пробирках содержится не более 40 мл жидкости. После замораживания замените колпачок на покрытие, которое позволяет газообмен, например, деликатную задачу протирать, закрепленную резинкой. - Хранить полученную пену в морозильной камере при −20 °C до тех пор, пока не потребуется синтез микрогелевой суспензии.
- Синтез микрогелей GelMA
ПРИМЕЧАНИЕ: Микрогели синтезируют с использованием эмульсии «вода в масле»методом 13 (фиг.2). Этот метод был опробован на растворе GelMA объемом 1-10 мл. Этот же протокол может быть использован для синтеза желатиновых микрогелей, используемых для печати автономных отпечатков костей.- Сделайте 10% мас./мас. раствора GelMA в PBS, взвесив лиофилизированный GelMA, добавив его в трубку с PBS и нагревая на водяной бане при 50 °C до полного увлажнения.
- Добавьте 37 мл масла на 1 мл раствора GelMA в стакан, убедившись, что он заполнен не более чем на 65%.
- Установите систему двойного стакана на конфорке с магнитным перемешиванием, поместив стакан, содержащий масло, внутрь большего стакана.
ПРИМЕЧАНИЕ: Размер двух стаканов должен быть таким, чтобы лед можно было легко сбросить в пространство между их стенками. Установка показана на рисунке 2. - Нагревать до 40 °C при перемешивании.
ПРИМЕЧАНИЕ: Убедитесь, что вихрь не турбулентный и имеет глубину примерно 1/3 высоты масла в стакане. - Загрузите раствор GelMA в шприц и добавьте его по каплям в перемешивающее масло через фильтр 0,45 мкм. Дайте эмульсии уравновеситься в течение 10 мин.
- Уменьшите температуру эмульсии до 15 °C, чтобы термически стабилизировать сферы, добавив измельченный лед в пространство между двумя стаканами.
- Добавьте ацетон в вращающуюся эмульсию в объемном соотношении 1:11 раствора GelMA к ацетону.
ПРИМЕЧАНИЕ: Добавьте ацетон осторожно через воронку, чтобы избежать нарушения эмульсии. Перемешивать в течение 60 мин. - Декантируйте содержимое стакана в трубки по 50 мл, обязательно промыв стенки стакана ацетоном. Оставьте на 20 мин, чтобы обезвоженные микрогели осели на дно.
- Выбросьте супернатант и промыть не менее 2 раз ацетоном.
ПРИМЕЧАНИЕ: Супернатант должен быть четким. - Сконцентрируйте в одну трубку, доливайте ацетоном и обрабатывайте ультразвуком в течение 10 с. Промыть 2x ацетоном.
- Хранить в ацетоне при комнатной температуре до тех пор, пока не потребуется печать.
- Подготовка микрогелевой суспензии GelMA к печати
- Приготовьте 1% мас./мас. раствора GelMA в модифицированной орлиной среде Dulbecco (DMEM), взвесив лиофилизированный GelMA в пробирке, добавив DMEM и нагревая на водяной бане при 50 °C до полного увлажнения.
- Испарите ацетон из обезвоженных микрогелей и взвесьте полученный порошок в пробирку. Добавляют ацетон и переносят в стерильную среду.
- Для образования микрогелевой суспензии выпаривают ацетон и добавляют DMEM, 1% мас./мас. раствора GelMA в DMEM и 2,5% мас./мас. раствора инициатора фенил-2,4,6-триметилбензоилфосфината (LAP) для достижения окончательной доли упаковки 30%. Дайте полностью увлажниться не менее 12 ч при комнатной температуре. Хранить в холодильнике до 7 дней. Дайте дойти до комнатной температуры перед использованием.
ПРИМЕЧАНИЕ: Объемы этих реагентов основаны на сухом весе микрогелей и могут быть рассчитаны с использованием уравнений, приведенных в таблице 1.
| Уравнение | |
| x = масса сухих микрогелей (мг) | |
| Объем 1% мас./мас. GelMA в DMEM, а (мкл) | a = 21,93x |
| Объем ДМЭМ, b (мкл) | b = 8,773x |
| Объем 2,5% мас./мас. раствора LAP, c (мкл) | c = 0,6267x |
| Общий объем произведенной микрогелевой суспензии (мкл) | a + b + c |
Таблица 1: Уравнения для расчета объемов реагентов, необходимых для гидратации микрогелевых суспензий GelMA. Сокращения: GelMA = желатин метакрилат; LAP = фенил-2,4,6-триметилбензоилфосфинат лития.
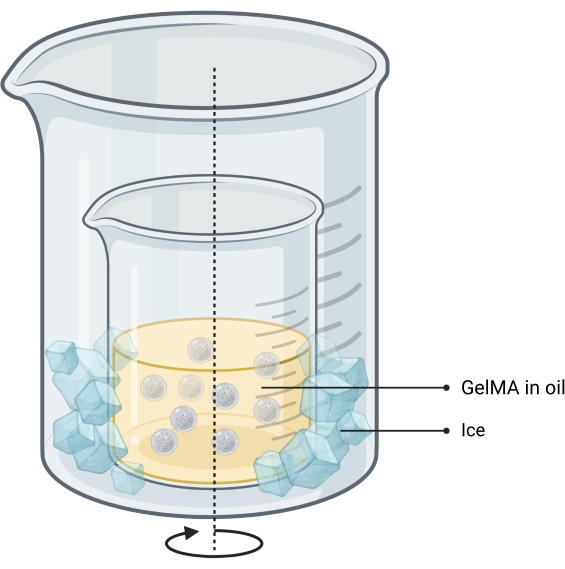
Рисунок 2: Схема маслоэмульсионного метода, используемого для синтеза микрогелей. Установка с двойным стаканом показывает стакан, содержащий перемешивающую (обозначенную стрелкой) эмульсию, помещенную внутри более крупного стакана для охлаждения. Аббревиатура: GelMA = желатин метакрилат Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Печать костных чернил в клеточных суспензиях
ПРИМЕЧАНИЕ: Микрогели на основе желатина поддерживают адгезию многих различных типов клеток, что делает этот подход поддающимся одному и нескольким клеткам в микрогелевой матрице. Этот протокол описывает процедуру использования мезенхимальных стволовых клеток жирового происхождения (ADSCs), поскольку это популярный и надежный тип клеток для инженерии костно-мышечной ткани.
- Культивируйте ADSC в ДМЭМ с низким содержанием глюкозы, дополненное 10% фетальной бычьей сывороткой и 1% пенициллин-стрептомицином при 37 °C и 5% CO2 до слияния.
- Отделяют ADSC от колбы для посева тканей путем удаления среды, промывки стерильным PBS и инкубации при 37 °C и 5% CO2 с 0,25% трипсином в течение 3 мин.
- Гранулируют ячейки центрифугированием при 150 × г при комнатной температуре в течение 5 мин.
- Подсчитайте клетки и рассчитайте 5 × 105 клеток на каждый 1 мл микрогелей GelMA. Выделите необходимый объем клеточной суспензии в отдельную трубку и гранулу, как указано выше.
- Осторожно удалите как можно больше супернатанта с помощью пипетки, оставив только ячейку гранулы. Аккуратно добавьте необходимый объем микрогелевой суспензии в гранулу и аспират, чтобы обеспечить равномерное распределение клеток.
ПРИМЕЧАНИЕ: Если в суспензии есть избыточные пузырьки воздуха, аккуратно центрифугируйте, чтобы удалить и пипетку вверх и вниз, чтобы перераспределить ячейки. - Загрузите нагруженную ячейками микрогелевую суспензию в реактор с помощью пипетки.
ПРИМЕЧАНИЕ: В настоящем исследовании реакторы размером 10 мм х 10 мм х 3 мм с объемом 100 мкл были напечатаны на 3D-принтере. - Нанесите костные чернила с помощью шприца объемом 1 мл, оснащенного иглой 23 г.
ПРИМЕЧАНИЕ: Это можно сделать с помощью 3D-принтера либо путем модернизации экструзионной системы, которая позволяет печатать непосредственно со шприца объемом 1 мл, либо путем загрузки костяных чернил непосредственно в экструзионный картридж принтера (рисунок 3). - Сшивайте нагруженную клетками и костями микрогелевую конструкцию GelMA с помощью УФ-сшивающей лампы (405 нм) в течение 90 с. Немедленно переложить на плиту скважины соответствующего размера и покрыть ее полным DMEM.
ПРИМЕЧАНИЕ: Вышеупомянутые 3D-печатные реакторы помещаются внутри 24-луночных пластин для культивирования клеток. - Инкубировать при 37 °C и 5% CO2. Заменяют питательную среду через 24 ч, затем каждые 48-72 ч по мере необходимости.
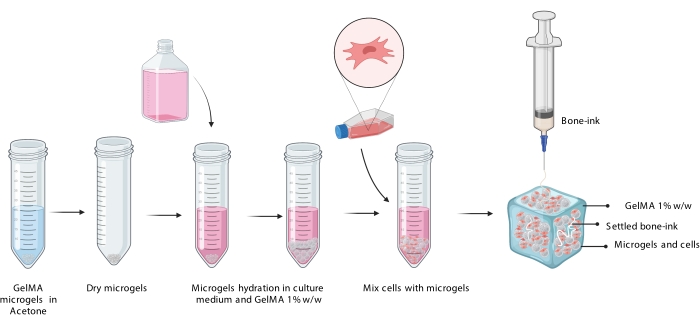
Рисунок 3: Схематическое изображение процедуры COBICS, показывающее гидратацию микрогелей, включение клеток и последующую печать костных чернил в суспензии микрогеля, насыщенной клетками. Аббревиатура: COBICS = керамическая всенаправленная биопечать в клеточных суспензиях; GelMA = желатин метакрилат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Оценка жизнеспособности и пролиферации клеток
- Чтобы оценить цитотоксичность костно-чернил, храните клеточные конструкции COBICS в полной питательной среде. Выполните анализ Live Dead через 24 ч, 72 ч и 120 ч (или соответствующие временные точки).
- В каждый момент времени промывайте конструкции PBS, затем добавляйте раствор dmEM без фенола, содержащий 4 мМ кальциина и 2 мМ бромида этидия. Инкубировать в течение 1 ч при 37 °C и 5% CO2.
- Вымойте PBS и переложите в стеклянную посуду для визуализации с помощью конфокального микроскопа при спектрах Ex/Em 494/517 нм и 528/617 нм.
Access restricted. Please log in or start a trial to view this content.
Результаты
COBICS печатает сложные, биологически значимые конструкции без необходимости в жертвенных вспомогательных материалах или жестких этапах постобработки (например, радиация и высокотемпературное спекание), которые являются двумя из самых больших проблем в аддитивном производстве костных...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Технология 3D-печати COBICS была разработана для изготовления минерализованных костно-подобных структур путем экструзии в сшиваемую микрогелевую суспензию, содержащую живые клетки. Метод был применен к разлагаемой микрогелевой суспензии, и клетки демонстрируют хорошую жизнеспособност?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет никаких конфликтов интересов для раскрытия.
Благодарности
Авторы хотели бы отметить Национальный совет по здравоохранению и медицинским исследованиям (грант No GNT1111694 и GNT1141602) и Австралийский исследовательский совет (грант No FT180100417, FL150100060 и CE14100036). Авторы хотели бы отметить Центр биомедицинской визуализации в Университете Нового Южного Уэльса. Рисунки были созданы с помощью Biorender.com, Adobe Photoshop и Adobe Illustrator и были экспортированы по платной подписке.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
Ссылки
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , CRC Press. Boca Raton, FL. 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757(2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041(2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660(2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986(2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209(2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014(2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520(2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216(2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758(2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490(2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены