Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микротензиометр для конфокальной микроскопии Визуализация динамических интерфейсов
В этой статье
Резюме
Эта рукопись описывает конструкцию и работу микротензиометра / конфокального микроскопа для одновременного измерения межфазного натяжения и поверхностной дилатационной реологии при визуализации межфазной морфологии. Это обеспечивает построение в реальном времени отношений структура-свойство интерфейсов, важных в технике и физиологии.
Аннотация
Адсорбция поверхностно-активных молекул к интерфейсам жидкость-жидкость повсеместно распространена в природе. Характеристика этих интерфейсов требует измерения скорости адсорбции поверхностно-активных веществ, оценки равновесного поверхностного напряжения как функции объемной концентрации поверхностно-активного вещества и сопоставления того, как поверхностное натяжение изменяется с изменениями в межфазной области после равновесия. Одновременная визуализация интерфейса с использованием флуоресцентной визуализации с помощью высокоскоростного конфокального микроскопа позволяет непосредственно оценить структурно-функциональные отношения. В микротензиометре капиллярного давления (CPM) полусферический воздушный пузырь зажимается на конце капилляра в резервуаре жидкости объемом 1 мл. Капиллярное давление через пузырьковый интерфейс контролируется с помощью коммерческого микрофлюидного контроллера потока, который позволяет управлять давлением на основе модели, кривизной пузырьков или зоной пузырьков на основе уравнения Лапласа. По сравнению с предыдущими методами, такими как желоб Ленгмюра и подвесное падение, точность измерения и управления и время отклика значительно улучшены; изменения капиллярного давления могут применяться и контролироваться в миллисекундах. Динамический отклик пузырькового интерфейса визуализируется через вторую оптическую линзу, когда пузырь расширяется и сжимается. Контур пузырька подходит к круглому профилю для определения радиуса кривизны пузырька, R, а также любых отклонений от циркулярности, которые могут аннулировать результаты. Уравнение Лапласа используется для определения динамического поверхностного натяжения интерфейса. После уравновешивания небольшие колебания давления могут быть наложены управляемым компьютером микрофлюидным насосом для колебания радиуса пузырька (частоты 0,001-100 циклов / мин) для определения модуля дилатации Общие размеры системы достаточно малы, чтобы микротензиометр помещался под линзой высокоскоростного конфокального микроскопа, позволяя количественно отслеживать флуоресцентно помеченные химические виды с субмикронным боковым разрешением.
Введение
Воздушно-водные интерфейсы, покрытые поверхностно-активными пленками, повсеместно распространены в повседневной жизни. Закачки поверхностно-активного раствора используются для повышения нефтеотдачи с истощенных месторождений и используются в качестве решений для гидравлического разрыва сланцевого газа и нефти. Газожидкостные пены и жидко-жидкие эмульсии являются общими для многих промышленных и научных процессов в качестве смазочных материалов и чистящих средств и распространены в пищевых продуктах. Поверхностно-активные вещества и белки на границах раздела стабилизируют конформацию антител при упаковке, хранении и введении 1,2,3,4,5, стабильность слезной пленки в глазу 6,7,8 и легочную механику 9,10,11,12,13,14, 15.
Изучение поверхностно-активных агентов или поверхностно-активных веществ, адсорбирующих интерфейсы и их свойства, имеет долгую историю со многими различными экспериментальными методами 16,17,18,19,20,21,22,23,24,25,26,27 . Недавней разработкой является микротензиометр капиллярного давления (CPM), который позволяет исследовать межфазные свойства на сильно изогнутых интерфейсах в гораздо меньших масштабах длины, используя при этом значительно меньше материалов, чем другие распространенные методы 9,23,24,25. Конфокальная флуоресцентная микроскопия (CFM) может быть использована для изучения морфологии липидов и белков на границах раздела воздух-вода в CPM22 или на впадинах Ленгмюра 20,26,27,28,29. Здесь CPM и CFM были объединены для связи морфологических явлений с динамическими и равновесными межфазными свойствами для развития структурно-функциональных отношений для биологических и технологических интерфейсов.
Существует множество важных параметров в межфазных поверхностно-активных системах, доступных для CPM-CFM. В CPM воздушный пузырь диаметром 30-200 мкм прижимается к кончику стеклянной капиллярной трубки. В более ранних версиях CPM разность капиллярного давления между внутренней и внешней частью пузыря контролировалась с помощью водяного столба и колебательного шприцевого насоса 9,30; новая версия, описанная здесь, заменяет их более высокоточным микрофлюидным насосом с компьютерным управлением. Поверхностное натяжение (γ) определяется с помощью уравнения Лапласа, ΔP = 2γ/R, из перепада давления через интерфейс, заданного насосом, ΔP и оптического анализа радиуса кривизны пузыря, R. Динамическое поверхностное натяжение интерфейса может быть определено с временным разрешением 10 мс после образования нового пузырька, контактирующего с объемной жидкостью, содержащей растворимое поверхностно-активное вещество. Динамика адсорбции поверхностно-активного вещества может быть описана классическим уравнением Уорда-Тордая10,31 для определения существенных свойств поверхностно-активного вещества, включая диффузионность, поверхностное покрытие и взаимосвязь между объемной концентрацией и равновесным поверхностным натяжением. Как только достигается равновесное поверхностное натяжение, межфазная область может колебаться для измерения дилатационного модуля, 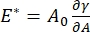 регистрируя изменения поверхностного натяжения, вызванные небольшими изменениями в площади поверхности пузыря, A32. Для более сложных интерфейсов, которые развивают свои собственные внутренние структуры, такие как запутанные полимеры или белки, поверхностное натяжение, заменяется более общим поверхностным напряжением 4,33,
регистрируя изменения поверхностного натяжения, вызванные небольшими изменениями в площади поверхности пузыря, A32. Для более сложных интерфейсов, которые развивают свои собственные внутренние структуры, такие как запутанные полимеры или белки, поверхностное натяжение, заменяется более общим поверхностным напряжением 4,33, 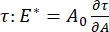 .
.
Стабильность легких во время дыхания может быть напрямую связана с поддержанием как низкого поверхностного натяжения, так и высокого модуля дилатации на альвеолярной воздушно-жидкостной границе раздела 9,10. Все внутренние поверхности легких выстланы непрерывной пленкой эпителиальной выстилающей жидкости толщиной в микроны для поддержания гидратации тканей34. Эта эпителиальная подкладочная жидкость в основном представляет собой воду, с солями и различными другими белками, ферментами, сахарами и поверхностно-активным веществом для легких. Как и в случае с любой изогнутой границей раздела жидкость-пар, капиллярное давление индуцируется давлением выше на внутренней стороне альвеолы (или пузыря). Однако, если поверхностное натяжение было постоянным везде в легких, уравнение Лапласа, ΔP = 2γ / R, показывает, что меньшие альвеолы будут иметь более высокое внутреннее давление по сравнению с более крупными альвеолами, заставляя газовое содержимое меньших альвеол перетекать в более крупные альвеолы с более низким давлением. Это известно как «нестабильность Лапласа»9,35. Конечным результатом является то, что мельчайшие альвеолы разрушаются и заполняются жидкостью и становятся трудными для повторного раздувания, вызывая коллапс части легкого, а другие части будут чрезмерно раздуваться, оба из которых являются типичными симптомами острого респираторного дистресс-синдрома (ОРДС). Однако в правильно функционирующем легком поверхностное натяжение динамически изменяется, поскольку граница раздела воздух-эпителиальная жидкость в межфазной области альвеол расширяется и сжимается во время дыхания. Если 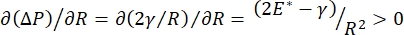 , или
, или 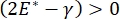 , давление Лапласа уменьшается с уменьшением радиуса и увеличивается с увеличением радиуса, чтобы устранить нестабильность Лапласа, тем самым стабилизируя легкое9. Следовательно, и то,
, давление Лапласа уменьшается с уменьшением радиуса и увеличивается с увеличением радиуса, чтобы устранить нестабильность Лапласа, тем самым стабилизируя легкое9. Следовательно, и то, 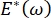 как это зависит от частоты, морфологии и состава монослоя, а также состава альвеолярной жидкости, может иметь важное значение для стабильности легких. CPM-CFM также обеспечил первые демонстрации влияния межфазной кривизны на адсорбцию поверхностно-активных веществ25, монослойную морфологию22 и дилатационный модуль9. Небольшой объем (~1 мл) резервуара в CPM позволяет быстро вводить, удалять или обменивать жидкую фазу и сводит к минимуму необходимое количество дорогостоящих белков или поверхностно-активных веществ10.
как это зависит от частоты, морфологии и состава монослоя, а также состава альвеолярной жидкости, может иметь важное значение для стабильности легких. CPM-CFM также обеспечил первые демонстрации влияния межфазной кривизны на адсорбцию поверхностно-активных веществ25, монослойную морфологию22 и дилатационный модуль9. Небольшой объем (~1 мл) резервуара в CPM позволяет быстро вводить, удалять или обменивать жидкую фазу и сводит к минимуму необходимое количество дорогостоящих белков или поверхностно-активных веществ10.
Контрастность в изображении CPM-CFM обусловлена распределением малых фракций флуоресцентно меченых липидов или белков на границераздела 16,27. Двумерные монослои поверхностно-активного вещества часто демонстрируют боковое фазовое разделение в зависимости от поверхностного натяжения или поверхностного давления, 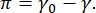 π представляет собой разницу между поверхностным натяжением чистой границы раздела жидкость-жидкость, γ0, и интерфейсом, покрытым поверхностно-активным веществом, γ. π можно рассматривать как 2-D «давление», вызванное взаимодействиями молекул поверхностно-активного вещества на границе раздела, который действует для снижения поверхностного натяжения чистой жидкости. При низком поверхностном давлении липидные монослои находятся в жидком дезорганизованном состоянии; это называется жидкой расширенной (LE) фазой. По мере увеличения поверхностного давления и уменьшения площади на молекулу липида липиды ориентируются друг с другом и могут подвергаться фазовому переходу первого порядка в фазовую фазу длинного порядка с конденсированной жидкостью (LC) 16,20,27. Фазы LE и LC могут сосуществовать при различных поверхностных давлениях и могут быть визуализированы, поскольку флуоресцентно помеченные липиды исключаются из фазы LC и отделяются от фазы LE. Таким образом, фаза LE яркая, а фаза LC темная при изображении с помощью CFM16.
π представляет собой разницу между поверхностным натяжением чистой границы раздела жидкость-жидкость, γ0, и интерфейсом, покрытым поверхностно-активным веществом, γ. π можно рассматривать как 2-D «давление», вызванное взаимодействиями молекул поверхностно-активного вещества на границе раздела, который действует для снижения поверхностного натяжения чистой жидкости. При низком поверхностном давлении липидные монослои находятся в жидком дезорганизованном состоянии; это называется жидкой расширенной (LE) фазой. По мере увеличения поверхностного давления и уменьшения площади на молекулу липида липиды ориентируются друг с другом и могут подвергаться фазовому переходу первого порядка в фазовую фазу длинного порядка с конденсированной жидкостью (LC) 16,20,27. Фазы LE и LC могут сосуществовать при различных поверхностных давлениях и могут быть визуализированы, поскольку флуоресцентно помеченные липиды исключаются из фазы LC и отделяются от фазы LE. Таким образом, фаза LE яркая, а фаза LC темная при изображении с помощью CFM16.
Целью этой рукописи является описание шагов, необходимых для создания и эксплуатации комбинированного микроскопического микроскопического микроскопа. Это позволит читателю выполнять адсорбционные исследования, измерять поверхностное натяжение, реологическое поведение и одновременно изучать межфазную морфологию на микронной границе раздела воздух/вода или масло/вода. Это включает в себя обсуждение того, как вытягивать, разрезать и гидрофобизировать необходимые капилляры, инструкции по использованию режимов давления, кривизны и контроля площади поверхности, а также межфазный перенос нерастворимого поверхностно-активного вещества на изогнутый интерфейс микротензиометра.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовка капиллярных трубок
- Поместите капилляр в капиллярный съемник и запустите нужную программу вытягивания, чтобы сделать два конических капилляра с наружным диаметром (OD) ~ 1 мкм на кончике.
ПРИМЕЧАНИЕ: OD капилляра перед вытягиванием должен соответствовать OD, указанному для размещения в капиллярном держателе в ячейке микротензиометра. Внутренний диаметр (ID) капилляра может варьироваться, но будет влиять на критический радиус капилляра после вытягивания. Программа вытягивания выбирается таким образом, что полученный конус сначала быстро уменьшает капиллярные OD и ID, затем достигает радиуса вблизи нужных капиллярных OD и ID, а затем уменьшается в диаметре медленнее. Это создаст большую длину капилляра, которая может быть оценена, чтобы получить пригодный для использования капилляр 30-100 мкм в ID. - Оцените кончик капилляра в нужном месте, чтобы получить id 30-100 мкм и отломите наконечник. Капилляр теперь будет иметь OD и ID желаемого радиуса на кончике (рисунок 1A). Капилляры можно хранить до шага 2.
ПРИМЕЧАНИЕ: Срезанный край капилляра должен иметь чистый разрыв на 90°. Любой дефект кромки среза приведет к плохому закреплению пузырька к капилляру и плохим измерениям свойств поверхности. Конические кончики капилляров очень деликатные. Они будут уничтожены, если они вступят в контакт с чем-либо, кроме растворов (например, стенки флаконов, воздушная насадка).
2. Гидрофобизация капилляров
- Соберите вытянутые стеклянные капилляры, раствор для кислотной очистки, пластиковый пинцет, деионизированную (DI) воду, раствор для гидрофобизации (2% силан в этаноле), вакуумный насос и раствор этанола. Подробности см. в Таблице материалов .
ВНИМАНИЕ: Раствор для кислотной очистки очень токсичен, вызывает коррозию / раздражение кожи и глаз, окисляет. Раствор для гидрофобизации является раздражителем кожи/глаз/дыхательных путей. Носите средства защиты глаз, лабораторные халаты и перчатки и работайте с растворами в вытяжном капюшоне. - Кислотно-очистите капилляры
ПРИМЕЧАНИЕ: Кислотная очистка капилляра удаляет любые органические остатки внутри капилляра и подготавливает стеклянную поверхность к реакции силанизации, которая делает капилляр гидрофобным.- Крепко захватите капилляр возле его широкого конца пинцетом.
- Окуните конический наконечник в раствор для кислотной очистки, прикрепив шланг от вакуумного насоса к широкому концу капилляра. Это будет всасывать раствор в капилляр.
ПРИМЕЧАНИЕ: Наконечник пипетки может быть прикреплен к концу капиллярного шланга, чтобы обеспечить лучшее прилегание к капиллярному концу. - Остановитесь, когда кислотный чистящий раствор заполнит около половины капилляра.
ПРИМЕЧАНИЕ: После удаления кончика капилляра из раствора кислотной очистки раствор на внешней стороне капилляра часто образует шарик возле кончика капилляра. Аккуратно прикосните капилляр к шейке флакона с раствором, чтобы удалить лишний раствор. - Дайте раствору кислотной очистки оставаться в капиллярах не менее 30 минут, гарантируя, что пробка жидкости остается на коническом конце капилляра.
- Удалите кислотный чистящий раствор из капилляра, крепко удерживая капилляр пинцетом и используя вакуумный шланг, чтобы вытащить жидкость из большого конца капилляра.
- Промыть капилляры
- Погрузите конический конец капилляра в воду DI, гарантируя, что он погружен достаточно глубоко, чтобы покрыть любой внешний вид, который был погружен в раствор для кислотной очистки. Пока наконечник погружен в воду, используйте вакуумный шланг, чтобы протянуть воду DI через капилляр. Извлеките капилляр из воды и удалите оставшуюся воду вакуумным шлангом.
- Повторите описанный выше шаг по крайней мере 4 раза.
- Выполните этап 2.3, снова заменив воду DI этанолом.
- Применяйте всасывание непрерывно до тех пор, пока этанол полностью не испарится из внутренней части капилляра. Капилляр станет мутным и холодным на ощупь, поскольку этанол начнет испаряться, но очистится через 30-45 с.
- Покрыть капилляр раствором гидрофобизации
- Кратковременно окуните широкий конец капилляра в ~2% силан в растворе этанола. Капиллярное действие приведет к тому, что раствор покрытия поднимется внутри капилляра. Извлеките капилляр из раствора, как только пробка размером ~ 1 см поднимется внутри капилляра.
- Ориентируйте капилляр так, чтобы конический кончик был обращен вниз, позволяя раствору покрытия падать с гравитацией к коническому кончику.
- Дайте раствору покрытия остаться в капилляре не менее 3 мин.
ПРИМЕЧАНИЕ: В пробке раствора покрытия, контактирующей с внутренней частью конического наконечника, не должно быть пузырьков воздуха. Если есть пузырь воздуха, то внутренняя часть капилляра, вероятно, была недостаточно высушена на этапе 2.5. Чтобы устранить эту проблему, при необходимости повторите шаги 2.4-2.6.
- Промыть капилляры этанолом 1x так же, как и на этапе 2.3.
- Установка гидрофобного покрытия на капилляр
- Поместите чистые и сухие сцинтилляционные флаконы в вакуумную печь при температуре 120 °C. Поместите покрытые оболочкой капилляры во флаконы (в идеале один капилляр на флакон) с широкими концами, опирающимися на основание флакона. Дайте капиллярам оставаться в печи в течение не менее 6 ч (предпочтительно в течение ночи), чтобы добиться постоянного склеивания гидрофобного силанового слоя с капиллярами. Капилляры можно хранить до шага 4.
3. Пробоподготовка и хранение
- Смешайте и храните растворы поверхностно-активных веществ и флуорофоров в чистых флаконах, промытых кислотой, чтобы избежать загрязнения.
ПРИМЕЧАНИЕ: Коммерчески доступные липиды должны быть самой высокой чистоты и храниться между использованием при -20 °C. Старые или загрязненные липиды часто приводят к тому, что результаты трудно воспроизвести.
4. Настройка микротензиометра
- Соберите ячейку CPM, как описано на рисунке 2.
- Поместите большую сторону капилляра в верхнюю часть ячейки CPM, пока она не продвинется на нижнюю сторону клетки.
- Осторожно затяните заглушку PEEK, чтобы закрепить капилляр, а затем прикрепите трубку от микрофлюидного насоса к большой стороне капилляра. Будьте осторожны, чтобы не коснуться конуса капилляра.
- При необходимости прикрепите шланги для обмена резервуара и/или контроля температуры к соответствующим входным и выходным отверстиям на ячейке CPM (рисунок 2); в противном случае подключите неиспользуемые входы и розетки.
- Прикрепите ячейку CPM к ступени конфокального микроскопа, примерно выровняв ее с объективом CFM, камерой CPM и источником света CPM (рисунок 3).
- Откройте поток газа для микрофлюидного насоса при рекомендуемом рабочем давлении насоса (150 мбар для микрофлюидного насоса, используемого здесь) и убедитесь, что поток в капилляр открыт.
- Запустите виртуальный интерфейс CPM (Файл дополнительного кодирования 1: Виртуальный микротензиометр Interface.vi) в режиме контроля давления с частотой и амплитудой колебаний капиллярного давления, установленными равными нулю (рисунок 4-7). На рисунке 4 показан снимок экрана виртуального интерфейса. Для воды DI и капиллярного радиуса ~ 35 мкм давление ~ 20 мбар гарантирует, что вода не попадет в капилляр.
- Наполните ячейку CPM водой с помощью пипетки.
- Сосредоточьтесь на кончике капилляра с помощью камеры микротензиометра.
- Сосредоточьтесь на капиллярном наконечнике с помощью CFM. Если есть трудности с поиском капилляра, используйте камеру CPM, чтобы найти цель CFM. Это поможет приблизить расстояние между целью CFM и пузырем, достигнув правильного рабочего расстояния.
- После того, как кольцевое кольцо (проекция зеленого сектора) будет центрировано на пузыре, вручную отрегулируйте фокус так, чтобы край пузыря был четко виден (рисунок 4-3).
ПРИМЕЧАНИЕ: Положение, начальный и конечный угол, а также внутренний и внешний радиусы кольцевого кольца можно регулировать с помощью меню под окном обзора. - Нажмите на Reset Bubble, и убедитесь, что образовался новый пузырь (можно будет услышать старый пузырь, и новый пузырь будет виден из окна просмотра панели управления; Рисунок 4-3). Если пузырь не лопается, увеличьте давление сброса или увеличьте время задержки сброса на вкладке Сброс пузырьков под окном просмотра. Проверьте, составляет ли поверхностное натяжение около 73 мН/м (для солевых растворов или пузырьков воды/воздуха) (рисунок 4-9).
- Выньте воду через шприц с прямым доступом к ячейке (рисунок 3-13), опорожните ее и снова подключите. Образец готов к загрузке для запуска эксперимента.
5. Адсорбционное исследование
- Заполните ячейку нужным образцом с помощью автоклавной пипетки, удерживающей программное обеспечение CPM в режиме контроля давления . Убедитесь, что начальное поверхностное натяжение составляет около 73 мН/м при создании нового пузырькового интерфейса.
- Определите радиус вновь образованного пузырька и введите это значение в элемент управления центральной областью (рисунок 4-7) и измените тип элемента управления на элемент управления областью, щелкнув вкладку Area Control (рисунок 4-8).
ПРИМЕЧАНИЕ: Также может использоваться постоянное регулирование давления, но это приводит к непрерывному изменению радиуса пузырька по мере изменения поверхностного натяжения интерфейса. Эта изменяющаяся область может усложнить анализ скорости адсорбции поверхностно-активных веществ и привести к тому, что пузырь лопнет во время исследования. - Начните запись конфокального видео.
- Нажмите на Reset Bubble (рисунок 4-5) и сразу же нажмите На Collect Data (Рисунок 4-6). Сигнальный индикатор на кнопке станет зеленым.
- Отрегулируйте скорость записи данных в соответствии с концентрацией образца, сдвинув полосу, показанную на рисунке 4-6. Для более медленных адсорбций используйте более медленную скорость записи. Это может быть скорректировано в середине прогона, если требуется более высокая скорость записи на ранней стадии, но более медленная скорость предпочтительна для длительных исследований, чтобы уменьшить размер файла.
- После окончания эксперимента (когда достигнуто окончательное плато поверхностного натяжения) сохраните файл, выбрав правильный путь к файлу (рисунок 4-1) и нажав на кнопку Сохранить (рисунок 4-2).
- Остановите и сохраните запись на CFM.
6. Исследование колебаний/релаксации
- Заполните ячейку образцом с помощью автоклавной пипетки, удерживающей программное обеспечение CPM в режиме контроля давления . Убедитесь, что поверхностное натяжение составляет около 73 мН/м при создании нового пузырькового интерфейса.
- Подождите, пока образец полностью адсорбируется в интерфейсе. Это может быть выполнено непосредственно после исследования адсорбции, а не начинать заново с новым пузырьковым интерфейсом.
- Решите, будет ли колебание колебанием давления, колебанием площади или колебанием кривизны, выбрав соответствующую вкладку (рисунок 4-8) и введя желаемое базовое значение, процент колебаний и частоту колебаний (рисунок 4-7).
ПРИМЕЧАНИЕ: Колебания пилообразной, квадратной и треугольной волновой области также доступны из раскрывающегося меню на вкладке «Колебания другой области ». - Начните запись конфокального видео и нажмите «Собрать данные» (рисунок 4-6) на программном обеспечении CPM.
- Запустите колебание. Обязательно запишите не менее семи циклов для достижения наилучших результатов. Выберите скорость сбора данных (рисунок 4-6), чтобы дать достаточное количество точек данных для каждого цикла колебаний.
- Если требуются другие амплитуды или частоты колебаний, измените значения во время эксперимента.
- Сохраните результаты, как показано в шагах 5.6 и 5.7.
7. Исследование обмена растворителями
- Заполните ячейку образцом с помощью автоклавной пипетки, поддерживая программное обеспечение CPM в режиме контроля давления. Убедитесь, что поверхностное натяжение составляет около 73 мН/м, когда создается новый пузырьковый интерфейс.
ПРИМЕЧАНИЕ: Исследования адсорбции и/или колебаний могут быть выполнены до исследования обмена растворителем. - Соедините впускную трубку с флаконом нужного обменного раствора (рис. 3-11) с перистальтическим насосом (рис. 3-10).
- Запустите запись видео в конфокальном программном обеспечении и нажмите На Collect Data (Рисунок 4-6) на программном обеспечении CPM.
- Установите скорость перистальтического насоса. Это будет контролировать скорость обмена жидкости и должно быть выбрано исходя из требований к эксперименту, то есть того, как быстро растворитель должен быть заменен.
- Если необходимо заменить несколько жидкостей, остановите перистальтический насос и подключите входное отверстие к другому обменному раствору.
- После завершения обмена (~20 мин) сохраните результаты, как на шагах 5.6 и 5.7.
8. Нерастворимая адсорбция поверхностно-активных веществ
ПРИМЕЧАНИЕ: Если поверхностно-активное вещество, подлежащее адсорбированию, не растворимо в резервуарной жидкости, этот метод может быть использован для переноса монослоя с границы раздела воздух/вода ячейки на поверхность пузырька. Многие бислоеобразующие липиды почти нерастворимы в солевом растворе и не всасываются спонтанно в пузырь при суспендировании в резервуарном растворе.
- Заполните ячейку образцом с помощью автоклавной пипетки, удерживающей программное обеспечение CPM в режиме контроля давления . Убедитесь, что поверхностное натяжение составляет около 73 мН/м, когда создается новый пузырьковый интерфейс.
- Нанесите монослой нерастворимого поверхностно-активного вещества на воздушно-водную границу раздела ячейки из раствора в летучий органический раствор. Используя шприц, нанесите небольшие капли на границе раздела и позвольте растворителю испариться, оставив липид позади в виде тонкой пленки.
ВНИМАНИЕ: Хлороформ используется в качестве растворителя для фосфолипидов, таких как фосфатидилхолины и жирные кислоты. Разбрасывающие растворы обычно составляют 0,01-0,02 мг липидов на мл растворителя. Хлороформ остро токсичен, может вызывать раздражение кожи и глаз и является канцерогенным. Наденьте соответствующую защиту глаз, лабораторное пальто и перчатки и сделайте раствор в вытяжном капюшоне. - Уменьшите площадь поверхности с помощью контроля давления по осевой линии (рисунок 4-7) пузыря до тех пор, пока он не станет почти плоским. Это предотвращает лопание пузыря после адсорбции поверхностно-активного вещества.
- Извлеките резервуарную жидкость из ячейки с помощью прямого шприца до тех пор, пока граница раздела воздух/вода не пройдет мимо кончика капилляра. В то время как шприцевой насос может быть использован, этот шаг может быть достигнут вручную с помощью шприца.
- Увеличьте высоту резервуара жидкости до его начального уровня.
ПРИМЕЧАНИЕ: После повторного погружения наконечника пузырь будет больше из-за поверхностно-активного вещества, которое теперь адсорбируется на интерфейсе. Монослой теперь будет готов к экспериментам по колебаниям или обмену растворителями.
9. Очистка
- Выключите CFM.
- Перейдите в режим контроля давления .
- Извлеките образец из ячейки с помощью пипетки. Загрузите ячейку водой DI и увеличьте давление до ~ 50 мбар, чтобы пузырьки постоянно выходили из капилляра и очищали кончик капилляра. Повторите этот процесс 2x.
- Закройте предохранительный клапан и выключите CPM, нажав на красную кнопку в левом верхнем углу, выключите световую и синюю панель управления давлением и закройте источник давления.
- Извлеките клетку из стадии конфокального микроскопа. Промойте ячейку этанолом и водой DI. Извлеките капиллярную трубку из клетки CPM.
10. Очистка ячейки
- Разберите ячейку. Очистите внутреннюю стенку зубной щеткой, смывая под водой DI. Погрузите детали в этанол и храните его ультразвуком в течение ~ 30 мин.
- Промойте все детали водой DI несколько раз. Высушите детали, либо продув их газообразным азотом, либо высушив их в вакуумной печи.
11. Анализ колебаний
- Запустите код Dilatational_Rheology_Analysis.m (дополнительный файл кодирования 2), выбрав нужный файл, сохраненный из виртуального интерфейса CPM. Образцы данных включены в дополнительные файлы.
- График давления и времени будет отображаться так, как показано на дополнительном рисунке 1. Щелкните левой кнопкой мыши точку, где начинается колебание, и щелкните левой кнопкой мыши еще раз там, где заканчивается колебание. Если данные содержат несколько колебаний, повторите этот процесс для всех колебаний.
- Когда все начальная и конечная точки будут щелкнуты левой кнопкой мыши, щелкните правой кнопкой мыши в любом месте. Например, как показано на дополнительном рисунке 1, можно щелкнуть левой кнопкой мыши в точках 1, 2, 3 и 4, а затем щелкнуть правой кнопкой мыши.
ПРИМЕЧАНИЕ: Код рассчитает дилатационный модуль и фазовый угол, и результаты будут записаны в новый файл .csv в исходном расположении файла. Результаты для образца данных можно увидеть в результатах кода, приведенных в файле дополнительного кодирования 2. MATLAB также сгенерирует несколько графических представлений данных, как показано на дополнительном рисунке 2.
- Когда все начальная и конечная точки будут щелкнуты левой кнопкой мыши, щелкните правой кнопкой мыши в любом месте. Например, как показано на дополнительном рисунке 1, можно щелкнуть левой кнопкой мыши в точках 1, 2, 3 и 4, а затем щелкнуть правой кнопкой мыши.
Access restricted. Please log in or start a trial to view this content.
Результаты
Основным источником погрешности измерений являются капилляры, дефекты которых возникают либо в процессе резки (рисунок 5A, B), либо в процессе нанесения покрытия (рисунок 5D). Оба типа дефектов приводят к ошибкам в определении формы и размера пузыр...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Комбинированный CPM/CFM является мощным инструментом для изучения межфазной динамики, равновесия и морфологии. Этот протокол описывает шаги, необходимые для получения данных с помощью CPM/CFM.
На фиг.2 показана конструкция ячейки с указанными каналами для капи...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Все изображения конфокальной микроскопии были получены с помощью многофотонного конфокального микроскопа Nikon A1RHD. Мы признаем руководство и помощь вспомогательного персонала, особенно Гильермо Маркеса, в Университетском центре визуализации в Университете Миннесоты. Эта работа была поддержана грантом NIH HL51177. SI был поддержан грантом Рут Л. Киршштейн NRSA на институциональную исследовательскую подготовку F32 HL151128.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ - cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL - 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Ссылки
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44(2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al. Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. Ramachadran, A., et al. , chap. 7 (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., et al. Surfactant Progress. Nag, K. , New York. (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604(2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. Physical Chemistry of Surfaces, Sixth ed. , Wiley-Interscience. New York. 784(1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14(2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115(2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены