Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение сжимаемости клеток и ядер на основе акустофлюидного микроустройства
В этой статье
Резюме
Здесь представлен протокол построения быстрой и неразрушающей системы измерения сжимаемости клеток или ядер на основе акустофлюидного микроустройства. Исследованы изменения механических свойств опухолевых клеток после эпителиально-мезенхимального перехода или ионизирующего излучения, демонстрирующие перспективу применения данного метода в научных исследованиях и клинической практике.
Аннотация
Клеточная механика играет важную роль в метастазировании опухоли, злокачественной трансформации клеток и радиочувствительности. Во время этих процессов изучение механических свойств клеток часто является сложной задачей. Обычные методы измерения, основанные на контакте, такие как сжатие или растяжение, склонны вызывать повреждение клеток, влияя на точность измерения и последующую культуру клеток. Измерения в адгезивном состоянии также могут влиять на точность, особенно после облучения, поскольку ионизирующее излучение сплющивает клетки и усиливает адгезию. Здесь разработана система измерения клеточной механики на основе акустофлюидного метода. Сжимаемость ячейки может быть получена путем записи траектории движения ячейки под действием акустической силы, которая может осуществлять быстрое и неразрушающее измерение в подвешенном состоянии. В этой статье подробно описываются протоколы проектирования чипов, подготовки образцов, регистрации траектории, извлечения и анализа параметров. На основе этого метода измеряли сжимаемость различных типов опухолевых клеток. Измерение сжимаемости ядра также достигалось путем регулировки резонансной частоты пьезоэлектрической керамики и ширины микроканала. В сочетании с проверкой на молекулярном уровне экспериментов с иммунофлуоресценцией сравнивали сжимаемость клеток до и после лекарственно-индуцированного эпителиального перехода в мезенхимальный переход (ЭМТ). Далее выявлено изменение сжимаемости клеток после рентгеновского облучения различными дозами. Предложенный в данной работе метод измерения клеточной механики является универсальным и гибким и имеет широкие перспективы применения в научных исследованиях и клинической практике.
Введение
Механические свойства клеток играют важную роль в метастазировании опухоли, злокачественной трансформации клеток и радиочувствительности 1,2. Чтобы получить глубокое понимание роли механических свойств клеток в вышеуказанном процессе, точное измерение клеточной механики имеет решающее значение, и измерение не должно вызывать повреждения клеток для последующей культивирования и анализа. Процесс измерения должен быть как можно более быстрым, в противном случае жизнеспособность клеток может пострадать, если клетки будут удалены из среды культивирования на длительное время.
Существующие методы измерения клеточной механики сталкиваются с некоторыми ограничениями. Некоторые методы, такие как магнитная скручивающая цитометрия, магнитный пинцет и микрореология отслеживания частиц, вызывают повреждение клеток из-за введения частиц в клетки 3,4,5. Методы, которые измеряют путем контакта с клетками, такие как атомно-силовой микроскоп (AFM), аспирация микропипетки, микросужение и метод параллельных пластин, также подвержены повреждению клеток, и пропускную способность трудно увеличитьна 6,7,8. Кроме того, ионизирующее излучение будет сплющивать клетки и увеличивать их адгезию9; поэтому необходимо измерить механику целых клеток в суспензии.
В ответ на вышеуказанные вызовы была разработана система измерения клеточной механики на основе акустофлюидного метода10,11,12,13,14. Ширина канала соответствует акустической половине длины волны, создавая таким образом узел стоячей волны на средней линии микроканала. Под действием силы акустического излучения ячейки или стандартные шарики могут перемещаться к узлу акустического давления. Поскольку физические свойства стандартных шариков (размер, плотность и сжимаемость) известны, плотность акустической энергии может быть определена. Затем сжимаемость ячейки может быть получена путем записи траекторий движения клеток в акустическом поле. Может быть достигнуто неразрушающее высокопроизводительное измерение ячеек в состоянии суспензии. В этом документе будет представлен дизайн микрофлюидного чипа, создание системы и этапы измерения. Измерение различных типов опухолевых клеток было проведено для проверки точности метода. Область применения этого метода была распространена на субклеточные структуры (такие как ядро) путем регулировки резонансной частоты пьезоэлектрической керамики и ширины микроканала. Кроме того, исследованы изменения сжимаемости клеток после медикаментозного ЭМТ или рентгеновского облучения различными дозами. Полученные результаты демонстрируют широкую применимость данного метода как мощного инструмента для изучения корреляции между биохимическими изменениями и клеточными механическими свойствами.
протокол
1. Изготовление и сборка акустофлюидного микроустройства
- Изготовление микрофлюидного чипа.
- Спроектируйте одноканальный чип только с одним входом и выходом, как показано на рисунке 1. Для измерения ячеек держите прямоугольное поперечное сечение микроканала на уровне 740 мкм в ширину и 100 мкм в глубину. Для измерения ядра клетки измените ширину и глубину микроканала на 250 мкм и 100 мкм соответственно.
- Подготовьте микроканал на кремниевой пластине с помощью реактивного ионного травления. Запечатайте верхнюю часть микроканала куском прозрачного термостойкого стекла с помощью анодного склеивания15. Мойте чипсы ультразвуковым очистителем в течение 10 минут. Высушите их в сушильной печи при 50 °C для последующего использования.
- Изготавливают полидиметилсилоксановые (PDMS) блоки.
- Добавьте 30 мл предварительного полимера в стеклянную посуду диаметром 100 мм .. Добавьте 3 мл отверждающего агента к предварительному полимеру шприцем.
ПРИМЕЧАНИЕ: Объемное соотношение отверждающего агента и предварительного полимера составляет 1:10. - Энергично смешайте преполимерный и отверждающий агент PDMS со стеклянным стержнем в течение примерно 10 минут. Ищите небольшие и равномерно разделенные пузырьки воздуха в растворе, которые указывают на то, что предполимерный и отверждающий агент PDMS хорошо перемешаны.
- Поместите стеклянную посуду в вакуумный осушитель и откусите на 15-25 с. Повторяйте этот процесс до тех пор, пока в смеси не появятся пузырьки воздуха.
- Поместите стеклянную посуду в сушильную печь, установленную при 50 °C в течение 1 часа, чтобы смесь затвердела. После инкубации используйте скальпель, чтобы разрезать PDMS на блоки подходящего размера около 1,2 см длиной и 1 см шириной.
ПРИМЕЧАНИЕ: Длина блока PDMS соответствует ширине чипа, а ширина выбирается для обеспечения достаточного пространства в середине для пьезоэлектрической керамики при склеивании двух блоков PDMS на чипе.
- Добавьте 30 мл предварительного полимера в стеклянную посуду диаметром 100 мм .. Добавьте 3 мл отверждающего агента к предварительному полимеру шприцем.
- Привяжите блок PDMS к чипу.
- Перфорационные отверстия в блоке PDMS для впускных и выпускных отверстий с полой иглой диаметром 1 мм. Поместите блоки PDMS и чип (тыльную сторону вверх) в плазмоочиститель на 1 мин.
- Выровняйте отверстия на блоках PDMS с входом и выходом стружки. Осторожно прижмите блоки PDMS к чипу в течение 15 с. Это должно привести к склеиванию между блоками PDMS и поверхностью чипа.
- Подключите катетер из политетрафторэтилена (PTFE) к чипу (рисунок 2B).
- Вырежьте два куска катетера из PTFE с внутренним диаметром 0,8 мм и длиной 10 см. Согните иглу из нержавеющей стали с внутренним диаметром 0,7 мм и длиной 1,5 см на 90° в L-образную форму. Подключите его к одному концу катетера. Подготовьте два таких катетера иглами.
- Вставьте иглы из нержавеющей стали в отверстия блоков PDMS. Для входа подключите дозирующую иглу 19 G к другому концу катетера в качестве разъема для шприца.
- После выполнения вышеуказанных шагов введите деионизированную воду, чтобы проверить герметичность общего канала. Непроницаемый для воды означает хорошее уплотнение.
- Пьезоэлектрическая керамическая сборка (Рисунок 2С)
- Используйте алмазный проволочный резак для резки пьезоэлектрических керамических листов диаметром 2 см на четыре полосы шириной 5 мм.
- Убедитесь, что резонансная частота пьезоэлектрической керамики соответствует ширине микроканала чипа. Для микроканалов шириной 740 мкм и 250 мкм используют пьезоэлектрическую керамику с резонансными частотами 1 МГц и 3 МГц соответственно.
- Сварная проволока с обеих сторон пьезоэлектрической керамики на одном конце.
- Приклейте пьезоэлектрическую керамику к середине задней части чипа цианоакрилатным клеем.
- Чтобы равномерно распределить клей, поместите каплю клея на пьезоэлектрическую керамику, разгладьте клей зубочисткой и удалите лишний клей. Затем быстро нажмите его на чип и продолжайте настаивать в течение примерно 1 минуты. Убедитесь, что пьезоэлектрическая керамика и чип прочно связаны и равномерно контактируют.
- Смонтируйте микроустройство (рисунок 2D).
- Вырежьте кусок PDMS (около 1,5 см в длину и 1 см в ширину) в качестве основы микроустройства. Используя двустороннюю ленту, приклейте одну сторону основания к входным и выходным блокам PDMS, а другую сторону к прозрачному стеклянному слайду. Закрепите все микроустройство на ступени микроскопа, чтобы сохранить чип в одной фокальной плоскости.
2. Пробоподготовка
- Приготовление растворов стандартных частиц полистирола.
- Добавьте 0,05 мл раствора частиц полистирола (диаметром 6 мкм) (2,1 x 108 частиц/мл) в 10 мл фосфатного буферного физиологического раствора (PBS) и хорошо перемешайте.
ПРИМЕЧАНИЕ: Чтобы уменьшить погрешность измерения, вызванную изменением плотности акустической энергии, раствор частиц полистирола смешивали с раствором образца в каждом эксперименте в качестве калибровки.
- Добавьте 0,05 мл раствора частиц полистирола (диаметром 6 мкм) (2,1 x 108 частиц/мл) в 10 мл фосфатного буферного физиологического раствора (PBS) и хорошо перемешайте.
- Приготовление клеточных суспензий.
- Промывайте адгезивные ячейки (например, MCF7, MDA-MB-231, HCT116) при 90% слиянии (~5 x 105 клеток) с PBS. Добавьте 500 мкл 0,25% трипсина (1x) в течение 1-2 мин при комнатной температуре (25 °C). Удалить трипсин, добавить 1 мл полной среды и сформировать клеточную суспензию путем пипетирования.
- Центрифугируют клеточную суспензию при 100 х г в течение 5 мин. Удаляют супернатант и повторно суспендируют в 0,5-1 мл PBS с целью получения клеточной суспензии. Клетки подсчитывали гемоцитометром и концентрация составляла около 3-5 х 105 клеток/мл.
- Приготовление суспензии клеточного ядра
- Выполните шаг 2.2. Затем удаляют супернатант и добавляют 200 мкл реагента для экстракции цитоплазматического белка А (дополненного 1% PMSF) на гранулу клетки 20 мкл (приблизительно 5 миллионов клеток) и хорошо перемешивают.
- Закрутите вышеуказанную смесь по 220 х г в течение 5 с, а затем поместите на ледяную ванну на 10 мин. После инкубации добавляют в раствор 10 мкл реагента для экстракции цитоплазматического белка В.
- Вихрь при 220 х г в течение 5 с. Поместите на ледяную ванну на 1 мин и снова вихрь при 220 х г в течение 5 с. Затем, наконец, центрифугу при 1000 х г в течение 5 мин при 4 °C.
ПРИМЕЧАНИЕ: Объемное соотношение реагентов для экстракции цитоплазматического белка А и В составляет 20:1. - Удалите супернатант и повторно суспендируйте гранулу в 1 мл PBS. Затем центрифугу при 1000 х г при 4 °C в течение 4 мин. Удаляют супернатант и повторно суспендируют в 100 мкл PBS в виде суспензии клеточного ядра.
- Добавьте трипан синего цвета к суспензии ядра вышеуказанной клетки и окрашивайте при комнатной температуре (25 °C) в течение 4 мин. Объемное отношение раствора трипана синего к суспензии ядра составляет 1:1. Подсчитайте количество ядер под инвертированным микроскопом с 10-кратным объективом.
ПРИМЕЧАНИЕ: Для четкой идентификации клеточных ядер под микроскопом требуется окрашивание трипан-синим цветом. Раствор трипан синего должен находиться на водяной бане при температуре 37 °C в течение 10 мин перед использованием для эффективного окрашивания. - Разбавляют вышеуказанную суспензию ядра клетки буфером PBS до концентрации 2-3 х 105 ядер/мл. Отфильтруйте суспензию ядра клетки через сито 70 мкм.
3. Измерение сжимаемости клетки и ядра
- Настройка измерительной системы (рисунок 3)
- Включите источник света микроскопа и откройте программное обеспечение камеры. Используйте объектив 4x, чтобы найти среднее положение микроканала, то есть положение пьезоэлектрической керамики.
- Соедините провода и приварите их к положительным и отрицательным клеммам выхода генератора сигналов на пьезоэлектрической керамике соответственно.
- Поместите шприц на микроинъекционный насос и подключите его к входному катетеру. Поместите небольшой контейнер в конце выходного катетера, чтобы удерживать жидкость, вытекающую из микроканала.
- Определение параметров измерения
- Аспирировать раствор частиц полистирола шприцем и впрыскивать его в микроканал чипа. Избегайте пузырьков воздуха в микроканале чипа, чтобы обеспечить точное измерение. Убедитесь, что частицы равномерно распределены в микроканале чипа.
ПРИМЕЧАНИЕ: Измерение может проводиться без проточного или шприцевого насоса. При необходимости расход микроинъекционного насоса должен быть установлен на надлежащее значение. Здесь диапазон расхода составляет 0-20 мкл/ч. - На выходе генератора сигналов установлен синусоидальный сигнал с частотой 1 МГц (3 МГц для измерения ядра ячейки) и пиковым напряжением (Vpp) 10 В.
- Тонкая настройка частоты сигнала до тех пор, пока не будет замечено, что частицы движутся к средней линии микроканала и остаются в прямом движении вдоль средней линии после достижения средней линии (рисунок 4).
ПРИМЕЧАНИЕ: Скорость частиц, движущихся к средней линии, определяется амплитудой напряжения, которая может регулироваться между 5 Впп и 20 Впп.
- Аспирировать раствор частиц полистирола шприцем и впрыскивать его в микроканал чипа. Избегайте пузырьков воздуха в микроканале чипа, чтобы обеспечить точное измерение. Убедитесь, что частицы равномерно распределены в микроканале чипа.
- Измерение клеток и ядер
- Смешайте 1 мл клеточной или ядерной суспензии со стандартным раствором частиц в соотношении 1:1 и введите его в микроканал шприцем.
- Начните запись с помощью ПЗС-камеры, когда клетки или ядра войдут в поле зрения. Затем включите генератор сигналов. Прекратите запись, когда клетки или ядра достигнут средней линии.
- Промывайте микроканал деионизированной водой, 75% спиртом и деионизированной водой последовательно для последующего использования.
4. Обработка данных
- Отображение траекторий частиц или ячеек.
- Импортируйте захваченное видео в программное обеспечение ImageJ: > «Открыть файл> «Выбрать папку». Нажмите на фигуру эллипса на панели инструментов программного обеспечения ImageJ, чтобы выбрать интересующую ячейку и соседнюю с ней частицу (рисунок 5).
- Как показано на рисунке 5, предустановленные параметры измерения в программном обеспечении ImageJ как Analyze→ Set Measurement →Area, Centroid, Display Label.
- Взятие кадра, где целевая ячейка или частица подвергается продольному смещению в качестве стартового кадра; записывайте положение пикселя и размер ячейки или частицы в каждом кадре, пока они не достигнут средней линии микроканала. Экспортируйте данные в виде файла электронной таблицы и повторяйте шаг до тех пор, пока не будут получены траектории для всех интересующих ячеек.
- Преобразование и коррекция координат.
- Запишите пиксельные координаты четырех углов микроканала в этом поле зрения как (0, y1), (0, y2), (x3, y3), (x4, y4). Здесь x3 = x4.
- Для каждой точки измерения (xi, yi) вычислите новую координату (xi', yi') после коррекции вращения, используя следующие формулы:
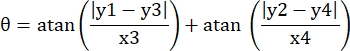
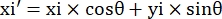

- Преобразуйте пиксельные координаты в координаты реального размера. Фактические координаты могут быть получены путем умножения пиксельных координат на отношение. Соотношение представляло собой фактическую ширину микроканала, деленную на ширину пикселей (H) микроканала.
- Преобразуйте и исправьте пиксельные координаты ячеек и частиц, полученные на шаге 4.1, в конечные данные траектории движения. Все координаты минус координаты левого нижнего угла, т.е. (0, y2). Частота кадров видео составляет 40 кадров в секунду, поэтому умножьте количество кадров, соответствующих каждой координате, на 0,025 с, чтобы получить время движения частицы, тем самым получив изменение положения в направлении y со временем.
- Рассчитайте плотность акустической энергии (рисунок 6A,B).
- Движение ячейки или частицы в направлении Y управляется акустической силой Fac и гидродинамической силой FD. Рассчитайте траекторию движения, используя следующие формулы:
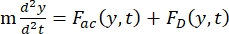 (1)
(1)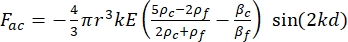 (2)
(2)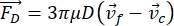 (3)
(3)
где r и D — радиус и диаметр ячейки или частицы, ρ и β — плотность и сжимаемость, ν — вектор скорости. Подстрочные индексы c и f обозначают ячейку и жидкость соответственно. d — расстояние от ближайшего узла акустического давления, μ — динамическая вязкость жидкости, k — волновое число, e — плотность акустической энергии.
ПРИМЕЧАНИЕ: Плотность MCF7, HCT116, A549 и ядер клеток составила 1068 кг/м3, 1077 кг/м3, 1073 кг/м3 и 1155 кг/м3, соответственно 12,16,17. - Согласно формулам, описанным на этапе 4.3.1, используйте программное обеспечение MATLAB для получения численного решения для стандартной траектории частиц под акустическим полем методом конечных разностей.
- В пределах заданного диапазона акустического поля измените плотность акустической энергии и подойдите к численному решению (полученному на шаге 4.3.2) и измеренной траектории движения (полученной на шаге 4.2) для стандартной частицы. Выберите наилучший результат подгонки в соответствии со средней квадратичной погрешностью подгонки. Полученная здесь плотность акустической энергии используется в качестве параметра для последующего расчета сжимаемости ячейки.
- Движение ячейки или частицы в направлении Y управляется акустической силой Fac и гидродинамической силой FD. Рассчитайте траекторию движения, используя следующие формулы:
- Рассчитайте сжимаемость ячейки (рисунок 6C,D).
- Установите плотность акустической энергии на значение, полученное на шаге 4.3.3.
- Согласно формулам, описанным на этапе 4.3.1, используйте программное обеспечение MATLAB для получения численного решения траектории ячейки под акустическим полем методом конечных разностей.
- Аналогично этапу 4.3.3, в пределах заданного диапазона сжимаемости изменяют сжимаемость и подходят численное решение (полученное на этапе 4.4.2) и измеренная траектория движения ячейки (полученная на этапе 4.2). Используйте коэффициент сжимаемости, соответствующий наилучшему результату подгонки, в качестве измеряемой сжимаемости ячейки.
Результаты
Здесь в работе представлен протокол построения быстрой и неразрушающей системы измерения сжимаемости клеток на основе акустофлюидного микроустройства и продемонстрированы его преимущества для измерения клетки и ядра в различных ситуациях. На рисунке 1 показана схем?...
Обсуждение
Обычно используемыми методами измерения клеточной механики являются AFM, аспирация микропипетки, методы микрофлюидики, метод параллельной пластины, оптический пинцет, оптические носилки и акустические методы20. Методы микрофлюидики могут работать с тремя подходами: микро?...
Раскрытие информации
Авторы не имеют конкурирующих финансовых интересов или других конфликтов интересов.
Благодарности
Это исследование было поддержано Национальным фондом естественных наук Китая (номера грантов 12075330 и U1932165) и Фондом естественных наук провинции Гуандун, Китай (номер гранта 2020A1515010270).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin(1x) | GIBCO | 15050-065 | |
| 502 glue | Evo-bond | cyanoacrylate glue | |
| A549 | ATCC | CCL-185 | lung adenocarcinoma |
| Cytonucleoprotein and cytoplasmic protein extraction kit | Beyotime | P0027 | Contains cytoplasmic protein extraction reagents A and B |
| Dulbecco’s modified Eagle medium (DMEM) | corning | 10-013-CVRC | |
| Fetal Bovine Srum(FBS) | AUSGENEX | FBS500-S | |
| HCT116 | ATCC | CCL247 | colorectal carcinoma |
| Heat-resistant glass | Pyrex | ||
| Leibovitz’s L-15 medium | GIBCO | 11415-064 | |
| MCF-7 | ATCC | HTB-22 | breast Adenocarcinoma |
| MDA-MB-231 | ATCC | HTB-26 | breast Adenocarcinoma |
| Minimum Essential Medium (MEM) | corning | 10-010-CV | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| Phosphate buffer | corning | 21-040-cvc | |
| PMSF | Beyotime | ST506 | 100mM |
| Polybead Polystyrene Red Dyed Microsphere | polysciences | 15714 | The diameter of microshpere is 6.00µm |
| propidium iodide(PI) | Sigma-Aldrich | P4170 | |
| SYLGARD 184Silicone ELASTOMER | Dow-Corning | 1673921 | Contains prepolymers and curing agents |
| Trypan Blue | Beyotime | C0011 |
Ссылки
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews. Cancer. 11 (7), 512-522 (2011).
- Frame, F. M., et al. HDAC inhibitor confers radiosensitivity to prostate stem-like cells. British Journal of Cancer. 109 (12), 3023-3033 (2013).
- Tseng, Y., Kole, T. P., Wirtz, D. Micromechanical mapping of live cells by multiple-particle-tracking microrheology. Biophysical Journal. 83 (6), 3162-3176 (2002).
- Möller, W., Brown, D. M., Kreyling, W. G., Stone, V. Ultrafine particles cause cytoskeletal dysfunctions in macrophages: role of intracellular calcium. Particle and Fibre Toxicology. 2, 7 (2005).
- Wang, X., et al. A three-dimensional magnetic tweezer system for intraembryonic navigation and measurement. IEEE Transactions on Robotics. 34 (1), 240-247 (2018).
- Machida, S., et al. Direct manipulation of intracellular stress fibres using a hook-shaped AFM probe. Nanotechnology. 21 (38), 385102 (2010).
- Bufi, N., et al. Human primary immune cells exhibit distinct mechanical properties that are modified by inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Jung, J. -. W., et al. Ionising radiation induces changes associated with epithelial-mesenchymal transdifferentiation and increased cell motility of A549 lung epithelial cells. European Journal of Cancer. 43 (7), 1214-1224 (2007).
- Hartono, D., et al. On-chip measurements of cell compressibility via acoustic radiation. Lab-on-a-Chip. 11 (23), 4072-4080 (2011).
- Sitters, G., et al. Acoustic force spectroscopy. Nature Methods. 12 (1), 47-50 (2015).
- Augustsson, P., Karlsen, J. T., Su, H. -. W., Bruus, H., Voldman, J. Iso-acoustic focusing of cells for size-insensitive acousto-mechanical phenotyping. Nature Communications. 7 (1), 11556 (2016).
- Cushing, K. W., et al. Ultrasound characterization of microbead and cell suspensions by speed of sound measurements of neutrally buoyant samples. Analytical Chemistry. 89 (17), 8917-8923 (2017).
- Riaud, A., Wang, W., Thai, A. L. P., Taly, V. Mechanical characterization of cells and microspheres sorted by acoustophoresis with in-line resistive pulse sensing. Physical Review Applied. 13 (3), 034058 (2020).
- Petersson, F., Aberg, L., Swärd-Nilsson, A. -. M., Free Laurell, T. flow acoustophoresis: microfluidic-based mode of particle and cell separation. Analytical Chemistry. 79 (14), 5117-5123 (2007).
- Griwatz, C., Brandt, B., Assmann, G., Zänker, K. S. An immunological enrichment method for epithelial cells from peripheral blood. Journal of Immunological Methods. 183 (2), 251-265 (1995).
- Katholnig, K., Poglitsch, M., Hengstschläger, M., Weichhart, T. Lysis gradient centrifugation: a flexible method for the isolation of nuclei from primary cells. Methods in Molecular Biology. 1228, 15-23 (2015).
- Fu, Q., Zhang, Y., Huang, T., Liang, Y., Liu, Y. Measurement of cell compressibility changes during epithelial-mesenchymal transition based on acoustofluidic microdevice. Biomicrofluidics. 15 (6), 064101 (2021).
- Zhang, Y., et al. Ionizing radiation-induced DNA damage responses affect cell compressibility. Biochemical and Biophysical Research Communications. 603, 116-122 (2022).
- Hao, Y., et al. Mechanical properties of single cells: Measurement methods and applications. Biotechnology Advances. 45, 107648 (2020).
- Yousafzai, M., et al. Effect of neighboring cells on cell stiffness measured by optical tweezers indentation. Journal of Biomedical Optics. 21 (5), 057004 (2016).
- Wei, M. -. T., et al. A comparative study of living cell micromechanical properties by oscillatory optical tweezers. Optics Express. 16 (12), 8594-8603 (2008).
- Khan, Z. S., Vanapalli, S. A. Probing the mechanical properties of brain cancer cells using a microfluidic cell squeezer device. Biomicrofluidics. 7 (1), 011806 (2013).
- Hirawa, S., Masudo, T., Okada, T. Acoustic recognition of counterions in ion-exchange resins. Analytical Chemistry. 79 (7), 3003-3007 (2007).
- Joosse, S. A., Gorges, T. M., Biology Pantel, K. detection, and clinical implications of circulating tumor cells. EMBO Molecular Medicine. 7 (1), 1-11 (2015).
- Martin, O. A., Anderson, R. L., Narayan, K., MacManus, M. P. Does the mobilization of circulating tumour cells during cancer therapy cause metastasis. Nature Reviews Clinical Oncology. 14 (1), 32-44 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены