Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экспериментальная количественная оценка взаимодействий между системами доставки лекарств и клетками in vitro: руководство по доклинической наномедицинской оценке
В этой статье
Резюме
Продемонстрирован рабочий процесс для абсолютной количественной оценки взаимодействий между лекарственными средствами и клетками-носителями с использованием проточной цитометрии, чтобы обеспечить лучшую рациональную оценку новых систем доставки лекарств. Этот рабочий процесс применим к носителям лекарств любого типа.
Аннотация
Основной компонент разработки систем доставки лекарств касается того, как усиливать или ослаблять взаимодействия с конкретными типами клеток. Например, химиотерапевтический препарат может быть функционализирован антителом для усиления связывания с раковыми клетками («нацеливание») или функционализирован полиэтиленгликолем, чтобы помочь избежать распознавания иммунных клеток («скрытность»). Даже на клеточном уровне оптимизация связывания и поглощения лекарственного носителя является сложной проблемой биологического дизайна. Таким образом, важно отделить то, насколько сильно новый носитель взаимодействует с клеткой, от функциональной эффективности груза перевозчика после доставки в эту ячейку.
Продолжая химиотерапевтический пример, «насколько хорошо он связывается с раковой клеткой» является отдельной проблемой от «насколько хорошо он убивает раковую клетку». Количественные анализы in vitro для последних хорошо известны и обычно полагаются на измерение жизнеспособности. Тем не менее, большинство опубликованных исследований по взаимодействиям между клетками и носителями являются качественными или полуколичественными. Как правило, эти измерения основаны на флуоресцентной маркировке носителя и, следовательно, сообщают о взаимодействиях с клетками в относительных или произвольных единицах. Однако эта работа может быть стандартизирована и сделана абсолютно количественной с небольшим количеством экспериментов по характеристике. Такая абсолютная количественная оценка ценна, поскольку она облегчает рациональное, меж- и внутриклассовое сравнение различных систем доставки лекарств - наночастиц, микрочастиц, вирусов, конъюгатов антитело-лекарство, инженерных терапевтических клеток или внеклеточных везикул.
Кроме того, количественная оценка является предпосылкой для последующих мета-анализов или подходов к моделированию in silico . В этой статье представлены видеоруководства, а также дерево решений о том, как достичь количественной оценки in vitro для систем доставки лекарств-носителей, которые учитывают различия в размере носителя и способе маркировки. Кроме того, обсуждаются дополнительные соображения по количественной оценке передовых систем доставки лекарств. Это призвано служить ценным ресурсом для улучшения рациональной оценки и проектирования для следующего поколения медицины.
Введение
Дизайн конструкций доставки лекарств, которые демонстрируют специфическое, спроектированное поведение в зависимости от того, с каким типом клеток они сталкиваются, привлек значительный исследовательский интерес. Потенциальные конструкции доставки лекарств или «носители» включают липидные составы, нано-выращенные неорганические вещества, полимерные сборки, внеклеточные везикулы, функционализированные бактериальные клетки или модифицированные вирусы. Все они могут проявлять специфичность органов, тканей или клеток из-за физических свойств, свойств поверхности или инженерных химических функционализаций, таких как присоединение антител 1,2.
Почти вездесущим шагом в оценке носителей in vitro является инкубация клеток с суспензией, содержащей указанный носитель, нагруженный лекарственными средствами. После инкубации производительность носителя измеряется с помощью функционального считывания характеристик лекарственного груза, например, эффективности трансфекции или токсичности. Функциональные показания полезны, поскольку они являются последующим показателем эффективности носителя. Однако для более сложных конструкций доставки лекарств становится все более важным выйти за рамки функциональных показаний и отдельно количественно оценить степень взаимодействия носителя с интересующей клеткой. Для этого есть несколько причин.
Во-первых, растет интерес к открытию (и итеративному совершенствованию) «платформенных» технологий перевозчика, которые могут перевозить различные грузы. Например, липидные наночастицы (LNP), предназначенные для инкапсуляции РНК, могут обменивать одну последовательность РНК на другую с несколькими оговорками3. Таким образом, чтобы итеративно улучшить технологию перевозчика, крайне важно количественно оценить ее производительность независимо от функциональности груза. Во-вторых, функциональные показания могут быть непростыми для интересующего груза, что ставит под угрозу способность быстро итерировать и оценивать составы носителей. В то время как можно выполнить оптимизацию in vitro с использованием модельного груза с простым функциональным считыванием (например, флуоресценцией), изменение груза может изменить биологическую реакцию на носитель4 и, таким образом, может не дать репрезентативных результатов. В-третьих, многие носители предназначены для взаимодействия и поглощения определенным типом клеток. Такая способность носителя к наведению может и должна быть дифференцирована от выполнения его терапевтического наведения на грузовой пост. Чтобы продолжить пример LNP, груз РНК может быть чрезвычайно мощным, но если LNP не может связываться с клеткой, быть интернализованным и высвобождать РНК, никакого последующего функционального эффекта не будет наблюдаться. Это может быть проблемой, особенно для носителей, предназначенных для нацеливания на труднотрансфецируемые типы клеток, такие как Т-клетки5. И наоборот, LNP может нацеливаться чрезвычайно эффективно, но груз РНК может не функционировать. Последующий анализ, который просто измеряет функциональность груза, не сможет различить эти две ситуации, что усложнит разработку и оптимизацию систем доставки лекарств перевозчиком.
В этой работе обсуждается вопрос о том, как абсолютно количественно оценить ассоциацию носителей. Ассоциация — это термин, который относится к экспериментально измеренной степени взаимодействия между носителем и клеткой. Ассоциация не дифференцирует мембранное связывание и интернализацию - носитель может быть связан, потому что он связан с поверхностью клетки или потому, что клетка усвоила его. Ассоциация обычно измеряется как часть экспериментов по инкубации клеточных носителей. Исторически сложилось так, что ассоциация была зарегистрирована либо в произвольных флуоресцентных единицах (обычно «средняя интенсивность флуоресценции» или MFI), либо как «процентная ассоциация», метрики, ограничения которых ранее обсуждались6. Короче говоря, эти измерения не сопоставимы между экспериментами, лабораториями и носителями лекарств из-за различий в экспериментальных протоколах, настройках проточного цитометра и интенсивности маркировки различных носителей. Были предприняты усилия по преодолению первого путем калибровки цитометра, тем самым преобразуя относительную меру МФО в абсолютно количественную меру флуоресценции7. Однако этот метод не учитывает изменчивость интенсивности маркировки различных носителей и, таким образом, не позволяет проводить рациональное сравнение различных характеристик носителей в целевой ячейке выбора8.
Здесь показано, как практически преобразовать относительные, произвольные флуоресцентные единицы в абсолютную количественную метрику «числа носителей на клетку», выполнив небольшое количество дополнительных экспериментов по характеризации. Если требуется другая метрика концентрации носителя (например, масса носителя на ячейку или объем носителя на ячейку), ее легко преобразовать из носителей на ячейку, при условии, что была сделана характеристика носителя. Для краткости и во избежание жаргона слово «носитель» используется в этой работе для обозначения обширного ассортимента конструкций доставки лекарств. Эти методы количественной оценки одинаково применимы, независимо от того, применяются ли они к наноинженерной частице золота или биоинженерным бактериям.
Несколько фактов позволяют преобразовать произвольные флуоресцентные единицы в носители на ячейку. Во-первых, измеренная интенсивность флуоресценции пропорциональна концентрации флуорофора9 (или флуоресцентно меченого носителя), при условии, что флуоресценция находится в пределах обнаружения прибора, а настройки прибора одинаковы. Таким образом, если флуоресценция носителя и флуоресценция образца известны, можно определить, сколько носителей присутствует в этом образце, если все измерения были выполнены в одних и тех же условиях. Однако, особенно для небольших носителей, может оказаться невозможным измерить флуоресценцию носителей, автофлуоресценцию клеток и флуоресценцию, связанную с клетками-носителями, на одном приборе с теми же настройками. В этом случае существует второе требование, позволяющее осуществлять преобразование между измеренной флуоресценцией на одном приборе и измеренной флуоресценцией на другом. Для этого может быть установлена стандартная кривая концентрации флуорофора для измерения интенсивности флуоресценции на обоих приборах, используя преимущества стандарта9 «Молекулы эквивалентного растворимого фторхрома» (MESF). Это позволяет измерять флуоресценцию носителя навалом навалом на нецитометре, измерение, которое может быть выполнено на носителях любого размера или характеристики. Когда такая количественная оценка навалом производится на суспензии носителя известной концентрации, количество носителей на ячейку образца может быть вновь рассчитано.
Хотя эта работа демонстрирует процесс измерения ассоциации носителей (определяемой измеренной интенсивностью флуоресценции), аналогичный протокол может быть выполнен для других измерений взаимодействия между клетками и носителями (например, экспериментальный протокол, который дифференцирует интернализованные и мембранно-связанные носители). Кроме того, этот протокол был бы в значительной степени таким же, если бы ассоциация измерялась с помощью нефлуоресцентного анализа (например, с помощью массовой цитометрии).
протокол
1. Выбор подходящего потока
- Следуйте дереву решений, показанному на рисунке 1 , чтобы определить лучший рабочий процесс (поток) (рисунок 2) для используемой экспериментальной установки. Обратитесь к обсуждению для дальнейших комментариев по этому выбору потока.
- Если вы следуете за потоком цитометра, перейдите к шагам 2.1.1-2.2.7. Если вы следуете за массовым потоком, перейдите к шагам 3.1.1.1-3.1.5.7.
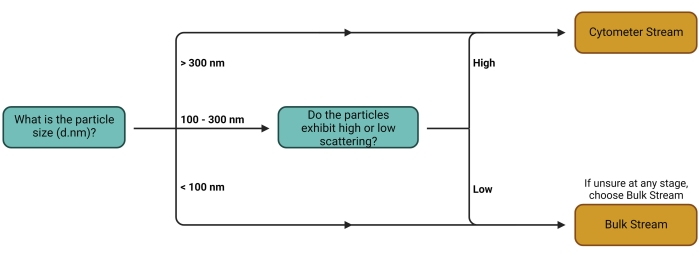
Рисунок 1: Дерево решений рабочего потока. Решение о том, какой Stream использовать, зависит, прежде всего, от типа интереса перевозчика. Более крупные носители и носители с высокими свойствами рассеяния могут быть легко обнаружены индивидуально на цитометрах, что делает их пригодными для количественной оценки с использованием цитометра Stream. Bulk Stream подходит для всех других типов перевозчиков. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
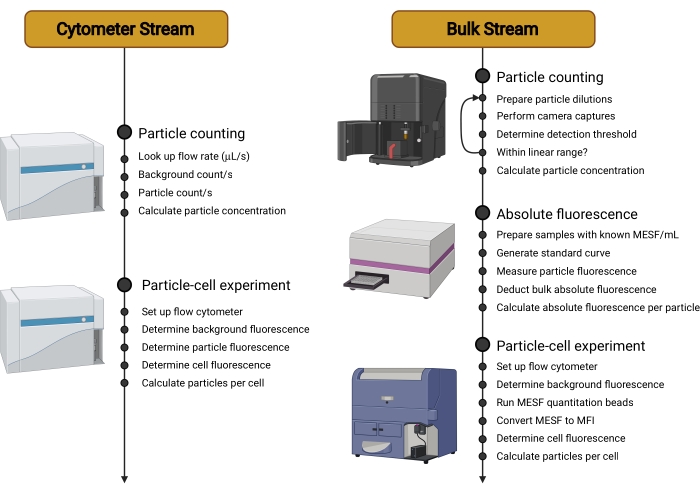
Рисунок 2: Обзор рабочих потоков. Этот протокол разделен на два разных потока. Cytometer Stream использует чувствительный цитометр для подсчета носителей в суспензии, измерения их индивидуальной флуоресценции, а затем определения флуоресценции клеток, инкубированных с носителями. Bulk Stream использует методы, не основанные на цитометрии, такие как анализ отслеживания наночастиц, для подсчета носителей в суспензии. Затем флуоресценция отдельного носителя количественно оценивается с помощью микропластичного считывателя или спектрофлуфлюорометра. Поэтому использование проточного цитометра ограничивается измерением конечной флуоресценции клеток, инкубированных с носителями, измерение, которое может быть выполнено на более широком диапазоне цитометров и которое не зависит от используемого типа носителя. Сокращения: MESF = молекулы эквивалентного растворимого фторхрома; MFI = средняя интенсивность флуоресценции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Поток цитометра
- Подсчет перевозчиков
ПРИМЕЧАНИЕ: Для этого измерения может быть использован любой проточный цитометр при условии, что известна скорость потока (мкл/с). Если скорость потока неизвестна и не может быть определена, не переходите к этому шагу. Вместо этого перейдите к шагу 3.1. Подсчет носителей в суспензии позволяет точно и воспроизводимо определить количество носителей, инкубированных в каждом клеточном эксперименте.- Настройте цитометр для обнаружения носителей, как по оптическому каналу рассеяния (обычно боковому рассеянию [SSC]), так и по флуоресценции. Обязательно отрегулируйте пороговое значение, чтобы разрешить обнаружение носителей.
ПРИМЕЧАНИЕ: Итерация по различным оптическим каналам рассеяния может потребоваться, если SSC не обеспечивает четкий сигнал (например, прямой рассеяние [FSC]). - Запустите образец только для разбавителя, чтобы количественно оценить количество фоновых событий как в SSC, так и в флуоресцентных каналах.
ПРИМЕЧАНИЕ: Идеальное количество фоновых событий составляет <100 событий/с. - Подготовьте носители к проточной цитометрии.
- Убедитесь, что носители хорошо подвешены путем вихря или обработки ультразвуком, в зависимости от задействованной несущей системы.
- Если возможно, убедитесь, что концентрация носителя составляет от 1000 носителей/мкл до 10 000 носителей/мкл. Количество событий на один-два порядка выше, чем фон, является хорошим началом. Если порядок величины концентрации носителя неизвестен, хорошим началом является приготовление разбавления 1:1000 из запаса. Используйте первоначальные результаты в качестве обратной связи для информирования о будущих разбавлениях проб.
ПРИМЕЧАНИЕ: Мутная подвеска, как правило, слишком концентрирована.
- Загрузите первый образец носителя на цитометр и начните запись.
- Сравните количество событий, полученных как от SSC, так и от флуоресцентных каналов; они должны быть примерно равны (разница <10%). Если нет, проверьте настройки цитометра, например, настройки фотоумножителя (PMT) и интенсивность лазера для флуоресцентного канала. Альтернативно, используйте другие методы, такие как конфокальная микроскопия, чтобы подтвердить, что флуоресцентная маркировка носителей присутствует и однородна.
- Повторите этапы 2.1.3-2.1.5 два или более дополнительных раза с различными разбавлениями из запаса. Убедитесь, что количество событий в каждом выборке по крайней мере на один порядок выше, чем количество фоновых событий.
- Удостовериться в том, что три или более образцов показывают линейный тренд, т.е. двукратное разбавление пробы должно привести к соответствующему двукратному снижению измеренной концентрации носителя.
- Используйте образцы в линейном диапазоне, соответствующие коэффициенты разрежения и известный расход цитометра для расчета концентрации носителя запаса в соответствии с уравнением (1):
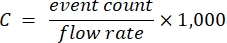 (1)
(1)
где C - концентрация стокового носителя в носителях/мл. Рекомендуется использовать количество событий, полученное в результате обнаружения оптического рассеяния, а не флуоресценции.
- Настройте цитометр для обнаружения носителей, как по оптическому каналу рассеяния (обычно боковому рассеянию [SSC]), так и по флуоресценции. Обязательно отрегулируйте пороговое значение, чтобы разрешить обнаружение носителей.
- Показания проточной цитометрии эксперимента с клеткой-носителем, включая определение интенсивности флуоресценции на носитель
ПРИМЕЧАНИЕ: В идеале интенсивность флуоресценции на носитель должна определяться как можно ближе к эксперименту с несущей ячейкой. Это делается для обеспечения того, чтобы МФО, полученные для отдельных носителей, можно было непосредственно сравнить с МФУ клеток, связанных с носителями. На практике цитометр обычно генерирует аналогичные результаты при использовании в последовательные дни с использованием одних и тех же напряжений PMT, но это не может быть гарантировано.- Разработайте эксперимент с несущей ячейкой. Используйте концентрацию носителя, определенную на стадии 2.1, для введения желаемой дозы носителей.
- Настройте проточный цитометр для окончательного эксперимента с несущей ячейкой, определив оптимальные настройки напряжения PMT в соответствующих каналах. Установите пороговые значения, чтобы разрешить обнаружение носителей.
- Запустите носители в суспензии для определения интенсивности флуоресценции на носитель в соответствии с текущими настройками PMT.
- При необходимости измените пороговые значения цитометра, чтобы обнаружить клетки, а не носителей.
- Запускают отрицательный контрольный образец — клетки, не инкубированные с носителями, — для определения фоновой флуоресценции (аутофлуоресценции) клеток.
- Запустите образцы клеток-носителей, чтобы определить интенсивность флуоресценции на клетку. Эта флуоресценция представляет собой линейную комбинацию клеточной аутофлуоресценции и присутствия флуоресцентных носителей.
- Рассчитайте количество носителей на ячейку, используя следующее уравнение (2):
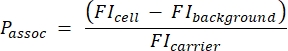 (2)
(2)
где Passoc - количество носителей, связанных с клеткой, FI-клетка - это MFI клеток, инкубированных с носителями, ФОН FI - это MFI клеток, не инкубированных с носителями, а FI-носитель - это MFI носителей в суспензии.
3. Объемный поток
- Подсчет носителей: анализ отслеживания наночастиц
ПРИМЕЧАНИЕ: В объемном потоке подсчет носителей является необходимым шагом для количественной оценки абсолютной интенсивности флуоресценции на носитель (см. этап 3.1.4). Кроме того, подсчет носителей в суспензии позволяет точно и воспроизводимо определить количество носителей, инкубированных в каждом клеточном эксперименте.- Подготовка
- Установите проточную ячейку на лазерный модуль и зафиксируйте весь лазерный модуль на месте внутри прибора.
- Медленно (не быстрее 0,1 мл/с) промыть проточную ячейку ~1 мл дистиллированной воды. Если пузырьки образуются внутри проточной ячейки, частично втяните суспензию, чтобы объединить пузырь с интерфейсом воздух-жидкость, прежде чем продолжить.
- Запустите камеру примерно на полпути через промывку; обязательно подтвердите, что мусор носителя вымыт. Выберите «Захват», чтобы открыть вкладку «Параметры захвата», и нажмите « Запустить камеру».
- Высушите систему 1 мл воздуха. Если на экране видны статические носители, очистите проточную ячейку в соответствии с инструкциями производителя.
- Подготовьте носители к анализу отслеживания наночастиц, убедившись, что носители хорошо подвешены с помощью вихрей или обработки ультразвуком, в зависимости от задействованной системы носителей. Если порядок величины концентрации запаса неизвестен, подготовьте из запаса разбавление 1:100 и используйте первоначальные результаты в качестве обратной связи для информирования о будущих разбавлениях проб. Разбавляют носители в воде, а не в фосфатно-буферном физиологическом растворе (PBS) для получения по меньшей мере ~0,6-1 мл каждого образца с концентрацией носителя от 1 × 107 носителей/мл до 1 × 109 носителей/мл.
ПРИМЕЧАНИЕ: Мутная подвеска, как правило, слишком концентрирована. Буферы и соли могут генерировать высокий фоновый шум.
- Измерение
- Выньте лазерный модуль и поместите его в вертикальное положение.
- Снимите первый образец носителя в шприц объемом 1 мл. Прикрепите шприц к входному отверстию трубки и осторожно загрузите образец в проточную ячейку. Если пузырьки образуются внутри проточной ячейки, частично втяните суспензию, чтобы объединить пузырь с интерфейсом воздух-жидкость, прежде чем продолжить. Убедитесь, что вся проточная ячейка заполнена жидкостью, затем сделайте паузу.
- Отрегулируйте фокусировку камеры, если это необходимо, чтобы визуализировать отдельные носители. Выполняйте грубые настройки фокусировки с помощью вращающейся ручки с правой стороны инструмента. Внесите более точные изменения, выбрав вкладку Оборудование | Насосы/Ступень. Измените фокус, отрегулировав ползунок «Фокус ».
- Отрегулируйте уровень камеры, чтобы убедиться в отсутствии перенасыщения. На вкладке Захват выберите оптимальный уровень камеры , настроив ползунок.
- Если прибор оснащен этим аксессуаром, загрузите шприц, содержащий образец носителя, в шприцевой насос для обеспечения непрерывного потока проб во время измерений.
- На вкладке СОП выберите Стандартное измерение , чтобы сделать пять снимков по 30 с каждый. Введите базовое имя файла и, при необходимости, добавьте дополнительный образец информации, нажав кнопку Дополнительно (которая открывает модальный диалог с различными вариантами).
ПРИМЕЧАНИЕ: Если введен коэффициент разрежения, конечное измерение концентрации носителя будет автоматически скорректировано программным обеспечением. Вводить этот фактор рекомендуется не рекомендуется. Вместо этого выполните регулировку вручную, что облегчает анализ и позволяет оценить, попадает ли каждое разбавление в динамический диапазон прибора (этап 3.1.3.4). - Нажмите Создать и запустить сценарий и подождите, пока появится всплывающее окно с запросом Пожалуйста, предварительный пример.
- При использовании шприцевого насоса выберите вкладку Оборудование | Шприц Насос вкладка | установите скорость инфузии на 30-80 и нажмите Infuse. Если не используется шприцевой насос, вручную продвиньте образец.
- Во всплывающем окне нажмите кнопку ОК , чтобы начать запись. После каждого из пяти захватов, когда снова появляется всплывающее окно «Пожалуйста, продвиньте образец », убедитесь, что образец все еще движется через проточную ячейку, вручную или через шприцевой насос. Затем нажмите кнопку ОК , чтобы продолжить следующий захват.
ПРИМЕЧАНИЕ: После пяти захватов программное обеспечение автоматически открывает вкладку «Процесс» и открывает всплывающее окно с просьбой настроить параметры процесса.
- Анализ
- На вкладке Процесс настройте ползунок Порог обнаружения (от 4 до 8), чтобы правильно определить отдельные носители, видимые на экране. Отрегулируйте усиление экрана , чтобы облегчить визуализацию; это не повлияет на последующий анализ. Используйте ползунок под экраном захвата для прокрутки нескольких кадров видео, чтобы упростить установку порога обнаружения.
ПРИМЕЧАНИЕ: Пороговое значение обнаружения должно устанавливаться один раз и впоследствии не должно изменяться между измерениями или образцами. - Во всплывающем окне (примечание после шага 3.1.2.9) нажмите OK , чтобы начать анализ отслеживания. Следите за ходом анализа, нажав на вкладку Анализ | Вкладка "Одиночный анализ ".
- После завершения анализа найдите приглашение «Параметры экспорта», в котором по умолчанию должны быть выбраны параметры «Включить PDF » и «Включить сводку эксперимента ». Выберите любые другие форматы экспорта по желанию.
- В разделе « Результаты » экспорта данных в формате PDF для обеспечения надежности измеренной концентрации убедитесь, что измеренная концентрация носителя составляет от 1 × 107 носителей/мл до 1 × 109 носителей/мл - динамический диапазон прибора - и проверьте наличие любых сообщений об ошибках или сообщений об осторожности под результатом измерения концентрации.
- Повторите этапы 3.1.2.1-3.1.3.4 два или более раз с различными разбавлениями из запаса. Убедитесь, что концентрация каждого образца находится в линейном диапазоне прибора.
- Выберите три или более образцов, которые показывают линейный тренд, то есть двукратное разбавление пробы должно привести к соответствующему двукратному снижению измеренной концентрации носителя. Используйте отобранные образцы и соответствующие коэффициенты разрежения для расчета концентрации носителя запаса.
- На вкладке Процесс настройте ползунок Порог обнаружения (от 4 до 8), чтобы правильно определить отдельные носители, видимые на экране. Отрегулируйте усиление экрана , чтобы облегчить визуализацию; это не повлияет на последующий анализ. Используйте ползунок под экраном захвата для прокрутки нескольких кадров видео, чтобы упростить установку порога обнаружения.
- Определение абсолютной интенсивности флуоресценции на носитель
ПРИМЕЧАНИЕ: Поскольку флуоресценция отдельных носителей в этом потоке не может быть охарактеризована непосредственно, интенсивность флуоресценции количественно определяется массой. Этот метод опирается на то, что интенсивность флуоресценции линейно связана с концентрацией фторхрома по закону Ламберта-Бира. Когда такая количественная оценка переносчиков в суспензии производится на суспензии известной концентрации носителя (см. этап 3.1), может быть получена флуоресценция на каждый носитель. Этот шаг может быть выполнен либо на флуоресцентном пластинчатом считывателе, либо на спектрофлуфлюорометре. Интенсивность флуоресценции сравнивается со стандартной кривой образцов с известной абсолютной флуоресценцией, приведенной в числе MESF.- Используйте раствор свободного фторхрома для маркировки носителя: повторно суспендируйте краситель в соответствующем буфере (например, DMSO) и выполните дальнейшие разбавления в том же буфере, что и разбавитель носителя. Альтернативно, используют раствор антитела, конъюгированного с фторхромом. Рассчитайте концентрацию исходного раствора (MESF/мл) из концентрации в мг/мл, молекулярной массы в мг/моль и числа Авогадро с помощью уравнения (3). Выполните последовательное разбавление в разбавителе носителя для получения стандартных образцов кривой.
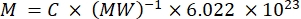 (3)
(3)
ПРИМЕЧАНИЕ: Используйте фторхром-конъюгированное антитело только в том случае, если известна степень маркировки, т.е. молярное соотношение между фторхромом и антителом в растворе. Первоначально сгенерируют стандартную кривую с широким диапазоном, так как интенсивность флуоресценции образца носителя до сих пор неизвестна. Отсюда сузьте его, чтобы включить требуемый диапазон. - Подготовьте образцы носителей.
ПРИМЕЧАНИЕ: Наилучшей практикой является испытание двух или более разбавлений носителей для проверки того, что измерения являются линейными и попадают в диапазон стандартной кривой. - Измерьте флуоресценцию равных объемов каждого образца, т.е. как несущей, так и стандартной кривых.
- Сгенерируйте стандартную кривую и вычтите объемную абсолютную интенсивность флуоресценции в MESF/мл для измеренных образцов носителей.
- Рассчитать абсолютную интенсивность флуоресценции на носитель (MESF/носитель) путем деления объемной флуоресценции (MESF/мл) на концентрацию носителя (носители/мл), как показано в уравнении (4):
 (4)
(4)
- Используйте раствор свободного фторхрома для маркировки носителя: повторно суспендируйте краситель в соответствующем буфере (например, DMSO) и выполните дальнейшие разбавления в том же буфере, что и разбавитель носителя. Альтернативно, используют раствор антитела, конъюгированного с фторхромом. Рассчитайте концентрацию исходного раствора (MESF/мл) из концентрации в мг/мл, молекулярной массы в мг/моль и числа Авогадро с помощью уравнения (3). Выполните последовательное разбавление в разбавителе носителя для получения стандартных образцов кривой.
- Клеточный эксперимент (включая определение эквивалентной интенсивности флуоресценции на носитель)
ПРИМЕЧАНИЕ: На этом этапе шарики количественного определения проточной цитометрии используются для создания стандартной кривой взаимосвязи между MESF и MFI. Эти бусины количественного определения состоят из нескольких популяций бусин с известным количеством MESF на бусину, и эти отдельные бусины могут быть обнаружены любым цитометром. В идеале стандартная кривая MESF определяется одновременно со считыванием экспериментов с несущими клетками. Это делается для того, чтобы значения МФО, рассчитанные для отдельных носителей, можно было непосредственно сравнить с МФО клеток, связанных с носителями. На практике цитометр обычно генерирует аналогичные результаты при использовании в последовательные дни с использованием одних и тех же напряжений PMT, но это не может быть гарантировано.- Разработайте эксперимент с несущей ячейкой. Используйте концентрацию носителя, определенную в разделе 3.1.3, для введения желаемой дозы носителей.
- Настройте проточный цитометр для окончательного эксперимента с несущей ячейкой, определив оптимальные настройки напряжения PMT в соответствующих каналах.
- Запускают отрицательный контрольный образец, то есть клетки, не инкубированные с носителями, для определения фоновой флуоресценции.
- Подготовьте и повторно суспендируйте шарики количественного определения проточной цитометрии. Используйте тот же буфер, который используется для образцов клеток (например, PBS). Если популяции бусин предоставляются отдельно, объедините их вместе.
- Запустите пробу бусины для измерения проточной цитометрии.
- Запустите образцы клеток-носителей, чтобы определить интенсивность флуоресценции на клетку.
- Используйте образец шарика количественного определения для создания стандартной кривой, преобразующей абсолютную интенсивность флуоресценции (MESF) в MFI. Используйте эту стандартную кривую и результаты шага 3.1.4 для расчета теоретических МФО носителей. Рассчитайте количество носителей на ячейку с помощью уравнения (5):
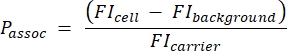 (5)
(5)
Где Passoc - количество носителей, связанных с клеткой, FI-клетка - это MFI клеток, инкубированных с носителями, ФОН FI - это MFI клеток, не инкубированных с носителями, а FI-носитель - это расчетная MFI носителей в суспензии (этап 3.1.4).
- Подготовка
Результаты
Как обсуждалось ранее, различные типы носителей лекарств требуют использования различных методов для абсолютной количественной оценки ассоциации клеточных носителей. Например, 633 нм дисульфид-стабилизированные частицы поли(метакриловой кислоты) (PMASH) ядра-оболочки являются бол...
Обсуждение
Характеристика взаимодействий между носителями лекарств и клетками становится все более важной в разработке новых систем доставки лекарств. В частности, чтобы обеспечить рациональную оценку и сравнение различных конструкций носителей, абсолютная количественная оценка производител...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Эта работа была поддержана Австралийским национальным советом по здравоохранению и медицинским исследованиям (NHMRC; Программный грант No GNT1149990), Австралийский центр исследований вирусологии ВИЧ и гепатита (ACH2), а также подарок от имения Режан Луизы Ланглуа. F.C. признает награду Национального совета по здравоохранению и медицинским исследованиям (NHMRC) Старшей главной исследовательской стипендии (GNT1135806). Рисунки 1 и 2 были созданы с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 C2 Maleimide | Invitrogen | A20347 | pH-stable dye used to label 150 nm, 235 nm, or 633 nm PMASH carriers; example of good dye to use in cell-carrier association studies |
| Apogee A50 Microflow | Apogee | Sensitive flow cytometer capable of detecting small carriers for counting | |
| CytoFLEX S Flow Cytometer | Beckman Coulter | Sensitive flow cytometer capable of detecting small carriers for counting and read out for final cell-barrier experiments | |
| FCS Express | De Novo Software | Software used to analyze flow cytometry data, i.e., perform gating and derive median fluorescence intensity values of populations of choice. Alternatives include FlowJo, OMIQ, Python | |
| Infinite 200 PRO | Tecan Lifesciences | Standard microplate reader instrument used for bulk fluorescence measurements of carriers in solution | |
| LSRFortessa Cell Analyzer | BD Biosciences | Less sensitive flow cytometer, but one more generally available to researchers. Can be used to read out final cell-carrier experiment | |
| NanoSight NS300 | Malvern Panalytical | Instrument used for Nanoparticle Tracking Analysis | |
| Prism 8 | GraphPad | Software used to graph and calculate standard curves. Alternatives include Microsoft Excel, Origin, Minitab, Python amongst many others | |
| Quantum MESF kits Alexa Fluor 647 | Bangs Laboratories | 647 | Absolute quantitation beads for flow cytometery. Used to convert fluorescence intensities measured in bulk on a microplate reader to fluorescence intensities measured on a flow cytometer using the MESF standard |
Ссылки
- Conde, J., et al. Revisiting 30 years of biofunctionalization and surface chemistry of inorganic nanoparticles for nanomedicine. Frontiers in Chemistry. 2, 48 (2014).
- Cheng, Q., et al. Selective ORgan Targeting (SORT) nanoparticles for tissue specific mRNA delivery and CRISPR/Cas gene editing. Nature Nanotechnology. 15 (4), 313-320 (2020).
- Jackson, N. A. C., Kester, K. E., Casimiro, D., Gurunathan, S., DeRosa, F. The promise of mRNA vaccines: A biotech and industrial perspective. npj Vaccines. 5 (1), 1-6 (2020).
- Press, A. T., et al. Cargo-carrier interactions significantly contribute to micellar conformation and biodistribution. NPG Asia Materials. 9 (10), 444 (2017).
- Cevaal, P. M., et al. In vivo T cell-targeting nanoparticle drug delivery systems: Considerations for rational design. ACS Nano. 15 (3), 3736-3753 (2021).
- Faria, M., Johnston, S. T., Mitchell, A. J., Crampin, E., Caruso, F. Bio-nano science: Better metrics would accelerate progress. Chemistry of Materials. 33 (19), 7613-7619 (2021).
- Shin, H., Kwak, M., Geol Lee, T., Youn Lee, J. Quantifying the level of nanoparticle uptake in mammalian cells using flow cytometry. Nanoscale. 12 (29), 15743-15751 (2020).
- Lozano-Andrés, E., et al. Considerations for MESF-bead based assignment of absolute fluorescence values to nanoparticles and extracellular vesicles by flow cytometry. bioRxiv. , (2021).
- Schwartz, A., et al. Formalization of the MESF unit of fluorescence intensity. Cytometry. Part B, Clinical Cytometry. 57 (1), 1-6 (2004).
- Faria, M., et al. Revisiting cell-particle association in vitro: A quantitative method to compare particle performance. Journal of Controlled Release. 307, 355-367 (2019).
- Chen, A. K., Cheng, Z., Behlke, M. A., Tsourkas, A. Assessing the sensitivity of commercially available fluorophores to the intracellular environment. Analytical Chemistry. 80 (19), 7437-7444 (2008).
- Comfort, N., et al. Nanoparticle tracking analysis for the quantification and size determination of extracellular vesicles. Journal of Visualized Experiments. (169), e62447 (2021).
- Cui, J., et al. Immobilized particle imaging for quantification of nano- and microparticles. Langmuir. 32 (14), 3532-3540 (2016).
- Shang, J., Gao, X. Nanoparticle counting: Towards accurate determination of the molar concentration. Chemical Society Reviews. 43 (21), 7267-7278 (2014).
- Thomas, D. G., et al. ISD3: A particokinetic model for predicting the combined effects of particle sedimentation, diffusion and dissolution on cellular dosimetry for in vitro systems. Particle and Fibre Toxicology. 15 (1), 6 (2018).
- Johnston, S. T., Faria, M., Crampin, E. J. Isolating the sources of heterogeneity in nano-engineered particle-cell interactions. The Journal of the Royal Society Interface. 17 (166), 20200221 (2020).
- Ahmed-Cox, A., et al. Spatio-temporal analysis of nanoparticles in live tumor spheroids impacted by cell origin and density. Journal of Controlled Release. 341, 661-675 (2022).
- Faria, M., et al. Minimum information reporting in bio-nano experimental literature. Nature Nanotechnology. 13 (9), 777-785 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены