Method Article
Генерация, высокопроизводительный скрининг и биобанкирование индуцированных человеком плюрипотентных сердечных сфероидов, полученных из стволовых клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь представлен набор протоколов для генерации и криоконсервации сердечных сфероидов (КС) из индуцированных человеком плюрипотентных кардиомиоцитов, полученных из стволовых клеток, культивируемых в высокопроизводительном многомерном формате. Эта трехмерная модель функционирует как надежная платформа для моделирования заболеваний, высокопроизводительных скринингов и сохраняет свою функциональность после криоконсервации.
Аннотация
Индуцированные человеком плюрипотентные кардиомиоциты, полученные из стволовых клеток (hiPSC-CM), имеют первостепенное значение для моделирования и лечения сердечных заболеваний человека. Недавно мы опубликовали экономически эффективную стратегию массового расширения hiPSC-CM в двух измерениях (2D). Двумя основными ограничениями являются незрелость клеток и отсутствие трехмерного (3D) расположения и масштабируемости на платформах скрининга с высокой пропускной способностью (HTS). Чтобы преодолеть эти ограничения, расширенные кардиомиоциты образуют идеальный источник клеток для создания 3D-культуры сердечных клеток и методов тканевой инженерии. Последний обладает большим потенциалом в сердечно-сосудистой сфере, обеспечивая более продвинутую и физиологически значимую ВТШ. Здесь мы описываем HTS-совместимый рабочий процесс с простой масштабируемостью для генерации, обслуживания и оптического анализа сердечных сфероидов (CS) в формате 96 лунок. Эти небольшие CS необходимы для заполнения пробела, присутствующего в современных моделях заболеваний in vitro и/или генерации для 3D-платформ тканевой инженерии. CS представляют собой высокоструктурированную морфологию, размер и клеточный состав. Кроме того, hiPSC-CM, культивируемые как CS, демонстрируют повышенное созревание и некоторые функциональные особенности человеческого сердца, такие как спонтанное обращение с кальцием и сократительная активность. Автоматизируя весь рабочий процесс, от генерации CS до функционального анализа, мы повышаем воспроизводимость внутри и между партиями, о чем свидетельствуют высокопроизводительные (HT) визуализации и анализ обработки кальция. Описанный протокол позволяет моделировать кардиологические заболевания и оценивать лекарственные/терапевтические эффекты на уровне отдельных клеток в сложной 3D-клеточной среде в полностью автоматизированном рабочем процессе HTS. Кроме того, в исследовании описывается простая процедура долгосрочного сохранения и биобанкирования цельных сфероидов, тем самым предоставляя исследователям возможность создать функциональное хранилище тканей следующего поколения. HTS в сочетании с долгосрочным хранением внесет существенный вклад в трансляционные исследования в широком спектре областей, включая открытие и тестирование лекарств, регенеративную медицину и разработку персонализированных методов лечения.
Введение
Открытие индуцированных человеком плюрипотентных стволовых клеток (ИПСК) открыло беспрецедентные возможности для изучения развития и болезней человека на клеточном уровне. За последнее десятилетие на основе уроков развития были разработаны различные протоколы, обеспечивающие эффективную дифференцировку ИПСК в кардиомиоциты (КМ)1,2,3,4. Кардиомиоциты, полученные из hiPSC (hiPSC-CM), могут служить ресурсом для моделирования генетически наследуемых сердечно-сосудистых заболеваний (ССЗ), тестирования сердечной безопасности для новых лекарств и сердечных регенеративных стратегий 5,6,7,8. Несмотря на направленную сердечную дифференцировку ИПСК, неопределенное количество КМ остается проблемой в области сердца, поскольку зрелые ИПСК-КМ обычно не являются пролиферативными, а первичные клетки человека недоступны в больших количествах.
Недавно мы описали, что сопутствующая активация передачи сигналов Wnt с культурой низкой плотности клеток приводила к массивному пролиферативному ответу (до 250 раз) hiPSC-CMs 9,10. Эта экономически эффективная стратегия массового расширения hiPSC-CM за счет последовательного пассажирования в формате колбы для культивирования облегчает стандартизацию и контроль качества большого количества функциональных hiPSC-CM. Кроме того, чтобы не отставать от спроса на большие партии hiPSC-CM от различных доноров, было описано биобанкирование hiPSC-CM10. Однако монослои кардиомиоцитов, посеянные в эти стандартные чашки для культивирования, не являются репрезентативными для сложной 3D-структуры, присутствующей в сердце. Кроме того, незрелость hiPSC-CM остается препятствием, таким образом, не имитируя биологический и физиологический фенотип сердечно-сосудистой среды in vivo.
Были разработаны новые 3D-модели in vitro, в которых hiPSC-CM демонстрируют более близкое физиологическое поведение, такое как самоорганизация 11,12, ремоделирование внеклеточного матрикса (ECM) 13, ускоренное созревание 14,15,16 и синхронизированное сокращение17,18,19 . 3D-модели использовались для открытия лекарств, тестирования кардиотоксичности лекарств, моделирования заболеваний, регенеративной терапии и даже первых клинических испытаний 20,21,22,23,24. Одной из наиболее часто используемых моделей является инженерная сердечная ткань на основе фибрина (EHT), которая демонстрирует тканеподобное расположение и сократимость сердца13,17,25. Ранее мы показали, что EHT, генерируемые из расширенных hiPSC-CM, демонстрируют сравнимую сократимость с таковыми из нерасширенных hiPSC-CM, демонстрируя нескомпрометированную клеточную функциональность после расширения9. Тем не менее, несмотря на то, что генерация EHT из hiPSC-CM хорошо налажена, ожидается дальнейшее развитие событий в отношении создания платформы оценки HT. Здесь быстрая генерация большого количества самоагрегирующих сердечных сфероидов (КС) в 96-луночном формате позволяет улучшить 3D-условия для целей высокопроизводительного скрининга (HTS).
В целом, преимуществом CS как 3D-культуры клеток является их высокая воспроизводимость и масштабируемость. В частности, CS в сочетании с роботизированной обработкой образцов могут стандартизировать и автоматизировать культуру CS, медикаментозное лечение и анализ с высоким содержанием20. Здесь мы описываем оптимизированные протоколы для создания высокочистых и высококачественных CS, которые могут быть эффективно криоконсервированы и проверены на сердечную функцию путем выполнения переходных измерений Ca2+ с использованием оптической системы сбора и анализа кальция. Эта модель представляет собой простой, но мощный инструмент для выполнения высокопроизводительных экранов на сотнях и тысячах сфероидов17,18.
протокол
ПРИМЕЧАНИЕ: hiPSC-CM, используемые в этом исследовании, были получены в соответствии с ранее описанными протоколами культивирования hiPSC и дифференцировки CM26,27. Опционально hiPSC-CM могут быть расширены и криоконсервированы, как недавно опубликовано, перед запуском протокола CS (раздел 4)10.
1. Приготовление сред для культивирования клеток, растворов и аликвот
- Подготовьте прикорневую среду
- Уравновесьте пенициллин-стрептомицин и среду (RPMI 1640) до комнатной температуры (RT) и убедитесь, что она полностью оттаяла. Смешайте 500 мл среды и 5 мл ручки/стрептококка. Хранить при температуре 4 °C до 8 недель; уравновесить до 37 °C перед использованием.
- Подготовьте RPMI + B27
- Уравновесьте добавку B27 и базальную среду до RT. Убедитесь, что добавка полностью разморозилась. Смешайте 490 мл базальной среды и 10 мл добавки 50x B27. Хранить при температуре 4 °C до 2 недель; уравновесить до 37 °C перед использованием.
- Подготовьте материал для повторного покрытия hiPSC-CM
- Добавьте Rho-ассоциированный ингибитор протеинкиназы (ROCK), содержащий спиральную спираль (ROCK) (конечная концентрация 2 мкМ) и 10% нокаутную замену сыворотки (KSR) в среду RPMI + B27. При необходимости добавляйте ингибитор ROCK непосредственно в среду RM. Не храните питательные среды после внесения добавок.
- Подготовьте размораживающую среду CM
- Добавьте добавку для выживания клеток в концентрации 1:100 (например, Revitacell) и 20% KSR в среду RPMI + B27 и уравновесьте до 37 ° C перед использованием.
- Приготовьте добавку для созревания
- Ранее описанная формула28 среды созревания состоит из: 3 мМ глюкозы, 10 мМ L-лактата, 5 мг/мл витамина B12, 0,82 мМ биотина, 5 мМ моногидрата креатина, 2 мМ таурина, 2 мМ L-карнитина, 0,5 мМ аскорбиновой кислоты, 1x NEAA, 0,5% (мас./об.) альбумакса, 1x B27 и 1% KOSR. Чтобы приготовить один полный флакон (500 мл) добавки для созревания, удалите 65 мл из флакона DMEM без глюкозы и добавьте 2,7 г глюкозы, 5,6 г L-лактата, 0,025 мг витамина B12, 1 мг биотина, 3,73 г моногидрата креатина, 1,25 г таурина, 1,975 г L-карнитина, 0,7125 г аскорбиновой кислоты, 50 мл NEAA, 12,5 г альбумакса и 5 мл пенициллина-стрептомицина.
- Фильтруйте через стерильный одноразовый фильтрующий блок с мембраной из полиэфирсульфона (PES) с порами 0,22 мкм.
- Аликвота на 45 мл (для приготовления 500 мл созревающей среды) или 4,5 мл (для приготовления 50 мл созревающей среды). Хранить при температуре 20 °C до 6 месяцев.
- Подготовьте среду для созревания
- Уравновесьте добавку B27, нокаутирующий SR, пенициллин-стрептомицин, добавку для созревания28 и среду DMEM без глюкозы при RT. Убедитесь, что добавка полностью разморозилась. Смешайте 435 мл среды DMEM без глюкозы с 10 мл добавки 50x B27, 5 мл пенициллина-стрептомицина, 5 мл нокаута SR и 45 мл добавки для созревания. Хранить при температуре 4 °C до 2 недель; уравновесить при 37 °C перед использованием.
- Приготовьте флуор из светлой среды
- Уравновесьте пенициллин-стрептомицин и фторобритную среду DMEM при ЛТ. Убедитесь, что добавка полностью разморожена. Смешайте 500 мл фторбритной среды DMEM с 5 мл пенициллина-стрептомицина. Хранить при температуре 4 °C до 1 месяца; уравновесить при 37 °C перед использованием.
- Приготовьте неионогенный раствор моющего средства
- Смешайте 20% неионогенного моющего порошка (например, F-127) с PBS. Фильтруйте с помощью фильтра 0,22 мкм и храните при температуре 4 °C до 6 месяцев; уравновесить при RT перед использованием.
- Подготовьте среду для окрашивания кальция
- Смешайте раствор неионогенного моющего средства (конечная концентрация 0,04% по об.) и 0,1x кальциевого красителя (например, Cal520 AM) во флуоресцентной светлой среде. В коническую пробирку объемом 50 мл добавьте 10 мкл кальция 520 и 20 мкл раствора неионогенного моющего средства. Перемешать до полного растворения. Держите раствор в темноте перед добавлением в клетки.
2. Подготовка буферов
- Подготовьте буфер для пермеабилизации и блокировки: Этот буфер содержит 10 мл PBS, 5% мас./об. BSA и 0,3% об./об. Triton-X-100.
- Подготовьте буфер для проточной цитометрии: Этот буфер содержит 50 мл PBS, 1% мас./об. BSA и 0,3% об./об. Triton-X-100.
- Буфер для промывки проточной цитометрии: Этот буфер содержит 50 мл PBS и 1% мас./об. BSA.
- Сфероидный буфер для промывки (SWB): Этот буфер содержит 1 мл Triton-X-100, 2 мл 10% (мас. / об. в DPBS) SDS и 2 г BSA в 1 л PBS.
ПРИМЕЧАНИЕ: SWB можно хранить при температуре 4 °C до 2 недель. - Приготовьте раствор для заделки (ES): Чтобы приготовить 100 мл раствора для заделки, смешайте 50 мл глицерина с 9,09 мл dH2O, 1 мл буфера Tris (1 М, pH 8,0) и 200 мкл ЭДТА (0,5 М). Добавьте 22,7 г фруктозы и перемешайте при РТ в темноте до полного растворения. Когда станет ясно, добавьте 22,2 г фруктозы и перемешайте до полного растворения. Затем добавьте 15 г мочевины и перемешайте до полного растворения (хранить при температуре 4 °C в темноте).
- Подготовьте буфер PBT (PBS с анимацией-20). Этот буфер содержит PBS/Tween-20 (0,1% об./об.). На 1 л PBS добавьте 1 мл Tween-20.
3. Получение малых молекул
- Восстановите порошок тиазовивина (ингибитора ROCK) в аликвотах 10 мМ по 50 мкл в ДМСО и храните при -20 ° C до 6 месяцев. Беречь от света.
- Приготовьте 2,5 мМ аликвоты по 10 мкл каждого Cal-520 AM в ДМСО и храните их при -20 ° C до 6 месяцев. Беречь от света.
4. Генерация сердечного сфероида
ПРИМЕЧАНИЕ: Для больших количеств CS засейте до 1 миллиона CM в 6-луночную пластину со сверхнизким креплением с 2 мл среды для повторного покрытия hiPSC-CM. В этом исследовании использовалось от 2 500 (2,5 тыс. CS) до 20 000 (20 тыс. CS) hiPSC-CM на скважину 96-луночного планшета.
- Для одной 96-луночной пластины подготовьте клеточную культуру, содержащую не менее 2 x 106 индуцированных человеком плюрипотентных кардиомиоцитов, полученных из стволовых клеток (hiPSC-CMs)10.
- Когда культивируемые hiPSC-CM достигают слияния, добавьте 0,1 мл /см2 стерильного раствора для отслойки сердца (например, трипла) в каждую лунку. Инкубируйте пластину при температуре 37 °C в течение 15 минут.
- Используя пипетку объемом 5 мл, механически диссоциируйте клетки, промывая 2 мл теплой базальной среды, чтобы получить одноклеточную суспензию. Подтвердите отслоение с помощью светлопольного микроскопа (4-кратное увеличение); Клетки будут выглядеть белыми и иметь круглую форму.
- Перенесите клеточную суспензию в коническую пробирку объемом 15 мл и центрифугу в течение 3 мин при 300 x g.
- Аспирируют надосадочную жидкость и ресуспендируют клетки в 1 мл среды для повторного покрытия hiPSC-CM.
- Используя наконечник пипетки объемом 1,000 мкл, механически диссоциируйте гранулу ячейки. Раствор кажется однородным после трех-четырех смешиваний. Посчитайте ячейки. Перенесите соответствующее количество ячеек в 100 мкл среды для повторного покрытия в каждую 96-луночную лунку со сверхнизкой насадкой с круглым дном.
- Поместите пластину CSs на орбитальный шейкер при 70 об/мин в инкубаторе на 24 часа. Установите условия инкубатора на 37 °C, 5% CO 2, 21% O2 и влажность 90%.
- Аспирируйте 50 мкл среды из каждой лунки и добавляйте 100 мкл среды RPMI + B27 на лунку в течение первых 48 часов.
ПРИМЕЧАНИЕ: Всегда держите 50 мкл среды в 96-луночной пластине, чтобы избежать случайной аспирации и разрыва сфероида. - Аспирируйте 100 мкл среды из каждой лунки и добавьте 100 мкл среды созревания в лунку. Поддерживайте клетки в среде созревания и обновляйте среду каждые 2-3 дня.
5. Криоконсервация КС
ПРИМЕЧАНИЕ: CS могут быть криоконсервированы для длительного хранения. Криоконсервацию можно проводить с 3-го дня после генерации КС. КС можно криоконсервировать непосредственно в лунках 96-луночного планшета или в виде суспензии КС в криовиалах.
- Предварительно охладите тарелку, поставив тарелку на лед на 10 минут.
- Центрифугируйте сфероидную пластину в течение 3 мин при 70 x g.
- Удалите надосадочную жидкость до тех пор, пока не останется 50 мкл, и добавьте 200 мкл ледяной морозильной среды hiPSC на лунку.
ПРИМЕЧАНИЕ: Держите суспензию CS на льду в течение всей процедуры. В случае 6-луночной пластины со сфероидами заморозьте одну лунку в криовальной среде для замораживания объемом 500 мкл. - Запечатайте пластину герметизирующей пленкой.
ПРИМЕЧАНИЕ: 96-луночная пластина должна храниться в полистирольном ящике или, если она недоступна, может быть изготовлена силиконовая форма, как описано на шаге 5.5.1. - Чтобы обеспечить равномерный теплообмен между колодезной плитой и морозильной камерой, аккуратно поместите пластину в полистирольный ящик или в силиконовую форму.
- Чтобы приготовить силиконовую форму: энергично смешайте два компонента набора кремниевого эластомера в соотношении 10:1. Разбавляйте раствор с помощью вакуумного насоса в течение 15-20 мин. Затем залейте раствор внутрь нижней части колодезной плиты и удалите пузырьки с помощью вакуумного насоса в течение 10 минут. Поместите форму в духовку и выдерживайте при 60 ° C в течение 8 часов, чтобы получить полугибкий эластомер, который снимается с пластины.
- Заморозьте пластину при -80 °C не менее 4 часов в коробке из полистирола или подготовленной силиконовой форме.
- Перенесите пластину в резервуар с жидким азотом или морозильную камеру с температурой -150 °C для длительного хранения.
6. Размораживание сфероидов сердца
ПРИМЕЧАНИЕ: Не размораживайте более одной пластины за раз, чтобы обеспечить быстрый процесс оттаивания.
- Приготовьте 20 мл предварительно нагретой базальной среды при температуре 37 °C в конической пробирке объемом 50 мл.
- Соберите клеточную пластину с КС из жидкого азота и поместите ее в инкубатор на 15 мин. Установите условия инкубатора на 37 °C, 5% CO 2, 21% O2 и влажность 90%.
- Удалите надосадочную жидкость и остатки клеточной гранулы и ресуспендируйте каждую лунку в теплой базальной среде. Используйте 200 мкл среды на лунку.
- Центрифуга в течение 3 мин при 70 х г.
- Повторите шаги 6.3 и 6.4.
- Удалите надосадочную жидкость до тех пор, пока не останется гранула ячейки, и добавьте 200 мкл талающей среды CM в каждую лунку.
- Поместите пластину CS на орбитальный шейкер при 70 об/мин в инкубаторе на 24 часа. Установите условия инкубатора на 37 °C, 5% CO 2, 21% O2 и влажность 90%.
- Аспирируйте 50 мкл среды из каждой лунки и добавляйте 100 мкл среды RPMI + B27 на лунку в течение первых 48 часов.
- Аспирируйте 100 мкл среды из каждой лунки и добавьте 100 мкл среды созревания в лунку. Поддерживайте клетки в созревающей среде и обновляйте среду каждые 2-3 дня.
7. Оценка внутриклеточных переходных процессовCa2+
ПРИМЕЧАНИЕ: CS находятся в культуре в общей сложности 3 недели; За 2 недели до заморозки и 1 неделю после размораживания. «Свежие» элементы управления соответствуют возрасту.
- После 1 недели культивирования размороженные CS оптимальны для оптической визуализации кальция. Используйте кальциевый краситель (например, Cal520AM) для оценки поглощения и высвобождения Ca2+ из клеток.
- Обработайте их 100 мкл среды кальциевого красителя на лунку и выдержите в инкубаторе 60 мин. Установите условия инкубатора на 37 °C, 5% CO 2, 21% O2 и влажность 90%.
ПРИМЕЧАНИЕ: Cal520AM чувствителен к свету. Выполняйте все погрузочные процедуры и эксперименты в темноте. - Подготовьте систему сбора и анализа кальция.
- Включите микроскоп, убедившись, что опция контроля окружающей среды включена.
- Отрегулируйте размеры диафрагмы камеры и кадрирования, чтобы свести к минимуму область фона.
ПРИМЕЧАНИЕ: Здесь использовался микроскоп Leica Thunder DMi8; Другие системы микроскопов также применимы до тех пор, пока они не разрешают частоту дискретизации выше 30 кадров в секунду (FPS).
- Запишите видео с последовательным потоком из 2−10 пиков в течение 10 с и просканируйте 96-луночную пластину, сначала двигаясь влево, а затем зигзагообразно вниз, чтобы покрыть всю пластину. Измерьте кальциевый сигнал с помощью лазера с длиной волны 488 нм; Установите контраст на черный фон с ярко-зеленым сигналом во время высвобождения кальция.
- После получения переходных процессов Ca2+ проанализируйте данные с помощью программного обеспечения для анализа следов флуоресценции (например, CyteSeer, Vala Sciences) в соответствии с инструкциями производителя.
8. Проточная цитометрия диссоциированных сердечных сфероидов
ПРИМЕЧАНИЕ: В этом исследовании проточная цитометрия использовалась для определения жизнеспособности CS до и после процесса оттаивания.
- Соберите CS в коническую пробирку объемом 15 мл, используя пипетку объемом 5 мл, чтобы избежать повреждения сфероида, и центрифугу в течение 3 минут при 70 x g. Аспирируйте надосадочную жидкость и добавьте 1 мл PBS.
- Центрифуга в течение 3 мин при 200 х г. Аспирируйте надосадочную жидкость и диссоциируйте CSs, добавив 1 мл раствора для отслойки сердца (например,.трипл). Инкубировать пробирку при 37 °C в течение 15 мин.
- Используя пипетку объемом 5 мл, механически диссоциируйте клетки, промывая 2 мл базальной среды до тех пор, пока отдельные клетки не будут видны при наблюдении под микроскопом.
- Центрифуга в течение 3 мин при 200 х г.
- Аспирируйте надосадочную жидкость и зафиксируйте КМ 200 мкл 4% раствора параформальдегида (ПФА) в 1x PBS. Инкубировать в течение 10 мин при РТ.
- Центрифуга в течение 3 мин при 200 х г. Аспирируйте надосадочную жидкость и добавьте 1 мл PBS.
ПРИМЕЧАНИЕ: Точка паузы: фиксированные hiPSC-CM можно хранить при температуре 4 °C до 4 недель. - Перенесите клеточную суспензию в пробирку FACS и центрифугу в течение 3 мин при 200 x g. Аспирируют надосадочную жидкость и ресуспендируют 1 x 105 клеток в 50 мкл буфера для пермеабилизации.
- Инкубировать клетки в течение 30 мин при 4 °C.
- Для иммунофлуоресцентного анализа проточной цитометрии выполните шаги 8.9.1-8.9.4.
- Ресуспендируют клетки в буфере проточной цитометрии (50 мкл), содержащем антитело к α-актинину, в разведении 1:300. В другой пробирке FACS ресуспендируют 1 x 105 клеток в буфере проточной цитометрии (50 мкл) с соответствующим контролем изотипа (например, IgM мыши FITC, изотип κ [разведение 1:200]). Точно так же ресуспендируют 1 x 105 клеток в 50 мкл буфера проточной цитометрии для отрицательного контроля.
- Инкубировать клетки в течение 30 мин при 4 °C.
- Добавьте 2,5 мл буфера для проточной цитометрии и центрифугируйте клетки при 200 x g в течение 3 мин при 4 °C; Выбросьте надосадочную жидкость и повторите этот этап стирки дважды.
- Ресуспендируют клетки в 50 мкл буфера проточной цитометрии с вторичным антителом козла-антимышь (разведение 1:300).
ПРИМЕЧАНИЕ: Поместите пробирку в темноту, так как раствор вторичных антител чувствителен к свету.
- Для проверки жизнеспособности йодида пропидия (PI) добавьте 150 мкл PI на образец (1:1000) и инкубируйте в течение 15 минут.
ПРИМЕЧАНИЕ: Поместите трубку в темноту, так как раствор PI чувствителен к свету. - Отрегулируйте ворота в соответствии со стандартной стратегией стробирования, как показано на дополнительном рисунке 1 , и проанализируйте клетки с помощью проточного цитометра.
9. Иммунофлуоресцентное окрашивание целых 3D-сфероидов
ПРИМЕЧАНИЕ: Этот протокол основан на протоколе 3D-визуализации с высоким разрешением целых органоидов при иммунофлуоресцентной маркировке, который был ранее опубликован29 и скорректирован для сердечных сфероидов. Во время процедуры все наконечники пипеток и конические трубки могут быть покрыты 1% мас./об. BSA-PBS, чтобы предотвратить прилипание сфероидов к пластику. Чтобы покрыть материалы, окуните их в 1% BSA-PBS. Будьте осторожны, чтобы не повредить сфероиды с помощью пипетки объемом 5 мл, избегая механического разрушения.
- Соберите CS в пробирку с покрытием объемом 15 мл с пипеткой объемом 5 мл. Сфероиды видны глазу. Соберите ~ 20-50 сфероидов на комбинацию антител. Центрифугу в течение 3 мин при 70 х г и аспирировать надосадочную жидкость.
- Осторожно ресуспендируйте сфероиды в 1 мл ледяного 4% раствора параформальдегида (ПФА) в 1x PBS, используя наконечник объемом 1 мл с покрытием.
- Хранить при температуре 4 °C в течение 45 минут. Через 20 минут осторожно ресуспендируйте сфероиды с помощью наконечника объемом 1 мл с покрытием. Это выравнивает фиксацию среди всех сфероидов.
- Добавьте 10 мл ледяного PBS в пробирку и аккуратно перемешайте, перевернув пробирку. Инкубировать в течение 10 мин при 4 °C и отжимать при 70 x g в течение 3 мин.
ПРИМЕЧАНИЕ: Начиная с этого этапа, покрытие наконечников и конических трубок, как правило, не требуется, так как CS не прилипают к наконечнику после фиксации. - Заблокируйте CS, ресуспендировав гранулу в ледяном SWB (200 мкл SWB на лунку), и перенесите сфероиды на 24-луночную суспензионную культуральную пластину.
ПРИМЕЧАНИЕ: CS из одной большой гранулы могут быть разделены на несколько лунок для выполнения различных окрашиваний. Используйте ~ 20-50 CS на комбинацию антител. - Инкубировать при 4 °C не менее 15 мин.
- Добавьте 200 мкл SWB в пустую скважину, чтобы она служила эталонной скважиной.
ПРИМЕЧАНИЕ: Для иммунофлуоресцентного окрашивания также можно использовать 48- или 96-луночные планшеты, чтобы уменьшить использование антител. Однако результаты окрашивания и стирки могут быть снижены из-за меньшего объема на лунку. - Дайте сфероидам осесть на дне пластины, оставив пластину наклоненной под углом 45° на 5 минут.
- Удалите SWB, оставив CS в 200 мкл SWB (используйте эталонную скважину, чтобы оценить минимальный объем 200 мкл).
- Добавьте 200 мкл SWB с первичными антителами, сконцентрированными в 2 раза (например, ɑ-актинин [1:200] и тропонин T [1:200]) и инкубируйте в течение ночи при 4 ° C, покачивая / встряхивая (40 об / мин на горизонтальном шейкере).
- На следующий день добавьте по 1 мл SWB в каждую лунку.
- Дайте сфероидам осесть на дне пластины, оставив пластину под углом 45° на 5 минут.
- Извлеките SWB, оставив 200 мкл в пластине. Добавьте 1 мл SWB и промывайте в течение 2 ч, медленно покачивая/встряхивая.
- Повторите шаги 9.12 и 9.13 еще дважды.
- Дайте CS осесть на дне пластины, оставив пластину наклоненной под углом 45 ° в течение 5 минут. Удалите SWB, оставив по 200 мкл в каждой лунке.
- Добавьте 200 мкл SWB с вторичными антителами, конъюгированными антителами и красителями в 2 раза концентрированными (например, DAPI [1 мкг/мл], мышь-AF488 [1:500], кролик-AF568 [1:500]) и инкубируйте в течение ночи при температуре 4 ° C в темноте, медленно покачивая / встряхивая.
- На следующий день повторите шаги 9.12 и 9.13 еще дважды.
- Осторожно перенесите CSs в пробирку объемом 1,5 мл и вращайте при 70 x g в течение 3 мин.
- Удалите как можно больше SWB с помощью пипетки, не нарушая CS.
- Добавьте раствор для встраивания (ES; не менее 50 мкл при RT) с помощью наконечника объемом 200 мкл с отрезанным концом и осторожно ресуспендируйте для предотвращения образования пузырьков и инкубируйте при RT в течение 20 минут.
- Тем временем создайте квадратную емкость на предметном стекле с лаком для ногтей или силиконовым герметиком.
- Отрежьте конец наконечника объемом 200 мкл и перенесите CS в ES в середину квадратного контейнера.
- Сверху положите квадратное покрывало. Чтобы уменьшить количество пузырьков воздуха, сначала поместите одну сторону покровного стекла, затем медленно опустите покровное стекло с одной стороны на другую, пока под поверхностью не останется захваченного воздуха, а затем отпустите покровное стекло.
- Аккуратно надавите на все края покровного стекла, чтобы прикрепить его к лаку для ногтей или силиконовому герметику.
- Оставьте слайд на ночь в RT. На следующий день слайд готов к визуализации.
ПРИМЕЧАНИЕ: Оптическая очистка с помощью ES может привести к незначительной усадке тканей. Однако это не может повлиять на общую морфологию CS. Здесь процедуру окрашивания можно приостановить, храня предметные стекла при температуре 4 °C (не менее 1 недели) или при -20 °C (не менее 6 месяцев).
Результаты
Протокол, показанный на рисунке 1A, описывает генерацию CS из ранее расширенных hiPSC-CM. CS приобретают 3D-структуру к 1-му дню после посева в пластинах со сверхнизким креплением с круглым дном и могут культивироваться до 6 недель (рис. 1B). По оценке иммунофлуоресцентного окрашивания, большинство клеток в 3-недельных КС экспрессировали саркомерные белки, такие как α-актинин и тропонин Т, и демонстрировали регулярную организацию саркомеров (рис. 1C). Для количественного определения α-актинин-положительных клеток был проведен анализ проточной цитометрии. В соответствии с результатами иммунофлюоресценции данные проточной цитометрии продемонстрировали сопоставимо высокие уровни α-актинина как в 0-й день (76,9% ± 16,6%), так и в 3-недельном КС (71,1% ± 22,7%) (рис. 1D), что указывает на постоянный и высокочистый клеточный состав во время культивирования. Наблюдалась повышенная экспрессия сердечных генов для соединений (GJA1, JPH2 и PKP2), десмосом (DES) и митохондрий (ATP5A) в сфероидах, полученных из hiPSC-CM (42-й день), по сравнению с hiPSC-CM, культивируемыми в 2D в течение 90 дней (рис. 1E). Экспрессия этих генов является отличительной чертой межклеточного взаимодействия и созревания30.
Впоследствии функциональные свойства КС, а именно скорость биения и обработка Ca2+, были оценены в разные моменты времени (рис. 2). Переходные параметры кальция, такие как время нарастания, время пика, время распада и продолжительность переходного процесса кальция (CTD90), оценивались, как показано на рисунке 2A, B. Процент побед над CS аналогичен в первые 3 недели после генерации, но значительно снизился на 6-й неделе (Wk6) CS (рис. 2C). Частота биения была значительно снижена в Wk3 по сравнению с Wk1 и, подобно проценту побед CS, резко снизилась в Wk6 (рис. 2D). В Wk6 наблюдалось ухудшение CS, что может объяснить снижение как скорости биения, так и количества биения CS. Измерение переходных параметров кальция показало значительно более высокое пиковое значение на Wk2 (рис. 2E), в то время как время нарастания, время распада и CTD90 были значительно увеличены на Wk3 по сравнению с Wk1 (рис. 2F-H ). Взятые вместе, эти результаты показывают, что сфероиды, полученные из hiPSC-CM, функционально оптимальны примерно на 2-й и 3-й неделях после генерации.
На рисунке 3 показано влияние размера сфероида на скорость биения и обработку кальция. КС были получены путем посева 2,5 x 10 4, 5 x 10 4, 10 x 10 4 и 20 x 10 4 hiPSC-CM в скважину 96-луночного планшета, в общей сложности 24 CS / скважины на условие (рис. 3A). Как и ожидалось, размер сфероида увеличивался по мере увеличения количества используемых ячеек, варьируясь от 178 ± 36 мкм до 351 ± 65 мкм (рис. 3A, правая панель). Переходные процессы Ca2+ были измерены в 3-недельных CS при четырех различных плотностях посева (рис. 3B). Измерения КС большего размера показали, что только около 50% КС меньшего размера (2,5 КБ и 5 КБ) были избиты, в то время как процент КС большего размера (10 КБ и 20 КБ) был значительно выше (около 85%) (рис. 3C). Аналогичная скорость биения (примерно 28 ударов в минуту) была показана 5K-, 10K- и 20K-CS, что было значительно выше по сравнению с 2,5K-CS (рис. 3D). Пиковые значения изображений кальция были одинаковыми во всех тестируемых условиях (рис. 3E), однако время нарастания (рис. 3F), время распада (рис. 3G) и CTD90 (рис. 3H) были значительно увеличены в больших размерах (10K- и 20K-CS) по сравнению с меньшими (2,5K- и 5K-CS). Взятые вместе, эти результаты показывают, что сфероиды, полученные из hiPSC-CM, оптимальны для скрининга обработки кальция, когда используется плотность посева от 10K- до 20K hiPSC-CMs / лунка.
Затем мы оценили влияние криоконсервации на жизнеспособность и функцию CS. Перед анализом размороженные КС выдерживали в культуре в течение 1 недели (рис. 4А). Как показали тесты на жизнеспособность клеток с помощью проточной цитометрии (рис. 4B) и кальцеина-AM (рис. 4C), криоконсервация не влияла на жизнеспособность клеток в CS. Кроме того, размороженные CS показали аналогичные уровни экспрессии саркомерных белков по сравнению со свежими CS того же возраста (рис. 4D). Эти данные указывают на то, что CS могут быть эффективно криоконсервированы для последующего анализа сердечной функции и высокопроизводительного скрининга.
Наконец, активность биения и обработка Ca2+ были измерены как в свежих, так и в криоконсервированных CS (рис. 5). Процент избиения КС измерялся в разные моменты времени после размораживания, соответственно, через 2, 5 и 7 дней. В то время как большинство свежих КС показали биение активности с течением времени, очевидно, что криоконсервированным КС потребовалось до 1 недели культивирования, чтобы восстановить свою бьющую активность (рис. 5B). Не было существенных изменений в скорости ударов размороженных CS по сравнению со свежими; однако в некоторых замороженных КС спонтанной биения не наблюдалось (рис. 5C). Несмотря на то, что пиковые значения были значительно снижены в замороженных/размороженных CS по сравнению со свежими (рис. 5D), не наблюдалось существенных изменений во времени нарастания, времени распада и CTD90 замороженных/размороженных CS по сравнению со свежими (рис. 5E-G). Эти данные указывают на то, что после размораживания важно дать CSs восстановиться в инкубаторе в течение как минимум 1 недели, прежде чем измерять активность биения и переходный процесс Ca2+.
Взятые вместе, эти результаты показывают, что криоконсервация сфероидов, полученных из hiPSC-CM, сохраняет жизнеспособность кардиомиоцитов, саркомерную структуру и их функциональные характеристики, такие как спонтанная биение и обработка кальция. Таким образом, сфероиды, полученные из hiPSC-CM, представляют собой подходящую модель для точного повторения электрофизиологии сердца in vitro.
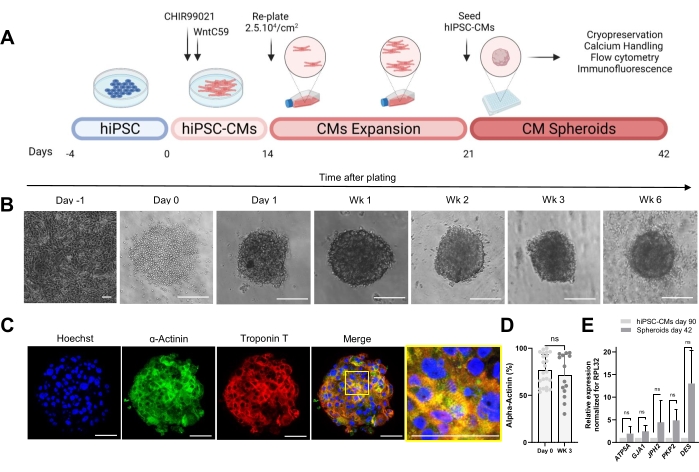
Рисунок 1: Генерация сердечных сфероидов . (A) Схематическое изображение направленной дифференцировки сердца на основе Wnt, последующего расширения hiPSC-CM и генерации CS. Создано с помощью biorender.com. (Б) Изображения светлого поля в разные моменты времени культивирования КС. Масштабная линейка, 200 мкм. Wk представляет собой неделю. (C) Репрезентативные иммунофлуоресцентные изображения сердечных саркомерных белков α-актинина и тропонина Т у КС 3-недельного возраста. Иммунофлуоресценция: Хёхст (синий), α-актинин (зеленый) и тропонин Т (красный). Масштабная линейка, 200 мкм. Увеличенное объединенное изображение справа отображает организацию саркомера. Масштабная линейка, 50 мкм. (D) Количественная оценка проточной цитометрии α-актинин-положительных клеток до (0-й день) и через 3 недели после образования CSs. (n = 14-23 на условие. (E) ОТ-кПЦР, проводимая на hiPSC-CM, культивируемых в течение 90 дней (2D), и образцах сфероидов, культивируемых в течение 42 дней, для установления уровней экспрессии различных сердечных генов, связанных с клеточными соединениями, промежуточными филаментами и митохондриями. (n = 1-3 партии). Данные представлены в виде среднего ± SD. NS (незначимый), рассчитанный с помощью непарного t-критерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
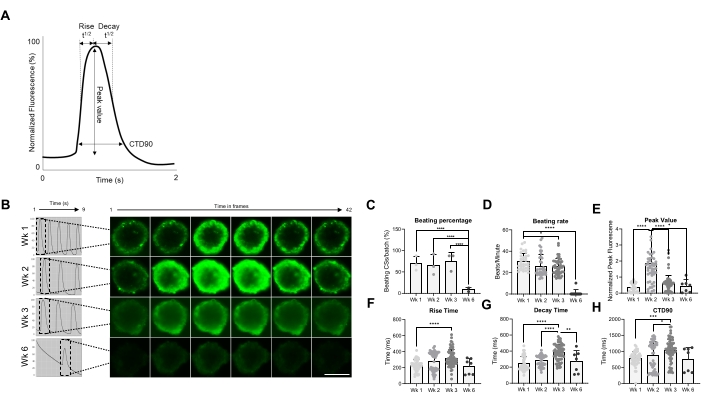
Рисунок 2: Скорость биения и обработка кальция в CS в разные недели после генерации. (A) Примеры переходных параметров кальция, рассчитанных алгоритмом анализа Vala sciences в Cyteseer Software. (B) Репрезентативные кальциевые переходные следы и покадровые изображения CS в разные моменты времени (недели) после генерации. Масштабная линейка, 200 мкм. (C) Количественная оценка спонтанной биения во времени выражается в процентах от бьения CS. (D) Скорость биения CS во время культивирования. (Е-Х) Количественная оценка переходных процессов кальция с указанием пикового значения, времени нарастания, времени распада и CTD90. Показанные данные являются средними ± SD. Биологические репликации = три, технические реплики = 38, 50, 66 и 7 соответственно. *p < 0,05, ****p < 0,001; односторонний ANOVA с последующим тестом Тьюки после нескольких сравнений. Сокращения; CTD = переходная продолжительность кальция, Wk = неделя, CSs = сердечные сфероиды человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
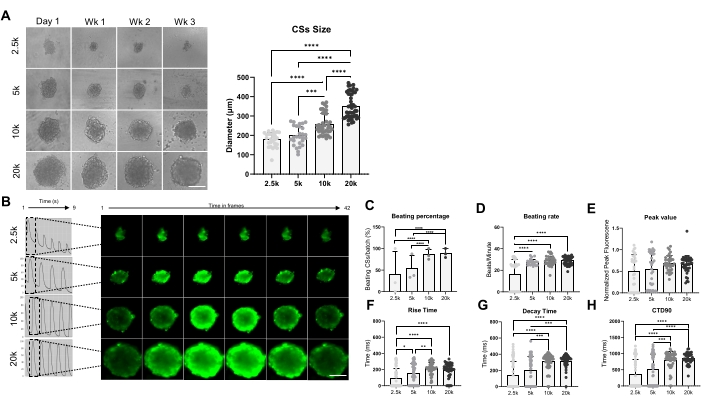
Рисунок 3: Скорость биения и обработка кальция в CS, полученных с использованием различных плотностей засева клеток. (A) Визуализация светлого поля (слева) и измерения размера (справа) CS, полученные с использованием различных чисел hiPSC-CM. Масштабная линейка, 200 мкм. (B) Репрезентативные кальциевые переходные следы и покадровые изображения 2,5K-20K-CS. (С,Д) Процент ударов и коэффициент ударов 2.5K-20K-CS. (Е-Х) Пиковое значение, время нарастания, время затухания и CTD90 в 2.5K-20K-CS. Данные являются средними ± SD. Биологические репликации = три, технические репликации = 28-39. *p < 0,05, ****p < 0,001; односторонний ANOVA с последующим тестом Тьюки после нескольких сравнений. Аббревиатуры: CTD = переходная продолжительность кальция, Wk = неделя, k = x 1,000 клеток, CSs = сердечные сфероиды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
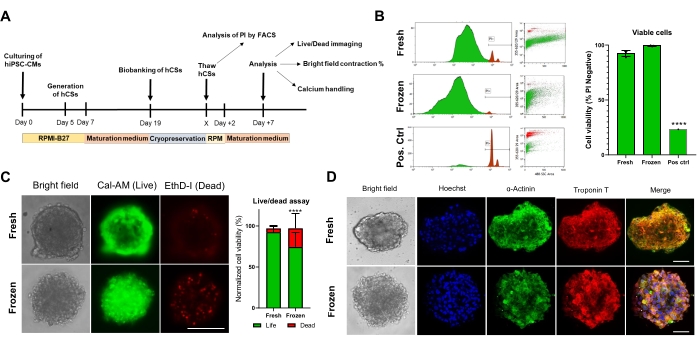
Рисунок 4. Влияние криоконсервации на жизнеспособность и структуру сердечных сфероидов. (A) Схематическое изображение генерации CS, последующего биобанкирования и размораживания. (B) Тест жизнеспособности клеток с помощью проточной цитометрии как в свежих, так и в криоконсервированных КС. В качестве положительного контроля использовали обработку 10% раствором Тритона-Х в течение 5 мин. (n = 4 на условие). Данные представлены в виде среднего ± SD. ** **p < 0,001; односторонний ANOVA с последующим тестом Тьюки после нескольких сравнений. (C) Тест на жизнеспособность клеток Calcein-AM в свежих и размороженных CS после 7 дней культивирования (n = 15-17 на условие, ** **p < 0,001, по парному t-критерию; масштабная линейка, 200 мкм). (D) Репрезентативное яркопольное (слева) и иммунофлуоресцентное окрашивание для экспрессии α-актинина и тропонина Т в свежих и размороженных CS. Иммунофлуоресценция: Hoechst (синий), α-актинин (зеленый) и тропонин T (красный). Объединенные изображения справа отображают бороздки саркомера в CS. Масштабная линейка, 50 мкм. Сокращения: X = день оттаивания по выбору, PI = йодид пропидия, Cal-AM = кальцеин-AM, EthD-I = гомодимер этидия I. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
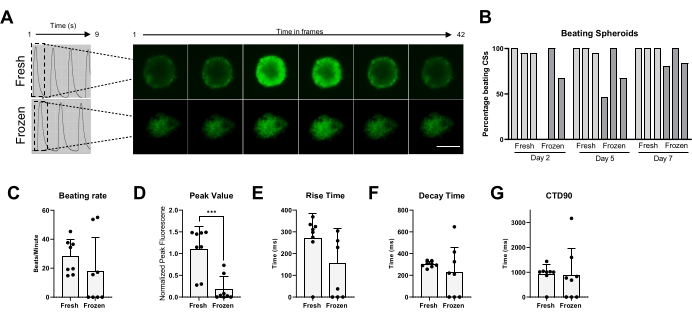
Рисунок 5: Переходные процессы кальция в свежих и размороженных CS. (A) Репрезентативные переходные следы кальция и покадровые изображения CS до криоконсервации и через 1 неделю после оттаивания. (B) Процент отбивания свежих и замороженных/размороженных сердечных сфероидов. Столбики представляют собой отдельные эксперименты. (C) Скорость биения свежих и замороженных/размороженных сердечных сфероидов. (Д-Г) Количественная оценка переходных параметров кальция: пиковое значение, время нарастания, время распада и CTD90. Данные являются средними ± SD. *p < 0,05, ****p < 0,001; односторонний ANOVA с последующим тестом Тьюки после нескольких сравнений. Сокращения; CTD = переходная продолжительность кальция, CSs = сердечные сфероиды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Репрезентативные стратегии стробирования для анализа проточной цитометрии. (A) Репрезентативная стратегия стробирования для α-актинин-положительных hiPSC-CM в чистой популяции по сравнению с отрицательным контролем и контролем изотипа. Количество α-актинин-положительных анализируемых клеток составляет 25 х 105. Сокращения; SSC = боковое рассеяние, PI+ = положительный йодид пропидия. (B) Репрезентативная стратегия стробирования для анализа жизнеспособности как в свежем, размороженном, положительном контроле (Triton-X), так и в отрицательном контроле (неокрашенном). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Открытие сердечных препаратов затруднено из-за зависимости от нечеловеческих животных и клеточных моделей с недостаточной пропускной способностью и физиологической точностью для точного выполнения показаний. Биология hiPSC-CM в сочетании с приборами HT и физиологическими зондами может повторно ввести человеческие модели на самые ранние стадии моделирования сердечных заболеваний и открытия лекарств. Мы разработали метод 3D-генерации сердечной ткани, который позволяет получать высококачественные и функциональные CS для оптимального моделирования сердечных заболеваний и платформы скрининга лекарств. Кроме того, сочетание сфероидной технологии в 3D-биореакторных системах для промышленного производства электромобилей позволяет сделать необходимый шаг к клиническому переводу терапии на основе электромобилей. Описанный здесь метод опирается на несколько решающих факторов и является вариантом существующих протоколов 9,10,28,29. Эти методы включают в себя: 1) генерацию 3D-тканевых конструкций, 2) оптимальное количество клеток и время перед скринингом, 3) повышение чувствительности и высокой пропускной способности инструментов и 4) возможность замораживания сфероидов перед любым функциональным анализом. В отличие от ранее описанных протоколов, предлагаемый протокол описывает генерацию до 1,500 сфероидов в день и пригодность для HTS. Обычный анализ ста соединений в дозах 6 x 0,5 log для 10 реплик с использованием существующих 96-луночных систем визуализации кальция или 24-луночных мультиплексированных инженерных тканей сердца требует от примерно 500 миллионов до 3 миллиардов hiPSC-CM31,32. Предлагаемое применение делает кардиологические скрининги менее дорогостоящими и эффективными по времени по сравнению с традиционными системами, поскольку для 96-луночных планшетов требуется только 10% плотности посева по сравнению с описанным методом. Кроме того, по сравнению с предыдущими протоколами, такими как метод подвешивания, генерация сфероидов путем самоагрегации в пластинах со сверхнизким креплением позволяет получать высококачественную автоматизированную визуализацию отдельных микротканей33.
Эта небольшая 3D-модель имитирует биологический и физиологический фенотип сердечно-сосудистой среды in vivo . Как было показано ранее, кальциевые переходные процессы резко увеличиваются в 3D-конструкциях сердечной ткани по сравнению с 2D-монослойными клеточными культурами34.
Затем мы обнаружили, что плотность посева и правильное время культивирования также являются критическими факторами для успешного скрининга CS. Плотность 10K-20K hiPSC-CM на сфероид и скрининг между 2-3 неделями после генерации были оптимальными, тогда как слишком маленькие или слишком старые сфероиды демонстрируют нарушенную обработку кальция (рис. 2 и рис. 3). Поэтому важно поддерживать как можно более постоянную плотность посева, поскольку размер влияет на функциональные параметры. Кроме того, хотя этот оптический метод обеспечивает хорошие результаты для живых 3D-культур как целой ткани, получение данных в более крупных сфероидах на (суб)клеточном уровне является сложной задачей, не полагаясь на трудоемкие методы гистологии. В последнее время было опубликовано несколько подходов, в которых используется «оптическая очистка», которая позволяет получать целые 3D-сфероиды с возможностью количественного определения маркеров в одной клетке. Здесь мы адаптировали 3-дневный протокол сбора CS к анализу изображений, который оптимизирован для 3D-визуализации с использованием конфокальной микроскопии29 (рис. 1C и рис. 4D).
Наконец, с увеличением числа 3D-приложений сердечной ткани и коммерческих применений растет спрос на долгосрочное хранение и биобанкинг для конкретных пациентов от различных доноров. Криоконсервация является эффективной стратегией создания HTS-планшетов из нескольких партий с течением времени. Замораживание hiPSC-CM было описано ранее и не отличается от других культивируемых типов клеток 10,35,36. Недавно были описаны подходы к замораживанию пластин с 2D-ячейками37. Здесь мы обнаружили, что набор для криоконсервации PSC является наиболее оптимальным состоянием по сравнению с тремя другими (данные не показаны), и использовали эту среду для эффективного замораживания сфероидов. После криоконсервации жизнеспособность остается высокой (рис. 4B, C), но это влияет на электрофизиологические свойства CS, и требуется период инкубации после размораживания. Действительно, через 1 неделю после размораживания CS проявляли спонтанную биение и обработку кальция. Однако было описано, что свежие и восстановленные hiPSC-CM не всегда проявляют идентичные молекулярные и физиологические свойства38. Это ограничение необходимо учитывать, когда криоконсервированные hiPSC-CM используются для оценки индуцированных лекарством сердечных показаний. Более того, хотя мы эффективно модулируем количество клеток на сфероид и оптимальное время переходной визуализации кальция, сердечные сфероиды могут быть улучшены путем смешивания кардиомиоцитарных клеток, полученных из hiPSC, с эндотелиальными клетками, фибробластами, клеточно-клеточными соединениями и внеклеточными матрицами, такими как хитозан, коллаген IV, фибронектин, матригель или ламинин, имитируя сердечную среду in vivo 39, 40. В целом, мы предлагаем пошаговый протокол для эффективного создания CS, которые подходят для последующих приложений, таких как моделирование заболеваний и скрининг лекарств HT.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Мы хотели бы поблагодарить VALA sciences за программный пакет Cyteseer и оптимизацию автоматизированного 3D-анализа кальция. Мы хотели бы выразить признательность за грантовую поддержку от Фонда PLN (RM). P.A.D. и F.S. поддерживаются CUREPLaN Leducq. J.P.G.S. поддерживается H2020-EVICARE (#725229) Европейского исследовательского совета (ERC). J.W.B. поддерживается клинической стипендией UMC в Утрехте, стипендией Нидерландского института сердца и грантом для молодых талантов CVON-Dosis; Нидерландский фонд сердца (CVON-Dosis 2014-40). N.C. поддерживается гравитационной программой «Регенерация, управляемая материалами» Нидерландской организации научных исследований (RegmedXB #024.003.013) и Действиями Марии Склодовской-Кюри (грантовое соглашение RESCUE #801540). В.С.-. поддерживается Фондом Альянса (UMCU, UU, TU/e). A.v.M. поддерживается финансируемым ЕС проектом BRAVE (H2020, ID:874827)
Материалы
| Name | Company | Catalog Number | Comments |
| 24 wells suspenion plate | Corning | 3738 | |
| 96 wells Ultra-Low Attachment Multiple Well Plate | Corning | CLS3474-24EA | |
| Albumax | Thermo Fisher Scientific | 11020021 | |
| Anti-α-Actinin (Sarcomeric) antibody | Sigma-Aldrich | A7811 | Dilution: 1:200 |
| Anti-Cardiac Troponin T antibody (ab45932) | Abcam | ab45932 | Dilution: 1:200 |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| B-27 supplement | Thermo Fisher Scientific | 17504-044 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Bovine serum albumin fraction V (BSA) | Roche | 10735086001 | |
| Cal-520, AM | Abcam | ab171868 | |
| Confocal microscope | Leica | DMi8 | |
| Confocal microscope software | Leica | Las X | |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Creatine monohydrate | Sigma-Aldrich | C3630 | |
| DAPI | Thermo Fisher Scientific | D3571 | Concentration: 1 µg/mL |
| DMEM no glucose | Thermo Fisher Scientific | 11966025 | |
| EDTA | Thermo Fisher Scientific | 15575020 | |
| Fructose | Sigma-Aldrich | 76050771.05 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glycerol | Boom | 76050771.05 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11029 | Dilution: 1:500 |
| Goat anti-rabbit Alexa Fluor 568 | Invitrogen | A11011 | Dilution: 1:500 |
| Horizontal shaker | IKA | 4003000 | |
| Human induced pluripotent stem cell lines | (Stanford Cardiovascular Institute (S-CVI) Biobank) | CVI-273 (control 1) | |
| Human induced pluripotent stem cell lines | Germany | 141 (control 2) 144 (control 3) | |
| Hydrochloric acid (HCl) | Ajax Firechem | 265.2.5L-PL | 10 M stock solution, corrosive |
| Isotype control, FITC mouse IgM κ isotype | BD | 556652 | |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828 | Protect from light |
| L-carnitine | Sigma-Aldrich | C0283 | |
| Myocyte calcium and contractility system | Leica | Thunder, DMi8 | |
| Non essential amino acids (NEAA) | Thermo Fisher Scientific | 11140 | |
| Paraformaldehyde solution 4% in 1x PBS, pH 7.0–7.6 | Santa Cruz | SC281692 | Hazardous |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010023 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140 | |
| PES Membrane Vacuum Filter system | Corning | 431097 | |
| PI/RNase Staining Solution | Invitrogen | F10797 | Dilution: 1:1000 |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| PSC Cryopreservation Kit | Thermo Fisher Scientific | A2644601 | |
| RevitaCell | Thermo Fisher Scientific | A2644501 | |
| RPMI 1640 medium | Thermo Fisher Scientific | 11875 | |
| Silicone Elastomer Kit | SYLGARD | 184 | |
| Sodium dodecyl sulfate solution (10%) | Sigma-Aldrich | 71736 | |
| Sodium L-Lactate | Sigma-Aldrich | 71718 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Tris Fisher | Scientific | 11486631 | |
| Triton X-100 | Merck | X100-1L | Hazardous |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Fisher Scientific | A1217701 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Urea | Sigma-Aldrich | 51456 | |
| Vitamin B12 | Sigma-Aldrich | V6629 | |
| Y-27632 dihydrochloride (Rho-kinase inhibitor) | Tocris | 1254 | Protect from light |
Ссылки
- Burridge, P. W., et al. Chemically defined and small molecule-based generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell. 8 (2), 228-240 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences. 109 (27), 1848-1857 (2012).
- Paige, S. L., et al. Endogenous Wnt/beta-catenin signaling is required for cardiac differentiation in human embryonic stem cells. PLoS One. 5 (6), 11134 (2010).
- Gintant, G., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes in preclinical cancer drug cardiotoxicity testing: A scientific statement from the American Heart Association. Circulation Research. 125 (10), 75-92 (2019).
- Ahmed, R. E., et al. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 19 (8), 178 (2020).
- Liu, C., et al. Generating 3D human cardiac constructs from pluripotent stem cells. EBioMedicine. 76, 103813 (2022).
- Musunuru, K., et al. Induced pluripotent stem cells for cardiovascular disease modeling and precision medicine: A scientific statement from the American Heart Association. Circulation: Genomic and Precision Medicine. 11 (1), 000043 (2018).
- Buikema, J. W., et al. Wnt activation and reduced cell-cell contact synergistically induce massive expansion of functional human iPSC-derived cardiomyocytes. Cell Stem Cell. 27 (1), 50-63 (2020).
- Maas, R. G. C., et al. Massive expansion and cryopreservation of functional human induced pluripotent stem cell-derived cardiomyocytes. Cell STAR Protocols. 2 (1), 100334 (2021).
- Tremblay, C., et al. A new construction technique for tissue-engineered heart valves using the self-assembly method. Tissue Engineering Part C: Methods. 20 (11), 905-915 (2014).
- Lewis-Israeli, Y. R., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12 (1), 5142 (2021).
- Goldfracht, I., et al. Engineered heart tissue models from hiPSC-derived cardiomyocytes and cardiac ECM for disease modeling and drug testing applications. Acta Biomaterialia. 1 (92), 145-159 (2019).
- Fleischer, S., et al. Comprehensive human stem cell differentiation in a 2D and 3D mode to cardiomyocytes for long-term cultivation and multiparametric monitoring on a multimodal microelectrode array setup. Biosensors and Bioelectronics. 126, 624-631 (2019).
- Branco, M. A., et al. Transcriptomic analysis of 3D cardiac differentiation of human induced pluripotent stem cells reveals faster cardiomyocyte maturation compared to 2D culture. Science Reports. 9 (1), 9229 (2019).
- Ergir, E., et al. Generation and maturation of human iPSC-derived cardiac organoids in long term culture. bioRxiv. , (2022).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scienctific Reports. 7 (1), 5464 (2017).
- Kofron, C. M., et al. A predictive in vitro risk assessment platform for pro-arrhythmic toxicity using human 3D cardiac microtissues. Science Reports. 11 (1), 10228 (2021).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Tenreiro, M. F., et al. Next generation of heart regenerative therapies: progress and promise of cardiac tissue engineering. npj Regenerative Medicine. 6 (1), 30 (2021).
- Hansen, A., et al. Development of a drug screening platform based on engineered heart tissue. Circulation Research. 107 (1), 35-44 (2010).
- McDermott-Roe, C., et al. Investigation of a dilated cardiomyopathy-associated variant in BAG3 using genome-edited iPSC-derived cardiomyocytes. Journal of Clinical Investigation Insight. 4 (22), 128799 (2019).
- National Library of Medicine (U.S.). Safety and efficacy of induced pluripotent stem cell-derived engineered human myocardium as biological ventricular assist tissue in terminal heart failure. National Library of Medicine. , (2020).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Oh, J. G., et al. Generation of ventricular-like HiPSC-derived cardiomyocytes and high-quality cell preparations for calcium handling characterization. Journal of Visualized Experiments. 155, 60135 (2020).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Feyen, D. A. M., et al. Metabolic maturation media improve physiological function of human iPSC-derived cardiomyocytes. Cell Reports. 32 (3), 107925 (2020).
- van Ineveld, R. L., et al. Single-cell resolution three-dimensional imaging of intact organoids. Journal of Visualized Experiments. (160), e60709 (2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: New phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Ding, B., et al. Three-dimensional renal organoids from whole kidney cells: Generation, optimization, and potential application in nephrotoxicology in vitro. Cell Transplantation. 29, 963689719897066 (2020).
- Denning, C., et al. Cardiomyocytes from human pluripotent stem cells: From laboratory curiosity to industrial biomedical platform. Biochimica Biophysica Acta. 1863, 1728-1748 (2016).
- Amaral, R. L. F., et al. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Daily, N. J., et al. Improving cardiac action potential measurements: 2D and 3D cell culture. Journal of Bioengineering and Biomedical Science. 5 (3), 168 (2015).
- Preininger, M. K., et al. Cryopreservation of human pluripotent stem cell-derived cardiomyocytes: Strategies, challenges, and future directions. Advances in Experimental Medicine and Biology. 951, 123-135 (2016).
- Kim, Y. Y., et al. Cryopreservation of human embryonic stem cells derived-cardiomyocytes induced by BMP2 in serum-free condition. Reproductive Science. 18 (3), 252-360 (2011).
- Daily, M. I., et al. Cryopreservation of primary cultures of mammalian somatic cells in 96-well plates benefits from control of ice nucleation. Cryobiology. 93, 62-69 (2020).
- Zhang, J. Z., et al. Effects of cryopreservation on human induced pluripotent stem cell-derived cardiomyocytes for assessing drug safety response profiles. Stem Cell Reports. 16 (1), 168-181 (2021).
- Yeh, H. -. Y., et al. The calcium-dependent regulation of spheroid formation and cardiomyogenic differentiation for MSCs on chitosan membranes. Biomaterials. 33 (35), 8943-8954 (2012).
- Scalise, M., et al. From spheroids to organoids: The next generation of model systems of human cardiac regeneration in a dish. International Journal of Molecular Sciences. 22 (24), 13180 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены