Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Проектирование биореактора для улучшения сбора данных и моделирования пропускной способности инженерных тканей сердца
В этой статье
Erratum Notice
Резюме
Трехмерные сердечные ткани, биоинженерные с использованием кардиомиоцитов, полученных из стволовых клеток, стали многообещающими моделями для изучения здорового и больного миокарда человека in vitro , повторяя ключевые аспекты нативной сердечной ниши. В данной статье описывается протокол изготовления и анализа высокосодержательных инженерных тканей сердца, полученных из индуцированных плюрипотентных кардиомиоцитов, полученных из стволовых клеток человека.
Аннотация
Сердечная недостаточность остается основной причиной смерти во всем мире, что создает острую потребность в более совершенных доклинических моделях человеческого сердца. Тканевая инженерия имеет решающее значение для фундаментальных научных исследований в области сердца; Культура клеток человека in vitro устраняет межвидовые различия животных моделей, в то время как более тканеподобная 3D-среда (например, с внеклеточным матриксом и гетероцеллюлярным сопряжением) моделирует условия in vivo в большей степени, чем традиционная двумерная культура на пластиковых чашках Петри. Однако для каждой модельной системы требуется специализированное оборудование, например, специально разработанные биореакторы и устройства функциональной оценки. Кроме того, эти протоколы часто являются сложными, трудоемкими и страдают от отказа маленьких, нежных тканей.
В данной работе описывается процесс создания надежной системы моделирования инженерной ткани сердца человека (hECT) с использованием индуцированных плюрипотентных кардиомиоцитов, полученных из стволовых клеток, для лонгитюдного измерения функции тканей. Шесть hECT с линейной геометрией полосы культивируются параллельно, при этом каждый hECT подвешивается к паре чувствительных к силе стойкам из полидиметилсилоксана (PDMS), прикрепленных к стойкам PDMS. Каждый пост увенчан черным трекером стабильных постов PDMS (SPoT), новой функцией, которая повышает простоту использования, пропускную способность, удержание тканей и качество данных. Форма позволяет надежно оптически отслеживать прогибы столбов, обеспечивая улучшенную трассировку силы подергивания с абсолютным активным и пассивным натяжением. Геометрия колпачка исключает разрушение тканей из-за соскальзывания hECT со стоек, а поскольку они включают в себя второй этап после изготовления стойки PDMS, SPoT могут быть добавлены к существующим конструкциям на основе стоек PDMS без существенных изменений в процессе изготовления биореактора.
Система используется для демонстрации важности измерения функции hECT при физиологических температурах и показывает стабильную функцию тканей во время сбора данных. Таким образом, мы описываем современную модельную систему, которая воспроизводит ключевые физиологические условия для повышения биоточности, эффективности и строгости инженерных сердечных тканей для применения in vitro .
Введение
Инженерные модели сердечной ткани имеют различную геометрию и конфигурацию для повторения различных аспектов нативной сердечной ниши, которые трудно получить с помощью традиционной двумерной клеточной культуры. Одной из наиболее распространенных конфигураций является линейная тканевая полоса с гибкими анкерами на каждом конце, чтобы вызвать самосборку ткани и обеспечить ткани определенный предварительный натяг и считывание результирующих сил подергивания 1,2,3,4,5,6,7,8,9,10,11, 12,13,14,15,16,17,18,19,20,21
,22,23,24,25,26,27. Создаваемая сила может быть надежно определена с помощью оптического отслеживания укорочения ткани и использования теории упругих пучков для расчета силы на основе измеренных прогибов и постоянной пружины анкеров 1,2,3,4,5,6,7,8,9,10,11, 12,13,14,15,16,17,18,19,20,
21,22,25,26,28.
Тем не менее, инженерия сердечных тканей все еще является развивающейся областью, и некоторые проблемы остаются. Для каждой модели системы 10,29,30,31 требуется специализированное оборудование, такое как биореакторы, изготовленные по индивидуальному заказу и устройства функциональной оценки. Размер и сложность микроокружения этих конструкций часто ограничены низкой пропускной способностью из-за трудоемких протоколов, большого количества клеток и хрупкости тканей. Чтобы решить эту проблему, некоторые группы обратились к изготовлению микротканей, содержащих только сотни или тысячи клеток, чтобы облегчить высокопроизводительные анализы, которые полезны для разработки лекарств. Однако эта уменьшенная шкала усложняет точную оценку функции12, устраняет ключевые аспекты нативной сердечной ниши (такие как градиенты диффузии питательных веществ/кислорода и сложная архитектура36) и ограничивает количество материала, доступного для последующего молекулярного и структурного анализа (часто требующего объединения тканей). В таблице 1 обобщены некоторые конфигурации линейных моделей тканевых полос в литературе 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15, 16,17,18,19,20,
21,22,23,24,25,26,37,38,39,40.
| Группа | Количество клеток в ткани | Количество салфеток в пластине | Формат пластины | Функция привязки | Функциональный метод сбора данных | Общая медиа-ванна? | Функциональная мера- В то же время, если вы не знаете, как это сделать, вы можете | ||||
| Йошида (ECT)38 | 4 миллиона | 6 | модифицированная 6-луночная пластина* | Преобразователь силы | Прямое измерение силы | Нет | Нет | ||||
| Чан (чЭСК-КМ-ЭСТ)26 | 310 К | 6 | Изготовленная на заказ тарелка с 6 лунками | Посты PDMS | Прямое измерение силы | да | Нет | ||||
| Файнберг (dyn-EHT)16 | 1,5 млн чел. | 6 | Изготовленная на заказ тарелка с 6 лунками | Провод PDMS | Форма ткани | Нет | да | ||||
| РАДИСИК (BioWire)39, 40 | 110 К | 8 | полимерная проволока | Форма проволоки | да | да | |||||
| Коста (однократная чЭСТ)1, 2 | 1-2млн | 4** | Чашка Петри 10 см** | Посты PDMS | Оптическое отклонение (слежение за краем/объектом) | да | да | ||||
| Коста (мульти-чЭСТ)3–9 | 500 К-1 миллион | 6 | Чашка Петри 6 см | Посты PDMS | Оптическое отклонение (слежение за краем/объектом) | да | да | ||||
| Коста (мульти-ЭСТ с СПоТ) | 1 миллион | 6 | Чашка Петри 6 см | Столбы PDMS с черными шапками | оптическое отклонение (слежение за объектом) | да | да | ||||
| Passier (EHT)17 | 245 К | 36 | 12-луночная пластина | Столбы PDMS с черными шапками | оптическое отклонение (слежение за объектом) | да | да | ||||
| Вуньяк-Новакович13, 18 | 1 миллион | 12 | Чашка Петри 6 см | Столбы PDMS с заглушками | оптическое отклонение (обнаружение края) | да | да | ||||
| Вуньяк-Новакович (MilliPillar)14 | 550 К | 6 | Изготовленная на заказ тарелка с 6 лунками | Столбы PDMS с заглушками | оптическое отклонение (слежение за объектом); Визуализация кальция | Нет | да | ||||
| Эшенхаген (EHT)10, 19–21 | 1 миллион | 12 | 12-луночная пластина | Столбы PDMS с заглушками | оптическое отклонение (определение края постпрогиба); Визуализация кальция | Нет | да | ||||
| Зандстра (CaMiRi)22 | 25-150 К | 96 | 96-луночная пластина | Посты PDMS с хуками | оптическое отклонение (обнаружение края) | Нет | да | ||||
| Марри23, 24 | 900 К | 24 | 24-луночный планшет | Стойки PDMS с заглушками, встроенный магнит | Магнитный датчик | Нет | да | ||||
| Рейх (мкТУГ)11, 12, 25 | неопределенный | 156 | Блюдо на 156 лунок | Стойки PDMS с заглушками, встроенный магнит | оптическое слежение (флуоресцентный шарик) | да | да | ||||
Таблица 1: Характеристики некоторых линейно-инженерных моделей сердечной ткани в литературе. Линейно-инженерные модели сердечной ткани различаются по размеру, пропускной способности, конструкции элементов закрепления и облегчению использования ванн с общей средой, а также по требованиям к отдельной системе мышечных ванн для функциональной характеристики. * Исследователи использовали коммерчески доступную инженерную тканевую систему, основанную на размерах стандартной 6-луночной пластины. ** Модульная система, в которой однотканевые биореакторы крепятся к любой пластиковой чашке для культур в нужном количестве и месте.
В этой статье описывается новейший протокол для создания нашей установленной модели линейной инженерной сердечной ткани человека (hECT)1,2,3,4,5,6,7,8,9,15,27 методы оценки сократительной функции hECT. Каждый многотканевой биореактор вмещает до шести hECT в общей ванне среды и состоит из двух «стоек» из силиконового эластомера полидиметилсилоксана (PDMS), установленного на жесткой раме из полисульфона. Каждая стойка PDMS содержит шесть гибких интегрированных стоек с датчиком силы диаметром 0,5 мм и длиной 3,25 мм, а вместе две стойки обеспечивают шесть пар стоек, каждая из которых вмещает один hECT. Инверсия биореактора помогает преодолеть любые препятствия для визуализации hECT снизу из-за конденсации воды из питательной среды или искажений от мениска границы раздела воздух-жидкость. Каждое сжатие hECT вызывает отклонение встроенных концевых стоек, и оптическое измерение сигнала отклонения обрабатывается в трассировку зависимости силы от времени, представляющую сократительную функцию hECT 1,2,3,4,5,6,7,8,9,15,27 . По сравнению с однотканевыми биореакторами, обычно используемыми для тканей такого размера, многотканевая конструкция повышает производительность эксперимента и позволяет изучать паракринную передачу сигналов между соседними тканями потенциально различного клеточного состава. Эта система была подтверждена в опубликованных исследованиях, описывающих применение в моделировании заболеваний 4,8, паракринной сигнализации 6,7, гетероклеточной культуре 5,9 и терапевтическом скрининге 7,9.
В этой системе hECT имеют длину около 6 мм и диаметр 0,5 мм, что обеспечивает надежное оптическое отслеживание измерений силы с низким уровнем шума. Кроме того, аспекты сложности тканей, такие как градиенты диффузии и клеточная организация, уравновешиваются управляемой потребностью в 1 миллион клеток на ткань. При использовании стандартной технологии ПЗС-камеры силы до 1 мкН (что соответствует менее 5 мкм после отклонения) генерируют четкий сигнал, гарантируя, что даже очень слабая сократительная функция, наблюдаемая в некоторых моделях заболевания hECT, может быть точно измерена. Это также облегчает детальный анализ кривой силы подергивания, что позволяет проводить анализ с высоким содержанием до 16 показателей сократимости41, включая развиваемую силу, скорости сокращения (+dF/dt) и расслабления (−dF/dt), а также вариабельность частоты биений.
Этот протокол начинается с инструкций по изготовлению компонентов биореактора. Особое внимание уделяется шагам по максимизации выхода hECT, снижению технической вариабельности функции тканей и оптимизации качества и глубины оценки тканей. В большинстве исследований в области инженерии сердечной ткани не сообщается о темпах потери тканей во время изготовления и долгосрочного тестирования, хотя это хорошо известная проблема в этой области и снижает пропускную способность иэффективность исследований. Методы тканевой инженерии, описанные здесь, совершенствовались на протяжении многих лет, чтобы обеспечить удержание всех hECT в большинстве биореакторов (независимо от того, как изготовлены стойки PDMS). Тем не менее, даже потеря 5-20% тканей может существенно повлиять на статистическую мощность, особенно в небольших экспериментах, ограниченных количеством доступных кардиомиоцитов (например, из-за проблем с дифференцировкой с некоторыми больными клеточнымилиниями или из-за высокой стоимости коммерчески закупаемых кардиомиоцитов) или условиями лечения (например, ограниченная доступность или высокая стоимость различных лекарственных препаратов).
В этом протоколе описывается изготовление стабильных пост-трекеров (SPoT), новой функции стоек PDMS, которые функционируют как колпачки на концах постов с датчиком силы, на которых размещаются hECT27. Показано, как геометрия колпачка значительно снижает потери hECT при падении или отрыве от стоек, тем самым открывая новые возможности для культивирования hECT с большим разнообразием жесткостей и напряжений, которые сложно культивировать на незакрытых стойках. Кроме того, SPoT обеспечивают высококонтрастный объект для улучшения оптического отслеживания сокращения hECT за счет последовательной и четко определенной формы27. Далее следует описание культивирования индуцированных плюрипотентных стволовых клеток человека (ИПСК) и дифференцировки кардиомиоцитов на основе ранее опубликованных протоколов 3,42,43, а также объяснение производства, культивирования и функциональных измерений hECT.
В этой статье также рассматривается необходимость измерения функции тканей при физиологической температуре. В миокарде человека (как плода, так и взрослых здоровых и больных тканей), а также в сердечной ткани широкого спектра видов животных (включая крыс, кошек, мышей, хорьков и кроликов)44,45 наблюдается заметное увеличение частотно-согласованной силы подергивания при температурах 28–32 °C по сравнению с физиологической температурой — явление, известное как гипотермическая инотропия45, 46. См. Тем не менее, влияние температуры на функцию искусственной ткани миокарда остается недостаточно изученным. Многие современные модели сердечной ткани, представленные в литературе, предназначены для функциональной оценки при 37 °C, чтобы приблизиться к физиологическим условиям 13,14,37. Однако, насколько нам известно, температурно-зависимое влияние на силу, генерируемую инженерными тканями сердца, систематически не исследовалось. В этом протоколе описывается конструкция электрода с движущейся частотой, которая сводит к минимуму потери тепла во время испытаний, а также позволяет включить изолированный нагревательный элемент в установку для функциональных измерений, который может поддерживать hECT при физиологической температуре без ущерба для стерильности27. Затем мы сообщаем о некоторых наблюдаемых эффектах температуры на функцию hECT, в том числе на развиваемую силу, частоту спонтанного биения, +dF/dt и −dF/dt. В целом, в этой статье представлены детали, необходимые для производства этой многотканевой силочувствительной биореакторной системы для изготовления инженерных тканей сердца человека и оценки их сократительной функции, а также представлен набор данных, обеспечивающих основу для сравнения измерений при комнатной температуре и при 37 °C27.
протокол
В этом протоколе использовалась обезличенная линия ИПСК SkiPS 31.3 (первоначально перепрограммированная с использованием дермальных фибробластов здорового 45-летнего мужчины)47 и, таким образом, он был освобожден от специального одобрения Институционального наблюдательного совета, в соответствии с руководящими принципами комитета по этике исследований на людях. Выполняйте все манипуляции с клетками и hECT в асептических условиях в шкафу биологической безопасности класса II с фильтрацией HEPA или на рабочем столе с ламинарным потоком. Стерилизуйте все нестерильные растворы путем фильтрации через фильтр 0,22 мкм и поддерживайте все клетки и hECT в инкубаторе при температуре 37 °C, относительной влажности 95% и 5%CO2.
1. Изготовление биореактора
- Компоненты биореакторов и изготовление алюминиевых отливок
ПРИМЕЧАНИЕ: Файлы систем автоматизированного проектирования (САПР) приведены в Дополнительном файле 1. Протокол может быть приостановлен в любом месте между этими шагами. Рекомендуется нанять профессионального механика для изготовления основных пресс-форм, описанных в этом разделе, так как для точной геометрии стойки и для правильной запрессовки рам из полисульфона к платным пластинам из политетрафторэтилена (ПТФЭ) (с целью обеспечения плотного прилегания к трению, но не слишком плотного) требуются высокие допуски (≤5 мкм) и гладкая поверхность.- С помощью фрезерного станка с числовым программным управлением (ЧПУ) обработайте опорную плиту из ПТФЭ в соответствии со схемами на рисунке 1A. В шести равномерно расположенных лунках (белые стрелки) будут сформированы hECT.
- С помощью фрезерного станка с ЧПУ обработайте штамп из алюминия из полидиметилсилоксана (PDMS) в соответствии со схемами на рисунке 1B, с тремя опорами рамы (зеленые звездочки). Просверлите шесть равномерно расположенных отверстий (пурпурные наконечники стрел) диаметром 0,5 мм для создания стоек PDMS.
- С помощью фрезерного станка с ЧПУ изготовьте каркас биореактора из полисульфона в соответствии со схемами на рисунке 1C. Опоры рамы (зеленые звездочки) соответствуют опорам рамы, видимым на отливке стойки (Рисунок 1B, зеленые звездочки).
- С помощью фрезерного станка с ЧПУ обработайте алюминиевый литой держатель из алюминия в соответствии со схемами на рисунке 1D. Каждая прорезь содержит треугольную полку (оранжевый треугольник) высотой 0,25 мм, чтобы обеспечить мертвое пространство для протекания PDMS через отверстия в отливках стойки PDMS (рис. 1B, пурпурные стрелки).
- Отливка стойки ПДМС из алюминиевых негативных мастеров
- С помощью 3D-принтера для моделирования методом наплавления термопластов напечатайте два кронштейна для реечного литья PDMS (Дополнительный файл 1). Используйте следующие настройки печати: высота слоя 0,1 мм, толщина стенки/дна/верха 1 мм, плотность заполнения 90% с треугольниками, температура печати 230 °C, температура рабочей формы 70 °C и края для адгезии.
- Поместите четыре алюминиевых отрицательных эталонных отливки в литой держатель (Рисунок 2AI) так, чтобы отверстия для стоек совпали с мертвым пространством напротив треугольных полок (см. Рисунок 1D). Оберните аппарат прямоугольным куском силиконовой пленки толщиной 0,5 мм (рис. 2Б, белые стрелки) в качестве прокладки для предотвращения утечки жидкого PDMS и зажмите его между двумя параллельными кронштейнами, напечатанными на 3D-принтере, с помощью винтового зажима.
- Добавьте 0,5 мл отвердителя PDMS к 5 мл эластомерной основы PDMS (соотношение 1:10, в соответствии с инструкциями производителя) в неглубоком контейнере и энергично перемешивайте в течение 5 минут. Дегазируют смесь PDMS в вакуумной камере и применяют сильный вакуум (0,1-1 кПа) в течение 20-60 минут при комнатной температуре или до исчезновения пузырьков.
- Залейте смесь PDMS на литейный аппарат, переполняя, чтобы обеспечить полное покрытие каждой щели (Рисунок 2AII). При необходимости добавьте маленькие цветные стеклянные шарики на корпус стоек PDMS (Рисунок 2AII), противоположный стороне со стойками (Рисунок 2B), для уникальной идентификации каждой стойки PDMS. Верните литейный аппарат в вакуумную камеру (убедившись, что он горизонтально выровнен) и создайте сильный вакуум не менее чем на 12 часов. Дайте PDMS отверждаться при комнатной температуре в течение примерно 48 часов вдали от пыли, чтобы обеспечить полное отверждение и максимальную прочность деликатных штифтов. Избегайте использования духового шкафа, так как это деформирует компоненты, напечатанные на 3D-принтере.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь.
- Снятие стойки PDMS с алюминиевых отрицательных мастер-отливок
- Снимите зажим, кронштейны и силиконовую пленку с литейного аппарата. С помощью бритвенного лезвия из нержавеющей стали обрежьте пленку PDMS поверх литейного аппарата и опор рамы и осторожно пальцами отделите стойки PDMS от боковых сторон литого держателя. Вставьте затупленное лезвие бритвы из нержавеющей стали в мертвое пространство между гипсом и литым держателем и подденьте их (рис. 2CI, II), убедившись, что PDMS, заполняющий мертвое пространство, остается с литым держателем (так как он прикреплен к стойкам). Острым лезвием из нержавеющей стали отрежьте оставшиеся пленки PDMS и срежьте PDMS с кончиков стоек с мертвым пространством (рис. 2C III-V).
- КРИТИЧЕСКИЙ ШАГ: Освободите стойку PDMS от слепка (рис. 2D). Начиная со стороны, противоположной стойкам, пальцами медленно отделяйте стойку PDMS от гипса, работая с поочередными сторонами, пока стойки не освободятся от мастер-забросов.
- Повторяйте предыдущий шаг до тех пор, пока не будут освобождены все стойки PDMS и все столбы. Используйте острое бритвенное лезвие, чтобы удалить оставшиеся излишки PDMS со стоек. В результате получилась стойка PDMS (рис. 2E) с шестью неповрежденными стойками (оранжевые наконечники стрелок) и цветными бусинами (синяя стрелка) для идентификации.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь.
- Изготовление стабильного трекера постов (SPoT)
- С помощью 3D-принтера для моделирования методом наплавления термопластов распечатайте компоненты литейного аппарата SPoT (Дополнительный файл 2 и Рисунок 3AI, II). Используйте следующие настройки печати: высота слоя 0,1 мм, толщина стенки/дна/верха 1 мм, плотность заполнения 80% с треугольниками, температура печати 230 °C, температура рабочей пластины 70 °C и край для адгезии.
- Обеспечьте надежную посадку между напечатанными на 3D-принтере деталями, а также между стойками PDMS и трехзубым зажимом, и убедитесь, что стойки PDMS плотно прилегают к стойкам, достигающим дна колодцев, не сгибаясь. При необходимости обрежьте/подпилите пластик.
- Добавьте 0,5 мл черного PDMS часть A к 0,5 мл части B (соотношение 1:1, в соответствии с инструкциями производителя) в небольшую весовую лодку (или аналогичную маленькую неглубокую емкость) и тщательно перемешайте до однородного цвета. Дегазируют смешанную черную ПДМС в вакуумной камере под сильным вакуумом в течение 20 мин. Вылейте дегазированный черный PDMS на 3D-печатную основу, чтобы заполнить отверстия, и постучите, чтобы убедиться, что не осталось пузырьков. Соскребите как можно больше лишних PDMS с основания.
- Защелкните трехзубую деталь на основании и поместите стойки PDMS в пазы на трехзубом приспособлении (рис. 3AII, бирюзовый прямоугольник), убедившись, что концы стоек погружаются в черные PDMS в круглых лунках (рис. 3B, C). Высушить черный PDMS при комнатной температуре и в защищенном от пыли месте в течение 48 часов.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь. - Выдвиньте трехзубчатую деталь, минимизировав натяжение на стойках. Используйте маленькие щипцы, чтобы соскрести тонкую пленку черного PDMS, которая окружает каждый SPoT; затем вставьте изогнутые щипцы с тонким наконечником в углубление SPoT, чтобы освободить его от основы, напечатанной на 3D-принтере (рис. 3D).
- Осмотрите SPoT (Рисунок 3E) и обрежьте всю оставшуюся черную пленку PDMS в процессе литья, не удаленную на шаге 1.4.5, с помощью тонких ножниц Vannas. Убедитесь, что готовые стойки имеют правильную длину, установив стойки PDMS на раму из полисульфона, а затем надвиньте ее на черную опорную плиту (Рисунок 4A).
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь. - Выполните сопряжение стоек PDMS и добавьте их в раму с помощью выступов рамы (рис. 4A) . Автоклав в пакете с опорной плитой из ПТФЭ в течение не менее 30 минут цикла (<122 °C для уменьшения коробления).
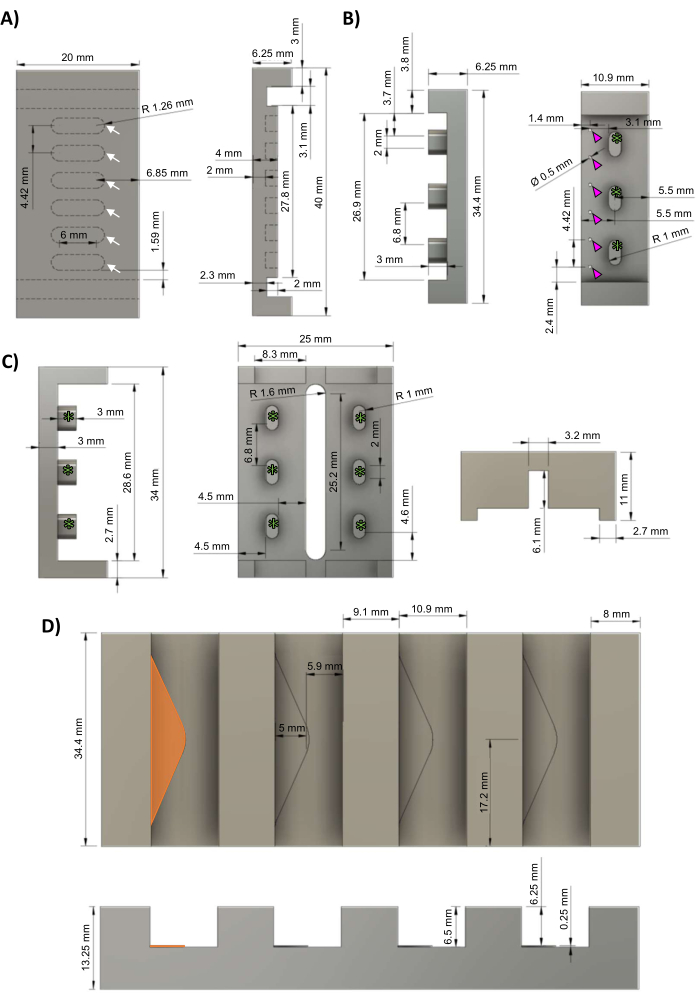
Рисунок 1: Компоненты биореактора hECT. (A) Вид сверху (слева) и сбоку (справа) опорной плиты из ПТФЭ с шестью равномерно расположенными лунками для формирования hECT (белые стрелки). (B) Вид сбоку (слева) и вид сверху (справа) алюминиевых отрицательных мастер-литей для стоек PDMS с шестью равномерно расположенными стойками (пурпурные наконечники стрел) и тремя зазорами для крепления к раме биореактора (зеленые звездочки). (C) Вид сбоку (слева) и снизу (справа) рамок из полисульфона для стоек PDMS с тремя равномерно расположенными опорами рамы (зеленые звездочки), соответствующими опорам рамы в стойке PDMS cast (панель B). (D) Вид сверху (сверху) и сбоку (снизу) алюминиевого литого держателя с четырьмя слотами для стоечных отливок PDMS, каждый из которых имеет треугольную полку высотой 0,25 мм (крайняя левая полка выделена оранжевым цветом). Эта фигура была изменена с van Neste27. Сокращения: hECT = инженерная сердечная ткань человека; Ø = диаметр; ПТФЭ = политетрафторэтилен; ПДМС = полидиметилсилоксан; R = радиус. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
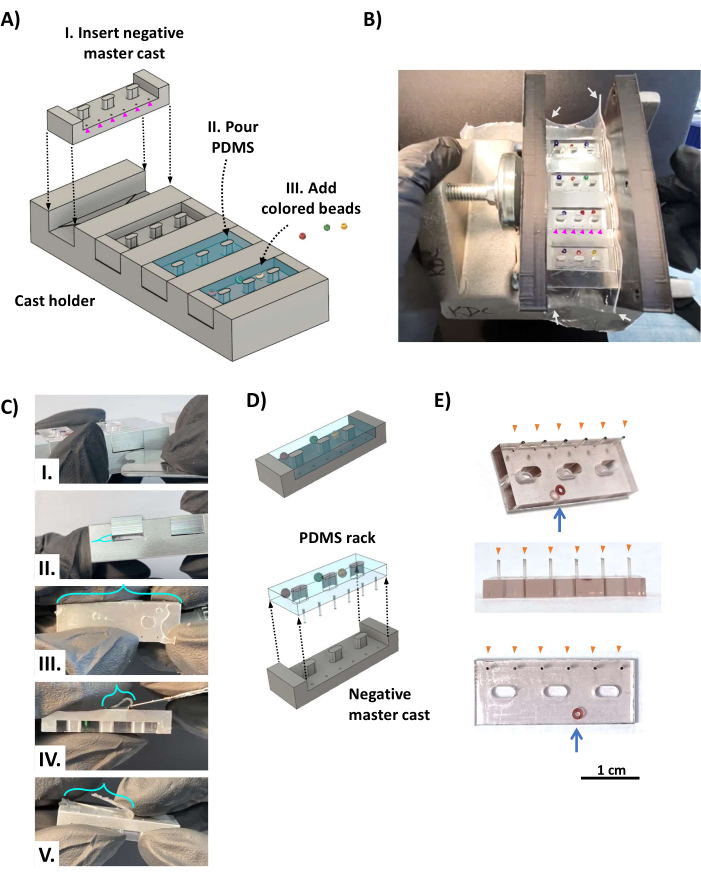
Рисунок 2: Изготовление стоек PDMS. (A) Визуализации САПР показывают наклонный вид литейного аппарата. (I) В каждый из четырех пазов литого держателя вставляется отрицательное эталонное литье стойки PDMS с отверстиями, образующими стойки PDMS (пурпурные наконечники стрелок), расположенными над мертвым пространством напротив треугольной полки (рис. 1D, оранжевый треугольник). (II) PDMS заливается в каждую полость отрицательной основной отливки. (III) Цветные шарики добавляются к неотвержденной PDMS в виде системы идентификации с цветовой кодировкой. (B) Фотография, показывающая собранный реечный литейный аппарат PDMS, который зажимается с обеих сторон двумя кронштейнами, напечатанными на 3D-принтере, удерживаемыми на месте винтовым зажимом и обернутыми силиконовой пленкой толщиной 0,5 мм (белые стрелки) для герметизации зажимных сторон. Цветные бусины размещаются так, чтобы они не закрывали отверстия диаметром 0,5 мм, образующие столбы (пурпурные наконечники стрел). (C) После отверждения PDMS гипс извлекается из гипсового держателя. (I) Затупленное бритвенное лезвие из нержавеющей стали или аналогичный тонкий металлический инструмент вставляется между гипсом и литым держателем, чтобы поддеть гипс из литого держателя (II). (III) Пленка (бирюзовые скобки), образованная PDMS, протекающей через отверстия стоек, прикреплена к кончикам стоек и должна быть срезана острым лезвием (IV, V). (D) Стойка PDMS отделена от отливки. (E) Фотографии, показывающие наклонный (сверху), сбоку (посередине) и снизу (снизу) виды стойки PDMS со стеклянной бусиной, встроенной в корпус для идентификации (синяя стрелка). Кончики столбов (оранжевые наконечники стрелок) помечены черными чернилами. Масштабная линейка = 1 см. Эта фигура была изменена с van Neste27. Сокращения: САПР = системы автоматизированного проектирования; ПДМС = полидиметилсилоксан. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
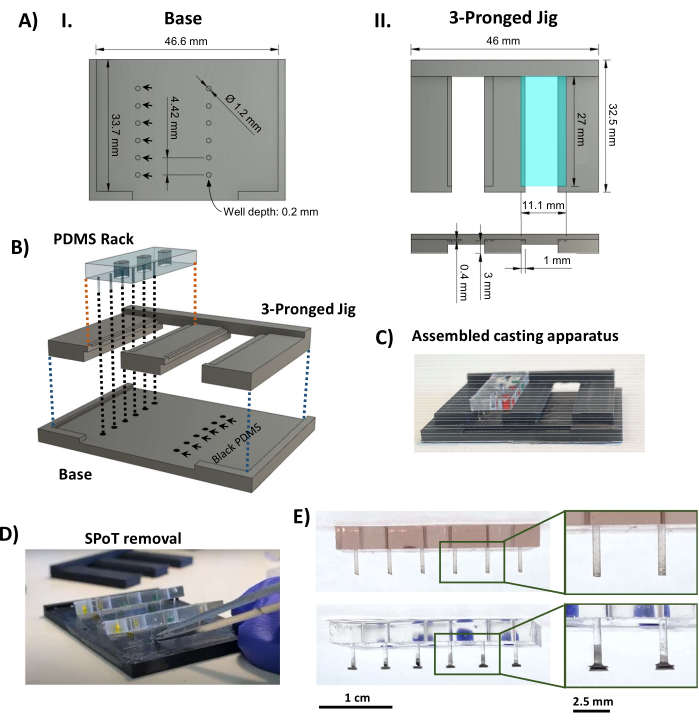
Рисунок 3: Изготовление SPoT. (A) Визуализация САПР с указанием основных размеров (I) основания и (II) трехзубой части литейного приспособления SPoT. Размеры круглых форм SPoT (AI, черные стрелки) задаются как 0,2 мм в глубину и 1,2 мм в диаметре, и каждая из них содержит черные PDMS для отдельного SPoT. Полка размером 11,1 мм x 27 мм, видимая на виде сверху (AII, сверху, бирюзовый прямоугольник), нажата на 0,4 мм (как видно на виде сбоку ниже), чтобы удерживать стойку PDMS на месте во время отверждения. (B) Визуализация в САПР, показывающая сборку литейного аппарата SPoT. (C) Фотография собранного литейного аппарата SPoT. (D) После отверждения PDMS трехзубый зажим выдвигается из-под стоек PDMS, и SPoT освобождаются от своих лунок с помощью тонких щипцов. (E) Фотографии стойки PDMS без (вверху) и с (внизу) SPoT. На врезках показаны увеличенные виды записей. Масштабные линейки = 1 см (E), 2,5 см (увеличенные изображения в E). Эта фигура была изменена с van Neste27. Сокращения: САПР = системы автоматизированного проектирования; Ø = диаметр; ПДМС = полидиметилсилоксан; R = радиус; SPoT = стабильный трекер постов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Клеточная культура
- Культивирование ИПСК
ПРИМЕЧАНИЕ: Для различных клеточных линий может потребоваться корректировка разбавления пассажа и частоты и/или титрования добавок среды.- Обмажьте обработанную клеточной культурой 6-луночную планшет сертифицированной матрицей базальной мембраны (разбавленной в соотношении 1:1 Dulbecco Modified Eagle Medium:Ham's F12 Nutrient Solution [DMEM/F12] в соответствии с инструкциями производителя) и инкубируйте планшет при 37 °C не менее 30 минут. Приготовьте 500 мл питательной среды для ИПСК в соответствии с инструкциями производителя и добавьте 5 мл раствора пенициллин-стрептомицина (от 10 000 МЕ/мл до 10 000 мкг/мл).
- Для прохождения ИПСК необходимо аспирировать среду из лунок и промыть каждую лунку 1 мл фосфатно-солевого буфера (PBS). Добавьте 1 мл раствора для диссоциации ИПСК на лунку и инкубируйте в ламинарном колпаке в течение 1 мин.
- Отсасывайте раствор для диссоциации ИПСК и инкубируйте клетки при 37 °C (без какой-либо среды) в течение 5 мин. Добавьте 1 мл 2 мкМ тиазовивина в среду ИПСК для нейтрализации раствора диссоциации ИПСК.
- Используйте серологическую пипетку объемом 2 мл, чтобы диссоциировать колонии на скопления примерно по 10 клеток, и промыть каждую лунку дополнительным 1 мл тиазовивина 2 мкМ в среде ИПСК. Добавьте 2 мл клеточной суспензии в каждую лунку планшета, покрытого матрицей базальной мембраны (шаг 2.1.1).
- Через 24 ч удалите среду и добавьте свежую среду для ИПСК (без тиазовивина). Каждые 48 ч подавайте ИПСК 2 мл среды ИПСК или каждые 72 ч 4 мл среды. Перекладывайте клетки в разведении 1:6 для пропускания каждые 3 дня или когда они достигнут 80% слияния.
ПРИМЕЧАНИЕ: Для различных клеточных линий может потребоваться регулировка частоты разведения и пассажа.
- Дифференцировка кардиомиоцитов
- Начинайте дифференцировку, когда монослои ИПСК сливаются на 80%-90%.
- Приготовьте дифференцировочную среду, добавив 10 мл добавки B27 без инсулина и 5 мл исходного раствора пенициллина-стрептомицина к 500 мл среды Roswell Park Memorial Institute 1640 (RPMI). Приготовьте питательную среду для кардиомиоцитов, добавив 10 мл добавки B27 и 5 мл исходного раствора пенициллина-стрептомицина к 500 мл RPMI 1640.
ПРИМЕЧАНИЕ: Дифференцировочную среду и среду для поддержания кардиомиоцитов можно хранить при температуре 4 °C до 2 недель. - День 0: Промывают клетки 1 мл DMEM/F12 и добавляют 2 мл 10 мкМ CHIR99021 и разбавленный матрицу базальной мембраны в дифференцировочную среду.
- День 1: Через 24 ч или когда слияние клеток уменьшится до уровня ниже 70%, промойте клетки 1 мл DMEM/F12, добавьте 2 мл дифференцировочной среды и инкубируйте в течение 48 ч.
- Дни 3-4: Промывают клетки 1 мл DMEM/F12 и добавляют 2 мл 5 мкМ IWR-1 в дифференцировочную среду. Повторите на 4-й день.
- Дни 5-6: Промыть клетки 1 мл DMEM/F12 и добавить 2 мл дифференцировочной среды. Повторите на 6-й день.
- Дни 7-10: Промывают клетки 1 мл DMEM/F12 и добавляют 2 мл поддерживающей среды кардиомиоцитов. Повторять каждые 24 часа.
- Дни 11+: Заменяйте среду 4 мл свежей поддерживающей среды кардиомиоцитов каждые 48-72 ч. Медленно аспирируйте и пипетку, чтобы не повредить энергично взбивающиеся монослои.
3. Культура hECT
- Забор кардиомиоцитов
- Собирают монослои кардиомиоцитов для использования в производстве hECT через 8-60 дней после индукции дифференцировки. Ожидайте 2-5 миллионов клеток на скважину.
Примечание: Если клетки не начали биться к 10-му дню, дифференцировка вряд ли будет успешной. Энергично бьющиеся монослои часто отделяются через 11-15 дней в дифференцировку и уплотняются в плотные ткани. Рекомендуется использовать или перекладывать такие ячейки в это время. - Промыть каждую лунку кардиомиоцитов 2 раза 2 мл PBS. Добавьте 1 мл 0,25% трипсина-ЭДТА комнатной температуры. Инкубируйте при температуре 37 °C в течение 5-10 минут до тех пор, пока клетки не станут округлыми и не отделятся легким постукиванием по планшету.
- Добавьте 1 мл 10% FBS в поддерживающую среду кардиомиоцитов в каждую лунку, чтобы нейтрализовать диссоциацию. Осторожно пропипетируйте монослои с помощью серологического наконечника для дозатора объемом 5 мл и переложите в коническую пробирку объемом 50 мл, чтобы разбить гранулы на комки по 10-20 клеток.
- Перемешайте клеточную суспензию, перевернув коническую трубку, перед переносом 10 мкл клеток в 10 мкл трипанового синего. Подсчитайте количество клеток с помощью автоматического счетчика клеток или стеклянного гемоцитометра. Отделите клеточную суспензию соответствующим образом, если не все клетки будут использованы или если некоторые клетки отведены для проточной цитометрии.
ПРИМЕЧАНИЕ: На этом этапе могут быть добавлены дополнительные клетки (например, фибробласты). - Центрифугируют клетки при 250 × г в течение 5 мин. Немедленно отсосите как можно больше надосадочной жидкости, не повредив клеточную гранулу, и держите на льду. Работайте быстро, чтобы свести к минимуму время, которое клетки проводят в гранулах.
- Собирают монослои кардиомиоцитов для использования в производстве hECT через 8-60 дней после индукции дифференцировки. Ожидайте 2-5 миллионов клеток на скважину.
- Изготовление hECT
- Используйте объемы, указанные в таблице 2, и отрегулируйте их в соответствии с количеством клеток в грануле так, чтобы каждая hECT содержала 1 миллион клеток. После каждого этапа медленно перемешивайте пипеткой, чтобы избежать пузырьков.
ПРИМЕЧАНИЕ: Выполняйте шаги 3.2.2-3.2.3 в защищенном от прямого света месте, так как некоторые компоненты чувствительны к свету. - Приготовьте раствор коллагена 1-го типа 2,9 г/мл в микропробирке объемом 1,7 мл, добавив 13,442 мкл дистиллированной воды, 4,4 мкл 10-кратного PBS и 0,638 мкл 1М NaOH. Добавьте 25,52 мкл бульонного раствора коллагена 5 мг/мл и медленно перемешайте.
- Приготовьте смесь для внеклеточного матрикса (смесь ECM из таблицы 2): добавьте 5,5 мкл 0,2 Н раствора pH 9 HEPES, а затем 5,5 мкл 10x MEM. Тщательно перемешайте до однородного светло-желтого или светло-розового цвета. Перенесите 35,2 мкл раствора смеси ECM в клеточную гранулу и добавьте 4,4 мкл матрицы базальной мембраны.
- Откройте автоклавный мешок с деталями биореактора (шаг 1.4.7, рисунок 4A). Надев перчатки, стерилизованные 70% этанолом, извлеките черную опорную пластину из пакета для автоклава и поместите в 60-миллиметровую посуду лунками вверх. Медленно закапывайте пипетку 44 мкл клеточной смеси в каждую лунку, чтобы избежать появления пузырьков. При необходимости используйте пипетку для удаления пузырьков, которые были введены при пипетировании или образовались из-за гидрофобности ПТФЭ. Восстановите объем hECT таким образом, чтобы поверхность жидкости была на одном уровне с кромкой лунки (рис. 4BI).
- Наденьте свежую пару стерилизованных перчаток и извлеките из автоклавного мешка рамку из полисульфона со стойками PDMS. Опустите раму на опорную плиту так, чтобы концы рамы вошли в пазы на концах опорной плиты (рисунок 4BII, III). Перед помещением в тарелку диаметром 60 мм осмотрите биореактор, чтобы убедиться, что все стойки прямые, а рама не наклонена.
- Добавьте 1 мл 10% FBS в поддерживающую среду кардиомиоцитов в чашку диаметром 60 мм (будьте осторожны, чтобы не потревожить hECT), чтобы увеличить влажность в чашке по мере затвердевания hECT. Поместите чашку диаметром 60 мм без крышки в высокопрофильную (высотой 20 мм) чашку диаметром 100 мм, накройте крышкой 100 мм и верните биореактор в инкубатор с температурой 37 °C, 5%CO2 , чтобы коллаген мог образовать гель с клетками во взвешенном состоянии.
- Через 2 ч достаньте посуду из инкубатора. Добавьте 13 мл 10% FBS в поддерживающую среду для кардиомиоцитов, наклоняя чашку, чтобы среда протекала между опорной пластиной из ПТФЭ и стойками PDMS.
- Осмотрите биореактор сбоку, чтобы убедиться в отсутствии пузырьков воздуха между гидрофобными поверхностями опорной плиты из ПТФЭ и стойками PDMS, и верните чашку в инкубатор. Если в нем застрял воздух, наклоните биореактор из среды, чтобы пузырь лопнул, и медленно опустите его снова, или используйте микропипетку с наконечником для загрузки геля, чтобы откачать воздух, стараясь не потревожить штифты.
- Используйте объемы, указанные в таблице 2, и отрегулируйте их в соответствии с количеством клеток в грануле так, чтобы каждая hECT содержала 1 миллион клеток. После каждого этапа медленно перемешивайте пипеткой, чтобы избежать пузырьков.
- Демонтаж опорной плиты
- Проверьте уплотнение hECT через зазор в раме. В течение 24-96 ч hECT уплотняются и становятся более непрозрачными (рис. 4CI-III). Как только появится видимый зазор между hECT и стенкой опорной пластины (рис. 4CII), выполните две замены среды половинного объема, чтобы заменить среду на поддерживающую среду кардиомиоцитов без FBS. Снимите опорную плиту, когда hECT будут уплотнены не менее чем на 30% по сравнению с исходным диаметром (Рисунок 4CIII). Наполните 60-миллиметровую чашку, содержащую биореактор, средой для поддержания кардиомиоцитов до тех пор, пока жидкость не окажется вровень с краем чашки, и добавьте 14 мл в новую 60-миллиметровую чашку.
- КРИТИЧЕСКИЙ ШАГ: Надев стерильные перчатки, переверните биореактор в чашке так, чтобы опорная пластина оказалась сверху (рис. 4BIV). Проверьте наличие захваченных пузырьков воздуха, как показано в шаге 3.2.8. Медленно поднимите опорную плиту, удерживая ее ровно (Рисунок 4BV).
- Если hECT отпадает во время снятия опорной пластины, но остается в базовой пластине, используйте стерильные изогнутые тонкие щипцы для переноса hECT с базовой пластины в чашку диаметром 60 мм. Используйте щипцы, чтобы направить конец hECT к его посту. Используйте вторую пару щипцов, чтобы удерживать штифт устойчиво, и проденьте его через отверстие в hECT. При необходимости повторите то же самое для второго поста.
- Прикрепив все hECT к стойкам, перенесите раму с hECT на новую тарелку диаметром 60 мм и поместите раму так, чтобы стойки были направлены вниз (рис. 4BVI). Осмотрите биореактор, чтобы убедиться, что hECT остаются на своих постах в непосредственной близости от SPoT.
- Если hECT был прижат поверхностным натяжением к основанию своих штифтов, стабилизируйте раму парой стерильных изогнутых щипцов. Вставьте другую пару щипцов через прорезь в рамке, держа ее закрытой. После того, как кончик щипцов будет опущен за стойки PDMS, поверните его так, чтобы он достиг стойки, и с помощью закрытых кончиков осторожно протолкните hECT к концу штифта, пока он не упрется в SPoT (рис. 4BVI, врезка).
- Техническое обслуживание hECT
- Каждые 24-48 ч следует проводить смену среды с поддержанием кардиомиоцитов (после 2 недель посева частоту можно сократить до двух раз в неделю).
- Когда в hECT обнаруживаются кластеры спонтанного биения, как правило, к 3-му дню, и скоординированное биение с видимым отклонением после прогиба к 5-му дню, начинают функциональные измерения и повторяют их так часто, как это необходимо.
ПРИМЕЧАНИЕ: ХЭСТ, которые не начали координированное биение к 7-му дню, вряд ли сделают это вообще.
| Компонент | Объем (мкл) | |||||||
| дистиллированныйН2О | 13.442 | Раствор коллагена 2,9 мг/мл | "ECM mix" | окончательная смесь клеток hECT | ||||
| NaOH 1N | 0.638 | |||||||
| ПБС 10х | 4.4 | |||||||
| 5 мг/мл коллагенового бульона | 25.52 | |||||||
| 0,2 N pH 9 HEPES | 5.5 | |||||||
| 10x MEM | 5.5 | |||||||
| Объем смеси ECM для переноса в гранулы клеток | 35.2 | |||||||
| Объем Matrigel | 4.4 | |||||||
Таблица 2: реагенты hECT. Компоненты следует добавлять в указанном порядке и держать на льду.
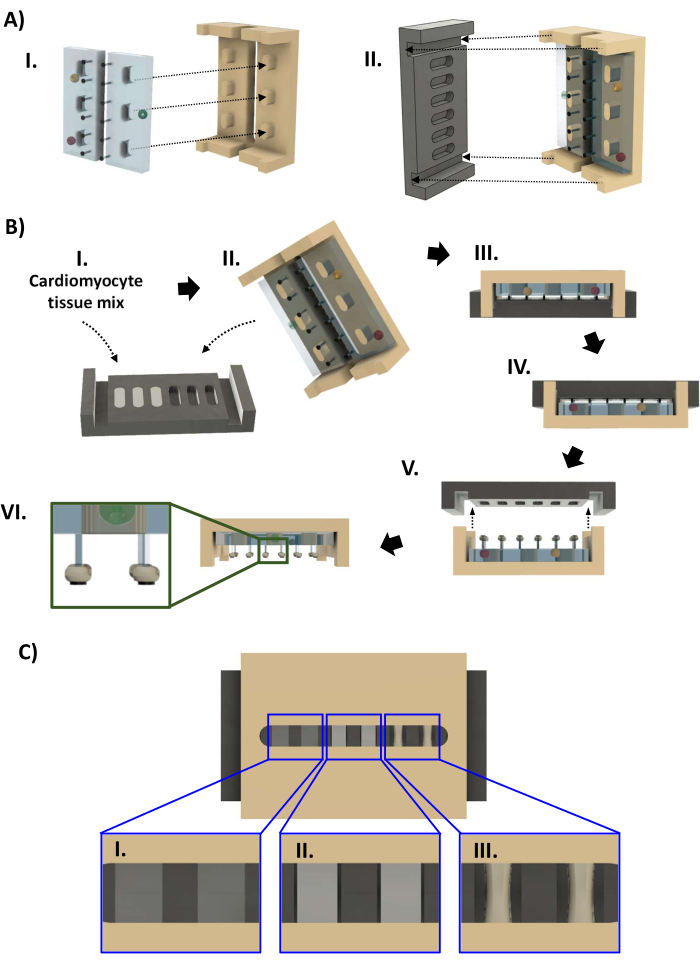
Рисунок 4: Сборка биореактора и изготовление hECT. (A) (I) Две стойки PDMS (слева, светло-голубые), установленные на раме из полисульфона (справа, коричневый). (II) Затем опорная плита из ПТФЭ (черная, слева) устанавливается на раму (справа) таким образом, что каждая пара стоек помещается в углубление опорной плиты. (B) (I) Сорок четыре микролитра суспензии кардиомиоцитов во внеклеточном матриксе на основе коллагена добавляют в каждую из шести лунок опорной пластины. (II,III) Рама со стойками PDMS запрессована на опорную плиту. Через 1-4 дня hECT можно снять с базовой пластины. (IV) Сначала биореактор переворачивается перед тем, как (V) опорная плита поднимается с рамы. (VI) Вид сбоку на биореактор с шестью hECT. Врезка: увеличенное изображение, показывающее положение hECT на стойках относительно SPoT (врезка). (C) Визуализация в САПР, показывающая три уровня уплотнения hECT ([I] низкий, [II] средний и [III] высокий), как видно через зазор в раме из полисульфона. Эта фигура была изменена с van Neste27. Сокращения: САПР = системы автоматизированного проектирования; ПДМС = полидиметилсилоксан; ПТФЭ = политетрафторэтилен; SPoT = стабильный трекер постов; hECT = искусственно созданная человеком сердечная ткань. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Кардиостимуляторы hECT
- Куртка для сцены с подогревом
- Используйте станок для лазерной резки, чтобы вырезать компоненты акриловой изоляционной оболочки из прозрачного акрилового листа толщиной 0,635 см (дополнительный файл 3), по одному на рисунке 5A-D и по два на рисунке 5E, F.
- Соберите детали (B), (C), (D) и одну из частей (E) с рисунка 5 и соедините вместе с помощью акрилового клея, как показано на рисунке 5GI. Прикрепите верхнюю панель (рис. 5GII), подождите несколько часов, пока клей схватится, а затем вставьте нагретый столик в боковую часть куртки (рис. 5GIII).
- После того, как оболочка будет на месте, используйте ленту, чтобы закрепить вставки между ножками нагреваемого столика, и добавьте переднюю панель (Рисунок 5GIV), чтобы завершить сборку (Рисунок 5GV).
- Изготовление графитированных электродов
- Графитовые прутки толщиной 6,25 мм и шириной 25 мм распиловывают ленточной пилой на блоки длиной 35 мм; Затем разрежьте каждый блок вдоль по изогнутой линии так, чтобы каждый электрод был высотой 13-16 мм с одного конца и 8-10 мм с другого конца. Просверлите два отверстия диаметром 0,7 мм в верхнем углу (рис. 6AI). Отполируйте детали бумажными полотенцами и проведите ультразвуком в воде в течение 20 минут, чтобы удалить графитовую пыль. Убедитесь, что электроды вклиниваются между стенками чашки и биореактора шириной 25 мм, чтобы обеспечить постоянное расстояние между электродами (рис. 6AII).
- Проденьте стальную проволоку длиной 150 мм и диаметром 0,25 мм через отверстия электродов и согните ее так, чтобы она подходила к краю чашки диаметром 60 мм и вокруг стенок чашки диаметром 100 мм так, чтобы крышка могла быть закрыта (рис. 6AII).
- Очистите электроды, замочив их в дистиллированной воде на 1-2 часа после каждого использования, чтобы удалить абсорбированную среду, дайте высохнуть в течение ночи, а затем автоклавируйте при 132 °C в течение 30 минут. Перед началом измерений поместите по одному электроду с каждой стороны биореактора (рис. 6AII). Расположите провода так, чтобы крышка чашки диаметром 100 мм могла быть закрыта, и верните биореактор в инкубатор для уравновешивания.
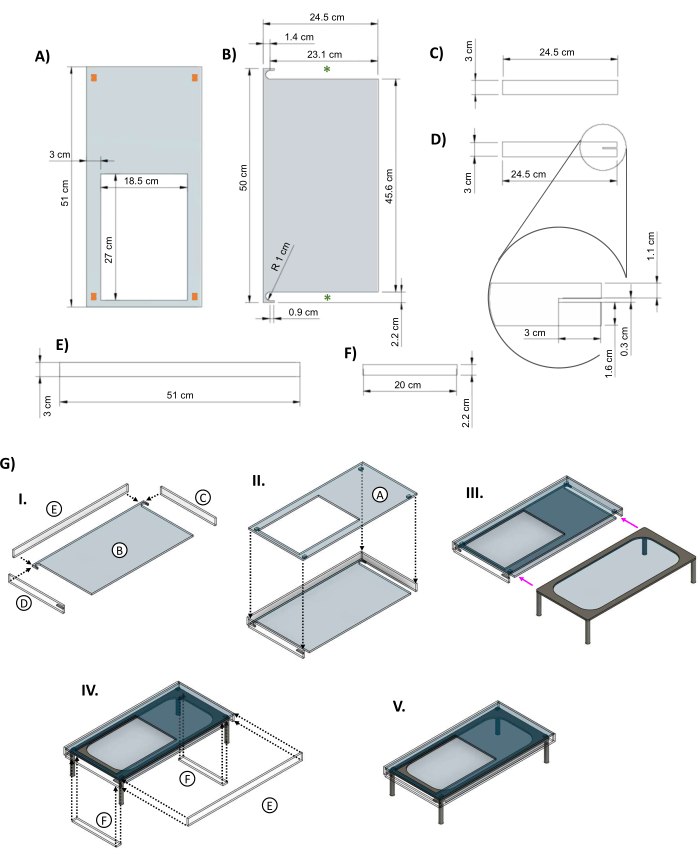
Рисунок 5: Акриловая оболочка для изоляции нагретого стеклянного столика. CAD-изображения, показывающие основные размеры деталей акриловой оболочки, предназначенной для стеклянного стола. (A) Верхняя панель имеет вырез в отверстии размером 27 см x 18,5 см, позволяющий установить тарелку биореактора на нагревательный элемент. Оранжевые прямоугольники по углам указывают на предлагаемое размещение небольших распорных элементов, чтобы обеспечить пространство между верхней частью куртки и нагревательным элементом. (B) Нижняя часть куртки имеет два выреза, позволяющих ногам сцены с подогревом скользить внутрь (зеленые звездочки). (К&Д) Две боковые панели помещаются под верхнюю часть. (D) На левой боковой панели имеется вырез (вставка) размером 3 см x 0,3 см для шнура питания сцены. (E) Длинные панели подходят спереди и сзади. (F) Вставки добавляются для заполнения пробелов после того, как стол находится внутри. (G) (I) Боковая и задняя панели крепятся к нижней части, а затем (II) добавляется верхняя панель. (III) Стеклянный стол вставляется в рубашку (пурпурные стрелки). (IV) Вставки крепятся между ножками стола, а задняя часть вставляется в отверстие, закрывающее коробку. (V) Готовая сборка куртки. Эта фигура была изменена с van Neste27. Сокращения: САПР = системы автоматизированного проектирования; R = радиус; Ø = диаметр. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 6: Сбор данных о сокращении hECT. (A) (I) Фотографии электродов, вырезанных из графитовых стержней. Пурпурные стрелки обозначают отверстия для крепления проводов из нержавеющей стали. Масштабная линейка = 1 см. (II) Наклонный вид (слева) и вид сверху (справа), показывающие расположение графитированных электродов в биореакторе. Электроды занимают пространство между биореактором шириной 25 мм и стенкой чашки, чтобы обеспечить постоянное расстояние между электродами. Провода изогнуты, чтобы обеспечить закрытие крышки посуды. (B) Фотография установки кардиостимуляции hECT внутри ламинарного настольного чистого стенда - все оборудование размещено на виброизоляционном столе для снижения вибрационного шума от чистого стенда. Биореактор (пурпурный наконечник стрелы) расположен на обогреваемой сцене с рубашкой, освещенной сверху светодиодным источником света. Препарирующий микроскоп направлен горизонтально на прямоугольное зеркало (оранжевая звездочка) для обзора биореактора снизу и оснащен ПЗС-камерой (слева). Бирюзовый кронштейн указывает на водяную баню для непрерывного контроля температуры, чтобы обеспечить обратную связь с контроллером ступени с подогревом с замкнутым контуром. Эта фигура была изменена с van Neste27. Сокращения: hECT = инженерная сердечная ткань человека; Светодиод = светодиод. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
5. Функциональные измерения hECT
- Настройка рабочего пространства для измерения темпа
- Включите нагретую ступень до 39,5 °C и установите кардиостимулятор на виброизоляционном столе внутри ламинарного стола для очистки потока в соответствии с рисунком 6B. Установите препарирующий микроскоп на подставку и направьте его на прямоугольное зеркало (рис. 6B, оранжевая звездочка), расположенное на лабораторном гнезде под стеклянным столом, чтобы рассмотреть биореактор снизу. Прикрепите высокоскоростную ПЗС-камеру к микроскопу и подключите к компьютеру. Облучайте установку ультрафиолетовым светом в течение 15 минут, чтобы стерилизовать рабочее место.
- Разместите биореактор (рис. 6B, пурпурный наконечник стрелы) на обогреваемую ступень с рубашкой, освещаемую сверху светодиодным источником света с двумя головками на гусиной шее (горловины светодиодных ламп могут быть более надежно прикреплены к основному блоку по сравнению с оптоволоконными лампами). Сведите к минимуму дополнительный шум, убедившись, что кардиостимулятор на вибростоле (и сам стол) не касается какой-либо части стола для очистки ламинарного потока.
- Добавьте вторую 60-миллиметровую тарелку, наполненную предварительно подогретой водой, внутри 100-миллиметровой тарелки на нагреваемый стол (рис. 6B, бирюзовый кронштейн), и оснастите датчиком температуры для непрерывного контроля температуры. При необходимости отрегулируйте температуру нагреваемой ступени для поддержания температуры эталонной чашки на уровне 36-37 °C.
- Установите увеличение микроскопа на 1,5x (или другое желаемое увеличение, с помощью которого можно визуализировать hECT целиком с соответствующим разрешением).
- Настройка параметров камеры
- Откройте программное обеспечение камеры. Измените размер видеопотока, чтобы максимально обрезать поле зрения, но при этом визуализировать весь hECT. Это максимизирует скорость камеры.
- Установите частоту съемки 90 кадров в секунду. Отрегулируйте время экспозиции и положение источника света , чтобы оптимизировать однородность условий освещения по всему полю зрения и максимизировать контрастность SPoT.
- Настройка программного обеспечения для сбора данных
- Включите квадратный стимулятор импульсов и подключите его к компьютеру. Отрегулируйте настройки для подачи двухфазных импульсов с амплитудой 12 В и длительностью 5 мс.
- Откройте программное обеспечение для сбора данных, а затем откройте файл «AutomatedPostTracking3.vi» (Дополнительный файл 4). После загрузки нажмите на белую стрелку в левой части панели инструментов, чтобы инициализировать программу (рисунок 7A).
- Откалибруйте программное обеспечение с помощью стеклянного гемоцитометра на нагретом столике. На панели инструментов (Рисунок 7B) щелкните инструмент «Линия », чтобы провести линию через 1 мм от маркировки гемоцитометра (не показана). В окне Калибровка расстояния (пиксели/мм) (рис. 7C) установите для параметра Опорная длина (мм) значение 1, а затем нажмите кнопку Вычислить .
- Измерьте площадь поперечного сечения hECT с помощью инструмента «Линия», чтобы провести линию по ширине ткани. Нажмите на 1 в поле Площадь поперечного сечения (мм^2) (Рисунок 7D), чтобы рассчитать площадь (предполагая цилиндрическую геометрию линейных полос ткани, как установлено в литературе 1,2,3,4,5,6,7,8,9,10,11, 12,15,16,18,19,20,
21,22,23,24,25,26,37,38). Повторите эти действия в разных частях hECT и запишите значения под двумя другими кнопками в поле. Файл таблицы выходных данных содержит среднее значение этих трех значений для вычисления диаметра ткани.
- Функциональная характеристика hECT
- Убедитесь, что подсказки по публикациям находятся в фокусе. Включите переключатель пороговых значений (рис. 7E) и отрегулируйте ползунок (рис. 7F) до тех пор, пока SPoT (рис. 7G) не будут четко разграничены и не изменят форму при сокращении hECT.
- С помощью инструмента «Прямоугольник » нарисуйте прямоугольник вокруг одного из SpoT (рис. 7, зеленый прямоугольник) и нажмите кнопку «Установить 1 » в окне «Границы столба » (рис. 7H), чтобы задать положение прямоугольника вокруг SPoT, убедившись, что SPoT всегда остается в пределах границы прямоугольника. Повторите то же самое для другого поста и запишите его в Набор 2.
- Отрегулируйте параметры размера объекта (Рисунок 7I), чтобы программа не отслеживала объекты меньшего размера. Убедитесь, что количество отслеживаемых объектов в каждом прямоугольнике остается постоянным. Интерфейс (рис. 7J) показывает измеренное расстояние между отслеживаемыми объектами в режиме реального времени. Используйте этот график для мониторинга шума.
- Выберите каталог для сохранения файлов (рисунок 7K). Храните данные за разные дни в отдельных папках. Выберите текущий номер ткани и введите необходимые комментарии в поле Комментарии .
- Под заголовком Pacing Frequency (Hz) (Рисунок 7L) укажите желаемый диапазон частот (Min и Max) и желаемый интервал шага от Min до Max. Если вы измеряете темп hECT во всем диапазоне захвата, протестируйте различные частоты стимуляции, чтобы найти самую низкую частоту , на которой достигается соотношение стимул:пик 1:1 , и продолжайте увеличивать частоту до тех пор, пока это соотношение не будет потеряно. Измерьте спонтанную функцию , выбрав произвольный диапазон частот (например, от 0,01 Гц до 0,01 Гц) и отключив выход стимулятора прямоугольных импульсов.
- В полях справа выберите желаемое время настройки (интервал времени после того, как частота была установлена, но данные не записаны), чтобы позволить hECT приспособиться к новой частоте стимуляции. Укажите время записи (с) и напряжение (В). Запустите программу, нажав кнопку «Запустить программу » (рисунок 7M).
ПРИМЕЧАНИЕ: Результаты автоматически сохраняются в выбранном каталоге. После каждой записи обратите внимание, что сценарий отображает преобразование Фурье данных (рис. 7N), где пики соответствуют обнаруженной частоте биений. - При необходимости запустите программу «Определение порога возбуждения», чтобы найти минимальное напряжение, необходимое для стимуляции hECT (рис. 7O). При желании рассчитайте максимальный и минимальный прогибы стоек (рисунок 7П).
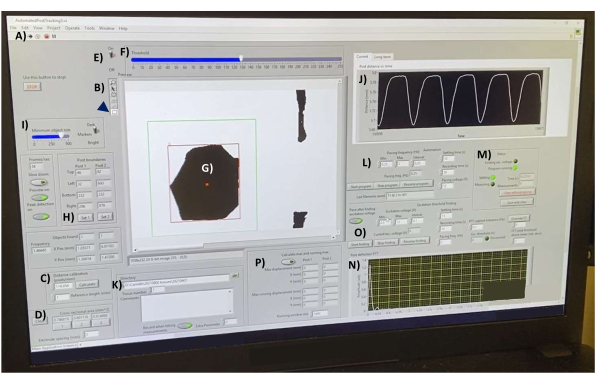
Рисунок 7: Интерфейс сбора данных после прогиба. (A) Кнопка запуска программного обеспечения. (B) Панель инструментов, содержащая инструменты «Линия» и «Прямоугольник» для измерения длины и выбора объекта соответственно. (C) Элементы управления калибровкой расстояния. (D) Инструменты для измерения площади поперечного сечения hECT в трех различных точках. (E) Переключатель пороговых значений и ползунок (F) для преобразования видеопотока в высококонтрастные изображения в режиме реального времени. (G) SPoT, видимый в окне предварительного просмотра. (H) Инструменты для выбора SPoT. (I) Ползунок для фильтрации объектов по размеру. (J) График, показывающий измеренное расстояние между отслеживаемыми объектами в режиме реального времени. (K) Параметры выбора каталога для сохранения выходных файлов. (L) Параметры настройки частотного диапазона, частотного интервала, времени записи и установки времени между записями для программы отслеживания постов (M). (N) Вывод графика преобразования Фурье кривой отклонения последней сохраненной записи. (O) Программа для нахождения минимального напряжения, необходимого для стимуляции hECT. (P) Программа для расчета максимальных и минимальных прогибов стоек. Сокращения: hECT = инженерная сердечная ткань человека; SPoT = стабильный трекер постов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
6. Измерения в стойке PDMS
- Расстояния без нагрузки
- Перед изготовлением hECT установите нужную пару стоек PDMS на раму. Для функциональных измерений используйте настройку темпа и программное обеспечение, описанные в шаге 5.1. Выберите стационарные SPoT на концах постов.
- При необходимости отрегулируйте источник света и/или пороговое значение, чтобы уменьшить шум до <2 мкм. Запишите среднее динамическое значение y, указанное на графике, в электронную таблицу.
- Высота столбов и высот hECT
- Из настройки темпа, описанной в шаге 5.2, снимите наклонное зеркало и столик с подогревом. Установите биореактор непосредственно на лабораторный домкрат, чтобы получить вид на биореактор сбоку.
- Откройте программное обеспечение камеры. Отрегулируйте время экспозиции и положение источника света , чтобы оптимизировать однородность условий освещения по всему полю зрения и максимизировать видимость постов.
- Откройте программное обеспечение для сбора данных, а затем откройте файл «PostMeasurement_PB3.vi» (Дополнительный файл 5). После загрузки нажмите на белую стрелку в левой части панели инструментов , чтобы инициализировать программу.
- Откалибруйте программное обеспечение с помощью стеклянного гемоцитометра. Нажмите на инструмент «Линия » на вертикальной панели инструментов слева от смотрового окна и проведите линию через 1 мм от маркировки гемоцитометра. В поле Калибровка расстояния (пиксели/мм) в левом нижнем углу экрана установите для параметра Опорная длина (мм) значение 1, а затем нажмите кнопку Рассчитать .
- Под полями калибровки задайте желаемый номер ткани (для идентификации) в поле Номер ткани . Сфокусируйте камеру на левой стойке hECT и выберите Left (Влево ) в поле Post Side (Сторона поста ).
- С помощью инструмента «Линия » нарисуйте линию от основания столба (вверху) до кончика SPoTs (внизу) и запишите, щелкнув по кнопке «Измерить пост Ht».
- Нарисуйте линию от основания столба до дальнего края hECT и запишите, нажав на Measure Tissue Top Ht. Проведите линию от основания стойки до ближайшего края hECT и запишите, щелкнув Измерить основание ткани Ht.
- В этот момент поверните биореактор, чтобы измерить правильную высоту столба. Выберите подходящий вариант поста , чтобы записать те же измерения. Нажмите кнопку « Добавить », чтобы заполнить электронную таблицу измеренными значениями и автоматически рассчитать среднюю высоту hECT, которая будет использоваться на шаге 7.
- После того, как вы закончите записывать высоту ткани, нажмите кнопку «Сохранить», чтобы сохранить значения в текстовый файл.
7. Функциональная обработка данных с помощью пользовательских скриптов анализа
- В табличном редакторе заполните файл сводки, используя шаблон (Дополнительный файл 6). Используйте значения длины стойки и средней высоты ткани , полученные на шагах 6.2. Убедитесь, что все hECT, данные которых находятся в папке, представлены в сводном файле. Назовите файл "summary #.csv", где # обозначает количество дней эксперимента.
ПРИМЕЧАНИЕ: Функциональные данные hECT должны находиться в отдельных папках в соответствии с днем эксперимента. - Убедитесь, что папка, содержащая сценарии AnalyzeLogsGUI (дополнительный файл 7), и папка с записями hECT добавлены в путь.
- Откройте программное обеспечение для анализа данных. Слева от панели каталогов нажмите кнопку Browse for folder , чтобы перейти к родительской папке, содержащей папку AnalyzeLogsGUI и функциональные данные hECT. На боковой панели «Текущее окно » щелкните правой кнопкой мыши по этим папкам, чтобы добавить в путь | Добавьте выбранные папки и вложенные папки.
- Откройте файл "AnalyzeLogsGui_SC.m". На вкладке «Редактор» нажмите кнопку «Выполнить» и дождитесь появления графического интерфейса пользователя (GUI) в новом окне.
- В окне Log Selection (рисунок 8AI) нажмите кнопку Select Directory и перейдите в папку, содержащую функциональные данные hECT. Выберите нужную hECT для обработки в раскрывающемся меню Tissue (Ткани ).
- В поле «Входные данные» (рис. 8AII) введите незагруженное расстояние между столбами, записанными на шагах 6.1, в поле «Диастолическое расстояние». Введите 0,25 в поле Радиус поста (мм).
- В окне Analysis Constraints (рисунок 8AIII) выберите частоты, которые нужно исключить из анализа, или выберите конкретные частоты для включения (через запятую). Время начала и время окончания по умолчанию установлены в 0 и −1 соответственно для обработки всей длины записей. При необходимости измените эти значения, чтобы обрезать записи.
- Измените параметры фильтра (рис. 8AIV) Полиномиальный порядок (Polynomial Order ) и Размер кадра (Frame Size ), чтобы изменить уровень сглаживания в процессе фильтрации, и ползунок Peak Detection Threshold (Порог обнаружения пиков ), чтобы установить минимальный размер пика , который будет распознаваться скриптами.
ПРИМЕЧАНИЕ: Скрипт содержит опцию Удаление шипов, которая обрезает высокие пики, вызванные артефактами; Однако это не рекомендуется, так как это изменяет форму подергиваний. Удалите артефакты, обрезав запись (рис. 8AIII). - Используйте дополнительные параметры (рис. 8AV) для получения дополнительных выходных данных анализа данных: Анализ после прогиба для запуска дополнительного алгоритма обнаружения пиков, Автомасштабирование оси Y на графиках масштабирования для автоматической настройки осей на кривой силы подергивания (Рисунок 8B), Сохранение кривых трассировки силы для сохранения каждой фигуры силы подергивания в файл .fig и Сохранение данных о силе-времени , чтобы сохранить координаты X и Y отфильтрованных данных, нанесенных на рисунок кривой силы Twitch.
- Нажмите кнопку Run Analysis , чтобы создать .txt файл, содержащий атрибуты кривой силы подергивания (дополнительный файл 8), усредненные по всей записи.
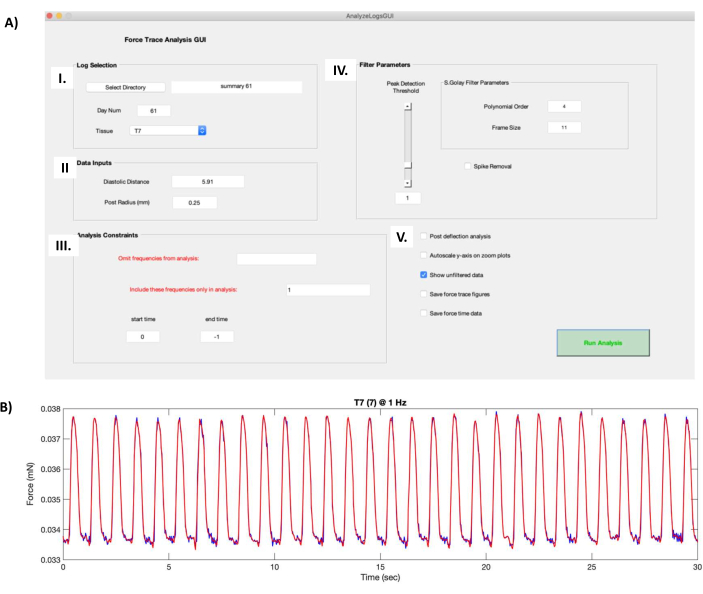
Рисунок 8: Расчет кривой силы Twitch. (A) Запуск файла "AnalyzeLogsGUI.m" в программном обеспечении для обработки данных открывает окно графического интерфейса. (I) Поле Log Selection позволяет пользователю выбрать каталог для папки, содержащей функциональные данные hECT. Поле Day Num автоматически заполняется из заголовка сводного файла, созданного на шаге протокола 7.1. Обрабатываемый hECT выбирается с помощью выпадающего меню Tissue (Ткань ). (II) Поле Data Inputs содержит информацию о паре постов PDMS, поддерживающих hECT, такую как расстояние без нагрузки (полученное на шаге протокола 6.1) и радиус поста (0,25 мм). (III) Поле Analysis Constraints (Ограничения анализа ) позволяет пользователю выбрать частоты, которые следует опустить, включить и обрезать записи. (IV) Окно параметров фильтра содержит параметры для выбора способа фильтрации необработанной кривой силы подергивания. Полиномиальный порядок и размер кадра изменяют уровень сглаживания в процессе фильтрации. Ползунок Peak Detection Threshold определяет минимальный размер пика, который будет распознаваться скриптами. Параметр «Удаление шипов » обрезает высокие пики, вызванные артефактами. (V) Дополнительные опции включают в себя Анализ после прогиба, который запускает дополнительный алгоритм обнаружения пиков, Автомасштабирование оси Y на графиках масштабирования, которое действует на кривую силы подергивания, Сохранение кривых трассировки силы, которое сохраняет значения силы подергивания, и Сохранение данных о силе-времени, которое сохраняет построенные данные о силе подергивания. (B) Пример кривой силы подергивания 30-секундной записи hECT с частотой 1 Гц, полученной с помощью снимка экрана графического интерфейса с панели A. Красная кривая силы подергивания показывает отфильтрованную силу, создаваемую параметрами в AIV, наложенную на необработанную кривую силы подергивания (темно-синяя кривая, появляется, когда выбран параметр Показать нефильтрованные данные в AV ). Сокращения: hECT = инженерная сердечная ткань человека; GUI = графический пользовательский интерфейс; ПДМС = полидиметилсилоксан. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
В соответствии с вышеприведенным протоколом, кардиомиоциты были получены из здоровой линии ИПСК, ранее использовавшейся нашей группой 9,15, и изготовлены в hECT через 8-61 день в культуре. На рисунке 9A показаны репрезентативные изображения hECT ...
Обсуждение
В литературе опубликовано множество линейно-инженерных моделей сердечной ткани, некоторые из которых описаны в таблице 1. Некоторые модели предполагают непосредственное измерение силы в тканях, но они, как правило, требуют переноса конструкции в отдельную мышечную ванну
Раскрытие информации
K.D.C. является соучредителем и главным научным сотрудником Novoheart, а также владеет долей в холдинговой компании Medera Biopharmaceutical. Компания Novoheart не принимала участия в финансировании, планировании или проведении этого исследования; тем не менее, результаты исследования потенциально могут оказать финансовое влияние на Novoheart и Medera. Другие авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Авторы выражают признательность доктору Тимоти Кэшману за предыдущую работу над этим методом. Это исследование было поддержано финансированием Национальных институтов здравоохранения (NIH) (R01-HL132226 и K01 HL133424) и Международной программы передового опыта Фонда Ледюка (CURE-PLaN).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25 mm diamete 304 Stainless Steel Wire | McMaster Carr | 6517K61 | |
| 0.25% trypsin-EDTA | Gibco | 25200056 | |
| 1.7 mL Microtubes | Axygen | MCT-175-C | |
| 10 cm dishes (20 mm tall) | Corning | 353003 | |
| 10 mL Serological Pipette | Drummond | 6-000-010 | |
| 10 N NaOH | Fisher Scientific | SS225-1 | dilute 1:10 in sterile distilled water |
| 10X Modified Eagle Medium | Sigma Aldrich | M0275 | |
| 20 - 200 μL Micropipette | Eppendorf | 3123000055 | |
| 200 μL MicroPipette Tips | VWR | 76322-150 | |
| 5 mL Serological Pipette | Drummond | 6-000-005 | |
| 50 mL Conical Centrifuge Tubes | Falcon | 352070 | |
| 6 cm Petri Dish | Corning | 353002 | |
| 6 Watt LED Dual Gooseneck Illuminator | AmScope | LED-6W | |
| 6-Well Plates | Corning | 353046 | |
| 90 degree angle mirror | Edmund Optics | 45-594 | |
| Acrylic bonding glue | SCIGRIP | #4 | |
| Adjustable 10 cm x 10 cm jack | Fisher Scientific | 14-673-50 | |
| Aluminum 6061 | McMaster Carr | 9008K82 | |
| A-Plan 10X Objective Lens | ZEISS | 1020-863 | |
| Autoclave Bags | Propper | 21002 | |
| B-27 supplement | ThermoFisher | 17504044 | |
| B-27 supplement (without insulin) | ThermoFisher | A1895601 | |
| Benchtop Centrifuge | Eppendorf | 5810 R | |
| Black ABS | Ultimaker | 2.85 mm wide | |
| Bovine Collagen I | Gibco | A1064401 | |
| CHIR99021 | Tocris | 4423 | |
| Class II Biosafety Cabinet | Labconco | 3430009 | |
| Clear Acrylic Sheeting | estreetplastics | 1002502436 | 6.25 mm thick |
| CNC Vertical Mill | Haas | VF-1 | |
| Conductive Graphite Bars | McMaster Carr | 1763T33 | |
| Dissection microscope | Olympus | SZ61 | |
| Dulbecco's Modified Eagle Medium/Ham's F-12 Nutrient Mix | ThermoFisher | 11330032 | |
| Ethanol | Fisher Scientific | A4094 | Dilute to 70% in water |
| EVE Automated Cell counter | NanoEntek | E1000 | |
| EVE Cell Counting Slide | NanoEntek | EVS-050 | |
| Fetal Bovine Serum | Life Technologies | 10438026 | |
| Fine Curved Forceps | Fine Science Tools | 11253-25 | |
| Forma Series II Water Jacketed CO2 Incubator | Thermo Electron Corporation | 3110 | AKA "incubator". With HEPA class 100 filter |
| Fusion360 software | Autodesk | AKA "CAD software" | |
| Glass Hemocytometer | Reichert | 1475 | 0.1 mm deep |
| HEPES | Sigma Aldrich | H3784 | |
| hESC qualified matrigel | Corning | 354277 | AKA "basement membrane matrix". Store in frozen aliquots |
| High Speed CCD Camera | PixelLINK | P7410 | |
| Inverted Microscope | Carl Zeiss Werk | Axiovert 40 CFL | 10X phase contrast objective |
| IWR-1 | Selleck Chem | S7086 | |
| LabView Software | National Instruments | 2016 | |
| Laminar flow clean bench | NuAire | NU-201-330 | necessary for hECT functional analysis |
| Laptop | AsusTek | Strix | Intel Core i& processor ,CPU 2.8GHz, 16GB RAM |
| Laser Cutting Machine | Epilog | Helix 24 | |
| Magnification headset | ExcelBlades | 70020 | Recommended for steps requiring fine manipulations |
| Matlab | Mathworks | Version 2019b or later | AKA "data analysis software" |
| Micro Vannas Scissors, 3 mm blade | WPI Instruments | 501839 | |
| Microscope Boom Stand | Olympus | SZ2-STU1 | |
| Penicillin-Streptomycin stock solution | ThermoFisher | 15140122 | 10,000 IU/ml penicillin; 10,000 μg/ml streptomycin |
| Phosphate-buffered saline without divalent cations | Sigma Aldrich | P3813 | Diluted in distilled water to 1X and 10X concentrations |
| Pipette Controller | Drummond | 4-000-100 | |
| PixelLINK Capture OEM | PixelLINK | 10.2.1.6 | AKA "Camera Software" |
| Polysulfone | McMaster Carr | 86735K73 | translucent amber color |
| Polytetrafluoroethylene (PTFE) | McMaster Carr | 8545K176 | Black, molded |
| ReLeSR | Stem Cell Technologies | 5872 | AKA "iPSC dissociation media" |
| Rosewell Park Memorial Institute 1640 Media | ThermoFisher | 11875135 | |
| Silicone Sheeting | SMI manufacturing | glossy, 0.02 in thickness, durometer 40 | |
| Size 10/0 Blue, Green, Red, and Yellow Glass Seed Beads | Michael's | color should withstand autoclaving | |
| Spatula | Fisher Scientific | 14-373 | used for mixing PDMS |
| Square Pulse Stimulator | Astro-Med / Grass Technologies | S88X | |
| Stainless Steel Razoblades | GEM | 62-0179-CTN | preferred over non-stainless steel due to lower hardness |
| Stemflex | ThermoFisher | A3349401 | AKA "iPSC culture media" |
| Sterile distilled water | ThermoFisher | 5230 | |
| Sylgard 170 - Silicone Elastomer Encapsulant Black 0.9 kg Kit | Dow | DOWSIL 170 2LB KIT | AKA black Polydimethylsiloxane (black PDMS) |
| Sylgard 184 - Silicone Elastomer Clear 1 lb Kit | Dow | DC 184 SYLGARD 0.5KG 1.1LB KIT | AKA Polydimethylsiloxane (PDMS) |
| Temperature-controlled heated stage | Okolab | H401-HG-SMU | Set height to 10 cm |
| Thermoplastic 3D printer | Ultimaker | Ultimaker 3 | |
| Thiazovivin | Selleck Chem | S1459 | |
| Trypan Blue | NanoEntek | EBT-001 | |
| Vacuum Chamber | Bel-Art Parts | F42027-0000 | |
| Variable Speed Mini Band Saw | Micro-Mark | 82203 | |
| Variable Speed Miniature Drill Press | Micro-Mark | 82959 | |
| Vibration Isolation Table | Labconco | 3618000 | |
| Weighing Boats | VWR | 10803-140 | |
| Talon Cylinder Bench Clamp | VWR | 97035-528 | AKA screw clamp |
Ссылки
- Serrao, G. W., et al. Myocyte-depleted engineered cardiac tissues support therapeutic potential of mesenchymal stem cells. Tissue Engineering. Part A. 18 (13-14), 1322-1333 (2012).
- Turnbull, I. C., et al. Advancing functional engineered cardiac tissues toward a preclinical model of human myocardium. FASEB Journal. 28 (2), 644-654 (2014).
- Cashman, T. J., et al. Construction of defined human engineered cardiac tissues to study mechanisms of cardiac cell therapy. Journal of Visualized Experiments. (109), e53447 (2016).
- Stillitano, F., et al. Genomic correction of familial cardiomyopathy in human engineered cardiac tissues. European Heart Journal. 37 (43), 3282-3284 (2016).
- Mayourian, J., et al. Experimental and computational insight into human mesenchymal stem cell paracrine signaling and heterocellular coupling effects on cardiac contractility and arrhythmogenicity. Circulation Research. 121 (4), 411-423 (2017).
- Mayourian, J., et al. therapeutic paracrine modulation of cardiac excitation-contraction coupling. Circulation Research. 122 (1), 167-183 (2018).
- Mayourian, J., et al. Exosomal microRNA-21-5p mediates mesenchymal stem cell paracrine effects on human cardiac tissue contractility. Circulation Research. 7 (122), 933-944 (2018).
- Turnbull, I. C., et al. Cardiac tissue engineering models of inherited and acquired cardiomyopathies. Methods in Molecular Biology. 1816, 145-159 (2018).
- Murphy, J. F., et al. Adult human cardiac stem cell supplementation effectively increases contractile function and maturation in human engineered cardiac tissues. Stem Cell Research & Therapy. 10 (1), 373 (2019).
- Breckwoldt, K., et al. Differentiation of cardiomyocytes and generation of human engineered heart tissue. Nature Protocols. 12 (6), 1177-1197 (2017).
- Huang, C. Y., et al. Enhancement of human iPSC-derived cardiomyocyte maturation by chemical conditioning in a 3D environment. Journal of Molecular and Cellular Cardiology. 138, 1-11 (2020).
- Ramade, A., Legant, W. R., Picart, C., Chen, C. S., Boudou, T. Microfabrication of a platform to measure and manipulate the mechanics of engineered microtissues. Methods in Cell Biology. 121, 191-211 (2014).
- Ronaldson-Bouchard, K., et al. Engineering of human cardiac muscle electromechanically matured to an adult-like phenotype. Nature Protocols. 14 (10), 2781-2817 (2019).
- Tamargo, M. A., et al. milliPillar: A platform for the generation and real-time assessment of human engineered cardiac tissues. ACS Biomaterials Science & Engineering. 7 (11), 5215-5229 (2021).
- Ceholski, D. K., et al. CXCR4 and CXCR7 play distinct roles in cardiac lineage specification and pharmacologic β-adrenergic response. Stem Cell Research. 23, 77-86 (2017).
- Bliley, J. M., et al. Dynamic loading of human engineered heart tissue enhances contractile function and drives a desmosome-linked disease phenotype. Science Translational Medicine. 13 (603), (2021).
- Ribeiro, M. C., et al. A new versatile platform for assessment of improved cardiac performance in human-engineered heart tissues. Journal of Personalized Medicine. 12 (2), 214 (2022).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Mannhardt, I., et al. Human engineered heart tissue: Analysis of contractile force. Stem Cell Reports. 7 (1), 29-42 (2016).
- Mannhardt, I., et al. Blinded contractility analysis in hiPSC-cardiomyocytes in engineered heart tissue format: Comparison with human atrial trabeculae. Toxicological Sciences. 158 (1), 164-175 (2017).
- Saleem, U., et al. Force and calcium transients analysis in human engineered heart tissues reveals positive force-frequency relation at physiological frequency. Stem Cell Reports. 14 (2), 312-324 (2020).
- Thavandiran, N., et al. Functional arrays of human pluripotent stem cell-derived cardiac microtissues. Scientific Reports. 10 (1), 6919 (2020).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Engineering. Part C, Methods. 22 (10), 932-940 (2016).
- Leonard, A., et al. Afterload promotes maturation of human induced pluripotent stem cell derived cardiomyocytes in engineered heart tissues. Journal of Molecular and Cellular Cardiology. 118, 147-158 (2018).
- Bose, P., Huang, C. Y., Eyckmans, J., Chen, C. S., Reich, D. H. Fabrication and mechanical properties measurements of 3D microtissues for the study of cell-matrix interactions. Methods in Molecular Biology. 1722, 303-328 (2018).
- Zhang, W., et al. Maturation of human embryonic stem cell-derived cardiomyocytes (hESC-CMs) in 3D collagen matrix: Effects of niche cell supplementation and mechanical stimulation. Acta Biomaterialia. 49, 204-217 (2017).
- van Neste, C. Advances in bioreactor design and multi-dimensional analysis for assessing maturation phenotype of human engineered cardiac tissues. PhD thesis. Icahn School of Medicine at Mount Sinai. , (2022).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Salazar, B. H., Cashion, A. T., Dennis, R. G., Birla, R. K. Development of a cyclic strain bioreactor for mechanical enhancement and assessment of bioengineered myocardial constructs. Cardiovascular Engineering and Technology. 6 (4), 533-545 (2015).
- Putame, G., et al. Application of 3D printing technology for design and manufacturing of customized components for a mechanical stretching bioreactor. Journal of Healthcare Engineering. 2019, 3957931 (2019).
- Akintewe, O. O., Roberts, E. G., Rim, N. -. G., Ferguson, M. A. H., Wong, J. Y. Design approaches to myocardial and vascular tissue engineering. Annual Review of Biomedical Engineering. 19, 389-414 (2017).
- Chen, G., et al. Phospholamban as a crucial determinant of the inotropic response of human pluripotent stem cell-derived ventricular cardiomyocytes and engineered 3-dimensional tissue constructs. Circulation. Arrhythmia and Electrophysiology. 8 (1), 193-202 (2015).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Beauchamp, P., et al. 3D co-culture of hiPSC-derived cardiomyocytes with cardiac fibroblasts improves tissue-like features of cardiac spheroids. Frontiers in Molecular Biosciences. 7, 14 (2020).
- Campostrini, G., et al. functional analysis and applications of isogenic three-dimensional self-aggregating cardiac microtissues from human pluripotent stem cells. Nature Protocols. 16 (4), 2213-2256 (2021).
- Swiatlowska, P., Iskratsch, T. Tools for studying and modulating (cardiac muscle) cell mechanics and mechanosensing across the scales. Biophysical Reviews. 13 (5), 611-623 (2021).
- Zhao, Y., et al. Engineering microenvironment for human cardiac tissue assembly in heart-on-a-chip platform. Matrix Biology. 85-86, 189-204 (2020).
- Fujiwara, Y., Deguchi, K., Miki, K., Nishimoto, T., Yoshida, Y. A method for contraction force measurement of hiPSC-derived engineered cardiac tissues. Methods in Molecular Biology. 2320, 171-180 (2021).
- Wang, E. Y., et al. Biowire model of interstitial and focal cardiac fibrosis. ACS Central Science. 5 (7), 1146-1158 (2019).
- Zhao, Y., et al. A platform for generation of chamber-specific cardiac tissues and disease modeling. Cell. 176 (4), 913-927 (2019).
- Lee, E. K., et al. Machine learning of human pluripotent stem cell-derived engineered cardiac tissue contractility for automated drug classification. Stem Cell Reports. 9 (5), 1560-1572 (2017).
- Batalov, I., Feinberg, A. W. Differentiation of cardiomyocytes from human pluripotent stem cells using monolayer culture. Biomarker Insights. 10, 71-76 (2015).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), E1848-E1857 (2012).
- Penefsky, Z. J., Buckley, N. M., Litwak, R. S. Effect of temperature and calcium on force-frequency relationships in mammalian ventricular myocardium. Pflugers Archiv. 332 (4), 271-282 (1972).
- Bers, D. M. . Excitation-Contraction Coupling and Cardiac Contractile Force. , (2001).
- Kanaya, N., Gable, B., Wickley, P. J., Murray, P. A., Damron, D. S. Experimental conditions are important determinants of cardiac inotropic effects of propofol. Anesthesiology. 103 (5), 1026-1034 (2005).
- Galende, E., et al. Amniotic fluid cells are more efficiently reprogrammed to pluripotency than adult cells. Cellular Reprogramming. 12 (2), 117-125 (2010).
- Wacker-Gussmann, A., Strasburger, J. F., Cuneo, B. F., Wakai, R. T. Diagnosis and treatment of fetal arrhythmia. American Journal of Perinatology. 31 (7), 617-628 (2014).
- Federmann, M., Hess, O. M. Differentiation between systolic and diastolic dysfunction. European Heart Journal. 15, 2-6 (1994).
- Knight, W. E., et al. Maturation of pluripotent stem cell-derived cardiomyocytes enables modeling of human hypertrophic cardiomyopathy. Stem Cell Reports. 16 (3), 519-533 (2021).
- Ma, Z., et al. Contractile deficits in engineered cardiac microtissues as a result of MYBPC3 deficiency and mechanical overload. Nature Biomedical Engineering. 2 (12), 955-967 (2018).
- de Lange, W. J., et al. Human iPSC-engineered cardiac tissue platform faithfully models important cardiac physiology. American Journal of Physiology. Heart and Circulatory Physiology. 320 (4), H1670-H1686 (2021).
- Hiranandani, N., Varian, K. D., Monasky, M. M., Janssen, P. M. L. Frequency-dependent contractile response of isolated cardiac trabeculae under hypo-, normo-, and hyperthermic conditions. Journal of Applied Physiology. 100 (5), 1727-1732 (2006).
- Puglisi, J. L., Bassani, R. A., Bassani, J. W., Amin, J. N., Bers, D. M. Temperature and relative contributions of Ca transport systems in cardiac myocyte relaxation. The American Journal of Physiology. 270 (5), H1772-H1778 (1996).
- Puglisi, J. L., Yuan, W., Bassani, J. W., Bers, D. M. Ca(2+) influx through Ca(2+) channels in rabbit ventricular myocytes during action potential clamp: Influence of temperature. Circulation Research. 85 (6), e7-e16 (1999).
- Li, R. A., et al. Bioengineering an electro-mechanically functional miniature ventricular heart chamber from human pluripotent stem cells. Biomaterials. 163, 116-127 (2018).
- Sharma, A., et al. Biomanufacturing in low Earth orbit for regenerative medicine. Stem Cell Reports. 17 (1), 1-13 (2022).
- Strauss, D. G., Wu, W. W., Li, Z., Koerner, J., Garnett, C. Translational models and tools to reduce clinical trials and improve regulatory decision making for QTc and proarrhythmia risk (ICH E14/S7B updates). Clinical Pharmacology & Therapeutics. 109 (2), 319-333 (2021).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756 (2020).
Erratum
Formal Correction: Erratum: Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Posted by JoVE Editors on 1/10/2024. Citeable Link.
An erratum was issued for: Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues. The title was corrected from:
Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues
to:
Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены