Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Контроль фракции частиц в микропористых отожженных каркасах частиц для 3D-культуры клеток
В этой статье
Резюме
Минимизация изменчивости фракции частиц в зернистых каркасах облегчает воспроизводимые эксперименты. В данной работе описываются методы получения гранулированных каркасов с контролируемыми фракциями частиц для применения в тканевой инженерии in vitro .
Аннотация
Микрогели являются строительными блоками каркасов микропористых отожженных частиц (MAP), которые служат платформой как для культуры клеток in vitro , так и для восстановления тканей in vivo . В этих зернистых каркасах врожденная пористость, создаваемая пустотным пространством между микрогелями, обеспечивает инфильтрацию и миграцию клеток. Контроль фракции пустоты и фракции частиц имеет решающее значение для проектирования каркасов MAP, поскольку пористость является биологически активным сигналом для клеток. Сферические микрогели могут быть сгенерированы на микрофлюидном устройстве для контролируемого размера и формы и впоследствии лиофилизированы с использованием методов, предотвращающих разрыв полимерной сети. При регидратации лиофилизированные микрогели приводят к контролируемым фракциям частиц в каркасах MAP. Реализация этих методов лиофилизации микрогелей привела к воспроизводимым исследованиям, показывающим влияние фракции частиц на диффузию макромолекул и распространение клеток. Следующий протокол будет охватывать изготовление, лиофилизацию и регидратацию микрогелей для контроля фракции частиц в каркасах MAP, а также отжиг микрогелей с помощью биоортогонального сшивания для 3D-культуры клеток in vitro.
Введение
Каркасы микропористых отожженных частиц (MAP) представляют собой подкласс гранулированных материалов, в которых микрогелевые (мкгелевые) строительные блоки взаимосвязаны, образуя объемный, пористый каркас. Благодаря уникальной микроархитектуре этих зернистых каркасов врожденная пористость, создаваемая пустотным пространством между взаимосвязанными сферическими микрогелями, поддерживает ускоренную инфильтрацию клеток и миграцию1. Микрогелевые строительные блоки каркасов MAP могут быть изготовлены как из синтетических, так и из природных полимеров с химическими модификациями2. Методы, описанные здесь, специально подчеркивают использование микрогелей, состоящих из основы гиалуроновой кислоты (ГК), модифицированной функциональными ручками норборнена (NB). Функциональная ручка NB на полимере ГК поддерживает реакции щелочной химии для формирования микрогелей и связывания их вместе для создания каркасов MAP 3,4. Для связывания микрогелей вместе (т.е. отжига) были использованы многочисленные схемы, такие как ферментативная1, 5,6 на основе света и химия щелчка без добавок 3,7 реакции. Химия щелчков без добавок описана в этой работе с использованием обратного электронного потребления тетразин-норборнена Дильса-Альдера для взаимосвязи микрогелей HA-NB.
Для изготовления каркасов MAP пользователи сначала генерируют микрогелевые строительные блоки с использованием обратных эмульсий либо в периодических системах, либо в микрофлюидных устройствах, а также с помощью электрогидродинамического распыления, литографии или механической фрагментации2. Производство сферических микрогелей HA-NB было хорошо описано и ранее сообщалось с использованием как периодической эмульсии2, так и методов генерации микрофлюидных капель 8,9,10,11. В этой работе сферические микрогели HA-NB были сгенерированы на ориентированной на поток микрофлюидной платформе для контролируемого размера и формы, как описано ранее 8,9,10. После очистки микрогели существуют в водной суспензии и должны быть сконцентрированы, чтобы вызвать защемленное состояние. При защемлении микрогели проявляют свойства разжижения сдвига, которые позволяют им функционировать как инъекционные, заполняющие пространство материалы1. Одним из способов индуцирования застрявшего состояния является сушка микрогелей путем лиофилизации или сублимационной сушки, а затем последующая регидратация высушенного продукта в контролируемом объеме12. Альтернативно, избыточный буфер может быть удален из микрогелевой суспензии посредством центрифугирования над сетчатым фильтром или с ручным удалением буфера из гранулы микрогеля либо путем аспирации, либо с использованием абсорбирующего материала. Однако использование центрифугирования для сушки микрогелей может генерировать очень изменчивый диапазон фракций частиц и фракций пустот при изготовлении гранулированных каркасов12. Описаны способы лиофилизации микрогелей с использованием 70% IPA для микрогелей полиэтиленгликоля (PEG)13, фторированных масел для желатиновых метакрилоиловых (GelMa) микрогелей14 и 70% этанола для микрогелей HA12. Этот протокол выделяет методы сублимационной сушки сферических микрогелей ГК с использованием 70% этанола, стандартного лабораторного реагента, для сохранения исходных свойств микрогеля во время процесса сушки. Лиофилизированные микрогели ГК могут быть взвешены и регидратированы с заданными пользователем весовыми процентами для контроля конечных фракций частиц в каркасахMAP 12.
Заключительный этап формирования каркасов MAP основан на отжиге микрогелей для создания объемного, пористого каркаса1. Используя нативные компоненты внеклеточного матрикса и используя биоортогональные схемы отжига, каркасы MAP служат биосовместимой платформой как для клеточной культуры in vitro , так и для восстановления тканей in vivo 3. Благодаря этим подходам каркасы MAP могут быть изготовлены из строительных блоков HA-NB с определяемыми пользователем фракциями частиц для их использования в приложенияхтканевой инженерии 12. Следующий протокол описывает микрофлюидное производство микрогелей HA-NB с последующей лиофилизацией и регидратизацией для контроля фракции частиц в каркасах MAP. Наконец, этапы отжига микрогелей описаны с использованием биоортогональной химии для экспериментов in vitro с 3D-культурой клеток.
протокол
1. Изготовление микрофлюидных устройств
- Мягкая литография
ПРИМЕЧАНИЕ: Этот протокол описывает изготовление устройства для проектирования микрофлюидного устройства, фокусирующего поток, из de Wilson et al.9. Однако этот протокол можно использовать с любой конструкцией устройства на пластине СУ-8. Пластина может быть приклеена к чашке Петри, а затем должна быть силанизирована, чтобы предотвратить прилипание PDMS к особенностямпластины 15.- Смешайте основание эластомера полидиметилсилоксана (PDMS) с отверждающим агентом (см. Таблицу материалов) в соотношении 10:1. Приготовьте примерно 100 г, чтобы покрыть пластину ~5 мм PDMS. Вылейте смесь PDMS на пластину и дегазируйте в осушителе в течение примерно 30 минут. Как только все пузырьки исчезнут, поместите в духовку при 60 °C не менее чем на 2 часа, чтобы вылечить PDMS.
- Используйте нож, чтобы аккуратно проследить вокруг параметра устройства без растрескивания пластины; затем аккуратно снимите PDMS с пластины. Используйте 1 мм биопсийный перфоратор (см. Таблицу материалов) для создания входных и выходных каналов.
ПРИМЕЧАНИЕ: Будьте осторожны при пробивке микрофлюидного устройства. Разрывы или разрывы вокруг входных или выходных каналов могут вызвать утечки во время производства микрогелей. - Используйте ленту для удаления пыли с устройства на стороне функции. Поместите устройства и очистите стеклянные слайды на конфорке при температуре 135 °C в течение не менее 15 минут, чтобы удалить влагу.
- В вытяжном шкафу используйте коронную плазменную пушку (см. Таблицу материалов) на верхних контактных стеклах и устройствах (сторона объекта открыта) в течение примерно 30 с, а затем быстро свяжите их вместе. Осторожно нажмите, чтобы обеспечить хорошее уплотнение между устройством и стеклом. Поместите устройства в духовку с температурой 60 °C на ночь, чтобы закрепить сцепление.
2. Микрофлюидная продукция микрогелей гиалуроновой кислоты (ГК) с функциональными ручками норборнена (NB)
- Синтез HA-NB
ПРИМЕЧАНИЕ: Синтез HA-норборнена (HA-NB) был адаптирован из Darling et al.3 с использованием 79 кДа натрия HA с молярными эквивалентами 1:1,5:2,5 ГК-повторных единиц до 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорида (DMTMM) до 5-норборнен-2-метиламина (НМА).- Взвесьте реагенты. Растворить ГК при 20 мг/мл в 200 мМ MES буфере (рН ~6) путем перемешивания в стакане или колбе на перемешиваемой пластине. После растворения добавьте ДМТМм в раствор ГК и дайте вступить в реакцию в течение приблизительно 20 мин при комнатной температуре. Например, можно использовать 1 г ГК + 1,09 г ДМТММ + 845 мкл НМА.
- Добавьте NMA по каплям в решение HA/DMTMM. Добавьте парапленку к открытию реакционного сосуда, чтобы свести к минимуму испарение, и накройте реакционный сосуд фольгой. Продолжайте помешивать, давая реакции продолжаться в течение примерно 24 ч.
- Через 24 ч охладите 200 стойким этанолом (примерно в 10 раз больше реакционного объема). На перемешиваемой пластине переложите реакцию по каплям на охлажденный этанол, чтобы вывести в осадок HA-NB и продолжайте перемешивание при 200-300 об/мин в течение 20 мин.
- Переложите раствор на конические пробирки объемом 50 мл, а затем центрифугу на 5000 х г в течение 10 мин. Высыпьте избыток этанола для утилизации в качестве отходов. В этот момент продукт HA-NB должен представлять собой белые гранулы в конических трубках. Вытяните вакуум на HA-NB в осушителе для высыхания в течение ночи.
- Очистите HA-NB с помощью 12-14 кДа молекулярно-весовых отсечных целлюлозных диализных трубок (см. Таблицу материалов). Растворить HA-NB в 2 М растворе NaCl и перенести в диализную трубку. При необходимости завяжите трубку и закрепите зажимами. Переложите заполненную диализную трубку в ведро с 5 л сверхчистой воды и диализуйте HA-NB против воды на ночь.
- На следующий день вынуть воду и заменить 1 М раствором NaCl в течение 30 мин. Удалите раствор NaCl, а затем диализуйте против сверхчистой воды в течение 3 дней, заменяя воду ежедневно.
- Отфильтруйте диализованный продукт с помощью вакуумного фильтра 0,2 мкм, а затем перенесите отфильтрованный продукт в конические трубки объемом 50 мл.
- Добавьте жидкий азот в криогенный контейнер и заморозьте пробирки HA-NB в течение 10 минут. Затем удалите конические трубки щипцами и быстро снимите колпачок и накройте тканью лабораторного класса (см. Таблицу материалов). Закрепите ткань резинкой и перенесите в контейнер для лиофилизации или камеру (см. Таблицу материалов) и лиофилизируйте. Хранить лиофилизированный продукт при -20 °C.
ВНИМАНИЕ: Жидкий азот является опасным веществом. Надевайте соответствующие средства индивидуальной защиты при работе с жидким азотом. - Количественное определение модификации норборнена путем растворения HA-NB при 10 мг/мл вD2Oи анализа с помощью протонного ЯМР (рисунок 1A)16.
- Чтобы определить величину функционализации, сначала откалибруйте пик растворителяD2O до 4,8 PPM. Интегрируйте пик для метилпротонов ГК (δ2,05) и откалибруйте интеграцию до 3,0. Далее интегрируем пики для подвесных норборненовых групп при δ6,33 и δ6,02 (виниловые протоны, эндо). Нормализуют интегрирование этих пиков в соответствующее число протонов для определения средней степени модификации3.
- Получение предшественника микрогеля HA-NB
- Подготовьте буфер HEPES емкостью 50 мМ (рН 7,5) и стерильную фильтрацию буфера с помощью вакуумного фильтра 0,2 мкм. Используя буфер HEPES, подготовьте соответствующие запасы 50 мМ фотоинициатора фенил(2,4,6,-триметилбензоила)фосфината (LAP) и восстановителя трис(2-карбоксиэтил)фосфина (TCEP). Держите решение LAP вдали от света.
- Приготовьте другие компоненты-предшественники микрогеля путем получения соответствующих 50 мМ запасов ди-тиолового линкера и пептида RGD в стерильной дистиллированной воде. Взвесите HA-NB и растворите в буфере HEPES для получения запаса 10 мг/мл.
ПРИМЕЧАНИЕ: Различные ди-тиоловые компоновщики могут быть использованы для внутреннего сшивания микрогелей на основе предпочтений пользователя. Как разлагаемый (т.е. MMP-расщепляемый), так и неразлагаемый (дитиотрейтол или DTT) линкер были перечислены в Таблице материалов. Пептид RGD включен в состав микрогеля для содействия клеточной адгезии в каркасах MAP, но этот компонент может быть удален и заменен равным объемом буфера HEPES. - Комбинируйте компоненты-прекурсоры с конечными концентрациями 9,9 мМ LAP, 0,9375 мМ TCEP (4 тиола/TCEP), 2,8 мМ ди-тиолового линкера, 1 мМ пептида RGD и 3,5 мас.% (мас./об.) HA-NB путем добавления дополнительного буфера HEPES для достижения желаемого конечного объема. Хорошо перемешайте предшественник с помощью пипетки с положительным смещением.
- Используя пипетку P1000, медленно подтягивайте всю смесь. Положите наконечник на конец шприца объемом 1 мл и извлеките наконечник из пипетки. Потяните плунжер шприца, чтобы загрузить смесь в шприц, а затем добавьте фильтр 0,2 мкм на конец шприца и отфильтруйте в новую микроцентрифужную трубку объемом 1,5 мл. Центрифугируйте отфильтрованный раствор предшественника для удаления пузырьков, образующихся при фильтрации.
- Опять же, используя пипетку P1000, медленно подтягивайте отфильтрованный предшественник, стараясь не создавать пузырьков. Если есть пузырьки, осторожно постучите по кончику, чтобы они сместились и всплыли наверх.
- Положите наконечник на конец шприца объемом 1 мл и извлеките наконечник из пипетки. Держите шприц вертикально и медленно тяните поршень шприца, пока весь раствор предшественника не окажется в шприце. Добавьте к шприцу иглу с тупым наконечником и протолкните предшественник через кончик иглы. Заверните шприц в фольгу, чтобы не было света.
- Приготовление раствора для защемления микрогелей
- Приготовить 5% v/v Span-80 в тяжелом белом минеральном масле и хорошо перемешать. Высушите, чтобы удалить пузырьки. Держите смесь поверхностно-активного вещества и масла при комнатной температуре, завернутую в фольгу. Хорошо перемешайте и высушите перед каждым использованием.
- Используйте шприц объемом 5 мл для получения смеси масла и поверхностно-активного вещества (сведите к минимуму пузырьки) до тех пор, пока расстояние между плунжером и рукояткой пальца не будет примерно равно расстоянию от шприца-предшественника. Добавьте тупую иглу в шприц и протолкните масло через кончик иглы.
- Настройка микрофлюидного устройства
- Добавьте тупую иглу в шприц объемом 1 мл и заполните синтетическим гидрофобным лечебным раствором (см. Таблицу материалов). Осторожно пропустите раствор через микрофлюидное устройство до тех пор, пока он не растается на каждом входе/выходе. Дайте раствору высохнуть в устройстве на столешнице в течение примерно 30 минут, а затем потяните вакуум на выходное отверстие, чтобы удалить лишний раствор. Закрепите устройство зажимами на настольном микроскопе.
- Оберните коническую трубку объемом 15 мл фольгой и поместите в стойку для трубок, чтобы она служила контейнером для сбора микрогелей. Используйте кольцевую подставку с зажимом, чтобы поместить зонд ультрафиолетового излучения в отверстие коллекторной трубки. Используйте УФ-детектор (см. Таблицу материалов) для измерения интенсивности УФ-излучения, перемещая зонд до тех пор, пока не будет достигнуто 20 мВт/см2 . Выключите ультрафиолетовый свет на потом.
- Разрезайте трубку на длину, которая будет доходить от микрофлюидного устройства до контейнера для сбора. На одном конце трубки вырежьте угол 45°. Аккуратно вставьте угловой конец трубки в выходной канал.
ПРИМЕЧАНИЕ: Будьте осторожны при вставке трубки в микрофлюидное устройство. Разрывы или разрывы вокруг входных или выходных каналов могут вызвать утечки во время производства микрогелей. - Закрепите шприцы как прекурсора, так и шприцы масляной фазы на насосе с двумя шприцевыми шприцами (см. Таблицу материалов). Вырежьте еще два куска трубки на длину, которая будет доходить от кончиков шприца до микрофлюидного устройства. На одном конце каждой трубки вырежьте угол 45°. Тщательно закрепите трубку (тупой конец) на обоих наконечниках шприца.
- Измените настройки насоса для шприца 1 мл и включите приблизительный объем предшественника. Медленно толкайте насос вперед до тех пор, пока не будет подано достаточное давление на шприцевые плунжеры, чтобы протолкнуть масло и предшественник к концам трубки, удаляя любой воздух из системы. Дайте давлению выровняться за 5-10 минут до перехода к шагу 2.4.6.
- Осторожно вставьте угловой конец трубки во входные каналы микрофлюидного устройства с раствором предшественника микрогеля на переднем входе и защемляющим маслом на заднем входе. Перемещайте насос вперед небольшими шагами до тех пор, пока в устройстве не начнется поток и сферические микрогели не начнут образовываться в области, фокусирующей поток. Запустите насос со скоростью потока 0,4 мкл/мин и дайте устройству работать до тех пор, пока оно не стабилизируется. При необходимости отрегулируйте скорость потока ±0,1 мкл/мин с небольшими шагами для стабилизации производства микрогеля.
- Как только производство микрогелей стабилизируется, как показано на рисунке 1B, замените трубку для сбора новой трубкой и включите ультрафиолетовый свет. Периодически проверяйте прогон, чтобы обеспечить стабильность производства микрогелей в течение всего пробега.
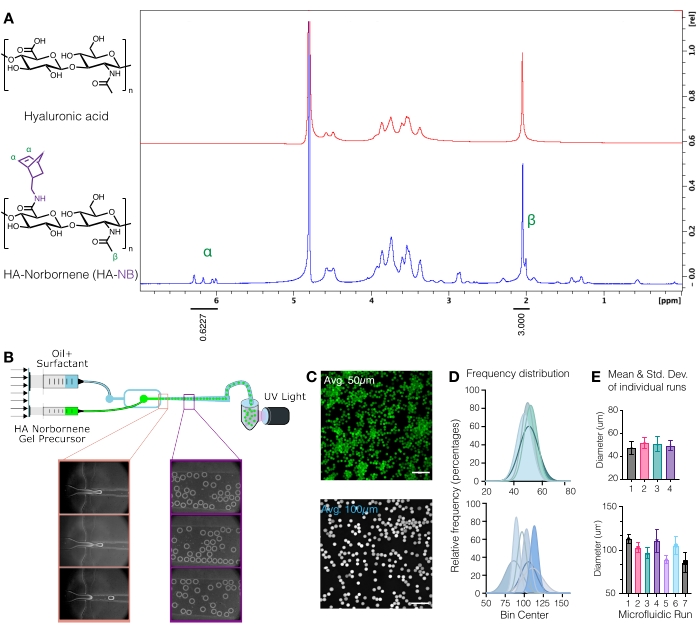
Рисунок 1: Микрофлюидная продукция микрогелей гиалуроновой кислоты (ГК) с функциональными ручками норборнена (NB ). (А) Приблизительно 31% повторных единиц ГК были успешно модифицированы с помощью NB, что было определено протонным ЯМР-анализом, выполненным в оксиде дейтерия. 1 См. H ЯМР сдвиги подвесных норборненов при δ6,33 и δ6,02 (виниловые протоны, эндо) и δ6,26 и δ6,23 ppm (виниловые протоны, экзо) сравнивали с метильной группой ГК δ2,05 ppm для определения функционализации. Перепечатано из Anderson et al.12 с разрешения Elsevier. (B) Схема микрофлюидного устройства, фокусирующего поток, используемого для генерации МКГЕЛЕЙ HA-NB. (C) Проекции максимальной интенсивности с помощью конфокальной микроскопии использовались для визуализации флуоресцентно меченых мкгелей (шкала бар = 500 мкм). (D) Частотные распределения диаметра микрогеля от независимых прогонов на микрофлюидной установке демонстрируют контроль над размером микрогеля ~50 мкм или ~100 мкм в зависимости от используемого устройства. (E) Диаметр микрогеля указывается как среднее и стандартное отклонение для каждого независимого пробега. Перепечатано из Wilson et al.9 с разрешения Wiley. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Очистка и сушка микрогелей
- Очистка микрогелей
- Подготовьте буфер для промывки микрогелей (300 мМ HEPES, 50 мМ NaCl, 50 мМ CaCl2), а также 2% (мас./об.) раствор поверхностно-активного вещества Pluronic F-127 в буфере промывки. Стерилизуйте растворы с помощью вакуумного фильтра 0,2 мкм.
- Центрифугируйте трубку для сбора микрогелей (5 000 х г) в течение 5 мин. В стерильной вытяжке осторожно аспирируйте фазу надосадочного масла. Соедините мкгели 1:1 с 2% раствором поверхностно-активного вещества Pluronic F-127 и вихрем для хорошего перемешивания. Центрифуга (5 000 х г) в течение 5 мин и аспирировать раствор для промывки супернатанта.
- Добавьте промывочный буфер с объемом 4 микрогеля и вихрь, чтобы хорошо перемешать. Центрифугу (5 000 х г) смесь в течение 5 мин и аспирируют моющим раствором. Завершите 4-8 промывок с помощью промывочного буфера до тех пор, пока поверхностно-активное вещество не будет удалено из системы (т.е. пузырьков не останется).
- Флуоресцентная маркировка микрогелей HA-NB
ПРИМЕЧАНИЕ: Собственный синтез флуоресцентно меченого тетразина опирается на две катализируемые основанием реакции присоединения тиола-Майкла последовательно, которые были хорошо описаны и ранее сообщены3. Для этой работы Alexa Fluor-488 был сопряжен с тетразином для маркировки норборнен-модифицированных мкгелей. Лиофилизированный продукт (Alexa Flour 488-Tet) растворяли в диметилформамиде при 1 мг/мл и хранили при -20 °C.- Чтобы флуоресцентно маркировать мкгели, сначала готовят рабочий раствор Alexa Fluor 488-Tet, разбавляя запас 1 мг/мл 1:14 в стерильном 1x PBS. В стерильной вытяжке соединить мкгели с рабочим раствором (2:1 по объему).
- Используйте вытесняющую пипетку и хорошо перемешайте. Инкубировать смесь в течение 1 ч при комнатной температуре или на ночь при 4 °С.
- Центрифуга (5 000 х г) и аспирация окрашивающего раствора. Дважды вымойте мкгели с 1x PBS (1:1 по объему), чтобы удалить непрореагировавший Alexa Fluor 488-Tet.
ПРИМЕЧАНИЕ: На этом этапе флуоресцентно меченые мкгели могут быть визуализированы на конфокальном микроскопе для количественной оценки размера микрогеля (рисунок 1C-E)9. Методы измерения размера микрогелей были подробно описаны Roosa et al.17.
- Сушка микрогелей HA-NB
- Перенесите очищенные мкгели (рисунок 2А) в криобезопасную винтовую трубку с помощью пипетки с положительным смещением. Добавьте 70% этанола к очищенным мкгелям 50% (v/v) и хорошо перемешайте с вытесняющей пипеткой. Центрифуга в течение 5 мин при 5 000 х г.
ВНИМАНИЕ: Этанол является легковоспламеняющимся веществом.
ПРИМЕЧАНИЕ: Криобезопасную трубку с винтовой крышкой можно взвесить перед добавлением мкгелей, а затем снова взвесить после лиофилизации для определения массы мкгелей. Это рекомендуется для минимизации погрешности при использовании в количествах менее 1 мг. Убедитесь, что весы внутренне отрегулированы или откалиброваны перед использованием. - Аспирировать надосадочную жидкость и заменить 70% этанолом (50% v/v) (рисунок 2B). Хорошо перемешать с вытесняющей пипеткой. Инкубировать в течение ночи при 4 °C.
ПРИМЕЧАНИЕ: Микрогели могут храниться в 70% этаноле при 4 °C до лиофилизации для длительного хранения, если это необходимо. Лиофилизированные микрогели показаны на рисунке 2C. Другие лиофилизационные среды могут быть использованы на этом этапе, если требуется образование криогеля (рисунок 2D). - Кратковременно центрифугу, чтобы убедиться, что мкгели находятся в нижней части трубки с винтовой крышкой. Добавьте жидкий азот в криогенный контейнер, а затем добавьте пробирку с мкгелями для мгновенной заморозки.
- Через 5-10 мин снимите пробирку с мкгелями щипцами. Быстро снимите колпачок и накройте тканью лабораторного класса. Закрепите ткань резинкой и перенесите в контейнер для лиофилизации или камеру.
- Загрузите образец на лиофилизатор в соответствии с инструкциями производителя. Лиофилизируют при 0,066 торра и -63 °C. Хранить лиофилизированные мкгели (лио-мкгели) плотно закрытыми при комнатной температуре.
ПРИМЕЧАНИЕ: Лиофилизация завершается, когда из пробирки удаляется вся жидкость и остается высушенный продукт. Органические растворители могут уменьшить долговечность резиновых светильников на обычных системах лиофилизации.
- Перенесите очищенные мкгели (рисунок 2А) в криобезопасную винтовую трубку с помощью пипетки с положительным смещением. Добавьте 70% этанола к очищенным мкгелям 50% (v/v) и хорошо перемешайте с вытесняющей пипеткой. Центрифуга в течение 5 мин при 5 000 х г.
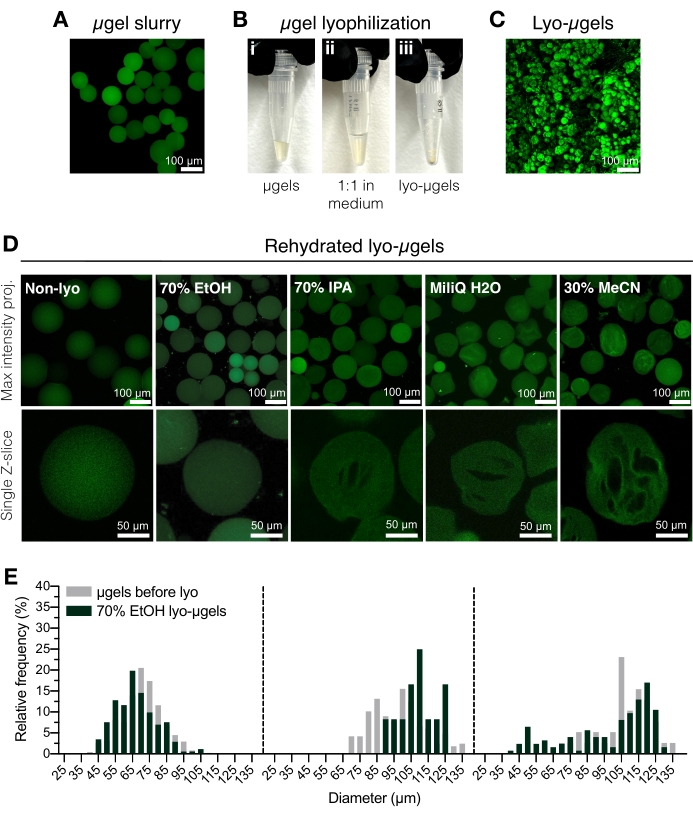
Рисунок 2: Сушка микрогелей HA-NB. (A) Проекция максимальной интенсивности мкгелей в водном растворе (шкала бар = 100 мкм). (B) Очищенные мкгели могут быть инкубированы 1:1 по объему в лиофилизационной среде выбора и лиофилизированы. (C) Проекция максимальной интенсивности высушенных лио-мкгелей (шкала бар = 100 мкм). (D) Микрогели повторно суспендируются после лиофилизации. EtOH (70%) рекомендуется для сохранения исходных свойств мкгелей на протяжении всего процесса лиофилизации; однако другие среды, такие как изопропиловый спирт (IPA), вода и ацетонитрил (MeCN), могут использоваться взаимозаменяемо для облегчения образования криогеля (шкала бар = 100 или 50 мкм, как отмечалось). (E) Измерение диаметра микрогеля HA-NB до (серый) и после лиофилизации (зеленый) в 70% EtOH показано как распределение частот для трех популяций микрогелей. Перепечатано из Anderson et al.12 с разрешения Elsevier. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Изготовление строительных лесов MAP
- Синтез тетразинового линкера
ПРИМЕЧАНИЕ: Тетразиновые линкеры могут быть использованы для соединения μgels, несущих свободные норборненовые группы (рисунок 3A). Процедуру синтеза ГК-тетразина (ГК-Тет) адаптировали из Zhang et al.18 с использованием 79 кДа натрия ГК с молярными эквивалентами 1:1:0,25 ГК-повторных единиц к ДМТММ до тетразин-амина (Рисунок 3В)12.- Взвесьте реагенты. Растворить ГК при 20 мг/мл в 200 мМ MES буфере (рН ~6) путем перемешивания в стакане или колбе на перемешиваемой пластине. После растворения добавьте ДМТМм в раствор ГК и дайте вступить в реакцию в течение приблизительно 20 мин при комнатной температуре. Например, можно использовать 100 мг ГК + 72,8 мг ДМТММ + 14,14 мг тетразин-амина.
- Растворить тетразин-амин в 15 мг/мл в буфере MES 200 мМ и добавить по каплям в раствор HA/DMTMM. Обратитесь к рисунку 3C для установки реакции HA-Tet.
- Добавьте парапленку к открытию реакционного сосуда, чтобы свести к минимуму испарение, и накройте реакционный сосуд фольгой. Продолжайте помешивать, давая реакции продолжаться в течение примерно 24 ч.
- Через 24 ч охладите 200 стойким этанолом (примерно в 10 раз больше реакционного объема). На перемешиваемой пластине переложите реакцию по каплям на охлажденный этанол, чтобы вывести в осадок ГК-Тет (рисунок 3D) и продолжайте перемешивание в течение 20 мин.
- Переложите раствор на конические пробирки объемом 50 мл, а затем центрифугу на 5000 х г в течение 10 мин. Высыпьте избыток этанола для утилизации в качестве отходов. Вытяните вакуум на HA-Tet в осушителе для высыхания в течение ночи. Пример высушенного продукта на этом этапе протокола можно найти на рисунке 3E.
- Очистите ГК-Тет с помощью диализа. Растворить HA-Tet в 2 М растворе NaCl и перенести в диализную трубку целлюлозы с отсечкой молекулярной массы 12-14 кДа. Переложите заполненную диализную трубку в ведро с 5 л сверхчистой воды и диализуйте HA-Tet против воды на ночь.
- На следующий день вынуть воду и заменить 1 М раствором NaCl в течение 30 мин. Удалите раствор NaCl, а затем диализуйте против сверхчистой воды в течение 3 дней, заменяя воду ежедневно.
- Отфильтруйте диализованный продукт с помощью вакуумного фильтра 0,2 мкм, а затем перенесите отфильтрованный продукт HA-Tet в конические трубки объемом 50 мл.
- Восплывают конические трубки в жидком азоте в течение 10 мин, а затем удаляют конические трубки щипцами. Быстро снимите колпачок и накройте тканью лабораторного класса. Закрепите ткань резинкой и перенесите в контейнер для лиофилизации или камеру и лиофилизируйте. Хранить лиофилизированный продукт (рисунок 3F) при температуре -20 °C.
- Количественное определение модификации тетразина путем растворения HA-Tet при 10 мг/мл вD2Oи анализа с помощью протонного ЯМР (рисунок 3G)16.
- Чтобы определить величину функционализации, сначала откалибруйте пик растворителяD2O до 4,8 PPM. Интегрируйте пик для метилпротонов ГК (δ2,05) и откалибруйте интеграцию до 3,0. Затем интегрируем пики для подвесных тетразиновых групп при δ8,5 (2H) и δ7,7 (2H) (ароматические протоны). Нормализуют интегрирование этих пиков в соответствующее число протонов для определения средней степени модификации12.
- Взаимосвязь лио-мкгелей для формирования каркасов MAP для характеристики
- Подготовьте компоненты каркаса MAP (т.е. мкгели, HA-Tet, объем регидратации). Взвесьте лио-мкгели (рисунок 4А) и восстановите в 84% конечного объема MAP в 1x PBS. Дайте микрогелям набухнуть в течение приблизительно 20 мин (рисунок 4B,C). Мас.% MAP, используемый для регидратации, может быть выбран на основе предпочтений пользователя в отношении конечной фракции частиц (см. рисунок 4D, E).
- Растворите ГК-Тет в 1x PBS в выбранной концентрации (см. ПРИМЕЧАНИЕ ниже).
ПРИМЕЧАНИЕ: Изменение как фракции упаковки (через мас.% MAP), так и концентрации HA-Tet приведет к изменению механических свойств каркаса. Например, каркас MAP 3,4 мас.% сшитый с 0,02 мг/мл HA-Tet (коэффициент отжига 2,6 моль Tet:mol HA-NB) генерирует каркасы MAP с модулем хранения сдвига приблизительно 700 Па12. - Используйте вытесняющую пипетку, чтобы соединить HA-Tet и лио-мкгели и хорошо перемешать. На этом этапе смесь может быть перенесена с помощью вытесняющей пипетки на стеклянные слайды, пластины колодцев или контейнер по выбору пользователя. Дайте мкгелям отжигнуть при 37 °C в течение 25 мин, а затем используйте шпатель для переноса каркасов MAP на плиты скважин, заполненные 1x PBS. Храните каркасы MAP в 1X PBS до тех пор, пока они не будут готовы к характеристике.
- Вычисление фракции частиц каркаса MAP
- Для улучшения качества изображения перенесите каркас MAP на стеклянный покров с помощью шпателя. Изображение каркасов MAP на конфокальном микроскопе с использованием лазера для возбуждения и излучения FITC. Изобразите каркас MAP на 20-кратном объективе и получите Z-стек, проходящий 250-300 мкм в Z-направлении с размером шага 2,5 мкм. Запишите калибровку изображения по мкм/пикселю.
- Импортируйте изображение Z-стека в программное обеспечение для анализа (см. Таблицу материалов). Нажмите кнопку Добавить новые поверхности . Установите флажок Сегментировать только интересующую область, а затем нажмите синюю кнопку со стрелкой Далее: Интересующая область.
- Определите интересующую область, отслеживая X-, Y- и Z-измерения анализируемого объема. Нажмите синюю кнопку со стрелкой Далее: Исходный канал.
ПРИМЕЧАНИЕ: X- и Y-измерения находятся в единицах пикселей, в то время как Z-размерность - это количество шагов. Рекомендуемая Z-высота для интересующей области должна включать не менее двух мкгелей. - Используйте раскрывающийся список Исходный канал , чтобы выбрать канал FITC. Установите флажок Smooth (Гладкий ) и введите деталь поверхности 2,50 мкм. В разделе Пороговое значение выберите Абсолютная интенсивность, а затем нажмите синюю кнопку со стрелкой Далее: Пороговое значение.
- Используйте рекомендуемое пороговое значение для канала FITC. Поверните 3D-проекцию, чтобы оценить качество рендеринга и настроить его по мере необходимости. Выберите Далее: Классификация поверхностей.
ПРИМЕЧАНИЕ: Кнопка «Назад» может использоваться для редактирования предыдущих шагов процесса, таких как Z-измерение, по мере необходимости. - Проверьте, равно ли Число вокселей 10.0, а затем нажмите зеленую кнопку с двойной стрелкой Готово: Выполните все шаги создания и завершите работу мастера.
ПРИМЕЧАНИЕ: Параметры рендеринга тома могут быть сохранены для пакетного анализа, так что те же настройки применяются для анализа всех скаффолдов. - Чтобы экспортировать данные, перейдите на вкладку Статистика , а затем на вкладку Подробно . Используйте второй раскрывающийся список, чтобы выбрать переменную Volume. Нажмите кнопку Экспорт статистики на дискете на вкладке Отобразить в файл и сохраните ее в виде файла электронной таблицы (.xls) при появлении соответствующего запроса.
- Откройте файл и используйте функцию СУММ в столбце A Volume для определения общего объема (мкм3) мкгелей в интересующей области.
- Преобразуйте размеры интересующей области, которая была проанализирована, из пикселей в мкм. Используйте калибровку изображения мкм/пиксель из шага 4.3.1 для преобразования X- и Y-размеров. Умножьте Z-размерность (количество шагов) на размер шага для изображения, чтобы преобразовать Z-размерность в мкм. Рассчитайте объем интересующей области (мкм3), умножив X-, Y- и Z-измерения.
- Чтобы определить долю частиц каркаса, разделите общий объем мкгелей в интересующей области (найденной на этапе 4.3.8) на объем интересующей области (найденной на этапе 4.3.9).
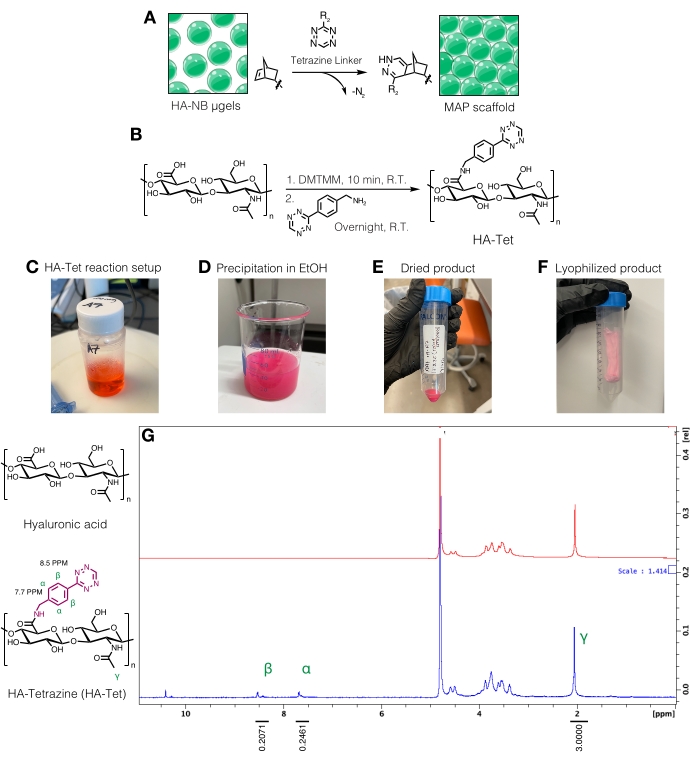
Рисунок 3: Синтез тетразинового линкера для изготовления каркасов микропористых отожженных частиц (MAP). (A) Схема мкгелей HA-NB, связанных с тетразиновым линкером для формирования каркасов MAP. (B) Схема реакции для синтеза HA-Tet. (C) Реакция HA-Tet была настроена и позволила вступить в реакцию в течение ночи с последующим (D) осаждением HA-Tet в этаноле. (E) После очистки и сушки HA-Tet регидратировали и лиофилизировали с получением (F) высушенного светло-розового продукта. (G) Протонный ЯМР-анализ показывает успешную модификацию 11% повторных единиц ГК. Перепечатано из Anderson et al.12 с разрешения Elsevier. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
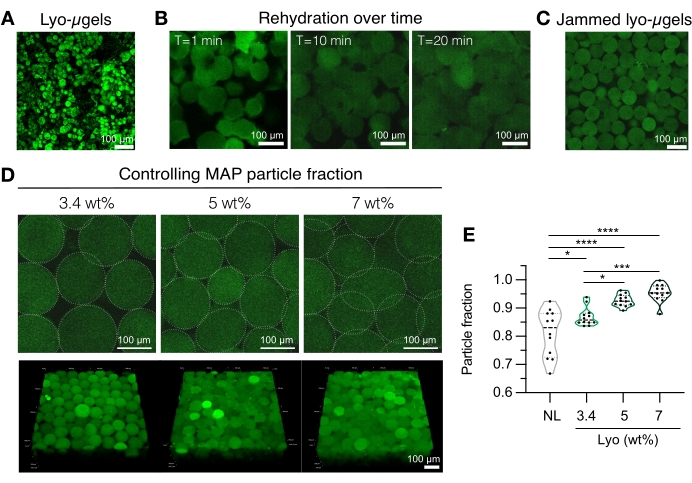
Рисунок 4: Регидратация лиофилизированных микрогелей для изготовления каркасов MAP. (A) Проекция максимальной интенсивности высушенных лио-мкгелей (шкала бар = 100 мкм). (B) После сублимационной сушки показано, что регидратация лио-мкгелей занимает приблизительно 20 мин (шкала бар = 100 мкм). (C) Лио-мкгели могут быть регидратированы при различном мас.% MAP для получения застрявших мкгелей (шкала бар = 100 мкм). (D) Увеличение мас.% MAP при регидратации лио-мкгелей изменяет фракцию частиц в каркасах MAP, как показывают одиночные Z-срезы каркасов MAP и проекции объема (шкала бар = 100 мкм). (E) С помощью этих определяемых пользователем каркасов MAP можно получить уникальные фракции частиц (NL = нелиофилизированные мкгели). На образцах проводили одностороннюю ANOVA с Tukey HSD (n = 3), со значимостью, сообщенной при p < 0,05 (*), p < 0,01 (**), p < 0,005 (***) и p < 0,001 (****). Перепечатано из Anderson et al.12 с разрешения Elsevier. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5.3D клеточная культура в каркасах карты
- Подготовка устройств для культивирования клеток
- Чтобы создать пользовательское устройство для культивирования клеток для этих экспериментов (рисунок 5A-C), используйте 3D-принтер для печати отрицательной формы с помощью файла CAD, найденного в файле дополнительного кодирования 1.
ПРИМЕЧАНИЕ: Размеры устройства для культивирования клеток следующие: 94,9 мм x 94,9 мм x 4,8 мм при общей высоте скважины 2,6 мм. Диаметр внутренних и наружных скважин составляет 4 мм и 6 мм соответственно. - Смешайте основание эластомера полидиметилсилоксана (PDMS) с отверждающим агентом в соотношении 10:1 по массе. Налейте смесь PDMS в большую пластиковую чашку Петри и дегазируйте в осушителе примерно на 30 минут или до тех пор, пока все пузырьки не исчезнут.
- Как только все пузырьки исчезнут, аккуратно поместите 3D-печатную форму в PDMS, чтобы свести к минимуму образование новых пузырьков. Поместите в духовку при температуре 60 °C не менее 2 ч для отверждения PDMS.
- С помощью ножа или лезвия бритвы аккуратно проследить параметр культурального устройства, а затем аккуратно удалить форму. Используйте 4 мм биопсийный перфоратор, чтобы удалить любую PDMS со дна колодцев. Вырежьте устройства, чтобы они поместились на стеклянной крышке.
ПРИМЕЧАНИЕ: Устройства для культивирования клеток также могут быть прикреплены к стеклянным слайдам, но стеклянные крышки улучшают визуализацию образцов. - Используйте ленту для удаления пыли с нижней стороны устройств для культивирования. Поместите прозрачные стеклянные крышки и устройства для культивирования (снизу вверх) на конфорку при температуре 135 °C не менее чем на 15 минут для удаления влаги.
- В вытяжном капюшоне используйте коронную плазменную пушку как на стеклянной крышке, так и на нижней стороне устройства в течение 30 с, а затем быстро свяжите обработанные поверхности вместе. Осторожно нажмите, чтобы обеспечить хорошее уплотнение между устройством для культивирования и стеклянным покровом.
- Повторите шаг 5.1.6 для всех устройств, а затем поместите в печь с температурой 60 °C на ночь, чтобы закрепить сцепление. Автоклав устройств для стерилизации перед использованием in vitro.
- Чтобы создать пользовательское устройство для культивирования клеток для этих экспериментов (рисунок 5A-C), используйте 3D-принтер для печати отрицательной формы с помощью файла CAD, найденного в файле дополнительного кодирования 1.
- Клеточная культура в каркасах MAP
- Подготовьте компоненты каркаса MAP (т.е. мкгели, HA-Tet, объем среды) на основе желаемой фракции частиц (см. рисунок 4D-E). Взвесьте лио-мкгели в стерильной вытяжке и восстановите в 84% конечного объема MAP клеточных сред на основе выбранного мас.% MAP. Дайте мкгелям набухнуть в течение примерно 20 минут.
ПРИМЕЧАНИЕ: Эти методы требуют, чтобы пользователь взвешивал лио-микрогельовый продукт для регидратации. Для небольших масс (1 мг или менее) предлагается сначала взвесить криотрубу перед добавлением и лиофилизацией мкгелей, а затем перевзвешивать трубку после лиофилизации, чтобы определить массу продукта для минимизации погрешности. - Растворяют HA-Tet в клеточных средах в 16% от конечного объема MAP.
ПРИМЕЧАНИЕ: Следующие этапы подготовки клеток к посеву в каркасах MAP могут быть изменены в зависимости от типа используемой ячейки. В этом протоколе мезенхимальные клетки мыши D1 выращивались в модифицированной орлиной среде Dulbecco (DMEM), дополненной 1% пенициллин-стрептомицином (pen-strep) и 10% фетальной бычьей сывороткой (FBS) (см. Таблицу материалов). Для этих клеток должны соблюдаться стандартные протоколы клеточных культур, при этом культуры поддерживаются при 37 °C и 5% CO2 в сосудах, обработанных культурой тканей. - Как только мезенхимальные клетки мыши D1 достигнут 70%-80% конфлюзии, аспирируют среду и промывают клетки с 1x PBS. Поднимите клетки, добавив достаточный объем 1% трипсина-ЭДТА для покрытия поверхности сосуда культуры ткани. Инкубируют при 37 °C в течение 1-3 мин, а затем гасят трипсинизацию, добавляя DMEM-среду, дополненную 1% стрептококком и 10% FBS при 2-кратном объеме трипсина-ЭДТА.
- Центрифугируют клеточную суспензию при 100 х г в течение 5 мин при комнатной температуре, чтобы гранулировать ячейки. Аспирировать надосадочную среду и повторно суспендировать клетки в 1 мл DMEM среды, дополненной 1% пен-стрептококком и 10% FBS.
- Убедитесь, что клеточная суспензия хорошо перемешана, а затем перенесите 20 мкл в новую микроцентрифужную трубку. Добавить 20 мкл раствора трипана синего цвета и хорошо перемешать. Используйте 20 мкл этой смеси для подсчета клеток с помощью гемоцитометра или автоматизированного счетчика клеток с слайдами камеры подсчета клеток.
- Перенесите количество клеток, необходимое для посева 10 000 клеток/мкл MAP, в новую микроцентрифужную трубку. Центрифуга при 100 х г в течение 5 мин при комнатной температуре гранулирует ячейки. Осторожно аспирируйте надосадочную среду из клеточной гранулы, не аспирируя клетки.
- Добавьте мкгели и сшиватель в гранулу ячейки с помощью вытесняющей пипетки. Хорошо перемешать с вытесняющей пипеткой, а затем посеять по 10 мкл смеси на лунку. При обшивке пипетку круговыми движениями равномерно распределить смесь в лунке.
- Дайте мкгелям отжигнуть при 37 °C в клеточном инкубаторе в течение 25 мин перед добавлением клеточной среды для заполнения лунок (~50 мкл среды на лунку). Поддерживайте 3D-культуры при температуре 37 °C и меняйте носитель по мере необходимости. Чтобы избежать аспирации каркаса при смене среды, стабилизируйте кончик пипетки вдоль гребня верхнего колодца.
ПРИМЕЧАНИЕ: При добавлении или удалении жидкости из культуральных скважин положите конец наконечника пипетки на уступ над каркасом MAP, чтобы свести к минимуму вероятность разрушения или аспирации каркаса из скважины. - В нужные моменты времени фиксируют образцы, удаляя носитель и добавляя 50 мкл 4% параформальдегида на лунку в течение 30 мин при комнатной температуре. Промывайте образцы 3x с 50 мкл 1x PBS или предпочтительным буфером. На этом этапе протокола могут соблюдаться стандартные методы иммунофлуоресцентного или флуоресцентного окрашивания, используя 50 мкл на колодец в качестве рабочего объема.
ПРИМЕЧАНИЕ: Эти методы фиксации и окрашивания клеток конкретно описывают использование флуоресцентных пятен; однако иммуноокрашивание первичными и/или вторичными конъюгациями антител может быть выполнено в этих каркасах, а также в соответствии с инструкциями производителя с использованием 50 мкл в качестве рабочего объема на лунку. - Изобразите ячейки в каркасах MAP на конфокальном микроскопе с помощью 20-кратного объектива и получите Z-стек, проходящий 200-250 мкм в Z-направлении с размером шага 2,5 мкм. Пример флуоресцентного окрашивания DAPI (ядерное окрашивание, разбавленное 1:1000 в 0,15% Triton-X в 1x PBS) и фаллоидином-647 (F-актиновое пятно, разбавленное 1:40 в 0,15% Triton-X в 1x PBS) показано на рисунке 5E, F с фиксированными клетками D1, культивируемыми в каркасах MAP в течение 3 дней.
ПРИМЕЧАНИЕ: Плазменная обработка стеклянных поверхностей приводит к повышению гидрофильности, которая, как было показано, усиливает адгезию клеток. Вероятно, будет наблюдаться распространение клеток вдоль нижней части колодцев клеточной культуры, но их не следует включать в подсчет клеток или количественную оценку объема клеток для оценки реакции клеток в каркасах MAP.
- Подготовьте компоненты каркаса MAP (т.е. мкгели, HA-Tet, объем среды) на основе желаемой фракции частиц (см. рисунок 4D-E). Взвесьте лио-мкгели в стерильной вытяжке и восстановите в 84% конечного объема MAP клеточных сред на основе выбранного мас.% MAP. Дайте мкгелям набухнуть в течение примерно 20 минут.
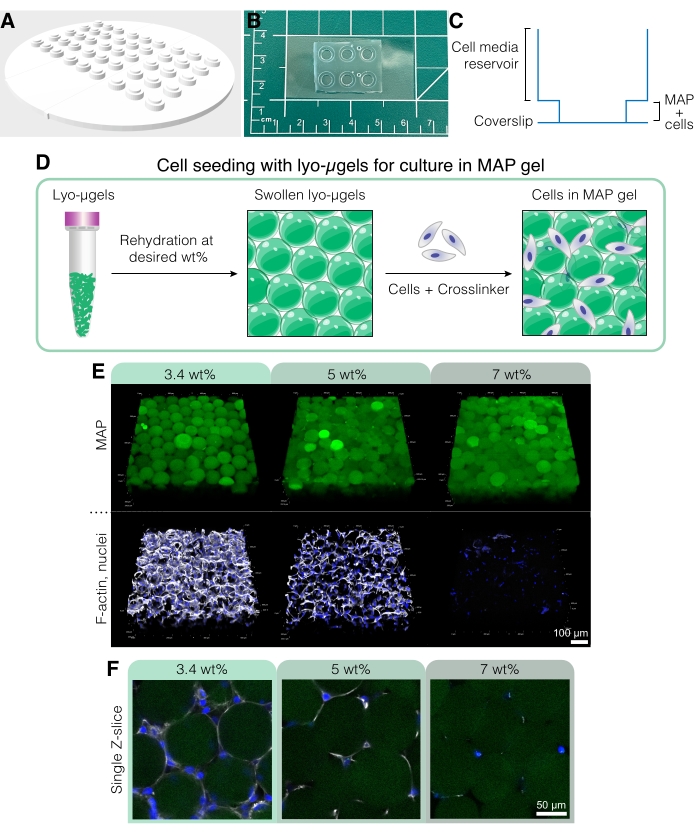
Рисунок 5: Клеточная культура в каркасах MAP. (A) Форма для создания колодцев клеточных культур может быть напечатана на 3D-принтере и отлита с помощью PDMS. Вся форма имеет диаметр 95 мм, большие скважины - 6 мм в диаметре, а маленькие внутренние колодцы - 4 мм в диаметре. (B) После литья с помощью PDMS устройства клеточной культуры связываются плазмой с покровными листами для улучшения возможностей микроскопии. (C) Поперечное сечение колодца клеточной культуры изображает резервуар для клеточных сред (~50 мкл) и меньший резервуар для посева каркаса MAP с ячейками (~10 мкл). (D) Процесс посева клеток в каркасах MAP сначала основывается на регидратации лио-мкгелей на желаемом пользователем мас.%, а затем смешивании с клетками и сшивателем для взаимосвязи мкгелей. (E) Ячейки могут быть инкапсулированы в каркасы MAP (зеленый) с различным мас.% MAP. Репрезентативные изображения относятся к 5-му дню культуры клеток D1 в каркасах MAP (шкала = 100 мкм). (F) Одиночные Z-срезы показывают различия в росте клеток в каркасах, содержащих различные мас.% MAP (шкала = 50 мкм). Перепечатано из Anderson et al.12 с разрешения Elsevier. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Целью данного протокола является демонстрация подготовки микропористых отожженных частиц (MAP) каркасов с биоортогональной схемой сшивания, а также контролируемых фракций частиц для 3D клеточной культуры. Во-первых, ГК была модифицирована норборненовыми подвесными группами для исполь?...
Обсуждение
Было показано, что микрофлюидное производство микрогелей HA-NB генерирует микрогели с более узким диапазоном распределения по размерам, чем периодическое производство эмульсий 3,9. Микрогели, описанные в этом протоколе, были сформулированы с использовани?...
Раскрытие информации
ARA и TS подали предварительный патент на эту технологию.
Благодарности
Авторы хотели бы поблагодарить Национальные институты здравоохранения, Национальные институты неврологических расстройств и инсульта (1R01NS112940, 1R01NS079691, R01NS094599) и Национальный институт аллергии и инфекционных заболеваний (1R01AI152568). Эта работа была выполнена частично в Центре приборостроения общих материалов Университета Дьюка (SMIF), члене Нанотехнологической сети Исследовательского треугольника Северной Каролины (RTNN), которая поддерживается Национальным научным фондом (номер награды ECCS-2025064) в рамках Национальной скоординированной инфраструктуры нанотехнологий (NNCI). Авторы хотели бы поблагодарить бывшего постдока лаборатории доктора Лукаса Ширмера, а также Итана Никлоу за их помощь в создании 3D-печатного устройства для экспериментов с клеточными культурами.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309628 | |
| 5 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309646 | |
| Alexa Fluor 488 C5 maleimide | Invitrogen | A10254 | For synthesis of fluorescently-labeled tetrazine |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | For staining cell culture samples |
| Aluminum foil | VWR | 89107-726 | |
| Biopsy punch with plunger, 1.0 mm | Integra Miltex | 69031-01 | |
| Biopsy punch, 4 mm | Integra Miltex | 33-34 | |
| Blunt needle, 23 G 0.5", Non-Sterile, Capped | SAI Infusion Technologies | B23-50 | |
| Bottle-top vacuum filter, 0.22 μm | Corning | CLS430521 | |
| Calcium chloride | VWR | 1B1110 | For microgel washing buffer |
| Capillary-piston assemblies for positive-displacement pipettes, 1000 μL max. volume | Rainin | 17008609 | |
| Capillary-piston assemblies for positive-displacement pipettes, 25 μL max. volume | Rainin | 17008605 | |
| Capillary-piston assemblies for positive-displacement pipettes, 250 μL max. volume | Rainin | 17008608 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Centrifuge tube, 15 mL | CELLTREAT | 667015B | |
| Centrifuge tube, 50 mL | CELLTREAT | 229421 | |
| Chloroform, ACS grade, Glass Bottle | Stellar Scientific | CP-C7304 | For synthesis of fluorescently-labeled tetrazine |
| Corona plasma gun, BD-10A High Frequency Generator | ETP | 11011 | |
| CryoTube Vials, Polypropylene, Internal Thread with Screw Cap | Nunc | 368632 | |
| D1 mouse mesenchymal cells | ATCC | CRL-12424 | Example cell line for culture in MAP gels |
| DAPI | Sigma-Aldrich | D9542 | For staining cell culture samples |
| Deuterium oxide, 99.9 atom% D | Sigma-Aldrich | 151882 | For NMR spectroscopy |
| Dialysis tubing, regenerated cellulose membrane, 12-14 kDa molecular weight cut-off | Spectra/Por | 132703 | For purifying HA-NB and HA-Tet |
| Diethyl ether | VWR | BDH1121-4LPC | For synthesis of fluorescently-labeled tetrazine |
| Dimethylformamide | Sigma-Aldrich | 277056 | For synthesis of fluorescently-labeled tetrazine |
| 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride (DMTMM) | TCI-Chemicals | D2919 | For modifying HA |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | Non-degradable dithiol linker (substitute for MMP-cleavable peptide) |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | D6429-500ML | For D1 cell culture |
| EMS Paraformaldehyde, Granular | VWR | 100504-162 | For making 4% PFA |
| Ethanol absolute (200 proof) | KOPTEC | 89234-850 | |
| Fetal bovine serum (FBS) | ATCC | 30-2020 | For D1 cell culture |
| Heating Plate | Kopf Instruments | HP-4M | |
| Hemacytometer with coverglass | Daigger Scientific | EF16034F | |
| 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Sodium hyaluronate, 79 kDa average molecular weight, produced in bacteria Streptococcus zooepidemicus, pharmaceutical grade, microbial contamination <100 CFU/g, bacterial endotoxins <0.050 IU/mg | Contipro | N/A | 79 kDa average molecular weight was used for HA-Tet synthesis, but these methods could be adapted for other molecular weights. |
| IMARIS Essentials software package | Oxford Instruments | N/A | Microscopy image analysis software |
| Infusion pump, dual syringe | Chemyx | N/A | |
| Kimwipe | Kimberly-Clark | 34120 | |
| Laboratory stand with support lab clamp | Geyer | 212100 | |
| Liquid nitrogen | Airgas | NI 180LT22 | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate | TCI-Chemicals | L0290 | |
| Lyophilizer | Labconco | N/A | Labconco FreeZone 6 plus has been discontinued, but other lab grade console freeze dryers could be used for this protocol. |
| Methyltetrazine-PEG4-maleimide | Kerafast | FCC210 | For synthesis of fluorescently-labeled tetrazine |
| 2-(4-Morpholino)ethane Sulfonic Acid (MES) | Fisher Scientific | BP300-100 | For modifying HA |
| Micro cover glass, 24 x 60 mm No. 1 | VWR | 48393-106 | |
| Microfluidic device SU8 master wafer | FlowJem | Custom design made either in-house in clean room or outsourced | |
| Mineral oil, heavy | Sigma-Aldrich | 330760 | |
| MMP-cleavable dithiol crosslinker peptide (Ac-GCRDGPQGIWGQDRCG-NH2) | GenScript | N/A | |
| 5-Norbornene-2-methylamine | TCI-Chemicals | 95-10-3 | For HA-NB synthesis |
| Packing tape | Scotch | 3M 1426 | |
| Parafilm | Bemis | PM996 | |
| PEG(thiol)2 | JenKem Technology USA | A4001-1 | For synthesis of fluorescently-labeled tetrazine |
| Penicillin-Streptomycin, 10,000 units/mL | Thermo Fisher Scientific | 15140122 | For D1 cell culture |
| Petri dish, polystyrene, disposable, Dia. x H=150 x 15 mm | Corning | 351058 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | For washing HMPs |
| Phosphate buffered saline (PBS) 1x | Gibco | 10010023 | |
| RainX water repellent glass treatment | Grainger | 465D20 | Synthetic hydrophobic treatment solution for microfluidic device treatment |
| RGD peptide (Ac-RGDSPGERCG-NH2) | GenScript | N/A | |
| Rubber bands | Staples | 112417 | |
| Sodium chloride | Chem-Impex | 30070 | For dialysis |
| Span 80 for synthesis | Sigma-Aldrich | 1338-43-8 | |
| Sylgard 184 Silicone Elastomer | Electron Microscopy Science | 4019862 | polydimethylsiloxane (PDMS) elastomer for making microfluidic devices and tissue culture devices |
| Syringe filter, Whatman Uniflo, 0.2 μm PES, 13 mm diameter | Cytvia | 09-928-066 | |
| Tetraview LCD digital microscope | Celestron | 44347 | |
| Tetrazine-amine HCl salt | Chem-Impex | 35098 | For HA-Tet synthesis |
| Triethylamine | Sigma-Aldrich | 471283 | For synthesis of fluorescently-labeled tetrazine |
| Tris(2-carboxyethyl)phosphine (TCEP) | Millipore Sigma | 51805-45-9 | |
| Triton X-100 | VWR | 97063-864 | |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| Trypsin EDTA (0.25%), Phenol red | Fisher Scientific | 25-200-056 | For lifting adherent cells to seed in MAP gels |
| Tygon ND-100-80 Non-DEHP Medical Tubing, Needle Gauge=23, Wall Thickness=0.020 in, Internal diameter = 0.020, Outer diameter = 0.060 in | Thomas Scientific | 1204G82 | |
| UV curing system controller, LX500 LED | OmniCure | 010-00369R | |
| UV curing head, LED spot UV | OmniCure | N/A | |
| UV light meter, Traceable | VWR | 61161-386 | |
| Vacuum dessicator | Bel-Art | 08-594-15C | |
| X-Acto Z Series Precision Utility Knife | Elmer's | XZ3601W |
Ссылки
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Darling, N. J., et al. Click by click Microporous Annealed Particle (MAP) scaffolds. Advanced Healthcare Materials. 9 (10), 1901391 (2020).
- Truong, N. F., et al. Microporous annealed particle hydrogel stiffness, void space size, and adhesion properties impact cell proliferation, cell spreading, and gene transfer. Acta Biomaterialia. 94, 160-172 (2020).
- Pfaff, B. N., et al. Selective and improved photoannealing of Microporous Annealed Particle (MAP) scaffolds. ACS Biomaterials Science & Engineering. 7 (2), 422-427 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science & Engineering. 2 (11), 2034-2041 (2016).
- Caldwell, A. S., Campbell, G. T., Shekiro, K. M. T., Anseth, K. S. Clickable microgel scaffolds as platforms for 3D cell encapsulation. Advanced Healthcare Materials. 6 (15), 1700254 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Wilson, K. L., et al. Stoichiometric post modification of hydrogel microparticles dictates neural stem cell fate in microporous annealed particle scaffolds. Advanced Materials. 34 (33), 2201921 (2022).
- Muir, V. G., Qazi, T. H., Shan, J., Groll, J., Burdick, J. A. Influence of microgel fabrication technique on granular hydrogel properties. ACS Biomaterials Science & Engineering. 7 (9), 4269-4281 (2021).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3D printing applications. Advanced Science. 6 (1), 1801076 (2018).
- Anderson, A. R., Nicklow, E., Segura, T. Particle fraction as a bioactive cue in granular scaffolds. Acta Biomaterialia. 150, 111-127 (2022).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. R. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step variable height photolithography for valved multilayer microfluidic devices. Journal of Visualized Experiments. (119), e55276 (2017).
- JoVE. Nuclear Magnetic Resonance (NMR) Spectroscopy. JoVE Science Education Database. Organic Chemistry. JoVE. , (2022).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. Journal of Visualized Experiments. (184), e64119 (2022).
- Zhang, H., Dicker, K. T., Xu, X., Jia, X., Fox, J. M. Interfacial bioorthogonal crosslinking. ACS Macro Letters. 3 (8), 727-731 (2014).
- Welzel, P. B., et al. Cryogel micromechanics unraveled by atomic force microscopy-based nanoindentation. Advanced Healthcare Materials. 3 (11), 1849-1853 (2014).
- Plieva, F., Huiting, X., Galaev, I. Y., Bergenståhl, B., Mattiasson, B. Macroporous elastic polyacrylamide gels prepared at subzero temperatures: control of porous structure. Journal of Materials Chemistry. 16 (41), 4065-4073 (2006).
- Rommel, D., et al. Functionalized microgel rods interlinked into soft macroporous structures for 3D cell culture. Advanced Science. 9 (10), 2103554 (2022).
- Kurt, E., Segura, T. Nucleic acid delivery from granular hydrogels. Advanced Healthcare Materials. 11 (3), 2101867 (2021).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science & Engineering. 5 (12), 6395-6404 (2019).
- Truong, N. F., Lesher-Pérez, S. C., Kurt, E., Segura, T. Pathways governing polyethylenimine polyplex transfection in Microporous Annealed Particle scaffolds. Bioconjugate Chemistry. 30 (2), 476-486 (2019).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147 (2019).
- Li, F., et al. Cartilage tissue formation through assembly of microgels containing mesenchymal stem cells. Acta Biomaterialia. 77, 48-62 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены