Method Article
Использование минимально инвазивных методов для оценки использования топлива и циркадных ритмов у пожилых людей
В этой статье
Резюме
Представлен новый и минимально инвазивный протокол для оценки синергетического влияния использования топлива и циркадных ритмов на стареющих людей с использованием мононуклеарных клеток периферической крови.
Аннотация
Старение связано с многочисленными физиологическими изменениями, которые синергетически и независимо друг от друга способствуют физической инвалидности и риску хронических заболеваний. Несмотря на то, что этиология возрастной физической инвалидности является сложной и многофакторной, снижение функции митохондрий, по-видимому, совпадает с прогрессированием функционального снижения у многих пожилых людей. Причина, по которой происходит снижение митохондриальной функции с возрастом, остается неясной, но новые научные данные указывают на то, что как топливный метаболизм, так и циркадные ритмы могут влиять на функцию митохондрий.
Недавние исследования установили, что циркадные ритмы нарушаются с возрастом, и что нарушенные циркадные ритмы имеют патологические последствия, которые влияют на функцию митохондрий и пересекаются со многими возрастными хроническими заболеваниями. Современные количественные методы прямой оценки функции митохондрий являются инвазивными и, как правило, требуют биопсии мышц, что может вызвать трудности с набором участников и приверженностью к исследованию, учитывая воспринимаемые уровни потенциальной боли и риска. Таким образом, был адаптирован инновационный и относительно неинвазивный протокол для оценки изменений в функции митохондрий на клеточном уровне и циркадных паттернов у пожилых людей. В частности, для оценки биоэнергетической функции митохондриальных клеток лейкоцитов в условиях дифференциальной доступности субстрата используется анализатор метаболических потоков в режиме реального времени.
Также анализируется экспрессия генов циркадных часов в белых кровяных клетках для перекрестной корреляции с митохондриальной биоэнергетикой и исходами циркадного ритма. Считается, что эти инновационные методологические подходы помогут будущим клиническим испытаниям, предоставив минимально инвазивные методы для изучения предпочтений митохондриального субстрата и циркадных ритмов у пожилых людей.
Введение
Достижения прошлого века привели к увеличению продолжительности жизни и численности стареющего населения. Заглядывая в будущее, прогнозируется, что процент взрослых в возрасте 65 лет и старше увеличится на 5% в период с 2020 по 2050 год в Соединенных Штатах1. Такое увеличение продолжительности жизни не предполагает увеличения продолжительности здоровья – периода жизни, связанного с самостоятельным функционированием. Реальность такова, что старение сопровождается бесчисленными биологическими изменениями, которые влияют на клеточный метаболизм и физиологию, вызывая постепенное снижение когнитивных ифизических функций. Поскольку ожидаемая продолжительность жизни человека продолжает увеличиваться, с возрастом4 лет возрастает потребность в сохранении функциональных способностей и независимости.
Давно известно, что снижение физической функции и самостоятельности с возрастом является многофакторным, хотя часто связано с возникновением хронических заболеваний и острыми провоцирующими событиями5. И наоборот, было показано, что это снижение физической работоспособности и мышечных характеристик связано с развитием инвалидности с возрастом без четкой связи с каким-либоодним заболеванием. В связи с трудностями в понимании точной этиологии хронических заболеваний и физической инвалидности, считается, что нарушения функции митохондрий совпадают с возникновением и прогрессированием хронических заболеваний и потерей физических функций у стареющих взрослых 7,8.
Митохондрии обеспечивают большую часть аденозинтрифосфата (АТФ), необходимого для многих клеточных процессов9. Сильно окисляющие ткани полагаются на митохондрии для адекватного производства энергии; со старением снижается окислительная способность и синтез митохондриального синтеза АТФ. Это снижение отчасти связано с окислительным повреждением митохондриальной ДНК (мтДНК), что приводит к постепенному накоплению мутаций и делеций мтДНК10. Накопление мутаций и делеций мтДНК приводит к снижению образования белков функциональной цепи переноса электронов, что приводит к снижению способности клеток продуцировать АТФ. Возрастное снижение митохондриальной функции наиболее заметно в тканях с высокой степенью окисления, таких как сердце и скелетныемышцы. Исследования показали, что митохондрии икроножной мышцы в старых образцах крыс демонстрируют примерно 50% снижение продукции и содержания АТФ по сравнению с более молодымиобразцами. Кроме того, было показано, что способность митохондриальных АТФ вырабатываться в скелетных мышцах человека снижается примерно на 8% за десятилетие жизни. Эти результаты свидетельствуют о том, что возрастное снижение митохондриальной функции может способствовать снижению выработки энергии в организмах.
Считается, что ключевым регулятором митохондриальной активности является коактиватор-1 рецептора γ (PPARγ), активируемого пролифератором пероксисом (PGC-1α)14. Ухудшение активности PGC-1α или снижение его численности приводит к снижению окислительной активности митохондрий и, как следствие, к нарушению выработки энергии. Кроме того, снижение качества митохондрий может повлиять на качество скелетных мышц и впоследствии привести к развитию или обострению саркопении, динапении и снижению функциональной способности15,16. Данные о связанном с возрастом одновременном снижении митохондриальной функции и качества скелетных мышц позволяют предположить связь между митохондриальными нарушениями и патогенезом функционального снижения17. Недавно это было подтверждено у пожилых людей, живущих в функциональных сообществах, что показывает, что снижение метаболизма митохондрий скелетных мышц предсказывает снижение подвижности вэтой популяции. Хотя точный механизм, приводящий к снижению митохондрий с возрастом, неясен, последние данные выявили взаимное взаимодействие между циркадными часами и функцией митохондрий, что имеет последствия для использования митохондриального топлива и биогенеза.
Утилизация топлива
На функцию митохондрий, по-видимому, влияет метаболизм топлива и тип топлива, используемого на клеточном уровне в скелетной мышечной ткани11. В периоды истощения топлива, особенно углеводного истощения у людей, предпочтения в топливе для производства (митохондриальной) энергии меняются. При низком уровне глюкозы предпочтение топлива смещается от глюкозы к жирным кислотам и кетоновым телам, полученным из кислот. Этот метаболический переключатель характеризуется повышением липидного обмена в адипоцитах с последующим повышенным выбросом кетонов в кровь4. Сдвиг в использовании топлива от глюкозы к кетонам при кетогенной диете, по-видимому, оказывает благотворное влияние на производство активных форм кислорода в митохондриях, антиоксидантную защиту, синтез АТФ и биогенез.
Метаболический переход от углеводного к липидному происходит в периоды низкой доступности питательных веществ в окружающей среде и когда запасы гликогена истощены. Когда это переключение инициируется, накопленные триглицериды расщепляются на глицерин, субстрат для глюконеогенеза, и свободные жирные кислоты, которые транспортируются в печень для окисления посредством β-окисления в ацетилкоэнзим А (ацетил КоА). Кетоновые тела синтезируются, главным образом, в печени, путем двухступенчатой конденсации трех молекул ацетил-КоА в β-гидрокси-β-метилглутарил-КоА, которые затем далее перерабатываются в кетоновые тела, включая ацетоацетат и 3-βэта гидроксибутират21. Эти кетоновые тела распределяются по тканям по всему телу, при этом наибольшее потребление происходит в сердце, мозге и скелетныхмышцах. С возрастом окисление митохондриальных жирных кислот нарушается, что влияет на метаболический переключатель22. Было высказано предположение, что нарушения в использовании митохондриального топлива приводят к дальнейшей митохондриальной дисфункции, которая, в свою очередь, способствует возрастным заболеваниями функциональному снижению.
Изменения потребления кислорода в митохондриях мононуклеарными клетками периферической крови (ПМЦ) были изучены для оценки закономерностей, связанных с дисфункцией и васкуляризацией. Hartman et al. провели исследование, целью которого было определить корреляцию между потреблением кислорода и дилатацией с различными эффектами, что, как было установлено, предполагает связь между митохондриальной дисфункцией и дисфункцией гладкомышечных клеток сосудов24. Что касается других органов, PBMC коррелируют с более высокими когнитивными функциями и функционированием мозга, что определено с помощью респирометрии25. Таким образом, биоэнергетика и способность к дыханию PBMC могут служить потенциальными биомаркерами для оценки функциональной способности органов или тканей по всему телу.
Циркадный ритм
Еще одним важным фактором, влияющим на здоровье митохондрий, является циркадный ритм. Циркадные ритмы – это ~24-часовые колебания в поведении и физиологии, которые происходят в отсутствие сигналов окружающей среды. Эти ритмы функционируют прогностическим образом, поддерживая системный и тканевый гомеостаз. Механизм, лежащий в основе циркадных ритмов, представляет собой петлю обратной связи по транскрипции-трансляции, называемую циркадными часами27. За последние 15 лет было продемонстрировано, что механизм циркадных часов существует практически во всех клеткахорганизма. В дополнение к сохранению времени, механизм молекулярных часов также вносит свой вклад в ежедневную программу экспрессии генов, называемую выходом циркадных часов29. Гены выхода часов уникальны для каждого типа тканей и функционально связаны с путями, важными для клеточного метаболизма, аутофагии, восстановления и гомеостаза. Последние данные показали, что здоровье митохондрий зависит от функции циркадных часов и влияет на функцию митохондрий, включая биогенез митохондрий, использование топлива и митофагию.
Новые данные как доклинических, так и клинических исследований показали, что на протяжении всего старения наблюдаются нарушения циркадныхритмов. К ним относятся нарушения нормальных циклов сна и бодрствования, уменьшение амплитуды ритмов температуры тела и задержка способности приспосабливаться к сдвигам в фазе31. В одном исследовании, например, была поставлена задача на циркадную систему взрослых и старых (20+ месяцев) мышей, сместив график освещения на 6 часов. Было обнаружено, что старым мышам потребовалось больше времени, чтобы привести свои паттерны активности в соответствие с новым световым графиком32. В соответствии с изменениями в циркадном поведении, анализ тканевых часов показал, что как центральные, так и периферические тканевые часы были нарушены в стареющей когорте.
Совсем недавно несколько групп провели транскриптомный анализ циркадных часов и выходных данных часов в различных тканях в возрасте33 лет. Результаты этих исследований подчеркивают, что с возрастом происходит широкомасштабное перепрограммирование выходных данных циркадных часов. Это означает, что, несмотря на то, что основные часы поддерживают функцию синхронизации, гены, нацеленные на ежедневную экспрессию, в значительной степени отличаются. Например, в двух исследованиях биопсия мышц у людей собиралась каждые 4 часа в течение 24 часов, и результаты определили, что пик и спад экспрессии часовых генов меняются местами у ночных грызунов и дневных людей 34,35,36. Это указывает на то, что когда экспрессия часовых генов сравнивается исключительно на основе активной фазы и фазы покоя (а не светлой и темной), паттерны экспрессии часовых генов в мышцах практически одинаковы у разных видов. Предполагается, что это возрастное изменение в выходе часов приводит к нарушениям в регуляции путей, которые включают известные признаки старения, такие как митохондриальная функция, повреждение и репарация ДНК, а также аутофагия37.
Обоснование исследования
Связь между функцией митохондрий и снижением физической функции хорошо установлена. Тем не менее, основная причина митохондриальной дисфункции остается предметом споров. Недавние исследования показывают, что использование клеточного топлива и циркадные ритмы могут играть роль в этом процессе. Традиционные методы оценки митохондриальной функции, такие как измерение потребления митохондриального кислорода в образце мышечной биопсии, часто воспринимаются как болезненные и инвазивные, что может препятствовать участию, особенно в популяциях с низкой мышечной массой, такихкак хрупкие взрослые и взрослые с саркопенией.
Учитывая эти ограничения, существует потребность в менее инвазивном методе оценки изменений в использовании клеточного топлива и циркадном ритме у пожилых людей. Это исследование направлено на оценку нового, минимально инвазивного протокола, который может быть использован для оценки метаболизма топлива и циркадного ритма в этой популяции. Результаты этого исследования будут способствовать лучшему пониманию возрастных изменений и реакции на медицинские или поведенческие вмешательства, послужив моделью для будущих исследований в этой области.
протокол
Процедуры с участием людей были одобрены Комитетом по этике исследований (Политика этики Флориды 1.0104) и Институциональным наблюдательным советом Университета Флориды.
1. Функция митохондрий
- Выделение мононуклеарных клеток периферической крови (ПМЦ)
- Соберите PBMC с помощью специальных пробирок для сбора крови объемом 8 мл (16 мм x 125 мм; содержащие либо 0,1 М цитрата натрия антикоагулянт, либо антикоагулянт гепарина натрия) (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Пробирки для сбора крови содержат среду для разделения крови, состоящую из тиксотропного полиэфирного геля и градиентной среды (см. Таблицу материалов) для улучшения разделения белых кровяных телец. - Обрабатывайте пробирки для подготовки клеток объемом 8 мл в течение 2 ч после сбора для получения жизнеспособных результатов.
- Перемешайте пробирки для сбора крови после их наполнения кровью (путем осторожной инверсии или на миксере) и держите при комнатной температуре (RT) не более 2 часов.
- Центрифугируйте пробирки для забора крови в фитинговом поворотном роторе при давлении 2000 × г в течение 15 мин (или эквивалентно 30000 Г-мин; не более 2000 × г) при РТ.
ПРИМЕЧАНИЕ: Эти пробирки выше, чем обычная центрифужная пробирка объемом 15 мл; Поэтому дополнительное внимание необходимо уделить использованию правильного ротора. - Аспирацию и выбросьте в контейнер для биологически опасных отходов ~80% слоя плазмы, а клеточный слой соберите из пробирки для сбора крови (с помощью передаточной пипетки) в центрифужную пробирку объемом 15 мл.
ПРИМЕЧАНИЕ: При использовании пробирки объемом 15 мл добавьте 7 мл клеточного слоя и заполните до 14 мл стерильным фосфатно-солевым буфером (PBS). Отношение клеток к PBS должно быть 1:1. При необходимости используйте несколько трубок. Аккуратно перемешайте, перевернув. - Центрифугируйте в поворотно-поворотном роторе при давлении 900 × g в течение 5 мин (или эквивалентно 4 500 G-мин) при RT.
- Не повреждая клеточную гранулу, аспирируйте раствор PBS и выбросьте его в контейнер для биологически опасных отходов.
- Ресуспендируйте клеточную гранулу в 1 мл базальной среды (БМ; см. Таблицу материалов) путем осторожного тритуирования. Добавьте BM в общей сложности до 10 мл и аккуратно перемешайте, переворачивая. Выполните подсчет ячеек.
- Центрифугируйте суспензию элемента в поворотно-откидном роторе при давлении 900 × g в течение 5 мин при RT.
ПРИМЕЧАНИЕ: Если клетки используются в один и тот же день для биоэнергетической оценки, перейдите к шагу 1.1.10; Если ячейки заморожены для хранения, перейдите к шагу 1.1.13. - Рассчитайте объем пробирной среды (АМ; см. Таблицу материалов) для ресуспендирования следующей клеточной гранулы для достижения желаемой клеточной концентрации.
Примечание: Например, для плотности посева 150 000 клеток/лунку в 50 мкл желаемая концентрация клеточной суспензии составляет 3 миллиона клеток/мл. - Не нарушая клеточную гранулу, аспирируйте надосадочную жидкость и выбросьте ее в контейнер для биологически опасных отходов.
- Осторожно суспендируйте клеточную гранулу в 1 мл или менее AM. Добавьте AM к общему расчетному объему для желаемой концентрации клеток. Теперь клетки готовы к посеву в покрытую оболочкой клеточную культуральную пластину (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Следующие шаги предназначены для замораживания ячеек для хранения (1.1.13-1.1.16) и не относятся к процедуре в тот же день. - Для замораживания клеток аспирируйте надосадочную жидкость, не повреждая клеточную гранулу, и выбросьте ее в контейнер для биологически опасных отходов.
- Аккуратно ресуспендируйте клетки в замораживающих средах (см. Таблицу материалов) до желаемой концентрации (5-10 миллионов клеток/мл). Аликвоты желаемых объемов в меченых криовиалах.
- Медленно заморозьте суспензию клеток с помощью контейнера для заморозки (см. Таблицу материалов) минимум на 4 часа или на ночь при температуре -80 °C.
- Через 4 часа или на следующее утро перенесите криовиалы в хранилище жидкого азота, где они должны находиться в паровой фазе.
- За день до измерения покройте дно лунки микропланшета клеточной культуры (см. Таблицу материалов) клеточным клеем (см. Таблицу материалов). Приготовьте клей в соответствии с инструкциями производителя с рекомендуемой концентрацией 22,4 мкг/мкл, разбавив соответствующий объем раствора клеевого материала в 0,1 М бикарбоната натрия (pH 8,0). Нанесите 25 мкл клея на каждую лунку микропланшета клеточной культуры.
- Через 20 мин откачайте оставшуюся жидкость из каждой лунки и дважды промойте лунки 200 мкл стерильной, очищенной воды. Дайте планшету высохнуть в шкафу биобезопасности (в течение ~2 часов).
- Оберните тарелку в алюминиевую фольгу или поместите ее в закрытый вторичный контейнер и храните в холодильнике при температуре 4 °C.
- Соберите PBMC с помощью специальных пробирок для сбора крови объемом 8 мл (16 мм x 125 мм; содержащие либо 0,1 М цитрата натрия антикоагулянт, либо антикоагулянт гепарина натрия) (см. Таблицу материалов).
- Биоэнергетическая оценка PBMC с помощью анализатора метаболических потоков в эфирное время
ПРИМЕЧАНИЕ: Использование анализатора потоков и многорежимного считывателя (см. Таблица материалов), была определена оптимальная плотность засева 150 000 PBMC на лунку, концентрация фенилгидразона (FCCP) в окончательном разъединителе карбонильцианида-4 (трифторметокси) в 2 мкМ и конечная концентрация Hoechst 33342 в 4 мкМ (с временем инкубации не менее 20 мин после впрыска).- Чтобы гидратировать сенсорные картриджи с гидроусилителем, извлеките сенсорный картридж с хозяйственной пластиной из коробки и поместите картридж «сенсором вверх» на скамейку. Нанесите 200 мкл калибра (см. Таблицу материалов) в каждую лунку рабочей плиты и плотно установите гидроусилитель на рабочую пластину, а затем сенсорный картридж. Осмотрите и удалите все захваченные пузырьки воздуха и поместите в инкубатор с температурой 37 °C безCO2 на ночь.
- Включите анализатор потоков и затем откройте программное обеспечение для анализа (см. Таблицу материалов). Установите температуру на 37 °C. Оставьте прибор включенным на ночь, чтобы обеспечить стабилизацию заданной температуры.
ПРИМЕЧАНИЕ: Следующие шаги программирования (1.2.4-1.2.10) могут быть выполнены за день до или в день проведения эксперимента - Чтобы запрограммировать файл программного обеспечения для анализа (см. Таблицу материалов), откройте шаблон для стресс-теста на окисление субстрата. Перейдите в раздел «Определения групп», откройте вкладку «Стратегии инъекций», отредактируйте стресс-тест Inhibitor + Sub Ox на Etomoxir + Sub Ox Stress Test и добавьте еще две стратегии инъекций: UK5099 + Sub Ox Stress Test и BTPES + Sub Ox Stress Test. В каждой стратегии инъекции в окне «Условие инъекции» нажмите на A для порта A и введите конечную концентрацию соответствующего ингибитора (Etomoxir: 4 μM; UK5099: 2 мкМ; BTPES: 3 μM).
- Нажмите на порты B, C и D и введите соответствующие концентрации (порт B: концентрация олигомицина [1,50 μM], порт C: FCCP [2,0 μM]; порт D: Ротенон + Антимицин А [0,5 мкМ]). Добавьте Hoechst 33342, 4 μM в окно соединений для порта D.
- Откройте вкладку «Предварительная обработка» и выберите «Предварительная обработка», если применимо. Например: контрольный, экспериментальный или обычный (например, базовый и последующий режим). При необходимости добавьте описания в окно ниже.
- Откройте вкладку « Пробирная среда» и в раскрывающемся меню « Среда » выберите RPMI Medium, pH 7,4, введите номер партии, персонал, готовящий среду, время приготовления и добавки, добавленные в среду (10 мМ глюкозы, 2 мМ глутамина, 1 мМ пируват; см. Таблицу материалов).
- Откройте вкладку Тип ячейки и введите PBMC-Subject ID в качестве Name, PBMC в качестве Cell Type, 150000 в качестве Seed Density, Subject ID в качестве источника, персонал, который подготовил ячейки, дату подготовки и день оттаивания ячеек, если применимо.
- Нажмите « Создать группы», перейдите в раздел «Карта пластин» и назначьте скважины 96-скважинной пластины соответствующим группам. Скважины A1, A12, H1 и H12 должны быть назначены фоновыми скважинами.
- Перейдите в раздел «Протокол», установите флажок «Равновесие » (настройка по умолчанию) и введите следующую информацию: Базовый уровень: пять циклов измерения: 3 минуты смешивания, 0 минут ожидания и 3 минуты измерения; Среда или ингибитор (порт А): шесть циклов измерения: 3 мин смешивание, 0 мин ожидание и 3 мин измерение; Олигомицин (порт В): три цикла измерения: 3 минуты смешивания, 0 минут ожидания и 3 минуты измерения; FCCP (порт C): три цикла измерения: 3 мин смешивания, 0 мин ожидания и 3 мин измерения; Ротенон + антимицин А + Hoechst 33342 (порт D): три цикла измерения: 3 минуты смешивания, 0 минут ожидания и 3 минуты измерения.
- В день биоэнергетической оценки достаньте из холодильника микропланшет с покрытием для клеточной культуры и дайте ему нагреться до RT в шкафу биобезопасности.
- Приготовьте среду для анализа (АМ), смешав 97 мл предварительно подогретой КМ и добавки: 1 мл пирувата (конечная концентрация: 1 мМ), 1 мл глюкозы (конечная концентрация 10 мМ) и 1 мл глутамина (конечная концентрация: 2 мМ). Поместите AM при температуре 37 °C в инкубатор безCO2 до использования.
- Чтобы засеять клетки, добавьте 50 мкл клеточной суспензии (из 1.1.12), содержащей 150 000 PBMC, в каждую лунку, за исключением A1, H1, A12 и H12 (назначенных фоновыми лунками).
КРИТИЧНО: Оптимальная плотность посева была определена заранее. - Накройте клеточную пластину крышкой и дайте ячейкам отдохнуть в режиме RT в боксе биобезопасности в течение 60 минут, чтобы обеспечить равномерное распределение клеток.
КРИТИЧЕСКИЙ: Рассматривайте клетки под микроскопом, чтобы обеспечить желаемое однородное распределение клеток по лунке. - Для визуализации клеток включите многорежимный ридер (см. Таблицу материалов) за несколько часов до первой инкубации клеток; дождитесь завершения протокола инициации считывателя, прежде чем открывать программное обеспечение для обработки изображений (см. Таблицу материалов). Откройте программное обеспечение для обработки изображений и установите температуру предварительного нагрева на 37 °C.
- Чтобы приготовить реактивы для анализа, следуйте инструкциям набора для анализа по восстановлению реагентов с небольшими изменениями, как указано в таблице 1.
КРИТИЧЕСКОЕ: Оптимальные конечные концентрации FCCP и Hoechst33342 были определены ранее. - После 60-минутного отдыха клеток осмотрите лунки с помощью микроскопа для клеточных культур и обратите внимание на любые визуальные аномалии, такие как клеточная агрегация.
- Центрифугировать планшет для культивирования клеток в ОТ в центрифуге с поворотным ротором для микропланшетов при 60 × g в течение 1 мин, с минимальным ускорением и минимальным разрывом; Переверните планшет и снова центрифугируйте при 40 × г в течение 1 минуты. Установите ускорение и тормоз на минимум. Инкубируйте клетки в течение 25-30 минут при 37 °C в инкубаторе без содержания CO2 .
ПРИМЕЧАНИЕ: Когда выполняется визуализация клеток, клеточный планшет инкубируется в предварительно нагретом многорежимном считывателе (см. Таблицу материалов), и в течение этого инкубационного периода (первая клеточная инкубация) делается светлопольное изображение каждой лунки. - Отсканируйте штрихкод планшета для клеточной культуры с помощью сканера штрихкодов (см. Таблицу материалов), выберите «Начать сканирование в светлом поле», поместите планшет для клеточных культур на лоток для планшета и начните втягивание лотка. Выберите ячейки, содержащие лунки для сканирования, и начните сканирование.
- Во время первой инкубации клеток загрузите реагентами порты сенсорного картриджа , как указано в таблице 1: порт (А): 20 мкл АМ (контроль), этомоксир (ингибитор транспорта длинноцепочечных жирных кислот в митохондрии), УК 5099 (2-циано-3-(1-фенил-1H-индол-3-ил)-2-пропеновая кислота; ингибитор митохондриального носителя пирувата) или BPTES (Бис-2-(5-фенилацетамидо-1, 3,4-тиадиазол-2-ил)этилсульфид; ингибитор превращения глутамина в глутамат); порт (В): 22 мкл олигомицина (ингибитора АТФ-синтазы); порт (C): 25 мкл FCCP (развязка карбонильцианида-4 (трифторметокси) фенилгидразона); порт (D): 27 мкл ротенона/антимицина A/Hoechst 33342 (ингибиторы митохондриального комплекса I и III соответственно и ядерного красителя). Верните картридж датчика в инкубатор с температурой 37 °C без CO2 еще на 5 минут.
ПРИМЕЧАНИЕ: Следуйте инструкциям производителя по загрузке портов. - Выньте планшет для культивирования клеток из инкубатора или планшетного ридера после первой инкубации клеток и после завершения визуализации клеток (если применимо) и добавьте теплое AM в каждую лунку до конечного объема 180 мкл на лунку. Поместите клеточную пластину при температуре 37 °C в инкубатор безCO2 еще на 15-25 минут (инкубация второй клетки).
- Начните метаболический анализ , начав калибровку датчика во время второй инкубации клеток. Нажмите « Запустить анализ», когда анализ будет готов к началу калибровки картриджа датчика. При появлении запроса перенесите картридж с датчиком из инкубатора с температурой 37 °C, не содержащего CO2 , в лоток для анализатора потоков и начните калибровку. Следуйте инструкциям программного обеспечения для анализа и замените рабочую пластину для клеточной пластины после завершения калибровки.
ПРИМЕЧАНИЕ: Калибровка занимает около 20 минут. - После метаболического анализа следуйте подсказкам программного обеспечения и извлеките картридж датчика и клеточную пластину из прибора. Извлеките картридж датчика из пластины ячейки и накройте пластину ячейки крышкой.
- После того, как время инкубации красителя Хёхста было определено в предварительных экспериментах, отсканируйте штрих-код планшета и следуйте подсказкам программного обеспечения, чтобы получить флуоресцентное изображение каждой лунки, содержащей клетки, с помощью многорежимного считывателя.
ПРИМЕЧАНИЕ: Программное обеспечение для визуализации и анализа анализов имеет интерфейс, что позволяет импортировать данные о количестве клеток в файл данных анализа анализа для нормализации данных по количеству клеток.
2. Экспрессия генов циркадных часов
ПРИМЕЧАНИЕ: Экспрессия часовых генов из PBMC у участников будет проверена путем выделения РНК с помощью набора РНК крови (см. Таблицу материалов).
- Наберите 3 мл крови участника непосредственно в РНК-пробирку (см. Таблицу материалов) с 6 мл стабилизирующих реагентов. Вортекс в течение 10 с до полного перемешивания.
Примечание: Если стабилизирующие реагенты не были тщательно перемешаны с образцом крови участника, то существует повышенный риск ошибки исследования. - Перенесите 1,0 мл стабилизированного образца крови в пробирку объемом 15 мл с 5 мл буфера для лизиса эритроцитов. Выдерживать на льду в течение 10-15 минут. Сделайте вихревой пробирку 2 раза во время инкубации. Центрифугируйте пробирку при 4 °C при 400 × г в течение 10 минут.
- Определите гранулу и осторожно слейте надосадочную жидкость, содержащую лизированные эритроциты. Добавьте 2 мл буфера для лизиса эритроцитов (см. Таблицу материалов), повторно суспендируйте клетки, кратковременно перемешайте и центрифугируйте при 400 × г в течение 10 минут при 4 °C.
- Слейте надосадочную жидкость и оставьте трубку перевернутой на впитывающей бумаге на 1-2 минуты. Промокните всю жидкость вокруг края пробирки чистой бумагой перед следующим шагом.
- Осторожно добавьте 600 мкл буфера для лизиса РНК (см. Таблицу материалов). Следуя протоколу производителя, добавьте β-меркаптоэтанол и повторно суспендируйте гранулу.
- Пипетируйте лизат непосредственно в одноразовый гомогенизатор клеточного лизата (см. Таблицу материалов), вращающуюся колонку, помещенную в пробирку для сбора объемом 2 мл, и центрифугируйте в течение 2 мин на максимальной скорости для гомогенизации. Выбросьте одноразовую колонку гомогенизатора клеточного лизата и сохраните гомогенизированный лизат.
- Добавьте 1 объем (600 μл) 70% этанола к гомогенизированному лизату и перемешайте с помощью пипетирования. Тщательно отпижите образец, включая образовавшийся осадок, в новую спиновую колонку в пробирке для сбора объемом 2 мл, но не увлажняйте ободок. Центрифуга в течение 15 с при >8 000 × г.
- Перенесите спиновую колонку (см. Таблицу материалов) в новую пробирку для сбора объемом 2 мл. Нанесите 700 мкл строгого промывочного буфера (см. Таблицу материалов) на спиновую колонну и центрифугуйте в течение 15 с при >8 000 × г для промывки. Откажитесь от проточной части.
- Осторожно откройте отжимную колонку и добавьте 500 μл мягкого буфера для стирки (см. Таблицу материалов). Закройте крышку и запустите центрифугу на полной скорости (20 000 × г) на 3 минуты.
- Перенесите спиновую колонку в микроцентрифужную пробирку объемом 1,5 мл и нанесите 30-50 мкл воды, не содержащей РНКазы, непосредственно на мембрану из диоксида кремния. Центрифугируйте в течение 1 минуты при >8000 × г для элюирования РНК. Повторите еще раз.
ПРИМЕЧАНИЕ: РНК можно хранить при температуре -80 °C. - Обработку ДНКазой проводят на колонке с использованием набора ДНКазы без РНКазы (см. Таблицу материалов), в соответствии с протоколом производителя.
- Сгенерируйте кДНК с использованием 500 нг общей РНК и системы полимеразной цепной реакции (ПЦР) в реальном времени (см. Таблицу материалов), в соответствии с протоколом производителя. Разведите все образцы кДНК в соотношении 1:25 в воде, не содержащей РНКазы, и используйте 4 мл для проведения количественной ПЦР с обратной транскрипцией (qRT-PCR).
- Используйте метод добавления праймеров (см. Таблицу материалов) для завершения qRT-PCR с 10 мМ каждого из праймеров, показанных в таблице 2. Выполните qRT-PCR с использованием системы в режиме реального времени (см. Таблицу материалов).
- Нормализуйте уровни мРНК выбранных генов с помощью уровней мРНК Rpl26 . Используйте метод 2-DDCt для вычисления относительной количественной оценки.
- Чтобы определить, проявляет ли экспрессия данной мРНК циркадные колебания, используйте тест, основанный на LR_rhythmicity39 вероятности (с использованием p≤ 0,01) для определения циркадной ритмичности в одном из экспериментальных условий40.
3. План анализа данных
ПРИМЕЧАНИЕ: Медицинский опросник будет использоваться для категоризации участников на основе использования лекарств43.
- Используйте линейную модель со смешанными эффектами, в которой возраст, пол, вес, рост, артериальное давление, частота сердечных сокращений и другие факторы риска должны быть включены в качестве ковариат.
- Термин со случайным эффектом должен быть включен для объяснения корреляции данных внутри субъекта.
- Для подгонки модели должен быть реализован выбор обратной переменной по иерархическому принципу.
- Из аппроксимированной модели изменяется мера от временной точки 1 к временной точке 2 с учетом всех ковариат в подогнанной модели.
Результаты
Предлагаемый протокол включает в себя предварительные данные, которые служат валидацией для методологии. Протокол включает в себя анализатор метаболического потока в режиме реального времени для изучения функции митохондрий и использования клеточного топлива, а также экстракцию РНК и qRT-ПЦР для анализа генов циркадного ритма (например, BMAL1, CLOCK, Nfil2, Nr1d1, Dbp, Cry1, Per2).
Скорость потребления кислорода (OCR) отдельными человеческими PBMC от пяти участников контрольной группы через 10 дней после первоначального анализа представлена на рисунке 1. Данные используются для сравнения пре- и пост-значений и показывают средние значения базального дыхания, острой реакции, максимального дыхания и резервной емкости после инъекции контрольной группы, этомоксира, UK5099 и BPTES. Примечательно, что на рисунке 1С показан значительный отрицательный острый ответ после инъекции этомомоксира, но не наблюдалось существенных эффектов в отношении базального дыхания, максимального дыхания или резервных мощностей.
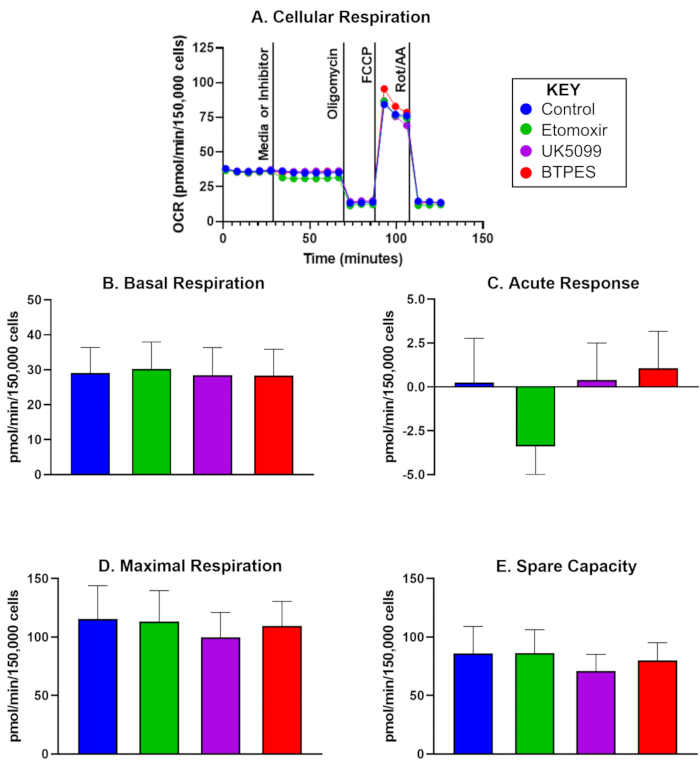
Рисунок 1: Потребление кислорода выделенными мононуклеарными клетками периферической крови человека (ПМЦ). (A) Скорость потребления кислорода в реальном времени (OCR; pmol/(min∙150 000 клеток) PBMC, выделенных у контрольного субъекта, измеренная с помощью анализатора потоков и оцененная с помощью анализа окисления субстрата. Клетки засеивались с плотностью 150 000 клеток/лунка. Первая инъекция была либо средой (контролем), либо ингибитором (этомоксир, UK5099 или BPTES; подробности см. в тексте) и происходила после измерения частоты базального клеточного дыхания. Острый ответ на ограничение митохондриального субстрата определяли как разницу базальных OCR до и после введения ингибитора. Олигомицин, ингибитор АТФ-синтазы, ингибирует дыхание, связанное с продуцированием АТФ, и вызывает дыхание с утечкой протонов. FCCP, размыкающее устройство, индуцирует максимальное, несвязанное дыхание; Ротенон и антимицин А (ингибиторы комплексов I и III соответственно) ингибируют все, кроме немитохондриального дыхания (подробнее см. текст). (В-Е) Количественная оценка клеточного дыхания (n = 5; данные представлены в виде среднего ± SD). (B) базальная OCR до инъекции ингибитора, (C) острая реакция на ингибитор (изменение OCR относительно базальной скорости до инъекции ингибитора), (D) максимальная OCR и (E) резервная емкость (разница между максимальной OCR и базальной OCR после первой инъекции). Острая реакция (C) на инъекцию этомоксира может свидетельствовать о более высокой зависимости OCR от жирных кислот в качестве энергетического субстрата в базальных условиях по сравнению с другими группами субстратов без заметного влияния на OCR при высокой потребности в энергии (D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Соединение | Добавление AM (μL) в соединение | Запас (μM) | запас (μл) для оборотного состава | AM (μL) для оборотного состава | Оборотное сырье (μM) | Рабочий состав (μл) [порт] | Итоговая консистенция (μM) |
| Этомоксир | 700 | 160 | 500 | 1500 | 40 | 20 [А] | 4 |
| УК5099 | 700 | 80 | 500 | 1500 | 20 | 20 [А] | 2 |
| БТЭС | 700 | 120 | 500 | 1500 | 30 | 20 [А] | 3 |
| Олиго | 420 | 150 | 300 | 2700 | 15 | 22 [В] | 1.5 |
| ФКХП | 720 | 100 | 600 | 2400 | 20 | 25 [С] | 2 |
| Гниль/АА/Н | 540 | 50 | 300 | 2700 | 5 | 27 [D] | 0.5 |
Таблица 1: Подготовка реагентов для испытания на окисление субстрата и концентрации исходного, рабочего и конечного растворов. Все реагенты являются частью стресс-теста Cell Mito или наборов для стресс-тестов на окисление субстрата. Сокращения: олиго = олигомицин; FCCP = разъединитель карбонильцианид-4 (трифторметокси) фенилгидразона; Rot/AA/H = ротенон/антимицин A/Hoechst 33342. Etomoxir, UK5099, BTPES: ингибиторы окисления жирных кислот, глюкозы и глутамина соответственно.
| Бмал1 | Вперед – GCACGACGTTCTTTCTTCTGT |
| Реверс – GCAGAAGCTTTTTTTCGATCTGCTTTT | |
| Часы | Вперед – CGTCTCAGACCCTTCCTCAAC |
| Реверс – GTAAAATGCTGCCTGGGTGGA | |
| Крик1 | Вперед – ACTGCTATTGCCCTGTTGGT |
| Реверс – GACAGGCAAATAACGCCTGA | |
| Пер1 | Вперед – ATTCGGGTTACGAAGCTCCC |
| Реверс – GGCAGCCCTTTCATCCACAT | |
| Пер2 | Вперед – CATGTGCAGTGGAGCAGATTC |
| Реверс – GGGGTGGTAGCGGATTTCAT | |
| Rev-erb α | Вперед – ACAGATGTCAGCAATGTCGC |
| Реверс – CGACCAAACCGAACAGCATC |
Таблица 2: Праймеры генов циркадных часов.
Обсуждение
Снижение функции митохондрий и регуляции циркадного ритма с возрастом все чаще рассматриваются как факторы, способствующие возрастным заболеваниям. Изменение циркадных ритмов с помощью изменений образа жизни, таких как диета и физическая активность, представляет собой потенциальную стратегию, способствующую здоровому старению и снижению подвижности, связанному со старением. Тем не менее, современные методы прямой оценки митохондриальной функции являются инвазивными и часто требуют биопсии мышц, что может создать проблемы с набором и удержанием участников из-за воспринимаемой боли и рисков.
Оценка маркеров циркадного и метаболического здоровья с помощью менее инвазивных методов, таких как забор крови, обеспечит ценные результаты для изучения и тестирования терапевтических целей в будущих исследованиях. Эти минимально инвазивные методы могут значительно продвинуть эту область, обеспечивая новое понимание сложного взаимодействия между циркадным ритмом и метаболическим здоровьем и их влияния на функцию. Целью данного исследования является оценка взаимосвязи между клеточным энергетическим метаболизмом и циркадным ритмом. В частности, биоэнергетический анализ потока используется для оценки функции митохондрий при различных условиях доступности субстрата, наряду с мониторингом экспрессии генов группы циркадных генов в белых кровяных клетках участников. Используя обе сферы анализа, биоэнергетику и экспрессию генов, можно достичь всестороннего понимания взаимосвязи между этими двумя фундаментальными процессами.
Статистический анализ данных этого временного ряда с циркадной точки зрения дает представление о силе, диапазоне и времени циркадных ритмов. В заключение следует отметить, что интеграция анализа экспрессии генов, клеточной биоэнергетики и метаболических показателей на уровне организма представляет собой новый и инновационный подход, который прольет свет на взаимодействие между энергетическим метаболизмом и циркадными ритмами у человека.
В пилотном исследовании мы обнаружили острую реакцию в OCR PBMC на ограничение утилизации жирных кислот (после инъекции этомоксира, ингибитора карнитин пальмитоилтрансферазы 1a). Это открытие позволяет предположить, что в ПМК из этой конкретной группы участников может наблюдаться зависимость от жирных кислот в качестве энергетического субстрата во время базального дыхания. Тем не менее, максимальное дыхание не было затронуто, что позволяет предположить, что альтернативные источники энергии, такие как глюкоза и глутамин, могут компенсировать снижение использования жирных кислот во время высокой потребности в энергии. В будущих исследованиях следует выяснить, отражает ли а) биоэнергетика PBMC энергию всего организма и б) могут ли такие вмешательства, как ограниченное по времени питание, повлиять на предпочтения энергетического субстрата.
Анализ потоков PBMC включает в себя несколько важных этапов. Во-первых, перед оценкой экспериментальных образцов следует оптимизировать плотность затравки клеток (клеток на лунку) путем обеспечения непрерывного равномерного распределения клеток внутри каждой лунки и по каждой пластине, а конечную концентрацию FCCP следует оптимизировать путем проведения тестовых прогонов концентраций с использованием концентраций 0, 0,125, 0,25, 0,5, 1,0 и 2,0 мкМ, и, если применимо, окрашивание Hoechst 33342 должно быть оптимизировано в соответствии с инструкциями производителя. Во-вторых, нормализация метаболических данных к клеточным параметрам имеет решающее значение для сопоставимости данных между экспериментами. В настоящем протоколе описывается подсчет клеток после завершения анализа с помощью анализатора потока с использованием клеток, окрашенных методом Hoechst 33342, и устройства для визуализации клеток. Если подходящее устройство недоступно, могут быть применены альтернативные методы нормализации, такие как общее содержание клеточного белка или ядерной ДНК в лунке. Существует отмеченная модификация, которая может быть использована в протоколе по сравнению с теми, которые были предложены. В частности, протокол может быть составлен с использованием индивидуального набора для каждого из трех ингибиторов, по сравнению с двумя предложенными здесь наборами (см. Таблицу материалов).
Использование PBMC в качестве суррогата для изучения взаимодействия между энергетическим метаболизмом и циркадными ритмами у пожилых людей ограничено предположением, что их реакция на лечение может точно отражать реакцию в других тканях и органах. Несмотря на то, что этот подход является новым и минимально инвазивным, важно признать, что различные ткани и органы, такие как мозг, печень и скелетные мышцы, могут реагировать по-разному в различных условиях. Доклиническое исследование показало, что экспрессия генов часов была изменена у мышей, которых кормили и голодали, что приводило к частичной регуляции генов-мишеней BMAL1 в печени и мышечной ткани, но к подавлениюдругих генов. Эти периферические ткани и органы в высокой степени репрезентативны для метаболических процессов и могут подвергаться влиянию сигналов окружающей среды, которые влияют на механизмы экспрессии генов часов42. Необходимы дальнейшие исследования, чтобы полностью понять взаимосвязь между периферическими тканями, органами и центральными циркадными часами.
Еще одним ограничением является то, что участники не дисквалифицируются за прием каких-либо рецептов, что может наложить ограничения на статистический анализ. Чтобы противодействовать этому ограничению, в будущих исследованиях будет использоваться медицинский опросник, который был валидирован на популяциях пожилых людей, принимающихлекарства. Участники будут классифицированы на основе рекомендованных лекарств, записанных в разделе обзора данных протокола. В общей сложности существует три категории, с точки зрения лекарств, которые, как было показано, 1) ускоряют функциональное снижение, 2) замедляют функциональное снижение и 3) влияют на функцию скелетных мышц.
Наконец, митохондриальная окислительная способность скелетных мышц человека демонстрирует дневной и ночной ритм, достигая пика между 18:00 и 23:00 и снижаясь между 08:00 и 11:00утра44. Пока неясно, относится ли это к митохондриальной окислительной способности PBMC. Тем не менее, предварительные данные свидетельствуют о том, что PBMC и митохондриальный метаболизм связанымежду собой 45. Учитывая, что информация о биопсии мышц и изменениях в PBMC не так ясна, следует соблюдать осторожность при анализе результатов. Учитывая это ограничение, важно учитывать эту информацию при оценке и разработке протокола, поскольку она может предоставить ценный контекст и понимание, которые могут помочь в обеспечении действительности и эффективности протокола.
Насколько нам известно, ни в одном из предыдущих исследований не оценивались закономерности использования топлива или циркадные ритмы с помощью методов, предложенных в этом проекте. Наша цель состоит в том, чтобы изучить реакцию маркеров использования митохондриального топлива и здоровья циркадных ритмов на изменения. В данном исследовании представлен минимально инвазивный метод измерения высокочувствительного биомаркера, который может служить альтернативой в будущих интервенционных исследованиях, где биопсия мышц невозможна.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Это исследование финансировалось Центром независимости пожилых американцев (NIH/NIA P30AG028740) при содействии Института клинических и трансляционных наук (NIH/NCRR UL1TR000064).
Материалы
| Name | Company | Catalog Number | Comments |
| Agilent Technologies Cell Imaging | Agilent Technologies | Cell image software | |
| Agilent/Seahorse Wave desktop program | Agilent Technologies | 5994-0039EN | Software used to analyse data from the celluar analyser and stress test assay |
| Agilent/Seahorse XFe96 Flux Analyzer | Agilent Technologies | S7800B | Real-time cellular flux analyzer; flux analyser |
| Bar Code Reader | Agilent Technologies | G2615-90007 | |
| Seahorse Wave Desktop Software | Agilent technologies | Data acquisition software; assay analysis; wave program | |
| Seahorse XF 1.0 M Glucose solution | Agilent Technologies | 103577-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 100 mM Pyruvate solution | Agilent Technologies | 103578-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 200 mM Glutamine solution | Agilent Technologies | 103579-100 | Supplement to basal medium to make assay medium |
| Seahorse XF Cell Mito Stress Test | Agilent Technologies | 103015-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF Mito Fuel Flex Test | Agilent Technologies | 103260-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF RPMI Medium | Agilent Technologies | 103576-100 | Basal medium for PBMCs |
| Seahorse XFe96 FluxPak mini | Agilent Technologies | 102601-100 | Sensor cartridges and cell culture microplates |
| Cytation 1 Cell Imaging Multi-Mode Reader | Agilent/BioTek | Multimode reader to image cells | |
| CPT Sodium Heparin Tube, 16 x 125 mm x 8.0 mL | Becton Dickinson | 362753 | Blood collection tubes for isolation of peripheral blood mononuclear cells |
| CellTak Cell and Tissue Adhesive | Corning | 354240 | Cell adherent to coat cell culture microplate |
| Phosphate Buffered Saline | Corning | 21-040-CV | Buffer to wash blood cells |
| Ficoll Paque Plus | Cytiva | GE17-1440-02 | Gradient medium |
| Lunar Prodigy DXA scanner | General Electric | EN 60601-2-7 5.1 | Whole body lean mass and fat/lean tissue mass ratio |
| Freezing container, Nalgene Mr. Frosty | MilliporeSigma | C1562 | Freezing container used to slow-freeze cell suspension |
| Buffer EL. | Qiagen | 79217 | Erythrocyte lysis buffer |
| Buffer RLT | Qiagen | 79216 | RNA lysis buffer |
| Buffer RPE | Qiagen | 1018013 | Mild washing buffer |
| Buffer RW1 | Qiagen | 1053394 | Stringent washing buffer |
| QIAamp DNA Micro Kit | Qiagen | 56304 | DNA preps: QIAamp MinElute Columns, Proteinase K, Carrier RNA, Buffers, Collection Tubes (2 ml) |
| QIAamp RNA Blood Mini Kit | Qiagen | 52304 | RNA blood kit; Used to isolate RNA |
| QIAshredder | Qiagen | 79656 | disposable cell-lysate homogenizers |
| RNase-Free DNase Set | Qiagen | 79254 | Used to perform DNA digest |
| 2-Mercaptoethanol (Reagent) | Thermo Fisher Scientific | MFCD00004890 | |
| 2-mL collection tubes, 100 count | Thermo Fisher Scientific | AM12480 | |
| Fast SYBR Green Master Mix | Thermo Fisher Scientific | 4385612 | Primers are added to this and used to carry out qRT-PCR |
| Microcentrifuge Tubes, 1.5 mL | Thermo Fisher Scientific | 69715 | Used to hold RNA purification filter during RNA purification |
| Narrow p1000 pipette tips | Thermo Fisher Scientific | 02-707-402 | |
| QuantStudio 3 Real-Time PCR System, MiniAmp Plus Thermal Cycler, and 96-Well Plates Package | Thermo Fisher Scientific | A40393 | |
| Tempus Blood RNA Tube | Thermo Fisher Scientific | 4342792 | RNA Tube |
| Tempus Spin RNA Isolation kit | Thermo Fisher Scientific | 4380204 | RNA extraction and isolation |
Ссылки
- UN Department of Economic and Social Affairs. Population Division 2019, World Population Prospects. UN Department of Economic and Social Affairs. , (2019).
- Anton, S., Leeuwenburgh, C. Fasting or caloric restriction for healthy aging. Experimental Gerontology. 48 (10), 1003-1005 (2013).
- Dziechciaż, M., Filip, R. Biological psychological and social determinants of old age: Bio-psycho-social aspects of human aging. Annals of Agricultural and Environmental Medicine. 21 (4), 835-838 (2014).
- Anton, S. D., et al. Flipping the metabolic switch: understanding and applying the health benefits of fasting. Obesity. 26 (2), 254-268 (2018).
- Fried, L. P., Guralnik, J. M. Disability in older adults: evidence regarding significance, etiology, and risk. Journal of the American Geriatrics Society. 45 (1), 92-100 (1997).
- Manini, T. Development of physical disability in older adults. Current Aging Science. 4 (3), 184-191 (2011).
- Chung, H. Y., et al. Molecular inflammation: underpinnings of aging and age-related diseases. Ageing Research Reviews. 8 (1), 18-30 (2009).
- Sun, N., Youle, R. J., Finkel, T. The mitochondrial basis of aging. Molecular Cell. 61 (5), 654-666 (2016).
- Tarasov, A. I., Griffiths, E. J., Rutter, G. A. Regulation of ATP production by mitochondrial Ca2. Cell Calcium. 52 (1), 28-35 (2012).
- Chistiakov, D. A., Sobenin, I. A., Revin, V. V., Orekhov, A. N., Bobryshev, Y. V. Mitochondrial aging and age-related dysfunction of mitochondria. Biomed Research International. 2014, 238463 (2014).
- Boengler, K., Kosiol, M., Mayr, M., Schulz, R., Rohrbach, S. Mitochondria and ageing: role in heart, skeletal muscle and adipose tissue. Journal of Cachexia, Sarcopenia, and Muscle. 8 (3), 349-369 (2017).
- Drew, B., et al. Effects of aging and caloric restriction on mitochondrial energy production in gastrocnemius muscle and heart. American Journal of Physiology Regulatory, Integrative and Comparative Physiology. 284 (2), R474-R480 (2003).
- Short, K. R., et al. Decline in skeletal muscle mitochondrial function with aging in humans. Proceedings of the National Academy of Sciences. 102 (15), 5618-5623 (2005).
- Musci, R. V., Hamilton, K. L., Miller, B. F. Targeting mitochondrial function and proteostasis to mitigate dynapenia. European Journal of Applied Physiology. 118 (1), 1-9 (2018).
- Picca, A., et al. Targeting mitochondrial quality control for treating sarcopenia: lessons from physical exercise. Expert Opinion on Therapeutic Targets. 23 (2), 153-160 (2019).
- Fernandez-Marcos, P. J., Auwerx, J. Regulation of PGC-1α, a nodal regulator of mitochondrial biogenesis. The American Journal of Clinical Nutrition. 93 (4), 884-890 (2011).
- Kim, Y., Triolo, M., Hood, D. A. Impact of aging and exercise on mitochondrial quality control in skeletal muscle. Oxidative Medicine and Cellular Longevity. 2017, 3165396 (2017).
- Wang, H., Hiatt, W. R., Barstow, T. J., Brass, E. P. Relationships between muscle mitochondrial DNA content, mitochondrial enzyme activity and oxidative capacity in man: alterations with disease. European Journal of Applied Physiology and Occupational Physiology. 80 (1), 22-27 (1999).
- Tian, Q., et al. Muscle mitochondrial energetics predicts mobility decline in well-functioning older adults: The baltimore longitudinal study of aging. Aging Cell. 21 (2), e13552 (2022).
- Sardon Puig, L., Valera-Alberni, M., Cantó, C., Pillon, N. J. Circadian rhythms and mitochondria: connecting the dots. Frontiers in Genetics. 9, 452 (2018).
- Gano, L. B., Patel, M., Rho, J. M. Ketogenic diets, mitochondria, and neurological diseases. Journal of Lipid Research. 55 (11), 2211-2228 (2014).
- Liesa, M., Shirihai, O. S. Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure. Cell Metabolism. 17 (4), 491-506 (2013).
- Lesnefsky, E. J., Chen, Q., Hoppel, C. L. Mitochondrial metabolism in aging heart. Circulation Research. 118 (10), 1593-1611 (2016).
- Hartman, M. L., et al. Relation of mitochondrial oxygen consumption in peripheral blood mononuclear cells to vascular function in type 2 diabetes mellitus. Vascular Medicine. 19 (1), 67-74 (2014).
- Mahapatra, G., et al. Blood-based bioenergetic profiling is related to differences in brain morphology in African Americans with Type 2 diabetes. Clinical Science. 132 (23), 2509-2518 (2018).
- Moore-Ede, M. C. Physiology of the circadian timing system: predictive versus reactive homeostasis. The American Journal of Physiology. 250 (5), R737-R752 (1986).
- Young, M. W. Life's 24-hour clock: molecular control of circadian rhythms in animal cells. Trends in Biochemical Sciences. 25 (12), 601-606 (2000).
- Yoo, S. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proceedings of the National Academy of Sciences. 101 (15), 5339-5346 (2004).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences. 111 (45), 16219-16224 (2014).
- de Goede, P., Wefers, J., Brombacher, E. C., Schrauwen, P., Kalsbeek, A. Circadian rhythms in mitochondrial respiration. Journal of Molecular Endocrinology. 60 (3), R115-R130 (2018).
- Hood, S., Amir, S. The aging clock: circadian rhythms and later life. The Journal of Clinical Investigation. 127 (2), 437-446 (2017).
- Sellix, M. T., et al. Aging differentially affects the re-entrainment response of central and peripheral circadian oscillators. The Journal of Neuroscience. 32 (46), 16193-16202 (2012).
- Sato, S., et al. Circadian reprogramming in the liver identifies metabolic pathways of aging. Cell. 170 (4), 664-677 (2017).
- Lundell, L. S., et al. et al. feeding alters lipid and amino acid metabolite rhythmicity without perturbing clock gene expression. Nature Communications. 11 (1), 4643 (2020).
- Perrin, L., et al. Transcriptomic analyses reveal rhythmic and CLOCK-driven pathways in human skeletal muscle. eLife. 7, e34114 (2018).
- Gutierrez-Monreal, M. A., Harmsen, J. -. F., Schrauwen, P., Esser, K. A. Ticking for metabolic health: the skeletal-muscle clocks. Obesity. 28, S46-S54 (2020).
- Wolff, C. A., et al. Defining the age-dependent and tissue-specific circadian transcriptome in male mice. bioRxiv. 42 (1), 111982 (2023).
- Wilson, D., Breen, L., Lord, J. M., Sapey, E. The challenges of muscle biopsy in a community based geriatric population. BMC Research Notes. 11 (1), 830 (2018).
- Ding, H., et al. Likelihood-based tests for detecting circadian rhythmicity and differential circadian patterns in transcriptomic applications. Briefings in Bioinformatics. 22 (6), 224 (2021).
- Ding, Z., Lamb, T. M., Boukhris, A., Porter, R., Bell-Pedersen, D. Circadian clock control of translation initiation factor eIF2α activity requires eIF2γ-dependent recruitment of rhythmic PPP-1 phosphatase in Neurospora crassa. mBio. 12 (3), e00871 (2021).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Kalfalah, F., et al. Crosstalk of clock gene expression and autophagy in aging. Aging. 8 (9), 1876-1895 (2016).
- Psaty, B. M., et al. Assessing the use of medications in the elderly: methods and initial experience in the cardiovascular health study. Journal of Clinical Epidemiology. 45 (6), 683-692 (1992).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Molecular Metabolism. 5 (8), 635-645 (2016).
- Janssen, J. J. E., et al. Extracellular flux analyses reveal differences in mitochondrial PBMC metabolism between high-fit and low-fit females. American Journal of Physiology. Endocrinology and Metabolism. 322 (2), E141-E153 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены