Method Article
Использование референтных реагентов для подтверждения надежности анализов высвобождения цитокинов для прогнозирования безопасности моноклональных антител
В этой статье
Резюме
Использование референтных реагентов для анализа высвобождения цитокинов позволяет получить более воспроизводимые и стандартизированные in vitro профили безопасности иммунотерапевтических моноклональных антител. В этой статье мы описываем, как анализ высвобождения цитокинов может быть использован вместе с панелью референтных реагентов для прогнозирования безопасности некоторых терапевтических моноклональных антител.
Аннотация
Новые иммуностимулирующие антитела, предназначенные либо для прямой стимуляции специфических иммунных клеток, либо для косвенного усиления иммунного ответа путем блокирования или активации эндогенного регулятора иммунной системы, могут вызывать серьезные иммунные побочные эффекты, такие как синдром высвобождения цитокинов (CRS). Поэтому крайне важно оценить профиль безопасности таких препаратов с помощью комбинации экспериментов in vivo и in vitro до введения первой дозы человеку. Анализы высвобождения цитокинов (CRAs), в которых предлагаемое терапевтическое антитело культивируется совместно с иммунными клетками человека (такими как мононуклеарные клетки периферической крови (PBMC), цельная кровь или иное) и измеряется количество вырабатываемых воспалительных цитокинов, имеют решающее значение для идентификации опасности. Тем не менее, использование разных контрольных антител в разных лабораториях может угрожать гармонизации CRA, а клинически значимые контрольные антитела (например, TGN1412) могут быть труднодоступными, что может привести к менее точным или надежным результатам или данным, которые трудно сравнивать между лабораториями. Включение положительного и отрицательного контроля в CRA может обеспечить точность и надежность результатов. Национальный институт биологических стандартов и контроля (NIBSC) разработал панель контроля лиофилизированных антител, предназначенную для использования в различных платформах CRA с целью гармонизации результатов в различных лабораториях и методах анализа. Набор из трех различных положительных контрольных антител включает анти-CD52, анти-CD3 и анти-CD28 суперагонист (SA), которые, как известно, индуцируют дозозависимый СВЦ у пациентов. Каждое антитело снабжено изотипически совместимым отрицательным контрольным антителом. Ранее было показано, что эта панель референтных реагентов обладает хорошей межлабораторной воспроизводимостью и является подходящим средством контроля для повышения достоверности и надежности данных о безопасности, полученных с различных платформ CRA.
Введение
Индуцированное высвобождение цитокинов может быть ожидаемым и желательным эффектом некоторых иммуномодулирующих моноклональных антител (мАТ). Тем не менее, непредвиденное высвобождение провоспалительных цитокинов может привести к синдрому высвобождения цитокинов (СВЦ) у пациентов, характеризующихся лихорадкой, усталостью и даже полиорганной недостаточностью1. Поэтому крайне важно, чтобы новые иммуностимулирующие мАТ тестировались in vitro на их способность вызывать СВК путем измерения высвобождения цитокинов в анализе высвобождения цитокинов (CRA).
TGN1412 представляет собой моноклональное антитело, которое было разработано в качестве потенциального средства для лечения В-клеточного хронического лимфоцитарного лейкоза, действуя как суперагонист CD28 (CD28SA), способный активировать Т-лимфоциты путем сшивания костимулирующего рецептора CD282. В 2006 году шесть здоровых добровольцев, которым вводили TGN1412 в клиническом исследовании, испытали серьезные побочные эффекты, включая СВЦ, в течение нескольких часов послеприема препарата. Это привело к тому, что испытание было остановлено, а TGN1412 сняты с дальнейшей разработки. Другие антитела, которые, как известно, вызывают СВК в качестве побочного эффекта, включают анти-CD52 mAb, Campath-1H3, и анти-CD3 mAb, муромонаб (OKT3)4. Учитывая их способность индуцировать дозозависимый СВК у пациентов, TGN1412, OKT3 и Campath-1H являются подходящими положительными контрольными антителами для получения надежных и надежных результатов CRA. Тем не менее, эти контрольные антитела ранее было нелегко получить из-за высокой стоимости или ограниченной доступности.
Тем не менее, восстановленная лиофилизированная референсная панель этих трех антител 5,6,7 вместе с отрицательным контролем, соответствующим изотипу, была недавно предоставлена Национальным институтом биологических стандартов и контроля (NIBSC). Ранее было показано, что эта панель референтных реагентов обладает хорошей межлабораторной воспроизводимостью8 и, следовательно, является подходящим средством контроля для повышения достоверности и надежности данных о безопасности, полученных с различных платформ CRA. Таким образом, обоснованием использования данного протокола наряду с этими реагентами является улучшение гармонизации CRA, при этом преимущество этих реагентов было подтверждено в международном совместном исследовании.
Здесь мы описываем, как лучше всего использовать эту панель референтных реагентов в твердофазном (SP) PBMC CRA и водно-фазном (AQ) цельной крови (WB) CRA для прогнозирования СВЦ, индуцированного антителами. Оба этих формата CRA являются комплементарными из-за способа презентации антител (непрямой для твердой фазы против прямого для водной фазы) и из-за того, что они нацелены на разные группы ответных клеток. Тот же протокол может быть адаптирован для использования с разбавленной цельной кровью (dWB) или с эндотелиальными: кокультурами PBMC.
протокол
Данный протокол соответствует рекомендациям комитета по этике научных исследований NIBSC. В соответствии с применимыми правилами и рекомендациями получите письменное информированное согласие здорового донора или пациентов. Используйте стерильные методы для выполнения всех этапов подготовки протокола в ламинарном проточном культуре клеток. Подробную информацию обо всех реагентах и оборудовании см. в Таблице материалов .
1. Подготовка покрытых пластин mAb для твердофазного (SP) анализа
- Восстановите содержимое реагента сравнения в ампулах с 1 мл стерильной дистиллированной воды. Дайте 5-10 минут для регидратации, прежде чем смешивать раствор антител и переложить его в стерильную пробирку с крышкой.
- После восстановления в 1 мл воды исходная концентрация следующих рекомбинантных антител составит 200 мкг/мл: анти-CD3 (15/162), анти-CD52 (15/178), контроль изотипа IgG1K (15/198) для анти-CD52, контроль изотипа IgG2a (15/218) для анти-CD3, контроль изотипа IgG4 (15/232) для анти-CD28SA.
- После восстановления в 1 мл воды исходная концентрация анти-CD28SA (15/144) составит 100 мкг/мл. При кратковременном хранении до 7 дней восстановившийся материал переложите в стерильную пробирку с крышкой до 4 °C.
- Разбавить восстановленные антитела и тестируемые антитела до 10 мкг/мл в стерильном PBS и покрыть лунки стерильного 96-луночного микротитровального планшета из полипропилена, обработанного не ТЦ, 100 мкл разбавленного раствора антитела (1 мкг/лунку) и инкубировать в течение ночи при 4°С.
Примечание: Для адсорбции белка важно использовать полипропиленовые пластины, поскольку они использовались при валидации стандартных реагентов9.
2. Подготовка ПМЦ
- Соберите не менее 30 мл периферической цельной крови (WB) в гепаринизированные/содержащие гепарин пробирки и переверните несколько раз, чтобы обеспечить правильное смешивание с гепарином натрия.
- Перелейте 15 мл ВБ в отдельную пробирку для последующего использования при подготовке анализа цельной крови в водной фазе (шаг 3.1)
- Разведите оставшиеся 15 мл крови в соотношении 1:1 с помощью PBS или бессывороточной среды RPMI-1640 и аккуратно нанесите разбавленную кровь поверх 15 мл градиентной среды плотности (например, lymphoprep, Ficoll-Hypaque) в пробирке объемом 50 мл.
- Центрифугируйте пробирку при давлении 500 x g в течение 20 минут при комнатной температуре в поворотном роторе без тормоза и с уменьшенным ускорением, чтобы разделить кровь на различные компоненты.
- После центрифугирования градиент плотности отделяется в виде верхнего слоя плазмы, за которым следует тонкий слой охристой оболочки, содержащий PBMC, и нижний слой, содержащий эритроциты (RBC) и полиморфноядерные гранулоциты, включая нейтрофилы и эозинофилы. Осторожно соберите PBMC, вставив пипетку непосредственно через верхний слой плазмы в PBMC. Или удалите верхний слой перед сбором клеток.
- Аккуратно восстановите суспендию в 10 мл PBS или бессывороточной среды RPMI-1640. Снова центрифугируйте пробирку при давлении 500 x g в течение 10 минут, чтобы гранулировать клетки. Удалите надосадочную жидкость и выбросьте ее.
- Повторите шаг стирки 2.6. и ресуспендировать гранулу в 2 мл RPMI с 10% FCS (полный RPMI-1640, cRPMI)
- Подсчитайте клетки с помощью гемоцитометра10.
- Отрегулируйте PBMC до концентрации 1 x 106 клеток/мл в cRPMI.
3. Подготовка анализа на выброс цитокинов в водной фазе (AQ) цельной крови (WB)
- Добавьте 190 μL WB в лунки 96-луночной полистирольной пластины с U-образным дном. Если концентрация еще не достигла 100 мкг/мл, предварительно разведите все антитела для лечения и референтные реагенты до 100 мкг/мл в PBS.
- Добавьте 10 мкл разведенных антител к 190 мкл WB, чтобы получить конечную концентрацию антител 5 мкг/мл антител в 95% WB.
- Инкубировать в течение 48 ч в увлажненном инкубаторе при температуре 37 °C.
4. Получение твердофазного (SP) анализа высвобождения цитокинов PBMC
- С помощью многоканальной пипетки удалите и слейте раствор антитела с покрытых пластин (описан в шаге 1), заполните резервуар с реагентом PBS и промойте планшет 3 раза 200 мкл PBS для удаления несвязанных mAb.
- Добавьте по 200 мкл клеточной суспензии с шага 2,8 в каждую лунку. Инкубировать планшет в течение 48 ч в увлажненном инкубаторе при температуре 37 °C, 5%CO2.
5. Забор надосадочной жидкости или плазмы
- После инкубации в течение 48 ч с контрольными и тестовыми мАБ центрифугируйте планшеты при давлении 400 x g в течение 5 мин и соберите кондиционированную среду или плазму, стараясь не повредить клеточную гранулу. Заморозьте собранную надосадочную жидкость или плазму при температуре -20 °С.
ПРИМЕЧАНИЕ: Следите за тем, чтобы не потревожить гранулу эритроцитов при сборе плазмы.
6. Проведение количественного определения цитокинов в надосадочной жидкости или плазме
- С помощью собранной надосадочной жидкости или плазмы провести цитокиновый анализ концентраций ИФН-γ, ИЛ-2, ФНО-α и ИЛ-6 с использованием предпочтительного мультиплексного варианта. Пример метода мультиплексного анализа цитокинов с использованием цитометрического анализа шариков был опубликован ранее11.
ПРИМЕЧАНИЕ: Пожалуйста, обратитесь к Таблице материалов для комплекта мультиплексирования, который использовался при создании репрезентативных результатов.
Результаты
Результаты СП-анализа должны продемонстрировать высвобождение ИЛ-2, ИФН-γ, ИЛ-6 иФНО-α 12 в диапазоне пг/мл от всех положительных контрольных антител через 48 ч и должны быть статистически значимо выше, чем у контрольных образцов соответствующего изотипа. Наши репрезентативные результаты показывают, что положительные контрольные антитела, αCD28, αCD3 и αCD28SA, индуцируют значительно более высокие уровни ИФН-γ, IL-6 и TNF-α по сравнению с контрольными изотипами при проведении в анализе PBMC SP (рис. 1). Этот анализ также характеризуется высоким кратным изменением высвобождения IL-2 при стимуляции αCD28SA по сравнению с его соответствующим изотипом (859,0). В то время как αCD3 и αCD52, продолжая индуцировать экспрессию IL-2, приводят к меньшим изменениям кратности, чем αCD28SA (6,2 и 3,3 для αCD3 и αCD52 соответственно, рис. 2).
В анализе WB AQ (рис. 3) уровень детектируемых цитокинов заметно ниже, чем в анализе PBMC SP, но характеризуется большей чувствительностью к стимуляции антителами αCD52 (рис. 2 и рис. 3) со средними кратными изменениями IL-2, IFN-γ и IL-6 выше 100.
Исследуемое антитело, можно ожидать, что в будущем первая дозировка у человека не вызовет какого-либо непредвиденного значительного увеличения высвобождения цитокинов по сравнению с соответствующими контрольными изотипами. Тем не менее, вместо того, чтобы останавливать разработку нового терапевтического mAb, положительный результат при CRAA следует рассматривать какчасть управления риском/пользой. При разработке новой платформы CRA анализ следует повторить с использованием другого набора доноров, чтобы обеспечить воспроизводимость платформы. Следует также уделять внимание вариабельности ответа между донорами14, и поэтому рекомендуется провести хорошо организованный эксперимент15. Для того, чтобы понять широту ответов и получить полное представление о вариабельности, которая может наблюдаться в ответах доноров, анализ в идеале должен быть проведен с несколькими отдельными донорами в дополнение к анализу терапевтического препарата в повторных экспериментах.

Рисунок 1: Высвобождение цитокинов в результате эксперимента PBMC-SP. Репрезентативные результаты высвобождения ИФН-γ, ИЛ-2, ИЛ-6 и ФНО-α получены с помощью анализов высвобождения цитокинов PBMC-SP (3 независимых эксперимента, каждый из которых содержит 5-8 доноров в каждом эксперименте; n=8, n=10, n=5 [сверху вниз]) через 48 ч при использовании антител к референтному реагенту. Сокращения: PBMC = мононуклеарные клетки периферической крови; SP = твердое тело; ИФН-γ = интерферон-гамма; ИЛ-2 = интерлейкин 2; ИЛ-6 = интерлейкин 6; TNF-α = фактор некроза опухоли альфа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
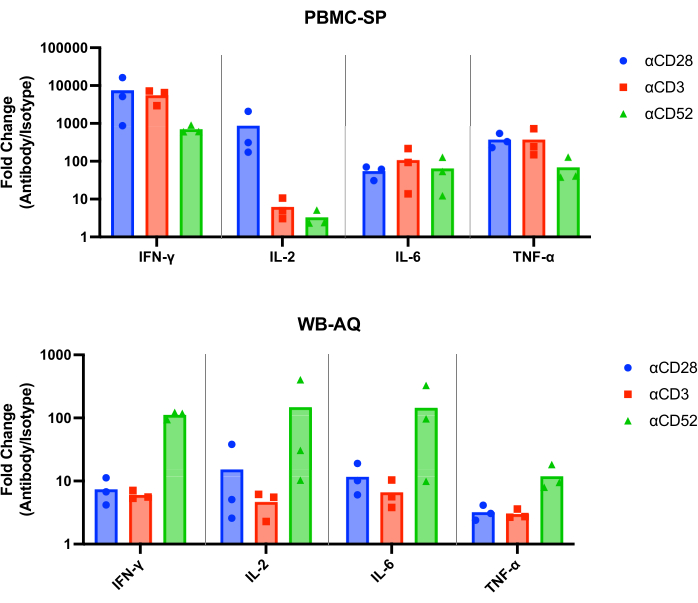
Рисунок 2: Увеличение изменения цитокинового фолда в экспериментах PBMC-SP и WB-AQ. Кратное изменение высвобождения ИФН-γ, ИЛ-2, ИЛ-6 и ФНО-α референтных реагентов антител, индуцирующих CRS, по сравнению с их соответствующими контролем изотипов, полученными с помощью анализов высвобождения цитокинов PBMC-SP и WB-AQ через 48 ч. Сокращения: PBMC = мононуклеарные клетки периферической крови; SP = твердое тело; WB = цельная кровь; AQ = водный (фаза); ИФН-γ = интерферон-гамма; ИЛ-2 = интерлейкин 2; ИЛ-6 = интерлейкин 6; TNF-α = фактор некроза опухоли альфа; CRS = синдром высвобождения цитокинов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
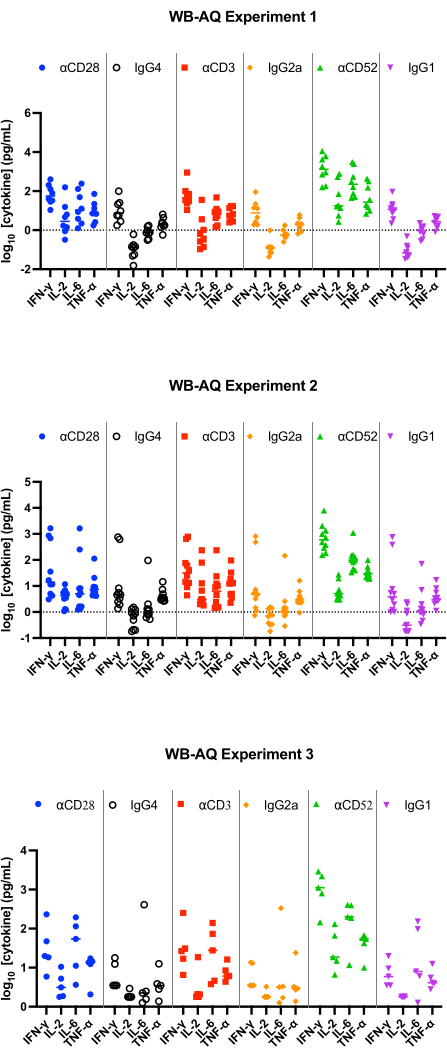
Рисунок 3: Высвобождение цитокинов в эксперименте WB-AQ. Репрезентативные результаты высвобождения ИФН-γ, ИЛ-2, ИЛ-6 и TNF-α получены с помощью анализов высвобождения цитокинов WB-AQ (3 независимых эксперимента, каждый из которых содержит 5-8 доноров в каждом эксперименте; n=8, n=10, n=5 [сверху вниз]) через 48 ч при использовании антител референтного реагента. Сокращения: WB = цельная кровь; AQ = водный (фаза); ИФН-γ = интерферон-гамма; ИЛ-2 = интерлейкин 2; ИЛ-6 = интерлейкин 6; TNF-α = фактор некроза опухоли альфа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Здесь описаны методы измерения высвобождения цитокинов из PBMC и WB после антитело-опосредованной стимуляции из пластины, покрытой антителами, или с антителом в растворе, с использованием панели референтных реагентов для положительного и отрицательного контроля. Каждый из этих анализов имеет свои сильные и слабые стороны. Анализы PBMC и WB являются взаимодополняющими, поскольку доля различных иммунных клеток, таких как лимфоциты, моноциты и гранулоциты, различается в двух экспериментальных матрицах, используемых для CRA. Интересно отметить, что, хотя анализ WB может лучше представлять состояние in vivo в отличие от монокультуры PBMC, первая платформа менее прогностическая для Т-клеточного риска CRS от TGN1412 и OKT315; результат воздействия гликофорина А на эритроциты, ингибирующего опосредованную IL-2 экспансию Т-клеток16. Тем не менее, прогнозирование риска СВК от анти-CD52 остается неизменным в WB CRA из-за присутствия нейтрофилов (потерянных при использовании традиционных методов градиента плотности, описанных на шаге 2, используемых для выделения PBMC).
Формат представления CRA (SP или AQ) имеет решающее значение для выявления специфического механизма CRS. Например, представление mAb в водной фазе к лимфоцитам человека17,18, использованное во время доклинических испытаний безопасности in vitro TGN1412, не позволило выявить риск СВЦ, вероятно, из-за отсутствия кластеризации и вовлечения локализованных клеточных рецепторов19 и последующей активации Т-клеток, опосредованной антителами в водной фазе. Фактически, TGN1412-опосредованный CRS может быть точно обнаружен только в формате SP, который искусственно воспроизводит сшивку рецептора Fc-гамма (FcγR), как показано здесь, или путем контакт-зависимого прайминга в прекультуре PBMC при высокой плотности и взаимодействии Fc с CD32+ иммунными клетками (такими как B-клетки20 и моноциты21).
Помимо этих платформ, существуют и другие способы проведения CRA с более сложными системами совместной культуры. Примером альтернативного КРА по сравнению с описанными в этих методах является совместное культивирование PBMC с аутологичными эндотелиальными клетками роста крови (BOEC)22. Этот анализ был описан в 2015 году как усовершенствование тогдашнего традиционного анализа HUVEC:PBMC со смешанными донорами за счет устранения искажающего несоответствия тканей. Он демонстрирует лучшую чувствительность к анти-CD28SA CRS, чем анализ WB, а также преодолевает ограничения монокультурного анализа PBMC, имитируя комбинацию эндотелиальных клеток и лейкоцитов, присутствующих in vivo, но ценой более длительных процедурных этапов, требующих специализированных методов культивирования клеток22.
Кроме того, в то время как этот протокол конкретно фокусируется на высвобождении ИФН-γ, ИЛ-2, ИЛ-6 и ФНО-α, коллеги из MHRA ранее рассматривали ИЛ-12 и другие в этом контексте. Продукция IL-12 увеличивается за счет этих антител к СВЦ положительного контроля, хотя они не особенно чувствительны и, следовательно, возможно, не являются хорошим предиктором СВК в этой модальности. Некоторые цитокины, такие как IL-15 и другие, никогда не тестировались, хотя 4 цитокина, оцененные в нашем протоколе, дают хорошее представление о потенциальном риске СВЦ. Конечно, в зависимости от модальности и тестируемых антител можно было бы оценить и другие цитокины.
В совокупности эти наблюдения подчеркивают важность того, что, хотя использование референтных реагентов может помочь определить риск СВК новых антител, следует проявлять осторожность, чтобы избежать неоптимальной платформы CRA, которая может не выявить потенциал СВЦ. Важно отметить, что прогнозируемый механизм действия терапевтического средства, будь то через его Fc-область или его гипотетическое действие на клетки, экспрессирующие антиген, должен соответствовать биологии анализа. Таким образом, в то время как различия в механизме действия испытуемых терапевтических и референтных реагентов, обсуждаемых в данной статье, могут представлять собой потенциальное ограничение таким образом, что релевантный CRA для тестируемого антитела может быть несовместим с биологией референтных реагентов, анализ обеспечивает надежную и надежную платформу для идентификации опасности. Однако для оптимальной достоверности данных оценки безопасности могут потребоваться результаты использования нескольких форматов CRA, охватывающих различные механизмы действия и субпопуляции иммунных клеток.
Раскрытие информации
Ранее EM работала в Агентстве по регулированию лекарственных средств и изделий медицинского назначения (MHRA). У остальных авторов конфликта интересов нет.
Благодарности
Эта работа финансировалась Национальным институтом биологических стандартов и контроля. Мы благодарим Сандру Диболд за рецензирование рукописи и за полезные комментарии и предложения. Мы также благодарны Ка Сенг Иеонгу за съемки видео.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
Ссылки
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042(2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440(2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), author reply 1570 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены