Двухэтапная безметная изоляция митохондрий для улучшения обнаружения и количественного определения белка
В этой статье
Резюме
Мы представляем двухэтапный протокол для высококачественного выделения митохондрий, который совместим с открытием и количественной оценкой белка в масштабе протеома. Наш протокол не требует генной инженерии и, таким образом, подходит для изучения митохондрий из любых первичных клеток и тканей.
Аннотация
Большинство физиологических и болезненных процессов, от центрального метаболизма до иммунного ответа на нейродегенерацию, связаны с митохондриями. Митохондриальный протеом состоит из более чем 1000 белков, и количество каждого из них может динамически изменяться в ответ на внешние раздражители или во время прогрессирования заболевания. Здесь мы описываем протокол выделения высококачественных митохондрий из первичных клеток и тканей. Двухэтапная процедура включает (1) механическую гомогенизацию и дифференциальное центрифугирование для выделения сырых митохондрий и (2) безметный иммунный захват митохондрий для выделения чистых органелл и устранения загрязняющих веществ. Митохондриальные белки с каждой стадии очистки анализируются с помощью количественной масс-спектрометрии, и рассчитываются выходы обогащения, что позволяет открывать новые митохондриальные белки с помощью субтрактивной протеомики. Наш протокол обеспечивает чувствительный и комплексный подход к изучению содержания митохондрий в клеточных линиях, первичных клетках и тканях.
Введение
Митохондрии представляют собой сложные и динамичные органеллы, способные ощущать и адаптироваться к метаболическим потребностям клетки. Митохондрии, занимающие центральное место в сложности клеточного метаболизма, действуют как метаболические центры, где сходятся реакции метаболизма углеводов, белков, липидов, нуклеиновых кислот и кофакторных реакций1. Они также служат сигнальными органеллами для путей врожденного иммунного ответа и в ответ на изменения ионов и активных форм кислорода 2,3. На сегодняшний день около 1,100 белков были сопоставлены с митохондриями 4,5,6, но мы можем предположить, что еще много еще предстоит открыть, особенно те, которые экспрессируются только в определенных типах клеток или временно в определенных условиях окружающей среды. Разработка новых подходов к количественной оценке изменений в составе митохондрий в интересующих метаболических состояниях расширит наши знания об этих органеллах и выделит новые терапевтические возможности для расстройств, характеризующихся митохондриальной дисфункцией7.
В настоящее время доступны различные протоколы выделения митохондрий с различными выходами и уровнями чистоты8. Подходы, основанные на центрифугировании, являются наиболее популярными, благодаря своей простоте и низкой стоимости. Несмотря на то, что дифференциальное центрифугирование подходит для большинства применений, оно имеет недостаток, заключающийся в получении более низкой чистоты митохондрий и требовании большого количества исходного материала при использовании более сложных применений на основе градиента плотности. В последние годы появились новые методы выделения митохондрий, такие как захват иммунитета на основе меток («MITO-IP»)9 и сортировка органелл, активированных флуоресценцией10. Хотя обе процедуры могут генерировать образцы с высокой чистотой, первая требует генной инженерии для маркировки митохондрий для аффинной очистки, что делает протоколы несовместимыми с первичным материалом от немодифицированных организмов или доноров человека. Между тем, последнее зависит от доступа к проточной цитометрии и инструментам сортировки. Сочетание различных методов изоляции дает надежду на создание более надежных протоколов и повышение чистоты.
Здесь мы представляем новый протокол выделения митохондрий, основанный на комбинации двух существующих методов: (1) дифференциальное центрифугирование для выделения сырой митохондриальной фракции и (2) безметный иммунный захват митохондрий суперпарамагнитными шариками, ковалентно связанными с антителами против транслоказы внешней митохондриальной мембраны 22 (Tomm22)11, вездесущего митохондриального белка внешней мембраны (рис. 1). Процедура, которую мы описываем, совместима с количественной масс-спектрометрией белков, и, поскольку она не содержит меток и не требует генетических манипуляций, ее можно применять к широкому спектру исследовательских моделей, от клеточных линий до жидкостей организма и целых тканей животных. Кроме того, использование двух этапов в протоколе позволяет использовать субтрактивную протеомику 6,12 для открытия новых митохондриальных белков и изучения их экспрессии.
протокол
Необходимо постоянно носить перчатки и выполнять этапы культивирования клеток под вытяжкой с ламинарным потоком. Клетки выдерживаются в инкубаторе с температурой 37 °C с 5%CO2. Исследование, представленное в этом протоколе, было одобрено и выполнено в соответствии с рекомендациями Лозаннского университета и Швейцарии по использованию животных.
1. Культура клеточной линии макрофагов RAW264.7
- Выращивайте клетки макрофагов RAW264.7 мышей в модифицированной среде орла (DMEM) Дульбекко с высоким содержанием глюкозы и глютамина, дополненной 5% инактивированной теплом эмбриональной бычьей сыворотки (HI-FBS) и 100 МЕ / мл пенициллина и 100 мкг / мл стрептомицина (P / S).
ПРИМЕЧАНИЕ: Для выделения митохондрий достаточно одной сливающейся пластины размером 15 см (около 70 x 10 7 клеток RAW264,7). - Поддерживайте клетки RAW264.7 в планшетах для культивирования тканей. Начальная плотность посева 1 x 10,5 клеток/мл приводит к сливающейся пластине через 3 дня. Используйте 25 мл клеточной суспензии в среде для 15-сантиметровой пластины. Клетки RAW264.7 имеют высокую скорость деления клеток и должны разделяться чаще, чем большинство клеточных линий.
- Отсоединение ячеек RAW264.7
- Аспирируйте среду и промойте клетки один раз фосфатно-буферным физиологическим раствором (PBS).
- Для 15-сантиметровой пластины добавьте 8 мл теплого диссоциационного буфера RAW (270 мМ хлорида калия, 30 мМ дигидрата цитрата натрия в H2O, стерильно отфильтрованного) и инкубируйте клетки при 37 ° C в течение 5 мин.
- Добавьте эквивалентный объем среды в планшеты (разбавление диссоциационного буфера 1:1) и пипетку для отделения и гомогенизации клеток.
- Перенесите клеточную суспензию в коническую пробирку и центрифугируйте пробирку при 300 x g в течение 3 мин при комнатной температуре.
- Аспирируют надосадочную жидкость и ресуспендируют гранулу в соответствующем объеме среды (описанном на шаге 1.1) для подсчета клеток.
ПРИМЕЧАНИЕ: Можно использовать другие методы отделения клеток RAW264.7, такие как трипсин или клеточный скребок. Однако эти методы более суровы для клеток и могут привести к их поляризации в М1-подобные макрофаги в течение нескольких дней после отсоединения.
2. Выделение и культивирование макрофагов костного мозга (БМДМ)
ПРИМЕЧАНИЕ: Описанный здесь протокол предназначен для одной мыши и может быть расширен для нескольких мышей. Подробные протоколы выделения и культивирования BMDM были описаны в другом месте13,14.
- Принесите в жертву 8-12-недельную мышь C57BL / 6 с высокой дозой CO2.
ПРИМЕЧАНИЕ: Можно использовать как самцов, так и самок мышей. - Опрыскайте мышь 75% этанолом, чтобы стерилизовать ее.
- Рассеките и соберите бедра, бедренные кости и большеберцовые кости мыши15.
- Чтобы собрать костный мозг из бедренной и большеберцовой костей, удалите конец коленного сустава обеих костей15. Восстановите костный мозг из бедер, удалив вертлужную впадину.
- Перенесите кости в коническую пробирку объемом 50 мл с 4 мл среды BMDM, хранящейся на льду (DMEM с высоким содержанием глюкозы и глютамина с добавлением 5% HI-FBS, P / S и 10 мМ HEPES).
ПРИМЕЧАНИЕ: Важно хранить кости в среде, чтобы избежать высыхания костного мозга во время рассечения. - Добавьте 4 мл PBS и 4 мл теплой среды BMDM в две разные лунки 6-луночного планшета.
- Перенесите кости и среду из конической пробирки объемом 50 мл в пустую лунку 6-луночной пластины.
- Используя пару щипцов, хорошо перенесите кости в PBS, чтобы промыть их.
- Перенесите кости в лунку, содержащую теплую среду BMDM.
- Сделайте щипцами отверстие диаметром 1-2 мм в нижней части двух пробирок по 0,5 мл и поместите их в пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ: Для этого быстрого шага нет необходимости добавлять носитель в трубку. - В каждую пробирку объемом 0,5 мл поместите бедренную кость, большеберцовую кость и бедро таким образом, чтобы костный мозг открытых костей был обращен ко дну трубок.
- Центрифугируют пробирки при 13 000 x g в течение 1 мин при комнатной температуре, чтобы собрать костный мозг и оставшуюся среду через отверстие пробирки 0,5 мл в пробирку 1,5 мл. Откажитесь от пробирок объемом 0,5 мл с костями.
- Ресуспендируют гранулы костного мозга в среде BMDM и переносят в коническую пробирку объемом 15 мл.
- Добавьте среду BMDM до 10 мл.
- Поместите клеточный сетчатый фильтр размером 40 мкм на коническую трубку объемом 50 мл и отфильтруйте через него суспензию костного мозга.
- Центрифугируют отфильтрованную суспензию при 300 x g в течение 5 мин при комнатной температуре, чтобы восстановить неповрежденные клетки и удалить мелкий мусор из клеточной суспензии.
- Приготовьте 70 мл среды BMDM с добавлением 50 нг/мл колониестимулирующего фактора макрофагов (М-КСФ).
- Ресуспендировать гранулу в 10 мл среды BMDM с добавлением M-CSF.
- Добавьте 9 мл среды BMDM с добавлением M-CSF в каждую из семи 10-сантиметровых чашек Петри.
- Планшет 1 мл клеток (около 1 х 107 клеток) в каждой из семи 10-сантиметровых чашек Петри.
- Гомогенизируйте клеточную суспензию в каждой пластине, осторожно пипетируя вверх и вниз по пластине, и перенесите планшеты в инкубатор.
- Через 3 дня добавьте в каждую пластину 5 мл теплой среды BMDM с добавлением 50 нг/мл м-КСФ.
- Через 3 дня (6-й день, после выделения костного мозга) проверяют адгезию и дифференцировку БМД с помощью микроскопии.
ПРИМЕЧАНИЕ: На этом этапе можно переходить непосредственно к выделению митохондрий (шаг 3). В качестве альтернативы можно репластинировать БМДМ, что позволяет лечить их цитокинами и малыми молекулами. - Отсоединение BMDM
- Аспирируйте среду из каждой пластины и добавьте 7 мл холодного PBS с добавлением 5 мМ этилендиаминтетрауксусной кислоты (ЭДТА).
- Инкубировать клетки при 4 °C в течение 7-8 мин.
- Отсоедините BMDM, осторожно пипетируя вверх и вниз с помощью пипетки объемом 10 мл.
- Объедините ресуспендированные BMDM со всех семи пластин в одну коническую пробирку объемом 50 мл и центрифугу при 300 x g в течение 3 мин при комнатной температуре.
- Аспирируйте надосадочную жидкость и ресуспендируйте клетки в 40 мл теплой среды BMDM для подсчета клеток.
ПРИМЕЧАНИЕ: От 7 до 9 x 10 на мышь получается7 BMDM. Для протеомики рекомендуется минимум 6 x 107 BMDM для выделения митохондрий. - При желании нанесите пластинки и обработайте БМДМ в соответствии с экспериментальной целью. Если нет, перейдите непосредственно к шагу 3.3.
3. Получение сырой митохондриальной фракции методом дифференциального центрифугирования
ПРИМЕЧАНИЕ: Все этапы центрифугирования выполняйте при температуре 4 °C. Требуются две центрифуги, одна с поворотным ротором и адаптерами для конических пробирок с относительной центробежной силой не менее 300 x g, а другая с относительной центробежной силой не менее 21 000 x g, подходящая для пробирок объемом 1,5 мл. При использовании адгезивных ячеек используйте клеточный скребок.
- Для адгезивных клеток аспирируйте среду и добавьте 10 мл PBS на 15-сантиметровую пластину.
ПРИМЕЧАНИЕ: Соскабливание ячеек в PBS позволяет мыть их одновременно. Если ячейки уже находятся в суспензии, переходите непосредственно к шагу 3.3. - Отделите клетки с помощью клеточного скребка и объедините их в одну коническую трубку объемом 50 мл. Гомогенизируйте клеточную суспензию путем пипетки вверх и вниз.
ПРИМЕЧАНИЕ: Ячейки можно отсоединить с помощью скребка ячеек, так как это быстрее, и вскоре после этого они будут лизироваться. - Для каждого экспериментального условия перенесите 5% объема клеточной суспензии в пробирку объемом 1,5 мл и центрифугируйте ее при 300 x g в течение 5 мин при комнатной температуре.
ПРИМЕЧАНИЕ: При использовании суспензионных ячеек обязательно промывайте их один раз с помощью PBS, чтобы удалить возможные загрязнения из среды, такой как FBS. - Выбросьте надосадочную жидкость и держите гранулы на льду.
ПРИМЕЧАНИЕ: Это будет представлять собой долю «общей ячейки» для протеомики. - Центрифугируют остальные образцы со стадии 3.1 или 3.2 при 300 x g в течение 5 мин при комнатной температуре.
- Выполните все следующие действия на льду и с использованием ледяных буферов.
- Аспирируют надосадочную жидкость и ресуспендируют клеточную гранулу в 5 мл ледяного митохондриального буфера (МБ) (210 мМ маннита, 70 мМ сахарозы, 10 мМ HEPES/NaOH [рН 7,4] и 1 мМ ЭДТА).
- Восстанавливают клетки центрифугированием при 300 x g в течение 5 мин при 4 °C.
- Ресуспендируют клеточную гранулу в 0,5 мл холодного MB и переносят ее в пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ: Эта процедура дает приблизительную концентрацию клеток 1,5 x 10 8 клеток BMDM / мл или 3 x 108 клеток RAW264,7 / мл. - Используя шприц объемом 1 мл, оснащенный иглой 25 г, гомогенизируйте клеточную суспензию через 30 проходов через иглу (рис. 1А).
- Добавьте 1 мл холодного МБ в пробирку и перемешайте инверсией. Центрифугируют гомогенизированную клеточную суспензию при 2000 x g в течение 5 мин при 4 °C.
- Перенесите 1 мл надосадочной жидкости в свежую пробирку объемом 1,5 мл на льду, не нарушая клеточную гранулу. Ресуспендируйте гранулу ячейки и снова гомогенизируйте ее, как показано на шаге 3.7.
- Объедините гомогенизированную клеточную гранулу и надосадочную жидкость из двух предыдущих этапов в одну пробирку объемом 1,5 мл и центрифугируйте ее при 2000 x g в течение 5 мин при 4 °C.
ПРИМЕЧАНИЕ: На данный момент гранула содержит в основном ядра и неразрушенные клетки и выбрасывается. Надосадочная жидкость содержит клеточный мусор, цитозоль и органеллы, включая митохондрии (рис. 1B). - Разделите надосадочную жидкость между четырьмя пробирками по 1,5 мл.
ПРИМЕЧАНИЕ: Разделение надосадочной жидкости между несколькими пробирками на этом этапе улучшает удаление загрязнений на следующих этапах. - Добавьте МБ, чтобы получить окончательный объем 1 мл в каждой из четырех пробирок. Смешивают путем инверсии и центрифугируют пробирки при 13 000 x g в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: После этого шага видна гранула с двумя слоями. Нижняя, твердая, коричневая гранула содержит митохондрии и хранится для дальнейшей очистки (рис. 1В). Верхняя, рыхлая, белая гранула содержит другие клеточные структуры и может быть отброшена. - Выполняйте этот шаг осторожно. Удалите надосадочную жидкость с как можно большим количеством белой верхней гранулы. Осторожно пипетируя на нем, можно ресуспендировать белую гранулу, а затем выбросить ее, оставив коричневую митохондриальную гранулу нетронутой.
- Держите одну из четырех пробирок с митохондриальной гранулой на льду. Это представляет собой фракцию «сырых митохондрий» для протеомики.
- Объедините остальные три гранулы в пробирку объемом 1,5 мл в конечном объеме 1 мл МБ.
4. Очистка митохондрий на основе суперпарамагнитных антител
ПРИМЕЧАНИЕ: Выполните все следующие действия в холодном помещении при температуре 4 °C.
- Перенесите 1 мл сырого митохондриального препарата со стадии 3.18 в коническую пробирку объемом 15 мл и добавьте 7 мл МБ с добавлением 150 мМ NaCl (MB + NaCl).
ПРИМЕЧАНИЕ: Добавление NaCl улучшает связывание антител и уменьшает неспецифическое связывание загрязняющих веществ с шариками и митохондриями. - Добавьте 50 мкл шариков Tomm22 в суспензию сырых митохондрий объемом 8 мл (рис. 1D) и инкубируйте пробирку в течение 15 минут при 4 ° C на вращающемся колесе на низкой скорости.
ПРИМЕЧАНИЕ: Шарики Tomm22 ковалентно связаны с моноклональными антителами Tomm22, выращенными у мышей, в сочетании с суперпарамагнитными шариками. - Тем временем поместите столбик на магнит.
- Уравновесьте колонку 8 мл MB + NaCl и откажитесь от протока.
- После 15-минутной инкубации при 4 °C образца с шариками Tomm22 перенесите образец в колонку. Откажитесь от проточной части.
ПРИМЕЧАНИЕ: Митохондрии останутся прикрепленными к магнитным шарикам в столбце (рис. 1E). - Трижды промойте колонку 8 мл MB + NaCl.
- Снимите колонку с магнита и поместите ее в коническую трубку объемом 15 мл.
- Элютируйте митохондрии, добавив 1,5 мл MB + NaCl в колонку, и немедленно примените поршень, чтобы разбавить очищенные митохондрии в пробирку.
- Перенесите элюированные митохондрии в пробирку объемом 1,5 мл и центрифугируйте ее при 21 000 x g в течение 10 мин при 4 ° C.
ПРИМЕЧАНИЕ: Образуется коричневая гранула. Он содержит изолированные митохондрии и некоторые шарики, связанные с антителами (рис. 1F). - Осторожно удалите надосадочную жидкость из гранулы. Гранула представляет собой фракцию «чистых митохондрий» для протеомики. Эти гранулы вместе с гранулами из этапов 3.4 и 3.17 могут храниться при -20 °C и готовы к последующему применению.
Результаты
В настоящем протоколе генерируются три образца с возрастающей степенью чистоты митохондрий: общие клетки, сырые митохондрии («мито-сырые») и чистые митохондрии («мито-чистые») (рис. 1). Мы подтвердили очистку митохондрий из клеточной линии макрофагов RAW264.7 путем загрузки равных белковых количеств каждой фракции на гель и иммуноблоттинга и обнаружили, что митохондриальная цитратсинтаза (Cs) была обогащена на каждом этапе очистки; между тем, белки из цитозоля (GAPDH), плазматической мембраны (Na/K АТФазы), ядра (ламин B), лизосом (Lamp1) и эндоплазматического ретикулума (ER) (Pdi) постепенно исчезали (рис. 2A). Аналогичные результаты были получены при использовании BMDM. Для дальнейшей проверки чистоты и целостности выделенных митохондрий была проведена электронная микроскопия чистой митохондриальной фракции. Мы наблюдали митохондрии классической овальной формы и интактные кристы, окруженные электронно-плотными частицами, соответствующими шарикам, покрытым антителами (рис. 2B). Таким образом, можно сделать вывод, что наш протокол обогащает митохондрии, истощает другие клеточные компоненты и поддерживает структурную целостность митохондрий.
Затем был проведен протеомный анализ каждой фракции с использованием жидкостной хроматографии, связанной с масс-спектрометрией (LC/MS). Всего было идентифицировано 6 248 белков в экстракте из общего количества клеток, 907 из которых были ранее аннотированы как митохондриальные в инвентаре MitoCarta3.05. После фильтрации белков с порогом не менее двух уникальных пептидов мы рассчитали оценку обогащения для каждого белка в каждом образце на основе их интенсивности по сравнению с общими клетками. Затем мы распределили белки по семи основным субклеточным компартментам: митохондриям, ER, лизосомам, аппарату Гольджи, цитоскелету, ядру и цитозолю, используя Gene Ontology (GO)16,17 и MitoCarta3.05 в качестве ссылок. Важно отметить, что наблюдалось среднее обогащение митохондриальных белков более чем в 10 раз и более чем в 20 раз в сырой и чистой фракциях митохондрий соответственно (рис. 2C). Напротив, компоненты других шести проанализированных клеточных компартментов были истощены во время процедуры очистки. Особо следует отметить, что во фракции сырых митохондрий мы наблюдали временное обогащение для белков ER и лизосомальных белков, двух классов загрязняющих белков, часто присутствующих после протоколов дифференциального центрифугирования18. Возможно, это было связано с взаимодействиями органелл и аналогичными коэффициентами седиментации, особенно для лизосом, которые очень распространены в макрофагах19. В то время как оба были в основном истощены после иммунного захвата, мы обнаружили небольшой сигнал для белков из сайтов контакта ER-митохондрий в миточистой фракции.
Затем мы напрямую сравнили содержание белка в общих клетках и в миточистых образцах и наблюдали две различные популяции, соответствующие митохондриальным и немитохондриальным белкам (рис. 2D). В то время как подавляющее большинство белков MitoCarta сгруппированы вместе, мы обнаружили несколько (<5%), которые группировались с белками, не относящимися к MitoCarta. Эти белки могут представлять собой (1) цитозольные митохондриально-взаимодействующие белки (новая категория, аннотированная в версии 3.0 MitoCarta), (2) двойные локализованные белки или (3) неправильно аннотированные белки. И наоборот, мы обнаружили несколько случаев, когда белки, не относящиеся к MitoCarta, группировались с митохондриальными белками. Хотя такие белки могут представлять собой загрязнители процедуры выделения, они также могут представлять собой белки, ранее не классифицированные как присутствующие в митохондриях.
Для исследования этого нового класса потенциальных митохондриальных белков была использована субтрактивная протеомика, подход, который оказался полезным для открытия органеллярных протеомов, включая митохондрии 6,12. Субтрактивная протеомика предполагает, что митохондрии должны обогащаться на этапах очистки, а загрязняющие вещества должны истощаться6. Например, в то время как загрязняющие вещества могут накапливаться во время дифференциального центрифугирования (например, из-за сходных седиментационных свойств) или во время иммунного захвата (например, из-за неспецифического связывания антител), только истинные митохондриальные белки должны значительно накапливаться в обоих. Таким образом, можно отфильтровать белки, которые были обнаружены в чистой митохондриальной фракции, но показали противоречивые закономерности обогащения. В настоящем примере с клетками RAW264.7, установив порог для уникальных пептидов ≥1 для мито-сырых и миточистых образцов и используя строгие пороги обогащения, мы смогли уточнить список восстановленных митохондриальных протеомов из 1,127 белков, первоначально обнаруженных в сырой митохондриальной фракции после дифференциального центрифугирования, до 481 белка после второго раунда очистки с использованием иммуноотбора Tomm22. Уменьшенное количество аннотированных белков MitoCarta в миточистой фракции отражает высокую строгость, применяемую для отбора. Интересно, что 70 белков, присутствующих в миточистой фракции, отсутствовали в инвентаре MitoCarta3.0 (рис. 3A, B). Эти последние белки могут представлять собой потенциальные новые митохондриальные белки-кандидаты, которые могут экспрессироваться только в клеточной линии макрофагов RAW264.7 и в родственных клетках и которые заслуживают дальнейшего изучения.
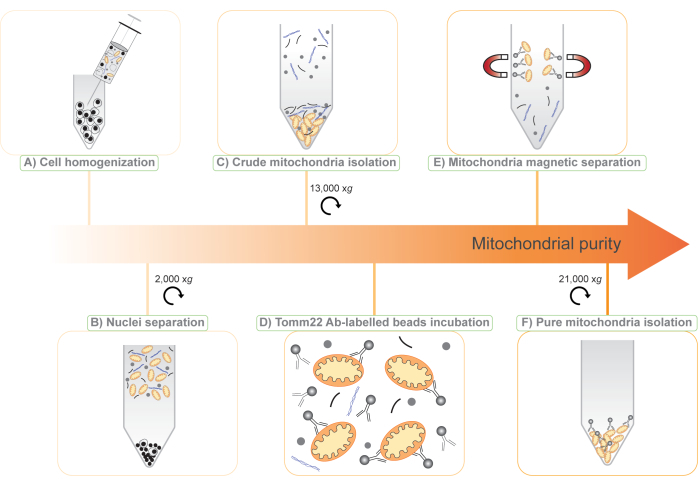
Рисунок 1: Иллюстрация двухэтапного протокола выделения митохондрий без меток . (A) Клеточная суспензия разрушается через иглу 25 G. (B) Ядра и целые клетки отделяются центрифугированием при 2000 x g , и надосадочная жидкость сохраняется. (C) Сырые митохондрии выделяют дифференциальным центрифугированием надосадочной жидкости при 13 000 x g (мито-сырой). (D) Затем сырые митохондрии инкубируют с антителами Tomm22 (Ab), ковалентно связанными с суперпарамагнитными шариками. (E) Комплексы антитела-шарики митохондрий-Tomm22 отделяют от загрязняющих веществ с помощью магнитных колонок и элюируют. (F) Чистые митохондрии собираются и концентрируются центрифугированием (мито-чистым). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
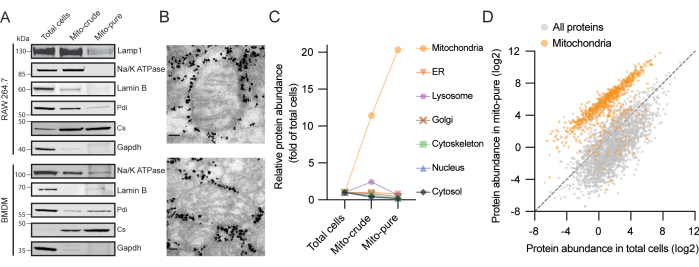
Рисунок 2. Репрезентативные результаты выделения митохондрий из двух источников макрофагов. (A) Иммуноблоттинг белков клеток RAW264.7 (вверху) и BMDM (внизу) с использованием антител к митохондриальной цитратсинтазе (Cs - митохондрии), глицеральдегид-3-фосфатдегидрогеназе (Gapdh - цитозоль), натрий-калиевому насосу (Na/K АТФаза - плазматическая мембрана), ламину B (ламин B - ядро), лизосомально-ассоциированному мембранному белку 1 (Lamp1 - лизосома) и дисульфидизомеразе белка (Pdi - ER). (B) Электронная микроскопия очищенных митохондрий из клеток RAW264.7. Частицы высокой плотности, окружающие митохондрии, соответствуют шарикам Tomm22, которые переносятся с миточистыми образцами после элюирования из колонок. Масштабные линейки: 80 нм. (C) Баллы обогащения по общим клеткам, мито-сырым и мито-чистым из семи клеточных компартментов в клетках RAW264.7. Для аннотации белков использовали MitoCarta3.0 и GO, и представлены средние баллы. Аббревиатура: ER = эндоплазматический ретикулум. (D) Значения содержания белка (riBAQ) для белков в общих клетках и миточистых образцах из клеток RAW264.7. Белки MitoCarta3.0 показаны оранжевым цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
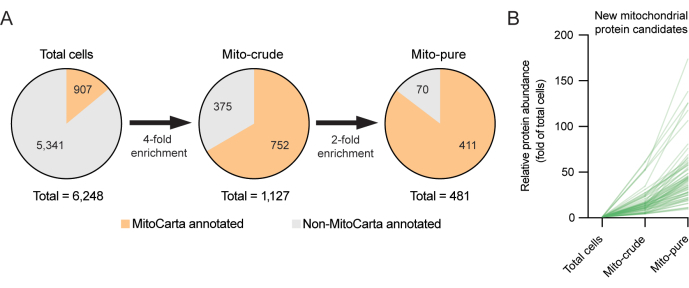
Рисунок 3. Открытие новых митохондриальных белков с использованием субтрактивной протеомики. (A) Стратегия субтрактивной протеомики для открытия новых митохондриальных белков. Высокие пороги отбора (4x и 2x) применяются для минимизации отбора ложных срабатываний. (B) Выход обогащения (складывание общего количества клеток) новых белков-кандидатов в митохондрии, ранее не аннотированных в инвентаре MitoCarta3.0. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Мы объединили дифференциальное центрифугирование и иммунозахват для достижения улучшенной чистоты выделения митохондрий. Наша процедура позволяет получить доступ к первичному материалу для идентификации и характеристики новых митохондриальных белков. Протокол прост и надежен и может применяться к клеточным линиям, первичным клеткам и тканям без необходимости генетической модификации. Мы подтвердили наш протокол иммуноблоттингом и протеомным анализом образцов, взятых на разных этапах процедуры очистки.
По сравнению с методами одиночной изоляции комбинация этапов обогащения различной природы - в данном случае центрифугирование и иммунная маркировка - создает более надежный протокол для выделения митохондрий. Это связано с тем, что, хотя митохондриальные белки будут обогащаться при обеих очистках, маловероятно, что загрязняющие вещества также будут обогащены после обоих этапов обогащения. Хотя высокая чистота митохондрий также может быть достигнута с помощью ультрацентрифугирования с градиентом плотности, этот подход требует большого количества исходного материала и доступа к ультрацентрифуге. Наконец, в отличие от последних методов, основанных на выделении митохондрийна основе меток 20, наш подход не требует генетической модификации образца, что делает его пригодным для первичного материала из любого источника.
Некоторые технические и биологические соображения должны быть приняты во внимание при разработке эксперимента при применении нашего протокола. (1) Количество исходного материала имеет решающее значение для получения достаточного количества материала. Неизбежно, что небольшое количество митохондрий будет потеряно во время гомогенизации (этап 3.10), так как не все клетки лизируются, или во время промывки трех колонок (этап 4.6). В то время как наш протокол фокусируется на чистоте, а не на выходе, эффективность выделения митохондрий и, следовательно, их выход не были измерены или оптимизированы. Ожидается, что использование большего количества шариков Tomm22 и большего количества колонок увеличит выход восстановления митохондрий. В то же время тщательная оптимизация этапа гомогенизации также может привести к улучшению выхода митохондрий. Этот протокол и исходные номера ячеек, которые мы сообщаем здесь для клеток RAW264.7 и BMDM, подходят для протеомики и могут быть скорректированы для других приложений. В случае первичных BMDM мы обнаружили, что одной мыши было достаточно для одной репликации. При необходимости процедура может быть расширена для выделения БКМД от нескольких животных, которые затем могут быть объединены для получения достаточного количества материала. Количество клеток может быть оптимизировано в зависимости от типа клетки, ее размера и содержания митохондрий. (2) Tomm22 экспрессируется в митохондриях всех типов клеток и тканей21, но уровень его выражения может варьироваться. Поэтому при разработке эксперимента для сравнения различных условий важно убедиться, что уровни экспрессии Tomm22 сопоставимы. Кроме того, из-за повсеместной экспрессии Tomm22 невозможно изучать митохондриальные белки клеточного типа в сложных тканях. (3) Время, необходимое для генерации чистых митохондрий (около 2,5 ч), несовместимо с изучением переходных событий, таких как изменения метаболических профилей. В этом случае мы рекомендуем прямой иммунный захват на основе меток9, что также позволяет изучать митохондрии, специфичные для клеточного типа in vivo20. (4) Хотя исследования изолированных митохондрий, полученных с использованием только шариков, меченных антителами Tomm22, показали активность в функциональных анализах11, еще предстоит определить, совместимы ли митохондрии, сгенерированные с помощью нашего протокола, с последующими анализами, основанными на активности. Окрашивание или измерение респирометрии с помощью MitoTracker или перхлората метилового эфира тетраметилродамина (TMRM) являются потенциальными подходами к количественной оценке функциональности изолированных митохондрий22. (5) После вымывания «мито-чистого» образца из колонки некоторые шарики Tomm22 будут присутствовать во фракции чистых митохондрий (Рисунок 2B). Хотя мы не наблюдали никакого вмешательства в расщепление трипсина и белковую масс-спектрометрию, присутствие этих шариков и иммуноглобулинов следует принимать во внимание в других последующих приложениях. Антитело Tomm22 представляет собой моноклональное антитело, вырабатываемое у мышей23, и поэтому важно иметь в виду, что при использовании вторичных антител против мышей при иммуноблоттинге он будет генерировать неспецифические полосы по размеру цепей иммуноглобулинов. (6) Полная гомогенизация клеточной суспензии является ключом к успешному выделению митохондрий. Здесь мы используем шприц с иглой 25 G для лизиса как клеток RAW264.7, так и BMDM. Однако, в зависимости от типа ячейки и ее размера, другие методы механической гомогенизации, такие как использование гомогенизатора Dounce, или более контролируемые подходы, такие как устройства гомогенизатора клеток, могут быть более подходящими. Также могут быть рассмотрены немеханические методы гомогенизации, такие как щадящая обработка ультразвуком. Подходы к гомогенизации тканей далее обсуждаются в других исследованиях24,25. (7) Хотя валидация методом иммуноблоттинга является наиболее простым и дешевым методом, ее результаты не всегда могут коррелировать с изменениями на уровне органелл в целом. Вот почему мы рекомендуем использовать протеомику для полной проверки обогащения или истощения митохондрий и других органелл соответственно.
Описанный здесь двухэтапный протокол очистки митохондрий позволил нам генерировать последовательные образцы с возрастающей чистотой митохондрий, и это позволило нам обнаружить новых кандидатов на митохондриальный белок с помощью субтрактивной протеомики12. Для нашего анализа мы используем строгие пороговые значения для выбора значительно обогащенных митохондриальных белков, и хотя это может не идентифицировать некоторые известные митохондриальные белки (рис. 3A), частота ложноположительных результатов для открытия новых митохондриальных белков снижается. Тем не менее, важно подчеркнуть, что любые белки-кандидаты, выявленные нашим протоколом, должны быть проверены с помощью ортогональных подходов. Мы рекомендуем карбокси-концевую GFP-маркировку или использование антител против эндогенного белка для подтверждения связи с митохондриями либо микроскопически, либо с помощью анализов протеазной защиты.
Прямое применение нашего метода в случае немодифицированных клеток и тканей предлагает мощный инструмент для исследования того, как митохондрии изменяются и адаптируются к окружающей среде в здоровых и болезненных условиях. Применение нашего протокола к клеточным линиям, моделям болезней животных, человеческим жидкостям и даже биопсиям в результате операции может оказаться особенно полезным для улучшения нашего понимания митохондрий и связанных с ними нарушений.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Мы благодарим Манфредо Квадрони, Центр анализа белков и Центр электронной микроскопии Лозаннского университета за их помощь. Мы также благодарим Х.Г. Шпренгера, К. Маундрелла и сотрудников лаборатории Журдена за советы и отзывы о рукописи. Эта работа была поддержана Фондом Пьера-Мерсье за науку и Швейцарским национальным научным фондом (грант проекта 310030_200796).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD Plastipal | 309628 | |
| 25 G Needle | BD Microlance | 300400 | |
| 40 µm cell strainer | Corning | 352340 | |
| Anti-TOM22 Microbeads, mouse | Miltenyi Biotec | 130-127-693 | |
| Cell scraper | FisherScientific | 11577692 | |
| DMEM, high glucose, GlutaMAX | ThermoFisher | 31966 | |
| Ethylenediaminetetraacetic acid | FisherScientific | BP-120-1 | |
| Fetal bovine serum | Gibco | 10270 | |
| HEPES | BioConcept | 5-31F00-H | |
| LS columns and plungers | Miltenyi Biotec | 130-042-401 | |
| Macrophage colony-stimulating factor | Immunotools | 12343115 | |
| Mannitol | Sigma | M4125 | |
| Sodium chloride | Sigma | 71380 | |
| Sucrose | Sigma | S1888 | |
| Penicillin/Streptomycin | BioConcept | 4-01F00-H | |
| Petri dishes | Corning | BH93B-102 | |
| Phosphate-buffered saline 10X | Eurobio Scientific | CS3PBS01-01 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| Vi-CELL BLU Cell Viability Analyzer | Beckman Coulter | C19196 |
Ссылки
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- West, A. P., Shadel, G. S., Ghosh, S. Mitochondria in innate immune responses. Nature Reviews Immunology. 11 (6), 389-402 (2011).
- Chakrabarty, R. P., Chandel, N. S. Mitochondria as signaling organelles control mammalian stem cell fate. Cell Stem Cell. 28 (3), 394-408 (2021).
- Morgenstern, M., et al. Quantitative high-confidence human mitochondrial proteome and its dynamics in cellular context. Cell Metabolism. 33 (12), 2464-2483 (2021).
- Rath, S., et al. MitoCarta3.0: an updated mitochondrial proteome now with sub-organelle localization and pathway annotations. Nucleic Acids Research. 49, D1541-D1547 (2021).
- Pagliarini, D. J., et al. A mitochondrial protein compendium elucidates complex I disease biology. Cell. 134 (1), 112-123 (2008).
- Diaz-Vegas, A., et al. Is mitochondrial dysfunction a common root of noncommunicable chronic diseases. Endocrine Reviews. 41 (3), 005 (2020).
- Bury, A. G., Vincent, A. E., Turnbull, D. M., Actis, P., Hudson, G. Mitochondrial isolation: when size matters. Wellcome Open Research. 5, 226 (2020).
- Chen, W. W., Freinkman, E., Sabatini, D. M. Rapid immunopurification of mitochondria for metabolite profiling and absolute quantification of matrix metabolites. Nature Protocols. 12 (10), 2215-2231 (2017).
- Daniele, J. R., Heydari, K., Arriaga, E. A., Dillin, A. Identification and characterization of mitochondrial subtypes in Caenorhabditis elegans via analysis of individual mitochondria by flow cytometry. Analytical Chemistry. 88 (12), 6309-6316 (2016).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PLoS One. 8 (12), e82392 (2013).
- Yates, J. R., Gilchrist, A., Howell, K. E., Bergeron, J. J. M. Proteomics of organelles and large cellular structures. Nature Reviews Molecular Cell Biology. 6 (9), 702-714 (2005).
- Trouplin, V., et al. marrow-derived macrophage production. Journal of Visualized Experiments. (81), e50966 (2013).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Toda, G., Yamauchi, T., Kadowaki, T., Ueki, K. Preparation and culture of bone marrow-derived macrophages from mice for functional analysis. STAR Protocols. 2 (1), 100246 (2020).
- Gene Ontology Consortium. The Gene Ontology resource: enriching a GOld mine. Nucleic Acids Research. 49, D325-D334 (2021).
- Ashburner, M., et al. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium. Nature Genetics. 25 (1), 25-29 (2000).
- Hartwig, S., et al. A critical comparison between two classical and a kit-based method for mitochondria isolation. Proteomics. 9 (11), 3209-3214 (2009).
- Delamarre, L., Pack, M., Chang, H., Mellman, I., Trombetta, E. S. Differential lysosomal proteolysis in antigen-presenting cells determines antigen fate. Science. 307 (5715), 1630-1634 (2005).
- Bayraktar, E. C., et al. MITO-Tag mice enable rapid isolation and multimodal profiling of mitochondria from specific cell types in vivo. Proceedings of the National Academy of Sciences. 116 (1), 303-312 (2019).
- Nusinow, D. P., et al. Quantitative proteomics of the cancer cell line encyclopedia. Cell. 180 (2), 387-402 (2020).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Hornig-Do, H. T., et al. Isolation of functional pure mitochondria by superparamagnetic microbeads. Analytical Biochemistry. 389 (1), 1-5 (2009).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Lanza, I. R., Nair, K. S. Functional assessment of isolated mitochondria in vitro. Methods in Enzymology. 457, 349-372 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены